一种富含花青素抗视疲劳的果蔬酱及其加工工艺的制作方法
本发明涉及功能性食品技术领域,具体涉及一种富含花青素抗视疲劳的果蔬酱及其加工工艺。
背景技术:
近年来,由于可视电子产品的广泛应用,人们用眼强度的不断加大,加之机体自然老化等原因导致视力疲劳已成为普遍现象,因此百姓对能够有效保护眼睛、缓解眼睛疲劳的功能性产品颇受关注。植物源的花色苷具有保护和增进视力、预防眼疾的功能,因此选用花青素含量高的天然果蔬,高效对花青素成分进行释放和保护,开发富含花青素的即食食品,具有十分广阔的市场前景。
眼睛功能的退化与病变主要原因为氧化应激反应、环境污染与光线伤害三方面,主要对视网膜黄斑区域造成巨大伤害。而叶黄素与花青素是视网膜中最重要的两种功能成分,无法自身合成,仅能通过外部摄取。
目前具有护眼功能的产品,多为外用滴眼液,食品中功能因子明确且经验证有效的产品甚少,主要为叶黄素类与复合维生素类产品,功能较为单一,多为天然产物提纯产品,由于眼部血管多为毛细血管,营养运输能力弱,因此上述高纯度产品虽含量较高,但仍难以达到理想效果。
技术实现要素:
针对上述存在的问题,本发明采用传统中医理论,将菊花、黑枸杞等传统明目食材与紫薯、蓝莓等新兴果蔬,按寒性与热性科学比例搭配,采用多次适度破碎,将果蔬中的纤维破碎至适宜的细度,既提高了吸收效率又对叶黄素、花青素、原花青素等易氧化功能因子有效保留。该产品经实验,花青素、叶黄素含量丰富,对于眼部神经细胞具有显著的抗氧化效果。
本发明的技术方案是:一种富含花青素抗视疲劳的果蔬酱,包括新鲜的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣和樱桃,以及葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干,按照每100份计,所述葡萄的添加量为2-7份,所述黑加仑的添加量为3-10份,所述蓝莓的添加量为3-10份,所述黑枸杞的添加量为3-10份,所述红枸杞的添加量为2-7份,所述紫薯的添加量为3-10份,所述柠檬的添加量为2-7份,所述山楂的添加量为2-7份,所述酸枣的添加量为2-7份,所述樱桃的添加量为2-7份;所述葡萄干的添加量为2-7份,所述黑加仑干的添加量为3-10份,所述蓝莓干的添加量为3-10份,所述菊花干的添加量为3-10份,所述黑枸杞干的添加量为3-10份,所述红枸杞干的添加量为2-7份,所述紫薯干的添加量为3-10份,所述柠檬干的添加量为2-7份,所述山楂干的添加量为2-7份,所述酸枣干的添加量为2-7份,其余为樱桃干。
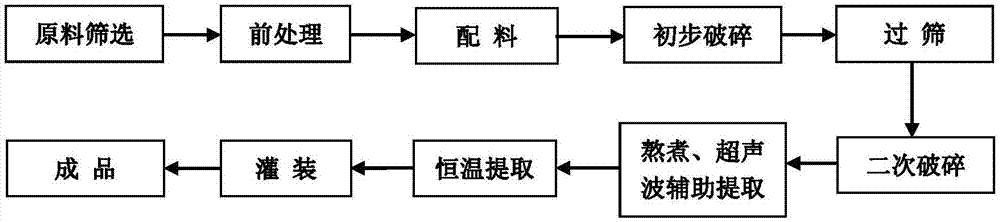
一种富含花青素抗视疲劳的果蔬酱的加工工艺,包括如下步骤:
步骤一:原料筛选
选取新鲜、无霉变的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣、樱桃的鲜果;以及无霉变的葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干;
步骤二:前处理
将11种果蔬干洗净;将10种新鲜果蔬洗净,并去皮、去核,紫薯、柠檬切分至2-3cm2小块;
步骤三:配料
将各种果蔬及果蔬干按配方比例准确称重,投入高剪切粉碎机中;
步骤四、初步粉碎
使用高剪切粉碎机将原料粉碎,采用点动式操作方法将块状物料粉碎;
步骤五:过筛
经初步粉碎后的物料依次经过20目筛和40目筛;收集20目筛拦截的物料进行二次粉碎,通过40目筛的物料即为成品所需细度。40目筛的筛下物与汁液在熬煮后期加入,以保持活性;
步骤六:二次破碎
被20目筛拦截的物料进行二次破碎,重复步骤五;
步骤七:熬煮、超声波辅助提取
将步骤五和步骤六中符合目数的物料加入装有超声波辅助提取的夹层锅中加热熬煮,同时进行超声波辅助提取,加热温度85℃-95℃,超声波功率500w,熬煮、提取时间0.5h-2h;
步骤八:恒温提取
经熬煮、提取后的物料由管道传送至保温储料罐中进行恒温提取,恒温提取温度50℃-60℃,保温2h-4h后,进行冷却;
步骤九:灌装
为保证成品中固液物质含量相对均匀,故将物料置于带搅拌功能的半固态灌装机中,进行灌装;
步骤十:成品
成品出厂前经感官、固形物含量、总酸、菌落总数、大肠菌群的项目检验。
与现有技术相比,本发明的有益效果:
(1)本发明针对易视疲劳人群,以花青素和叶黄素含量丰富的蓝莓、菊花、紫薯、黑枸杞为主要原料,经过现代化加工手段,将物料中的花青素、叶黄素、黄酮等多种具有营养眼部与抗氧化的功能因子充分混合,保留果蔬中绝大部分营养物质,保护功能因子活性,从而达到营养眼部的目的。
(2)本发明在原料选择上,使用葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣、樱桃的新鲜果实以及这些新鲜果蔬制成的果蔬干,同时使用鲜果与干制品,鲜果中抗氧化物质含量丰富,干果中经烘干产生了特殊的香气,蛋白质等物质有效浓缩,使用超声波辅助提取将细胞内物质提取至胞外,既提高了风味,营养也更加丰富。
附图说明
图1是本发明动物卵母细胞极体的视觉自动检测方法的流程图。
图2是本发明产品总花色苷浓度对arpe-19细胞活力的影响图。
图3是本发明产品总花色苷对arpe-19细胞相对荧光强度的影响图。
图4是本发明产品总花色苷抑制dcfh氧化为dcf的剂量-效应图。
图5是本发明产品总花色苷对arpe-19细胞ho-1和gst蛋白表达的影响图。
图6是本发明产品总花色苷对arpe-19细胞oh-1mrna表达的影响对比图。
图7是本发明产品总花色苷对arpe-19细胞gstmrna表达的影响对比图。
具体实施方式
下面结合实施例附图,对本发明的技术方案进行清楚、完整的描述,显然,描述的实施例仅仅是本发明的一个具体的实施例,不是全部的实施例。下述实施例是说明性的,不是限制性的,不能以下述实施例来限定本发明的保护范围。
实施例1
一种富含花青素抗视疲劳的果蔬酱,包括新鲜的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣和樱桃,以及葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干,按照每100份计,所述葡萄的添加量为4份,所述黑加仑的添加量为10份,所述蓝莓的添加量为6份,所述黑枸杞的添加量为6份,所述红枸杞的添加量为4份,所述紫薯的添加量为10份,所述柠檬的添加量4份,所述山楂的添加量为2份,所述酸枣的添加量为2份,所述樱桃的添加量为4份;所述葡萄干的添加量为4份,所述黑加仑干的添加量为3份,所述蓝莓干的添加量为3份,所述菊花干的添加量为4份,所述黑枸杞干的添加量为10份,所述红枸杞干的添加量为7份,所述紫薯干的添加量为3份,所述柠檬干的添加量为2份,所述山楂干的添加量为4份,所述酸枣干的添加量为4份,其余为樱桃干。
一种富含花青素抗视疲劳的果蔬酱的加工工艺,包括如下步骤:
步骤一:原料筛选
选取新鲜、无霉变的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣、樱桃的鲜果;以及无霉变的葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干;
步骤二:前处理
将11种果蔬干洗净;将10种新鲜果蔬洗净,并去皮、去核,紫薯、柠檬切分至2-3cm2小块;
步骤三:配料
将各种果蔬及果蔬干按配方比例准确称重,投入高剪切粉碎机中;
步骤四、初步粉碎
使用高剪切粉碎机将原料粉碎,采用点动式操作方法将块状物料粉碎;
步骤五:过筛
经初步粉碎后的物料依次经过20目筛和40目筛;收集20目筛拦截的物料进行二次粉碎,通过40目筛的物料即为成品所需细度。40目筛的筛下物与汁液在熬煮后期加入,以保持活性;
步骤六:二次破碎
被20目筛拦截的物料进行二次破碎,重复步骤五;
步骤七:熬煮、超声波辅助提取
将步骤五和步骤六中符合目数的物料加入装有超声波辅助提取的夹层锅中加热熬煮,同时进行超声波辅助提取,加热温度85℃-95℃,超声波功率500w,熬煮、提取时间0.5h-2h;
步骤八:恒温提取
经熬煮、提取后的物料由管道传送至保温储料罐中进行恒温提取,恒温提取温度50℃-60℃,保温2h-4h后,进行冷却;
步骤九:灌装
为保证成品中固液物质含量相对均匀,故将物料置于带搅拌功能的半固态灌装机中,进行灌装;
步骤十:成品
成品出厂前经感官、固形物含量、总酸、菌落总数、大肠菌群的项目检验。
实施例2
一种富含花青素抗视疲劳的果蔬酱,包括新鲜的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣和樱桃,以及葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干,按照每100份计,所述葡萄的添加量为2份,所述黑加仑的添加量为3份,所述蓝莓的添加量为3份,所述黑枸杞的添加量为10份,所述红枸杞的添加量为7份,所述紫薯的添加量为3份,所述柠檬的添加量7份,所述山楂的添加量为4份,所述酸枣的添加量为4份,所述樱桃的添加量为2份;所述葡萄干的添加量为7份,所述黑加仑干的添加量为10份,所述蓝莓干的添加量为6份,所述菊花干的添加量为7份,所述黑枸杞干的添加量为3份,所述红枸杞干的添加量为4份,所述紫薯干的添加量为6份,所述柠檬干的添加量为2份,所述山楂干的添加量为7份,所述酸枣干的添加量为2份,其余为樱桃干。
一种富含花青素抗视疲劳的果蔬酱的加工工艺,包括如下步骤:
步骤一:原料筛选
选取新鲜、无霉变的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣、樱桃的鲜果;以及无霉变的葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干;
步骤二:前处理
将11种果蔬干洗净;将10种新鲜果蔬洗净,并去皮、去核,紫薯、柠檬切分至2-3cm2小块;
步骤三:配料
将各种果蔬及果蔬干按配方比例准确称重,投入高剪切粉碎机中;
步骤四、初步粉碎
使用高剪切粉碎机将原料粉碎,采用点动式操作方法将块状物料粉碎;
步骤五:过筛
经初步粉碎后的物料依次经过20目筛和40目筛;收集20目筛拦截的物料进行二次粉碎,通过40目筛的物料即为成品所需细度。40目筛的筛下物与汁液在熬煮后期加入,以保持活性;
步骤六:二次破碎
被20目筛拦截的物料进行二次破碎,重复步骤五;
步骤七:熬煮、超声波辅助提取
将步骤五和步骤六中符合目数的物料加入装有超声波辅助提取的夹层锅中加热熬煮,同时进行超声波辅助提取,加热温度85℃-95℃,超声波功率500w,熬煮、提取时间0.5h-2h;
步骤八:恒温提取
经熬煮、提取后的物料由管道传送至保温储料罐中进行恒温提取,恒温提取温度50℃-60℃,保温2h-4h后,进行冷却;
步骤九:灌装
为保证成品中固液物质含量相对均匀,故将物料置于带搅拌功能的半固态灌装机中,进行灌装;
步骤十:成品
成品出厂前经感官、固形物含量、总酸、菌落总数、大肠菌群的项目检验。
实施例3
一种富含花青素抗视疲劳的果蔬酱,包括新鲜的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣和樱桃,以及葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干,按照每100份计,所述葡萄的添加量为7份,所述黑加仑的添加量为6份,所述蓝莓的添加量为10份,所述黑枸杞的添加量为3份,所述红枸杞的添加量为2份,所述紫薯的添加量为6份,所述柠檬的添加量2份,所述山楂的添加量为4份,所述酸枣的添加量为2份,所述樱桃的添加量为4份;所述葡萄干的添加量为2份,所述黑加仑干的添加量为6份,所述蓝莓干的添加量为10份,所述菊花干的添加量为2份,所述黑枸杞干的添加量为6份,所述红枸杞干的添加量为2份,所述紫薯干的添加量为10份,所述柠檬干的添加量为4份,所述山楂干的添加量为2份,所述酸枣干的添加量为4份,其余为樱桃干。
一种富含花青素抗视疲劳的果蔬酱的加工工艺,包括如下步骤:
步骤一:原料筛选
选取新鲜、无霉变的葡萄、黑加仑、蓝莓、黑枸杞、红枸杞、紫薯、柠檬、山楂、酸枣、樱桃的鲜果;以及无霉变的葡萄干、黑加仑干、蓝莓干、菊花干、黑枸杞干、红枸杞干、紫薯干、柠檬干、山楂干、酸枣干、樱桃干;
步骤二:前处理
将11种果蔬干洗净;将10种新鲜果蔬洗净,并去皮、去核,紫薯、柠檬切分至2-3cm2小块;
步骤三:配料
将各种果蔬及果蔬干按配方比例准确称重,投入高剪切粉碎机中;
步骤四、初步粉碎
使用高剪切粉碎机将原料粉碎,采用点动式操作方法将块状物料粉碎;
步骤五:过筛
经初步粉碎后的物料依次经过20目筛和40目筛;收集20目筛拦截的物料进行二次粉碎,通过40目筛的物料即为成品所需细度。40目筛的筛下物与汁液在熬煮后期加入,以保持活性;
步骤六:二次破碎
被20目筛拦截的物料进行二次破碎,重复步骤五;
步骤七:熬煮、超声波辅助提取
将步骤五和步骤六中符合目数的物料加入装有超声波辅助提取的夹层锅中加热熬煮,同时进行超声波辅助提取,加热温度85℃-95℃,超声波功率500w,熬煮、提取时间0.5h-2h;
步骤八:恒温提取
经熬煮、提取后的物料由管道传送至保温储料罐中进行恒温提取,恒温提取温度50℃-60℃,保温2h-4h后,进行冷却;
步骤九:灌装
为保证成品中固液物质含量相对均匀,故将物料置于带搅拌功能的半固态灌装机中,进行灌装;
步骤十:成品
成品出厂前经感官、固形物含量、总酸、菌落总数、大肠菌群的项目检验。
实施例4:产品中花色苷的提取与纯化
提取条件为柠檬酸质量分数为0.81%,料液比为26.36∶1(ml/g),提取温度为63.76℃,提取时间30min,超声波功率300w,在此条件下,得到的花色苷含量为81.71mg/100g。
考虑到解析时间,选取0.8ml/min。当以盐酸酸化的乙醇溶液(70%乙醇溶液,盐酸浓度为0.04%)作为解吸液,洗脱流速为0.8ml/min,解吸率为98%。
实施例5:产品中主要营养因子含量检测
1.实验方法
1.1花青素检验方法:分光光度计法,通过测定产品在530nm处吸光度,折算花青素含量。操作具体见郭彩华、卢珍华、伍菱等,紫薯花青素的提取及其在vc含量测定中的应用[j],食品科学,2016.1;
1.2原花青素检验方法:gb/t22244-2008保健食品中前花青素的测定;
1.3叶黄素检验方法:gb5009.248-2016食品安全国家标准食品中叶黄素的测定。
2.主要营养因子检测
将本发明富含花青素抗视疲劳的果蔬酱产品,分别从三个批次进行抽样,按照如上检测方法,进行花青素、原花青素和叶黄素的检测,检测结果取平均值,如表一所示:
表1
实施例6:细胞实验
1.产品中总花色苷对色素上皮细胞清除自由基的能力
arpe-19细胞(急性视网膜色素上皮细胞-19)生长于含10%fbs的dmem/f12培养液中,置于37℃、5%co2的孵育箱中培养。细胞生长融合后用0.25%的胰蛋白酶以1∶2的比例消化传代。
对照组:含10%pbs的dmem/f12培养基中不加入任何有效成分,即有效成分浓度为0μg/ml;
实验组:将总花色苷浓度依次设10,20,30,40,50,60μg/ml,以每并列5个孔为一组,实验重复3次;采用mtt比色法将arpe细胞正常传代计数,调整细胞密度为104个/100μl,接种于96孔板中,每孔100μl细胞悬液。
空白组:孔内加入100μldmem/f12培养基,不含细胞。
实验时,将不同浓度的总花色苷(10,20,30,40,50,60μg/ml)加入实验组细胞孔内,对照组介入相同体积的pbs,每组设复孔,37℃培养4h,弃上清,每孔加入150μldmso,低速振荡10min,使紫色结晶溶解。选择530nm测定各孔光吸收值(od值)。重复实验3次,按下式计算不同浓度总花色苷作用下的细胞存活率。
式中:
odx为加入不同浓度总花色苷溶液在530nm的吸光度;
od0为空白组在530nm的吸光度;
odc为对照组在530nm的吸光度。
将对数期的arpe-19细胞接种于黑色96孔板中,使得每孔细胞数约为104个,向每孔加入100μl生长培养基,在37℃,5%co2条件下培养24h后,用pbs清洗两次,然后加入200μl含有10μmdcfh-da探针和总花色苷溶液的新鲜培养基培养1h,用pbs清洗两次,再加入300μm的h2o2溶液100μl,用酶标仪在1h内每5min测定一次荧光强度值,测定条件为:激发波长488nm,发射波长525nm。其中:空白组用dcfh-da探针处理,总花色苷溶液和h2o2溶液用培养基代替;对照组用dcfh-da探针和总花色苷溶液处理,h2o2溶液用培养基代替。用可见光和荧光分光光度计法检测产品对细胞清除自由基活力的影响。
以相对荧光强度为纵坐标,以时间为横坐标绘制荧光强度-时间曲线。用origin软件计算荧光强度-时间曲线下的积分面积,细胞内抗氧化活性值(caa)由以下公式:
caa=100-(∫sa/∫ca)×100
给出,其中∫sa为加入不同浓度花色苷溶液的荧光强度-时间曲线的积分面积;∫ca为对照组荧光强度-时间曲线的积分面积。
由图2可知,在10-60μg/ml的浓度范围内,随着总花色苷浓度的升高细胞存活率略有下降,但仍保持在90%以上,说明在这个浓度范围内,总花色苷浓度对细胞存活率的影响可以近乎忽略不计,即arpe-19细胞在此总花色苷浓度范围内仍能保持良好的细胞活力。由图3可知,随着总花色苷浓度的增加,细胞内荧光强度下降,说明总花色苷能降低细胞内ros(活性氧)的水平,具有抗氧化的作用。由图4可知,在设定的浓度范围内总花色苷具有明显的抗氧化活性,且随着总花色苷浓度的增加,抗氧化活性增大,当总花色苷浓度为60μg/ml时,caa值约为70。
2.产品对关键酶(ho-1,gst)的影响
根据预实验结果,加入不同浓度的总花色苷(终浓度依次为0、40、50、60ug/ml),每个孔浓度设6孔。培养48h,收集培养后的arpe-19细胞,提取总蛋白,用bca法蛋白定量,上样,sds-page凝胶电泳后,转膜,pbs洗膜,5%脱脂牛奶封闭1h;pbs洗膜后加入一抗,4℃过夜;pbs洗膜:加入辣根过氧化物酶标记的二抗孵育0.5h;洗膜;用增强化学发光试剂盒检测。结果扫描后,用quantityone图像分析软件光密度分析,以β-actin为内参校正。测定不同总花色苷浓度下两种关键酶ho-1(红素氧合酶1)和gst(还原性谷胱甘肽转移酶)蛋白的表达水平。
图5中,1为空白对照组,按照总花色苷含量,2为40ug/ml组,3为50ug/ml组,4为60ug/ml组。由图5可见,总花色苷对arpe-19细胞gst的表达无明显影响,在1.0左右上下浮动;但对ho-1的表达有明显的抑制作用,当总花色苷浓度达到最大60ug/ml时,ho-1的表达水平相比一开始(花色苷浓度为0时)降低了一半左右。
3.3rt-pcr技术评价产品对关键酶mrna表达的影响
24孔板中每孔加入300ultrizol,室温放置5min后加入80ul氯仿,吸至1.5ml离心管,剧烈振荡15s,室温放置2-15min于10000r,4℃下离心15min;将上层水相转移至新的离心管中,加入200ul异丙醇,室温放置10min后于12000r,4℃下离心10min;小心移去上清,加入400ul70%乙醇,于7500r,4℃离心下5min。小心移去上清,室温放置10min左右,待乙醇挥发后,用适量depch2o液溶解沉淀,得到rna溶液。
于试管中加入总rna1ug,oligo(dt)0.2ug,depch2o适量(混合总体积为13ul),70℃下水浴5min后,立即置于冰浴中。加入5×buffer4ul,dntpmixture(2.5mmol/l)2ul,rnaseinhibitor0.5ul,m-mlv反转录酶0.5ul组成的逆转录混合液,于42℃下反应1h。在95℃下水浴5min,灭活反转录酶。冰浴5min,获得的cdna保存于-20℃。以β-actin为内参照进行pcr反应,反应体系为10×buffer5ul,dntpmixture(10mmeach)lul,mgcl2(25um)4ul,cdna1ul,primerf(10um)2.5ul,primerr(10um)2.5ul,灭菌h2o33ul,taq酶(1u/u1)1ul,total50ul;将上述反应液加入8联排中,每个样品做4个复孔;轻轻摇晃混匀反应液,离心使反应液集中于管底,按照表2的反应条件设置反应程序。
表2real-timepcr引物序列及反应条件
应用abisteponeplus实时定量pcr仪分析软件调整基线和阈值后,查看并分析反应板数据,获得每个样品每次反应的ct值,再计算得到其δct,与对照组比较后,取2-δδct值进行数据统计。由图6-7可知,两种关键酶oh-1mrna和gstmrna在总花色苷的影响下表达量均显著高于空白组。
以上通过实施例对本发明进行了详细说明,但所述内容仅为本发明的示例性实施例,不能被认为用于限定本发明的实施范围。本发明的保护范围由权利要求书限定。凡利用本发明所述的技术方案,或本领域的技术人员在本发明技术方案的启发下,在本发明的实质和保护范围内,设计出类似的技术方案而达到上述技术效果的,或者对申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖保护范围之内。应当注意,为了清楚的进行表述,本发明的说明中省略了部分与本发明的保护范围无直接明显的关联但本领域技术人员已知的处理表述。
- 还没有人留言评论。精彩留言会获得点赞!