双乙酰产量增加的鼠李糖乳杆菌的制作方法
本发明涉及适用于制备包含鼠李糖乳杆菌(lactobacillusrhamnosus)菌株的乳制品的组合物,该菌株能够通过高产量的双乙酰赋予乳制品增强的奶油风味,而不会不利地影响乳制品的流变性。本发明的组合物可以与用于生产乳制品的起子培养物一起使用或用作起子培养物的一部分。本发明进一步涉及制备具有高双乙酰含量的乳制品的方法,例如低脂酸奶、奶酪和酸奶油。用于制备这种乳制品的鼠李糖乳杆菌菌株也是本发明的一部分。
背景技术:
wo2012/136830公开了用于生产乳制品的抗真菌鼠李糖乳杆菌菌株。
在乳制品工业中,消费者对脂肪含量低或无脂肪产品的需求越来越多。但是,这类低脂乳制品通常缺乏奶油风味。
双乙酰是高价值产品,在乳制品工业中用作产生黄油风味的化合物,添加到人造黄油和油基产品等产品中。
异型乳酸菌形成作为主要产物的乳酸以及作为副产物的双乙酰/乙偶姻。细胞通过丙酮酸氧化酶由丙酮酸和硫胺素焦磷酸形成活性乙醛。活性乙醛与另一分子丙酮酸缩合形成α-乙酰乳酸合酶。尚未完全了解鼠李糖乳杆菌中双乙酰的形成——已经表明,在鼠李糖乳杆菌乳酸亚种双乙酰乳酸生物变种(lactococcuslactissubsp.lactisbiovar.diacetylactis)中,α-乙酰乳酸被α-乙酰乳酸氧化酶氧化成双乙酰(jyotietal2003)。乙偶姻通过α-乙酰乳酸的脱羧直接形成。乙偶姻形成还可以通过双乙酰不可逆的双乙酰还原酶转化为乙偶姻而发生。
鼠李糖乳杆菌是可用于产生双乙酰和乙偶姻等风味化合物的异型乳酸菌(jyotietal.2003)。所产生的双乙酰的水平取决于菌株以及其生长的底物。
美国专利第4,867,992号和美国专利第5,236,833号涉及通过用产生乳酸的细菌分别发酵咖啡基质和果胶基质来生产双乙酰的方法。
双乙酰和/或乙偶姻的制备、浓缩和添加到食品中与大量成本有关。
us4,678,673涉及用产生双乙酰和乙偶姻的鼠李糖乳杆菌菌株发酵的油料制品。发酵的油料制品具有类似黄油或乳制品的风味。没有提及鼠李糖乳杆菌在乳制品中的用途。
wo2012/136832公开了用于生产乳制品的产生双乙酰的鼠李糖乳杆菌菌株。
需要提供用于生产具有增加的双乙酰产量的乳制品的乳酸菌。
技术实现要素:
本发明的目的是,提供用于制备由存在的鼠李糖乳杆菌菌株赋予的增强的奶油风味而改善的乳制品的组合物和方法。
本发明的另一个目的是,提供就能够赋予诸如酸奶或奶酪等乳制品增强的奶油风味而言,具有改善的特性的新型鼠李糖乳杆菌菌株。
在下文中,其他目的会变得显而易见,而其他目的对于本发明所属领域的技术人员而言会是显而易见的。
从本文的工作实施例中可以看出,所述的鼠李糖乳杆菌菌株chcc15871,其已保藏在德国微生物保藏中心(germancollectionofmicroorganismsandcellcultures,dsmz),保藏编号为dsm32666,产生双乙酰和乙偶姻,从而赋予乳制品增强的奶油风味,而不会显著影响乳制品的流变性和后酸化。
另外,令人惊讶地发现,本发明的鼠李糖乳杆菌菌株chcc15871除了具有高双乙酰生产活性外,还具有高抗真菌活性。特别是,与常规抗真菌鼠李糖乳杆菌菌株相比,本发明的鼠李糖乳杆菌菌株chcc15871具有提高的抗酵母生长的活性。
因此,本发明的第一方面涉及包含鼠李糖乳杆菌菌株chcc15871或其突变菌株的组合物,鼠李糖乳杆菌菌株chcc15871保藏在德国微生物保藏中心(dsmz),保藏编号为dsm32666,其中突变菌株通过使用保藏的菌株作为母株获得,并且其中突变菌株与所述母株相比具有相同或更高的双乙酰产量。
本发明的第二方面涉及本发明的第一方面的组合物用于制备乳制品的用途。
本发明的第三方面涉及生产乳制品的方法,该方法包括以下步骤:
a)用根据本发明第一方面的组合物接种乳基质;
b)发酵乳基质;
c)任选地向乳基质中添加其他微生物和/或添加剂;
d)任选地对乳基质进行后处理;和
e)任选地包装乳制品。
本发明的第四方面涉及可通过本发明第三方面的方法获得的乳制品。
本发明的第五方面涉及鼠李糖乳杆菌chcc15871菌株或其突变菌株,chcc15871菌株保藏在德国微生物保藏中心(dsmz),保藏编号为dsm32666,其中突变菌株通过使用保藏的菌株作为母株获得,并且其中突变菌株与母体菌株相比具有相同或更高的双乙酰产量。
附图说明
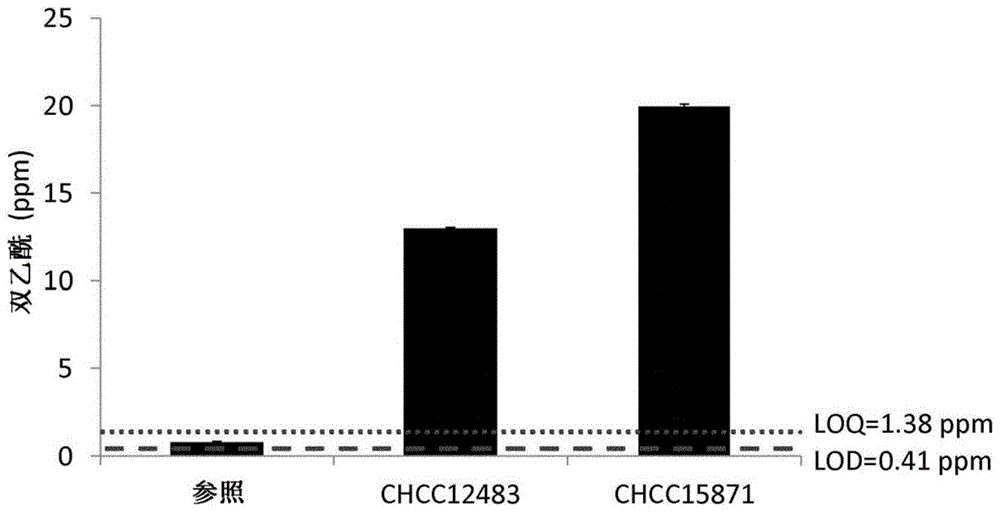
图1显示了在7±1℃下储存14天后,在用仅起子培养物(参照)或起子培养物与鼠李糖乳杆菌chcc12483的组合或与鼠李糖乳杆菌chcc15871一起发酵的发酵乳制品中的双乙酰水平。lod:检测限。loq:定量限。
图2显示了在7±1℃下储存14天后,在用仅起子培养物(参照)或起子培养物与鼠李糖乳杆菌chcc12483的组合或与鼠李糖乳杆菌chcc15871一起发酵的发酵乳制品中的乙偶姻水平。lod:检测限。loq:定量限。
图3显示了对于四种不同的酵母污染物a、b、c以及d,和对于三种酵母浓度(顶行、中行、底行),酵母在由用仅起子培养物(参照,第一平板)、与鼠李糖乳杆菌chcc12483一起(第二平板)或与鼠李糖乳杆菌chcc15871一起(第三平板)发酵的乳制备的平板上的生长。
图4显示了对于一种酵母污染物和对于三种酵母浓度(顶行、中间行、底行),酵母在由用仅起子培养物(参照,第一平板)、与鼠李糖乳杆菌chcc12483一起(第二平板)、与鼠李糖乳杆菌比较菌株一起(第三平板)或与鼠李糖乳杆菌chcc15871一起(第四平板)发酵的乳制备的平板上的生长。
图5显示对于3种不同的霉菌污染物a、b和c,和对于2种不同的温度(上平板和下平板),霉菌在由用仅起子培养物(参照,第一平板)或与鼠李糖乳杆菌chcc12483一起(第二平板)或与鼠李糖乳杆菌chcc15871一起发酵的乳制备的平板上的生长。
图6显示了在43℃发酵期间发酵乳制品的酸化曲线。该制品用仅起子培养物(参照)或起子培养物与鼠李糖乳杆菌chcc12483菌株或鼠李糖乳杆菌chcc15871菌株的组合进行了发酵。
图7显示了当在7±1℃下储存21天时,发酵乳制品中ph随时间的变化。该制品用仅起子培养物(参照)或起子培养物与鼠李糖乳杆菌chcc12483菌株或鼠李糖乳杆菌chcc15871菌株的组合进行了发酵。
图8显示了对于3种不同的霉菌污染物a、b和c,霉菌在由仅起子培养物(参照,第一平板)或与鼠李糖乳杆菌chcc15871一起(第二平板)发酵的乳制备的平板上的生长。
图9显示了在30℃下达到最终ph4.50的发酵时间(以分钟为单位)。该制品用仅五种不同的酸奶油起子培养物(sc1–sc5)和与鼠李糖乳杆菌chcc15871菌株或鼠李糖乳杆菌chcc12697菌株的组合进行了发酵。
图10显示了在5±1℃下储存7天和21天后,在用仅五种不同的起子培养物(sc1-sc5)和与鼠李糖乳杆菌chcc15871菌株或鼠李糖乳杆菌chcc12697菌株的组合发酵的发酵酸奶油制品中的双乙酰水平(ppm,平均值+/-标准偏差)。
图11显示了在5±1℃储存7天和21天后,在用仅五种不同起子培养物(sc1-sc5)和与鼠李糖乳杆菌chcc15871菌株或鼠李糖乳杆菌chcc12697菌株的组合发酵的发酵酸奶油制品中的乙偶姻水平(ppm,平均值+/-标准偏差)。
图12显示了在5±1℃下储存7天后,发酵酸奶油制品的流变学测量结果。从流量曲线数据得出300剪切速率(1/s)下的剪切应力(pa,平均值+/-标准偏差)。样品用仅五种不同起子培养物(sc1-sc5)和与鼠李糖乳杆菌chcc15871菌株或鼠李糖乳杆菌chcc12697菌株组合进行了发酵。
图13显示了在7±1℃下储存14天后,在用仅起子培养物和与8种不同的鼠李糖乳杆菌菌株(chcc15871、chcc12483、菌株1、菌株2、菌株3、菌株4、菌株5和菌株6)的组合发酵的酸奶制品中的双乙酰水平(ppm,平均值+/-标准偏差)。
具体实施方式
定义
本文所用术语“乳酸菌”表示革兰氏阳性、微需氧或厌氧细菌,其通过产生酸来发酵糖,所述酸包括乳酸作为主要产生的酸、乙酸和丙酸。工业上最有用的乳酸菌见于“乳杆菌目(lactobacillales)”,其包括乳球菌属种(lactococcusspp.)、链球菌属种(streptococcusspp.)、乳杆菌属种(lactobacillusspp)、明串珠菌属种(leuconostocspp.)、假明串珠菌属种(pseudoleuconostocspp.)、片球菌属种(pediococcusspp.)、短杆菌属种(brevibacteriumspp.)、肠球菌属种(enterococcusspp.)和丙酸杆菌属种(propionibacteriumspp.)。另外,属于严格厌氧细菌的产乳酸细菌双歧杆菌,即双歧杆菌(bifidobacteriumspp.)通常包括在乳酸菌组中。这些细菌经常单独或与其他乳酸菌组合用作食品培养物。
通常将乳酸菌,包括乳杆菌属种和嗜热链球菌(streptococcusthermophilus),作为用于批量起子繁殖的冷冻或冻干培养物或作为所谓的“直投式”(directvatset,dvs)培养物供应给乳制品工业,用于直接接种到发酵容器或发酵槽中以产生乳制品,例如发酵乳制品或奶酪。这种乳酸菌培养物通常称为“起子培养物”或“起子”。
术语“嗜温菌”在本文中是指在中等温度(15℃-40℃)下生长最好的的微生物。工业上最有用的嗜温菌包括乳球菌属种和明串珠菌属种。术语“嗜温发酵”在本文中是指在约12℃至约35℃的温度下发酵。术语“嗜温乳制品”是指通过嗜温起子培养物的嗜温发酵制备的乳制品,包括诸如酪乳、酸乳、培养乳、斯美塔那(smetana)、酸奶油和鲜干酪等发酵乳制品,鲜干酪例如夸克(quark)、tvarog和奶油干酪。
术语“嗜热菌”在本文中是指在高于43℃的温度下生长最好的微生物。工业上最有用的嗜热菌包括链球菌属种和乳杆菌属种。术语“嗜热发酵”在本文中是指在高于约35℃的温度下发酵。术语“嗜热乳制品”是指通过嗜热起子培养物的嗜热发酵制备的乳制品,并且包括诸如酸奶等乳制品。
术语“乳”应理解为通过对诸如奶牛、绵羊、山羊、水牛或骆驼等任何哺乳动物挤奶获得的乳状分泌物。在优选的实施方案中,乳是牛乳。术语乳还包括由诸如豆奶等植物材料制成的蛋白质/脂肪溶液。
术语“乳基质”可以是可根据本发明的方法进行发酵的任何未加工的和/或加工的乳料。因此,有用的乳基质包括但不限于任何乳或包含蛋白质的乳样产品的溶液/悬浮液,例如全脂乳或低脂乳、脱脂乳、酪乳、复原乳粉(reconstitutedmilkpowder)、炼乳、奶粉(driedmilk)、乳清、乳清渗透物、乳糖、乳糖结晶的母液、乳清蛋白浓缩物或乳膏(cream)。显然,乳基质可以来自任何哺乳动物,例如可以是基本上纯的哺乳动物乳,或复原乳粉。
在发酵之前,可根据本领域已知的方法将乳底物均质化和巴氏灭菌。
本文所用的“均质化”是指强烈混合以获得可溶性悬浮液或乳液。如果在发酵之前进行均质化,则可以进行均质化以将乳脂分解成更小的尺寸,使得它不再与乳分离。这可以通过在高压下迫使乳通过小孔来实现。
本文所用的“巴氏灭菌”是指处理乳基质以减少或消除例如微生物等活生物的存在。优选,通过将指定温度保持指定的时间段来实现巴氏灭菌。通常通过加热来达到指定的温度。可以选择温度和持续时间,以杀死或灭活某些细菌,例如有害细菌。随后可以进行快速冷却步骤。
本发明方法中的“发酵”是指通过微生物的作用将碳水化合物转化为醇或酸。优选,本发明方法中的发酵包括将乳糖转化为乳酸。
用于生产乳制品的发酵方法是众所周知的,本领域技术人员将知道如何选择合适的工艺条件,例如温度、氧气、微生物的量和特性以及处理时间。显然,选择发酵条件是为了支持实现本发明,即获得固体(例如奶酪)或液体(例如发酵乳制品)形式的乳制品。
在本文中,术语“剪切应力”决定粘度。粘度(单位为pas)定义为剪切应力(pa)/剪切速率(1/s)。
在本文中将剪切速率=3001/s下的剪切应力值报告为标准。感官实验表明(数据未显示),当使用在剪切速率3001/s下测量的粘度时,发现了流变学测量值与感官粘度/口腔厚重感(mouththickness)之间的最佳相关性。
关于本发明,术语“剪切应力”是指通过以下方法测量的剪切应力:
孵育七天后,使发酵乳制品升温至13℃并用配备有穿孔圆盘的条状物轻轻地手动搅拌,直至样品均匀。通过使用浮-杯(bob-cup)在流变仪(具有asc(automaticsamplechanger,自动换样器)的antonpaarphysica流变仪,anton
保持时间(重建到某种原始结构)
5分钟,不对样品施加任何物理应力(振荡或旋转)。
振荡步骤(分别测量弹性模量和粘性模量,即g'和g”,因此计算复数模量g*)
恒定应变=0.3%,频率(f)=[0.5...8]hz
60s(秒内)6个测量点(每10s一个)
旋转步骤(以3001/s测量剪切应力)
设计了两个步骤:
剪切速率=[0.3-300]1/s和2)剪切速率=[275-0.3]1/s。
每个步骤都在210s内包含21个测量点(每10s)。
选择3001/s下的剪切应力用于进一步分析,因为这与吞咽发酵乳制品时的口腔厚重感相关。
在本发明的上下文中,术语“突变体”应理解为,通过例如基因工程、辐射、uv光和/或化学处理和/或诱导基因组发生变化的方法,由本发明的菌株衍生的菌株。优选突变体是功能上等同的突变体,例如与母株具有基本相同或改善的特性(例如有关双乙酰产量、粘度、凝胶硬度、口腔包覆感、风味、后酸化、酸化速度和/或噬菌体稳健性)的突变体。这种突变体是本发明的一部分。特别是,术语“突变体”是指通过使本发明的菌株经历任何常规使用的诱变处理而获得的菌株,包括用化学诱变剂例如乙烷甲烷磺酸盐(ems)或n-甲基-n'-硝基-n-硝基胍(ntg)、紫外线处理,或是指自发发生的突变体。特别是,突变体是天然突变体,即例如通过对母菌株进行诱变处理而获得的突变体,诱变处理包括在没有一种或多种常规生长因子的培养基中使母菌株生长,这也称为选择压力。就此而言,术语“天然突变体”是指不是通过使用基因工程、辐射、uv光和/或化学处理获得的突变体。突变体可能已经经历了几次诱变处理(单次处理应理解为包含一个诱变步骤,然后进行筛选/选择步骤),但本发明优选进行不超过20次,或不超过10次或不超过5次处理(或筛选/选择步骤)。在本发明优选的突变体中,与母株相比,细菌基因组中少于5%,或少于1%或甚至少于0.1%的核苷酸已经被另一核苷酸替换或缺失。在具体实施方案中,与母株相比,突变体含有不超过20个,特别是不超过10个,特别是不超过5个,特别是不超过4个,特别是不超过3个,特别是不超过2个,并且特别是不超过1个细菌基因组核苷酸突变,其中突变是一个核苷酸的取代、插入或缺失。
在描述本发明的上下文中(特别是在以下权利要求的上下文中)术语“a(一)”和“an(一)”和“所述”以及类似指代的使用,应解释为涵盖单数和复数,除非本文另有说明或与上下文明显矛盾。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应解释为开放式术语(即,意味着“包括但不限于”)。除非本文另有说明,否则本文中对数值范围的列举仅旨在用作单独提及落入该范围内的每个单独值的简写方法,并且每个单独值并入本说明书中,如同其在本文中单独列举一样。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。除非另外声明,否则本文提供的任何和所有实例或示例性语言(例如,“诸如”)的使用仅旨在更好地说明本发明,而不是对本发明的范围进行限制。不应将说明书中的语言解释为表明任何未要求保护的要素对于本发明的实践是必不可少的。
本发明的组合物
本发明的发明人令人惊奇地发现,除了起子培养物之外,用鼠李糖乳杆菌菌株接种和发酵乳基质,有可能赋予所得乳制品令人愉悦的奶油风味,而不会不利地影响乳制品的质地、发酵时间和后酸化。
在存在鼠李糖乳杆菌chcc15871的情况下,在通过嗜温和嗜热发酵工艺制备的乳制品中检测到增强的奶油风味,该鼠李糖乳杆菌chcc15871保藏在德国微生物保藏中心(dsmz),保藏编号为dsm32666。
术语“增强的奶油风味”是指与不包含本发明的鼠李糖乳杆菌菌株的制品相比,制品中双乙酰和/或乙偶姻的含量增加和/或由感官小组确定的制品的奶油风味得到增强。
在不希望受理论的束缚的情况下,相信本发明的鼠李糖乳杆菌菌株赋予乳制品的增强的奶油风味是由于鼠李糖乳杆菌菌株的双乙酰和/或乙偶姻的产量增加所致。
在优选的实施方案中,乳制品是低/无脂肪发酵乳制品或奶酪,当本发明的鼠李糖乳杆菌菌株未用于发酵中或未用于发酵时,其基本上缺乏奶油风味。
在本发明的具体实施方案中,组合物包含至少一种其他乳酸菌。
在本发明的组合物的具体实施方案中,另一种乳酸细菌是至少一种选自由以下组成的组的抗真菌乳酸菌:鼠李糖乳杆菌菌株、发酵乳杆菌(lactobacillusfermentum)菌株、副干酪乳杆菌(lactobacillusparacasei)、植物乳杆菌(lactobacillusplantarum)菌株、费氏丙酸杆菌(propionibacteriumfreudenreichii)菌株,例如费氏丙酸杆菌谢氏亚种(propionibacteriumfreudenreichiisubsp.shermanii),特氏丙酸杆菌(propionibacteriumthoenii)菌株、詹氏丙酸杆菌(propionibacteriumjensenii)菌株、乳酸片球菌(pediococcusacidilactici)菌株、粪肠球菌(enterococcusfaecium)菌株、乳酸乳球菌(lactococcuslactis)菌株和淀粉乳杆菌(lactobacillusamylovorus)。在该实施方案中,组合物适用于在生产乳制品,例如发酵乳制品,例如酸奶、酸奶油或奶酪的过程中,在发酵开始时与起子培养物一起添加到乳基质中,以增加发酵制品或奶酪中双乙酰含量和/或获得抗真菌效果。或者,可以在发酵过程中,即在发酵开始之后且在发酵结束之前添加组合物。
在本发明的组合物的具体实施方案中,至少一种抗真菌乳酸菌是鼠李糖乳杆菌菌株chcc15860,其保藏在德国微生物保藏中心(dsmz),保藏编号为:32092。
在本发明的具体实施方案中,组合物包含用于生产发酵乳制品的起子培养物,所述起子培养包含一种或多种选自由乳球菌属(lactococcus)、链球菌属(streptococcus)和乳杆菌属(lactobacillus)组成的组的菌株。
通常,这样的组合物包含浓缩形式的细菌,浓缩形式包括通常具有活细胞浓度的冷冻、干燥或冻干浓缩物,所述活细胞浓度的范围为每克组合物104-1012cfu(菌落形成单位),包括每克组合物至少104cfu,例如至少105cfu/g,例如至少106cfu/g,例如至少107cfu/g,例如至少108cfu/g,例如至少109cfu/g,例如至少1010cfu/g,例如至少1011cfu/g。因此,本发明的抗微生物组合物优选以冷冻、干燥或冻干的形式存在,例如作为直投式(dvs)培养物存在。然而,如本文所用,抗微生物组合物也可以是将冷冻、干燥或冻干的细胞浓缩物悬浮在液体介质如水或pbs缓冲液中后获得的液体。当本发明的抗微生物组合物是悬浮液时,活细胞的浓度范围为每毫升组合物104-1012cfu(菌落形成单位),包括每毫升组合物至少104cfu,例如至少105cfu/ml,例如至少106cfu/ml,例如至少107cfu/ml,例如至少108cfu/ml,例如至少109cfu/ml,例如至少1010cfu/ml,例如至少1011cfu/ml。
组合物可另外含有冷冻保护剂和/或常规添加剂作为另外的成分,包括营养成分,例如酵母提取物、糖和维生素,例如维生素a、c、d、k或维生素b族的维生素。可以添加到本发明组合物中的合适冷冻保护剂是改善微生物的耐寒性的成分,例如甘露醇、山梨糖醇、三聚磷酸钠、木糖醇、甘油、棉子糖、麦芽糊精、赤藓糖醇、苏糖醇、海藻糖、葡萄糖和果糖。其他添加剂可包括碳水化合物、调味剂、矿物质、酶(例如凝乳酶、乳糖酶和/或磷脂酶)。
由于在乳酸菌发酵过程中将混合培养物用作起子培养物是正常的,因此在某些实施方案中,组合物会包含属于同一物种或属于不同物种的多菌株。在嗜热起子培养物中乳酸菌的这种有用组合的典型实例是保加利亚乳杆菌(lactobacillusbulgaricus)菌株和嗜热链球菌(streptococcusthermophilus)菌株的混合物。在嗜温起子培养物中乳酸菌的这种有用组合的典型实例是乳酸乳球菌菌株与选自由以下组成的组菌株的组合:明串珠菌属(leuconostoc)菌株、乳酸乳球菌乳酸亚种双乙酰生物变种(lactococcuslactissubsp.lactisbiovar.diacetylactis)菌株和嗜热链球菌菌株。
在本发明的优选实施方案中,起子培养物是嗜热起子培养物,并且该组合物适合于嗜热发酵。
在另一个优选的实施方案中,起子培养物选自由链球菌属(streptococcus)和乳杆菌属(lactobacillus)组成的组。优选的实施方案中的起子培养物包含至少一种乳酸乳球菌菌株。起始培养物可以包含本领域已知的任何乳酸乳球菌菌株,例如乳酸乳球菌乳脂亚种(lactococcuslactissubsp.cremoris)、乳酸乳球菌霍氏亚种(lactococcuslactissubsp.hordniae)或乳酸乳球菌乳酸亚种(lactococcuslactissubsp.lactis)的菌株。在又一个优选的实施方案中,起子培养物包含乳酸乳球菌乳脂亚种菌株和乳酸乳球菌乳酸亚种。
组合物可用于制备具有增强的奶油风味的乳制品。
在优选的实施方案中,乳制品是发酵乳制品,例如酸奶。在另一个优选的实施方案中,乳制品是奶酪。
在优选的实施方案中,乳制品含有至少1.0ppm的双乙酰,特别是至少3.0ppm的双乙酰,更特别是至少5.0ppm的双乙酰,更特别是至少7.0ppm的双乙酰,更特别是至少9.0ppm的双乙酰,更特别是至少11.0ppm的双乙酰,更特别是至少13.0ppm的双乙酰,更特别是至少15.0ppm的双乙酰,更特别是至少17.0ppm的双乙酰,最特别是至少19.0ppm的双乙酰。
技术人员应当知道多种测定本发明的乳制品中双乙酰含量的方法。例如,含量可以通过合适的色谱方法例如静态顶空气相色谱法(hsgc)来测定。可以使用本领域已知的不同测定来测定双乙酰的分泌,但是,优选在包括以下的测定中进行测定:
(1)通过以下方式制备发酵乳制品:
(a)用浓度为至少5x106cfu/g的鼠李糖乳杆菌和起子培养物接种乳,
(b)发酵,直至达到目标ph,例如ph4.6,和;
(2)将发酵乳制品在7±1℃下储存14天;
(3)将200μl4nh2s04添加到1g发酵乳制品中,并通过静态顶空气相色谱法测定双乙酰的浓度。
本发明的抗真菌组合物
在具体实施方案中,本发明的组合物是抗真菌、包含本发明的鼠李糖乳杆菌chcc15871和至少一种其他抗真菌乳酸菌的组合物。
在优选的实施方案中,本发明的组合物用于抵抗诸如酵母和霉菌等真菌。这意味着该组合物用于抑制和/或防止在乳品工业过程,特别是乳发酵过程中引起污染的真菌的生长。本发明的组合物可以用于例如抑制和/或预防以下的生长:酵母,例如以下属的酵母:克鲁维酵母属(klyveromyces)(例如马克斯克鲁维酵母(k.marxianus)、乳酸克鲁维酵母(k.lactis))、毕赤酵母属(pichia)(例如,发酵毕赤酵母(p.fermentans))、耶氏酵母属(yarrowia)(例如解脂耶氏酵母(y.lipolytica))、假丝酵母属(candida)(例如清酒假丝酵母(c.sake))、德巴利氏酵母属(debaryomyces)(例如汉逊德巴利酵母(d.hansenii));或霉菌,例如以下属的霉菌:青霉属(penicillium)(例如纳地青霉(p.nalgiovense)、普通青霉(p.commune)、皮落青霉(p.crustosum)、短密青霉(p.brevicompactum)、光滑青霉(p.glabrum))、毛霉属种(mucorspp.)、枝孢霉属种(cladiosporiumssp.)、曲霉属(aspergillus)(例如杂色曲霉(a.versicolor))等。特别优选的是,使用本发明的组合物来抑制和/或预防以下种的生长:马克斯克鲁维酵母、解脂耶氏酵母、纳氏青霉、枝孢霉属种、普通青霉、毛霉属种、短密青霉、杂色曲霉、皮落青霉、乳酸克鲁维酵母和/或汉逊德巴利酵母。
在本发明的具体实施方案中,可以将鼠李糖乳杆菌chcc15871菌株的抗真菌活性测量为抑制以保藏编号dsm32093保藏的真菌离生青霉(penicilliumsolitum)的生长或以保藏编号dsm32094保藏的真菌短密青霉的生长或皮落青霉的生长的能力。
在本发明的上下文中,优选地使用包括以下的测定法来测定抑制以保藏编号dsm32093保藏的真菌离生青霉的生长或以保藏编号dsm32094保藏的真菌短密青霉的生长的能力:
(1)通过以下方式制备发酵乳制品:
(a)用浓度为至少5x106cfu/g的鼠李糖乳杆菌chcc15871和起子培养物接种乳,
(b)发酵,直至达到目标ph,例如ph4.6,并且
(c)通过添加琼脂固化发酵乳;
(2)以500个孢子/斑点的浓度在琼脂固化的发酵乳上生成离生青霉或短密青霉的至少一个斑点,并在25℃下孵育7天;
(3)通过测定由离生青霉或短密青霉的生长形成的菌落的最大直径,并将该直径表示为在相同条件下但不存在鼠李糖乳杆菌菌株的情况下形成的最大直径的百分比来测定抑制百分比。
在本发明的具体实施方案中,将鼠李糖乳杆菌chcc15871菌株的抗真菌活性测量为抑制一种或多种选自由以下组成的组的酵母的生长的能力:德尔布有孢圆酵母(torulasporadelbrueckii)、长莓隐球酵母(cryptococcusfragicola)、汉逊德巴利酵母、解脂耶氏酵母、胶红酵母(rhodotorulamucilaginosa)、季也蒙毕赤酵母(pichiaquilermondii)和假丝酵母属种(candidaspp),优选一种或多种选自由以下组成的组的酵母:德尔布有孢圆酵母、长莓隐球酵母、汉逊德巴利酵母、解脂耶氏酵母和胶红酵母的酵母。
在本发明的上下文中,优选地使用包括以下的测定法测定抑制一种或多种选自由德尔布有孢圆酵母、长莓隐球酵母、汉逊德巴利酵母、解脂耶氏酵母和胶红酵母组成的组的酵母的生长能力:
(1)通过以下方式制备发酵乳制品:
(a)用浓度为至少5x106cfu/g的鼠李糖乳杆菌chcc15871和起子培养物接种乳,
(b)发酵,直至目标ph,例如ph4.6,并且
(c)通过添加琼脂来固化发酵乳;
(2)以103、102和101cfu/斑点的浓度在琼脂固化的发酵乳上生产四种酵母即德尔布有孢圆酵母、长莓隐球酵母、汉逊德巴利酵母和解脂耶氏酵母的至少一个斑点,并将其在7℃孵育27天;
(3)通过确定含有鼠李糖乳杆菌chcc15871和起始培养物的平板中发生生长的12个斑点的数目(从0-12个斑点),并将该数目表示为仅含有起子培养物的平板中发生生长的斑点数目的百分比,来测定抑制百分比。
在可替代的实施方案中,通过目视检查和比较平板,并通过相对于1)无生长的斑点数量和2)对于生长的斑点,生长水平(斑点的直径、密度和厚度),比较板来评估抑制水平,进行步骤(3)作为定性确定。
本发明的用途
如上所述,本发明还涉及本发明的组合物用于制备乳制品的用途。
在具体实施方案中,乳制品是发酵乳制品。在具体实施方案中,发酵乳制品是酸奶。在另一个具体实施方案中,乳制品是奶酪。
在具体实施方案中,乳制品包含至少0.75ppm的双乙酰,特别是至少1.5ppm的双乙酰。
本发明还涉及本发明的组合物在制备乳制品的方法中用于产生双乙酰的用途。
本发明还涉及本发明的组合物在制备乳制品的方法中抑制真菌生长的用途。本发明还涉及本发明的组合物在制备乳制品的方法中抑制酵母生长的用途。
本发明的方法
如上所述,本发明的一个方面涉及制造具有奶油风味的乳制品的方法,包括:
a)用本发明第一方面的组合物接种乳基质;
b)发酵乳基质;
c)任选地向乳基质中添加其他微生物和/或添加剂;
d)任选地对乳基质进行后处理;和
e)任选地包装乳制品。
如上所述,步骤a)中所用的乳基质可以是可根据本发明的方法进行发酵的任何未加工的乳料和/或加工的乳料。
可以通过任何合适的方法用上述组合物接种乳基质。例如,可以通过直接接种到发酵容器中来接种乳基质。
在一个优选的实施方案中,步骤b)包括在高于约37℃的温度下,优选在约38℃至约45℃的温度下,更优选在约39℃至约42℃的温度下发酵乳基质。在另一个优选的实施方案中,步骤b)包括在约22℃至约34℃,更优选在约24℃至约32℃之间,更优选在约26℃至约30℃的温度下发酵乳底物。
用于生产乳制品的发酵方法是众所周知的,并且本领域技术人员将知道如何选择合适的工艺条件,例如温度、氧气、微生物的数量和特性以及处理时间。显然,选择发酵条件以获得适于生产具有改善的风味和高质地的乳制品的发酵乳制品。
可以在步骤(b)的发酵乳基质之前、之中或之后,将其他微生物和/或添加剂添加到乳基质中。可以添加到乳基质中的微生物将以有利的方式有助于乳制品的性能。例如,微生物可以改善或支持乳制品中双乙酰的产生、粘度、凝胶硬度、口腔包覆感、风味、后酸化和/或酸化速度。任选地,可以将其他成分添加到乳基质中,例如颜料、稳定剂,例如果胶、淀粉、改性淀粉、cmc等;或多不饱和脂肪酸,例如ω-3脂肪酸。此类成分可以在生产过程中的任何时候添加,例如发酵之前或之后。
乳基质可以通过生产期望的乳制品所需的任何方法进一步后处理。例如可以将其他成分,例如包括诸如糖和维生素等营养物的常规添加剂添加到乳基质中。此外,乳基质可以被均质化,或用热处理乳基质,即巴氏灭菌。
可以以本领域已知的任何合适方式包装乳制品。例如,可以将乳制品包装在体积为例如25-1500ml的密封容器中。可以在生产过程中的任何时候包装制品,例如在接种步骤后包装,然后在包装中发酵。
通过该方法获得的乳制品包括作为典型实例的制品,例如酸奶、酸奶油、奶酪和酪乳。
通过上述方法可获得的乳制品也是本发明的一部分。
在优选的实施方案中,乳制品是发酵乳制品。本文所用的“发酵乳制品”包括但不限于诸如嗜热发酵乳制品例如酸奶、嗜温发酵乳制品例如酸奶油和酪乳,以及发酵乳清等制品。
术语“嗜热发酵乳制品”是指通过嗜热起子培养物的嗜热发酵而制备的发酵乳制品,并且包括诸如凝固酸奶、搅拌酸奶和饮用酸奶等发酵乳制品,例如养乐多(yakult)。
术语“嗜温发酵乳制品”是指通过嗜温起子培养物的嗜温发酵制备的发酵乳制品,包括诸如酪乳、酸乳、培养乳、斯美塔那(smetana)、酸奶油、克非尔(kefir)和新鲜干酪的发酵乳制品,所述新鲜干酪例如夸克(quark)、tvarog和奶油奶酪。
在又一个优选的实施方案中,乳制品是奶酪,例如松软奶酪(cottage)、羊乳酪(feta)、切达奶酪(cheddar)、帕尔马奶酪(parmesan)、马苏里拉奶酪(mozzarella)、埃曼塔尔(emmentaler)、丹博奶酪(danbo)、古乌达奶酪(gouda)、伊丹奶酪(edam)、羊乳酪类(feta-type)、蓝纹奶酪(bluecheese)、盐水奶酪(brinecheese)、卡门培尔奶酪(camembert)或布里奶酪(brie)。
在优选的实施方案中,乳制品包含至少0.75ppm的双乙酰,例如至少1.0ppm的双乙酰,例如至少1.5ppm的双乙酰。
本发明的菌株chcc15871
本发明的第五方面涉及鼠李糖乳杆菌chcc15871菌株,其保藏在德国微生物保藏中心(dsmz),保藏编号为dsm32666。除此菌株外,本发明还涉及由其衍生的突变体,即它们是通过使用保藏的菌株chcc15871作为母株获得的。突变菌株可以例如通过基因工程、辐射、uv光、化学处理和/或诱导基因组发生变化的方法由chcc15871衍生。就乙酸盐、乙醛、双乙酰和/或乙偶姻的生产水平而言,本发明的突变体会基本上具有与母株相同的特征。优选突变体与其母株相比产生基本上至少80%或更多,至少90%或更多,至少95%或更多或至少100%或更多的乙酸盐、乙醛、双乙酰和/或乙偶姻。
关于本发明,表述“与母株相比相同或更高的双乙酰产量”是指与母株相比至少100%的双乙酰产量。
对于本领域技术人员显而易见的是,通过使用保藏的菌株作为母株,有技术的读者可以通过常规诱变或重新分离技术常规地获得保留本文所述相关特征和优点的其他突变体或衍生物。因此,第一方面的术语“其突变体”是指通过使用保藏的菌株作为母株获得的突变菌株。
下面通过非限制性实施例描述本发明的实施方案。
实施例
实施例1:鼠李糖乳杆菌chcc15871对不同酵母和霉菌污染物的抑制作用和双乙酰产量的半定量分析
对于鼠李糖乳杆菌chcc15871抑制作用的半定量分析,使用琼脂测定,类似于酸奶的制造过程和制品:
将降脂(1.5%w/v)均质乳在90±1℃下热处理20min(分钟),然后立即冷却。以0.02%(v/w)接种商业酸奶起子培养物(f-dvsyoflexmild2.0),并将接种的乳分配到200ml瓶中。一瓶接种了总浓度为1x107cfu/g的鼠李糖乳杆菌chcc15871,一瓶接种了总浓度为1x107cfu/g的鼠李糖乳杆菌chcc12483,其是商业生物保护菌株(从
以500个孢子/斑点的浓度使三种不同霉菌的孢子悬浮液产生斑点:短密青霉(dsm32094)、皮落青霉、离生青霉(dsm32093)。使三种霉菌在同一平板上产生斑点。将平板在25±1℃下孵育,并定期检查霉菌的生长。使五种酵母以103、102和101cfu/斑点的浓度产生斑点,这五种酵母包括德尔布有孢圆酵母、长莓隐球酵母、汉逊德巴利酵母、解脂耶氏酵母和胶红酵母。将平板在7±1℃下孵育,并定期检查酵母的生长。
在第14天,通过静态顶空气相色谱法(hsgc)分析样品的双乙酰,静态顶空气相色谱法是用于分析复杂基质中挥发物的灵敏方法。该设置构成为连接到具有火焰离子化检测器(flameionizationdetector,fid)的气相色谱仪的静态顶空进样器。为此,使用了以下设备:
hs-自动进样器:hs40×i,turbomatrix110,perkinelmer(珀金埃尔默)。
hs-软件:hscontrolv.2.00,perkinelmer。
gc:autosystemxl,perkinelmer。
gc-软件:turbochromnavigator(turbochrom导航器),perkinelmer。
柱:hp-ffap25mx0.20mmx0.33μιη,agilenttechnologies。
使用已知浓度的标准品确定响应因子(校准),使用对照来控制所用响应因子在分析系列内以及系列之间和一段时间(月)内稳定。使用来自标准品的响应因子测定样品和对照中的挥发物浓度(ppm)。通过将200μl4nh2so4添加到1g酸奶样品中来制备样品,并立即通过hsgc分析。
图1说明了对双乙酰产量的影响,表明在乳发酵过程添加鼠李糖乳杆菌chcc15871与商业化鼠李糖乳杆菌菌株相比产生的双乙酰水平更高。
图2说明了对乙偶姻产量的影响,表明在乳发酵过程添加鼠李糖乳杆菌chcc15871与商业化鼠李糖乳杆菌菌株相比产生的乙偶姻水平更高。
图3显示了酵母在由仅用起子培养物(参照,第一平板)、与鼠李糖乳杆菌chcc12483一起(第二平板)或与鼠李糖乳杆菌chcc15871一起(第三平板)发酵的乳制备的平板上的生长。平板已经在7±1℃下孵育27天。以1x103cfu/斑点(顶行)、1x102cfu/斑点(中间行)和1x101cfu/斑点(底行)的浓度添加靶污染物:(a)德尔布有孢圆酵母,(b)长莓隐球酵母,(c)汉逊德巴利酵母和(d)解脂耶氏酵母。
图4显示了酵母在由用仅起子培养物(参照,第一平板)、与鼠李糖乳杆菌chcc12483一起(第二平板)、与鼠李糖乳杆菌比较菌株一起(第三平板)或与鼠李糖乳杆菌chcc15871一起(第四平板)发酵的乳制备的平板上的生长。平板已经在7±1℃下孵育26天。以1x103cfu/斑点(顶行)、1x102cfu/斑点(中间行)和1x101cfu/斑点(底行)的浓度添加靶污染物,即胶红酵母。
从图3和图4所示的酵母琼脂测定结果可以看出,测试的酵母在仅用起子培养物发酵的乳制成的琼脂平板上生长得很好(参照)。然而,当在乳发酵过程中存在鼠李糖乳杆菌chcc15871时,所得平板抑制了所有测试的酵母的生长。抑制水平甚至高于在商业生物保护菌株鼠李糖乳杆菌chcc12483和鼠李糖乳杆菌比较菌株中观察到的抑制水平。
图5显示了霉菌在由用仅起子培养物(参照,第一平板)或与鼠李糖乳杆菌chcc12483一起(第二平板)或与鼠李糖乳杆菌chcc15871一起(第三平板)发酵的乳制备的平板上的生长。平板已经在25±1℃下孵育12天(顶行)或在7±1℃下孵育27天(底行)。以500个孢子/斑点的浓度添加靶污染物:(a)短密青霉,(b)皮落青霉和(c)离生青霉。
图5显示,所有测试的霉菌都能够在仅用起子培养物(参照)发酵的乳制成的琼脂平板上生长。当乳发酵过程中存在鼠李糖乳杆菌chcc12483时,霉菌的生长受到抑制。当乳发酵过程中存在鼠李糖鼠乳杆菌chcc15871时,霉菌的生长受到的抑制甚至高于chcc12483。
实施例2:鼠李糖乳杆菌菌株chcc15871对后酸化的影响
测试了鼠李糖鼠乳杆菌菌株(chcc15871)对酸化速度及其对后酸化的影响。
将降脂(1.5%w/v)均质乳在90±1℃下热处理20min,然后立即冷却。以0.02%(v/w)接种商业酸奶起子培养物(f-dvsyoflexmild2.0),并将接种的乳分配到200ml瓶中。一瓶接种了总浓度为1x107cfu/g的鼠李糖乳杆菌chcc15871,一瓶接种了总浓度为1x107cfu/g的鼠李糖乳杆菌chcc12483,其是商业生物保护菌株(从
为了监测对后酸化的影响,将三种发酵乳样品(仅起子、鼠李糖乳杆菌chcc12483和鼠李糖乳杆菌chcc15871)在7±1℃下储存21天,并在第1、7、14和21天测量ph。
图6显示了在43℃发酵过程中发酵乳制品的酸化曲线。制品是用仅起子培养物、参照或起子培养物与鼠李糖乳杆菌chcc12483菌株或鼠李糖鼠乳杆菌chcc15871菌株的组合发酵的。
从图6中可以看出,两种鼠李糖乳杆菌菌株的添加都不改变发酵的酸化曲线。
图7显示了当在7±1℃下储存21天时,发酵乳制品的ph随时间的发展(后酸化)。制品是用仅起子培养物、参照或起子培养物与鼠李糖乳杆菌chcc12483菌株或鼠李糖乳杆菌chcc15871菌株的组合发酵的。
从图7中可以看出,两种鼠李糖乳杆菌菌株的添加都没有在很大程度上改变发酵乳制品的后酸化特性。
实施例3:鼠李糖乳杆菌chcc15871对不同霉菌污染物的抑制作用的半定量分析
对于鼠李糖乳杆菌chcc15871抑制作用的半定量分析,使用琼脂测定,类似于酸奶油的制造过程和制品:
将标准化乳(9%脂肪w/v)的均质乳在90±1℃下热处理20min,然后立即冷却。以0.02%(v/w)接种商业酸奶油起子培养物(f-dvsxt-314),并将接种的乳分配到200ml瓶中。一瓶接种了总浓度为5×106cfu/g的鼠李糖乳杆菌chcc15871,一瓶用作参照,仅接种了起子培养物。将两个瓶在26±1℃的水浴中孵育,并在这些条件下发酵,直至达到4.60±0.1的ph。发酵后,将瓶剧烈振荡以破坏凝聚物,并在冰上冷却。然后将发酵乳加热至40℃的温度,并添加40ml已融化并冷却至60℃的5%无菌琼脂溶液。然后将这种发酵乳和琼脂的溶液倒入无菌的皮氏培养皿中,并将平板在laf工作台中干燥30min。
以500个孢子/斑点的浓度使三种不同的霉菌孢子悬浮液产生斑点:短密青霉(dsm32094)、皮落青霉和离生青霉(dsm32093)。使三种霉菌在同一平板上产生斑点。将平板在25±1℃下孵育,并定期检查霉菌的生长。
图8显示了霉菌在由用仅起子培养物(参照,第一平板)或与鼠李糖乳杆菌chcc15871lb一起(第二平板)发酵的乳制备的平板上的生长。平板已经在25±1℃下孵育12天。以500个孢子/斑点的浓度添加靶污染物:(a)短密青霉,(b)皮落青霉和(c)离生青霉。
图8表明,所有测试的霉菌都能够在仅用起子培养物(参照)发酵的乳制成的琼脂平板上生长。当乳发酵过程中存在鼠李糖乳杆菌chcc15871时,霉菌的生长受到强烈抑制。
实施例4:鼠李糖乳杆菌菌株chcc15871对双乙酰和乙偶姻产量、发酵时间和粘度的影响
测试了鼠李糖乳杆菌菌株(chcc15871)对酸奶油应用中双乙酰和乙偶姻产量、发酵时间和粘度的影响。将性能与已知具有高双乙酰产量(参见wo2012/136832)和抗真菌活性(参见wo2012/136830)的常规鼠李糖乳杆菌chcc12697进行了比较。
将酸奶油基材(18%脂肪和2.7%w/v蛋白质)均质化(两步,在70℃下200/70bar),在85±1℃下热处理3min,然后立即冷却。在试验开始时,将酸奶油基材分配到200ml无菌瓶中。以0.01%(v/w)接种了五种起子培养物(sc1-sc5)–由乳酸乳球菌乳酸亚种、乳酸乳球菌乳脂亚种、嗜热链球菌和明串珠菌属组成。每种起子培养物接种五瓶。两瓶再接种总浓度为5x106cfu/g的鼠李糖乳杆菌chcc15871,另两瓶再接种总浓度为5x106cfu/g的鼠李糖乳杆菌chcc12697(比较基准)。每种起子培养物一瓶用作参照/对照。将所有瓶在30±1℃的水浴中孵育,并在这些条件下发酵,直至达到4.50±0.1的ph。在终点ph,搅拌(用手动搅拌器20次)凝聚物以达到均匀质地,并在冰上冷却。冷却后,将瓶储存在5±1℃下。
图9说明了记录的发酵时间。重要的是,与鼠李糖乳杆菌菌株的组合没有引起发酵时间的明显增加。对于sc1、sc2、sc4和sc5,起子培养物和chcc15871的混合物的发酵时间比单独的起子培养物的发酵时间以及起子培养物和chcc12697的发酵时间要短。
在第7天和第21天,通过静态顶空气相色谱法(hsgc)分析样品的双乙酰和乙偶姻,静态顶空气相色谱法是分析复杂基质中挥发物的灵敏方法。该设置构成为连接到具有火焰离子化检测器(fid)的气相色谱仪的静态顶空进样器。为此,使用了以下设备:
hs-自动进样器:hs40×i,turbomatrix110,perkinelmer
hs-软件:hscontrolv.2.00,perkinelmer
gc:autosystemxl,perkinelmer
gc-软件:turbochromnavigator,perkinelmer
柱:hp-ffap25mx0.20mmx0.33μιη,agilenttechnologies
使用已知浓度的标准品确定响应因子(校准),使用对照来控制所用响应因子在分析系列内以及系列之间和一段时间(月)内稳定。使用来自标准品的响应因子测定样品和对照中的挥发物浓度(ppm)。通过将200μl4nh2so4添加到1g发酵酸奶油样品中来制备样品,并通过hsgc分析。
图10说明了对双乙酰产量的影响,图11说明了对乙偶姻产量的影响。图10表明,在发酵过程中添加鼠李糖乳杆菌chcc15871对产生的双乙酰的量有非常大的影响,尤其是在冷藏21天后,并且令人惊讶的是,与具有鼠李糖乳杆菌chcc12697的样品相比,该量显著更高。此外,如图11所示,与chcc12697相比,chcc15871还产生更高水平的乙偶姻。
产生后7天,将发酵的酸奶油制品升至13℃并手动搅拌(20次),直至样品均匀。在流变仪(具有asc(automaticsamplechanger,自动换样器)的antonpaarphysica流变仪,anton
保持时间(重建到某种原始结构)5分钟,不对样品施加任何物理应力(振荡或旋转)。
旋转步骤(测量3001/s的剪切应力)
设计了两个步骤:
1)剪切速率=[0.3-300]1/s和2)剪切速率=[275-0.3]1/s。
每个步骤都在210s内包含21个测量点(每10s)。
选择流动曲线峰值点(3001/s)处的剪切应力,用于进一步分析,因为该值已显示出与所感知的口腔厚重感良好相关。剪切应力(pa)表示为粘度(pa*s)*剪切速率(1/s)。
图12说明了流变结果。显然,添加鼠李糖乳杆菌菌株对以300剪切速率下的剪切应力表示的质地特性没有负面影响。与参照样品(sc1–sc5)相比,剪切应力未下降。
实施例5:鼠李糖乳杆菌chcc15871与不同鼠李糖乳杆菌菌株的双乙酰产量的比较
鼠李糖乳杆菌chcc15871菌株与七种不同鼠李糖乳杆菌菌株的双乙酰产量。
将降脂(1.5%w/v)均质乳在90±1℃下热处理20min,然后立即冷却。以0.02%(v/w)接种商业酸奶起子培养物(f-dvsyoflexmild2.0),并将接种的乳分配到200ml瓶中。用总浓度为1x107cfu/g的鼠李糖乳杆菌菌株(chcc15871、chcc12483、菌株1、菌株2、菌株3、菌株4、菌株5和菌株6)接种8瓶,每瓶一种菌株。一瓶用作参照,仅接种了起子培养物。将所有瓶在43±1℃的水浴中孵育,并在这些条件下发酵,直至达到4.55±0.1的ph。发酵后,将瓶剧烈振荡以破坏凝聚物,并在冰上冷却。冷却后,将样品存储在7±1℃下。
在第14天,通过静态顶空气相色谱法(hsgc)分析样品的双乙酰,静态顶空气相色谱法是用于分析复杂基质中挥发物的灵敏方法。该设置构成为连接到具有火焰离子化检测器(fid)的气相色谱仪的静态顶空进样器。为此,使用了以下设备:
hs-自动进样器:hs40×i,turbomatrix110,perkinelmer
hs-软件:hscontrolv.2.00,perkinelmer
gc:autosystemxl,perkinelmer
gc-软件:turbochromnavigator,perkinelmer
柱:hp-ffap25mx0.20mmx0.33μιη,agilenttechnologies
使用已知浓度的标准品确定响应因子(校准),使用对照来控制所用响应因子在分析系列内以及系列之间和一段时间(月)内稳定。使用来自标准品的响应因子测定样品和对照中的挥发物浓度(ppm)。通过将200μl4nh2so4添加到1g酸奶样品中来制备样品,并立即通过hsgc分析。
图13说明了对双乙酰产量的影响,表明在发酵过程中添加七种不同的鼠李糖乳杆菌菌株在储存14天后会导致样品中存在不同水平的双乙酰。观测到水平在6.3ppm和20ppm之间变化。相比之下,chcc15871产生的双乙酰量最高。
保藏和专家解决方案
申请人要求,在授予专利之日之前,只能向专家提供下文所述的保藏的微生物样品。
鼠李糖乳杆菌菌株chcc15871于2017年10月17日保藏在布伦瑞克因霍芬街7b,d-38124(d-38124braunschweiginhoffenstr.7b)的德国微生物保藏中心(deutschesammlungvonmikroorganismenundzellkulturengmbh;dsmz),保藏编号为:dsm32666。
鼠李糖乳杆菌菌株chcc15860于2015年07月16日保藏在布伦瑞克因霍芬街7b,d-38124的德国微生物保藏中心,保藏编号为:dsm32092.
鼠李糖乳杆菌菌株chcc12697于2011年03月01日保藏在布伦瑞克因霍芬街7b,d-38124的德国微生物保藏中心,保藏编号为:dsm24616。
离生青霉菌株chcc16948于2015年07月16日保藏在布伦瑞克因霍芬街7b,d-38124的德国微生物保藏中心,保藏编号为:dsm32093。
短密青霉菌株chcc16935于2015年07月16日保藏在布伦瑞克因霍芬街7b,d-38124的德国微生物保藏中心,保藏编号为:dsm32094。
这些保藏是根据有关用于专利程序的国际承认的微生物保藏的布达佩斯条约进行的。
参考文献
jyoti,b.d.,suresh,a.k.,andvenkatesh,k.v.(2003):diacetylproductionandgrowthoflactobacillusrhamnosusonmultiplesubstrates.worldjournalofmicrobiology&biotechnology19:509-514.
pct/ro/134表
- 还没有人留言评论。精彩留言会获得点赞!
- 一种再生纤维素纤维改性鼠李糖脂乳化沥青的制备方法与流程
- 一种玻璃纤维改性鼠李糖脂乳化沥青的制备方法与流程
- 一种秸秆纤维改性鼠李糖脂乳化沥青的制备方法与流程
- 一种乙基多杀菌素的化学合成方法与制造工艺
- 鼠李糖乳杆菌促进生态失调后肠道菌群多样性恢复的应用的制造方法与工艺
- 涉及具有牛乳蛋白过敏症的受试者的营养组合物的制造方法与工艺
- 改善的制备4‑(1‑(4‑(全氟乙氧基)苯基)‑1H‑1,2,4‑三唑‑3‑基)苯甲酰叠氮的方法与制造工艺
- 一种鼠李糖乳杆菌胞外多糖的制备及用途的制造方法与工艺
- 生产鼠李糖脂的方法与制造工艺
- 与多糖聚合物粘合剂缀合的鼠李糖乳杆菌RHT‑3201,及其用于预防或治疗特应性疾病的用途的制造方法与工艺