通过错流过滤进行的液体介质交换在制备药物混悬液中的用途的制作方法与工艺
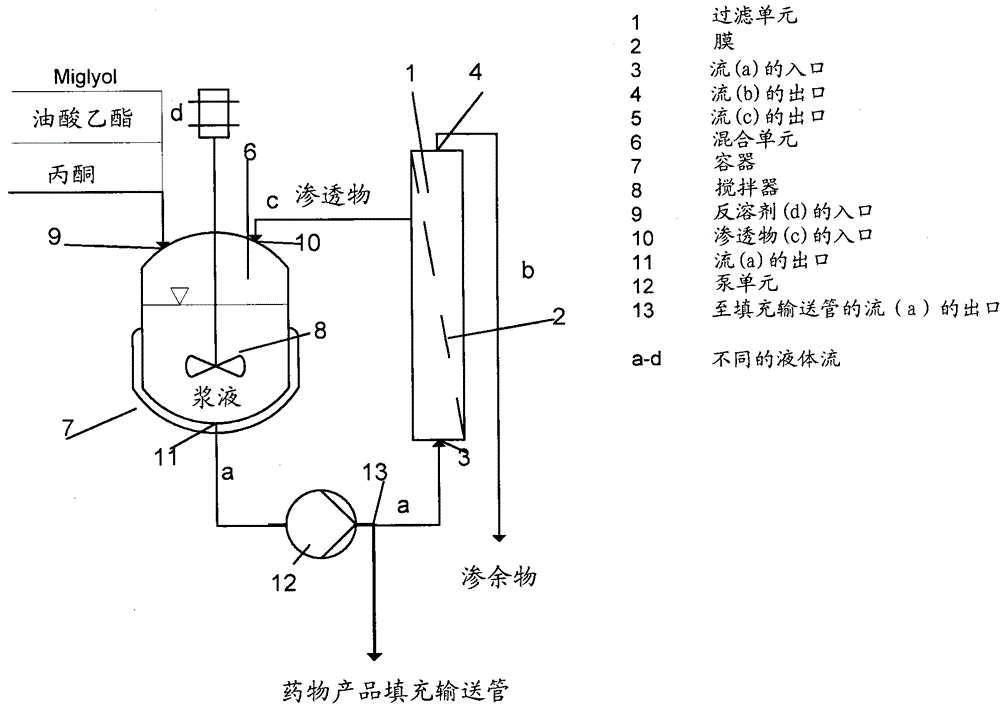
通过错流过滤进行的液体介质交换在制备药物混悬液中的用途发明领域本发明涉及药物混悬液的制备。发明背景错流(cross-flow)过滤(也被称为渗滤)技术已经在全球范围内广泛用于工业中,其大量应用于处理水性原料流。当纯化水时,其与传统的蒸发方法相比成本效益很高。已经建议在药物生产中通过利用有机溶剂耐受膜的渗滤实现从一个有机合成步骤至下一个步骤的过程中发生的溶液中的非热溶剂交换(ShethJ.P.,etal,JournalofMembraneScience211(2003),251-261)。然而之前未描述过在药物合成的后处理过程中使用错流过滤技术进行药物混悬液之间的液体介质交换以获得颗粒形式的药物,或者在包含药物的药物产品的直接生产中使用错流过滤技术(其中可以省略首先分离颗粒的步骤)。在药物混悬液中,通常期望提供相对小粒径并且具有期望粒径分布的颗粒形式的药物,特别是晶体颗粒。药物颗粒最终配制成所述颗粒的混悬液形式的药物产品。期望粒径的形成以及在药学上可接受的液体介质中获得稳定混悬液的需求提出了几项技术性挑战。一是颗粒,特别是晶体颗粒的获得需要以可控方式从溶液或混悬液中沉淀。为此,例如在硫酸头胞喹肟(cefquinomesulfate)的情况下,将丙酮加入水或水与丙酮的混合物中,以促进沉淀。这导致溶剂(或者,更正确地,反溶剂(anti-solvent)丙酮)体积相对较高,使得商业上可行的批量生产转向不经济的方向。因此,期望提供一种能够在反溶剂体积大大减少的基础上获得期望粒径的颗粒,特别是晶体颗粒的方法。还期望提供一种方法,通过该方法颗粒聚结成较大的聚集性颗粒,以易于进行过滤步骤(如果颗粒应当被照这样分离)。此外,在现有的方法中,最终的药物产品是药学上可接受的液体介质例如油酸乙酯中的晶体颗粒混悬液,所述晶体颗粒在该方法的较早时期以期望的粒径产生。因此整个方法不仅需要控制颗粒沉淀,还需要进行分离、干燥、包装、运输和配制。期望能够在颗粒形成(即在混悬液中)与最终制剂的产生(也是混悬液)之间省去一个或多个步骤。发明概要为了更好地满足一个或多个前述的需求,在一个方面中,本发明提供了一种制备包含药物颗粒的组合物的方法,其中最初在第一液体介质中产生混悬液形式的药物,其中混悬液针对另一种液体介质发生错流过滤,所述另一种液体介质选自表现为药物的反溶剂的介质和能够使药物保持为混悬液的药学上可接受的介质。在另一个方面中,本发明提供了渗滤方法在颗粒,特别是药物的晶体颗粒(正如这种颗粒的聚集体,以易于进行过滤步骤)的生产中的用途。在又另一个方面中,本发明提供了通过加入药物的反溶剂从而从溶液或液体介质中的混悬液中分离药物颗粒的方法,其中反溶剂通过渗滤方式加入。在又一个方面中,本发明提供了制备药物制剂的方法,所述药物制剂包含药物在药学上可接受的液体介质中的混悬液,其中制剂由工艺液体介质(processingliquidmedium)中的晶体混悬液制备,并且其中所述药学上可接受的液体介质通过渗滤方式取代所述工艺液体介质。在又一个方面中,本发明涉及通过渗滤进行的液体介质交换在制备药物混悬液中的用途。附图简要说明图1显示本发明一个实施方案的示意体系,其中使用渗滤制备药物颗粒。图2显示本发明一个实施方案的示意体系,其中使用渗滤将颗粒制备步骤中获得的无菌药物混悬液直接转化为药物产品(在药学上可接受的液体介质中的混悬液制剂)。发明详述广义上来讲,本发明基于药物混悬液制备过程中使用渗滤作为液体介质交换方法的明智认知。根据本发明,该方法可以应用于药物合成的后处理过程中以获得颗粒形式的药物,或者应用于包含药物的药物产品的直接生产中,其中可以省略首先分离颗粒的步骤。药物混悬液是固体药物颗粒在液体介质中的均一分散体,其中药物是几乎不溶的。药物混悬液的示例是例如肌内和皮下施用的注射用抗菌剂混悬液、乳房内施用的抗菌剂混悬液、口服抗酸剂混悬液、口服抗菌剂混悬液、口服止痛剂混悬液、口服和皮下注射用驱虫剂混悬液、口服抗惊厥剂混悬液、口服抗真菌剂混悬液。本文中使用的术语“几乎不溶的”适用于在混悬介质中基本上完全不溶或者在这种介质中至少溶解性很差(溶解度小于大约10%)的药物。在一个实施方案中,药物混悬液是非水性混悬液,即液体介质是非水性的,例如油性的。任何几乎不溶的药物均可以有利地用于本发明的药物组合物中。在该方面中,应当领会的是,尽管说明书将于此处列出通常被认为几乎不溶的大量药物,许多药物(无论是否被认为是几乎不溶的)将具有事实上几乎不溶的形式(晶体形式、多晶型物等)。而且,将要领会的是,未来研发的、也被认为几乎不溶的药物也包含于本发明的范围内。尽管发明人已经证明本发明的方法对于头孢菌素抗生素例如头胞喹肟和头孢洛宁(cefalonium)具有特殊益处,但对于其它类型的药物也具有类似的益处,所述其它类型的药物例如其它抗生素、驱虫剂、抗高血压药、免疫抑制剂、抗炎剂、止痛剂、利尿剂、抗癫痫剂、降低胆固醇的药物、激素类降血糖药、抗病毒药物、鼾粘膜充血消除药、anti-arrthrytics、抗癌药物、抗寄生虫剂、蛋白、肽、CNS刺激剂、CNS镇静剂、5-HT抑制剂、抗精神分裂症药、抗阿尔茨海默病药、抗银屑病剂、甾体类、寡核苷酸、抗溃疡药、质子泵抑制剂、抗哮喘剂、血栓溶解剂和维生素。即使下面的描述将主要描述与头孢菌素抗生素药物有关的本发明的实施方案,将要领会的是,本发明并不限于此。所描述的附图仅仅是示意性并且是非限制性的。在附图中,出于说明性目的,某些部件的大小可能是夸大的,并未依比例绘制。当本发明的说明书和权利要求书中使用术语“包含”时,其不排除其它部件或步骤。在使用不定冠词或定冠词的情况下,当提及单名词时,例如“a”或“an”、“the”,这包括该名词的复数形式,除非另有其它特别声明。当颗粒产生的步骤将形成混悬液(具体地是无菌混悬液)时,混悬液的液体介质将不得不被反溶剂取代,以使颗粒沉淀(例如在硫酸头胞喹肟的情况下的丙酮)。一般这可以通过利用热单位操作(例如蒸馏或蒸发)的溶剂交换来实现。如果反溶剂在高于液体介质的温度下沸腾,这将易于操控。如果产物是温度敏感型的或者反溶剂在低于液体介质的温度下沸腾,则将出现问题。一种解决办法是将大量反溶剂加入液体介质中,以迫使晶体沉淀。该步骤以及所需相对大量的反溶剂,大大降低了能够产生的药物颗粒的批量大小。本发明的发明人已经发现了通过渗滤(错流过滤)加入反溶剂的方法。其优势之一是所需反溶剂的量大大减少,并且可以以期望的商业批量大小产生颗粒。因此,在一个实施方案中,本发明是制备包含药物颗粒的组合物的方法,其中最初在第一液体介质中产生混悬液形式的药物,其中混悬液针对另一种液体介质发生错流过滤,并且其中所述另一种液体介质选自表现为药物的反溶剂的介质。“反溶剂”是指产物在其中不溶的溶剂。反溶剂是已知的,并且当药物已给定时,选择适宜的反溶剂在本领域技术人员的平均能力范围内。在头胞喹肟或硫酸头胞喹肟或其它酸加成盐的情况下,适宜的反溶剂是丙酮或水和丙酮的混合物(其中丙酮是主要成分)。其它适宜的反溶剂在本领域技术人员的能力范围内。在实施本发明的渗滤时,在进行过程中可以根据需要改变另一种液体介质的组成,例如通过在利用水和丙酮的混合物作为反溶剂的情况下逐渐增加丙酮的量。在该实施方案中,包含药物颗粒的组合物实际上包含已分离(沉淀)的颗粒本身。一些混悬液包含非常小的药物颗粒,其不能通过常规的过滤方法分离,因为细小颗粒会堵塞过滤器并导致过滤时间延长。这些颗粒具有通常0.05-50μm范围的粒径。通过本发明的方法,可以利用适宜的反溶剂形成这些细小颗粒的聚结物。可以接着通过常规过滤方法将这种聚结物分离。优选过滤后可以例如通过简单搅动颗粒的混悬液或在超声作用下使细小颗粒的聚结被逆转。在一个优选的实施方案中,另一种液体介质选自能够使药物保持为混悬液的药学上可接受的介质。因此,在本实施方案中,本发明以不同方式进行上述的渗滤。优选的实施方案利用药物颗粒的混悬液的渗滤来加入药物产品的最终液体介质,即上述的药学上可接受的混悬液介质,例如油性液体,而不是利用现有方法中的技术(即在颗粒的分离步骤时加入)。在该实施方案中,包含药物颗粒的组合物是药物在药学上可接受的液体介质中的混悬液形式的药物组合物。这产生巨大优势,因为与分离药物颗粒相关的所有方法步骤均可以省略。因此,本发明的该实施方案使得能够进行由无菌晶体混悬液至最终药物产品混悬液的直接步骤,而无需包括分离、干燥、调整粒径(微粉化)、包装、运输和再配制成混悬液的步骤。这种药物的混悬液例如呈现为注射制剂,例如悬浮于油中,所述油例如油酸乙酯,或者为饱和的、椰子和棕榈仁油来源的辛酸和癸酸脂肪酸与甘油或丙二醇形成的酯类的形式(其以商标名Miglyol被知晓)。在一个实施方案中,药物是头孢菌素。头孢菌素是一类β-内酰胺类抗生素,其一般被认为是7-氨基头孢菌烷酸(7-aminocephalosporanicacid)的衍生物。很多头孢菌素是市售的。非专有名称一般以“cef(头孢)”(有时为ceph)起始。优选的头孢菌素包括头孢克定(cefclidine)、头孢吡肟(cefepime)、头孢瑞南(cefluprenam)、头孢噻利(cefoselis)、头孢唑兰(cefozopran)、头孢匹罗(cefpirome)、头孢噻夫(ceftiofur)、头孢匹林(cephapirin)、头孢噻肟(cefotaxime)、头孢羟氨(cefadroxil)、头孢氨苄(cephalexin)、cefovectin、头孢唑啉(cefazolin)、头孢噻吩(cephalothin)和头胞喹肟。更优选头孢菌素是头孢喹肟,最优选头胞喹肟酸加成盐。为了制备头胞喹肟的酸加成盐,将适宜的酸加入甜菜碱溶液中。这些酸可以是有机或无机酸、一元酸或二元酸,优选矿物酸。合适的酸包括例如HCl、HBr、HI、HF、H2NO3、HClO4、HSCN、脂肪族一元、二元或三元羧酸,例如乙酸、三氟乙酸、三氯乙酸,或优选的生理上可接受的酸,例如马来酸,以提供具有单马来酸根阴离子HOOCCH=CHCOO-的盐。另一种适宜的有机酸是萘甲酸。优选的头胞喹肟酸加成盐包括二盐酸头胞喹肟、二氢碘酸头胞喹肟、硫酸头胞喹肟、6-羟基萘甲酸头胞喹肟、萘甲酸头胞喹肟、2,4二羟基苯甲酸头胞喹肟。最优选的盐是硫酸头胞喹肟。头孢菌素一般呈现为在药学上可接受的液体介质中的混悬液,具体地是油基中的混悬液形式,所述油基是植物油或矿物油或其混合物,例如花生油、蓖麻油、油酸乙酯、液体石蜡、MCT油(参见下文)或(参见下文)。油基优选包含药学上可接受的低粘度油性介质,例如中链甘油三酯或中链甘油三酯的混合物。中链甘油三酯(MCT油)具有6-12个碳原子的脂肪酸链,并且对于医学精制级的MCT油,每条链具有8-10个碳原子。MCT油可以包含C8-C10脂肪酸的甘油三酯,或这些脂肪酸的丙二醇二酯,或甘油三酯和丙二醇二酯的混合物。优选这些C8-C10脂肪酸是完全饱和的,例如正辛酸和正癸酸。这些通过对天然存在的植物(例如椰子)油进行商业分馏以提供主要为C8-10的脂肪酸并随后用选择的醇使这些酸酯化而便利地制备。具有期望组成的分馏的植物油是市售的。这些油的专有示例是癸酸/辛酸甘油三酯和丙二醇二辛酯/癸酯最优选的是级812。取决于药物产品混悬液中使用的药学上可接受的液体介质和其中产生药物晶体混悬液的液体介质,这些液体介质可以或可以不与彼此足够地混溶以进行渗滤。“混溶”是指液体介质以所有比例混合,形成均质溶液。在后一种情况下,优选用中间(第二)液体介质,即与第一液体介质(其中产生晶体的)和另一种液体介质(药物产品中的药学上可接受的液体介质)混溶的液体介质,进行额外的渗滤。在下表中,对所使用的若干示例性液体给出了指导。可能的液体不限于本文中提及的那些,并且本领域技术人员将能够容易地确定液体是否是混溶的,以决定是否能够直接进行渗滤或者通过中间液体进行渗滤。表格各种液体的混溶性在本发明中,药物混悬液针对另一种液体介质发生错流过滤,所述另一种液体介质选自表现为药物的反溶剂的介质和能够使药物保持为混悬液的药学上可接受的介质。将理解的是,药学上可接受的液体介质一般不是药物的溶剂,因为其保持为药物的混悬液形式。鉴于利用中间液体介质的以上实施方案,还将理解的是,本发明包含最初所获得的混悬液中的液体介质与最终药学上可接受的液体介质之间的间接交换。错流过滤(也被称为渗滤)是已知的技术,通常用于完全不同的目的。通常的用途包括水-水处理、产生纯净水或纯化盐水。药学工业中的一种通常用途是用于发酵浆液的富集。卫生保健领域中的另一种通常用途是熟知的人血透析。如“过滤和分离词典”(“DictionaryofFiltrationandSeparation”)中所述,渗滤是基于膜的分离,其用于从工艺液体或分散体中减少、去除或交换盐和其它小分子污染物。该方法基本上包括在一侧使原料流穿过膜过滤器,并在另一侧以相反方向使澄清液体穿过膜过滤器。对于含有高比例小粒径的固体的原料(在这里渗透物是最有价值的)通常选择这种过滤类型,因为使用死端(dead-end)过滤,固体材料能够快速堵塞(遮蔽)过滤器表面。在批量渗滤中,通常用“澄清”液体将工艺流体稀释2倍,通过渗滤回到初始浓度,并重复整个过程数次,以达到所需的污染浓度。在连续性渗滤中,“澄清”液体以与渗透物流相同的速率加入。错流过滤是指大部分原料流切向穿过过滤器表面而非进入过滤器内的事实。其原理优势是滤饼(其能够遮蔽过滤器)在过滤过程中基本上被清洗掉,增加了过滤单元可运行的时间长度。与分批式死端过滤不同,其可以是连续的过程。本发明使用渗滤技术的方式与其常规用途在几个方面有所不同。在一个方面中,本发明中该技术用于使固体(即药物颗粒)沉淀,在传统过滤中这意味着使它们保持为渗余物。在另一个方面中,该技术用于将药物颗粒从一种混悬液转移至另一种,这与渗滤的一般(过滤类型)用途完全不能相比。在本发明的渗滤过程中,过滤器将优选是陶瓷膜。这种过滤器是已知的,其由例如硅、氮化硅、氮氧化硅、碳化硅、硅化物、铝土、氧化锆、氧化镁、氧化铬、氧化钛、氮氧化钛、氮化钛、钇钡铜氧化物制成,或者作为复合膜,由位于无机(例如陶瓷或沸石(zeolithe))表面层上的基于聚乙烯醇、聚酰亚胺、聚丙烯酰胺、聚硅氧烷、聚二甲基硅氧烷、乙烯-丙烯-二烯三元共聚物(ethylene-propylenediene)、聚降冰片烯、聚辛烯(polyoctenamer)、聚氨酯、丁二烯、丁腈橡胶、聚乙烯、聚丙烯、聚偏二氟乙烯、其衍生物和混合物的聚合物膜制成。过滤器膜可以具有多种形状,例如圆盘型或空心管型。将理解的是,膜具有孔,所述孔给技术人员提供孔径的选择。本发明的下限是直径为1nm。上限是10μm。渗滤过程可以在本领域已知的仪器中进行。通常,仪器将包括过滤单元(1),其包含管状或盘状渗滤膜(2)、要进行渗滤的液体流(a)的入口(3)、渗余物流(b)的出口(4)和渗透物流(c)的出口(5);所述过滤单元包含具有混合单元(6)的流体联接(fluidconnections)(上面的流a和c),所述混合单元包含配有搅拌器(8)的容器(7)、附图中指示为丙酮的反溶剂流(d)的入口(9)、渗透物流(c)的入口(10)和液体流(a)即混悬液(从容器(7)至过滤器单元(1),由泵单元(12)驱动)的出口(11)。在图1中,示出了用于产生头胞喹肟(或其它药物)晶体颗粒的仪器,其中使用丙酮作为反溶剂流(d),且其包括使得液体流(a)被引至分离单元(未显示)以获得固体颗粒或者引至过滤单元(1)以进行进一步渗滤的阀(13)。在图2中,示出了用于产生头胞喹肟(或其它药物)药物产品(混悬液)的上述仪器,其中使用所选载液(carrierliquid)作为反溶剂流(d),并且其中阀(13)使得液体流(a)被引至药物产品填充输送管(未显示)或引至过滤单元(1)以进行进一步渗滤。当制备作为药物产品的混悬液时,该方法的明智选择产生特别令人愉悦的优势。因此本发明在一个方面中还涉及渗滤方法在药物颗粒生产中的用途。该方法提供这些优势的原因尤其是生产作为药物产品的混悬液需要调节粒径的步骤,并且需要在药学上可接受的液体中将药物产品配制成混悬液的步骤。前一个步骤一般需要使用药学上不可接受的液体,例如丙酮。根据本发明的渗滤方法的使用提出了一种更为经济的方法,其中中间方法步骤中无菌性丧失的风险低于其中药物颗粒首先需要被分离并接着再配制的经典方法。在该方面中,在又一个实施方案中,本发明还涉及通过渗滤进行的液体介质交换在制备药物混悬液中的用途。在另一个方面中,本发明涉及一种制备药物制剂的方法,所述药物制剂包含药物在药学上可接受的液体介质中的混悬液,其中制剂由工艺液体介质中的晶体混悬液制备,并且其中所述药学上可接受的液体介质通过渗滤方式取代所述工艺液体介质。在又另一个实施方案中,本发明还涉及通过加入药物的反溶剂从而从溶液或液体介质中的混悬液(具体地是无菌混悬液)中分离药物颗粒的方法,其中反溶剂通过渗滤方式加入。将现有的渗滤技术转用到完全不同的药物颗粒制备领域的明智洞察力带来特别的优势。特别是由于反溶剂一般不是药学上可接受的液体,期望使用尽可能少的量。此外,在生产肠胃外施用的药物(尤其是晶体药物)颗粒混悬液的情况下,保持无菌是很重要的。这意味着反溶剂也需要是无菌的,并且需要在无菌仪器区使用。当需要使用相对大量的反溶剂时,这增加了技术复杂性和成本。综上所述,本发明提供了制备药物颗粒的方法,其中使用渗滤方法。渗滤可以使用反溶剂,在这种情况下获得的是颗粒本身的沉淀物。渗滤还可以使用药学上可接受的混悬液介质。在那种情况下,可以避免进行颗粒的分离、干燥、运输几个方法步骤,因为由颗粒合成产生的混悬液被直接转化为最终的药物产品制剂。通过参考以下非限制性实施例和所附附图,对本发明进行进一步阐述。实施例实验的通用体系渗滤试验基于硫酸头胞喹肟混悬液进行,其具有在比例为2∶1的丙酮和水的混合物中的7.5-8%硫酸头胞喹肟的含量,如PCT/EP2010/060376中所描述。将混悬液置于夹套式且可搅拌的贮液池中。通过打开泵上的开关,将环路启动。通过冷却夹套式容器可以控制期望的温度。根据阀的位置,将渗透物再循环至贮液池中或在浓缩步骤和渗滤步骤期间被弃去。将混悬液浓缩至期望值(一般至初始浓度的三分之二或一半)。其后以与渗透物离开环路相同的速率加入丙酮,使得体积保持恒定。所加入丙酮的量决定渗滤因子(diafiltrationfactor)D(一般D=2.2)且最终决定最终混悬液中的残留水含量。渗滤结束后,将混悬液过滤并干燥。在改变悬浮剂(反溶剂)的情况下,将丙酮混悬液用合适的试剂(反溶剂)进行渗滤,产生相应的stem混悬液。实施例1本研究在孔隙率为150kD的陶瓷膜上进行。将0.7L的晶体混悬液浓缩至0.35L,接着用0.8L纯丙酮在稳定体积下进行渗滤。在该方法步骤期间,水含量降至7.5%。在压力过滤器上利用过滤性测试检验渗滤的成功。因此,用丙酮将一部分原始混悬液稀释至29∶1v∶v的丙酮/∶水比率,并进行过滤。该滤过物是混浊的,观察到滤过时间是1.4min/g固体。还对已渗滤的混悬液进行过滤,观察到了澄清的滤过物以及0.6min/g固体的滤过时间。分析结果最终滤过物的水含量:7.5%(通过密度测定)渗滤后分离晶体所需的特定滤过时间:0.6min/g稀释至29∶1v∶v的丙酮/水后分离晶体所需的特定滤过时间:1.4min/g实施例2实施例2依照实施例1进行,其中渗滤因子D=1.5,使得最终混悬液中的水含量为10%,过滤速率为1.3min/g。实施例3实施例3依照实施例1进行,其中渗滤因子D=2.2,使得最终混悬液中的水含量为5%,过滤速率为0.2min/g。实施例4实施例4依照实施例1进行,其中渗滤因子D=3.0,使得最终混悬液中的水含量为2%,过滤速率为0.1min/g。实施例5:扩大规模实施例5依照实施例1进行,其中体积为5L,使用表面为0.2m2的膜,规模为实验室规模的10倍,且采用的渗滤因子D=2.5,使得最终混悬液中的水含量为2%,过滤速率为0.1min/g。由于每混悬液体积的特定表面积加倍,浓缩和渗滤所需的时间是适宜实验的一半时间。未检测到扩大规模的效果。实施例6实施例6依照实施例5进行,其中渗滤因子D=2.5,使得最终混悬液中的水含量为2.3%,过滤速率为0.1min/g,但是使用50kD的陶瓷膜。实施例7实施例7依照实施例1进行,其中利用孔隙率为60nm的陶瓷盘和适宜的设备。用25L丙酮对6.1L晶体混悬液进行渗滤,使得水含量的计算值低于1%。利用<0.1min/g的过滤速率对最终混悬液进行过滤。实施例8将二水合头孢洛宁混悬于丙酮∶水2∶1中,产生与水关联的10%二水合头孢洛宁混悬液。利用与如实施例7中所描述的相同过滤仪器进行渗滤方法。用23L丙酮对4.7L混悬液进行渗滤,使得水含量<1%。将最终混悬液浓缩至4L的体积,并利用<0.1min/g的过滤速率进行过滤。制剂混悬液的溶剂变化实施例9:用于本实验的初始混悬液具有在比率为2∶1的丙酮和水的混合物中的7.5-8%的硫酸头胞喹肟的含量。本试验按如下进行:1.在20℃下以X=1.6对初始混悬液进行浓缩,2.在20℃下用丙酮以D=2.5进行渗滤(残留水含量少于3%),3.在30℃下用油酸乙酯以D=5.3进行渗滤(残留丙酮含量少于1%)膜类型:孔隙率150kD;面积220cm2所得油酸乙酯混悬液具有<0.2%的丙酮含量,<0.4%的水含量和8.6%的硫酸头胞喹肟含量。实施例10:用油酸乙酯进行渗滤,以液体石蜡作为溶解加速剂(solutizingagents)实施例8依照实施例7进行,其中在30℃下用油酸乙酯以D=2.0进行渗滤,随后在30℃下用液体石蜡以D=5.0进行渗滤,得到残留丙酮含量的计算值<0.15%和残留油酸乙酯含量的计算值<1%的石蜡混悬液。实施例11用进行渗滤,以液体石蜡作为溶解加速剂实施例9依照实施例7进行,其中在30℃下用以D=5.0进行渗滤,得到丙酮含量的计算值<1%的混悬液。接着用丙酮对混悬液进行稀释以使丙酮含量为20%(D=2),随后在30℃下用液体石蜡以D=5.0进行渗滤,得到残留丙酮含量的计算值<0.15%和残留含量的计算值<1%的石蜡混悬液。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1