猪瘟E2亚单位疫苗及其应用的制作方法
本发明属于生物技术领域,涉及一种猪瘟E2亚单位疫苗及其制备方法。
背景技术:
猪瘟(Classical Swine Fever,CSF),是由猪瘟病毒(Classical Swine Fever Virus,CSFV)引起的一种高度接触性传染病,猪是该病毒唯一的自然宿主。近百余年来其流行遍及全球。国际兽疫局将其定为A类传染病,是目前危害我国养猪业发展的主要疫病之一。疫苗接种是发展中国家防控猪瘟的主要措施。目前应用最广泛的主要为猪瘟弱毒疫苗,包括中国猪瘟兔化弱毒疫苗(C株)、日本GPE-疫苗和法国的Thiverval疫苗。但是,近年来猪瘟疫苗质量难以保证(主要是滴度不够和污染BVDV),常常造成免疫失败。
杆状病毒表达系统作为一个新的研究领域迅速发展。大量的外源基因通过杆状病毒表达载体系统获得了成功表达。杆状病毒的特征是通常包含在包涵体(也成为多角体)的杆状病毒颗粒。许多蛋白已经在编码该蛋白质的重组杆状病毒感染的昆虫细胞中表达。杆状病毒表达系统提供了生产重组蛋白质的有力工具。昆虫细胞的无血清培养技术已经十分成熟,昆虫细胞的微载体培养技术和悬浮培养技术为大规模制备重组蛋白质提供了条件。我国每年因猪瘟病毒的爆发给我国养猪业带来了巨大的经济损失,利用杆状病毒表达系统在昆虫细胞中大量表达重组猪瘟E2蛋白,研制出具有良好免疫效果的亚单位疫苗,对于猪瘟病毒病的防制具有重要的意义。
CN103908663A公开了一种新型猪瘟病毒E2重组杆状病毒灭活疫苗及其制备方法,具体公开了通过猪瘟病毒E2基因的合成、转移 载体的构建、转移载体与线性杆状病毒的重组、重组杆状病毒的分子生物学和免疫学鉴定、猪瘟病毒E2蛋白的表达、猪瘟病毒E2重组杆状病毒的灭活、猪瘟病毒E2蛋白与佐剂563VG乳化制成疫苗。其所制备的疫苗是利用表达的上清液去直接免疫动物,蛋白没有经过纯化,会有很多杂蛋白及培养基在里面,安全性和有效性大大降低。
张文杰等,2007,中国实验动物学报,15(1),猪瘟病毒E2基因在昆虫细胞/杆状病毒中的表达,公开了猪瘟病毒E2基因在昆虫细胞/杆状病毒中的表达,具体公开了:采用RT-PCR扩增CSFV E2基因,将PCR产物克隆到p-GEM-T-Easy载体,将该基因插入到pFast-BacHT A载体中,构建重组转坐载体后转化DH10Bac感受态细胞,获得重组Bacmid质粒后转染sf9昆虫细胞,传毒3代,对表达蛋白进行Western-blot及免疫组化鉴定,成功克隆CSFV E2基因,SDS-PAGE电泳结果显示表达E2蛋白相对分子质量约为43×103,Western-blot和免疫组化结果证实表达蛋白能够被CSFV标准阳性血清识别。
技术实现要素:
为解决上述问题,本发明的目的在于提供一种猪瘟E2基因工程亚单位疫苗、其制备方法和应用。
首先,本发明提供一种猪瘟E2基因工程亚单位疫苗,其含有抗原和佐剂,其特征在于,所述抗原为杆状病毒载体表达系统重组表达的猪瘟E2蛋白,其中,用于猪瘟E2蛋白的核酸序列如SEQ ID No.2所示。
其中,所述的E2基因为人工合成,包括:GP67信号肽核酸序列(129bp)、猪瘟病毒E2基因部分序列(1011bp)、6His标签序列(18bp)以及片段5’端的EcoR I酶切位点(6bp)和片段3’端的Xho I酶切位点(6bp)。
其中,所述佐剂为201R VG水包油包水型矿物油佐剂。
本发明所述的亚单位疫苗,其中,每头动物E2蛋白的用量为40-70μg。
本发明还提供猪瘟E2基因工程亚单位疫苗的制备方法,包括如下步骤:
1)昆虫细胞内密码子偏好性,进行猪瘟病毒E2基因的优化,在5′端引入GP67信号肽核苷酸序列,优化后的序列如SEQ ID No.1所示;
2)构建含有步骤1)猪瘟E2基因的转移载体,转化入含有穿梭载体的大肠杆菌感受态细胞中,获得包含猪瘟E2基因的穿梭载体,再将该穿梭载体转染入昆虫细胞中,获得重组杆状病毒;
3)重组杆状病毒感染昆虫细胞及昆虫细胞的培养;
4)昆虫细胞中表达猪瘟E2重组蛋白,收获和纯化猪瘟E2蛋白;
5)利用猪瘟E2重组蛋白,辅以佐剂,经乳化,制备猪瘟E2亚单位疫苗。
其中,将佐剂与抗原按质量比1:1混合,在200-400rpm条件下,将抗原与佐剂均质,时间为2-10min,制备猪瘟E2亚单位疫苗。
本发明还提供所述的猪瘟E2基因工程亚单位疫苗在制备防治猪瘟病毒感染引起的疾病的药物中的用途。
本发明猪瘟E2蛋白为经过His纯化后的蛋白,有效地减少了杂蛋白引起的副反应;本发明猪瘟E2蛋白有效抗原量稳定,能够定量,生产中不同批次间容易确定有效抗原的剂量。
应用本发明的技术方案制备的猪瘟E2亚单位疫苗抗原纯度高、安全性好,免疫原性强,且对猪没有致病性,为今后猪瘟病毒的净化提供物质保障。
附图说明
图1为目的基因与载体构建示意图
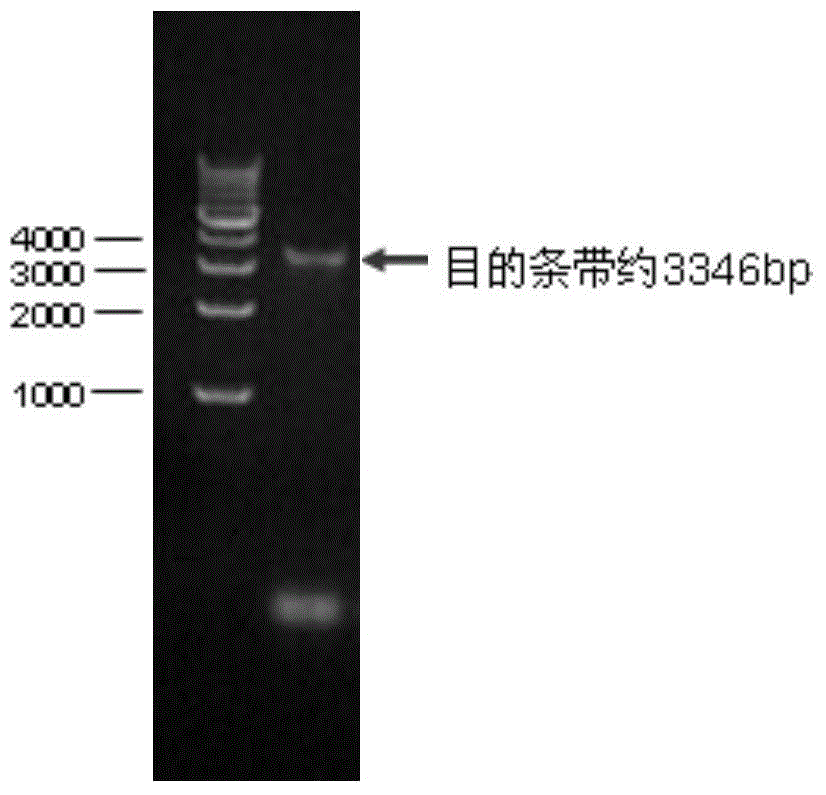
图2为猪瘟病毒E2重组杆状病毒E2基因的PCR鉴定图;
图3为重组杆状病毒vBac-CSFV-E2在sf9细胞和Hi5细胞表达的western-blot结果;如图所示:证明了重组杆状病毒vBac-CSFV-E2在Hi5细胞中的表达量明显高于sf9细胞。
图4为猪瘟病毒E2蛋白的表达及免疫原性及表达的时效性western blot图。如图所示:1:蛋白Marker;2、3、4、5、6、7分别为培养24h、36h、48h、60h、72h和96h后E2蛋白;证明了E2蛋白48h表达量最高。
图5为猪瘟病毒E2蛋白Histrap镍柱纯化结果图。
图6为免疫小鼠血清猪瘟病毒ELISA抗体检测。如图所示:证明猪瘟病毒E2重组亚单位疫苗组抗体水平明显高于猪瘟E2重组蛋白昆虫细胞的上清液组。
图7为免疫血清猪瘟病毒阻断ELISA抗体检测。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1猪瘟病毒E2蛋白制备
1)猪瘟病毒E2基因优化及合成
参考国内外经典毒株和流行毒株的E2基因,选择基因亚型2.1的猪瘟病毒(基因序列是Classical swine fever virus strain Zj0801,complete genome GenBank:FJ529205.1)按昆虫细胞内密码子偏嗜性进行猪瘟病毒E2基因的优化,交与公司合成,人工合成的基因包括:GP67信号肽核酸序列(129bp)、猪瘟病毒E2基因部分序列(1011bp)、6His标签序列(18bp)以及片段5’端的EcoR I酶切位点(6bp)和片段3’端的Xho I酶切位点(6bp)(见图1)(SEQ ID No.2所示)。
2)基因的克隆:
将人工合成的外源DNA片段经EcoRⅠ和XhoⅠ双酶切后连接到pFastBac1质粒,克隆质粒用核酸序列测定方法进行验证。酶切、连 接、转化等均为常规分子生物学方法。
3)将pFastBac CSFV E2转化含有穿梭质粒Bacmid的大肠杆菌DH10Bac(购自Invitrogen公司),获得重组质粒Bacmid-CSFV-E2;PCR筛选,提取阳性质粒,制备阳性重组质粒Bacmid-CSFV-E2DNA。采用II Reagent转染SF9细胞(购自Invitrogen公司),待细胞出现病变后,进行重组病毒噬斑纯化和病毒扩增,然后通过通用引物M13F和M13R进行PCR验证目的重组E2基因(见图2)。纯化获得重组杆状病毒,命名为vBac-CSFV-E2。扩增重组杆状病毒vBac-CSFV-E2作为种毒,通过噬斑法进行效价滴定后于4℃保存备用。
4)重组杆状病毒vBac-CSFV-E2分别感染sf9细胞和High Five细胞及培养,优化重组杆状病毒vBac-CSFV-E2在不同昆虫细胞中的表达水平。结果表明重组杆状病毒vBac-CSFV-E2在High Five细胞中的表达水平明显高于sf9细胞(见图3),sf9和High Five细胞都可用于表达,表达分泌性蛋白时用High Five更好。
5)vBac-CSFV-E2重组杆状病毒感染悬浮培养的昆虫细胞High Five
在含有400ml的培养基的1L的摇瓶中无菌悬浮培养High Five细胞,接种细胞密度为0.35~0.6×106个细胞/ml。当细胞密度达到1.8~2.5×106个细胞/ml时,用重组病毒vBac-CSFV-E2接种摇瓶,接种到各摇瓶中的重组杆状病毒的感染复数(MOI)建议为0.5-1.5,接种重组杆状病毒后,以27℃,转速为120rpm,分别于培养的24h、36h、48h、60h、72h和96h后取样,western blot验证猪瘟病毒E2蛋白的表达及免疫原性及表达的时效性(见图4)。结果表明48h猪瘟E2蛋白表达量最高,48h后将细胞液摇匀后倒入离心瓶中离心,以转速9000rpm离心1h,收取上清液即为猪瘟病毒E2蛋白液。
6)猪瘟E2基因工程亚单位疫苗制备用E2蛋白的纯化
收取蛋白:4℃,9000rpm离心1h,弃沉淀,上清用0.22μm滤膜抽滤,以去掉杂质防止堵塞Histrap。
Histrap镍柱:使用前先用去离子水把柱子中的NiSO4洗掉,再用20mM Tris,150mM NaCl,pH8.0平衡。抽滤好的蛋白上清用蠕动泵在冷库(4℃)过夜结合Histrap,计算好时间,并用Ep管测算好流速,切勿抽干。结合完蛋白上清后,把Histrap卸下,安装到AKTA上,流速2.5ml/min(AKTA先用20mM Tris,150mM NaCl,pH8.0洗泵,走平后UV值调零),用20mM Tris,150mM NaCl,pH8.0 Buffer洗杂蛋白,冲至UV值较平缓,再用20mM咪唑,20Mm Tris,150mM NaCl,pH8.0洗脱非特异性结合的杂蛋白,冲至UV值较平缓,最后用300mM咪唑,20mM Tris,150mM NaCl,pH8.0洗脱目的蛋白,冲至UV值较平缓(一般收集到200mAU为止)。取样跑蛋白胶(见图5)。目的蛋白收集浓缩到20mL左右,冷库中透析,用20mM Tris,150mM NaCl,pH8.0 Buffer透析,透析液体积应为蛋白体积20倍以上,4小时后换液一次。
实施例2猪瘟病毒E2蛋白亚单位疫苗制备
猪瘟病毒E2蛋白与201R乳化制成疫苗:佐剂的准备,201R佐剂(121℃、15pa、20min)进行灭菌,将蛋白抗原与佐剂1:1混合,以转速350rpm乳化5min,即制得猪瘟E2重组亚单位疫苗。
试验例1
用30只BALB/c 5-6周龄雌性小鼠,分为3组,每组10只,1组为猪瘟病毒E2重组亚单位疫苗组(12.5μg/头份),二组为猪瘟E2重组蛋白昆虫细胞的上清液组(12.5μg/头份)(按CN103908663A制备),3组为安慰剂组,分别在小鼠大腿内侧肌肉注射疫苗,注射时间是0d、21d,采血时间是0d、21d、35d。利用间接ELISA检测抗体滴度(见图6),结果表明猪瘟病毒E2重组亚单位疫苗的免疫效果明显高于猪瘟E2重组蛋白昆虫细胞的上清液的免疫效果。
本发明的猪瘟病毒E2重组亚单位疫苗的效力检验:用30头4~5周龄健康易感仔猪(猪瘟病毒抗原抗体均为阴性,免疫抑制性疾病(蓝耳病、圆环病毒病)抗原阴性猪),分为6组,每组5头,1-4组分别为猪瘟病毒E2重组亚单位疫苗不同剂量组50μg/头份、200μg/头份、500μg/头份、1000μg/头份,第5组免疫猪瘟脾淋苗,第6组作为对照组,在同等条件下隔离饲养,一免后21d以相同剂量与途径进行二免,二免后21d,所有猪颈部肌肉注射猪瘟石门系血毒1ml(106TCID50/ml)进行攻毒,之后每天监测猪只体温14d,接种猪瘟E2重组亚单位疫苗和猪瘟脾淋苗的5组试验猪体温未见升高,剖检后发现,扁桃体、喉头、淋巴结、肾脏、脾脏、回盲瓣均未见出血点和其他异常病理状况,对照组试验猪攻毒后,体温升高40℃以上,消瘦,腹泻,共济失调,攻毒后5d和12d分别死亡1只,剖检时扁桃体、喉头、淋巴结、肾脏、脾脏、回盲瓣均有出血点或出血斑,脾脏边缘梗死,淋巴结切面呈大理石样花纹,肾脏表面有大量出血点,呈现典型“麻雀肾”病理变化。应用阻断ELISA检测抗体滴度,结果见图7,结果表明猪瘟E2亚单位疫苗免疫猪在免疫后3w,猪瘟特异性中和抗体开始产生,加强免疫后抗体持续升高,并于加强免疫后3周达到峰值,一直持续到攻毒前,攻毒后抗体迅速升高,并一直持续到实验结束,而对照组安慰剂组免疫猪均未产生猪瘟特异性抗体。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!