带氨基酸链的蟾蜍二烯内酯类化合物在制备抗癌药物中的应用的制作方法
本文介绍了氨基酸链的有无对蟾皮化合物抗癌活性的影响和蟾蜍二烯内酯化合物馏分对结肠癌HT-29细胞和胃癌HGC-27细胞的生长抑制作用。本文所述的带氨基酸链的蟾蜍二烯内酯类化合物馏分包括带有氨基酸链的蟾蜍二烯内酯类馏分混合物以及利用高效液相色谱法分离的带有氨基酸链的蟾蜍二烯内酯1-11号馏分。
背景技术:
蟾皮是我国重要的中药资源,近年来,关于蟾蜍皮的抗癌活性研究的报道引起了广泛关注。蟾皮在治疗肝癌、胃癌、食道癌及结肠癌等癌症方面具有确切的疗效,而蟾蜍二烯内酯类化合物和极性含氮化合物被认为是蟾皮中最有效的药理成分。但是蟾皮组成数量庞大,成分复杂,甚至会引起某些过敏反应,若能借助于先进的活性筛选评价体系,筛选有确切抗肿瘤作用的成分,将有利于开发新的抗肿瘤药物。
对于抗癌药物的研究,大部分都是基于2D细胞的药物试验,虽然操作方法简单方便,但是准确性和再现性方面仍存在一些局限性。而与传统的2D细胞药物试验相比,3D细胞生长的活性更加良好,该模型的建立更加有效和稳定,能贴切地模拟体内实体肿瘤细胞间相互作用,特别是细胞间的黏附作用,这可以有效地评价抗癌药物对细胞的作用情况。在本发明中,我们采用了一种简单、
快速、可重复及标准化的3D细胞球形成技术,系统研究了蟾皮中蟾蜍二烯内酯类化合物馏分的抗结肠癌和胃癌活性。(Vinci M,Gowan S,Boxall F,et al.Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation[J].BMC biology,2012,10(1):29.)
目前关于本发明中提到的带有氨基酸链的蟾蜍二烯内酯类化合物馏分的抗结肠癌和胃癌活性尚未报道
技术实现要素:
本文介绍了氨基酸链的有无对蟾皮化合物抗癌活性的影响和带有氨基酸链的蟾蜍二烯内酯化合物对结肠癌HT-29细胞和胃癌HGC-27细胞的生长抑制作用,目的之一是提供具有抗结肠癌和胃癌作用的蟾蜍二烯内酯类化合物药物。外细胞实验表明,带有氨基酸链的蟾蜍二烯内酯化合物相较于不带氨基酸链的蟾蜍二烯内酯化合物对结肠癌和胃癌的生长抑制作用更显著,同时某些带有氨基酸链的蟾蜍二烯内酯馏分对结肠癌细胞球和胃癌细胞球都有明显抑制作用,因此可以用于制备治疗结肠癌和胃癌的药物。
本发明提供一种带氨基酸链的蟾蜍二烯内酯类化合物在制备抗癌药物中应 用。
所述的抗癌药物是以带有氨基酸链的蟾蜍二烯内酯类化合物馏分为活性成分制备而成。
所述的抗癌药物主要为抗结肠癌和/或胃癌的药物。
所述的抗癌药物中还包括药物学上可接受的载体或赋形剂。
所述带氨基酸链的蟾蜍二烯内酯类化合物包括带有氨基酸链的蟾蜍二烯内酯类化合物或化合物馏分的混合物或利用高效液相色谱法从蟾蜍皮中分离的带有氨基酸链的蟾蜍二烯内酯馏分。
所述带氨基酸链的蟾蜍二烯内酯类化合物为利用高效液相色谱法从蟾蜍皮中分离的带有氨基酸链的蟾蜍二烯内酯馏分,其分离过程为:
称取剪碎的蟾皮加入纯甲醇浸泡后回流提取,将提取液减压浓缩蒸干得总提取物;将总提取物用65-75%甲醇-水(V/V)溶解后,用正庚烷萃取,甲醇部分减压浓缩蒸干得样品;样品溶于乙醇通过Click XIon柱分段洗脱,第一段为纯乙醇洗脱的馏分,其为不带氨基酸的蟾蜍二烯内酯馏分,第二段为体积浓度45-55%乙醇洗脱的馏分,其为带氨基酸的蟾蜍二烯内酯馏分;
将带有氨基酸的蟾蜍二烯内酯馏分用体积浓度20-35%乙醇-水溶解过0.22μm的有机膜后透过膜的组分用XCharge C18的色谱柱进行分离,流动相为甲醇和水的体系,梯度洗脱条件为0~80~82~96~100~120min,对应甲醇体积浓度50%-70%-100%-100%-60%-60%甲醇,收集18.5~26.5min时间段内的馏分为3号样品,收集26.5~32.2min时间段内的馏分为4号样品,收集32.2~42.9min时间段内的馏分为5号样品,收集42.9~51.9min时间段内的馏分为6号样品,收集51.9~67.7min时间段内的馏分为7号样品,收集67.7~72.9min时间段内的馏分为8号样品,收集72.9~82.8min时间段内的馏分为9号样品,收集82.8~87.5min时间段内的馏分为10号样品;
其中所述3号样品、4号样品和5号样品、6号样品、7号样品、8号样品、9号和10号样品中的一种或二种以上具有抗癌活性可用于制备抗癌药物中。
所述带氨基酸链的蟾蜍二烯内酯类化合物为要强调的要保护的优选馏分为6、7和8号样品中的一种或二种以上具有抗癌活性可用于制备抗癌药物中。
附图说明
图1蟾皮提取物在Click XIon柱上分段的色谱分离图;
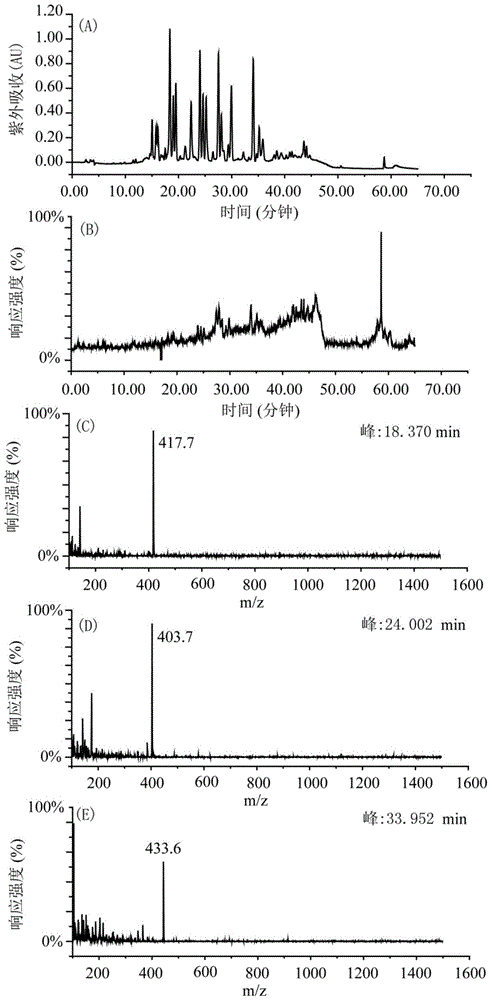
图2蟾皮提取物在Click XIon柱上分段得到的第一段馏分的紫外和质谱表征图谱;
图3蟾皮提取物在Click XIon柱上分段得到的第二段馏分的紫外和质谱表征图谱;
图4带有氨基酸的蟾蜍二烯内酯馏分在XCharge C18上的分离制备馏分图谱;
图5不同接种密度的HT-29细胞经3D培养形成的细胞球随着时间的增长曲线;
图6不同接种密度HGC-27细胞经3D培养形成的细胞球随着时间的增长曲线;
图7HT-29的3D细胞球经高低浓度不带氨基酸链蟾蜍二烯内酯(10μM/1μM)处理后随着时间的增长曲线;
图8HT-29的3D细胞球经高低浓度带有氨基酸链蟾蜍二烯内酯(10μM/1μM)处理后随着时间的增长曲线;
图9HGC-27的3D细胞球经高低浓度不带氨基酸链蟾蜍二烯内酯(10μM/1μM)处理后随着时间的增长曲线;
图10HGC-27的3D细胞球经高低浓度带有氨基酸链蟾蜍二烯内酯(10μM/1μM)处理后随着时间的增长曲线;
图11HT-29的3D细胞球经高浓度带有氨基酸链蟾蜍二烯内酯馏分1-11号(10μM)随时间的形态变化图;
图12HT-29的3D细胞球经低浓度带有氨基酸链蟾蜍二烯内酯馏分1-11号(1μM)随时间的形态变化图;
图13HGC-27的3D细胞球经高浓度带有氨基酸链蟾蜍二烯内酯馏分1-11号(10μM)随时间的形态变化图;
图14HGC-27的3D细胞球经低浓度带有氨基酸链蟾蜍二烯内酯馏分1-11号(1μM)随时间的形态变化图;
图15HGC-27的3D细胞球经不同浓度的6号、7号和8号样品处理后的剂量-效应曲线。
具体实施方式
现结合实例,对本发明做进一步说明。实例仅限于说明本发明,而非对本发明的限定。
实施例1:蟾皮馏分制备过程
中华大蟾蜍皮采自山东临沂,经中国中医科学院西苑中药研究室杨小平鉴定为正品。
称取剪碎的蟾皮200g,按料液比1:7,加入1.4L纯甲醇,浸泡两天,80℃微沸回流4h,过滤得滤液,滤渣再次加入1.4L纯甲醇,80℃微沸回流4h,过滤得滤液,共提取两次,将两次的提取液合并共得2730mL,60℃减压浓缩蒸干得7g总提取物。将总提取物用160mL 65-75%甲醇-水(V/V)溶解后,用160mL正庚烷萃取,甲醇部分再次用160mL正庚烷萃取,共萃取两次,然后甲醇部分60℃减压浓缩蒸干得4g样品,并溶于乙醇。通过Click XIon柱分段洗脱,第一段为纯乙醇洗脱的馏分(对应于不带氨基酸的蟾蜍二烯内酯馏分)(洗脱时间为20min),第二段为体积浓度45-55%乙醇洗脱的馏分(对应于带氨基酸的蟾蜍二烯内酯馏分)(洗脱时间为10min),分离色谱图见图1。通过C18HCE柱的分离,使用紫外检测器和质谱检测器分别对第一段馏分和第二段馏分进行表征,表征图分别见图2和图3。从图2中可以看出第一段馏分在特征吸收波长300nm下都有吸收,且通过不同时间点的质谱图(图2C-E)的分子量可以看出,第一段 馏分的分子量都在400左右,根据带有氨基酸的蟾蜍二烯内酯类化合物的分子量在700左右而不带有氨基酸的蟾蜍二烯内酯类化合物的分子量在400左右,可以推断出纯乙醇洗脱20min得到的馏分为不带氨基酸的蟾蜍二烯内酯馏分;从图3中可以看出第二段馏分在特征吸收波长300nm下都有吸收,且通过不同时间点的质谱图(图3C-E)的分子量可以看出,第二段馏分的分子量都在700左右,根据带有氨基酸的蟾蜍二烯内酯类化合物的分子量在700左右而不带有氨基酸的蟾蜍二烯内酯类化合物的分子量在400左右,可以推断50%乙醇洗脱10min得到的第二段馏分为带有氨基酸的蟾蜍二烯内酯馏分。
将带有氨基酸的蟾蜍二烯内酯馏分用体积浓度20-35%乙醇-水溶解至24.7mg/mL,过0.22μm的有机膜后透过膜的组分用XCharge C18的色谱柱进行分离,流动相为甲醇和水的体系,流速为60mL/min,检测波长为300nm,梯度洗脱条件为0~80~82~96~100~120min,对应体积浓度50%-70%-100%-100%-60%-60%甲醇。1-11号馏分对应的时间段分别为接取时间5.7~10.5min,10.5~18.5min,18.5~26.5min,26.5~32.2min,32.2~42.9min,42.9~51.9min,51.9~67.7min,67.7~72.9min,72.9~82.8min,82.8~87.5min和87.5~105min。具体的分离制备图见图4。
实施例2:3D细胞球筛选模型的建立
人结肠癌细胞HT-29和人胃癌细胞HGC-27购于中国科学院上海细胞库;ULA-96孔板购于Corning;蟾皮馏分为实施例1获得的1-11号馏分;倒置显微镜购于OLYMPUS。
将处于对数生长期的HT-29细胞和HGC-27细胞分别接种于ULA-96孔板中,使得每孔板中细胞数量分别为20K、10K、5K、2.5K、1.25K和0.625K,接种体积为200μL/well,HT-29细胞使用的培养基为McCOY's 5A含10%胎牛血清,HGC-27细胞使用的培养基为RPMI-1640含20%胎牛血清,每个细胞密度重复三次,每隔24h利用用倒置显微镜记录3D细胞球形态的显微照片,连续记录4天。其结果如图5和图6所示。根据3D细胞球连续4天生长的状态及第4天细胞球的大小,确定最佳的细胞密度。最佳的细胞密度一般为细胞球具有最快的生长速度并且在第4天时细胞球的直径大小落入范围300μm~500μm之中,因为在此范围内3D细胞球的状态更接近与体内肿瘤的状态,更有利于抗癌药物的筛选。根据图5和图6可以看出两种细胞系满足上述要求的最佳细胞密度都为1.25K/孔。
实施例3:研究氨基酸链的有无对蟾皮化合物抗癌活性的影响
将最佳密度(1.25K/孔)的HT-29和HGC-27细胞接种于ULA-96孔板,培养4天,HT-29细胞使用的培养基为McCOY's 5A含10%胎牛血清,HGC-27细胞使用的培养基为RPMI-1640含20%胎牛血清,生长至最佳粒径的3D细胞球之后,每孔置换100μL的新鲜培养基,分别加入通过Click XIon柱分段洗脱的带有氨基酸链的蟾蜍二烯内酯馏和不带氨基酸链的蟾蜍二烯内酯馏分样品,每个馏分的粗筛终浓度为10μM和1μM(馏分中化合物的平均分子量按500Da计算),每个馏分样品重复三次。每隔24h使用倒置显微镜记录3D细胞球的大小,连续 记录6天。其结果如图7-图10所示。与HT-29细胞相比,蟾蜍二烯内酯类馏分对HGC-27细胞的生长抑制作用更加明显。其中,带有氨基酸链的蟾蜍二烯内酯馏分较不带氨基酸链的蟾蜍二烯内酯馏分有更加优越的抗癌活性,甚至在低浓度的情况下也有抑制肿瘤细胞生长的作用。
带有氨基酸链的蟾蜍二烯内酯馏分比不带有氨基酸链的蟾蜍二烯内酯馏分具有更高的抗结肠癌和胃癌活性。
实施例4:粗筛实施例1带有氨基酸链的蟾蜍二烯内酯类馏分1-11号对3D细胞球生长的抑制作用
最佳密度(1.25K/孔)的HT-29和HGC-27细胞接种于ULA-96孔板,培养4天,HT-29细胞使用的培养基为McCOY's 5A含10%胎牛血清,HGC-27细胞使用的培养基为RPMI-1640含20%胎牛血清,生长至最佳粒径的3D细胞球之后,每孔置换100μL的新鲜培养基,分别加入1-11号样品,每个样品的粗筛终浓度为10μM和1μM(馏分中化合物的平均分子量按500Da计算),每个样品重复三次。每隔24h使用倒置显微镜记录3D细胞球的大小,连续记录6天。其结果如图11-图14所示。基于HT-29的3D细胞球模型,对于带有氨基酸链的蟾蜍二烯内酯馏分1-11号样品进行活性筛查,发现3号、5号、6号、7号、8号、9号、10号和11号样品对肿瘤细胞生长都有一定的影响,使肿瘤细胞形态发生明显变化。而基于HGC-27的3D细胞球模型,对于带有氨基酸链的蟾蜍二烯内酯馏分1-11号样品进行活性筛查,发现3号、4号、5号、6号、7号、8号和10号样品抗癌活性较其他样品更佳。在1μM浓度的情况下,这些馏分对肿瘤细胞的生长抑制作用也很明显。
实施例5:有强抗癌活性的馏分6号、7号和8号样品抑制3D细胞球生长的剂量关系
将对两种肿瘤细胞模型抑制能力最强的馏分6号、7号和8号样品的不同剂量作用于HGC-27的3D细胞球。将最佳密度(1.25K/孔)的HGC-27细胞接种于ULA-96孔板,培养4天,HT-29细胞使用的培养基为McCOY's 5A含10%胎牛血清,HGC-27细胞使用的培养基为RPMI-1640含20%胎牛血清,生长至最佳粒径的3D细胞球之后,每孔置换100μL的新鲜培养基,分别加入粗筛药物(6号、7号和8号样品)10μL,各样品的终浓度梯度分别为100μM、33.3μM、11.1μM、3.70μM、1.23μM、0.411μM和0.137μM,每个样品的每个浓度重复三次。每隔24h使用倒置显微镜记录3D细胞球的大小,连续记录6天,其结果如图15所示。据剂量-效应曲线,得到6号、7号和8号样品的IC50值分别为0.094±0.020μM、0.078±0.014μM、0.874±0.089μM。可见,6号、7号和8号样品对HGC-27的3D细胞球生长有明显抑制作用,具有较强的抗癌活性。
- 还没有人留言评论。精彩留言会获得点赞!