糖工程化的抗体药物缀合物的制作方法
相关申请
本申请要求申请日为2014年10月9日的美国临时专利申请no.62/061,989的优先权权益。上述申请的全部内容通过提述以其整体并入本文。
发明背景
使用特异性抗体治疗人和其他动物是一种对于治疗多种病况和病症非常有效的有力工具。然而,对更有效的靶向治疗,尤其是具有更高功效和更大治疗窗口的靶标特异性疗法的需求很大。这些靶标特异性治疗之一使用抗体-效应部分缀合物,其中靶向部分将特异性抗体引导至期望的治疗部位。在临床环境中,这些分子显示出比非靶向抗体更好的治疗指标——更高的功效和/或更低的毒性特征。然而,此类治疗剂的开发可能是具有挑战性的,因为包括抗体自身和连接稳定性在内的许多因素可以对疾病靶标(例如肿瘤)特异性具有显著影响,从而降低功效。具有高非特异性结合和低循环稳定性的抗体-效应部分缀合物会在到达靶位点之前通过正常组织清除。此外,具有高药物负载的重要亚群的抗体-效应部分缀合物可以产生聚集体,其会被巨噬细胞清除,导致较短的半衰期。因此,对于关键过程控制和改进以及防止诸如来自抗体的产物聚集和非特异性毒性的并发症的需求日益增加。
尽管根据当前方法生成的抗体-效应部分缀合物是有效的,但是由于所使用的缀合化学物质通常导致异质混合物,此类治疗剂的开发是有挑战性的。例如,效应部分与抗体赖氨酸残基的缀合是复杂的,因为可用于缀合的抗体中存在许多赖氨酸残基(~30)。由于缀合的效应部分与抗体比率(dar)的最佳数目要低得多以使抗体的功能损失最小化(例如约4:1),所以赖氨酸缀合通常产生非常异质性的特征。此外,许多赖氨酸位于cdr区的关键抗原结合位点,并且药物缀合可能导致抗体亲和力的降低。另一方面,虽然硫醇介导的缀合主要靶向涉及铰链二硫键的8个半胱氨酸,但是仍然难以预测和鉴定8种半胱氨酸中的4种在不同制备物中始终是缀合的。最近,游离半胱氨酸残基的基因工程已经能使得与基于硫醇的化学物质进行位点特异性缀合,但是这种连接通常表现出高度可变的稳定性,其中接头经历了与白蛋白和其它含硫醇的血清分子进行的交换反应。最后,用于处理先前开发的缀合方案中的抗体的氧化剂(如高碘酸盐氧化酶和半乳糖氧化酶)能引起结合多肽的过度氧化和外部氧化,降低缀合本身的效率和功效。
因此,在不使用氧化剂的情况下产生具有定义的缀合位点和稳定连接的抗体缀合物的位点特异性缀合策略对于保证效应部分缀合、同时将对抗体结构或功能的不利作用最小化是非常有用的。
发明概述
本发明提供制备效应部分缀合物(例如靶向部分缀合物)的方法。这些方法涉及将唾液酸衍生物并入结合多肽的聚糖中,以形成缀合有唾液酸衍生物的结合多肽,以及在随后的反应中将效应部分与缀合有唾液酸衍生物的结合蛋白反应,以生成缀合有效应部分的结合多肽。
在一个方面,本发明提供制备缀合有效应部分的结合多肽的方法,包括如下步骤:(a)将单磷酸胞苷-唾液酸(cmp-唾液酸)衍生物与结合多肽的聚糖反应,以形成缀合有唾液酸衍生物的结合多肽;和(b)将所述缀合有唾液酸衍生物的结合多肽与效应部分反应,以形成缀合有效应部分的结合多肽,其中形成亚胺键,并且其中所述结合多肽和缀合有唾液酸衍生物的结合多肽均不用氧化剂处理。
在一个实施方案中,缀合有唾液酸衍生物的结合多肽包含末端酮或醛部分。在另一个实施方案中,效应部分包含末端氨基氧基部分,或结合至包含氨基氧基衍生物的部分。在又一个实施方案中,效应部分选自图45和46中的那些。
在一个实施方案中,步骤(b)导致肟键的形成。在另一个实施方案中,效应部分包含末端肼。在一个具体实施方案中,步骤(b)导致腙连接基的形成。在又一个实施方案中,效应部分具有如下结构式的一项或多项:
在一个方面,本申请提供制备缀合有效应部分的结合多肽的方法,包括如下步骤:(a)将包含c5位置处的末端反应部分的cmp-唾液酸衍生物与结合多肽的聚糖反应,以形成缀合有唾液酸衍生物的结合多肽;和(b)用点击化学将所述缀合有唾液酸衍生物的结合多肽与效应部分反应,以形成缀合有效应部分的结合多肽。
在一个实施方案中,末端反应部分是叠氮化物,其中所述效应部分包含炔,或是结合至包含炔的部分,且其中步骤(b)形成位于或连接至所述唾液酸衍生物的c5位置处的三唑环。在另一个实施方案中,结合多肽和缀合有唾液酸衍生物的结合多肽均不用氧化剂处理。在另一个实施方案中,cmp-唾液酸衍生物具有选自如下的结构式:
在另一个实施方案中,效应部分包含或结合至环辛炔。在一个具体实施方案中,所述环辛炔是氮杂二苯并环辛炔。在另一个实施方案中,步骤(b)在室温进行。在另一个实施方案中,步骤(b)在不存在铜的条件下进行。
在一个方面,本发明提供制备缀合有效应部分的结合多肽的方法,包括如下步骤:(a)将cmp-唾液酸衍生物与结合多肽的聚糖反应,以形成缀合有唾液酸衍生物的结合多肽;和(b)将所述缀合有唾液酸衍生物的结合多肽与效应部分反应,以形成缀合有效应部分的结合多肽,其中形成硫醚键。
在一个实施方案中,结合多肽和缀合有唾液酸衍生物的结合多肽均不用氧化剂处理。在另一个实施方案中,所述唾液酸衍生物包含末端硫醇部分。在另一个实施方案中,效应部分包含马来酰亚胺部分。在另一个实施方案中,效应部分是双-甘露糖-6-磷酸六甘露糖马来酰亚胺、乳糖马来酰亚胺、或包含至少一个结构式如下的马来酰亚胺部分的任何其他组分:
在一个实施方案中,效应部分包含一种或多种蛋白质、核酸、脂质、糖类、或其组合。在另一个实施方案中,效应部分包含聚糖。在一个具体实施方案中,效应部分包含一种或多种糖蛋白、糖肽、或糖脂。
在另一个实施方案中,结合蛋白具有一个或多个天然或工程化糖基化位点。在又一个实施方案中,所述方法包括使用一种或多种糖基转移酶、一种或多种糖苷酶、或其组合来实现或修饰所述结合蛋白的糖基化。在另一个实施方案中,步骤(a)在与唾液酸转移酶反应中发生。在又一个实施方案中,所述唾液酸转移酶是哺乳动物唾液酸转移酶。在一个具体实施方案中,所述唾液酸转移酶是β-半乳糖苷α-2,6-唾液酸转移酶1。在一个实施方案中,效应部分结合至细胞。在又一个实施方案中,所述细胞选自免疫细胞、肝细胞、肿瘤细胞、血管细胞、上皮细胞、或间充质细胞。在另一个实施方案中,所述细胞选自b细胞、t细胞、树突细胞、自然杀伤(nk)细胞、巨噬细胞、肝细胞、肝窦内皮细胞、或肝癌细胞。
在一个实施方案中,效应部分结合至细胞上的甘露糖6磷酸受体。在又一个实施方案中,效应部分包含甘露糖6磷酸部分。在另一个实施方案中,效应部分结合至细胞上的siglec。在又一个实施方案中,所述siglec是唾液酸粘附素(siglec-1)、cd22(siglec-2)、cd33(siglec-3)、mag(siglec-4)、siglec-5、siglec-6、siglec-7、siglec-8、siglec-9、siglec-10、siglec-11、siglec-12、siglec-14、或siglec-15。在另一个实施方案中,效应部分结合至细胞上的c型凝集素受体、半乳凝素、或l型凝集素受体。在又一个实施方案中,效应部分结合至tdec-205、巨噬细胞甘露糖受体(mmr)、dectin-1、dectin-2、巨噬细胞诱导型c型凝集素(mincle)、树突细胞特异性icam3结合非整合素(dc-sign、cd209)、dcnk凝集素群受体-1(dngr-1)、langerin(cd207)、cd169、凝集蛋白聚糖(lectican)、无唾液酸糖蛋白受体(asgpr)、dcir、mgl、dc受体、胶原凝集素、选择素、nk细胞受体、多ctld内吞受体、reg组(vii型)凝集素、软骨凝集素(chondrolectin)、四连接素(tetranectin)、多囊蛋白(polycystin)、吸引素(attractin,atrn)、嗜酸性粒细胞主要碱性蛋白(embp)、dgcr2、血栓调节素、bimlec、seec、或cbcp/frem1/qbrick。
在一个实施方案中,效应部分是能够结合细胞上的asgpr的糖肽。在又一个实施方案中,效应部分是含有糖肽的三价galnac聚糖或含有糖肽的三价半乳糖。在一个具体实施方案中,效应部分由式v表示:
在另一个具体实施方案中,效应部分如式vi所示:
在一个实施方案中,结合多肽包含fc域。在另一个实施方案中,经修饰的聚糖在fc域的氨基酸位置297处经天冬氨酸残基n-连接至结合多肽,其根据eu编号。在另一个实施方案中,经修饰的聚糖在fc域的氨基酸位置298处经天冬氨酸残基n-连接至结合多肽,其根据eu编号。在又一个实施方案中,fc域是人的。
在另一个实施方案中,结合蛋白包含ch1域。在又一个实施方案中,经修饰的聚糖在ch1域的氨基酸位置114处经天冬氨酸残基n-连接至结合多肽,其根据kabat编号。
在一个具体实施方案中,结合多肽是抗体或免疫粘附素。
附图简述
图1是从糖或糖衍生物形成示例性cmp-唾液酸衍生物的示意图。
图2是示例性cmp-唾液酸衍生物的示意图。
图3是本发明的不同化学反应的系列图示(a-e),其中圆圈及与其相结合的反应部分代表缀合有唾液酸衍生物的结合多肽。星形代表靶向或效应部分。
图4显示了具有图2所示的唾液酸衍生物的根据图3中所示方法(a-c部分)的缀合有效应部分的结合多肽的实例。
图5显示了具有图2所示的唾液酸衍生物的根据图3d中所示方法的缀合有效应部分的结合多肽的实例。
图6是抗体药物缀合物的合成示意图,其中用肟连接基将毒素部分连接至抗体聚糖的氧化唾液酸残基。
图7是考马斯蓝染色凝胶,其显示糖基化突变体的表达与纯化。
图8显示了表面等离子体共振实验的结果,该实验用于评估αβtcrhebe1igg抗体突变体对重组人fcγriiia(v158&f158)的结合。
图9显示了表面等离子体共振实验的结果,该实验用于评估αβtcrhebe1igg抗体突变体对重组人fcγri的结合。
图10显示了在突变体抗αβtcr抗体存在下的tnfa、gm-csf、ifny和il10自pbmc的细胞因子释放概况(第2天)。
图11显示了在突变体抗αβtcr抗体存在下的il6、il4和il2自pbmc的细胞因子释放概况(第2天)。
图12显示了在突变体抗αβtcr抗体存在下的tnfa、gm-csf、ifny和il10的细胞因子释放概况(第4天)。
图13显示了在突变体抗αβtcr抗体存在下的il6、il4和il2自pbmc的细胞因子释放概况(第4天)。
图14显示了通过western印迹(a)和表面等离子体共振(b)研究2c3突变体的表达水平的实验结果。
图15显示了研究肽n-糖苷酶f(pngasef)处理前和处理后的2c3突变体糖基化的实验结果。
图16显示了研究分离自细胞培养物的2c3突变体上糖基化位点的sds-page实验结果。
图17显示了表面等离子体共振实验的结果,该实验用于评估经修饰的抗-cd52对重组人fcγriiia(v158)的结合。在fc域中包含s298n/y300s突变的抗-cd52用于评估所述经修饰的分子结合至cd52肽(a)、结合至fcγriiia(v158,b)、和对照结合至小鼠fcrn(c)的效应功能。
图18显示了表面等离子体共振实验的结果,该实验研究了2c3突变体的fc结合特性。
图19显示了表面等离子体共振实验的结果,该实验研究了经修饰的抗-cd52对fcγriiia(val158)(如上文所述)和fcγriiia(phe158)二者的结合。在fc域中包含s298n/y300s突变的抗-cd52抗体用于评估所述经修饰的分子结合至fcγriiia(val158,a)和fcγriiia(phe58,b)的效应功能。
图20显示了s298n/y300s突变体和wt2c3对照中的c1q结合的分析(a)以及确认孔的相等涂覆的elisa分析结果(b)。
图21显示了等离子体共振实验的结果,该实验测量了2c3突变体对cd-52肽741的结合动力学。
图22显示了等离子体共振实验的结果,该实验比较了wt抗-cd-522c3和a114n高糖基化突变体的抗原结合亲和力。
图23显示了用于确定2c3突变体的聚糖含量的等电聚焦和质谱分析电荷表征实验的结果(a-d)。
图24显示了浓度结果(a;octet)和等离子体共振实验结果(b),其比较了wt抗-cd522c3和突变体的抗原结合亲和力。
图25显示了sds-page实验结果,其证明抗-tem1a114n突变体的额外糖基化。
图26显示了a114n抗-her2突变体的sds-page和疏水性相互作用色谱分析的结果。
图27显示了sds-page实验的结果,其证明peg与2c3a114n突变体经氨基氧基连接的缀合。
图28显示了lc-ms的实验结果,该实验用于确定抗-tem1a114n高糖基化突变体的聚糖含量。
图29显示了lc-ms的实验结果,该实验用于确定野生型her2抗体及a114n抗-her2高糖基化突变体的聚糖含量。
图30显示了用于进行抗体的位点特异性缀合的替代方法,包括使用氧化剂(a-c)。
图31显示了示例性效应部分的合成:氨基氧基-cys-mc-vc-pabc-mmae和氨基氧基-cys-mc-vc-pabc-peg8-dol10。
图32显示了唾液酸化her2抗体的表征信息(a-c)。
图33显示了氧化唾液酸化抗her2抗体的表征信息(a-d)。
图34显示了糖缀合物的疏水性相互作用色谱,所述糖缀合物用具有两种不同氨基氧基基团的三种不同的唾液酸化抗体制备。
图35显示了具有ao-mmae的抗-her2a114糖基化突变体缀合物的hic色谱,所述ao-mmae用gam(+)化学方法制备。
图36显示了抗-her2糖缀合物和硫醇缀合物的体外效力的比较(a-d)。
图37显示了抗fapb11糖缀合物和硫醇缀合物的体外效力的比较。
图38显示了抗-her2糖缀合物和硫醇缀合物在her2+肿瘤细胞异种移植物模型中的体内效力的比较(a-d)。
图39显示了lc-ms实验的结果,该实验用于确定含有s298n/y300s突变的突变体抗αβtcr抗体的聚糖含量。
图40显示了圆二色性实验的结果,该实验用于确定野生型抗αβtcr抗体和含有s298n/y300s突变的突变体抗αβtcr抗体的相对热稳定性。
图41显示了用携带a114n高糖基化突变和ao-mmae的抗her抗体制备的adc的细胞增殖测定的结果。
图42是抗体药物缀合物的替代合成的示意图,其中靶向部分用肟连接基连接至抗体聚糖的氧化唾液酸残基。该替代合成利用氧化剂。
图43是显示将抗体位点特异性缀合至糖肽的替代方法的示意图,所述缀合根据本发明的方法经氨基氧基连接基进行。该替代合成利用氧化剂。
图44是示意图,其显示了将新聚糖(neoglycan)经天然fc聚糖中的唾液酸位点特异性缀合至抗体的替代方法。该替代合成利用氧化剂。
图45是一系列可用于缀合的示例性聚糖,包括氨基氧基乳糖和双m6p六甘露糖氨基氧基(对于氨基氧基缀合而言)。
图46是m-6-p六甘露糖马来酰亚胺的制备示意图。
图47显示了用兔多克隆抗体制备的man-6-p六甘露糖氨基氧基缀合物的sds-page和maldi-tof表征。
图48显示了表面等离子体共振的实验结果,该实验用于测定对照的和缀合有man-6-p六甘露糖的兔igg抗体对m6p受体的结合。
图49显示了缀合有man-6-p的兔igg抗体在hepg2和raw细胞中的摄取。
图50显示了对照、缀合有man-6-p的、和缀合有乳糖的抗体的表征,其通过sds-page和凝集素印迹进行。
图51显示了对照、缀合有man-6-p的、和缀合有乳糖的抗体的maldi-tof完整蛋白分析的结果。
图52显示了缀合至man-6-p六甘露糖马来酰亚胺(在铰链半胱氨酸处的硫醇缀合)的多克隆抗体的表征,其通过sds-page(还原的和非还原的)、凝集素印迹(还原的)、和m6p定量进行。
图53显示了缀合至乳糖马来酰亚胺(在铰链半胱氨酸处的硫醇缀合)的多克隆抗体的表征,其通过sds-page和半乳糖定量进行。
图54显示了缀合至man-6-p六甘露糖马来酰亚胺(在铰链半胱氨酸处的硫醇缀合)的单克隆抗体的表征,其通过sds-page(还原的和非还原的)和聚糖(m6p)定量进行。
图55显示了铰链半胱氨酸多克隆抗体缀合物的尺寸排阻色谱(sec)分析的结果。
图56显示了铰链半胱氨酸单克隆抗体缀合物的尺寸排阻色谱(sec)分析的结果。
图57显示了确定来自nnas、唾液酸化nnas、和去唾液酸化及半乳糖基化nnas抗体的唾液酸释放量的唾液酸酶滴定结果。
图58显示了lc-ms实验的结果,该实验用于确定nnas修饰的抗体和去唾液酸化及半乳糖基化nnas修饰的抗体的聚糖含量。
图59显示了lc-ms实验的结果,该实验用于确定nnas修饰的抗体和唾液酸化nnas修饰的抗体的聚糖含量。
图60显示了通过天然fc聚糖或铰链二硫化物结合至缀合有双m6p聚糖的多克隆和单克隆抗体的m6p受体在溶液中的表征。
图61显示了酶修饰的和缀合的nnas抗体的表征,所述表征通过sds-page(4-12%nupage;还原的和非还原的)和ecl凝集素印迹(还原的)进行。
图62显示了nnas抗体、二唾液酸化/半乳糖基化nnas抗体、和缀合的nnas抗体中的末端半乳糖定量的结果,其以摩尔半乳糖或摩尔糖肽/摩尔抗体计。
图63显示了经α-2,3-唾液酸转移酶修饰且用20mmnacl洗脱自qae纯化柱的半乳糖马来酰亚胺的测验。所得的洗脱液用maldi-tof和dionexhplc加以表征。
图64显示了缀合有唾液酸乳糖马来酰亚胺(硫醇反应)的兔抗体的表征,所述表征用sds-page(a)和dionexhplc(b;唾液酸定量)进行。
图65显示了用α-2,6-唾液酸转移酶唾液酸化且用qae-琼脂糖柱纯化的乳糖马来酰亚胺的表征。显示了用dionexhplc针对(a)乳糖标准;(b)α-2,6-唾液酸乳糖标准;(c)乳糖马来酰亚胺标准;和(d)α-2,6-唾液酸乳糖马来酰亚胺级分(洗脱自qae-琼脂糖柱)进行的分析。
图66显示了用maldi-tof进行的α-2,6-唾液酸乳糖马来酰亚胺的级分(洗脱自qae-琼脂糖柱)的表征。
图67显示了对照抗体、缀合有α-2,3-唾液酸乳糖聚糖的多克隆抗体、和缀合有α-2,6-唾液酸乳糖聚糖的多克隆抗体的表征,所述表征通过sds-page(a)和dionexhplc(b;显示了唾液酸分析的图表)进行。
图68显示了对照的和酶修饰(双唾液酸化/半乳糖基化)的nnas突变体抗体的表征,所述表征通过sds-page和凝集素印迹进行。
图69显示了用多种量的半乳糖氧化酶通过还原性sds-page对对照抗体和galnnas的聚乙二醇化的表征。
图70显示了来自proteinsimple扫描的结果,其表征抗体重链的聚乙二醇化。
图71显示了用相对于抗体的多种peg摩尔过量(molarexcess)、通过还原性sds-page对对照抗体和galnnas的聚乙二醇化的表征。
图72显示了来自proteinsimple扫描的结果,其表征抗体重链的聚乙二醇化。
图73是乳糖3-cys3gly4的结构图。
图74显示了在不存在乙酸铜(a)和存在各种量的乙酸铜(a和b)的情况下,用半乳糖氧化酶通过还原性sds-page对对照抗体和galnnas的聚乙二醇化的表征。
图75是酶修饰的和缀合的野生型、a114n、nnas、和a114n/nnas抗体的表征,所述表征通过sds-page(4-12%nupage;还原的和非还原的)和ecl凝集素印迹(还原的)进行,以及末端半乳糖定量的结果,其以摩尔半乳糖或摩尔糖肽/摩尔抗体计。
图76是显示野生型和突变体抗体的唾液酸含量(以mol/mol计)的图表,如采用dionexhplc所测量的。
图77显示了野生型和和突变体抗体的聚乙二醇化的表征,其通过还原和非还原的sds-page进行。
图78是显示野生型和突变体抗体的聚乙二醇化(以mol/mol计)的图表。
图79是一系列照片,其显示了来自对照的、经修饰的(用半乳糖基转移酶)、或缀合的(用乳糖氨基氧基或乳糖马来酰亚胺)抗体与hepg2细胞温育的免疫荧光染色结果。
图80显示了三价galnac聚糖。
图81显示了表面等离子体共振实验的结果,该实验用于评估缀合有三价galnac聚糖的抗体对asgpr报告亚基h1的结合。图82显示了含有三价galnac的糖肽和含有三价半乳糖的糖肽。
图83显示了表面等离子体共振实验的结果,该实验用于评估缀合有三价galnac的和缀合有三价半乳糖的重组溶酶体酶对asgpr受体亚基h1的结合。
图84是显示唾液酸(0.2μmol)滴定的图表,所述滴定用多种量的cmp-唾液酸合成酶(n.mentingitidis)于37℃滴定,以合成的cmp-唾液酸对比所用的酶量。
图85是图表,其显示(自mannac)合成的唾液酸对比唾液酸醛缩酶(大肠杆菌(e.coli)k-12)的量,酶在37℃使用。
图86是图表,其显示(自manlev)合成的唾液酸衍生物对比唾液酸醛缩酶(大肠杆菌k-12)的量,酶在37℃使用。
图87是图表,其显示了在用唾液酸酶于37℃消化cmp-唾液酸衍生物(合成自manlev)之后释放的唾液酸衍生物,对比用hpaec-pad监测的唾液酸标准的保留时间。
图88是图表,其显示了合成自mannac的cmp-唾液酸和合成自manlev的cmp-唾液酸衍生物的hpaec-pad概况,其与cmp-唾液酸对比。
图89是图表,其显示了与cmp-唾液酸标准相比的cmp-唾液酸衍生物(合成自manlev、mannaz和manaz)的hpaec-pad概况。
图90是证明用cmp-唾液酸衍生物制备自manlev的抗体的唾液酸化的示意图。
图91是显示由ides蛋白酶释放自抗体赫赛汀(herceptin)的ch2ch3片段的lc-ms分析的图表,所述赫赛汀是用α2,6唾液酸转移酶和制备自manlev的cmp-唾液酸衍生物体外唾液酸化的。
图92是证明用制备自manlev的唾液酸衍生物唾液酸化的抗体的聚乙二醇化的示意图。
图93显示了聚乙二醇化的赫赛汀(其用制备自manlev的唾液酸衍生物预先唾液酸化)的sds-page表征。所述聚乙二醇化用肟化学方法进行。
图94是证明用制备自mannaz的cmp-唾液酸衍生物对抗体的唾液酸化的示意图。
图95显示了聚乙二醇化的赫赛汀(其用制备自mannaz的唾液酸衍生物预先唾液酸化)的sds-page表征。所述聚乙二醇化用点击化学进行。
发明详述
本公开提供制备效应部分缀合物(例如靶向部分缀合物)的方法。这些方法涉及将唾液酸衍生物并入结合多肽的聚糖以形成缀合有唾液酸衍生物的结合多肽,以及随后的反应,在所述反应中使效应部分与所述缀合有唾液酸衍生物的结合蛋白反应以生成缀合有效应部分的结合多肽。
i.定义
如本文使用的术语"结合蛋白"或“结合多肽”将是指含有至少一个负责选择性地与感兴趣的靶抗原(例如人抗原)结合的结合位点的多肽(例如抗体)。示例性的结合位点包括抗体的可变结构域、受体的配体结合位点或配体的受体结合位点。在一些方面,结合多肽包含多重(例如二、三、四或更多个)结合位点。在一些方面,结合蛋白不是治疗性的酶。
如本文使用的术语"天然的残基"将是指在结合多肽(例如抗体或其片段)的特定氨基酸位置天然存在且未经人为修饰、引入或改变的氨基酸残基。如本文使用的术语"改变的结合蛋白"或“改变的结合多肽”包括含有至少一个非天然的突变的氨基酸残基的结合多肽(例如抗体或其片段)。
如本文使用的术语"特异性结合"是指抗体或其抗原结合片段以最多如下的解离常数(kd)与抗原结合的能力:约1x10-6m、1x10-7m、1x10-8m、1x10-9m、1x10-10m、1x10-11m、1x10-12m或更低,和/或抗体或其抗原结合片段以相比其针对非特异性抗原至少高两倍的亲和力与抗原结合的能力。
如本文使用的术语"抗体"是指与感兴趣的抗原(例如肿瘤相关抗原)具有显著已知的特异性的免疫反应活性的这种装配体(例如完整的抗体分子、抗体片段或其变体)。抗体和免疫球蛋白包含轻链和重链,两者间可具有或不具有链间共价连接基。在脊椎动物体系中基本的免疫球蛋白结构已得到相对充分的认识。
如将在下文详细讨论的是,通用术语"抗体"包含五种不同的抗体种类,其可在生化水平进行区分。尽管全部五种抗体都明确属于本公开的保护范围内,但下列讨论将主要针对免疫球蛋白分子的igg类。对于igg,免疫球蛋白包含两条分子重量大致为23,000道尔顿的相同轻链和两条分子量为53,000-70,000的相同重链。所述四条链以"y"构型通过二硫键结合,其中所述轻链在"y"的开口处开始托架所述重链且持续贯穿可变区。
免疫球蛋白的轻链分为κ或λ(κ,λ)。每种重链可与κ或λ轻链结合。一般而言,所述轻链和重链共价地彼此结合,且当所述免疫球蛋白通过杂交瘤、b细胞或基因工程化的宿主细胞生成时,所述两种重链的"尾"部彼此通过共价二硫化物连接基或非共价连接基键合。在所述重链中,氨基酸序列从y构型分叉末端处的n-末端持续至每条链底部处的c-末端。本领域的技术人员将理解重链分为γ、μ、α、δ或ε(γ、μ、α、δ、ε),且这些类别中还具有一些亚类(例如γl-γ4)。该链的性质决定了抗体分别为igg、igm、iga、igg或ige的"种类"。免疫球蛋白同型亚类(例如igg1、igg2、igg3、igg4、iga1等)已详细表征且已知赋予功能上的特质。在本发明的基础上本领域的技术人员可轻易辨别这些类别和同型中的每一种的修饰版本且相应地,其也在本公开的保护范围内。
轻链和重链都分成具有结构和功能同源性的区。术语"区"是指免疫球蛋白或抗体链的部分或组分且包括恒定区或可变区以及所述区更分散的部分或组分。例如,轻链可变区包括穿插在如本文定义的"框架区"或"fr"中的"互补决定区"或"cdr"。
在"恒定区"的情况中基于多种类别成员在所述区中序列变化的相对缺乏,或在"可变区"的情况中基于多种类别成员在所述区中的显著变化,免疫球蛋白重链或轻链的区可以定义为"恒定"(c)区或"可变"(v)区。术语"恒定区"和"可变区"还可在功能上使用。在这方面,可以理解的是免疫球蛋白或抗体的可变区决定抗原识别和特异性。相反地,免疫球蛋白或抗体的恒定区赋予重要的效应功能如分泌、经胎盘的移动性、fc受体结合、补体结合等等。已知许多免疫球蛋白种类的恒定区的亚单元结构和三维构型。
免疫球蛋白重链和轻链的恒定和可变区折叠成为结构域。术语"结构域"是指重链或轻链的球状区,其包含通过例如β-折叠片层和/或链间二硫键稳定的肽环(例如包含3到4个肽环)。免疫球蛋白轻链上的恒定区结构域可互换地称为"轻链恒定区结构域"、"cl区"或"cl结构域"。重链上的恒定结构域(例如铰链、ch1、ch2或ch3结构域)可互换地称为"重链恒定区结构域"、"ch"区结构域或"ch结构域"。轻链上的可变结构域可互换地称为"轻链可变区结构域"、"vl区结构域或"vl结构域"。重链上的可变结构域可互换地称为"重链可变区结构域"、"vh区结构域"或“vh结构域"。
按照惯例,可变恒定区结构域的标号随其距离免疫球蛋白或抗体的抗原结合位点或氨基末端变远而增加。每条重或轻免疫球蛋白链的n-末端是可变区且c-末端是恒定区;ch3和cl结构域实际上分别包含重链和轻链的羧基-末端。相应地,轻链免疫球蛋白的结构域以vl-cl方向排列,而重链的结构域以vh-ch1-铰链-ch2-ch3的方向排列。
氨基酸在重链恒定区中的位置,包括氨基酸在ch1、铰链、ch2、ch3和cl结构域中的位置可根据kabat索引编号系统进行编号(参见kabat等,in"sequencesofproteinsofimmunologicalinterest",u.s.dept.healthandhumanservices,5thedition,1991)。可替换地,抗体的氨基酸位置可根据eu索引编号系统进行编号(参见kabat等,ibid)。
如本文使用的术语"vh结构域"包括免疫球蛋白重链的氨基末端可变结构域,而术语"vl结构域"包括免疫球蛋白轻链的氨基末端可变结构域。
如本文使用的术语"ch1结构域"包括免疫球蛋白重链的第一(氨基最末端)恒定区结构域,其例如在kabat编号系统中延伸自约位置114-223(eu位置118-215)。ch1结构域与vh结构域毗邻并且位于免疫球蛋白重链分子的铰链区的氨基末端,且不形成免疫球蛋白重链fc区的一部分。
如本文使用的术语"铰链区"包括将ch1结构域结合至ch2结构域的重链分子部分。该铰链区包含大致25个残基且是柔性的,因此允许两个n-末端抗原结合区独立运动。铰链区可细分为三个不同的结构域:上、中和下铰链结构域(roux等.j.immunol.1998,161:4083)。
如本文使用的术语"ch2结构域"包括重链免疫球蛋白分子的如下部分,其延伸自例如约kabat编号系统的位置244-360(eu位置231-340)。ch2结构域是独特的,这在于其并不与另一结构域紧密配对。相反,两条n连接的分支糖插入完整的天然igg分子的两个ch2结构域之间。在一个实施方案中,本公开的结合多肽包含源自igg1分子的ch2结构域(例如人igg1分子)。
如本文使用的术语"ch3结构域"包括重链免疫球蛋白分子的如下部分,其从ch2结构域的n-末端(例如从约kabat编号系统的位置361-476(eu位置341-445))延伸大致110残基。ch3结构域通常形成抗体的c-末端部分。然而在一些免疫球蛋白中,额外的结构域可从ch3结构域延伸以形成分子的c-末端部分(例如igm的μ链和ige的e链中的ch4结构域)。在一个实施方案中,本公开的结合多肽包含源自igg1分子(例如人igg1分子)的ch3结构域。
如本文使用的术语"cl结构域"包括免疫球蛋白轻链的恒定区结构域,其例如延伸自约kabat位置107a-216。cl结构域与vl结构域毗邻。在一个实施方案中,本公开的结合多肽包含源自κ轻链(例如人κ轻链)的cl结构域。
如本文使用的术语"fc区"定义为重链恒定区的部分,其开始于铰链区中木瓜蛋白酶裂解位点的正好上游(justupstream)(将重链恒定区的第一残基视为114的话,即igg中的残基216),并止于抗体的c-末端。相应地,完整的fc区至少包含铰链结构域、ch2结构域和ch3结构域。
如本文使用的术语"天然fc"是指包含非抗原结合片段的序列,无论是单体或多聚体形式,其可从抗体的消化或由其他方式产生获得,且可包含铰链区。天然fc的初始的免疫球蛋白来源可以是人来源且可以是任何免疫球蛋白,如igg1或igg2。天然fc分子由可通过共价(即二硫键)和非共价缔合连接成为二聚体或多聚体形式的单体多肽组成。天然fc分子单体亚单位间的分子间二硫键的数目可为1-4,取决于种类(例如igg、iga和ige)或亚类(例如igg1、igg2、igg3、iga1和igga2)。天然fc的一个实例是从igg的木瓜蛋白酶消化产生的二硫键键合的二聚体。如本文使用的术语"天然fc"为单聚、二聚和多聚形式的上位术语。
如本文使用的术语"fc变体"是指从天然fc修饰而来但仍包含用于补救受体(salvagereceptor)、fcrn(新生儿fc受体)的结合位点的分子或序列。示例性的fc变体和其与补救受体的相互作用为本领域已知。因此,术语"fc变体"可包含从非人天然fc人源化的分子或序列。此外,天然的fc包含由于提供并非为抗体样结合多肽所需的结构特征或生物活性而可去除的区。因此,术语"fc变体"包含缺乏一个或多个天然fc位点或残基的分子或序列,或其中一个或多个fc位点或残基已修饰,所述位点或残基影响或参与:(1)二硫键形成,(2)与选择的宿主细胞的不兼容性,(3)在选择的宿主细胞中表达时n-末端的异质性,(4)糖基化,(5)与补体的相互作用,(6)与fc受体而非补救受体的结合,或(7)抗体依赖的细胞的细胞毒性(adcc)。
如本文使用的术语"fc结构域"涵盖天然fc和如上文定义的fc变体和序列。与fc变体和天然fc分子相同的是,术语"fc结构域"包括单聚或多聚形式的分子,无论是从完整抗体消化或通过其他方式产生。
如上文所示,抗体的可变区允许其选择性地识别和特异性地结合抗原上的表位。也就是说,抗体的vl结构域和vh结构域组合以形成界定三维抗原结合位点的可变区(fv)。这种四元抗体结构形成存在于y的每个臂的末端的抗原结合位点。更具体地,所述抗原结合位点通过在每条重链和轻链可变区上的三个互补决定区(cdr)界定。如本文使用的术语"抗原结合位点"包括特异性结合(与其发生免疫反应)抗原(例如细胞表面或可溶抗原)的位点。抗原结合位点包括免疫球蛋白重链和轻链可变区且通过这些可变区形成的结合位点决定抗体的特异性。抗原结合位点通过一个抗体与另一抗体间不同的可变区形成。本公开的改变的抗体包含至少一个抗原结合位点。
在一些实施方案中,本公开的结合多肽包含至少两个提供用于结合多肽与选择的抗原缔合的抗原结合结构域。所述抗原结合结构域无需源自相同的免疫球蛋白分子。在这方面,可变区可以或为源自可对其进行诱导以装载体液应答和生成抗预期抗原的免疫球蛋白的任何类型的动物。由此,所述结合多肽的可变区可以是例如哺乳动物来源的,例如可以是人、鼠类、大鼠、山羊、绵羊、非人灵长类动物(如食蟹猴、猕猴等)、狼类(lupine)或驼类(camelid)(例如来自骆驼、美洲驼和相关品种)。
在天然存在的抗体中,当抗体在水性环境中呈现其三维构型,每个单聚抗体上的cdr为特异性定位以形成抗原结合位点的氨基酸的短的、非连续序列。重链和轻链可变结构域的剩余部分显示氨基酸序列中较少的分子间可变性且称为框架区。所述框架区大量采取β-片层构象,并且cdr形成连接所述β-片层结构(在一些情况中,形成β-片层结构的一部分)的环。因此,这些框架区发挥作用以形成通过链间非共价相互作用用以使六个cdr在正确方向定位的支架。通过定位的cdr形成的抗原结合结构域界定与免疫反应性抗原的表位互补的表面。该互补表面促进抗体与免疫反应性抗原表位的非共价结合。
本发明中表征的示例性结合多肽包括抗体变体。如本文使用的术语“抗体变体”包括合成的和工程化形式的抗体,其经过改变因此其并非天然存在的,例如包含至少两个重链部分但非两个完整重链的抗体(如结构域缺失的抗体或微型抗体);改变以结合至两种或多种不同抗原或至单一抗原上的不同表位的多重特异性(例如双特异性、三特异性等)抗体形式;与scfv分子结合的重链分子等等。此外,术语“抗体变体”包括多价形式的抗体(例如三价、四价等,与相同抗原的三个、四个或多个拷贝结合的抗体。
如本文使用的术语“价”是指在多肽中潜在的靶结合位点的数目。每个靶结合位点特异性结合一个靶分子或在靶分子上的特异性位点。当多肽包含多于一个靶结合位点时,每个靶结合位点可特异性结合相同或不同分子(例如可与不同配体或不同抗原或相同抗原上的不同表位结合)。主题结合多肽通常具有至少一个特异性针对人抗原分子的结合位点。
术语“特异性”是指特异性结合给定靶抗原(例如人靶抗原)(例如与其发生免疫反应)的能力。结合多肽可以是单特异性或包含一个或多个特异性结合靶的结合位点或多肽可以是多重特异性的且包含两个或多个特异性结合相同或不同靶的结合位点。在一些实施方案中,结合多肽特异性针对相同靶的两个不同(例如非重叠的)部分。在一些实施方案中,结合多肽特异性针对多于一个靶。包含与表达在肿瘤细胞上的抗原结合的抗原结合位点的示例性结合多肽(例如抗体)为本领域已知且来自这种抗体的一个或多个cdr可包括在本文所述的抗体中。
术语"连接部分"包括能够将效应部分与本文公开的结合多肽连接的部分。可根据其可裂解(例如可酶裂解或ph-敏感)或非-可裂解对连接部分进行选择。
如本文使用的术语"效应部分"包含具有生物学或其他功能活性的作用剂(例如蛋白、核酸、脂质、糖、糖肽、及其片段)。例如,包含与结合多肽缀合的效应部分的修饰的结合多肽与未缀合的抗体相比具有至少一种额外的功能或特性。例如,毒性药物(例如效应部分)与结合多肽的缀合导致具有作为第二功能(即抗原结合以外的功能)的药物毒性的结合多肽的形成。在另一实例中,第二结合多肽与结合多肽的缀合可赋予额外的结合性质。在一些实施方案中,其中效应部分是基因编码的治疗或诊断蛋白或核酸,所述效应部分可通过肽合成或本领域已知的重组dna的方法而合成或表达。另一方面,其中所述效应部分是非基因编码的肽或药物部分,所述效应部分可人工合成或从天然来源纯化。如本文使用的术语"药物部分"包括抗炎、抗癌、抗感染(例如抗真菌、抗细菌、抗寄生物、抗病毒等)和麻醉治疗剂。在进一步的实施方案中,药物部分是抗癌或细胞毒性剂。相容的药物部分还可包含前体药物。示例性的效应部分阐述于本文的表1中。
在一些实施方案中,“效应部分”包含“靶向部分”。如本文使用的术语“靶向部分”是指与靶分子结合的效应部分。靶向部分可以包括但不限于蛋白、核酸、脂质、糖(例如聚糖)及其组合(例如糖蛋白、糖肽和糖脂)。
如本文使用的术语"前体药物"是指与母体药物相比不那么活跃、具有反应性或容易产生副作用的药物活性剂的前体或衍生形式,且其能够在体内酶激活或以其他方式转变成更活跃的形式。与本公开的组合物相容的前体药物包括但不限于含磷酸盐的前体药物、含氨基酸的前体药物、含硫代磷酸盐的前体药物、含硫酸盐的前体药物、含肽的前体药物、含β-内酰胺的前体药物,含有任选的取代的苯氧酰胺前体药物或含有任选的取代的苯乙酰胺的前体药物、5-氟胞嘧啶和其他可转变为更活跃的无细胞毒性药物的5-氟尿嘧啶的前体药物。本领域的技术人员可对预期的药物部分或其前体药物制备化学修饰进而就制备本公开的修饰的结合多肽而言使该化合物的反应更加便利。药物部分还包括本文描述的药物部分的衍生物、可药用的盐、酯、酰胺和醚。衍生物包括对本文鉴别的药物的修饰,其可以改进或不显著降低特定药物的预期治疗活性。
如本文使用的术语"抗癌剂"包括对赘生性或肿瘤细胞的生长和/或增殖不利且可发挥作用以降低、抑制或摧毁恶性肿瘤的作用剂。这种作用剂的实例包括但不限于细胞抑制剂、烷化剂、抗生素、细胞毒核苷、微管蛋白结合剂、激素、激素拮抗剂、细胞毒性剂等等。细胞毒性剂包括茅屋霉素衍生物、美登素衍生物、cryptophycine衍生物、蒽环类衍生物,二膦酸衍生物、来普霉素衍生物、链黑菌素衍生物、奥瑞他汀衍生物和duocarmycin衍生物。任何延迟或减缓免疫反应细胞或恶性细胞生长的作用剂都在本公开的保护范围之内。
如本文使用的术语"抗原"或"靶抗原"是指能够通过结合多肽的结合位点结合的分子或分子的部分。靶抗原可以具有一个或多个表位。
如本文使用的术语“缀合有唾液酸衍生物的结合多肽”是指通过将cmp-唾液酸衍生物与结合肽的聚糖反应形成的多肽。例如,缀合有唾液酸衍生物的结合多肽包括但不限于图3a-e的多肽(其通过圆圈表示)与所键合的反应部分组合。
如本文使用的术语“三价糖肽”是指包含3个糖肽的靶向或效应部分。
如本文使用的术语“三价氨基氧基”是指氨基氧基部分,其还包含3个糖或糖肽。三价氨基氧基可以含有额外的官能团,例如接头。
如本文使用的术语“点击化学”是指末端反应部分的对子,其快速且选择性地互相反应(“点击”)而形成缀合有靶向或效应部分的结合多肽。点击化学在本文有进一步讨论。
如本文使用的术语“金属催化剂”是指包含过渡金属以及一个或多个配体的催化剂,所述过渡金属包括但不限于钌,镍,钯,铂和铁,所述配体包括但不限于联吡啶衍生物或三联吡啶衍生物。也可以原位形成金属催化剂。例如,可以在还原剂的存在下向反应混合物添加铜(ii)化合物,所述还原剂包括但不限于作为铜(ii)化合物的硫酸铜(cuso4)和作为还原剂的抗坏血酸钠。
如本文所用,术语“反应部分”是指包含部分或整个官能团的部分,其负责特征化学反应的一个或多个原子和一个或多个键的特定基团。在示例性实施方案中,反应部分包括但不限于醛部分,炔,氨基氧基部分,叠氮化物,肼,酮部分和硫醇。在一些实施方案中,反应部分是末端反应部分。在反应步骤中,第一反应部分与第二反应部分反应形成缀合有效应部分的结合多肽。
本文所用的“醛”部分是指甲酰基官能团,并且由以下结构式表示:
例如,包含末端醛部分的cmp-唾液酸衍生物包括但不限于以下结构式:
本文所用的“炔”部分是指碳-碳三键。
本文所用的“氨基氧基”部分是指氮-氧单键,并由以下结构式表示:
本文所用的“叠氮化物”部分是指rn3部分,并且可以由以下结构式表示:
本文使用的“肼”部分是指至少一个氮-氮单键,并由下列结构式表示:
例如肼可以具有如下结构式:
如本文所用,“亚胺”部分是指碳-氮双键,并由以下结构式表示:
在一些实施方案中,缀合有靶向或效应部分的结合多肽包含亚胺。例如,一种类型的亚胺包括但不限于醛亚胺,羟胺,腙,氯胺酮或肟。
本文所用的“腙”部分是指一种类型的亚胺,并由以下结构式表示:
在一些实施方案中,腙可以是末端腙。在一些实施方案中,腙连接基包含腙部分以及额外的官能团,例如接头或一部分连接部分。
如本文所用的“酮”或“酮”部分包含羰基官能团并由以下结构式表示:
如本文所用的“马来酰亚胺”部分包含不饱和酰亚胺并由以下结构式表示:
“肟”部分是一种类型的亚胺,由下列结构式表示:
术语“硫醚”由以下结构式表示:
“硫醇”是指包含-sh官能团的部分,也称为巯基。在一些实施方案中,硫醇包含碳键合的巯基。
当是指本文所用的反应部分时,术语“末端”描述了与直链或支链部分的末端键合的基团。在一些实施方案中,末端反应部分是官能团的取代基。
术语“氧化剂”是指从另一化合物或试剂接受或获得电子,从而在氧化所述另一化合物或试剂的同时得以进行还原的化合物或试剂。例如,氧化剂包括但不限于高碘酸钠,高碘酸氧化酶,半乳糖氧化酶,过氧化氢和铜化合物(例如硫酸铜(ii))。
本文所用的术语“环境温度”等同于术语“室温”,并且表示20℃至26℃(相当于68°f和79°f)的温度范围,平均温度约为23℃(73°f)。
本文所用的术语“缀合有效应部分的结合多肽”是指包含一种或多种与效应部分连接或键合的结合蛋白的结构。可以存在多个化学部分和官能团,其包含结合蛋白和效应部分之间的连接基,所述连接基包括但不限于任何聚糖或修饰的聚糖(例如一个或多个唾液酸衍生物或cmp-唾液酸衍生物)。
ii.唾液酸衍生物
在一个方面,本公开提供了从糖或糖衍生物制备唾液酸或唾液酸衍生物的方法。所使用的糖或糖衍生物可以是但不限于n-乙酰甘露糖胺或其衍生物,如n-乙酰甘露糖胺(mannac),n-乙酰丙基(levulinoyl)甘露糖胺(manlev),n-叠氮基乙酰甘露糖胺(manhaz),叠氮基甘露糖胺和n-硫代乙酰甘露糖胺(manhs)。
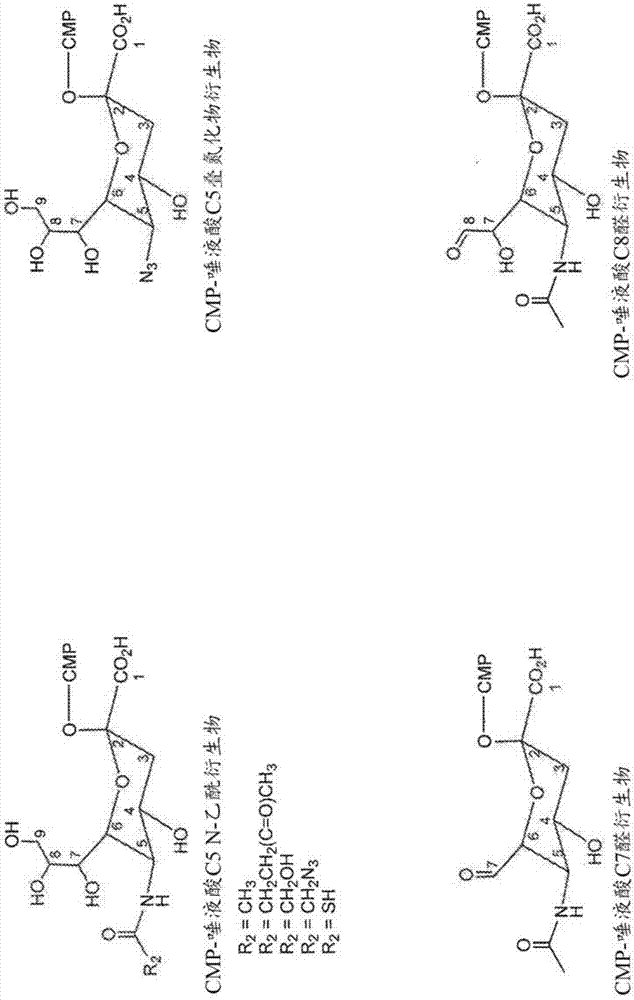
在示例性实施方案中,糖或糖衍生物具有以下结构式:
其中r1是反应部分,其包括但不限于nh(c=o)ch3、nh(c=o)ch2ch2(c=o)ch3、nh(c=o)ch2oh、nh(c=o)ch2n3、nh(c=o)sh、oh或n3。在一个实施方案中,cmp-唾液酸衍生物具有以下结构式:
其中r1是反应部分,其包括但不限于上文列举的基团。
ii.结合多肽
一方面,本公开提供包含糖基化的结构域例如糖基化的恒定结构域的结合多肽(例如抗体、抗体片段、抗体变体和融合蛋白)。本文公开的结合多肽涵盖任何包含具有n-连接糖基化位点的结构域的结合多肽。在一些实施方案中,所述结合多肽是抗体或其片段或衍生物。可将来自任何来源或物种的任何抗体应用于本文公开的结合多肽中。合适的抗体包括但不限于人抗体、人源化的抗体或嵌合抗体。
在一些实施方案中,所述的糖基化结构域是fc结构域。在一些实施方案中,所述糖基化结构域是在n297处的天然糖基化结构域。
在其他实施方案中,所述糖基化结构域是工程化的糖基化结构域。在fc结构域中示例性的工程化的糖基化结构域包含在氨基酸位置298处的天冬酰胺残基(根据eu编号);和在氨基酸位置300处的丝氨酸或苏氨酸残基(根据eu编号)。
来自任何免疫球蛋白种类(例如igm、igg、igd、iga和ige)和物种的fc结构域可用于本文公开的结合多肽。也可采用包含来自不同物种或ig种类的fc结构域部分的嵌合fc结构域。在一些实施方案中,所述fc结构域是人igg1fc结构域。在人igg1fc结构域的情况中,在kabat位置298处的野生型氨基酸突变成天冬酰胺并且在kabat位置300处的野生型氨基酸突变成丝氨酸或苏氨酸导致n-连接糖基化共有位点的形成(即n-x-t/s序列子,其中x是除脯氨酸外的任何氨基酸)。然而,在其他物种和/或ig种类或同型的fc结构域的情况中,本领域的技术人员会理解如果脯氨酸残基存在,有必要将fc结构域的kabat位置229突变以产生n-x-t/s序列子。
在其他实施方案中,本公开提供包含至少一个具有n-连接糖基化位点的ch1结构域的结合多肽(例如抗体、抗体片段、抗体变体和融合蛋白)。这种示例性的结合多肽可包括例如在位置114处(根据kabat编号)的工程化的糖基化位点。
来自任何免疫球蛋白类型(例如igm、igg、igd、iga和ige)和物种的ch1结构域可用于本文公开的结合多肽。也可采用包含来自不同物种或ig类型的ch1结构域的部分的嵌合ch1结构域。在一些实施方案中,所述ch1结构域是人igg1ch1结构域。在人igg1结构域的情况中,在位置114处的野生型氨基酸突变成天冬酰胺导致n连接糖基化共有位点(即n-x-t/s序列子,其中x是除脯氨酸外的任何氨基酸)的形成。然而,在其他物种和/或ig类型或同型的其他ch1结构域的情况中,本领域的技术人员将理解有必要将ch1结构域位置115和/或116突变以生成n-x-t/s序列子。
在一些实施方案中,本公开的结合多肽可包含抗体的抗原结合片段。术语"抗原结合片段"是指结合抗原或与完整抗体竞争(即与其所来自的完整抗体竞争)抗原结合(即特异性结合)的免疫球蛋白或抗体的多肽片段。抗原结合片段可通过本领域熟知的重组或生化方法产生。示例性的抗原结合片段包括fv、fab、fab'和(fab')2。在一些实施方案中,本公开的抗原结合片段是包含至少一个工程化的糖基化位点的改变的抗原结合片段。在一个示例性的实施方案中,本公开的改变的抗原结合片段包含前文所述的改变的vh结构域。在另一个示例性的实施方案中,本公开的改变的抗原结合片段包含前文所述的改变的ch1结构域。
在示例性的实施方案中,所述结合多肽包含单链可变区序列(scfv)。单链可变区序列包含具有一个或多个抗原结合位点的单多肽,例如通过柔性接头与vh结构域连接的vl结构域。scfv分子可以vh-接头-vl的方向或vl-接头-vh的方向构建。连接组成抗原结合位点的vl和vh结构域的柔性铰链通常具有约10至约50个氨基酸残基。连接肽为本领域已知。结合多肽可包含至少一个scfv和/或至少一个恒定区。在一个实施方案中,本公开的结合多肽可包含至少一个与包含ch1结构域(例如在kabat位置114处包含天冬酰胺残基的ch1结构域)和/或ch2结构域(例如在eu位置298处包含天冬酰胺残基并在eu位置300处包含丝氨酸或苏氨酸的ch2结构域)的抗体或片段连接或融合的scfv。
在一些示例性的实施方案中,本公开的结合多肽是通过将编码抗体的dna序列与scfv分子(例如改变的scfv分子)融合产生的多价(例如四价)抗体。例如,在一个实施方案中,组合这些序列进而scfv分子(例如改变的scfv分子)在其n-末端或c-末端与抗体的fc片段经由柔性接头(例如gly/ser接头)连接。在另一实施方案中,本公开的四价抗体可通过将scfv分子与连接肽融合制备,其与ch1结构域(例如在kabat位置114处包含天冬酰胺残基的ch1结构域)融合以构建scfv-fab四价分子。
在另一实施方案中,本公开的结合多肽是改变的微型抗体。本公开的改变的微型抗体是各自包含scfv分子(例如包含前文所述的改变的vh结构域的改变的scfv分子)的两条多肽链组成的二聚分子,其与ch3结构域或其部分经由连接肽融合。微型抗体可通过构建scfv组件和连接肽-ch3组件使用本领域描述的方法制备(参见例如us专利5,837,821或wo94/09817al)。在另一实施方案中,可构建四价微型抗体。四价微型抗体可以与微型抗体相同的方式构建,除了两个scfv分子使用柔性接头连接以外。连接的scfv-scfv构建体随后与ch3结构域结合。
在另一实施方案中,本公开的结合多肽包含双抗体。双抗体是各具有与scfv分子相似的多肽的二聚、四价分子,但其通常具有连接两个可变结构域的短(小于10,例如1-5)氨基酸残基接头进而使在相同多肽链上的vl和vh结构域不能相互作用。反而,一条多肽链的vl和vh结构域与在第二条多肽链上的vh和vl结构域(分别)相互作用(参见例如wo02/02781)。本公开的双抗体包含与ch3结构域融合的scfv分子。
在其他实施方案中,结合多肽包含在相同多肽链上含有一个或多个串联的可变结构域的多重特异性或多价抗体,例如串联结构域(tvd)多肽。示例性的tvd多肽包括"双头"或"双-fv"构型,描述于美国专利号5,989,830中。在双-fv构型中,两种不同抗体的可变结构域在两条分开的链(一条重链和一条轻链)上以串联方向表达,其中一条多肽链具有通过肽接头分开的两个串联vh结构域(vh1-接头-vh2)且另一多肽链由通过肽接头串联的互补vl结构域组成(vl1-接头-vl2)。在交叉双头构型中,两种不同抗体的可变结构域在两条分开的多肽链上(一条重链和一条轻链)以串联方向表达,其中一条多肽链具有两个通过肽接头分开的两个串联vh结构域(vh1-接头-vh2)且另一多肽链由在相反方向的通过肽接头串联的互补vl结构域组成(vl2-接头-vl1)。基于"双-fv"形式的额外抗体变体包括双可变结构域igg(dvd-igg)双特异性抗体(参见美国专利号7,612,181)和tbti形式(参见us2010/0226923a1)。恒定结构域向双fv的各条链的添加(ch1-fc向重链和κ或λ恒定结构域向轻链)导致功能双特异性抗体而无需任何额外修饰(即恒定结构域的明显添加以增强稳定性)。
在另一示例性的实施方案中,所述结合多肽包含基于"双头"构型的交叉双可变结构域igg(codv-igg)双特异性抗体(参见us20120251541a1,其在本文通过提述以其全文并入)。codv-igg抗体变体具有其中vl结构域与cl结构域串联(vl1-l1-vl2-l2-cl)的一条多肽链和其中互补vh结构域以相反的方向与ch1结构域串联的第二多肽链(vh2-l3-vh1-l4-ch1),其中所述多肽链形成交叉的轻链-重链配对。在一些实施方案中,所述第二多肽可进一步与fc结构域连接(vh2-l3-vh1-l4-ch1-fc)。在一些实施方案中,接头l3是接头l1长度的至少两倍且/或接头l4是接头l2长度的至少两倍。例如,l1和l2长度上可以是1-3个氨基酸残基,l3在长度上可以是2至6个氨基酸残基,且l4在长度上可以是4至7个氨基酸残基。合适的接头的实例包括单甘氨酸(gly)残基;二甘氨酸肽(gly-gly);三肽(gly-gly-gly);具有四个甘氨酸残基的肽(gly-gly-gly-gly);具有五个甘氨酸残基的肽(gly-gly-gly-gly-gly);具有六个甘氨酸残基的肽(gly-gly-gly-gly-gly-gly);具有七个甘氨酸残基的肽(gly-gly-gly-gly-gly-gly-gly);具有八个甘氨酸残基的肽(gly-gly-gly-gly-gly-gly-gly-gly)。也可使用其他氨基酸残基的组合如肽gly-gly-gly-gly-ser和肽gly-gly-gly-gly-ser-gly-gly-gly-gly-ser。
在一些实施方案中,所述结合多肽包含免疫粘附素分子,所述免疫粘附素分子包含与抗体恒定区融合的非抗体结合区(例如受体、配体或细胞粘附分子)(参见例如ashkenazi等.,methods,19958(2),104–115,将其通过提述整体并入本文)。
在一些实施方案中,所述结合多肽包含免疫球蛋白-样结构域。合适的免疫球蛋白-样结构域包括但不限于纤维连接蛋白结构域(参见例如,koide等.(2007),methodsmol.biol.352:95–109,其在本文通过提述以其全文并入)、darpin(参见例如,stumpp等.(2008)drugdiscov.today13(15–16):695–701,其在本文通过提述以其全文并入)、蛋白a的z结构域(参见nygren等.(2008)febsj.275(11):2668–76,其在本文通过提述以其全文并入)、lipocalins(参见例如,skerra等.(2008)febsj.275(11):2677–83其在本文通过提述以其全文并入)、affilins(参见例如,ebersbach等.(2007)j.mol.biol.372(1):172–85,其在本文通过提述以其全文并入)、affitins(参见例如,krehenbrink等.(2008)。j.mol.biol.383(5):1058–68,其在本文通过提述以其全文并入)、avimers(参见例如,silverman等.(2005)nat.biotechnol.23(12):1556–61,其在本文通过提述以其全文并入)、fynomers(参见例如,grabulovski等.(2007)jbiolchem282(5):3196–3204,其在本文通过提述以其全文并入)和kunitz结构域肽(参见例如,nixon等.(2006)curropindrugdiscovdevel9(2):261–8,其在本文通过提述以其全文并入)。
iii.n-连接聚糖
在一些实施方案中,结合多肽采用经由天冬酰胺残基“n-连接”至结合多肽的多肽骨架中的糖基化位点的n-连接聚糖。所述糖基化位点可以是天然的或工程化的糖基化位点。额外的或可替换地,聚糖可以是天然聚糖或包含非天然连接基的工程化聚糖。
在一些示例性的实施方案中,结合多肽包含抗体fc结构域的天然糖基化位点。这种天然糖基化位点包含在fc结构域位置297处(n297)(根据eu编号)的野生型天冬酰胺残基。存在于该位置的天然的n-连接聚糖通常通过β-糖基酰胺连接基与n297侧链的氮基团连接。然而,也可采用其他合适的本领域认可的连接基。在其他示例性的实施方案中,结合多肽包含一个或多个工程化的糖基化位点。这种工程化的糖基化位点包含将结合多肽的多肽骨架中一个或多个野生型氨基酸用能够由细胞的糖基化酶进行n-糖基化的天冬酰胺残基取代。示例性的工程化糖基化位点包括在fc结构域的氨基酸位置298处(298n)或ch1结构域的氨基酸位置114处的天冬酰胺突变的引入。
任何类型的天然存在或合成的(即非天然)n-连接聚糖可与本发明中表征的结合多肽的糖基化位点连接。在一些实施方案中,所述聚糖包含可氧化(例如通过高碘酸盐处理或半乳糖氧化酶)的糖(例如位于寡糖末端的糖残基)以生成适于与效应部分(例如具有反应性的醛基基团)缀合的基团。合适的可氧化糖包括但不限于半乳糖和唾液酸(例如n-乙酰神经氨酸)。在其他实施方案中,聚糖包含唾液酸或唾液酸衍生物,其不需要进一步氧化以产生适于缀合至效应部分(例如反应部分,包括但不限于醛部分,炔,氨基氧基部分,叠氮化物,肼,酮部分和硫醇)的基团。在具体的实施方案中,聚糖包括唾液酸衍生物。在一个实施方案中,聚糖包括唾液酸衍生物,其通过包含聚糖的结合多肽和cmp-唾液酸衍生物之间的反应形成。在一个实施方案中,唾液酸衍生物或cmp-唾液酸衍生物可以包含末端叠氮化物部分。在又一个实施方案中,cmp-唾液酸衍生物可以是cmp-唾液酸c5叠氮化物。在另一个实施方案中,唾液酸衍生物可以包含c5叠氮化物。在一些实施方案中,cmp-唾液酸衍生物具有以下结构式:
其中r1是反应部分,其包括但不限于nh(c=o)ch3、nh(c=o)ch2ch2(c=o)ch3、nh(c=o)ch2oh、nh(c=o)ch2n3、nh(c=o)sh、oh或n3。
在一些实施方案中,聚糖是双触角(biantennary)聚糖。在一些实施方案中,聚糖是天然存在的哺乳动物糖型。
糖基化可通过任何本领域已知的方式实现。在一些实施方案中,所述糖基化通过能够在细胞中n-连接糖基化的结合多肽的表达实现。可采用任何天然或工程化的细胞(例如原核或真核)。一般而言,采用哺乳动物细胞以实现糖基化。在哺乳动物细胞中产生的n-聚糖通常是指为复杂的、高甘露糖、混合型n-聚糖(参见例如drickamerk,taylorme(2006).introductiontoglycobiology,2nded.,其在本文通过提述以其全文并入)。这些复杂的n-聚糖具有的结构通常有二至六个外部分支,所述外部分支具有与内部核心结构man3glcnac2连接的唾液酸乳糖胺序列。复杂的n-聚糖具有终止于寡糖的交替的glcnac和半乳糖(gal)残基的至少一个分支,例如至少两个,如例如:neunac-;neuacα2,6galnacα1-;neuacα2,3galβ1,3galnacα1-和neuacα2,3/6galβ1,4glcnacβ1.;此外,硫酸酯可存在于半乳糖、galnac和glcnac残基上。neuac可以是o-乙酰化的或由neugl(n-羟乙酰神经氨酸)替代。复杂的n-聚糖还可以具有双开叉(bisecting)的glcnac和核心岩藻糖(fuc)的链间取代。
此外或可替换地,糖基化可在体外通过酶的方式获得或修饰。例如,可采用一种或多种糖基转移酶添加特定的糖残基至结合多肽的天然或工程化的n-聚糖,且可采用一种或多种糖苷酶以从n-连接聚糖去除不想要的糖。这种酶的方式为本领域已知(参见例如wo2007/005786,其在本文通过提述以其全文并入)。
iv.免疫效应功能和fc修饰
在一些实施方案中,结合多肽可包含介导一种或多种效应功能的抗体恒定区(例如igg恒定区,例如人igg恒定区,例如人igg1或igg4恒定区)。例如,c1-复合体与抗体恒定区的结合可激活补体系统。补体系统的激活在细胞病原体的调理作用和裂解中至关重要。补体系统的激活还刺激炎性响应且还可以参与自身免疫超敏反应。此外,抗体与在多种细胞上的受体经由fc区结合(在抗体fc区的fc受体结合位点与细胞上的fc受体(fcrs)结合)。存在多种特异性针对不同种类的抗体的fc受体,包括igg(γ受体)、ige(ε受体)、iga(α受体)和igm(μ受体)。抗体与细胞表面上的fc受体的结合激发多种重要且多样的生物响应,包括抗体包被的微粒的吞噬和破坏、免疫复合体的清除、抗体包被的靶细胞由杀伤细胞裂解(称为抗体依赖的细胞介导毒性或adcc)、炎性调节子的释放、胎盘转移和免疫球蛋白产生的控制。在一些实施方案中,本发明中表征的结合多肽(例如抗体或其抗原结合片段)与fc-γ受体结合。在可替换的实施方案中,结合多肽可包含缺乏一种或多种效应功能(例如adcc活性)且/或不能与fcγ受体结合的恒定区。
一些实施方案包括抗体,其中缺失或以其他方式改变了在一个或多个恒定区结构域中的至少一个氨基酸进而提供预期的生化特性,如与具有大致相同的免疫原性的完整或未改变的抗体相比时降低或增强的效应功能、非共价二聚化的能力、增加的在肿瘤位点定位的能力、降低的血清半衰期或增加的血清半衰期。例如,本文描述的用于在诊断和治疗方法中使用的一些抗体是结构域缺失的抗体,其包含与免疫球蛋白重链相似的多肽链,但缺少至少一个或多个重链结构域的一部分。例如,在一些抗体中,会缺失修饰的抗体恒定区的一个完整的结构域,例如,缺失ch2结构域的全部或部分。
在一些其他实施方案中,结合多肽包含源自不同抗体同型的恒定区(例如来自两个或多个人igg1、igg2、igg3或igg4的恒定区)。在其他实施方案中,结合多肽包含嵌合铰链(即包含源自不同抗体同型的铰链结构域(例如来自igg4分子的上铰链结构域和igg1中铰链结构域)的铰链区的铰链)。在一个实施方案中,结合多肽包含来自人igg4分子的fc区或其部分和在分子的核心铰链区中的ser228pro突变(eu编号)。
在一些实施方案中,可使用本领域已知的技术突变fc部分以增加或减少效应功能。例如,恒定区结构域的缺失或失活(通过点突变或其他方式)可降低循环的修饰抗体的fc受体结合,由此增加肿瘤定位。在其他情况中,与本发明相符的恒定区修饰可缓和补体结合且因此减少血清半衰期和缀合的细胞毒素的非特异性缔合。而恒定区的其他修饰可用于修饰由于增加的抗原特异性或柔性而允许增强的定位的二硫化物连接基或寡糖部分。可使用本领域已知的免疫技术而无需过度实验来轻易测量和量化所得修饰的生理概貌、生物利用度和其他生化效果,如肿瘤定位、生物分布和血清半衰期。
在一些实施方案中,在本发明中表征的抗体中采用的fc结构域是fc变体。如本文使用的术语"fc变体"是指相对于所述fc结构域所来源的野生型fc结构域具有至少一个氨基酸取代的fc结构域。例如,其中所述fc结构域源自人igg1抗体、所述人igg1fc结构域的fc变体相对于所述fc结构域包含至少一个氨基酸取代。
fc变体的氨基酸取代可以位于fc结构域内的任何位置(即任何eu惯例的氨基酸位置)。在一个实施方案中,所述fc变体包含位于铰链结构域或其部分中的氨基酸位置处的取代。在另一实施方案中,所述fc变体包含位于ch2结构域或其部分中的氨基酸位置处的取代。在另一实施方案中,所述fc变体包含位于ch3结构域或其部分中的氨基酸位置处的取代。在另一实施方案中,所述fc变体包含位于ch4结构域或其部分中的氨基酸位置处的取代。
结合多肽可采用任何本领域认可的已知在效应功能和/或fcr结合中赋予改进(例如,降低或增强)的fc变体。所述fc变体可包括例如下列中公开的任何氨基酸取代:国际pct公开wo88/07089a1、wo96/14339a1、wo98/05787a1、wo98/23289a1、wo99/51642a1、wo99/58572a1、wo00/09560a2、wo00/32767a1、wo00/42072a2、wo02/44215a2、wo02/060919a2、wo03/074569a2、wo04/016750a2、wo04/029207a2、wo04/035752a2、wo04/063351a2、wo04/074455a2、wo04/099249a2、wo05/040217a2、wo05/070963a1、wo05/077981a2、wo05/092925a2、wo05/123780a2、wo06/019447a1、wo06/047350a2和wo06/085967a2或美国专利号5,648,260;5,739,277;5,834,250;5,869,046;6,096,871;6,121,022;6,194,551;6,242,195;6,277,375;6,528,624;6,538,124;6,737,056;6,821,505;6,998,253;和7,083,784,其每一项在本文通过提述以其全文并入。在一个示例性的实施方案中,结合多肽可包含在eu位置268处含有氨基酸取代的fc变体(例如h268d或h268e)。在另一示例性的实施方案中,结合多肽可在eu位置239处(例如s239d或s239e)和/或eu位置332处(例如i332d或i332q)包含氨基酸取代。
在一些实施方案中,本发明的结合多肽可包含含有改变抗体的抗原依赖效应功能特别是结合多肽的循环半衰期的氨基酸取代的fc变体。当与缺乏这些取代的结合多肽比较时,这种结合多肽展示与fcrn增加的或降低的结合,因此在血清中分别具有增加的或减少的半衰期。具有针对fcrn改进的亲和力的fc变体预期具有较长的血清半衰期,且当期望施用的抗体具有较长半衰期时,这种分子在治疗哺乳动物的方法中具有有效应用,例如治疗慢性疾病或病症。相反,具有降低的fcrn结合亲和力的fc变体预期具有较短半衰期且这种分子同样有效,例如,当缩短的循环时间可能有利时用于哺乳动物的施用,例如用于体内诊断成像或在当存在于用于时期延长的循环中时初始抗体具有毒副作用的情况中。具有降低的fcrn结合亲和力的fc变体也不大可能穿过胎盘,且因此可在怀孕妇女中有效治疗疾病或病症。此外,其中可能期望降低的fcrn结合亲和力的其他应用包括定位在脑、肾和/或肝的应用。在一个示例性的实施方案中,改变的结合多肽(例如抗体或其抗原结合片段)展示降低的从血管穿过肾小球表皮的运输。在另一实施方案中,改变的结合多肽(例如抗体或其抗原结合片段)展示从脑穿过血脑屏障(bbb)进入血管间隙的降低的运输。在一个实施方案中,具有改变的fcrn结合的抗体包含在fc结构域的"fcrn结合环"内具有一个或多个氨基酸取代的fc结构域。所述fcrn结合环由氨基酸残基280-299(根据eu编号)组成。改变fcrn结合活性的示例性氨基酸取代公开于国际pct公开no.wo05/047327,其在本文通过提述以其全文并入。在一些示例性的实施方案中,结合多肽(例如抗体或其抗原结合片段)包含具有一个或多个下列取代的fc结构域:v284e、h285e、n286d、k290e和s304d(eu编号)。而在其他示例性的实施方案中,结合分子包含具有双突变h433k/n434f的人fc结构域(参见例如美国专利号8,163,881)。
在其他实施方案中,用于本文描述的诊断和治疗方法中使用的结合多肽具有恒定区,例如igg1或igg4重链恒定区,对其改变以降低或消除糖基化。例如,结合多肽(例如抗体或其抗原结合片段)还可包含含有改变抗体fc糖基化的氨基酸取代的fc变体。例如,所述fc变体可具有降低的糖基化(例如n-或o-连接糖基化)。在示例性的实施方案中,所述fc变体包含通常发现于氨基酸位置297(eu编号)处的n-连接聚糖降低的糖基化。在另一实施方案中,所述抗体在糖基化基序附近或之内具有氨基酸取代,例如,包含氨基酸序列nxt或nxs的n连接糖基化基序。在具体的实施方案中,所述抗体包含在氨基酸位置228或299(eu编号)处具有氨基酸取代的fc变体。在更具体的实施方案中,所述抗体包含含有s228p和t299a突变(eu编号)的igg1或igg4恒定区。
赋予降低或改变的糖基化的示例性氨基酸取代公开于国际pct公开no.wo05/018572中,其在本文通过提述以其全文并入。在优选的实施方案中,修饰本发明的结合多肽以消除糖基化。可将这种结合多肽称作"agly"结合多肽(例如"agly"抗体)。不受理论限制,相信"agly"结合多肽在体内可具有改进的安全性和稳定性。agly结合多肽可以是任何同型或其亚类,例如igg1、igg2、igg3或igg4。在一些实施方案中,agly结合多肽包含igg4抗体的无糖基化fc区,其缺乏fc-效应功能,由此消除了潜在的对表达il-6的正常生命器官的fc介导的毒性。而在其他实施方案中,本发明的结合多肽包含改变的聚糖。例如,所述抗体可在fc区asn297处的n-聚糖上具有降低数目的岩藻糖残基(即为无岩藻糖化)。无岩藻糖化增加nk细胞上的fcγrii结合并有力地增加adcc。已显示包含抗il-6scfv和抗cd3scfv的双抗体通过adcc诱导对表达il-6的细胞的杀伤。相应地,在一个实施方案中,将无岩藻糖化的抗il-6抗体用于靶向和杀伤il-6表达细胞。在另一实施方案中,所述结合多肽可在fc区asn297处的n-聚糖上具有改变数目的唾液酸残基。多种本领域认可的方法可用于制备"agly"抗体或具有改变的聚糖的抗体。例如,基因工程化的具有修饰的糖基化途径(例如糖基转移酶缺失)的宿主细胞(例如修饰的酵母,例如毕赤酵母(pichia)或cho细胞)可用于产生这种抗体。
v.效应部分
在一些实施方案中,本公开的结合多肽包含效应部分(例如药物部分和靶向部分)。一般而言这些效应部分与结合多肽上的n-连接聚糖缀合(直接或通过接头部分),(例如与ch2结构域的n298(eu编号)和/或ch1结构域的n114(kabat编号)连接的n-连接聚糖)。在一些实施方案中,所述结合多肽是包含两个在kabat位置114处具有聚糖的ch1结构域的全长抗体,其中所述两聚糖都与一个或多个效应部分缀合。
可将任何效应部分添加至本文公开的结合多肽。所述效应部分通常将非天然功能添加至改变的抗体或其片段而不显著改变结合多肽的内在活性。所述效应部分可以是例如但不限于靶向部分(例如糖肽或新聚糖)。本发明修饰的结合多肽(例如抗体)可包含一个或多个效应部分,其可相同或不同。
在一个实施方案中,效应部分可以是是式(i):
h2n-q-con-x
式(i),
其中:
a)q是nh或o;且
b)con是连接体部分;且
c)x是效应部分(例如如本文定义的靶向部分)。
连接体部分将治疗剂与h2n-q-连接。所述连接体部分可包括本领域的技术人员已知的任何合适的组件(component)的至少一种,包括例如,亚烷基组件、聚乙二醇组件、多聚(甘氨酸)组件、多聚(噁唑啉)组件、羰基组件、源自半胱氨酰胺的组件、源自与瓜氨酸偶联的缬氨酸的组件和源自4-氨基苄基氨基甲酸的组件或其任何组合。
在一些实施方案中,连接体部分(con)可以包含反应步骤中形成的分子的一部分,所述反应步骤形成缀合有效应部分的结合多肽。例如,连接体部分可以包含一个或多个如下结构式:
在另一个实施方案中,式(i)的效应部分可以是式(ia)的:
h2n-q-ch2-c(o)-z-x
式(ia),
其中:
a)q是nh或o;且
b)z是-cys-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f,
其中:
i.cys是源自半胱氨酰胺的组件;
ii.mc是源自马来酰亚胺的组件;
iii.vc是源自与瓜氨酸偶联的缬氨酸的组件;
iv.pabc是源自4-氨基苄基氨基甲酸的组件;
v.x是效应部分(例如如本文定义的靶向部分);
vi.a是0或1;
vii.b是0或1;
viii.c是0或1;且
ix.f是0或1。
所述“源自半胱氨酰胺的组件”是附接于h2n-q-ch2-c(o)-的点。在一个实施方案中,所述“源自半胱氨酰胺的组件”可指代具有如下结构的效应部分的一个或多个部分:
在一个实施方案中,所述效应部分的“cys”组件可包括一个这样的部分。例如,如下结构显示具有一个这样的部分的效应部分(其中所述“cys”组件用虚线框表示):
在另一个实施方案中,所述效应部分的“cys”组件可包括两个或更多个这样的部分。例如,如下部分包含两个这样的部分:
如从所述结构可见,每个“cys”组件带有-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f-x基团。
在一个实施方案中,短语“源自马来酰亚胺的组件”可指代具有如下结构的效应部分的任何部分:
其中d是2至5的整数。在效应部分中的任何cys-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f-x基团中包括的mc组件的数目由下标“a”表示且可以是0或1。在一个实施方案中,a是1。在另一实施方案中,b是0。
在一个实施方案中,所述“cys”组件可与“mc”组件经由“cys”组件中的硫原子连接,如下列结构中的虚线框所示:
在一个实施方案中,短语“源自与瓜氨酸偶联的缬氨酸的组件”可指代具有下列结构的效应部分的任何部分:
包括在效应部分中任何cys-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f-x基团中的vc组件的数目由下标“b”表示且可以是0或1。在一个实施方案中,b是1。在另一实施方案中,b是0。
在一个实施方案中,术语“源自4-氨基苄基氨基甲酸的组件”可指代具有下列结构的效应部分的任何部分:
包括在效应部分中的任何cys-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f-x基团中的pabc组件的数目由下标“c”表示且可以是0或1。在一个实施方案中,c是1。在另一实施方案中,c是0。
在一个实施方案中,“c16h32o8c2h4”指代如下结构:
包括在效应部分中任何cys-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f-x基团中的c16h32o8单元数目由下标“f”表示,在一个实施方案中,f是1。在另一实施方案中,f是0。
在一个实施方案中,a是1,b是1,c是1且f是0。
a)治疗性效应部分
在一些实施方案中,本公开的结合多肽与包含治疗剂的效应部分例如药物部分(或其前体药物)或放射性标记的化合物缀合。在一个实施方案中,所述治疗剂是细胞毒素。示例性的细胞毒性治疗剂阐述于本文的表1中。
表1.示例性的细胞毒性治疗剂
进一步的示例性药物部分包括抗炎、抗癌、抗感染(例如抗真菌、抗细菌、抗寄生物、抗病毒等)和麻醉治疗剂。在进一步的实施方案中,所述药物部分是抗癌剂。示例性的抗癌剂包括但不限于细胞抑制剂、酶抑制剂、基因调节剂、细胞毒性核苷、微管蛋白结合剂或微管蛋白抑制剂、蛋白酶体抑制剂、激素和激素拮抗剂、抗血管生成剂等等。示例性的抑制细胞生长的抗癌剂(cytostaticanti-canceragent)包括烷化剂如蒽环类家族药物(例如阿霉素、洋红霉素、环孢菌素a、氯喹、甲氨喋呤、光辉霉素(mithramycin)、甲基丝裂霉素(porfiromycin)、链黑菌素、甲基丝裂霉素、蒽二酮类(anthracenediones)和环乙亚胺类(aziridines))。其他抑制细胞生长的抗癌剂包括dna合成抑制剂(例如甲氨蝶呤和二氯甲胺蝶呤、3-氨基-1,2,4-苯并三嗪-1,4-二氧化物、氨基蝶呤、胞嘧啶β-d-阿拉伯呋喃糖苷、5-氟-5'-脱氧尿苷、5-氟尿嘧啶、更昔洛韦、羟基脲、放线菌素-d和丝裂霉素c)、dna-嵌入剂或交联剂(例如博来霉素、卡铂、卡莫司汀、苯丁酸氮芥、环磷酰胺、顺-二氨基铂(ii)二氯化物(顺铂)、美法仑、米托蒽醌和奥沙利铂)和dna-rna转录调节剂(例如放线菌素d、柔红霉素、阿霉素、高三尖杉酯和伊达比星)。其他与本公开相容的示例性的抑制细胞生长剂包括安沙霉素苯醌类、醌类衍生物(quinonoidderivatives)(例如喹诺酮类药物、染料木素、bactacyclin)、白消安、异环磷酰胺、二氯甲基二乙胺、三乙撑亚胺苯醌、地吖醌、卡巴醌、吲哚醌eo9、二乙烯亚氨基苯醌甲基dzq、三亚乙基磷酰胺和亚硝脲化合物(例如卡莫司汀、洛莫司汀、司莫司汀)。
示例性的细胞毒性核苷抗癌剂包括但不限于:阿糖腺苷、阿糖胞苷(cytarabine)、阿糖胞苷(cytosinearabinoside)、5-氟尿嘧啶、氟达拉滨、氟尿苷、替加氟和6-巯基嘌呤。示例性的抗癌微管蛋白结合剂包括但不限于紫杉烷类(例如紫杉醇、多西紫杉醇、紫杉烷)、诺考达唑、根霉素、多拉司他汀(例如多拉司他汀-10、-11或-15),秋水仙素和类秋水仙素(colchicinoids)(例如zd6126)、考布他汀(例如考布他汀a-4、ave-6032)和长春花生物碱类(例如长春碱、长春新碱、长春地辛和长春瑞滨(诺维本))。示例性的抗癌激素和激素拮抗剂包括但不限于:皮质类固醇(例如强的松)、孕激素(例如羟孕酮或medroprogesterone)、雌激素(例如己烯雌酚)、抗雌激素(例如他莫昔芬)、雄激素(例如睾酮)、芳香酶抑制剂(例如氨鲁米特)、17-(烯丙基氨基)-17-去甲氧基格尔德霉素、4-氨基-1,8-萘二甲酰亚胺、芹菜素、布雷菲德菌素a、西咪替丁、二氯亚甲基二膦酸、亮脯利特(亮丙瑞林)、促黄体生成激素释放激素、皮斐松-a、雷帕霉素、性激素结合球蛋白和毒胡萝卜素。示例性的抗癌、抗血管生成化合物包括但不限于:血管抑素ki-3、dl-a-二氟甲基鸟氨酸、内皮抑素、烟曲霉素、染料木素、米诺环素、星形孢菌素和(±)-沙利度胺。
示例性的抗癌酶抑制剂包括但不限于:s(+)-喜树碱、姜黄素、(-)-鱼藤素、5,6-二氯苯咪唑1-β-d-呋喃核糖苷、依托泊苷、福美坦、福司曲星、hispidin、2-亚氨基-1-咪唑烷乙酸(环肌酸(cyclocreatine))、麦维诺素(mevinolin)、曲古抑菌素a、酪氨酸磷酸化抑制剂ag34和酪氨酸磷酸化抑制剂ag879。
示例性的抗癌基因调节剂包括但不限于:5-氮杂-2'-脱氧胞苷、5-氮杂胞苷、胆钙化固醇(维生素d3)、4-羟基他莫昔芬、褪黑激素、米非司酮、雷洛昔芬、反式-视黄醛(维生素a醛)、视黄酸、维生素a酸、9-顺式-视黄酸、13-顺式-视黄酸、视黄醇(维生素a)、他莫昔芬和曲格列酮。
其他抗癌剂的种类包括但不限于:蝶啶家族药物、烯二炔类(diynenes)和鬼臼毒素类。这些种类特别有效的成员包括例如甲氨喋呤、鬼臼毒素或鬼臼毒素衍生物如依托泊苷或磷酸依托泊苷、异长春碱、长春地辛、环氧长春碱等等。
还有其他与本文教导相容的抗癌剂包括奥瑞他汀类(例如奥瑞他汀e和单甲基奥瑞他汀e)、格尔德霉素、卡奇霉素、短杆菌肽d、美登木素生物碱(maytansanoid)(例如美登木素)、新制癌菌素、托泊替康、紫杉烷类、细胞松弛素b、溴化乙锭、吐根碱、替尼泊苷、秋水仙碱、二羟基蒽二酮(dihydroxyanthracindione)、米托蒽醌、普鲁卡因、丁卡因、利多卡因、普萘洛尔、嘌呤霉素和其类似物或其同系物。
还有其他与本文教导相容的抗癌剂包括茅屋霉素衍生物、美登木素衍生物、cryptophycine衍生物、蒽环类衍生物、双膦酸盐衍生物、细霉素衍生物(leptomycinderivative)、链黑菌素衍生物、奥瑞他汀衍生物(auristatinederivative)和倍癌霉素衍生物(duocarmycinderivative)。
另一种可用作药物部分的相容抗癌剂是放射增敏药物,其有效针对肿瘤或免疫反应性细胞。这种药物部分增强对电离辐射的敏感性,由此增加放疗的效力。不受理论限制,但用放射增敏药物部分修饰并通过肿瘤细胞内化的抗体将更靠近核递送放射增敏剂,此处放射增敏将最大化。失去放射增敏剂部分的抗体将迅速从血液中清除,将剩余的放射增敏剂定位在靶向的肿瘤中并提供在正常组织中的最小吸收。从血液清除后,辅助的放疗可通过特异性针对肿瘤的体外射线照射、直接植入肿瘤的放射性或用相同修饰抗体的全身放射免疫治疗施用。
在一个实施方案中,所述治疗剂包含具有能够引起核dna中多重链断裂的高能电离辐射的放射性核素或放射性标记,其导致细胞死亡。示例性的高能放射性核素包括:90y、125i、131i、123i、111in、105rh、153sm、67cu、67ga、166ho、177lu、186re和188re。这些同位素通常产生具有短路径长度的高能的α-或β微粒。这种放射性核素杀伤其邻近距离的细胞,例如缀合物附接或进入的肿瘤细胞(neoplasticcell)。其对未定位的细胞具有很小作用或无作用且基本上是非免疫原性的。可替换地,高能同位素可通过同位素的热辐射(否则该同位素是稳定的)生成,例如如在硼中子-捕获疗法中(guan等.,pnas,95:13206-10,1998)。
在一个实施方案中,所述治疗剂选自mmae、mmaf和peg8-do110。
示例性的治疗效应部分包括以下结构:
在一个实施方案中,效应部分选自:
在一些实施方案中,效应部分包含多于一种治疗剂。这些多重治疗剂可以相同或不同。
b)诊断效应部分
在一些实施方案中,本公开的结合多肽缀合至包含诊断剂的效应部分。在一个实施方案中,所述诊断剂是可检测的小分子标记例如生物素、荧光团、发色团、自旋共振探针、显象剂或放射性标记。示例性的荧光团包含荧光染料(例如荧光素、罗丹明等等)和其他发光分子(例如鲁米诺)。荧光团可以是环境敏感的,因此如果其位于在结合底物时经历结构变化的经修饰的结合多肽中的一个或多个残基附近,则其荧光发生变化(例如丹酰基探针)。示例性的放射标记包括含有原子的小分子,所述原子带有一个或多个低灵敏度的核(13c、15n、2h、125i、124i、123i、99tc、43k、52fe、64cu、68ga、111in等等)。放射性核素是在施用和定位至成像位点间经过的时间后具有适于允许活性或检测的半衰期的γ、光子或发射正电子的放射性核素。
在一个实施方案中,所述诊断剂是多肽。示例性的诊断多肽包括具有发荧光或显色活性(例如裂解形成荧光团或发色团作为产物的底物的能力)的酶,(即报告蛋白如萤光素酶)。其他诊断蛋白可具有固有发荧光或显色活性(例如来自生物发光的海洋生物的绿色、红色和黄色荧光生物发光的水母发光蛋白)或其可包含含有一个或多个低能放射性原子核(13c、15n、2h、125i、124i、123i、99tc、43k、52fe、64cu、68ga、111in等等)的蛋白。
对于放射性标记的缀合物在与本公开相关联时的用途,本公开的结合多肽可直接标记(如通过碘化)或可通过螯合剂的使用间接标记。如本文使用,短语"间接标记"和"间接标记的方式"都意为螯合剂与结合多肽共价附接且至少一种放射性核素与螯合剂缔合。由于其与多肽和放射性同位素都结合,因此这种螯合剂通常被称为双功能螯合剂。示例性的螯合剂包含1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(1-isothiocycmatobenzyl-3-methyldiothelenetriaminepentaaceticacid)("mx-dtpa")和环己基二亚乙基三胺五乙酸("chx-dtpa")衍生物。其他螯合剂包含p-dota和edta衍生物。具体的用于间接标记的放射性核素包括111in和90y。大多数的成像研究采用5mci111in-标记的抗体,由于该剂量既安全并且与低剂量相比又具有增加的成像效力,在抗体施用后的三至六天发生最佳成像。参见例如j.nuc.med.26:3328andcarraguillo等,(1985),j.nuc.med.26:67。用于直接标记的放射性核素可以是例如131i。本领域的技术人员将理解非放射性缀合物还可依赖于所选的待缀合的作用剂来装配。
在一些实施方案中,所述诊断效应部分是fret(荧光共振能量转移)探针。fret已用于多种诊断应用包括癌症诊断。fret探针可包括连接fret探针供体和受体部分的可裂解接头(酶敏感性或ph接头),其中裂解导致增强的荧光(包括近红外)(参见例如a.cobos-correaet.al.membrane-boundfretprobevisualizesmmp12activityinpulmonaryinflammation,naturechemicalbiology(2009),5(9),628-63;s.gehriget.al.spatiallyresolvedmonitoringofneutrophilelastaseactivitywithratiometricfluorescentreporters(2012)angew.chem.int.ed.,51,6258–6261)。
在一个实施方案中,效应部分选自:
c)官能化的效应部分
在一些实施方案中,可将效应部分官能化以在效应部分本身以外包含额外的基团。例如,所述效应部分可包含可裂解接头,其在特定条件下从结合多肽释放效应部分。在示例性的实施方案中,所述效应部分可包含可由细胞酶裂解的接头且/或是ph敏感的接头。此外或可替换地,所述效应部分可包含二硫键,当吸收入细胞时其可通过细胞内谷胱甘肽裂解。示例性的二硫化物和ph敏感接头提供如下:
而在其他实施方案中,所述效应部分可包含亲水性和生物相容性部分如多聚(甘氨酸)、多聚(噁唑啉)或peg部分。示例性的结构(“y”)提供如下:
在一些实施方案中,效应部分含有氨氧基基团,其经由稳定的肟连接基促进与结合多肽的缀合。
在一些实施方案中,效应部分含有酰肼和/或n-烷基化的肼基团以促进经由稳定的腙连接基与结合多肽的缀合。示例性的含有氨基氧基的效应部分如本文表14所示。
表14.示例性的肼和/或腙效应部分
d)靶向部分
在一些实施方案中,效应部分包含特异性地与一个或多个靶分子结合的靶向部分。可采用任何类型的靶向部分包括但不限于蛋白、核酸、脂质、糖(例如聚糖)和其组合(例如糖蛋白、糖肽和糖脂)。在一些实施方案中,所述靶向部分是糖或糖肽。在一些实施方案中,所述靶向部分是三价糖肽(例如含有糖肽的三价galnac聚糖或含有糖肽的三价半乳糖)。在一个具体实施方案中,所述含有多肽的三价半乳糖是半乳糖3-cys3gly4。在一些实施方案中,靶向部分是聚糖。在一些实施方案中,靶向部分可以是天然或非天然存在的分子。适于用于缀合的靶向部分可以包括含有氨基氧基接头的那些(参见例如图45和46)。
本发明中描述的靶向部分可以在体外或体内结合任何类型的细胞,包括动物(例如哺乳动物),植物或昆虫细胞,但不限于此。细胞可以是内胚层,中胚层或外胚层起源的,并且可以包括任何细胞类型。在一些实施方案中,靶向部分结合至细胞,例如哺乳动物细胞,有利于将结合多肽递送至靶细胞,例如改善细胞靶向和/或摄取。示例性靶细胞包括但不限于免疫细胞(例如淋巴细胞如b细胞,t细胞,自然杀伤(nk)细胞,嗜碱性粒细胞,巨噬细胞或树突状细胞),肝细胞(例如肝细胞或非实质细胞如肝窦内皮细胞,kupffer细胞或肝星状细胞),肿瘤细胞(例如任何恶性或良性细胞,包括肝癌细胞,肺癌细胞,肉瘤细胞,白血病细胞或淋巴瘤细胞),血管细胞(例如主动脉内皮细胞或肺动脉内皮细胞),上皮细胞(例如单层鳞状上皮细胞(simplesquamousepithelialcells),单层柱状上皮细胞(simplecolumnarepithelialcells),假复层柱状上皮细胞或复层鳞状上皮细胞)或间充质细胞(例如淋巴和循环系统的细胞,骨和软骨细胞)。
在一个实施方案中,结合多肽由细胞内化。在另一个实施方案中,由细胞内化的结合多肽的量大于由细胞内化的缺乏靶向部分的参考结合多肽的量。
在一个实施方案中,靶向部分结合至靶细胞上的受体。例如,靶向部分可以包含甘露糖6磷酸部分,其结合至细胞上的甘露糖6磷酸受体。在其他示例性实施方案中,靶向部分结合至靶细胞上的siglec。示例性的siglec包括唾液酸粘附素(siglec-1)、cd22(siglec-2)、cd33(siglec-3)、mag(siglec-4)、siglec-5、siglec-6、siglec-7、siglec-8、siglec-9、siglec-10、siglec-11、siglec-12、siglec-14、或siglec-15。在其他实施方案中,靶向部分包含α2,3-、α2,6-、或α2,8-连接的唾液酸残基。在又一个实施方案中,靶向部分包含α2,3-唾液酸乳糖部分或α2,6-唾液酸乳糖部分。其他示例性受体包括c型凝集素受体、半乳凝素和l型凝集素受体。示例性的凝集素受体包括:tdec-205、巨噬细胞甘露糖受体(mmr)、dectin-1、dectin-2、巨噬细胞诱导型c型凝集素(mincle)、树突细胞特异性icam3结合非整合素(dc-sign、cd209)、dcnk凝集素群受体-1(dngr-1)、langerin(cd207)、cd169、凝集蛋白聚糖、无唾液酸糖蛋白受体(asgpr)、dcir、mgl、dc受体、胶原凝集素、选择素、nk细胞受体、多ctld内吞受体、reg组(vii型)凝集素、软骨凝集素、四连接素、多囊蛋白、吸引素(atrn)、嗜酸性粒细胞主要碱性蛋白(embp)、dgcr2、血栓调节素、bimlec、seec、或cbcp/frem1/qbrick。
本发明的结合多肽可用于通过靶向糖受体(例如甘露糖-6-磷酸受体,甘露糖受体和无唾液酸糖蛋白受体)在多种疾病中将有毒化合物和有害物质移除至肝脏。请参阅:ganesan,l.p等:rapidandefficientclearanceofblood-bornevirusbyliversinusoidalendothelium.plospathogens2011,9:1;和monnier,v.m等:glucosepane:apoorlyunderstoodadvancedglycationendproductofgrowingimportancefordiabetesanditscomplications.clinchemlabmed2014;52:21。
本发明的结合多肽也可用于通过靶向不同细胞受体而靶向肿瘤细胞,所述细胞受体包括但不限于:糖受体,无唾液酸糖蛋白受体和siglec。请参阅:chen,w.c等:invivotargetingofb-celllymphomawithglycanligandsofcd22.blood2010,115:4778;chen,w.c等:targetingblymphomawithnanoparticlesbearingglycanligandsofcd22.leuklymphoma2012,53:208;hatakeyama,s等:targeteddrugdeliverytotumorvasculaturebyacarbohydratemimeticpeptide.pnas,2011,108:19587;hong,f等:β-glucanfunctionsasanadjuvantformonoclonalantibodyimmunotherapybyrecruitingtumoricidalgranulocytesaskillercells.cancerres.2003,23:9023;kawasakia,n等:targeteddeliveryoflipidantigentomacrophagesviathecd169/sialoadhesinendocyticpathwayinducesrobustinvariantnaturalkillertcellactivation.pnas2013,110:7826;和medina,s.h等:n-acetylgalactosamine-functionalizeddendrimersashepaticcancercell-targetedcarriers.biomaterials2011,32:4118。
本发明的结合肽还可用于通过各种受体来调节免疫应答,所述受体包括但不限于糖受体,dc-sign或siglec。请参阅:anthony,r.m等:recapitulationofiviganti-inflammatoryactivitywitharecombinantiggfc.science2008,320:373;anthony,r.m等:identificationofareceptorrequiredfortheanti-inflammatoryactivityofivig.pnas2008,105:19571;kaneko,y等:anti-inflammatoryactivityofimmunoglobulingresultingfromfcsialylation.science2006,313:670;和mattner,j等:exogenousandendogenousglycolipidantigensactivatenktcellsduringmicrobialinfections.nature2005,434:525。
在一个实施方案中,靶向部分是糖肽。在又一个实施方案中,靶向部分是三-半乳糖基化的糖肽,例如乳糖3-cys3gly4(示于如下式v);
e)peg部分
在其他方面,效应部分是包含聚(乙二醇)的部分(peg,peo或poe)。peg是环氧乙烷的低聚物或聚合物,并具有化学结构h-(o-ch2-ch2)n-oh,其中括号中的元素重复。聚乙二醇化(或peg化)是其中peg聚合物链连接至另一分子(例如结合多肽)的方法,然后将其描述为聚乙二醇化(或peg化)。聚乙二醇化可以降低免疫原性和抗原性,并增加其所连接的分子的流体动力学尺寸(溶液中的大小),减少肾清除和延长循环时间。聚乙二醇化也可使分子更易溶于水。在本发明的一个实施方案中,peg部分可以包含单-peg,双-peg或三-peg。在另一个实施方案中,peg部分包含3至3.5个peg。
vi.效应部分与结合多肽的缀合
在一些实施方案中,效应部分与改变的结合多肽的氧化聚糖(例如氧化的n-连接聚糖)(例如在抗体ch1结构域n114处工程化的聚糖或在抗体f结构域的n297处天然的聚糖)缀合(直接或通过接头部分)。术语“氧化聚糖”意为已氧化的聚糖上的醇取代基,其提供羰基取代基。羰基取代基可与合适的氮亲核试剂发生发应以形成碳-氮双键。例如,羰基基团与氨氧基团或肼基基团的反应将分别形成肟或肼。在一个实施方案中,所述羰基取代基是醛。合适的氧化聚糖包括氧化半乳糖和氧化唾液酸。
在一个实施方案中,式(ii)的修饰的多肽可以为式(ii):
ab(gal-c(o)h)x(gal-sia-c(o)h)y
式(ii),
其中
a)ab是如本文定义的抗体或其他结合多肽;
b)gal是源自半乳糖的组件;
c)sia是源自唾液酸的组件;
d)x是0至5;且
e)y是0至5,
其中x和y中至少一个不为0。
可采用任何本领域认可的化学方法来将效应部分(例如包含接头部分的效应部分)与聚糖缀合(参见例如hermanson,g.t.,bioconjugatetechniques.academicpress(1996),其在本文通过提述以其全文并入)。在一些实施方案中,聚糖的糖残基(例如唾液酸或半乳糖残基)首先氧化(例如使用高碘酸钠处理唾液酸或使用半乳糖氧化酶处理半乳糖)以生成具有反应性的醛基基团。该醛基基团与效应部分的氨氧基基团或肼基基团发生发应以分别形成肟或腙接头。采用这种通用反应方案的示例性方法阐述于实施例10至15中。
在一些实施方案中,结合多肽的天然或工程化的聚糖首先在体外用糖基转移酶预处理以提供具有合适的反应性的末端糖残基。例如,唾液酸化可以首先使用半乳糖基转移酶(galt)和唾液酸转移酶(sialt)的组合实现。在一些实施方案中,缺乏半乳糖(g0f或g0)或仅包含一个半乳糖(g1f或g1)的双触角聚糖可转换成适于缀合的高阶半乳糖基化或唾液酸化结构(g1f、g1、g2f、g2、g1s1f、g1s1、g2s1f、g2s1、g2s2f或g2s2)。
用于产生唾液酸化的糖缀合物的示例性缀合方案示于图30c。用于产生唾液酸化的糖缀合物的示例性缀合方案示于图30b。唾液酸残基通过酶的方式且位点特异性地使用半乳糖基转移酶(galt)和唾液酸转移酶(sialt)的组合引入抗体的聚糖(例如在asn-297处的天然聚糖)。引入的唾液酸残基随后用低浓度的高碘酸钠氧化以获得可与接头(例如氨氧基药物接头)适当发生反应的具有反应性的唾液酸醛基以生成抗体-效应部分缀合物(例如肟连接的抗体-效应部分缀合物)。通过使用体外重塑控制聚糖数目和唾液酸残基数目,本领域的技术人员可具有对于抗体-效应部分缀合物的抗体-药物比率(dar)的精确控制。例如,如果将~1个唾液酸添加至每条重链中的单个双触角聚糖(a1f)上,那么可以均匀地获得dar为2的抗体或结合多肽。
氧化和氧化剂
通过单糖的氧化和氨基酸的氧化,氧化可以对抗体的完整性产生不利影响。已知甲硫氨酸残基(包括met-252和met-428(位于fcch3区中,临近fcrn结合位点))的氧化会影响fcrn结合,这对延长抗体血清半衰期至关重要(wang,w等.(2011)。impactofmethionineoxidationinhumanigg1fconserumhalf-lifeofmonoclonalantibodies.molimmunol48,860-6)。因此,之前已经尝试减少用于处理包含聚糖的结合蛋白的氧化剂(例如高碘酸氧化酶或半乳糖氧化酶)的量,以便产生用于与效应部分缀合的氧化基团。
本发明的方法使用包含反应部分(包括但不限于醛部分,炔,氨基氧基部分,叠氮化物,肼,酮部分或硫醇)的cmp-唾液酸衍生物,其可以与结合多肽反应以形成缀合有唾液酸衍生物的结合蛋白。然后,这些缀合有唾液酸衍生物的结合蛋白可以与不同的效应部分结合,而不用氧化剂处理。
亚胺化学
在一些实施方案中,cmp-唾液酸衍生物包含反应部分,包括醛,酮,肼或腙部分。在一些实施方案中,反应部分是末端反应部分,包括但不限于末端醛或末端酮部分。在例示实施方案中,cmp-唾液酸衍生物具有以下结构式之一:
其中r2包括但不限于ch3、ch2ch2(c=o)ch3、ch2oh、oh或h。在一些实施方案中,包含末端醛部分的cmp-唾液酸衍生物包括但不限于如下结构式:
在一些实施方案中,缀合有唾液酸衍生物的结合多肽包含反应部分,其包括醛、酮、肼或腙部分。在示例实施方案中,缀合有唾液酸衍生物的结合多肽可以下表示:
其中x代表缀合有唾液酸衍生物的结合多肽的剩余基团(即除了反应部分之外的)。
在一些实施方案中,效应或靶向部分包含反应部分,包括醛,酮,肼或腙部分。在示例性实施方案中,效应或靶向部分可以由以下表示:
其中x代表效应或靶向部分的剩余基团(即除了反应部分之外的)。
在一些实施方案中,缀合有靶向或效应部分的结合多肽包含亚胺。在示例性实施方案中,亚胺类型包括但不限于醛亚胺,羟胺,腙,氯胺酮或肟。例如,参见图3(a-c)的亚胺形成。在示例性实施方案中,缀合有靶向或效应部分的结合多肽的亚胺通过使包含醛或酮部分的缀合有唾液酸衍生物的结合多肽与包含氨基氧基部分的效应或靶向部分反应而形成,或是结合到包含氨基氧基衍生物或肼部分的部分。在示例实施方案中,缀合有靶向或效应部分的结合多肽的亚胺通过使包含氨基氧基部分的缀合有唾液酸衍生物的结合多肽反应而形成,或是结合到包含氨基氧基衍生物或肼部分的部分,其具有包含醛或酮部分的效应或靶向部分。
点击化学
在一些实施方案中,cmp-唾液酸衍生物包含末端叠氮化物部分。例如,cmp-唾液酸衍生物可以是cmp-唾液酸c5叠氮化物衍生物或唾液酸c5叠氮化物。在示例实施方案中,cmp-唾液酸衍生物具有以下结构式:
其中r1是反应部分,其包括但不限于nh(c=o)ch3、nh(c=o)c4h7o、nh(c=o)ch2oh、nh(c=o)ch2n3、nh(c=o)sh、oh或n3。在一些实施方案中,cmp-唾液酸衍生物具有选自以下的结构式:
在一些实施方案中,cmp-唾液酸衍生物包含含有炔或与包含炔的部分结合的部分。在一些实施方案中,cmp-唾液酸衍生物包含或结合至环辛炔,包括但不限于氮杂二苯并环辛炔(dbco,adibo,dibac)部分,一氟化环辛炔或二氟化环辛炔。
在一些实施方案中,缀合有唾液酸衍生物的结合多肽包含末端叠氮化物部分。例如,缀合有唾液酸衍生物的结合多肽可以是缀合有唾液酸c5叠氮化物衍生物的多肽。在一个示例性实施方案中,缀合有唾液酸衍生物的结合多肽具有如图95所示的结构式。在另一示例性实施方案中,缀合有唾液酸衍生物的结合多肽具有以下结构式之一
其中x代表缀合有唾液酸衍生物的结合多肽的剩余基团(即除了末端叠氮化物部分之外的)。
在一些实施方案中,缀合有唾液酸衍生物的结合多肽包含含有炔或与包含炔的部分结合的部分。在一些实施方案中,缀合有唾液酸衍生物的结合多肽包含或结合至环辛炔,包括但不限于氮杂二苯并环辛炔(dbco,adibo,dibac)部分,一氟化环辛炔或二氟化环辛炔。
在一些实施方案中,效应或靶向部分包含炔或与包含炔的部分结合。在一些实施方案中,效应或靶向部分包含或结合至环辛炔,包括但不限于氮杂二苯并环辛炔(dbco,adibo,dibac)部分,一氟化环辛炔或二氟化环辛炔。在一些实施方案中,效应或靶向部分结合至包含炔的部分且由以下结构式表示:
在一些实施方案中,效应或靶向部分包含末端叠氮化物部分。
在一些实施方案中,缀合有靶向或效应部分的结合多肽包含三唑环。在示例性实施方案中,缀合有靶向或效应部分的结合多肽的三唑环通过使用点击化学使包含末端叠氮化物部分的缀合有唾液酸衍生物的结合多肽与包含炔或与包含炔的部分结合的效应或靶向部分反应而形成。在示例实施方案中,缀合有靶向或效应部分的结合多肽的三唑环通过使用点击化学使包含炔的或与包含炔的部分结合的缀合有唾液酸衍生物的结合多肽与包含末端叠氮化物部分的效应或靶向部分反应而形成。
在一些实施方案中,形成缀合有靶向或效应部分的结合多肽的点击化学反应发生在环境温度。在一些实施方案中,形成缀合有靶向或效应部分的结合多肽的点击化学反应发生在金属催化剂存在下,例如铜(i)催化的叠氮化物-炔环加成反应。在一些实施方案中,用于形成缀合有靶向或效应部分的结合多肽的点击化学反应在没有铜的情况下进行。
在一些实施方案中,形成缀合有靶向或效应部分的结合多肽的点击化学反应的机制包括但不限于铜(i)催化的[3+2]叠氮化物-炔环加成,应变促进(strain-promoted)的[3+2]叠氮化物-炔环加成,叠氮化物部分和活化炔之间的[3+2]huisgen环加成,叠氮化物部分和缺电子的炔之间的[3+2]环加成,叠氮化物和芳炔之间的[3+2]环加成反应,四嗪和烯之间的diels-alder逆[4+2]环加成反应,或硫醇与烯之间的自由基加成。
硫醚化学
在一些实施方案中,cmp-唾液酸衍生物或唾液酸衍生物包含含有硫醇或马来酰亚胺部分的反应部分。在一些实施方案中,cmp-唾液酸衍生物或唾液酸衍生物包含末端硫醇。在示例实施方案中,包含末端硫醇的cmp-唾液酸衍生物包括但不限于以下结构式:
在一些实施方案中,缀合有唾液酸衍生物的结合多肽包含含有硫醇或马来酰亚胺部分的反应部分。在一些实施方案中,缀合有唾液酸衍生物的结合多肽包含末端硫醇部分。在示例实施方案中,缀合有唾液酸衍生物的结合多肽可以由以下表示,但不限于:
其中x是缀合有唾液酸衍生物的结合多肽的剩余基团(即除了硫醇或马来酰亚胺部分之外的)。
在一些实施方案中,效应或靶向部分包含反应部分,其包括硫醇或马来酰亚胺部分。在一些实施方案中,效应或靶向部分包含末端巯基部分。在一些实施方案中,效应或靶向部分包含末端马来酰亚胺部分。例如,包含马来酰亚胺部分的效应或靶向部分包括但不限于双-甘露糖-6-磷酸六甘露糖马来酰亚胺或乳糖马来酰亚胺。
在示例性实施方案中,效应或靶向部分可以由但不限于以下表示:
其中x是效应或靶向部分的剩余基团。
在一些实施方案中,缀合有靶向或效应部分的结合多肽包含硫醚。在示例实施方案中,缀合有靶向或效应部分的结合多肽的硫醚通过使包含硫醇部分的缀合有唾液酸衍生物的结合多肽与包含马来酰亚胺部分的效应或靶向部分反应而形成。在示例性实施方案中,缀合有靶向或效应部分的结合多肽的亚胺通过使包含马来酰亚胺部分的缀合有唾液酸衍生物的结合多肽与包含硫醇部分的效应或靶向部分反应而形成。
vii.修饰的结合多肽
在一些实施方案中,本发明提供修饰多肽,其为缀合效应部分与改变的结合多肽的氧化聚糖(例如氧化的n-连接聚糖)(例如在抗体ch1结构域的n114处的工程化聚糖或抗体f结构域的n297处的天然聚糖)缀合(直接或通过接头部分)的产物。
在一个实施方案中,所述结合多肽可以为式(iii):
ab(gal-c(h)=n-q-con-x)x(gal-sia-c(h)=n-q-con-x)y
式(iii),
其中:
a)ab是如本文定义的抗体;
b)q是nh或o;
c)con是如本文定义的连接体部分;且
d)x是如本文定义的靶向部分;
e)gal是源自半乳糖的组件;
f)sia是源自唾液酸的组件;
g)x是0至5;且
h)y是0至5,
其中x和y中至少一个不为0。
在一个实施方案中,所述结合多肽可以为式(iii)可以为式(iiia):
ab(gal-c(h)=n-q-ch2-c(o)-z-x)x(gal-sia-c(h)=n-q-ch2-c(o)-z-x)y
式(iiia),
其中:
a)ab是抗体;
b)q是nh或o;
c)z是cys-(mc)a-(vc)b-(pabc)c-(c16h32o8c2h4)f-,其中
i.cys是源自半胱氨酰胺的组件;
ii.mc是源自马来酰亚胺的组件;
iii.vc是源自与瓜氨酸偶联的缬氨酸的组件;
iv.pabc是源自4-氨基苄基氨基甲酸酯的组件;
v.x是效应部分(例如如本文定义的靶向部分);
vi.a是0或1;
vii.b是0或1;
viii.c是0或1;且
ix.f是0或1;
d)x是如本文定义的治疗剂;
e)gal是源自半乳糖的组件;
f)sia是源自唾液酸的组件;
g)x是0至5;且
h)y是0至5,
其中x和y中至少一个不为0。
可以理解的是式(iii)并非意在暗示抗体、gal取代基和gal-sia取代基以链样的方式连接。而是说当这种取代基存在时,所述抗体直接与每个取代基连接。例如,式(iii)的结合多肽(其中x是1且y是2)可具有如下所示的排列:
式(iii)中的con取代基和其中的组件如参考式(i)关于效应部分所述。
在一个实施方案中,q是nh。在另一实施方案中,q是o。
在一个实施方案中,x是0。
式(iii)的抗体ab可以是如本文所述的任何合适的抗体。
在一个实施方案中,提供用于制备式(iii)的结合多肽的方法,所述方法包括使式(i)的效应部分与式(ii)的修饰抗体反应:
nh2-q-con-x
式(i),
其中:
a)q是nh或o;
b)con是连接体部分;且
c)x是效应部分(例如如本文定义的靶向部分),
ab(oxg)r
式(ii)
其中
a)oxg是氧化聚糖;且
b)r选自0至4;
在一个实施方案中,提供用于制备式(iii)的结合多肽的方法,所述方法包括使式(i)的效应部分与式(iia)的修饰抗体反应:
nh2-q-con-x
式(i),
其中:
a)q是nh或o;
b)con是连接体部分;且
c)x是效应部分(例如如本文定义的靶向部分),
ab(gal-c(o)h)x(gal-sia-c(o)h)y
式(iia),
其中
a)ab是如本文定义的抗体;
b)gal是源自半乳糖的组件;
c)sia是源自唾液酸的组件;
d)x是0至5;且
e)y是0至5,
其中x和y中至少一个不为0。
vii.用修饰抗体处理的方法
一方面,本发明提供治疗或诊断对其有需要的患者的方法,其包括施用有效量的本文公开的结合多肽。在一些实施方案中,本发明包括用于在需要这种治疗的哺乳动物受试者中诊断和/或治疗病症(例如肿瘤病症)的试剂盒和方法。在一些实施方案中,受试者是人。
本公开的结合多肽在多种不同应用中都有效。例如,在一个实施方案中,主题的结合多肽对于降低或消除带有由结合多肽的结合结构域识别的表位的细胞是有用的。在另一实施方案中,所述主题结合多肽在降低循环中可溶抗原的浓度或消除循环中可溶抗原方面有效。在一个实施方案中,所述结合多肽可降低肿瘤大小、抑制肿瘤生长和/或延长带有肿瘤的动物的生存时间。相应地,本公开还涉及在人或其他动物中通过将有效的非毒性的量的修饰抗体施用至这些人或动物来治疗肿瘤的方法。本领域的技术人员将能够通过常规实验来确定就治疗恶性肿瘤而言修饰的结合多肽的有效、非毒性的量为多少。例如,修饰的抗体或其片段的治疗上具有活性的量可根据以下因素变化,所述因素如受试者的疾病阶段(例如阶段i对阶段iv)、年龄、性别、医学并发症(例如免疫抑制病况或疾病)和体重,以及在受试者中引起预期响应的修饰抗体的能力。给药方案可进行调整以提供最佳治疗响应。例如,每日可施用数次分开的剂量,或由治疗状况的紧急程度所指示的按比例减少。
一般而言,本公开提供的组合物可用于预防性或治疗性处理任何包含抗原标记的肿瘤(neoplasm),所述标记允许修饰抗体靶向癌细胞。
viii.施用修饰抗体或其片段的方法
制备和施用本公开的结合多肽至受试者的方法已知或由本领域的技术人员很容易地确定。本公开的结合多肽的施用途径可以是口服、肠胃外、通过吸入或局部。如本文使用的术语肠胃外包括静脉内、动脉内、腹膜内、肌内、皮下、直肠或阴道施用。虽然所有这些形式的施用被明确地考虑在本发明的范围之内,但是施用的形式是注射液,特别是用于静脉内或动脉内注射或滴注的溶液。通常,合适的用于注射的药物组合物可包含缓冲液(例如醋酸、磷酸或柠檬酸缓冲液)、表面活性剂(例如聚山梨酯)、任选地稳定剂(例如人白蛋白)等。然而,在其他与本文的教导相容的方法中,修饰抗体可直接递送至不良细胞群体的位点,由此增加疾病组织对治疗剂的暴露。
在一个实施方案中,施用的结合多肽是式(iii)的结合多肽:
ab(gal-c(h)=n-q-con-x)x(gal-sia-c(h)=n-q-con-x)y
式(iii),
其中:
a)ab是如本文定义的抗体;
b)q是nh或o;
c)con是如本文定义的连接体部分;且
d)x是效应部分(例如如本文定义的靶向部分);
e)gal是源自半乳糖的组件;
f)sia是源自唾液酸的组件;
g)x是0至5;且
h)y是0至5,
其中x和y中至少一个不为0。
用于肠胃外施用的制剂包括无菌水性或非水性溶液、悬浮液和乳液。非水性溶剂的实例为丙二醇、聚乙二醇、植物油如橄榄油和可注射的有机酯如油酸乙酯。水性载剂包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。在本公开的组合物和方法中,可药用的载剂包括但不限于0.01-0.1m或0.05m磷酸缓冲液或0.8%盐水。其他常用的肠胃外媒介包括磷酸钠溶液、林格氏(ringer’s)葡萄糖、葡萄糖和氯化钠,乳酸林格氏或不挥发油。静脉媒介包括流体和营养补充剂、电解质补充剂如基于林格氏葡萄糖的那些等等。防腐剂和其他添加剂也可存在,如例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等等。更具体地,适于注射用途的药物组合物包括无菌水性溶液(在水可溶性的情况下)或分散剂,和用于无菌可注射溶液或分散剂临场制备的无菌粉末。在这样的情况中,所述组合物必须为无菌且应以能够轻松注射的程度流动。其在制造和保存条件下应稳定,且还应当防止微生物如细菌和真菌的污染作用来保存。载剂可以是溶剂或分散剂介质,其包含例如水、醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等等)及其合适的混合物。可保持适当的流动性,例如,通过包衣如卵磷脂的使用、在分散剂的情况中通过保持所需的微粒尺寸和通过表面活性剂的使用。
微生物作用的预防可通过多种抗细菌和抗真菌剂实现,例如,羟基苯甲酸酯,氯丁醇,苯酚,抗坏血酸,硫柳汞等等。组合物中还可以包括等渗剂,例如糖、多元醇(如甘露醇、山梨醇)或氯化钠。可注射组合物的延长吸收可通过在组合物中包括延迟吸收的作用剂带来,例如单硬脂酸铝和明胶。
在任何情况中,无菌可注射溶液可通过以所需的量并入在适当的溶剂中与一种本文枚举的成分之一或成分的组合混合的具有活性的化合物(例如修饰的结合多肽本身或与其他活性剂的组合)制备,如果需要的话,随后可进行过滤除菌。一般而言,分散剂通过将具有活性的化合物并入包含基本的分散介质和来自那些上文枚举的所需的其他成分的无菌媒介制备。在用于无菌可注射溶液制备的无菌粉末情况中,制备方法通常包括真空干燥和冷冻干燥,其从之前无菌过滤的溶液产出活性成分的粉末加任何其他预期成分。加工用于注射的制剂,将其填入容器如安瓿瓶、袋、瓶、注射器或小瓶中,并根据本领域已知的方法在无菌条件下密封。此外,可将所述制剂包装并以试剂盒的形式出售,如那些在共同待审的u.s.s.n.09/259,337和u.s.s.n.09/259,338中所述,其每一篇在本文通过提述并入。这些制品可以包括表明相关组合物可用于治疗患有自身免疫或肿瘤病症或对自身免疫或肿瘤病症易感的受试者的标签或包装插页。
本发明的组合物用于治疗上述病况的有效剂量取决于多种不同的因素变化,包括施用方式、靶位点、患者的生理状态、患者为人还是动物、施用的其他药物和治疗为预防性还是治疗性。通常患者是人,但非人哺乳动物包括转基因哺乳动物也可接受治疗。治疗剂量可使用本领域技术人员已知的方法滴定测量以优化安全性和效力。
对于用结合多肽的被动免疫,剂量范围可以是,例如宿主体重的约0.0001至100mg/kg和更经常的0.01至5mg/kg(例如0.02mg/kg、0.25mg/kg、0.5mg/kg、0.75mg/kg、lmg/kg、2mg/kg等)。例如剂量可以是1mg/kg体重或10mg/kg体重或为1-10mg/kg的范围内,例如至少1mg/kg。上述范围中间的剂量也意在本公开的保护范围之内。受试者可以每日、每隔一日、每周或根据由经验分析确定的任何其他日程施用这样的剂量。典型的治疗需要在延长的期限例如至少六个月施用多重剂量。其他典型的治疗方案需要每两周一次或一个月一次或每3至6个月一次施用。典型的给药日程包括连续多日1-10mg/kg或15mg/kg、隔日30mg/kg或每周60mg/kg。在一些方法中,同时施用具有不同结合特异性的两种或多种单克隆抗体,其中每种抗体的施用剂量落入所示范围。
本公开的结合多肽可在多重时机施用。两次单独给药的间隔可以为每周、每月或每年。间隔还可以无规律,按照通过测量患者中修饰的结合多肽或抗原的血液水平所示进行。在一些方法中,剂量调整至获得修饰的结合多肽的血浆浓度为1-1000μg/ml,而在一些方法中为25-300μg/ml。可替换地,结合多肽可作为持续释放的制备物施用,其中需要的施用频率较低。对于抗体,剂量和频率取决于抗体在患者中的半衰期而变化。一般而言人源化的抗体显示最长的半衰期,随后是嵌合抗体和非人抗体。
施用剂量和频率可取决于治疗是预防性还是治疗性而变化。在预防性应用中,将包含本发明抗体或其鸡尾酒混合(cocktail)的组合物施用至未在疾病状态中的患者以增强患者的抗性。这样的量定义为“预防上有效的量”。在这种用途中,精确的量也取决于患者的健康和整体免疫的状态,但通常为0.1至25mg每剂量,特别是0.5至2.5mg每剂量。相对低剂量以相对不频繁的间隔在较长的时期进行施用。一些患者在其余生持续接受治疗。在治疗性应用中,有时需要相对高的剂量(例如约1至400mg/kg的抗体每剂量,其中5至25mg的剂量更常用于放射性免疫缀合物且更高剂量用于细胞毒素-药物修饰的抗体)以相对较短的间隔直至疾病进展降低或终止,或直至患者表现疾病症状的部分或完全改善。此后,可对患者施用预防性的方案。
本公开的结合多肽可任选地与其他在需要治疗的病症或病况的治疗中(例如预防性或治疗性)有效的作用剂组合施用。本公开的90y-标记的修饰抗体的有效的单治疗剂量(即治疗上有效的量)为约5-约75mci,如为约10-约40mci。131i-修饰抗体的有效的单治疗非骨髓消融剂量为约5-约70mci,如约5-约40mci。131i-标记抗体的有效的单治疗消融剂量(即可能需要自体骨髓移植)为约30至约600mci,如约50至小于约500mci。与嵌合抗体一起时,由于相比较的(vis-a-vis)鼠抗体较长的循环半衰期,碘-131标记嵌合抗体有效的单治疗非骨髓消融剂量为约5-约40mci,如少于约30mci。对于例如111in标记的成像标准通常少于约5mci。
尽管所述结合多肽可如上文所述立即施用,但是必须强调的是其他实施方案中结合多肽可作为一线治疗施用至其他方面健康的患者(otherwisehealthypatients)。在这些实施方案中,所述结合多肽可施用至具有正常或普通红骨髓储备的患者和/或还未经历一种或多种其他治疗的患者。如本文使用,修饰的抗体或其片段与辅助疗法一起或组合施用意为所述疗法和公开的抗体的顺序、同步、共延、同时、伴随的或同期施用或应用。本领域的技术人员将理解组合治疗方案的多种组件的施用或应用可定时以增强治疗的整体有效性。例如,化疗剂可以标准、已知的治疗进程施用,随后数周内为本公开的放射性免疫缀合物。相反地,与结合多肽缔合的细胞毒素可静脉内施用,随后为肿瘤局部的外部射线照射。而在其他实施方案中,修饰的结合多肽可与一种或多种选择的化疗剂在单一就诊时同时施用。基于选择的辅助疗法和本说明书的教导,本领域的技术人员(例如有经验的肿瘤学家)将能够很容易地辨别有效的组合治疗方案而无需过度实验。
在这方面,可以理解的是结合多肽和化疗剂的组合可以任何顺序且在任何为患者提供疗效的时间框架内施用。也就是说,化疗剂和结合多肽可以任何顺序或同时施用。在所选的实施方案中,本公开的结合多肽将施用至之前经历了化疗的患者。而在其他其他实施方案中,所述结合多肽和化疗治疗将基本上同时或同时施用。例如,可在经历化疗过程时将所述结合多肽给予所述患者。在一些实施方案中,修饰抗体将在任何化疗剂或治疗的一年内施用。在其他实施方案中,所述结合多肽将在任何化疗剂或治疗的10、8、6、4或2个月内施用。在仍然其他实施方案中,所述结合多肽将在任何化疗剂或治疗的4、3、2或1周内施用。而在其他实施方案中,所述结合多肽将在所选的化疗剂或治疗的5、4、3、2或1天内施用。应该进一步理解的是两种作用剂或治疗可在数小时或分钟(即基本上同时)内施用至患者。
应该进一步理解的是本公开的结合多肽可用于与任何消除、降低、抑制或控制体内肿瘤细胞生长的化疗剂或作用剂联合或组合(例如以提供组合治疗方案)。与本公开相容的典型化疗剂包括烷化剂、长春花生物碱(例如长春新碱和长春碱)、甲基苄肼、甲氨蝶呤和强的松。四种药物的组合mopp(mechlethamine(氮芥)、长春新碱(oncovin)、甲基苄肼和强的松)在治疗多种类型的淋巴瘤中非常有效,且可用于一些实施方案。在抗mopp的患者中,还可使用abvd(例如阿霉素、博来霉素、长春碱和达卡巴嗪)、chivpp(苯丁酸氮芥、长春碱、丙卡巴肼和强的松)、cabs(洛莫司汀、阿霉素、博来霉素和链脲佐菌素)、mopp加abvd、mopp加abv(多柔比星、博来霉素和长春花碱)或bcvpp(卡莫司汀、环磷酰胺、长春碱、丙卡巴肼和强的松)组合。arnolds.freedman和leem.nadler,malignantlymphomas,在harrison'sprinciplesofinternalmedicine1774-1788(kurtj.isselbacher等编,第13版.1994)中和v.t.devita等,(1997)以及其中引用的参考文献可用于标准剂量给药和时间安排。这些疗法可无变化地使用,或对于特定患者根据所需进行改变,与一种或多种如本文描述的本公开的结合多肽组合。
其他在本公开的背景中有效的方案包括单一烷化剂如环磷酰胺或苯丁酸氮芥的使用,或如cvp(环磷酰胺、长春新碱和强的松)、chop(cvp和阿霉素)、c-mopp(环磷酰胺、长春新碱、强的松和甲基苄肼)、cap-bop(chop加甲基苄肼和博来霉素)、m-bacod(chop加甲氨蝶呤、博莱霉素和甲酰四氢叶酸)、promace-mopp(强的松、甲氨蝶呤、阿霉素、环磷酰胺、依托泊苷和甲酰四氢叶酸加标准mopp)、promace-cytabom(强的松、阿霉素、环磷酰胺、依托泊苷、阿糖胞苷、博来霉素、长春新碱、甲氨蝶呤和甲酰四氢叶酸)和macop-b(甲氨蝶呤、阿霉素、环磷酰胺、长春新碱、固定剂量强的松、博来霉素和亚叶酸)的组合。本领域的技术人员将能够很容易地确定对于这些方案中的每一种的标准剂量和日程安排。chop还已与博来霉素、氨甲蝶呤、甲基苄肼、氮芥、阿糖胞苷和依托泊苷组合。其他相容的化疗剂包括但不限于2-氯脱氧腺苷(2-cda)、2'-脱氧柯福霉素和氟达拉滨。
对于具有中级和高级nhl的患者,其不能实现缓解或复发,可使用抢救疗法。抢救疗法采用药物如阿糖胞苷、卡铂、顺铂、依托泊苷和异环磷酰胺,所述药物单独或组合给予。在复发或侵袭形式的一些肿瘤病症中,使用下列方案:imvp-16(异环磷酰胺、甲氨蝶呤和依托泊苷)、mime(甲基-gag、异环磷酰胺、甲氨蝶呤和依托泊苷)、dhap(地塞米松、高剂量的阿糖胞苷和顺铂)、eshap(依托泊苷、甲泼尼龙、hd阿糖胞苷、顺铂)、cepp(b)(环磷酰胺、依托泊苷、丙卡巴肼、强的松和博来霉素)和camp(洛莫司汀、米托蒽醌、阿糖胞苷和强的松),其每一种以已知的给药速率和日程安排施用。
与本公开的修饰抗体组合使用的化疗剂的量可因受试者发生变化或可根据本领域已知进行施用。参见例如bruceachabner等,antineoplasticagents,在goodman&gilman'sthepharmacologicalbasisoftherapeutics1233-1287(joelg.hardman等编,第9版,1996).
如之前所述,本公开的结合多肽、免疫反应片段或其组合可以对体内治疗哺乳动物病症有效的量进行施用。在这方面,可以理解的是可配制公开的结合多肽以促进施用并增进活性剂的稳定性。
根据本公开的药物组合物通常包含可药用、无毒、无菌的载剂如生理盐水、无毒缓冲液、防腐剂等等。就本申请而言,与治疗剂缀合或非缀合的修饰结合多肽、免疫反应片段或其组合的药物上有效的量应保持足以实现与抗原的有效结合且实现益处例如改善疾病或病症或可检测物质或细胞的量的含义。在肿瘤细胞的情况中,修饰的结合多肽通常能够与肿瘤或免疫反应性细胞上的所选具有免疫反应性的抗原相互作用并用以增加那些细胞的死亡。当然,本公开的药物组合物可以单一或多重剂量施用以提供修饰结合多肽的药物上有效的量。
符合本公开的保护范围的是,本公开的结合多肽可以足以产生治疗或预防效果的量根据前文所述的治疗方法施用至人或其他动物。本公开的结合多肽可通过根据已知技术组合本公开的抗体与常规的可药用载剂或稀释剂制备的常规剂型施用至这些人或其他动物。本领域的技术人员将认可的是可药用载剂或稀释剂的形式和特征通过将与其混合的活性成分的量、施用途径和其他已知变量决定。本领域的技术人员将进一步理解包含一种或多种本公开所述的结合多肽的鸡尾酒混合可能被证明特别有效。
ix.结合多肽的表达
一方面,本发明提供编码本文公开的结合多肽的多核苷酸。还提供了制备结合多肽的方法,包括表达这些多核苷酸。
编码本文公开的结合多肽的多核苷酸通常插入用于引入宿主细胞的表达载体,所述宿主细胞可用于产生预期量的要求保护的抗体或其片段。相应地,一些方面,本发明提供包含本文公开的多核苷酸的表达载体和包含这些载体和多核苷酸的宿主细胞。
本文使用术语"载体"或"表达载体"是出于描述和要求保护的目的,意为与本发明对应使用的载体作为用于将预期基因引入细胞并表达的媒介。本领域的技术人员已知,这种载体可很容易地从下组选择:质粒、噬菌体、病毒和逆转录病毒。一般而言,与本发明相容的载体将包含选择标记、合适的限制性酶切位点以促进预期基因的克隆和进入真核或原核细胞和/或复制的能力。
可采用多种表达载体系统用于本发明的目的。例如,一类载体应用源自动物病毒的dna元件,如源自牛乳头状瘤病毒、多瘤病毒、腺病毒、牛痘病毒,杆状病毒,逆转录病毒(rsv、mmtv或momlv)或sv40病毒的元件。其他包括具有内部核糖体结合位点的多顺反子系统的使用。此外,具有整合入其染色体的dna的细胞可通过引入一种或多种允许转染宿主细胞选择的标记进行选择。标记可用于向营养缺陷型宿主提供原养型、杀菌抗性(例如抗生素)或重金属如铜抗性。可选择的标记基因可直接与将表达的dna序列连接,或通过共转化引入相同细胞。其他元件对于优化mrna的合成也可能是需要的。这些元件可包括信号序列、剪接信号以及转录启动子、增强子和终止信号。在一些实施方案中,克隆的可变区基因与如上文讨论的合成的重链和轻链恒定区基因(优选是人恒定区基因)共同插入表达载体。
在其他实施方案中,结合多肽可使用多顺反子构建体表达。在这种表达系统中,感兴趣的多重基因产物如抗体的重链和轻链可从单一多顺反子构建体产生。这些系统有利地使用内部核糖体进入位点(ires)以在真核宿主细胞中提供相对高水平的多肽。相容的ires序列公开于美国专利号6,193,980,其在本文通过提述并入。本领域的技术人员将理解这种表达系统可用以有效产生全范围的本申请公开的多肽。
更普遍地,一旦编码抗体或其片段的载体或dna序列已制备,所述表达载体可引入合适的宿主细胞。也就是说,可转化所述宿主细胞。质粒向宿主细胞的引入可通过多种本领域的技术人员熟知的技术完成。这些包括但不限于转染(包括电泳和电穿孔)、原生质体融合、磷酸钙沉淀、用包膜dna的细胞融合、显微注射和用完整病毒的感染。参见ridgway,a.a.g."mammalianexpressionvectors"第24.2章,第470-472页载体,rodriguez和denhardt编.(butterworths,boston,mass.1988)。质粒可以经由电穿孔引入宿主。转化的细胞在适于产生轻链和重链的条件下生长,并对重链和/或轻链蛋白的合成进行测定。典型的测定技术包括酶联免疫吸附试验(elisa)、放射免疫试验(ria)或荧光激活细胞分选仪分析(facs)、免疫组化等等。
如本文使用的术语"转化"应在广义上用于指代dna向受体宿主细胞的引入,其改变基因型并从而导致受体细胞中的变化。
本着同样的含义,"宿主细胞"指代已使用重组dna技术构建并编码至少一种异源基因的载体转化的细胞。对于从重组宿主分离多肽的工艺说明中,术语"细胞"和"细胞培养"可互换使用以指代抗体来源,除非另有清楚指明。也就是说,多肽从"细胞"的回收可意为从离心的完整细胞或从包含培养基和悬浮细胞的细胞培养物。
在一个实施方案中,用于抗体表达的宿主细胞系是哺乳动物来源;本领域的技术人员可判断哪些特定的宿主细胞系最适于预期的基因产物在其中表达。典型的宿主细胞系包括但不限于dg44和duxb11(中国仓鼠卵巢细胞系,dhfr减)、hela(人宫颈癌)、cvi(猴肾细胞系)、cos(具有sv40t抗原的cvi的衍生物)、r1610(中国仓鼠成纤维细胞)、balbc/3t3(小鼠成纤维细胞)、hak(仓鼠肾细胞系)、sp2/o(小鼠骨髓瘤)、bfa-1c1bpt(牛内皮细胞)、raji(人淋巴细胞)、293(人肾)。在一个实施方案中,细胞系提供在其中表达的抗体的改变的糖基化,例如无岩藻糖基化(例如per.c6.rtm.(crucell)或fut8敲除cho细胞系(potelligent.rtm.cells)(biowa,princeton,n.j.))。在一个实施方案中,可使用ns0细胞。cho细胞是特别有用的。宿主细胞系通常可从商业服务、americantissueculturecollection或从公开的文献获得。
体外制备允许扩大规模以提供较大的量的预期多肽。在组织培养条件下用于哺乳动物细胞培养的技术为本领域已知且包括均匀悬浮培养,例如在气升式反应器中或在连续搅拌反应器中,或固定化或包埋的细胞培养物,例如在空心纤维、微胶囊中,在琼脂糖微珠或陶瓷筒上。如果有必要和/或符合预期,多肽溶液可通过常规的色谱方法纯化,例如凝胶过滤、离子交换色谱、deae-纤维素上的色谱和/或(免疫)亲和力色谱。
编码本发明中表征的结合多肽的基因还可在非哺乳动物细胞如细菌或酵母或植物细胞中表达。这方面,将理解的是也可转化多种单细胞非哺乳动物微生物如细菌;即能够在培养物或发酵中生长的那些。对转化易感的细菌包括肠杆菌科的成员,如大肠杆菌(escherichiacoli)或沙门氏菌(salmonella);芽孢杆菌科(bacillaceae)如枯草芽孢杆菌(bacillussubtilis);肺炎球菌(pneumococcus);链球菌(streptococcus)和流感嗜血杆菌(haemophilusinfluenzae)的菌株。将进一步理解的是当在细菌中表达时,多肽可以是包涵体的一部分。必须将所述多肽分离、纯化并随后装配成功能分子。
原核细胞外,也可以使用真核微生物。酿酒酵母(saccharomycescerevisiae),或常用的面包酵母是真核微生物中最常使用的微生物,尽管多种其他菌株也通常是可以获得的。对于在酵母属(saccharomyces)中的表达,通常使用例如质粒yrp7(stinchcomb等,nature,282:39(1979);kingsman等,gene,7:141(1979);tschemper等,gene,10:157(1980))。该质粒已包含为缺乏在色氨酸中生长的能力的酵母突变株(例如atccno.44076或pep4-1(jones,genetics,85:12(1977))提供选择性标记的trp1基因。trpl病变作为酵母宿主细胞基因组的特征的存在随后为通过在不存在色氨酸的条件下的生长来检测转化提供了有效环境。
实施例
本发明通过下列实施例进一步阐述,其不应理解为进一步的限制。序列表、附图和贯穿本申请引用的全部参考文献、专利和公开的专利申请的内容通过提述明确并入本文。
实施例1.cmp-唾液酸或cmp-唾液酸衍生物在c5处的化学酶合成
可用唾液酸醛缩酶处理n-乙酰甘露糖胺或其衍生物,以形成唾液酸或唾液酸衍生物。随后在cmp-唾液酸合成酶的存在下用ctp处理唾液酸或唾液酸衍生物,产生cmp-唾液酸或cmp-唾液酸衍生物(图1)。
可以通过图1中概述的化学酶合成产生的cmp-唾液酸衍生物包括但不限于图2的c5cmp-唾液酸衍生物。图2还显示了在c7和c8处的cmp-唾液酸衍生物。cmp-唾液酸衍生物可用作底物,以通过体外唾液酸化将唾液酸衍生物转移至抗体,用于随后的缀合。
实施例2.用于通过唾液酸衍生物的缀合的不同化学方法
图3a-e是本发明的不同化学反应的示意图,其中圆圈及与之键合的反应部分的组合代表缀合有唾液酸衍生物的结合多肽。星型代表靶向或效应部分。图3a是显示包含末端醛的缀合有唾液酸衍生物的结合多肽与氨基氧基效应部分(例如药物或聚糖)反应形成亚胺的示意图。图3b是显示包含末端酮基的缀合有唾液酸衍生物的结合多肽与氨基氧基效应部分(如药物或聚糖)反应形成亚胺的示意图。图3c是显示包含末端醛或酮的缀合有唾液酸衍生物的结合多肽与包含肼的效应部分反应形成腙(其是亚胺的一种)的示意图。图3d是显示包含末端叠氮化物的缀合有唾液酸衍生物的结合多肽与包含炔或结合至包含炔的部分(此处为dbco)的效应部分(例如药物或聚糖)反应形成三唑的示意图。图3e是显示包含末端硫醇的缀合有唾液酸衍生物的结合多肽与包含马来酰亚胺的效应部分(例如药物或聚糖)反应形成硫酯键的示意图。
图4描绘了根据本发明的方法的缀合有效应部分的结合多肽。缀合有效应部分的结合多肽可以通过如下步骤形成:(a)使唾液酸衍生物与结合多肽的聚糖反应以形成缀合有唾液酸衍生物的结合多肽;和(b)使所述缀合有唾液酸衍生物的结合多肽与效应部分反应以形成缀合有效应部分的结合多肽,其中形成亚胺键,并且其中结合多肽和缀合有唾液酸衍生物的结合多肽均不用氧化剂处理。图4描绘了肟(亚胺的一种)的形成。
图5描绘了根据本发明的方法的缀合有效应部分的结合多肽。缀合有效应部分的结合多肽可以通过如下方法形成:(a)使包含c5位置处的末端反应部分的唾液酸衍生物与结合多肽的聚糖反应,以形成缀合有唾液酸衍生物的结合多肽;和(b)使用点击化学将缀合有唾液酸衍生物的结合多肽与效应部分反应,以形成缀合有效应部分的结合多肽。图5描绘了三唑环的形成。
实施例3.2c3抗cd-52高糖基化抗体突变体的设计、制备和表征
在抗cd-52抗体2c3的重链中设计了多个高糖基化突变,目的是将大体积基团添加至相互作用界面(例如fcrn结合位点,以调节抗体药代动力学),用于通过改变其与fcγr的相互作用来调节抗体效应功能,或引入用于效应部分缀合的新的交联位点亚序列化学修饰,包括但不限于药物,毒素,细胞毒性剂和放射性核苷酸。高糖基化的2c3突变体列于表3。
表3.高糖基化的2c3抗cd-52突变体
3a.2c3抗cd-52抗体高糖基化突变体的生成
通过诱变pcr将基于kabat编号系统指定的a114n突变引入2c3的ch1结构域。为了产生全长抗体,通过不依赖连接的克隆(lic)将vh结构域加突变的a114n残基插入到编码抗体ch结构域1-3的pentr-lic-igg1载体中。通过使用quikchange定点诱变试剂盒(agilenttechnologies,inc.,santaclara,ca,usa)通过定点诱变在pentr-lic-igg1上引入所有其它突变。通过lic将wt2c3vh克隆入突变载体。通过gateway克隆将全长突变体克隆到pcep4(-e+i)dest表达载体中。基于eu编号系统指定fc突变。通过dna测序证实突变。wt2c3重链和轻链和突变的2c3重链的氨基酸序列列于表4中。突变的氨基酸以灰色突出显示,突变产生的共有糖基化靶位点以下划线显示。
表4.2c3和抗cd-52抗体的氨基酸序列
将突变体和wt对照以6孔板格式转染至hek293-ebna细胞中。如图14a和b所示,通过sds-page和western印迹分析,发现表达水平为~0.1μg/ml。还通过biacore上的蛋白a捕获来测定条件培养基中突变体的表达。使用注射到固定化蛋白a中6分钟后的解离响应来确定浓度。将cho细胞产生的wt2c3在培养基中从90μg/ml至1.5ng/ml的连续稀释用作标准曲线。通过使用4参数拟合的校准曲线计算浓度至~0.2μg/ml。如图14b所示,相对表达水平低,通常与western印迹结果相符。
3b.高糖基化的验证
为测定是否额外的糖基化位点可通过突变引入,2c3突变体和野生型蛋白使用通用的去糖基化酶pngasef处理,且蛋白样品通过sds-page和western印迹分析。如图15所示,仅a114n突变体具有增加的表观分子量,表明额外的n连接糖的存在。
生产小规模的抗体制备以纯化2c3突变体用于进一步验证糖基化位点的引入。如图16所示,通过sds-page确认了仅a114n突变体具有额外引入的糖基化位点。
3c.2c3抗cd-52突变体的结合性质
使用biacore以比较纯化蛋白的结合性质。小鼠和sec-纯化的人fcrn-hpc4经由胺偶联固定在cm5芯片上。将每种抗体稀释至200、50和10nm并注射在固定的fc受体上。campath、cho-产生的wt2c3和depc-处理的campath作为阳性和阴性对照包括在内。如图18所示,y436s突变体展示出与人fcrn的结合中约2倍的降低。有趣的是,该突变体与小鼠fcrn的结合并未受到影响。其他2c3突变都未对人或小鼠fcrn结合具有任何显著影响。
使用biacore并使用cd-52肽741biacore结合试验来比较纯化蛋白的抗原结合性质。将cd-52肽741和对照肽777固定至cm5芯片。将抗体从60nm在hbs-ep中2倍系列稀释至0.2nm并一式两份注射持续3分钟,随后是在缓冲液中以50μl/min流速的5分钟的解离。gld52批次17200-084作为对照包括在内。用1脉冲的40mmhcl使表面再生。使用1:1结合模型来拟合7.5至0.2nm曲线。如图21所示,相比该试验中的其他突变体,a114n突变体具有稍微较低的cd-52结合亲和力而ngt突变体具有稍微较高的亲和力。cd-52肽741biacore结合试验用从较大规模制备纯化的蛋白进行了重复。如图22所示,a114n突变体展示与wt2c3可比较的cd-52肽结合。
3d.a114n突变体的电荷表征
实施等点聚焦(ief)以表征2c3突变体的电荷。使纯化的蛋白在固定的ph梯度(ph3-10)丙烯酰胺(ipg)凝胶上运行。如图23a所示,可能由于唾液酸残基,发现a114n具有更多的负电荷。完整的ms数据确认了在a114n突变体上具有唾液酸的复杂结构。相反地,wt2c3显示具有g0f和g1f作为主要的糖基化种类(分别在图23c和23d中)。
实施例4.数种抗体骨架中高糖基化的突变体的制备
2c3抗cd-52抗体外,在数种其他抗体骨架中工程化了a114n突变以确认独特的高糖基化位点可引入不相关的重链可变结构域序列中。高糖基化的抗tem1、抗fap和抗her2突变体阐述于表5中。
表5.在数种不相关抗体骨架中设计的a114n和/或s298n突变体
4a.抗tem1和抗fap抗体高糖基化突变体的产生
将基于kabat编号系统设计的a114n突变通过诱变pcr引入抗tem1和抗fap的ch1结构域。为产生全长抗体,突变的vh加残基114通过不依赖连接的克隆(lic)插入编码抗体ch结构域1-3的pentr-lic-igg1载体。全长的突变体随后通过gateway克隆克隆入pcep4(-e+i)dest表达载体。突变通过dna测序确认。抗tem1野生型和突变的重链和轻链的氨基酸序列阐述于表6中。突变的氨基酸以灰色标注且通过突变产生的共有糖基化靶位点为下划线部分。
表6.抗tem1和抗fap抗体的氨基酸序列
突变体和野生型对照转染入在三烧瓶形式(tripleflaskformat)中的hek293-ebna细胞并在hitrap蛋白a柱(gehealthcarebiosciences,pittsburgh,pa,usa)上纯化。如通过nanodrop分光光度计上a280分析,抗fapa114n和抗fapa114c的表达分别为约3μg/ml和约1μg/ml。抗tem1a114n的表达为约0.04μg/ml。
4b.高糖基化的验证
为确认额外的糖基化位点引入了a114n突变体,从a114n突变体纯化的蛋白与野生型对照蛋白在还原sds-page上分析。一种额外的糖基化位点将添加2000-3000道尔顿至重链分子量。如图25所示,sds-page表明抗fap和抗tem1a114n突变体重链条带具有增加的表观分子量,与额外的糖基化位点向两抗体的成功引入相符。
4c.抗her2抗体高糖基化突变体的产生
her-2a114n、her-2a114n/nnas和wther-2抗体通过不依赖连接的克隆产生。合成并用lic-相容的引物集合pcr扩增野生型或带有a114n突变的赫赛汀(herceptin)的vh结构域。为获得全长抗体,将扩增的vh插入片段(wt或a114n)克隆入编码ch1-3结构域的两个pentr载体,pentr-lic-igg1wt和pentr-lic-igg1nnas,获得三种全长的突变体(a114n、nnas、a114n/nnas)和作为pentr上的入门克隆的wt对照。将这些突变体通过gateway克隆克隆入pcep4(-e+i)dest表达载体。通过dna测序确认突变。抗her-2野生型和突变的重链和轻链的氨基酸序列阐述于表7。突变的氨基酸以灰色标注且通过突变产生的共有糖基化靶位点为下划线部分。
表7.抗her-2抗体的氨基酸序列
4d.a114n抗her2抗体高糖基化突变体的表达
a114n抗her2和野生型构建体用lipofectamine-2000(试剂对dna的比率为2.5:1)和xtremegenehp(试剂对dna的比率为3:1)转染入在12份三烧瓶(12tripleflasks)中的hek293-ebna细胞中。从第3天的条件培养基(cm)的等分试样获得的octet测量结果显示蛋白表达对于lipofectamine-2000和xtremegenehp两者在6个烧瓶之间是一致的。如表8所示,整体转染效率用xtremegenehp高约30%。在第3天收集的条件培养基汇集在一起用于两种转染条件并通过蛋白a柱纯化。octet测量显示了在包含血清的模拟培养基中的1.8ug/ml抗体对比在无血清模拟培养基中的0ug/ml。
表8.a114n抗her2高糖基化突变体的表达
收集来自第6天的条件培养基并对于每种转染条件分别纯化。将两种洗脱物分别缓冲交换入ph7.2的pbs并使用amicon-4(50kd截留)柱浓缩~15倍。第6天的cm与第3天的cm相比显示更高的表达水平。如表8所示,从第六天的条件培养基产生共3mg15.59mg/ml的赫赛汀a114n(来自lipofectamine转染)和6mg16.86mg/ml的赫赛汀a114n(来自xtremegenehp转染)用于其他下游应用,如抗体药物缀合。
4e.a114n抗her2突变体的sds-page和hic分析
缀合前,纯化的a114n赫赛汀通过sds-page和hic(疏水相互作用色谱)表征。如图26所示,确定纯化的a114n赫赛汀的质量适于进一步的下游应用。
4f.工程化的糖基化的缀合
已证明了:a)糖基化位点在抗tem1上的kabat位置114处引入;b)通过还原sds-page该a114n突变体在重链上具有高糖基化;且c)通过完整的lc/ms,该a114n高糖基化突变体具有复杂糖结构,包括末端唾液酸和半乳糖,其对于sam和gam缀合是理想的。为确认工程化的糖基化位点适于缀合,抗tem1a114n与5kdapeg经由氨氧基化学方法缀合。如图27所示,peg通过氨氧基连接基成功与抗tem1a114n缀合。该突变体也成功在抗fap和抗cd-522c3骨架(未显示)上制备。这些数据证明n114处的糖基化位点可用于效应部分的缀合。
实施例5:s298n/y300sfc突变体的生成
设计并生成了工程化的fc变体,其中在eu位置ser298处引入新的糖基化位点,毗邻天然存在的asn297位点。保持或通过突变消除asn297处的糖基化。突变和预期的糖基化结果阐述于表9中。
表9:多种抗体变体的糖基化状态
5a.h66αβ-tcr抗体改变的糖基化变体的生成
在αβt-细胞受体抗体克隆#66的重链上通过quikchange使用pentr_lic_igg1模板进行突变。用lic引物扩增hebe1δabigg1#66的vh结构域,之后通过lic克隆入突变或野生型pentr_lic_igg1以生成全长的突变或野生型抗体。用draiii/xhoi双消化确认亚克隆,在成功的克隆中产生大致1250bp-大小的插入片段。将那些全长的突变体随后经由gateway克隆克隆入表达载体pcep4(-e+i)dest。通过dna测序确认突变。wth66抗αβtcr重链和轻链和突变的h66重链的氨基酸序列阐述于表10中。突变的氨基酸以灰色标注且通过突变产生的共有糖基化靶位点用下划线标注。
表10:h66抗αβtcr抗体的氨基酸序列
将突变体、野生型和两种无糖基化对照的(pcep4中的hebe1aglyigg4和hebe1δabigg1)构建体转染入在三烧瓶中的hek293-ebna细胞用于表达。从160ml的条件培养基(cm)用1mlhitrap蛋白a柱(ge)使用多通道蠕动泵纯化蛋白。五微克的每种所得上清在4-20%tris-甘氨酸还原和非还原sds-page凝胶上分析(参见图7)。无糖基化的突变体的重链(n297q、t299a和agly对照)具有迁移较远(箭头),与在这些抗体中聚糖的损失一致。然而,工程化的糖基化抗体的重链(nsy、sty、sy、δab和wt对照,箭头)与野生型对照迁移相似。该结果与在eu位置298处工程化的糖基化位点的存在一致。sec-hplc分析表明所有突变体都作为单体表达。
5b.通过lc-ms的糖基化分析
工程化的h66igg1fc变体用20mmdtt在37℃部分还原30min。样品随后通过毛细管lc/ms在与qstarqqtof混合系统(qstarqqtofhybridsystem)(appliedbiosystems)偶联的agilent1100毛细管hplc系统上分析。使用bayesian蛋白的重建和基线纠正以及analystqs1.1(appliedbisoystem)中的计算机建模用于数据分析。s298n/t299a/y300sh66抗体突变体中,在氨基酸位点298处观察到一个糖基化位点,其中双触角和三触角复合型聚糖作为主要品种与g0f、g1f和g2f一起检出(参见图39)。这种改变的糖基化概貌与在n298处的迁移糖基化而非在n297处的野生型糖基化一致。
5c.使用biacore的αβtcr抗体突变体与人fcγriiia和fcγri的结合性质
使用biacore评估与重组人fcγriiia(v158&f158)和fcγri的结合。cm5芯片的全部四个流动池用抗hpc4抗体经由biacore提供的标准胺偶联步骤固定。所述抗hpc4抗体在ph5.0的10mm醋酸钠中稀释至50μg/ml用于偶联反应并以5μl/min注射25min。将大致12,000ru的抗体固定至芯片表面。将重组人fcγriiia-v158和fcγriiia-f158在结合缓冲液(具有1mmcacl2的hbs-p)中稀释至0.6μg/ml并分别以5μl/min持续3min注射至流动池2和4以在抗hpc4芯片上捕获300–400ru受体。为在低结合者间进行区分,在抗hpc4表面捕获了比在该试验中通常使用的多达三倍的rhfcγriiia。将流动池1和3用作参照。每种抗体在结合缓冲液中稀释至200nm并持续4min注射至四个流动池中,随后在缓冲液中解离5分钟。表面用hbs-ep缓冲液中的10mmedta以20μl/min持续3min重生。这些实验的结果示于图8。
biacore也用于比较fcγri结合。将抗四his抗体使用zebadesalting柱缓冲交换入ph4.0的10mm醋酸钠中,并在醋酸缓冲液中稀释至25μg/ml用于胺偶联。cm5芯片的两个流动池用~9000ru抗四his抗体以5μl/min注射20min后固定。如之前的实验中,捕获多达十倍的fcγri至抗四-his表面以比较具有弱结合的样品。将重组人fcγri在hbs-ep结合缓冲液中稀释为10μg/ml并以5μl/min持续1min注射至流动池2以捕获~1000ru受体至抗四-his芯片。100nm单一浓度的抗体以30μl/min持续3min注射至捕获受体和对照的表面。随后,监测解离三分钟。所述表面随后用ph2.5的10mm甘氨酸以20μl/min的两次30秒的注射重生。这些实验的结果如图9所示。
这些结果证明糖工程化的突变体与fcγriiia或fcγr结合的显著降低。特别是h66s298n/t299a/y300s与两种受体都几乎完全消除了结合。选择该突变体用于更详细的分析。
5d.使用圆二色谱(cd)的稳定性表征
s298n/t299a/y300s抗体突变体的稳定性通过far-uvcd热熔实验监测,其中由于增加的温度导致抗体的去折叠(变性),因此监测了216nm和222nm处的cd信号。
温度通过热电珀耳帖(jasco模型awc100)控制并以1℃/min的速率从25℃增加至89℃。cd谱在jasco815分光光度计上以pbs缓冲液中大致0.5mg/ml的蛋白浓度于石英比色杯(hellma,inc)中用10mm的路径长度收集。扫描速度为50nm/min且数据间距为0.5nm。使用2.5nm的带宽伴随培养基的灵敏度设置。从210-260nm使用0.5nm的数据间隔和1℃的温度间隔收集cd信号和ht电压且对于每个样品实施四次重复扫描。结果证明δabh66和s298n/t299a/y300sh66突变体两者都显示相似的热行为且具有大致相同的针对降解的起始温度(大约63℃)(图40),进一步表明其具有可比较的稳定性。
实施例6:fc-工程化突变体的功能分析
通过pbmc增殖试验和细胞因子释放试验评估fc-工程化的突变体。在pbmc增殖试验中,人pbmc用浓度逐渐增加的治疗性抗体培养72小时,添加3h-胸腺嘧啶并在18小时后收获细胞。对于t细胞消耗/细胞因子释放试验,用浓度逐渐增加的治疗性抗体培养人pbmc并对细胞计数和生存力进行每日分析(vi-cell,beckmancoulter)至第7天(outtoday7)。还收获了细胞上清,在-20℃保存并在8-丛细胞因子面板(8-plexcytokinepanel)(bio-rad)上分析。
融化正常的供体pbmc并在下列条件下处理(都在包含补体的培养基中):未处理;bma031、moigg2b10ug/ml;okt3、moigg2a10ug/ml;h66、huigg1δab10ug/ml、1ug/ml和0.1ug/ml;h66、huigg1s298n/t299a/y300s10ug/ml、1ug/ml和0.1ug/ml。
在第2天(d2)和第4天(d4)收获细胞因子用于bioplex分析(il2、il4、il6、il8、il10、gm-csf、ifng、tnfa)。细胞在d4针对cd4、cd8、cd25和abtcr表达进行染色。
在图10-13中显示的结果证明h66s298n/t299a/y300s与h66δab在全部实施的基于细胞的试验中表现相似,表明通过cd25表达的最小t-细胞激活、与abtcr的结合(具有与δab稍微不同的动力学)和在d2和d4两个时间点的最小细胞因子释放。因此s298n/t299a/y300s突变体与δab突变同样有效地消除了效应功能。
实施例7:抗cd52抗体骨架中工程化fc变体的制备和表征
除h66抗αβtcr抗体外,s298n/y300s突变也在抗cd52抗体骨架(克隆2c3)中工程化。随后检测该突变体进而确定在s298n/y300sh66抗αtcr抗体中观察到的效应功能调节是否与另一抗体骨架一致。
7a.2c3抗cd52抗体改变的糖基化变体的生成
首先,通过快速变化诱变(quickchangemutagenesis)使用pentr_lic_igg1制备了s298n/y300s2c3变体dna,并将wt2c3vh通过lic克隆入突变的载体。将全长突变体使用gateway技术克隆入pcep4(-e+i)dest表达载体。随后通过dna测序确认突变且序列阐述于表11中。随后将突变体转染入在6孔板形式中的hek293-ebna细胞并从条件培养基纯化蛋白。抗cd522c3野生型抗体作为对照平行产生。使用sd-page和western印迹分析发现表达水平为0.1μg/ml(图15a)。还通过在biacore上蛋白a的捕获测量了在纯条件培养基(neatconditionedmedium)中突变体的表达。向固定的蛋白a注射6分钟后使用解离响应测定浓度。将在培养基中从90μg/ml系列稀释至1.5ng/ml的cho-产生的wt2c3用作标准曲线。通过校准曲线使用4参数拟合在大致0.2μg/ml内计算浓度。相对表达水平较低且与western印迹数据基本一致(图15b)。
表11:抗cd52克隆2c3抗体序列
7b.使用pngasef的糖基化分析
为评估通过突变引入的额外的糖基化位点,富集的s298n/y300s突变体用pngasef去糖基化。在分子量中未表明任何表观变化,这说明不存在额外的糖(图15)。实施了小规模制备以纯化这些突变体用于进一步表征,且结果再次确认在s298n/y300s突变体上不存在额外的糖(图16)。
7c.使用biacore的2c3抗cd52抗体突变体与人fcγriiia1的结合性质
还使用了biacore来表征抗原结合、fcγriii和纯化的抗体的结合性质(参见图17a-c、18和19a及b)。s298n/y300s2c3变体与cd52肽紧密结合且结合传感图与野生型对照无法区分,表明该突变并不影响其抗原结合(图17a)。
为测定fc效应功能,在结合研究中使用了fcγriii受体(val158)。突变体和野生型对照抗体稀释至200nm并注射至hpc4-标签捕获的fcγriiia。fcγriii结合对于s298n/y300s突变体几乎不可检测,这表明该变体效应功能的损失(图17b和图19a)。为进一步测定fc效应功能,还在结合研究中使用了fcγriii受体(phe158)。突变体和野生型对照抗体稀释至200nm并注射至hpc4-标签捕获的fcγriiia。fcγriii结合对于s298n/y300s突变体几乎不可检测,这表明使用phe158变体的效应功能损失(图19b)。最后,使用biacore比较纯化蛋白的fcrn结合性质。小鼠和sec-纯化的人fcrn-hpc4经由胺偶联固定至cm5芯片。将每种抗体稀释至200、50和10nm并注射至受体上。campath、cho-产生的wt2c3和depc-处理的campath包括在内作为阳性和阴性对照。这些数据显示突变体与人和鼠类fcrn受体以与野生型抗体对照相同的亲和力结合且其在循环半衰期或其他药代动力学性质中可能不具有改变(参见图17c、图18)。相应地,s298n/y300s突变大体上可应用于抗体以降低或消除不想要的fc效应功能,例如通过人fcγ受体的参与。
实施例8:s298n/y300s突变体中循环免疫复合体的检测
对于s298n/y300s突变体和wt对照,循环的免疫复合体的检测使用c1q结合试验研究。高度结合costar96-孔板在4℃用100μl在包被缓冲液中(0.1mnacho3ph9.2)浓度范围从10至0.001μg/ml的2倍系列稀释的2c3ab包被。elisa分析显示对于s298n/y300s突变体,与wt比较c1q结合降低(图20a)。抗fabab与包被的2c3ab的结合证实孔的等同包被(图20b)。
实施例9:使用等点聚焦的s298n/y300s突变体的分离和分析
运行ph3-10的等电聚焦(ief)凝胶以表征s298n/y300s突变体。发现s298/y300s具有更多个负电荷,且因此可能具有更多的唾液酸分子(图23a)。s298n/y300s突变体和wt2c3两者都通过完整的ms显示具有g0f和g1f作为主要的糖基化种类(分别在图23b和d中)。
实施例10:s298n/y300s的抗原结合亲和力
使用biacore比较从较小规模(图21)和较大规模(图22)表达制备和纯化的wt抗cd522c3ab和s298n/y300s突变体的抗原结合亲和力。获得了用cd52肽741和对照肽777固定的cm5芯片。抗体在hbs-ep中从60nm2倍系列稀释至0.2nm且随后持续3min注射至芯片表面,随后是以50μl/min的流动速率在缓冲液中5min的解离。表面随后用40mmhcl的脉冲再生。这些分析实施两次并证明s298n/y300s突变体和wt2c3抗体显示可比较的cd52肽结合。
设计了培养基筛选平台以在纯化前测试功能性结合性质进而在小规模转染过程中筛选生成的抗体。使用octet实施这些测试(图24a)以测定浓度并使用了蛋白a生物传感器和gld52标准曲线。将样品在hbs-ep稀释至7.5和2nm用于使用biacore的cd52结合比较(图24b)。肽结合试验的结果显示s298n/y300s突变体和wt2c3抗体都具有可比较的cd52肽结合。此外,这些分析表明octet和biacore在预测由来自小规模转染的抗体的抗原结合中表现良好。
实施例11:s298n/y300s、s298n/t299a/y300s和n297q/s298n/y300s改变的糖基化突变体在额外的抗体骨架中的制备
在抗αβ-tcr抗体和2c3抗cd-52抗体外,s298/y300s、s298n/t299a/y300s和n297q/s298n/y300s突变在其他抗体骨架中工程化以确认额外的串联糖基化位点可引入不相关的重链可变结构域序列。以不同方式糖基化的(alternativelyglycosylated)抗cd-5212g6和抗her2突变体阐述于表12和13中。
表12:抗cd52克隆12g6抗体序列
表13:抗her2抗体序列
实施例12.包含具有反应性的聚糖的改变的抗体的生成
为生成包含能够与衍生的效应部分反应的聚糖部分的抗体,首先使用糖基转移酶和相关的糖核苷酸供体在体外对抗her抗体糖基化。例如,为引入唾液酸残基,首先用β-半乳糖基转移酶将供体抗体糖基化,随后根据kanekoetal.(kaneko,y.,nimmerjahn,f.,andravetch,j.v.(2006)anti-inflammatoryactivityofimmunoglobulingresultingfromfcsialylation.science313,670-3)的方法用α2,6-唾液酸转移酶唾液酸化。反应在一锅合成步骤(one-potsynthesisstep)中使用β-半乳糖基转移酶(50mu/mg,sigma)和α2,6-唾液酸转移酶(5ug/mg,r&d系统)与供体糖核苷酸底物(包含5mmmncl2的50mmmes缓冲液中(ph6.5)的udp-半乳糖(10mm)和cmp-唾液酸(10mm))进行。包含5mg/ml抗her2抗体的反应混合物在37℃温育48小时。唾液酸化的验证使用由pngasef从抗体释放的全甲基化的聚糖的maldi-tofms分析,使用dionexhplc和使用sna(一种特异性针对α2,6-唾液酸的凝集素)的凝集素印迹的唾液酸含量分析。
通过唾液酸化的抗her2抗体的pngasef处理释放的聚糖的maldi-tof分析表明天然聚糖已用主要为单唾液酸化的双触角结构a1f与少量的双唾液酸化种类共同完全重塑(图32a)。用较高的量的α2,6-唾液酸转移酶处理抗体产生了更均质的a1f糖型的群体,表明酶活性或聚糖定位可能阻止了完全唾液酸化。唾液酸含量测定为~2mol每mol抗体,这与a1f聚糖作为主要糖型种类一致(图32b)。用特异性针对α2,6-连接唾液酸的san凝集素(黑色接骨木凝集素(sambucusnigraagglutinin))进行的凝集素印迹证实了以α2,6-连接基构型中存在的唾液酸(图32c)。
总之,尽管天然蛋白聚糖在某种程度上是异质的,但通过半乳糖和唾液酸转移酶的重塑获得几乎均匀的具有单唾液酸化但完全半乳糖基化的双触角聚糖(a1f)的抗体。在每个分支聚糖上的两个半乳糖受体上仅~1个唾液酸的引入可能是由于经常埋藏在抗体中的聚糖的半乳糖之一有限的可到达性或聚糖与蛋白表面非共价的相互作用。
实施例13.替代方法:包含具有反应性的聚糖部分的改变的抗体的氧化
用多种浓度的高碘酸盐(0.25至2mm)研究了唾液酸化的抗her2抗体的氧化。首先将唾液酸化的抗体缓冲交换入包含5mmedta的25mmtris-hcl(ph7.5),随后用pbs缓冲液进行缓冲交换。缓冲的抗体混合物随后应用至用pbs缓冲液预先平衡的蛋白a琼脂糖柱。用15柱体积的pbs、15柱体积的包含5mmedta的pbs和30柱体积的pbs洗涤柱后,随后用25mm柠檬酸盐磷酸盐缓冲液(ph2.9)洗脱。洗脱物立即用磷酸氢盐缓冲液中和并使用来自millipore的amiconultra浓缩抗体。纯化后,再用在100mm醋酸钠缓冲液中(ph5.6)的高碘酸钠(sigma)在暗处冰上持续30分钟氧化唾液酸化的抗her2抗体,且反应用3%甘油在冰上持续15分钟淬灭。产物通过5轮在50kdaamicon上的超滤脱盐并交换入100mm醋酸钠(ph5.6)中。图33a显示用多种高碘酸盐的量滴定的唾液酸化的抗体的唾液酸含量分析。唾液酸残基的完全氧化在大于0.5mm的高碘酸盐浓度获得。低如0.5mm的高碘酸盐浓度足以完全氧化引入的唾液酸。相应地,选择1mm浓度的高碘酸盐用于氧化用于药物缀合的唾液酸化的抗体。
氧化可对抗体的整体性具有不良作用。例如,接近fcrn结合位点的甲硫氨酸残基的氧化,包括位于fcch3区的met-252和met-428,已知影响对延长抗体血清半衰期至关重要的fcrn结合(wang,w.,等(2011)impactofmethionineoxidationinhumanigg1fconserumhalf-lifeofmonoclonalantibodies.molimmunol48,860-6)。相应地,为检测高碘酸盐氧化作用于对fcrn相互作用至关重要的甲硫氨酸残基(例如met-252)的潜在副作用,唾液酸化的抗体的氧化状态通过胰蛋白酶肽消化的lc/ms分析测定。该分析揭示唾液酸化的曲妥珠单抗用1mm高碘酸盐处理后,~30%的met-252氧化和<10%的met-428氧化。为测定这种程度的甲硫氨酸氧化对fcrn结合的影响,使用表面等离子体共振(biacore)评估fcrn对于每种抗体的结合动力学。该分析揭示了氧化状态与fcrn结合的少量损失相关(对于小鼠和人fcrn的12%和26%降低,分别参见图33b和33c)。值得注意的是,已报道对于人fcrn的ka中~25%的降低对人fcrn转基因小鼠中的血清半衰期无作用,这是由于单个完整的fcrn位点对每种抗体都足以提供功能性和pk优势(wang等,id)。
总之,这些数据表明通过唾液酸转移酶处理的高碘酸盐-敏感性唾液酸残基的引入允许浓度低得多的高碘酸盐的使用,获得对抗体-fcrn相互作用和对通过聚集体评估的抗体完整性的降低的副作用(≤1%)。
高糖基化的抗体突变体中的半乳糖也可使用半乳糖氧化酶特异性地氧化以生成用于缀合的醛基团。为证实该方法,将a114n抗tem1抗体浓缩至13-20mg/ml且随后用在pbs中的20mu/mg唾液酸酶在37℃处理6小时。去唾液酸产物随后用半乳糖氧化酶(“gao”)氧化,首先用5uggao/mg蛋白在37℃过夜,随后添加2uggao/mg蛋白并温育额外5小时。添加醋酸钠以调整ph至5.6(0.1v/v,ph5.6),并在缀合前添加dmso以获得16%的最终反应浓度。高糖基化突变体a114n抗her抗体(15mg/ml)相似地用唾液酸酶(20mu/mg)去唾液酸化,并在单反应中用5uggao每mg蛋白在37℃过夜氧化。
实施例14.具有反应性的效应部分的合成
为促进与醛衍生的抗体糖型的缀合,候选的药物效应部分(例如单甲基奥瑞他汀e(mmae)和多拉司他汀10(dol10))用氨氧基-cystamide衍生以包含特异性与醛反应的功能性基团(例如氨氧基-cys)。
简要地,为生成氨氧基-cystamide作为初始材料,将s-三苯甲基-l-半胱氨酰胺(362mg,1mmol)添加至3mlt-boc-氨氧基醋酸n-羟基琥珀酰亚胺酯的dmf溶液中(289mg,1mmol)。如从hplc分析显而易见的是反应在3h后完成。反应混合物随后用30ml二氯甲烷稀释并用0.1m碳酸氢钠溶液(2x20ml)、水(2x20ml)和盐水(2x20ml)洗涤。所述溶液在无水硫酸钠上干燥、过滤并浓缩至干燥。向该干燥残余物添加3ml的tfa,随后是150μl的三乙基硅烷。获得的溶液从叔丁基甲基醚沉淀并重复该过程三次。过滤后,将所述残余物在降低的压力下干燥,获得205mg灰白色固体(67%收率)。将该化合物用于下一步而无需进一步纯化。
为生成氨氧基衍生的mmae(氨氧基-cys-mc-vc-pabc-mmae),将30.1mg的氨氧基-cystamide(0.098mmol,2当量)与64.6mg的mc-vc-pabc-mmae(0.049mmol)和100μl的在3mldmf中的三乙胺组合。获得的反应混合物在室温搅拌15分钟,根据hplc分析通过这段时间完成了反应。该化合物通过制备型hplc纯化,获得45mg(62%)为灰白色固体的期望产物。反相hplc分析表明化合物的纯度为>96%。esi计算值对于c73h116n14o18s(mh)+为1509.8501;实测值m/z1509.8469。
为生成氨氧基衍生的dol10(氨氧基-cys-mc-vc-pabc-peg8-dol10),7.4mg(0.024mmol,3当量)的氨氧基-cystamide、12mg(0.008mmol)的mc-vc-pabc-peg8-dol10和30μl三乙胺在3ml的dmf中组合。根据hplc分析该反应在15分钟内完成。制备型hplc纯化获得了6.2mg(46%)为灰白色固体的预期产物。反相hplc分析表明化合物的纯度为>96%。esi计算值对于c80h124n16o19s2(mh)+为1678.0664,实测值m/z1678.0613。
实施例15.唾液酸介导(sam)的具有反应性的效应部分的缀合
脱盐后,将实施例13的药物接头与实施例12的氧化、唾液酸化的抗体用75%dmso(0.167v/v)以25mm的浓度组合以获得24:1的药物接头比抗体摩尔比率和5mg/ml的抗体终浓度。该混合物在室温温育过夜。未并入的药物接头和任何游离的药物使用biobeads清除。产物使用pd-10柱缓冲交换入组氨酸-吐温缓冲液并过滤除菌。测定内毒素水平且对于体内研究获得了少于0.1eu/mg的adc。
图34a-c显示与ao-mmae糖缀合的不同唾液酸化的抗体(抗fapb11和g11和实施例13的抗her2抗体)的疏水相互作用色谱(hic)。唾液酸化的her2抗体也与药物接头ao-cys-mc-vc-pabc-peg8-dol10缀合(图34d)。该分析揭示了每抗体主要存在一个或两个药物缀合物,具有范围在1.3-1.9的药物比抗体比率(dar)。与mmae糖缀合物(图34c)相比dol10糖缀合物(图34d)增加的保留时间可能是由于dol10更强的疏水性所致。
还用与两种不同药物接头(ao-mmae或ao-peg8-dol10)缀合的抗her抗体以30mg的规模实施了lc-ms分析。该分析显示1.7和1.5(缀合后)的相似dar值,其与hic分析具有可比性。尺寸排阻色谱(sec)显示在这些缀合物中非常低的聚集物水平(1%)。
实施例16.半乳糖介导(gam)的具有反应性的效应部分的缀合
如实施例13所述用半乳糖氧化酶在a114n抗tem1高糖基化突变体抗体上生成的半乳糖醛基与24摩尔过量的抗体上的氨氧基-mc-vc-pabc-mmae药物接头通过25℃过夜温育缀合,获得具有1.72dar的adc缀合物。
向如实施例13所述制备的半乳糖氧化酶-处理的抗her抗体添加十分之一反应体积的ph5.6的1m醋酸钠以调整ph至5.6,并添加dmso以生成14%的终浓度,之后添加24当量(eq.)氨氧基mc-vc-pabc-mmae药物接头。反应在室温温育过夜。游离的药物和药物接头用biobead清除且产物由sec缓冲液交换(65%收率)。产物缀合物通过hplc分析。如图35所示,ao-mmae已与~60%的分子缀合。
实施例15.体外adc细胞增殖试验
抗her和抗fap糖缀合物分子的体外活性也与相应的包含相同药物部分经由巯基连接基与相同供体抗体的铰链区半胱氨酸连接的巯基缀合物进行了比较。相比糖缀合物,所述巯基缀合物包含大致两倍数目的药物每抗体(dar)。基于巯基的缀合如stefanoetal(methodsinmolecularbiology2013,出版中)所述实施。随后采用her2+sk-br-3和her2-mda-mb-231细胞系评估每种adc的相对效力。该分析的结果示于下列表15中。
表15.糖缀合物和巯基缀合物ec50的比较
注意:*dar由lc-ms测定;**dar由hic测定
图36a-d显示抗her糖缀合物和其对应的巯基缀合物体外效力的比较。细胞生存力在将缀合物暴露于her2抗原表达(sk-br-3)细胞(图36a和c)或非表达(mda-mb-231)细胞(图36b和d)72hr后测定。adc包含与聚糖(“糖”)或通过常规化学与铰链区的半胱氨酸(“巯基”)连接的mmae或peg8-dol10。如图36a和c所示,对于巯基缀合物观察到与糖缀合物相比~2倍更低的ec50,这与前者与后者相比2倍更高的dar一致。her2细胞系与任何多至100ug/ml的抗体未观察到毒性。
对于用针对肿瘤抗原(fap)(其在包括结肠、胰腺和乳腺癌的上皮癌中通过具有反应性的间质成纤维细胞高度表达)的抗体制备的adc,在细胞增殖中观察到相似的趋势(teicher,b.a.(2009)antibody-drugconjugatetargets.currcancerdrugtargets9,982-1004)。这些缀合物再次通过将氨氧基mmae药物接头或马来酰亚胺mmae药物接头与聚糖或巯基基团缀合制备。这些缀合物的细胞增殖试验显示巯基缀合物的ec50对于用人fap转染的cho细胞与缺乏fap表达的相同细胞相比具有~100倍更高的效力,如图37所示,其表明抗fapb11糖缀合物与巯基缀合物体外效力的比较。将缀合物暴露于用或不用fap抗原转染的cho细胞后对细胞生存力进行了测定。adc包含与聚糖(“糖”)或通过常规化学与铰链区的半胱氨酸(“巯基”)连接的mmae。注意假定对于靶结合和抗原表达cho细胞中内化的效力相似,与糖缀合物相比对于巯基~2倍更低的ec50与每抗体递送药物的相对量一致。平行测定了如之前所述的具有1.5dar的抗fap(b11)adc糖缀合物且显示相比对应的巯基缀合物~2倍更高的ec50(dar3.3)。
如图41所示,对于如实施例16所述用带有a114n高糖基化突变的抗her抗体和ao-mmae制备的adc,当在sk-br-3表达细胞或mda-mb-231上试验时,在细胞增殖试验中观察到了相似的趋势。a114n糖缀合物清楚表明了针对her2表达细胞系相比非表达细胞系增强的细胞毒性。与用相同抗体制备的sialt糖缀合物相比的相对毒性与该制剂较低的药物载荷一致。
如实施例16所述,对于用带有a114n高糖基化突变的抗tem1抗体和制备的ao-mmae制备的adc,也实施了细胞增殖试验。与非表达mda-mb-231细胞系相比用tem1-表达细胞系sjsa-1和a673观察到了较高的毒性。与用相同抗体的常规巯基缀合物相比,毒性水平与该制剂的药物载荷(dar)保持一致。
总之,通过聚糖与裂解接头的位点特异性缀合产生的adc具有与常规基于巯基的缀合物等同的毒性和体外效力,如使用不同抗体和不同药物接头所证明。此外2mm以下的高碘酸盐,药物缀合水平与唾液酸的还原相关。增加高碘酸盐至2mm以上产生小到几乎没有的益处,如根据唾液酸变成氧化形式的完全转换所预期的。然而,在所有条件下,药物每抗体的数目相比唾液酸含量稍低,表明氧化的唾液酸中的一些可能相似地不可用于缀合,这是由于其被埋藏或是另外由于因药物接头的大体积所引起的空间位阻所致。
实施例18.抗体药物缀合物的体内表征
抗her糖缀合物的效力还在her2+肿瘤细胞异种移植模型中进行了评估并与具有约2倍更高dar的巯基缀合对应物进行了比较。为beige/scid小鼠植入sk-ov-3her2+肿瘤细胞,使其能够在治疗开始前建立~150mm3的肿瘤。3或10mg/kg剂量的adc在第38、45、52和59天通过尾部静脉注射。~10只小鼠每组。测量了不同组中小鼠的肿瘤体积并记录了其生存率。基于kaplan-meier方法绘制了生存曲线。
图38a-d显示抗her糖缀合物和巯基缀合物在her2+肿瘤细胞异种移植模型中体内效力的比较。植入sk-ov-3her2+肿瘤细胞的beige/scid小鼠用包含糖缀合物或~2倍更高dar的巯基缀合物对应物的mmae(图38a和b)和peg8-dol10(图38c和d)给药。mmae缀合物的肿瘤生长动力学示于图38a。该情况中,糖缀合物显示相比裸抗体本身(黑色)显著更高但相比具有~2倍更高dar的巯基缀合物对应物(绿色)低的效力。mmae糖缀合物显示显著的肿瘤消退和肿瘤生长~20天的延迟(图38a)和从第一次给药起在生存时间上的~2倍增加(图38b)。巯基mmae缀合物在相同的adc剂量(10mg/kg)显示出近乎完全的肿瘤抑制。
peg8-dol10糖缀合物(“糖dol10’)和具有~2倍更高dar的巯基缀合对应物(“巯基dol10”)的体内效力在相同的her2+肿瘤细胞异种移植模型中进行了测定。两种缀合物都显示了相比如前文所述的mmae缀合物低的效力。然而,10mg/kg的氨氧基-peg8-dol10糖缀合物(“糖dol10”)显示肿瘤生长中15天的延迟(图38c)和第一次施用后生存时间的~20天(1.7-倍)的增加(图38d)。巯基缀合物在相同剂量更加有效,展示生存率的2-倍增加。在较低的剂量(3mg/kg),巯基缀合物展示相比10mg/kg糖缀合物低的效力。相比对于糖缀合物110umolpeg8-dol10药物每kg剂量,该剂量与80umolpeg8-dol10药物每kg剂量对应。
这些数据证明药物向抗体聚糖的唾液酸上的位点特异性缀合获得具有与经由基于巯基化学生成的adc相比可比较的效力的分子。在某种程度上较低的体内效力可能源于由每个抗体携载通过每个抗体结合抗原内化入肿瘤细胞中的药物数量较少。尽管我们尚未比较这些糖缀合物与具有相同dar的巯基缀合物,但是在代表施用药物可比较水平的两种adc的不同剂量观察到的效力显示糖缀合物具有与其巯基对应物相比可比较的固有效力,表明在该位点的缀合无有害影响。此外,仅引入28%更多药物的dol10糖缀合物的10mg/kg剂量在生存率上提供超过巯基缀合物(以3mg/kg)的2倍增加,表明这些缀合物在相同的dar甚至提供具有优势的效力。鉴于唾液酸在天然聚糖上并入的明显限制,较高的药物载荷可通过多种不同策略实现,包括支链药物接头的使用或额外糖基化位点的引入和使用相同方法。
实施例19.靶向部分的缀合
图42证明了用于将靶向部分缀合至已有的糖或工程化的糖基化位点的总体方案。这种缀合可以通过将新聚糖、糖肽或其他靶向部分附接至氧化的唾液酸化的抗体来进行(图43和44)。适于缀合的部分可以包括含有氨基氧基接头的那些(图45和46)。
实施例20.天然fc聚糖中经由唾液酸的缀合
将甘露糖-6-p六甘露糖氨基氧基缀合至特异性靶向man-6-p受体的多克隆抗体或单克隆抗体。抗man-6-p受体兔多克隆抗体与man-6-p六甘露糖氨基氧基的缀合的sds-page和maldi-tof分析示于图47中。图48描绘了用于测定对照和缀合有man-6-p六甘露糖的抗man-6-p受体兔多克隆igg抗体与m6p受体的结合的表面等离子体共振实验的结果。这种缀合抗体的体外分析证明了hepg2(人(homosapiens)肝细胞癌)和raw(鼠(musmusculus)的鼠白血病)细胞系二者中的增加的摄入(图49)。培养物用抗兔alexa488抗体染色,用dapi复染(counterstain)。
将缀合有m6p或乳糖氨基氧基部分的抗体进一步通过sds-page和凝集素印迹进行测试,并与未缀合的抗体比较(图50)。对照及缀合抗体的maldi-tof完整蛋白质分析证明缀合物的每个抗体具有约2个聚糖部分,而对照抗体则没有(图51)。
实施例21.抗体中经唾液酸与铰链半胱氨酸残基的缀合
将甘露糖-6-p六甘露糖马来酰亚胺缀合至特异性靶向man-6-p受体的多克隆抗体或单克隆抗体。
通过sds-page、凝集素印迹和m6p定量(用以确定每个抗体缀合的聚糖数目)测试了多克隆抗体经铰链半胱氨酸与man-6-p六甘露糖马来酰亚胺的缀合(图52)。还通过使用sds-page来测试了多克隆抗体与乳糖马来酰亚胺的缀合,并且对照抗体、缀合的抗体、以及滤液的半乳糖定量示于图53。通过尺寸排阻色谱(sec)观察到了缀合有铰链半胱氨酸的多克隆抗体的稍微增加的聚集(图55)。
还通过sds-page和聚糖定量(用以确定每个抗体缀合的聚糖数目)测试了单克隆抗体经铰链半胱氨酸与man-6-p六甘露糖马来酰亚胺的缀合(图54)。通过尺寸排阻色谱(sec)观察到了缀合有铰链半胱氨酸的多克隆抗体的稍微增加的聚集(图56)。
还通过非变性page(nativepage)测试了双m6p六糖(hexasaccharide)经天然fc聚糖或铰链二硫化物与多克隆抗体和单克隆抗体的缀合(图60)。
实施例22.唾液酸化单克隆抗体的制备和与三半乳糖基化糖肽或糖肽的缀合
用唾液酸酶和半乳糖基转移酶修饰具有sty突变(nnas)的小鼠单克隆抗体突变体,以主要制备天然的三半乳糖基化的聚糖(每个抗体2个聚糖)。同样的突变体还用唾液酸转移酶进行唾液酸化,并使用sam方法与糖肽缀合。测试了酶修饰抗体的唾液酸含量(图57)。此外,测试了从对照和去唾液酸化/半乳糖基化的(图58)nnas释放的聚糖以及从对照和唾液酸化的(图59)nnas释放的聚糖的maldi-tof分析。酶修饰和缀合的nnas的sds-page(4-12%nupage)和凝集素印迹示于图61。还测量了对照nnas抗体,去唾液酸化/半乳糖基化的nnas抗体和缀合的nnas抗体的末端半乳糖定量(图62)。
实施例23.用化学酶法制备α2,3唾液酸化的乳糖马来酰亚胺然后经铰链二硫化物缀合至非免疫的兔igg
由于糖结合蛋白(包括siglec蛋白)偏向于多价结合以供强相互作用,给定抗体上的单唾液酸化聚糖可能不能为其他siglec蛋白提供足够的唾液酸密度。因此,研究了用于引入多个唾液酸化聚糖拷贝的铰链二硫键缀合方法。为了产生用于缀合的唾液酸化聚糖,将乳糖马来酰亚胺(5mg)在tris缓冲液(ph7.5)中用来自美人鱼发光杆菌(photobacteriumdamsela)的α2,3唾液酸转移酶在37℃处体外唾液酸化2小时。在无唾液酸转移酶的条件下温育对照聚糖,并与初始聚糖进行比较。maldi-tof分析显示,在tris缓冲液(ph7.5)中将不含酶的乳糖马来酰亚胺在37℃温育2小时未改变分子的预期分子量,这表明测试条件没有导致马来酰亚胺水解。用α2,3唾液酸转移酶修饰的聚糖的maldi-tof和dionexhplc分析表明唾液酸乳糖的存在,尽管不是主峰(数据未显示)。因此,使用qae-琼脂糖凝胶柱额外纯化了唾液酸乳糖马来酰亚胺,随后使用maldi-tof和dionexhplc分析每个级分。这些分析表明,唾液酸乳糖马来酰亚胺作为主要种类存在于qae柱的20mmnacl洗脱液中(图63)。使用样品的唾液酸定量分析估计纯化的唾液酸化聚糖的量,表明了约1.8mg唾液酸乳糖马来酰亚胺的回收。
使用硫醇化学法测试了兔多克隆抗体与该唾液酸乳糖马来酰亚胺的随后缀合。在37℃,以4摩尔超量(相对于抗体),用tcep将兔igg抗体(1mg)还原2小时,然后在室温与24摩尔超量的唾液酸乳糖缀合1小时。然后将缀合物缓冲液交换至pbs中用于sds-page上的分析(图64a)。还用dionexhplc进行了唾液酸定量(图64,b)。将对照和硫醇缀合物的等分试样在37℃用或不用唾液酸酶(1u/mg)处理过夜,然后通过过滤(10kdamwco)回收上清液。测量上清液的唾液酸含量,并与未用唾液酸酶处理的样品进行比较。每抗体偶联有约4个α2,3唾液酸乳糖部分。
实施例24.通过将乳糖马来酰亚胺唾液酸化制备α2,6唾液乳糖马来酰亚胺,并通过α2,3-或α2,6-键与兔多克隆抗体的铰链二硫化物偶联,导致高唾液酸化
研究了多拷贝的α2,3-或α2,6-唾液酸化聚糖与兔多克隆抗体的铰链二硫化物的缀合。由于使用化学酶法(参见上文实施例23)成功地制备了α2,3唾液酸乳糖马来酰亚胺,使用类似的方法制备α2,6唾液酸乳糖马来酰亚胺(方案的微小修改包括使用不同的唾液酸转移酶)。为了产生α2,6唾液酸化聚糖用于缀合,将乳糖马来酰亚胺(~5mg)在体外用0.5u来自美人鱼发光杆菌的α2,6唾液酸转移酶在tris缓冲液(ph8)中于37℃唾液酸化1小时。酶促反应后,将产物施用于qae-琼脂糖凝胶柱。用10份1ml2mmtris(ph8),5份1ml含有20mmnacl的tris缓冲液和5份含有70mmnacl的1mltris缓冲液来洗涤柱。使用dionexhplc和乳糖和α2,6唾液酸乳糖标准品分析来自每个级分的等分试样。标准品和洗脱级分之一的寡糖图谱示于图65(a-d)中。还通过maldi-tof分析并确认了含有α2,6唾液乳糖马来酰亚胺的级分。其中一个级分中的聚糖可见于图66。
然后使用唾液酸定量分析估算纯化的α2,6唾液酸乳糖马来酰亚胺的量,其表明约1.5mg唾液酸乳糖马来酰亚胺的回收。
一旦制备了聚糖,使用硫醇化学法测试抗体与α2,6唾液酸乳糖马来酰亚胺或α2,3唾液酸乳糖马来酰亚胺的缀合。缓冲液交换兔多克隆igg抗体(1mg),并在37℃以4摩尔超量(相对于抗体)用tcep还原2小时。然后将还原的抗体分成两半:在室温将一部分与24摩尔超量的α2,6唾液乳糖马来酰亚胺缀合,另一部分与α2,3唾液酸乳糖马来酰亚胺缀合1小时。然后将两种缀合物在进行缓冲液交换至pbs中,然后进行sds-page分析(图67a)和用dionexhplc进行唾液酸定量(图67b)。用唾液酸定量来估算缀合的聚糖的数目。对照抗体和缀合有硫醇的抗体的等分试样在37℃用或不用唾液酸酶(1u/mg)处理过夜,然后通过过滤(10kdamwco)回收上清。测量上清的唾液酸含量,并与不勇唾液酸酶处理的样品(对照)进行比较。分析表明通过该方法约有7个聚糖(α2,3-或α2,6-唾液酸乳糖聚糖)与多克隆抗体缀合。
实施例25.用gam化学法对nnas的聚乙二醇化
将小鼠nnas(s298n/t299a/y300s)突变体单克隆抗体半乳糖基化和二唾液酸化,生成galnnas单克隆抗体,而不用任何蛋白酶降解。该抗体用半乳糖氧化酶(gao)修饰以生成半乳糖醛。然后将半乳糖醛与2或5kda的氨基氧基聚乙二醇(peg)缀合。图68描绘了使用sds-page和凝集素印迹的对照和酶修饰的(二唾液酸化/半乳糖基化)nnas突变体抗体的表征。图69描绘了用不同量的半乳糖氧化酶的对照抗体和galnnas的聚乙二醇化的还原型sds-page的表征。这些结果表明,galnnas可以用显著量的每重链缀合的单-、双-和三-peg有效聚乙二醇化。图71描绘了通过对照抗体和(相对于抗体)具有各种摩尔超量peg的galnnas的聚乙二醇化的还原型sds-page的表征。表征抗体的聚乙二醇化的proteinsimple扫描证明每条重链缀合有约1.5-1.7个peg部分(或约每个抗体3-3.4个peg)(图70和72)。
实施例26.用gam化学法对nnas的聚乙二醇化
nnas抗体用50mu/mg半乳糖基转移酶半乳糖基化,随后用50mmmes缓冲液(ph6.5)中的1u/mg唾液酸酶去唾液酸化。然后在存在或不存在0.5mm乙酸铜的情况下用半乳糖氧化酶(57mu/mg)/过氧化氢酶处理去唾液酸化的胎球蛋白和nnas以及半乳糖基化的nnas,然后与25摩尔超量的5kda氨基氧基peg缀合(图74,a)。在另一个实验中,在0、0.02、0.1和0.5mm乙酸铜存在下,用半乳糖氧化酶(57mu/mg)/过氧化氢酶处理半乳糖基化的nnas(图74,b),然后与25摩尔超量的5kda氨基氧基peg缀合。在乙酸铜存在下用半乳糖氧化酶氧化的抗体显示出比不存在乙酸铜时与半乳糖氧化酶反应的相同抗体更高程度的聚乙二醇化。当在含有浓度高于0.1mm的硫酸铜的反应中进行缀合时,观察到显著更高水平的聚乙二醇化。
实施例27.使用唾液酸酶/半乳糖基转移酶修饰野生型和突变体赫赛汀
将野生型和突变体(a114n,nnas和a114n/nnas)赫赛汀抗体用50mu/mg半乳糖基转移酶进行酶促修饰,随后用50mmmes缓冲液(ph6.5)中的1u/mg唾液酸酶进行去唾液酸化。使用sds-page(还原的和非还原的),具有ecl的凝集素印迹(一种对于末端半乳糖具有特异性的植物凝集素)和使用由半乳糖苷酶释放的半乳糖的dionexhplc分析的末端半乳糖定量来分析修饰的抗体(图75)。使用nnas和nnas/a114n双突变体获得含有约3至9个末端半乳糖的酶修饰的抗体,其表现出比野生型和a114n突变体更高水平的末端半乳糖。
实施例28.使用sam缀合法的野生型和突变体抗体的聚乙二醇化
将野生型和(a114n,nnas和a114n/nnas)赫赛汀抗体用唾液酸介导的(sam)缀合来聚乙二醇化。随后用2mm高碘酸钠氧化抗体。缓冲液交换后,将氧化的抗体用25摩尔超量的5kda氨基氧基peg来聚乙二醇化。使用dionexhplc测量野生型和突变体抗体的唾液酸含量(图76)。然后使用还原和非还原型sds-page分析聚乙二醇化的抗体(图77)。此外,通过使用proteinsimple分析扫描的凝胶来估算聚乙二醇化(par,每个抗体的peg数目)(图78)。nnas,a114n和a114n/nnas突变体均显示出比野生型赫赛汀抗体(1.4)高的par(2.7-4.6)。
实施例29.具有含聚糖配体的半乳糖的糖工程化抗体的摄取的研究
将多克隆抗体用半乳糖基转移酶(gal转移酶)进行酶促修饰,与乳糖氨基氧基(gal-glc至297:与来自唾液酸化抗体的asn-297的聚糖中的唾液酸缀合)或与乳糖马来酰亚胺缀合(gal-glc至铰链:与铰链二硫化物中的半胱氨酸缀合)。然后将对照、修饰的或缀合的抗体与hepg2细胞(表达asgpr的肝细胞系)在37℃温育1-2小时,然后使用免疫荧光染色测量摄取的抗体(图79)。结果显示酶促修饰的或乳糖缀合的抗体的hepg2细胞摄取增加。
实施例30.三价galnac聚糖与赫赛汀的缀合
将赫赛汀(抗her2)唾液酸化并与三价galnac聚糖缀合(图80),用于使用sam方法靶向asgpr。随后,用表面等离子体共振实验(biacore)评估这些缀合有三价galnac聚糖的抗体与asgpr受体亚基h1的结合(图81)。
实施例31.三价galnac和三价半乳糖与重组溶酶体酶的缀合
使用sam缀合法将重组溶酶体酶与含有糖肽的三价galnac聚糖或三价半乳糖(图82)缀合,用于靶向asgpr。随后,用表面等离子体共振实验(biacore)评估这些缀合有三价galnac聚糖和三价半乳糖的酶与asgpr受体亚基h1的结合(图83)。结果显示,缀合有三价galnac聚糖的重组溶酶体酶的asgpr结合强。
实施例32.使用甘露糖胺衍生物(包括manlev)用于体外抗体唾液酸化和缀合
用包括manlev,mannaz和manaz在内的甘露糖胺衍生物来制备唾液酸衍生物以及随后的cmp-唾液酸衍生物,用于抗体唾液酸化,然后进行位点特异性缀合。使用hpaec-pad表征制备的cmp-唾液酸衍生物,并用于体外抗体唾液酸化。最后,使用sam方法将唾液酸化抗体聚乙二醇化,而无高碘酸氧化。
在37℃用不同量的cmp-唾液酸合成酶(n.mentingitidis)滴定唾液酸(0.2μmol)。使用hpaec-pad监测cmp-唾液酸的产生,与cmp-唾液酸标准品的保留时间相比。绘制合成的cmp-唾液酸对所用酶量的关系,并表明cmp-唾液酸的产生由cmp-唾液酸合成酶饱和于每0.2μmol为5mu(图84)。
在37℃用不同量的唾液酸醛缩酶(大肠杆菌k-12)滴定mannac或manlev(0.2μmol)。使用hpaec-pad监测唾液酸(来自mannac)或唾液酸衍生物(来自manlev)的产生,与唾液酸标准品的保留时间相比。合成的唾液酸或唾液酸衍生物对使用的酶量关系如图85(macnac)和图86(manlev)所示。
为了表征使用hpaec-pad的唾液酸衍生物,首先在37℃用唾液酸酶消化cmp-唾液酸(来自mannac)或cmp-唾液酸衍生物(来自manlev)。与唾液酸标准品的保留时间相比,使用hpaec-pad监测释放的唾液酸或唾液酸衍生物,并通过高碘酸盐处理后唾液酸峰的消失也证实了唾液酸的身份(图87)。唾液酸衍生物(来自manlev)比唾液酸更晚被洗脱。
还在没有唾液酸酶预处理的hpaec-pad上直接分析了cmp-唾液酸(来自mannac)和cmp-唾液酸衍生物(来自manlev,mannaz,manaz)。将cmp-唾液酸的产生与cmp-唾液酸标准品的保留时间进行比较。由manlev,mannaz和manaz生产的cmp-唾液酸衍生物与cmp-唾液酸标准品相比显示出不同的保留时间(图88和89)。
此外,使用α2,6唾液酸转移酶和cmp-唾液酸衍生物在体外将赫赛汀唾液酸化。图90是使用制备自manlev的唾液酸衍生物来证明赫赛汀的唾液酸化的示意图。使用由ides蛋白酶释放的ch2ch3片段的lc-ms分析唾液酸化。图91显示了用制备自manlev的唾液酸衍生物(具有正确的质量)对赫赛汀的唾液酸化。
最后,将用制备自manlev和mannaz的唾液酸衍生物唾液酸化的赫赛汀聚乙二醇化。图92是示意图,其显示用制备自manlev的唾液酸衍生物唾液酸化的赫赛汀的聚乙二醇化。首先,赫赛汀在体外用α2,6唾液酸转移酶和制备自manlev的cmp-唾液酸衍生物进行唾液酸化。随后,将唾液酸化抗体与5kda氨基氧基peg混合。然后在还原和非还原条件下使用sds-page分析唾液酸化和聚乙二醇化抗体。用制备自manlev的唾液酸衍生物聚乙二醇化的唾液酸化赫赛汀的sds-page分析见图93。图94是显示用制备自mannaz的唾液酸衍生物对抗体的唾液酸化的示意图。使用制备自mannaz的唾液酸衍生物预先唾液酸化的聚乙二醇化赫赛汀的sds-page分析,如图95所示。
- 还没有人留言评论。精彩留言会获得点赞!