一种含有马来酸依那普利、叶酸和酸稳定剂的药物组合物的制作方法
本发明属于医药制剂领域,具体涉及一种含有马来酸依那普利、叶酸和酸稳定剂的药物组合物。
背景技术:
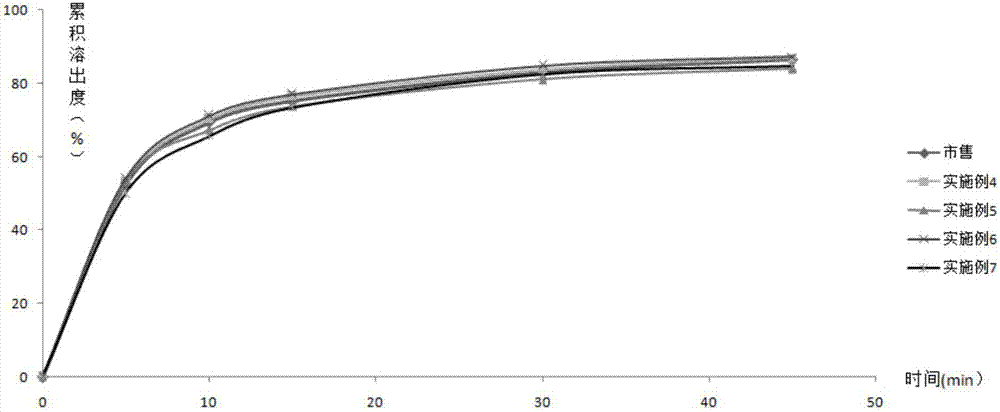
:中国心脑血管事件疾病谱与西方人群明显不同。我国人群脑卒中的年发病率为250/10万,心血管事件的年发病率为50/10万,脑卒中发病率是心血管事件发病率的5倍。在观察降压对心脑血管事件影响的临床试验中,我国高血压人群脑卒中/心肌梗死发病比值为6~13∶1,而西方高血压人群约为1∶1,提示脑卒中是我国高血压人群最主要的心脑血管事件,且我国人群可能存在血压增高之外的导致脑卒中的风险因素。高血压、高同型半胱氨酸(homocysteine,,hcy)血症、低叶酸均为脑卒中的重要危险因素。受人群遗传特征性影响,中国高血压患者中伴有血浆hcy水平升高(h型高血压)的比例高达75%,h型高血压高发可能是导致我国脑卒中高发病率和持续发展的重要原因。马来酸依那普利叶酸片是从我国人群遗传特征出发,体现多重危险因素(高血压、高hcy、低叶酸)综合防治的复方药物。马来酸依那普利降低高血压病人的血压,叶酸可以降血浆同型半胱氨酸水平,马来酸依那普利叶酸于2008年3月获得cfda批准上市,用于治疗伴有血浆同型半胱氨酸水平升高的原发性高血压,2010年成为《中国高血压防治指南》新亮点,2013年进入国家基本药物目录。cn1269529c保护了含有血管紧张素转化酶抑制剂和b族维生素的药物组合物,该组合物可以提高降压药的疗效,增强靶器官保护作用,减少眼底出血、心绞痛、肾功能衰竭等并发症的发生率。实施例1和2公开了马来酸依那普利和叶酸复方制剂的处方工艺,重复其操作,发现得到制剂稳定性较差,高温60℃、高湿rh92.5%条件下放置10天,杂质依那普利双酮和依那普利拉显著增加,其结构式如下:马来酸依那普利,化学名称为n-[(s)-1-(乙氧羰基)-3-苯丙基]-l-丙氨酰-l-脯氨酸顺丁烯二酸盐。马来酸依那普利原料药比较稳定,但是马来酸依那普利制剂较不稳定,与多种辅料相容不好,贮藏时杂质明显增加,且降解杂质受溶液ph值影响,当溶液ph值<5时,其主要降解产物是依那普利双酮,当溶液ph值≥5时,主要降解产物是依那普利拉。现阶段增加马来酸依那普利稳定性的方法有以下几种:(1)加入碱性物质碳酸氢钠,可以将马来酸依那普利的羧基转化成羧酸盐阴离子,能够将环化反应降到最小,从而抑制依那普利双酮的生成。但是此方法对于含有叶酸的马来酸依那普利复方药物并不适用,处方中加入碳酸氢钠,高温60℃放置10天,依那普利双酮杂质仍然明显增加,无法保证药物在临床上的安全使用和长期存放。(2)将依那普利与环糊精包合,然后做成制剂。被环糊精包合的依那普利由于空间限制和分子间相互反应降低了其药物分子的活动性,从而限制了固态下或者溶液中分子内亲核反应的可能性;但是辅料中加入羟丙基β-环糊精对人体有肾毒性和溶血性的不良反应,羟丙基β-环糊精口服给药在分别给予小鼠、大鼠、狗5000mg/kg,给药时间长达1年,上述试验动物除出现腹泻,给药时间达2年时部分大鼠出现胰腺癌,环糊精的使用存在不安全风险。糊精在水中的水解不均匀,不稳定,影响溶出,且对药物有一定的吸附作用,可能会干扰主药的含量测定,因此处方中应避免使用糊精。(3)加入酸稳定剂,cn102357084报道了在马来酸依那普利处方中加入苹果酸或酒石酸,cn105125514报道了在马来酸依那普利处方中加入精氨酸来提高制剂的稳定性。参考其配方制备马来酸依那普利叶酸片剂,发现苹果酸或精氨酸并不能提高马来酸依那普利叶酸复方制剂的稳定性,在高温60℃放置10天,马来酸依那普利双酮仍然明显增加,大于2%。(4)选择合适的晶型,马来酸依那普利存在多晶型现象,有i型和ii型之分,虽然有报道说两种晶型能量相似,相差仅0.6kcal/mol,但是在片子中ii型更不稳定。叶酸,化学名称n-[4-[(2-氨基-4-氧代-1,4-二氢-6-蝶啶)甲氨基]苯甲酰基]-l-谷氨酸,主要降解杂质为碟酸,其结构式如下:药物制剂稳定性是指药物制剂从制备到使用期间保持稳定的程度,通常指药物制剂的体外稳定性。药物制剂的最基本的要求是安全、有效、稳定。药物制剂在生产、贮存、使用过程中,会因各种因素的影响发生分解变质,从而导致药物疗效降低或副作用增加,有些药物甚至产生有毒物质,也可能造成较大的经济损失。固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。根据cfda的规定,仿制药的溶出度标准应与参比制剂一致。因此如何进行马来酸依那普利叶酸处方设计,提高复方制剂的稳定性,提高制剂质量,同时制剂与市售溶出一致,是一个函待解决的问题。技术实现要素:本发明目的在于提供一种新的马来酸依那普利叶酸组合物,该组合物稳定性好,可以保证药物在临床上的安全使用,工艺操作简单,适于工业化生产。申请人通过尝试在处方中加入不同的酸化剂,如枸橼酸、富马酸、马来酸、苹果酸、精氨酸,发现枸橼酸、苹果酸和精氨酸不能提高马来酸依那普利制剂的稳定剂,富马酸可以在一定程度上提高制剂的稳定性,而马来酸可以显著提高制剂稳定性。进一步筛选马来酸的用量,发现当马来酸含量为1~5%时,制剂稳定性较好。但是参照cn1269529c制备马来酸依那普利叶酸片剂,发现溶出与市售不一致。通过对不同的填充剂进行筛选,发现选淀粉和微晶纤维素做填充剂,叶酸在0.1m的盐酸介质中溶出明显低于市售。分析原因可能影响溶出的关键因素是填充剂的选择。由于淀粉和微晶纤维素都难溶于水,在盐酸溶液中释放较慢,如果选用水溶性的乳糖做填充剂,则溶出过快。根据cfda的规定,仿制药的溶出度标准应与参比制剂一致,比市售溶出过快或过慢都不符合要求。因此,申请人选用微晶纤维素和乳糖的混合物做填充剂,并对其比例做筛选,发现当乳糖:微晶纤维素重量比为1.67~3:1时,制得的片剂溶出与市售类似。本发明提供一种含有马来酸依那普利、叶酸和酸稳定剂的药物组合物,其特征在于,所述的酸稳定剂选自马来酸、富马酸或琥珀酸更优选马来酸。本发明优选方案,按重量百分比计算,酸稳定剂含量为1%~5%,优选2%~4%,进一步优选2%、2.4%、3%、4%。本发明优选方案,其特征在于,所述的酸稳定剂为马来酸或富马酸,优选马来酸。本发明优选方案,其特征在于,还包括填充剂、粘合剂、崩解剂和润滑剂,所述的填充剂为单水乳糖和微晶纤维素的混合物,所述的粘合剂选自聚维酮k30或羟丙甲纤维素e5,所述的崩解剂为交联羧甲基纤维素钠,所述的润滑剂为硬脂酸镁。本发明优选方案,其特征在于所述的微晶纤维素选自微晶纤维素101或微晶纤维素102。本发明优选方案,其特征在于,单水乳糖和微晶纤维素的重量比为1.67~3:1,优选1.67:1、2.2:1或3:1,即50:30、55:25或60:20。本发明还提供一种马来酸依那普利叶酸组合物的制备方法,包括以下步骤:(1)称取叶酸和单水乳糖过60目筛等量递增混匀,加入酸稳定剂,与马来酸依那普利混合过60目筛;(2)加入交联羧甲基纤维素钠和粘合剂,过60目筛按等量递增法混合均匀,与微晶纤维素混合过60目筛;(3)加入硬脂酸镁混匀压片。本发明还提供一种马来酸依那普利叶酸组合物的制备方法,包括以下步骤:(1)称取处方量的马来酸依那普利、叶酸、单水乳糖、微晶纤维素、酸稳定剂、交联羧甲基纤维素钠和粘合剂,过100目筛按等量递增法混合均匀;(2)干法制粒,喂料转速20~40rpm,压轮转速2~4rpm,压轮间距0.3mm,过20目筛得到颗粒;(3)将步骤(2)得到的颗粒与硬脂酸镁混匀压片。本发明优选方案,所述的酸稳定剂为重量比1%~5%的马来酸或富马酸,优选1%~5%的马来酸,进一步优选2%~4%的马来酸。本发明优选方案,所述的粘合剂选自聚维酮k30或羟丙甲纤维素e5,所述的微晶纤维素选自微晶纤维素101或微晶纤维素102。酸稳定剂的重量百分比是指以整个片剂重量计算,酸稳定剂所占的重量比例。如酸稳定剂重量比为1%~5%,若整个片剂重量为100mg,则酸稳定剂重量为1mg~5mg。转速:rpm转/分钟,压轮间距:mm毫米。与现有技术相比,本发明具有以下有益效果:(a)本发明制剂处方中加入1%~5%的马来酸,显著提高制剂的稳定性,高温60℃下依那普利双酮杂质<1%,40℃,rh75%条件下放置45天依那普利双酮杂质<0.5%,制得的马来酸依那普利叶酸片剂比市售稳定。(b)通过对不同填充剂筛选,发现用微晶纤维素和乳糖混合物可改善叶酸在0.1m盐酸介质中的溶出,达到与市售基本一致。附图说明图1为市售、rx13~rx18片剂中叶酸在0.1m盐酸介质中的溶出曲线;图2为市售、实施例4~7片剂中叶酸在0.1m盐酸介质中的溶出曲线。实施例1通过选用不同的酸,枸橼酸、富马酸、苹果酸、精氨酸和马来酸来筛选合适的稳定剂,对照中没有加任何酸,结果如表1所示。表1酸稳定剂选择制备工艺:(1)称取叶酸和淀粉过60目筛等量递增混匀,加入酸稳定剂枸橼酸、富马酸、苹果酸、精氨酸或马来酸,与马来酸依那普利混合过60目筛;(2)称取处方量的崩解剂交联羧甲基纤维素钠和粘合剂聚维酮k30,过60目筛按等量递增法混合均匀,与微晶纤维素102混合过60目筛;(3)加入润滑剂硬脂酸镁混匀压片,制成1000片。有关物质检测方法:waters高效液相色谱e2695-2489仪器检测,流速2.0ml/min,柱温:50℃,检测波长215nm,流动相a:0.01mol/l磷酸二氢钾缓冲溶液调ph为2.2,流动相b:乙腈,梯度洗脱流动相a/流动相b体积比90:10→70:30→90:10。将对照、处方rx1~rx5得到的制剂在60℃高温、湿度rh92.5%和4500lx强光照射条件下放置10天进行影响因素实验,考察其稳定性。结果发现,在湿度rh92.5%和4500lx强光照射条件下制剂中依那普利双酮、依那普利拉、碟酸杂质未出现明显变化,但是在60℃高温条件下,对照、rx1、rx3、rx4中依那普利双酮显著增加,均大于2%,rx2中依那普利双酮为1.85%,rx5中依那普利双酮增加最小为1.25%。由此可以说明,枸橼酸、苹果酸、精氨酸不能提高马来酸依那普利叶酸制剂的稳定剂,富马酸可以在一定程度上提高制剂的稳定性,而马来酸可以显著提高制剂稳定性,接下来对马来酸用量进一步优化。实施例2表2马来酸用量筛选制备方法同实施例1。通过考察重量百分比为0.1%~5%的马来酸用量对制剂的稳定性影响,将处方rx6~rx12得到的制剂在60℃高温、湿度rh92.5%和4500lx强光照射条件下放置10天进行影响因素实验。结果发现,在湿度rh92.5%和4500lx强光照射条件下制剂中依那普利双酮、依那普利拉、碟酸杂质未出现明显变化,但是在60℃高温条件下,依那普利双酮仍然增加。处方中随着马来酸用量的增加,依那普利双酮杂质逐渐减小,但当马来酸用量增大到5%时则杂质不再减小。按重量百分比计算,马来酸为1%~5%时,60℃高温条件放置10天,依那普利双酮杂质小于1%。但是,上述处方在0.1m的盐酸介质中叶酸溶出慢于市售,而在水、ph6.8、ph4.5介质中,叶酸15min释放完全,马来酸依那普利在0.1m盐酸、水、ph6.8和ph4.5介质中15min释放完全。因此提高叶酸在0.1m的盐酸介质中的溶出速率,制剂与市售溶出一致,仍是一个待解决的问题。上述处方制得的制剂,叶酸溶出较慢的原因,可能是填充剂选择不当。根据cfda的规定,仿制药的溶出度标准应与参比制剂一致,比市售溶出过快或过慢都不符合要求,接下来需对填充剂进行筛选。实施例3表3填充剂筛选成分rx13rx14rx15rx16rx17rx18马来酸依那普利10.0g10.0g10.0g10.0g10.0g10.0g叶酸0.8g0.8g0.8g0.8g0.8g0.8g淀粉0030.0g30.0g00无水乳糖80.0g050.0g000单水乳糖080.0g050.0g50.0g50.0g微晶纤维素102000030.0g0微晶纤维素1010000030.0g交联羧甲基纤维素钠5.0g5.0g5.0g5.0g5.0g5.0g聚维酮k301.0g1.0g1.0g1.0g1.0g1.0g马来酸2.0g2.0g2.0g2.0g2.0g2.0g硬脂酸镁1.0g1.0g1.0g1.0g1.0g1.0g片剂制备方法同实施例1。按照中国药典2010年版二部附录ⅹc第二法测定,以0.1m盐酸溶液500ml为溶出介质,转速为50rpm,在5min、10min、15min、30min、45min和60min对rx11~rx16和市售马来酸依那普利叶酸取点测定,结果如表4和附图1所示。表4市售、rx13~rx18片剂中叶酸在0.1m盐酸介质中的溶出数据相似因子f2的值范围在0~100,f2越大,两条曲线的相似性越高,美国fda和欧盟ema规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。由表4和附图1可以看出,rx13和rx14选用无水乳糖或单水乳糖做填充剂,溶出明显比市售快,f2<50,与市售溶出不一致;rx15用淀粉、无水乳糖做填充剂,rx16用淀粉、单水乳糖做填充剂,溶出明显比市售慢,f2<50,与市售溶出不一致;rx17用微晶纤维素101和单水乳糖混合物做填充剂,rx18用微晶纤维素102和单水乳糖混合物做填充剂,f2>80,溶出与市售大致相同。分析原因,可能是无水乳糖、单水乳糖水溶性较好,而淀粉、微晶纤维素101和微晶纤维素102难溶于水,因此制剂处方中更适合选不同的填充剂混合物来控制溶出。实验结果意外的发现,淀粉和无水乳糖、淀粉和单水乳糖混合物做填充剂,溶出仍然比市售慢,但是微晶纤维素102和单水乳糖、微晶纤维素101和单水乳糖混合物做填充剂,溶出与市售类似。实施例4粉末直压成分rx19马来酸依那普利10.0g叶酸0.8g单水乳糖60.0g微晶纤维素10120.0g交联羧甲基纤维素钠5.0g聚维酮k301.0g马来酸4.0g硬脂酸镁1.0g制备工艺:(1)称取叶酸和单水乳糖过60目筛等量递增混匀,加入酸稳定剂马来酸,与马来酸依那普利混合过60目筛;(2)称取处方量的崩解剂交联羧甲基纤维素钠和粘合剂聚维酮k30,过60目筛按等量递增法混合均匀,与微晶纤维素101混合过60目筛;(3)加入润滑剂硬脂酸镁混匀压片,制成1000片。实施例5干法制粒成分rx20马来酸依那普利10.0g叶酸0.8g单水乳糖55.0g微晶纤维素10225.0g交联羧甲基纤维素钠5.0聚维酮k303.0马来酸2.5g硬脂酸镁1.0g制备工艺:(1)称取处方量的马来酸依那普利、叶酸、单水乳糖、微晶纤维素102、马来酸、交联羧甲基纤维素钠和粘合剂聚维酮k30,过100目筛按等量递增法混合均匀;(2)干法制粒,喂料转速30rpm,压轮转速4rpm,压轮间距0.3mm,过20目筛得到颗粒;(3)将步骤(2)得到的颗粒与润滑剂硬脂酸镁混匀压片,制成1000片。实施例6粉末直压成分rx21马来酸依那普利10.0g叶酸0.8g单水乳糖50.0g微晶纤维素10230.0g交联羧甲基纤维素钠5.0羟丙甲纤维素e55.0马来酸3.0g硬脂酸镁1.0g制备工艺:(1)称取叶酸和单水乳糖过60目筛等量递增混匀,加入酸稳定剂马来酸,与马来酸依那普利混合过60目筛;(2)称取处方量的崩解剂交联羧甲基纤维素钠和粘合剂羟丙甲纤维素e5,过60目筛按等量递增法混合均匀,与微晶纤维素102混合过60目筛;(3)加入润滑剂硬脂酸镁混匀压片,制成1000片。实施例7干法制粒成分rx22马来酸依那普利10.0g叶酸0.8g单水乳糖55.0g微晶纤维素10125.0g交联羧甲基纤维素钠5.0羟丙甲纤维素e55.0马来酸2.0g硬脂酸镁1.0g制备工艺:(1)称取处方量的马来酸依那普利、叶酸、单水乳糖、微晶纤维素101、马来酸、交联羧甲基纤维素钠和粘合剂羟丙甲纤维素e5,过100目筛按等量递增法混合均匀;(2)干法制粒,喂料转速25rpm,压轮转速3rpm,压轮间距0.3mm,过20目筛得到颗粒;(3)将步骤(2)得到的颗粒与润滑剂硬脂酸镁混匀压片,制成1000片。对比例1按照cn1269529c实施例2方法制备对比例2加入碱性物质碳酸氢钠制备工艺:(1)称取叶酸和单水乳糖过60目筛等量递增混匀,加入碱稳定剂碳酸氢钠,与马来酸依那普利混合过60目筛;(2)称取处方量的崩解剂交联羧甲基纤维素钠和粘合剂羟丙甲纤维素e5,过60目筛按等量递增法混合均匀,与微晶纤维素101混合过60目筛;(3)加入润滑剂硬脂酸镁混匀压片,制成1000片。实施例8影响因素实验分别将市售马来酸依那普利叶酸片剂(国药准字h20103723,生产批号20160408)、实施例4~7、对比例1和对比例2得到的制剂在60℃高温、湿度rh92.5%和4500lx强光照射条件下放置10天进行影响因素实验,考察其稳定性,结果如表5所示。表5市售、实施例4~7和对比例1~2制剂的影响因素实验由表5可以看出,在高温60℃条件下,对比例1和对比例2制剂中依那普利双酮杂质明显增加,高于市售制剂中杂质的增加;在rh92.5%条件下,对比例1制剂中依那普利拉和依那普利双酮杂质也高于市售制剂中杂质的增加。分析原因,在没有酸稳定剂的情况下,对比例1制剂中的辅料淀粉、微晶纤维素、羧甲淀粉钠、硬脂酸镁在高温60℃与原料马来酸依那普利叶酸相容性较差,且对比例1湿法制粒也会带来依那普利双酮杂质的增加。而对比例2中加入的碱性物质碳酸氢钠并没有起到稳定剂作用,依那普利拉杂质仍然明显增加。实施例4~7在处方中加入重量比为2%~4%的马来酸,得到的马来酸依那普利叶酸复方制剂在高温60℃、rh92.5%和强光照条件下均较稳定,碟酸、依那普利拉和依那普利双酮杂质未出现明显变化,且高温60℃条件下低于市售依那普利双酮的增加,实施例4~7粉末直压或干法制粒有助于提高制剂的稳定性。结论:对比例1和对比例2的制剂稳定性不好,而实施例4~7的制剂稳定性较好,比市售稳定。实施例9稳定性实验分别将市售马来酸依那普利叶酸片剂(国药准字h20103723,生产批号20160408)、实施例4~7得到的制剂在40℃、湿度rh75%条件下放置45天进一步考察其稳定性,结果如表6所示。表6市售和实施例4~7制剂稳定性实验由表6可以看出,40℃、rh75%条件下放置45天,实施例4~7制剂中依那普利双酮杂质小于市售,比市售更稳定。实施例10溶出数据按照中国药典2010年版二部附录ⅹc第二法测定,以0.1m盐酸溶液500ml为溶出介质,转速为50rpm,在5min、10min、15min、30min、45min和60min对实施例4~7和市售马来酸依那普利叶酸取点测定,结果如表7和附图2所示。表7市售、实施例4~7片剂中叶酸在0.1m盐酸介质中的溶出数据由表7和附图2可以看出,相似因子f2≥80,实施例4~5制得的片剂叶酸在0.1m盐酸介质中的溶出与市售基本一致。应当说明的是,以上所述仅为本发明的较佳实施例而已,并不用于限制本发明的范围,凡在本发明的原则之内所作出的任何修改、等同的替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1