基于交联脂肪酸的生物材料的制作方法
相关申请
本申请要求2009年2月3日提交的美国专利申请No.12/364,763的优先权,所述美国专利申请:要求2008年10月10日提交的美国临时申请No.61/104,575和2008年10月10日提交的美国临时申请No.61/104,568的优先权;也是2006年10月16日提交的序号为11/582,135的美国专利申请的部分继续申请,所述美国专利申请要求2005年10月15日提交序号为60/727,312的临时专利申请的优先权;也是2005年9月28日提交的序号为11/237,264的美国专利申请的部分继续申请,所述美国专利申请要求2004年9月28日提交的美国临时申请No.60/613,808的优先权;并且也是2005年9月28日提交的序号为11/236,908的美国专利申请的部分继续申请,所述美国专利申请要求2004年9月28日提交的美国临时申请No.60/613,745的优先权。这些以前提交的申请的全部内容由是在此结合作为参考。
技术领域和
背景技术:
血管介入,例如血管再灌注术、球囊血管成形术和机械支架放置,经常导致继变窄的血管的机械扩张和管腔扩开之后的血管损伤。经常在这样的血管内过程之后,沿着受损血管内腔表面发生新生内膜增殖和血管损伤重塑;更具体地说,重塑在心脏中、以及在易损的外周血管如颈动脉、髂动脉、股动脉和腘动脉中发生。尚未发现已知的机械抑制手段来防止或抑制在继机械再灌注过程引起的血管损伤后立即发生这样的细胞增殖。如果不处理,在受治血管内腔中的血管介入之后血管损伤的数周之内,通常发生再狭窄。由局部机械性损伤引起的再狭窄,导致重塑的血管内腔组织增殖,致使血管内腔再狭窄,这能够因紊乱的血流纤维蛋白活化、血小板沉积和血管流面损伤加速,而引起血栓性闭塞。再狭窄使患者易罹患血栓性阻塞并阻断向其它位置的血流,导致严重的缺血性事件,经常导致发病。
由机械诱发的血管损伤性细胞重塑所启动的再狭窄可以是渐进过程。多个过程,包括纤维蛋白活化、凝血酶聚合和血小板沉积、管腔血栓形成、炎症、钙调神经磷酸酶(calcineurin)活化、生长因子和细胞因子释放、细胞增殖、细胞迁移和细胞外基质合成,均对再狭窄过程有贡献。虽然再狭窄的准确的生物-机械机制的顺序还不完全了解,但已经假定若干受怀疑的生化途径参与了细胞炎症、生长因子刺激、以及纤维蛋白和血小板沉积。从血小板释放的细胞衍生生长因子例如血小板衍生生长因子、成纤维细胞生长因子、表皮生长因子、凝血酶等等,侵入巨噬细胞和/或白细胞,或者直接来自平滑肌细胞,激起中膜平滑肌细胞的增殖和迁移反应。这些细胞经历了从收缩表型到合成表型(synthetic phenotype)的改变。增殖/迁移通常在损伤后一到两天内开始,并在之后几天达到顶峰。在正常的动脉壁中,平滑肌细胞以大约低于0.1%/天的低速率增殖。
但是,子细胞迁移到动脉平滑肌的内膜层并继续增殖且分泌大量的细胞外基质蛋白。增殖、迁移和细胞外基质合成持续直至损伤的内皮细胞层被修复,这时,通常是在损伤后七到十四天内,内膜中的增殖减慢。新形成的组织被称作新内膜(neointima)。接下来的三到六个月内发生的进一步的血管狭窄主要是由于负性或缩窄性重塑。
与局部增殖和迁移同时,作为愈合过程的一部分,来源于血管壁中层的炎性细胞继续侵袭血管损伤部位并在此增殖。损伤后三到七天内,沿着血管壁开始聚积显著的炎性细胞形成和迁移,遮掩血管损伤部位并愈合。在动物模型中,采用球囊损伤或支架植入,炎性细胞可以在血管损伤部位持续存在至少三十天。炎性细胞可能对再狭窄和血栓形成的急性期和延长的慢性期均有贡献。
如今,将药物局部递送到由血管内医疗装置例如冠状动脉支架引起的血管损伤部位的优选方法,是在所述装置上布置药物洗脱涂层。临床上,涂有包含永久性聚合物或降解性聚合物和适当治疗剂的药物洗脱覆层的医疗装置已经显示出血管造影证据,即在球囊血管成形术和/或机械支架放置之后的一定时间段中,即使不能消除、也可以减少血管损伤和/或血管再灌注过程后的血管壁增殖。通过药物洗脱医疗装置来局部递送单一的西罗莫司或泰素化合物,已经证明当在血管损伤之后立即施加时,对于最少化或防止细胞增殖和细胞重塑是有效的。这两种抗增殖化合物例子的各种类似物也已经在试验和临床上显示,用类似的药物洗脱涂层表现出类似的抗增殖活性。但是,抗增殖化合物例如西罗莫司和泰素,与聚合物的药物洗脱涂层一起,在从药物洗脱涂层进行主要药物释放期间和之后,也已经在临床上显示出现许多毒性副作用。这些长期和或延长的副作用限制了在给定的时间段中实际可被递送的药量,而且在直接施加到炎症和或细胞重塑部位时,对用于将治疗剂局部递送到血管损伤部位的聚合物涂层的相容性提出挑战。另外,化合物如西罗莫司和泰素的局部过量可以在医疗装置的局部组织区域中和周围,阻止、限制乃至停止细胞重塑或增殖。例如,在血管损伤愈合过程中,在细胞增殖中断期间缺少内皮细胞覆盖表现出内腔血栓的高度可能性,从而纤维蛋白和持续的血小板沉积覆盖了暴露的和未愈合的医疗装置和/或受损的血管损伤。在放置药物洗脱医疗装置之前和之后,没有不间断的全身供应或施用抗血小板药物如氯吡格雷并联合抗凝剂例如ASA,临床上已经显示这样的装置在放置的几天内形成血栓和阻塞。另外,虽然在医疗装置上使用的这些市场上可买到的药物洗脱型聚合物涂层一般的特征在于是生物相容的,但基于这些聚合物的化学物质缺乏化学水解、降解和吸收成为较小的、容易代谢的化学成分或产物,现已在临床上证明在血管损伤部位处引发延长的局部炎性反应,这可能在停用抗血小板药物的几天之内引起意想不到的血栓性阻塞。
对体内损伤(例如疝气修复)的伤口愈合或反应遵循与血管损伤相同的通用生物学级联(参见,例如,Y.C.Cheong等,Human Reproduction Update.2001;Vol.7,No.6,p556-566)。这个级联包括天然组织的炎症,继之以细胞、包括血小板和巨噬细胞在内的迁移和增殖来减轻炎性反应,和随后的愈合期,其包括纤维蛋白沉积和纤维蛋白基质形成、接下来是组织重塑。在疝气修复的情况下,当巨噬细胞表达炎性细胞因子(例如α-TNF)时,可以发生异常的腹膜愈合,这可以导致纤维蛋白基质不能恰当分解并可以导致形成粘连(Y.C.Cheong等,2001)。疝气修复之后形成的腹腔粘连可以导致疼痛、肠绞窄、不育,并在一些情况下导致死亡(Y.C.Cheong等,2001)。
损伤的血栓性和炎性反应的持续性质,使得期望提供可以减少植入后炎症和异物反应发生率的生物材料。还优选得到在一定时间段内提供一种或多种治疗剂的释放以便使被所述细胞活化的反应最小化的生物材料。另外,这样的生物材料还将优选是通过生物吸收机制被代谢的。
技术实现要素:
想要的是一种生物材料(例如,涂层或独立膜),其可以单独应用或用作药物递送载体,防止或减少由治疗剂或涂层的组分引起的慢性炎症。此外,期望所述生物材料以持续和受控方式向局部组织释放和递送治疗剂。本发明涉及解决这种需求的各种解决方案
还想要一种生物材料(例如涂层或独立膜),其可以被细胞生物吸收,并且可以递送药物而不引发已受到机械损伤或再灌注损伤的组织(例如腹膜或血管组织)的慢性局部炎症,因为细胞摄入生物材料的水解产物和药物,从而所述生物材料(例如涂层或独立膜)和治疗剂被所述细胞摄取和代谢。
在不同的方面中,生物材料是医疗装置用涂层,或独立膜。生物材料可以是基于脂肪酸的、预固化物衍生的生物材料。在不同的实施方案中,基于脂肪酸的、预固化物衍生的生物材料是非聚合物的。在某些情况中,如本文所述,脂肪酸的来源是油,例如鱼油。在这样的情况中,基于脂肪酸的、预固化物衍生的生物材料也可以称为“基于油的、预固化物衍生的生物材料”。
在一个具体的方面,本发明提供了基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜),其包含预固化组分。如本文所述,“预固化物”组分是指这样的脂肪酸(例如来自鱼油),即其部分地固化(使用热、UV等)引起初始量的脂肪酸氧化和交联,以形成粘性的脂肪酸衍生凝胶。预固化物组分可以溶解在溶剂中,并被喷涂至装置、例如医疗装置上。一旦预固化物组分与医疗装置结合,所述装置就可以用于治疗对象,或者它可以进一步暴露于附加的固化条件下,这可以引起平滑、共形的涂层,在本文中称为“基于脂肪酸的、预固化物衍生的生物材料(涂层)”。预固化物和/或基于脂肪酸的、预固化物衍生的生物材料可以表征为凝胶。
预固化的脂肪酸组分(本文也称为“预固化脂肪酸组分”、或者简单称为“预固化物”;当脂肪酸的来源是油、例如鱼油时,还可以称为“预固化的油”)可以被加到治疗剂中,其中所述治疗剂任选与油组合,产生的组合物可以进一步固化,从而进一步交联该油的脂肪酸,以提供基于脂肪酸的、预固化物衍生的生物材料,意味着一部分基于脂肪酸的生物材料在配制之前被预固化,然后在治疗剂存在下暴露于进一步的固化下。在一个实施方案中,基于脂肪酸的、预固化物衍生的生物材料具有定制的药物释放性质。当所生成的预固化物衍生的生物材料用作医疗装置用涂层或者用作独立膜时,它也可以在本文中被称为“基于脂肪酸的、预固化物衍生的涂层”或“基于脂肪酸的、预固化物衍生的独立膜”。
产生预固化物(例如鱼油的预固化物)的过程具有的优点是产生将被人类组织水解的氧化脂肪酸交联的初始平台。在一些实施方案中,预固化物的部分固化过程可以在不存在治疗剂下完成,使得能够在后面的过程中添加治疗剂。在这样的实施方案中,该预固化物过程可以在原本将导致热/化学敏感性目的治疗剂(例如雷帕霉素或环孢菌素衍生物)降解的温度和/或时间段内实施,除了该预固化物过程的该部分不存在所述治疗剂的情况。这种过程产生部分交联的组合物,其可氧化的活性部位(例如C=C键)减少,不包含治疗剂。在形成预固化物后,然后添加治疗剂,并任选也添加维生素E。维生素E组分具有保护药物和预固化的油免于进一步氧化的优点,但不抑制油的脂肪酸和/或甘油酯组分的进一步交联(例如酯化)。
因此,在不同的方面中,本发明提供了生产疏水性的、交联的、预固化物衍生的生物材料的方法,其中所述预固化物衍生的生物材料与一种或多种治疗剂组合使用,其中治疗剂具有受控的载量并在涂层被吸收时以持续的方式释放。在不同的实施方案中,提供了通过控制用于从含油起始材料来生产预固化物衍生的生物材料(例如涂层或独立膜)的固化条件、在形成预固化物衍生的生物材料的含油起始材料中使用自由基清除剂、或其组合,来定制预固化物衍生的生物材料的药物释放模式的方法。在不同的实施方案中,本发明的方法通过控制脂肪酸的交联度,定制了基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)的药物释放性质。在不同的实施方案中,本发明的方法通过控制基于脂肪酸的、预固化物衍生的生物材料中脂肪酸、生育酚、脂质氧化产物和可溶组分的水平,定制了预固化物衍生的生物材料(例如涂层或独立膜)的药物递送性质。
在不同的方面中,本发明可以提供具有预固化的油组分的脂肪酸衍生生物材料(例如涂层或独立膜),其包含一种或多种治疗剂,其中一种或多种治疗剂具有定制的释放模式。这样的材料在本文中被称为“基于脂肪酸的、预固化物衍生的生物材料”。在不同的实施方案中,定制的释放模式包括持续释放模式。在不同的实施方案中,定制的释放模式性质受到基于脂肪酸的、预固化物衍生的生物材料中的脂肪酸、生育酚、脂质氧化产物和可溶组分的水平的控制。在本发明不同的方面中,基于脂肪酸的、预固化物衍生的生物材料包含脂肪酸,许多脂肪酸开始是作为甘油三酯。以前已证明,甘油三酯副产物,例如部分水解的甘油三酯和脂肪酸分子,可以整合在细胞膜中并增强药物进入细胞膜的溶解度(M.Cote,J.of Controlled Release.2004,Vol.97,p269-281.;C.P.Burns等,Cancer Research.1979,Vol.39,p1726-1732;R.Beck等,Circ.Res.1998,Vol 83,p923-931.;B.Henning等,Arterioscler.Thromb.Vase.Biol.1984,Vol 4,p489-797)。已知完整的甘油三酯以及部分水解的甘油三酯不增强细胞摄入,因为完整的甘油三酯由于它们相对较大的分子大小,难以跨过细胞膜。维生素E化合物也可以整合到细胞膜中,导致膜流动性和细胞摄入降低(P.P.Constantinides.Pharmaceutical Research.2006;Vol.23,No.2,243-255)。
在不同的方面中,本发明可以提供预固化物衍生的生物材料(例如涂层或独立膜),其包含不同量和比例的脂肪酸、甘油酯、脂质氧化产物和α-生育酚,以提供控制基于脂肪酸的、预固化物衍生的生物材料和其中混合的任何治疗剂的细胞摄取特征的方式,对基于脂肪酸的、预固化物衍生的生物材料作出贡献。
在不同的方面中,本发明可以提供覆层的医疗装置,其具有包含所述预固化物衍生的生物材料的一个或多个层的基于脂肪酸的、预固化物衍生的生物材料药物释放涂层,其中至少一个预固化物衍生的生物材料含有一种或多种治疗剂。所述涂层可以是疏水性的、交联的、预固化物衍生的生物材料(从例如鱼油衍生,使得其是“油衍生的、预固化物衍生的生物材料”)。在不同的实施方案中,涂层是非聚合物的。在不同的实施方案中,药物释放涂层在体内水解成基本上非炎性的化合物。在不同的实施方案中,预固化物衍生的生物材料涂布在可植入患者中的医疗装置上,以实现治疗剂向患者的长期局部递送。在不同的实施方案中,所述递送至少部分地以治疗剂随时间释放的总量和相对量为特征。在不同的实施方案中,定制的递送模式由基于脂肪酸的、预固化物衍生的生物材料中的脂质氧化、维生素E和/或可溶组分的水平控制。在不同的实施方案中,递送模式是涂层组分和治疗剂在体内的溶解度和亲脂性的函数。预固化物衍生的生物材料可以是具有上面论述的性质的独立膜、凝胶、悬浮液或乳液。
在不同的实施方案中,本发明可以提供基于脂肪酸的、预固化物衍生的涂层,其中通过提供两个或更多个涂层和选择治疗剂的位置,定制了涂层的药物释放模式。药物位置可以改变,例如通过用第一种起始材料涂布医疗装置的裸露部分和产生第一个固化涂层,然后用药物-油制剂涂布第一个固化涂层的至少一部分产生第二个覆盖涂层。要理解,提供双层的过程可以扩展至提供三个或更多个层,其中至少一个层包含基于脂肪酸的、预固化物衍生的生物材料。另外,一个或多个所述层可以是释放药物层,这样的层的药物释放模式可以使用本文描述的方法来定制。
根据本发明的各种实施方案,预固化物衍生的生物材料(例如涂层或独立膜)包含脂质。预固化物衍生的生物材料可以由油例如鱼油起始材料形成。预固化物衍生的生物材料(例如涂层或独立膜)可以包含饱和脂肪酸、不饱和脂肪酸、或多不饱和脂肪酸。当基于脂肪酸的、预固化物衍生的生物材料是交联的时候,它可以包含ω-3脂肪酸。基于脂肪酸的、预固化物衍生的生物材料还可以包含α-生育酚、或维生素E衍生物、和/或治疗剂。
本发明的涂层可被配制成除了治疗剂以外,还包含多种其它化学物质和实体,包括但不限于以下一种或多种:可药用的载体,赋形剂,表面活性剂,粘合剂,佐剂,和/或稳定剂(包括防腐剂,缓冲剂和抗氧化剂)。在一个实施方案中,本发明的涂层中可被加入α-生育酚TPGS。
在不同的方面中,本发明可以提供在哺乳动物例如人类中治疗损伤的方法。在不同的实施方案中,损伤是血管损伤。在不同的实施方案中,方法包括通过从包含基于脂肪酸的、预固化物衍生的生物材料的涂层中持续释放一种或多种治疗剂,而局部施用治疗有效量的一种或多种治疗剂。
本文的讲授内容证明,包含基于脂肪酸的、预固化物衍生的生物材料的固化涂层和独立膜提供了调节载药的基于脂肪酸的、预固化物衍生的生物材料从所述膜或从植入型装置的释放模式的能力。在不同的实施方案中,释放模式可以通过改变基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)的组成和固化时间,在油化学方面加以变化来控制。所述讲授内容证明了可以基于改变油固化条件、油起始材料、固化时长、和交联量来改变治疗性化合物从预固化物衍生的生物材料(例如涂层或独立膜)的释放。讲授内容证明了,基于脂肪酸的、预固化物衍生的油涂层和基于脂肪酸的、预固化物衍生的独立膜的交联和凝胶化可以直接取决于油组分中氢过氧化物的形成,其随着油温度和不饱和度的增加而增加。溶出实验表明,使用较低温度固化条件(例如约150°F)产生的交联涂层比较高温度固化条件下(例如约200°F)产生的交联涂层更迅速释放药物。
在另一个方面,本发明提供了基于脂肪酸的、预固化物衍生的医疗装置用涂层,其包含交联的鱼油。鱼油可以任选包含治疗剂。涂层可以根据本文描述的方法制备,使得当涂层确实包含治疗剂时,所述涂层在体内以希望的释放速率释放治疗剂。
在另一个方面,本发明提供了医疗装置用涂层,其包含脂肪酸和治疗剂,其中脂肪酸在与治疗剂结合之前被部分交联。也就是说,脂肪酸被部分固化以引起初始量的脂肪酸交联,然后与治疗剂组合。所生成的组合物然后、例如在被施加到医疗装置后可以暴露于其他固化过程下,从而使脂肪酸进一步交联以形成涂层。在一个实施方案中,治疗剂以使得所述治疗剂具有增强的释放模式的方式被包含在涂层内。在本文使用时,短语“增强的释放模式”是指治疗剂通过使用本发明的方法制备的预固化物衍生的生物材料释放的模式。也就是说,在本文论述时,通过制备预固化物,向所述预固化物添加治疗剂,并进一步固化治疗剂-预固化物组合物,产生的治疗性的交联的生物材料释放治疗剂的方式不同于不按照本发明的方法制备的制剂(即没有利用预固化组合物制备的脂肪酸衍生生物材料)。
例如,首先在治疗剂不存在下制备预固化物,使得治疗剂不暴露于原本将导致其降解的工艺条件下。然后可以将治疗剂加到预固化物中用于进一步处理。因为这保护了治疗剂的结构,所以治疗剂在制造涂层期间发生较少降解。因此,涂层中存在较高量的可以释放的治疗剂,尤其与没有用预固化物制备的涂层相比(即,与其中将未固化的、含脂肪酸的材料首先与治疗剂组合、然后固化的涂层相比)。因此,“增强”了治疗剂的释放模式。
在一个实施方案中,本发明的涂层还包含预固化的甘油酯。所述涂层可以包含5-25%C14脂肪酸和/或5-30%C16脂肪酸。涂层可以被构造成在体内代谢后产生甘油酯。涂层可以包含大约30-90%的饱和脂肪酸;大约30-80%的不饱和脂肪酸;甘油酯;甘油酯、甘油和脂肪醇中的一种或多种,其任一种都可以是部分交联的;和/或维生素E。
在另一个实施方案中,涂层与植入型装置结合。涂层可以与医疗装置结合,该医疗装置是支架、导管、外科用网片或球囊。
在一个实施方案中,与涂层结合的治疗剂是抗增殖药、抗炎剂、抗微生物剂或抗生素。在另一个实施方案中,治疗剂是化合物A、化合物B、化合物C、化合物D、化合物E(如下所述)、环孢菌素衍生物或雷帕霉素衍生物。
在另一个实施方案中,涂层在0.01M磷酸盐缓冲盐水(PBS)中具有长达大约5-20天的治疗剂释放模式。涂层可以在体内以希望的释放速率释放所述治疗剂。在一个实施方案中,涂层在0.01M磷酸盐缓冲盐水(PBS)中具有长达20天以上的治疗剂释放模式。
在另一个实施方案中,涂层包含大约10-20%C14饱和脂肪酸和大约25-50%C16饱和脂肪酸。涂层可以包含内酯交联和酯交联。通过红外吸收和X-射线衍射确定,涂层可以包含不规则的烃链。
在另一个实施方案中,涂层不包含交联剂。
在又一个实施方案中,涂层在体内水解成脂肪酸、甘油和甘油酯;在体内水解成非炎性组分;和/或包含足以促进体内水解的量的羧酸基团。
涂层可以包含大约50-90%的饱和脂肪酸;大约10-50%的不饱和脂肪酸;甘油酯;和/或甘油酯、甘油和脂肪醇中的一种或多种,其任一种可以是部分交联的。在一个实施方案中,脂肪酸的来源是油,例如油是鱼油、橄榄油、葡萄油、棕榈油或亚麻籽油。在一个实施方案中,所述来源是鱼油。
在另一个方面,本发明提供了基于脂肪酸的、预固化物衍生的医疗装置用涂层,其包含:预固化的交联的脂肪酸,含有大约5-50%C16脂肪酸。
在又一个方面,本发明提供了基于脂肪酸的、预固化物衍生的覆层医疗装置用涂层,其包含:非聚合物的交联脂肪酸,含有大约5-25%C14脂肪酸和5-50%C16脂肪酸。
在另一个方面,本发明提供了基于脂肪酸的、预固化物衍生的覆层医疗装置用涂层,其包含交联脂肪酸和甘油酯,其中所述脂肪酸和甘油酯具有不规则的烷基,导致涂层是挠性的和可水合的。
在又一个方面,本发明提供基于脂肪酸的、预固化物衍生的医疗装置用涂层,其包含脂肪酸衍生生物材料,其中脂肪酸衍生生物材料包含δ-内酯。
在又一个方面,本发明提供了基于脂肪酸的、预固化物衍生的覆层医疗装置用涂层,其中通过在大约1740-1850cm-1处具有峰的红外吸收光谱表明,所述涂层分别包含内酯交联和酯交联。
在另一个方面,本发明提供了基于脂肪酸的、预固化物衍生的覆层医疗装置用涂层,其包含交联的、脂肪酸衍生的生物材料,其中大约60-90%的生物材料由分子量低于500的脂肪酸构成。
在又一个方面,本发明提供基于脂肪酸的、预固化物衍生的生物材料,其适合于在有需要的组织中实现受调愈合,其中所述生物材料以足以实现所述受调愈合的量施用,其中受调愈合包括调节所述组织区域中或附近的血小板或纤维蛋白沉积。在一个实施方案中,所述组织区域是对象的脉管系统。
在又一个方面,本发明提供基于脂肪酸的、预固化物衍生的生物材料,其适合于在有需要的血管损伤部位处实现受调愈合,其中所述组合物以足以实现所述受调愈合的量施用,其中受调愈合包括调节具有机体构造的组织修复中的至少一个量度。在一个实施方案中,血管愈合是血管愈合的炎性阶段。在另一个实施方案中,具有机体构造的组织修复包括血管损伤部位处的血小板或纤维蛋白沉积。在另一个实施方案中,调节具有机体构造的组织修复中的至少一个度量是血管损伤部位处的愈合过程延迟。
在另一个实施方案中,本发明的生物材料通过导管、球囊、支架、外科用网片、外科敷料或移植物施用至有需要的区域。
在另一个方面,本文提供了衍生医疗装置用涂层的制剂,所述制剂包含:
预固化的交联脂肪酸油,其中涂层包含酯交联和内酯交联,且其中一部分制剂包含预固化的天然油。该制剂可以进一步包含治疗剂。制剂的粘度为大约1.0×105cps至大约1.0×107cps。该制剂可以进一步溶解在有机溶剂中。
本文还提供了生产基于脂肪酸的、预固化物衍生的医疗装置用涂层的方法,其中所述方法包括:
根据第一固化条件固化含油起始材料,形成第二材料;
将治疗剂与第二材料组合,形成第三材料;
和固化第三材料,使得产生涂层。
在方法的一个实施方案中,治疗剂与含油材料或有机溶剂组合,然后与第二材料组合。在另一个实施方案中,第一固化条件和/或总固化持续期限的固化温度超过治疗剂的降解温度。在又一个实施方案中,第一固化条件导致在油中明显形成酯和内酯,使得在第二固化条件期间,发生显著的脂肪酸交联。在又一个实施方案中,调节固化温度和持续时间,以定制治疗剂的释放模式。第二材料中可被添加维生素E。在另一个实施方案中,第三材料与有机溶剂组合,并被施加到医疗装置上,然后固化形成共形涂层。然后可以将第三材料喷涂至医疗装置上,然后固化形成涂层,例如非共形涂层。在方法的另一个实施方案中,含油起始材料是鱼油。在方法的又一个实施方案中,医疗装置是支架、导管、外科用网片或球囊。
所述方法产生的第二材料的粘度可以是大约1.0×105cps至大约1.0×107cps。
该方法中使用的治疗剂可以是抗增殖药或抗炎剂。该方法中使用的治疗剂还可以是化合物A、化合物B、化合物C、化合物D、化合物E、环孢菌素衍生物或雷帕霉素衍生物。
在该方法的另一个实施方案中,定制第一固化条件,使得第二材料在被施加到医疗装置上时,在医疗装置上提供非共形涂层;和其中定制第二固化条件,使得第三材料在被施加到涂层时,提供共形涂层。在另一个实施方案中,第一固化条件的固化时间可以显著增加,以便减少第二固化条件为获得最终涂层想要的机械性能所需的固化时间。在另一个实施方案中,第一固化条件可以显著增加,以便减少第二固化条件为获得最终涂层想要的机械性能和保护热敏感性药物所需的固化时间。
在另一个方面,本文提供了基于脂肪酸的、预固化物衍生的医疗装置用涂层,其中所述涂层包含:疏水性的、非聚合物的、交联的鱼油;和治疗剂;其中所述涂层可以经受住16-22psi的压缩力。
在又一个方面,本文提供了基于脂肪酸的、预固化物衍生的医疗装置用涂层,其在体内水解成脂肪酸、甘油和甘油酯。
在又一个方面,本文提供了基于脂肪酸的、预固化物衍生的医疗装置用涂层,其包含:非聚合物的、部分交联的脂肪酸,和治疗剂,其中所述治疗剂以该治疗剂具有增强的释放模式的方式被包含在涂层内。
在另一个方面,本文提供了衍生医疗装置用涂层的制剂,所述制剂包含:非聚合物的、部分交联的脂肪酸,和治疗剂,其中所述涂层包含酯交联和内酯交联。
在又一个方面,本文提供了基于脂肪酸的、预固化物衍生的医疗装置用涂层,其包含:交联的脂肪酸油,和治疗剂;其中如下制备所述涂层:固化含天然油的起始材料以引起一部分脂肪酸交联;向部分交联的脂肪酸油中添加治疗剂以形成治疗剂-油组合物;和固化所述治疗剂-油组合物以引起脂肪酸中的附加交联,使得形成涂层。在涂层的一个实施方案中,治疗剂与含天然油的材料、有机溶剂和/或维生素E组合,然后与部分交联的脂肪酸油组合。在另一个实施方案中,治疗剂与维生素E组合,然后与部分交联的脂肪酸油组合,使得治疗剂具有增强的释放模式。
在另一个方面,本文提供了包含预固化的脂肪酸的独立膜。所述独立膜可以包含大约5-50%C16脂肪酸;5-25%C14脂肪酸,5-40%C16脂肪酸;和/或维生素E。膜可以是生物可吸收的,和/或保持抗粘连性质。独立膜可以进一步包含所述治疗剂,例如化合物A、化合物B、化合物C、化合物D、化合物E、环孢菌素衍生物或雷帕霉素衍生物。所述治疗剂可以与脂肪酸化合物组合,然后形成膜,导致治疗剂散布于整个膜中。
在另一个方面,本文提供了独立膜,其包含:
交联的脂肪酸油,和治疗剂;
其中如下制备独立膜:固化含天然油的起始材料以引起一部分脂肪酸交联;
向部分交联的脂肪酸油中添加治疗剂以形成治疗剂-油组合物;和
固化所述治疗剂-油组合物以引起脂肪酸中的附加交联,使得形成独立膜。
在另一个方面,本文提供了基于脂肪酸的、预固化物衍生的生物材料,其包含部分交联的脂肪酸和治疗剂,其中所述治疗剂按重量计占生物材料组合物的至少40%。在另一个实施方案中,治疗剂按重量计占生物材料组合物的至少50%。
附图说明
上述及本发明的其他方面、实施方案、目标、特征和优点可以从下面的说明书结合附图得到更全面地了解。在图中,同样的参考字符一般指示全部各个图中同样的特征和结构元件。图不一定按比例,重点是示出本发明的要素。
图1是在多不饱和油中产生过氧化物和醚交联的例子的示意图;
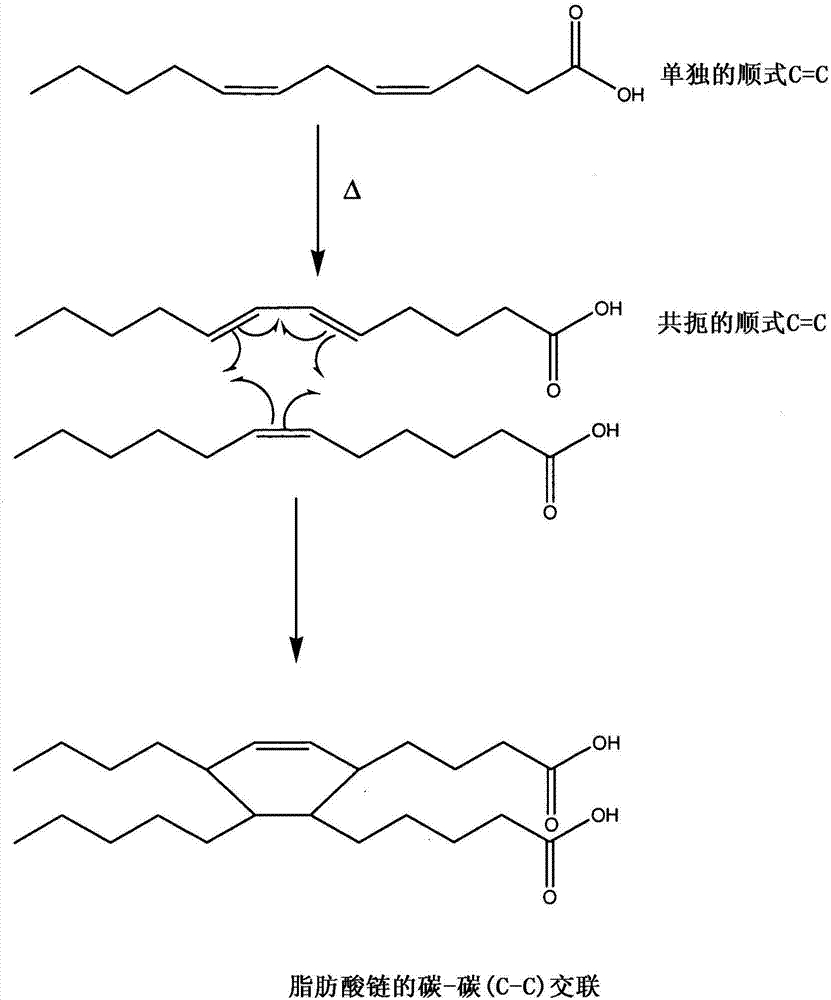
图2是在多不饱和油中产生碳-碳交联的例子的示意图(Diels-Alder型反应);
图3显示形成疏水性的预固化衍生的生物材料涂层的机制;
图4显示预固化衍生的生物材料反应化学的概要;
图5是引起酯基的形成的油的反应的示意图;
图6示意性描绘了甘油三酯中酯键的水解;
图7显示的柱状图表明了基于脂肪酸的、预固化物衍生的生物材料涂层和生物组织之间脂肪酸组成的相似性;
图8是流程图,示出了根据本发明的一个实施方案,制造本发明的覆层医疗装置的方法;
图9是流程图,示出了根据本发明的一个实施方案,图8方法的变体;
图10A-10E是覆层医疗装置的各种图像;
图11提供了如实施例1所述,总体固化的生物材料(没有预固化物组分)暴露30天后,来自0.1M PBS溶液的GC-FID脂肪酸谱;
图12显示了被喷涂至试样片(coupons)上的治疗剂/生物材料制剂在有和没有终固化的情况下获得的脂肪酸谱色谱;
图13描绘了流程图,介绍了在实施例2中概括的在载有治疗剂的支架上产生基于脂肪酸的、预固化物衍生的涂层的过程;和
图14显示了如实施例2所述,固化的油治疗涂层在0.01M PBS缓冲液中的药物释放曲线;
图15显示了实施例3所述的基于脂肪酸的、预固化物衍生的生物材料的药物释放曲线;
图16显示了实施例4所述的基于脂肪酸的、预固化物衍生的生物材料的药物释放曲线;
图17显示Co-Cr支架的测定回收率作为终固化时间的函数;
图18显示实施例4所述的基于脂肪酸的、预固化物衍生的生物材料的药物回收率;
图19显示了实施例6A所述的预固化物衍生的生物材料的粘度;
图20A和20B是涂有预固化物衍生的生物材料的支架的SEM;
图21A、21B和21C显示了预固化的鱼油在固化之前和之后的FTIR分析;
图22显示了在MTBE中被喷涂至试样片上的预固化物鱼油在终固化之前和之后的GC脂肪酸谱数据;
图23显示了在MTBE中被喷涂至试样片上的部分固化的(预固化物)鱼油在终固化之前和之后的脂肪酸谱色谱;
图24A、24B和24C显示溶解在MTBE中并被喷涂至试样片上的维生素E在有和没有终固化情况下的FTIR光谱;
图25A、25B和25C显示了维生素E对照与被喷涂至试样片上的维生素E在固化之前和之后的HPLC色谱;
图26A、26B和26C显示了治疗剂在被喷涂至试样片上后在固化之前和之后的FTIR分析;
图27A、27B和27C显示了治疗剂在被喷涂至试样片上后在固化之前和之后的HPLC色谱;
图28A、28B和28C呈现了化合物B脂肪酸衍生的、预固化的生物材料涂层在终固化之前和之后的FTIR光谱;
图29A和29B显示化合物B对照与从预固化物衍生的生物材料在终固化后获得的化合物B测定结果重叠的HPLC色谱;
图30显示了被喷涂至试样片上的治疗剂/生物材料制剂在有和没有终固化的情况下获得的脂肪酸谱数据;
图31A、31B和31C显示在75:25的预固化的鱼油:维生素E中被喷涂至支架上并固化不同时间的治疗剂的FTIR光谱;和
图32显示来自实施例15所述的体内实验的结果。
详细说明
本发明涉及形成基于脂肪酸的、预固化物衍生的生物材料,所述生物材料可以单独使用或与医疗装置组合使用,以释放和局部递送一种或多种治疗剂;还涉及形成所述涂层和定制所述涂层性质的方法,和使用所述涂层治疗哺乳动物损伤的方法。另外,由于生物材料的基础化学的独特性质,可以证实所述涂层包含特定的化学成分,该成分帮助在植入期间减少组织损伤部位处的异物反应和炎症,改善涂层的体内性能。基于脂肪酸的、预固化物衍生的生物材料可以由预固化物、例如预固化的脂肪酸形成。
在进一步描述本发明之前,对损伤和针对损伤的生物反应进行一般性和简要的描述是有帮助的。
血管损伤
引起内膜增厚的血管损伤可以大体分为由生物或机械引发的。生物学介导的血管损伤包括但不限于归结于下列的损伤:感染性病症,包括内毒素和疱疹病毒,例如巨细胞病毒;代谢失调,例如动脉粥样硬化;以及低温和放射引起的血管损伤。机械介导的血管损伤包括但不局限于由导管插入术或血管刮净(vascular scraping)术,例如经皮腔内冠状动脉成形术;血管手术;移植手术;激光治疗;和其它破坏血管内膜或内皮完整性的侵入过程所引起血管损伤。一般而言,新内膜形成是对血管损伤的愈合反应。
炎性反应
血管损伤后的伤口愈合分几个阶段发生。第一个阶段是炎性期。炎性期的特点在于止血和炎症。伤口形成期间的胶原暴露激活了凝血级联(内源和外源途经),启动炎性期。在组织损伤发生之后,因伤口形成而受损的细胞膜释放血栓烷A2和前列腺素2-α,它们是强有力的血管收缩剂。这个初始反应帮助限制出血。短时期之后,发生局部组胺释放继发的毛细血管扩张,和炎性细胞能够迁移到伤口床。正常伤口愈合过程中细胞迁移的时间线是可预测的。血小板是第一种反应细胞,释放多种趋化因子,包括表皮生长因子(EGF)、纤连蛋白、纤维蛋白原、组胺、血小板衍生生长因子(PDGF)、5-羟色胺和von Willebrand因子。这些因子帮助在血凝块形成期间稳定伤口。这些介质作用于控制流血和限制损伤程度。血小板脱颗粒还激活了补体级联,特别是C5a,它是中性粒细胞的强有力的化学吸引剂。
随着炎性期继续,更多免疫反应细胞迁移到伤口。第二种迁移至伤口的反应细胞是中性粒细胞,负责碎片清除、补体介导的细菌调理、和通过氧爆裂机制(即形成过氧化物和过氧化氢)破坏细菌。中性粒细胞杀死细菌和清除伤口的外来碎片。
接下来伤口中存在的细胞是白细胞和巨噬细胞(单核细胞)。巨噬细胞被称为指挥者(orchestrator),是伤口愈合必不可少的。许多酶和细胞因子通过巨噬细胞分泌。这些包括伤口清创的胶原酶;刺激成纤维细胞(生产胶原)和促进血管生成的白细胞介素和肿瘤坏死因子(TNF);和刺激角化细胞的转化生长因于(TGF)。这个步骤标志着向组织再建过程、即增殖期的转变。
细胞增殖
伤口愈合的第二阶段是增殖期。上皮形成、血管生成、肉芽组织形成和胶原沉积是伤口愈合的这个合成代谢部分的主要步骤。上皮形成发生在伤口修复早期。在伤口的边缘处,表皮立即开始增厚。边缘基底细胞开始沿着纤维蛋白链迁移过伤口,当它们相互接触时停止(接触抑制)。损伤后的前48小时内,整个伤口上皮形成。再建立上皮形成的分层。此时伤口的深处包含炎性细胞和纤维蛋白链。老化效应在伤口愈合中同样重要,即使不是最重要的,问题伤口在老年人群中出现。例如,老年患者的细胞不太容易增殖并且寿命缩短,而且老年患者的细胞对细胞因子的反应较低。
心脏病可以由供应心脏的血管的部分血管堵塞引起,在这之前是内膜平滑肌细胞增生。内膜平滑肌细胞增生的根本原因是血管平滑肌损伤和内皮衬的完整性破坏。动脉损伤之后的内膜增厚可以分成三个相继的步骤:1)继血管损伤之后平滑肌细胞开始增殖,2)平滑肌细胞向内膜迁移,和3)平滑肌细胞在内膜中进一步增殖,伴基质沉积。内膜增厚的发病机理研究已经表明,动脉损伤之后,血小板、内皮细胞、巨噬细胞和平滑肌细胞释放旁分泌和自分泌生长因子(例如血小板衍生生长因子,表皮生长因子,胰岛素样生长因子和转化生长因于)以及引起平滑肌细胞增殖和迁移的细胞因子。T细胞和巨噬细胞还迁移到新内膜中。该事件级联不限于动脉损伤,而是在静脉和小动脉损伤之后同样发生。
肉芽肿性炎症
慢性炎症或肉芽肿性炎症,可以进一步引起血管损伤愈合期间的并发症。肉芽肿是特定类型的慢性炎性细胞的聚集物,形成了毫米大小范围的小结。肉芽肿可以汇合,形成较大的区域。肉芽肿的主要成分是被称为上皮样细胞的改性巨噬细胞的集合,通常有淋巴细胞包围区。上皮样细胞传统上这样命名,是因为它们与上皮细胞组织学相似,但事实上不是上皮细胞;它们与所有巨噬细胞一样,源自血液单核细胞。上皮样细胞的吞噬作用比其它巨噬细胞低,显得分泌功能有改变。它们全部功能范围仍然不清楚。肉芽肿中的巨噬细胞通常进一步改变形成多核巨细胞。它们是通过没有核的上皮样巨噬细胞的融合或细胞分裂形成可以包含几十个核的巨大单细胞产生的。在一些情形中,核围绕细胞周边排列,被称为朗格罕型巨细胞;在其它情形中,核随机分散在整个细胞质中(即,对组织中存在的其它难消化的外来物质作出反应形成的异物型巨细胞)。肉芽肿性炎症的区域通常出现坏死。
形成肉芽肿性炎症看来需要存在难消化的外来物质(来自于细菌或其它来源)和/或针对损伤剂的细胞介导的免疫反应(IV型过敏反应)。
药物洗脱型的、基于脂肪酸的、预固化物衍生的生物材料:涂层和独立膜
本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层和独立膜)包含疏水性的交联脂肪酸衍生生物材料和任选的被包含在该基于脂肪酸的、预固化物衍生的生物材料中的一种或多种治疗剂。另外,本发明的预固化物衍生的生物材料(例如涂层和独立膜)如本文所述是生物可吸收的。治疗剂可以是被包含在涂层中的活性剂和/或例如一旦从涂层释放后变得有活性的前体药物。在本发明的一个实施方案中,药物洗脱型预固化物衍生的生物材料包含交联脂肪酸,例如ω-3脂肪酸。交联脂肪酸可以是非聚合物的。ω-3脂肪酸的来源可以是天然存在的油,例如鱼油。
本发明的疏水性的预固化物衍生的生物材料涂层和独立膜可以由油组分形成。油组分可以是任一种油,或油组合物。油组分可以是合成油,或天然存在的油,例如鱼油、鳕鱼肝油、亚麻籽油、葡萄籽油、或具有所需特性的其它油。本发明的一个实施方案利用鱼油部分是由于ω-3脂肪酸的含量高。鱼油还可以用作抗粘连剂。另外,鱼油也保持抗炎或非炎性性质。本发明不局限于用鱼油作为油起始材料来形成预固化物衍生的生物材料。但是,以下描述参考了利用鱼油作为一个示例性实施方案。根据本文描述的本发明,可以应用其它天然存在的油。
应该注意,在本文应用时,术语鱼油脂肪酸包括但不限于ω-3脂肪酸、油脂肪酸、游离脂肪酸、甘油一酯、甘油二酯或甘油三酯、脂肪酸的酯,或其组合。鱼油脂肪酸包括花生酸、顺式9-二十碳烯酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸、或其衍生物、类似物和可药用盐中的一种或多种。
此外,在本文中使用时,术语游离脂肪酸包括但不限于丁酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、油酸、11-十八碳烯酸、亚油酸、α-亚麻酸、γ-亚麻酸、山俞酸、芥酸、二十四烷酸、其类似物和可药用盐中的一种或多种。天然存在的油、包括鱼油,按照本文描述固化,形成疏水性的交联脂肪酸衍生的预固化物生物材料,产生涂层。
本发明涉及生物吸收型医疗装置用的涂层和独立膜,其可以表现出抗炎性质、非炎性性质和抗粘连性质,以及相应的制造方法。独立膜通常由天然存在的油、例如鱼油形成的。另外,油组合物可以包括治疗剂组分,例如药物或其它生物活性剂。独立膜可被植入患者中用于短期或长期应用。在本文中实施时,独立膜是至少部分地源自脂肪酸化合物的基于脂肪酸的、预固化物衍生的生物材料,其中独立膜根据本发明的方法制备。根据本发明的其它方面,独立膜可以进一步包括构成脂肪酸化合物的一部分的维生素E化合物。
根据本发明的其它方面,独立膜进一步包括治疗剂。治疗剂可以包括选自抗氧化剂、抗炎剂、抗凝剂、改变脂类代谢的药物、抗增殖剂、抗肿瘤剂、组织生长刺激剂、功能蛋白/因子递送剂、抗感染剂、显像剂、麻醉剂、化疗剂、组织吸收增强剂、抗粘连剂、杀菌剂、止痛剂、前体药物和抗菌剂的药剂。
根据本发明的其它方面,在形成膜之前,将治疗剂与脂肪酸化合物组合,致使治疗剂散布于整个膜中。或者,治疗剂以涂层的形式施加于膜。根据本发明的其它方面,独立膜是生物可吸收的。独立膜可以进一步保持抗粘连性质。
根据本发明的又一个实施方案,介绍了形成独立膜的方法。该方法包括提供液态的脂肪酸化合物并将所述脂肪酸化合物施加于基片。该方法还包括将脂肪酸化合物固化以形成独立膜。根据本发明的一个方面,基片包括膨化聚四氟乙烯(ePTFE)或聚四氟乙烯(PTFE)。根据本发明的其它方面,固化包括使用选自包括应用紫外线灯和应用热的固化方法中的至少一种固化方法。紫外线灯也可以应用于通过在液态脂肪酸化合物的上表面上形成衣、然后进一步固化,来使脂肪酸化合物硬化。根据本发明的其它方面,基片具有用作模具来成形独立膜的凹口。或者,该方法可以进一步包括将膜切割成合乎需要的形状的步骤。
本发明的独立膜可以用作屏障,保持组织分离,避免粘连。防止粘连的应用例子包括腹腔外科、脊椎修复、整形外科、肌腱和韧带修复、妇产科和盆腔外科、以及神经修复用途。独立膜可以敷在外伤部位上或包裹在组织或器官周围,限制粘连形成。可以利用向用于这些防止粘连用途的独立膜添加治疗剂,来添加有益的效应,例如缓减疼痛或最小化感染。独立膜的其它外科用途可以包括使用独立膜作为硬膜贴片、支撑材料、内部伤口护理(例如移植物吻合部位)、以及内部药物递送系统。独立膜也可以用于透皮应用、伤口愈合和非外科领域。独立膜可以用于外部伤口护理,例如治疗烧伤或皮肤溃疡。独立膜可以没有任何治疗剂,作为干净、不可渗透、不粘连、无炎性、抗炎的敷料使用,或独立膜可以和一种或多种治疗剂一起使用,以增加有益的效应。当独立膜载有或包被有一种或多种治疗剂时,独立膜也可以用作透皮药物递送贴片。
油
关于前面提到的油,通常已知,脂肪酸中的不饱和度越大,脂肪的熔点越低,并且烃链越长,脂肪的熔点越高。因此,多不饱和脂肪具有较低熔点,而饱和脂肪具有较高熔点。那些具有较低熔点的脂肪在室温下更经常是油。那些具有较高熔点的脂肪在室温下更经常是蜡或固体。因此,在室温下具有液体物理状态的脂肪是油。一般说来,多不饱和脂肪在室温下是液体油,而饱和脂肪在室温下是蜡或固体。
多不饱和脂肪是身体从食物衍生的四种基本类型脂肪之一。其它脂肪包括饱和脂肪、以及单不饱和脂肪和胆固醇。多不饱和脂肪还可以包括ω-3脂肪酸和ω-6脂肪酸。在根据第一个碳双键位置命名不饱和脂肪酸的惯例下,那些在分子的甲基末端起第三个碳原子处具有第一个双键的脂肪酸称为ω-3脂肪酸。同样,第一个双键在第六个碳原子处被称作ω-6脂肪酸。可以有单不饱和和多不饱和的ω脂肪酸。
ω-3和ω-6脂肪酸也被称作必需脂肪酸,因为尽管事实上人体不能自己生产它们,但它们对于保持身体健康是重要的。因而,ω-3和ω-6脂肪酸必须从外源、例如食物获得。ω-3脂肪酸可以进一步表征为含二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)、和α-亚麻酸(ALA)。EPA和DHA二者均已知在人体内具有抗炎效应和伤口愈合效应。
在本文中应用时,术语“生物可吸收的”通常是指具有能够渗透患者身体组织的性质或特征。在本发明的某些实施方案中,生物吸收通过亲脂机制发生。生物可吸收的物质可溶于身体组织细胞的磷脂双层,因此影响生物可吸收物质如何穿透进入细胞。
应该注意,生物可吸收物质与生物可降解物质不同。生物可降解通常定义为能够通过生物因素分解、或能够通过微生物或生物过程分解。生物可降解的物质由于母体物质或分解期间形成的物质所致,可以引起炎性反应,并且它们可以或不可以被组织吸收。因为本发明的材料是生物相容的,并且它们水解成非炎性组分,并随后被周围组织生物吸收,所以它们被称为“生物材料”。
药物递送
在患者需要治疗的选定靶组织位置处,使用带有涂层的独立膜、医疗装置或仪器,本发明的预固化物衍生的生物材料(例如涂层和独立膜)向靶区域局部递送一种或多种治疗剂。治疗剂从生物材料向靶组织位置释放。局部递送治疗剂使得治疗剂能够更浓缩并且更大量地向靶组织位置直接递送治疗剂,从而没有更广的全身副作用。采用局部递送,治疗剂避免了随着其向患者身体其余部分的行进时靶组织位置的稀释,显著减少或消除了全身副作用。
利用基于脂肪酸的、预固化物衍生的生物材料(例如涂层和独立膜)进行靶向局部治疗剂递送可以进一步分为两类,即,短期和长期。短期递送治疗剂通常大约在数秒或数分钟至几天或几周内。长期递送治疗剂通常存在数周至数月内。
本文使用的短语“持续释放”是指导致生物活性剂长期递送的活性剂释放。
短语“控释”在本文使用时通常是指生物活性剂在它要从其释放的医疗装置上形成后,按照需要和预先决定,所述生物活性剂在数周或数月的时间段中以基本上可预测的方式释放。控释包括在植入后提供初始突释,然后在前面提到的时间段中基本上可预测地释放。
药物释放机制
之前对于创建膜和药物递送平台、例如支架领域的尝试,主要利用基于高分子量合成聚合物的材料来提供更好地控制治疗剂释放的能力。基本上,一旦植入到患者内的位置后,平台中的聚合物就以预定的速度释放药物或药剂。无论多少量的治疗剂将最有益于损伤组织,聚合物都基于所述聚合物的性质来释放治疗剂,例如在生物稳定的聚合物中的扩散和在生物可降解的聚合物材料中的本体溶蚀。因此,在与具有涂层的医疗装置接触的组织表面处,治疗剂的效应基本上是局部的。在一些情况中,治疗剂的效应进一步局限到例如压靠在受治组织位置处的支架支杆或网片特定位置上。在邻近聚合物的组织中存在引发炎性反应的高浓度治疗剂可以产生局部毒性效应的可能性。
在本发明的各种实施方案中,除了基于溶蚀的释放机制之外,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层和独立膜)还通过溶出机制释放一种或多种治疗剂,例如将涂层的可溶组分中包含的治疗剂溶出到与所述涂层接触的介质(例如组织)中。因此,该药物释放机制可以基于治疗剂在周围介质中的溶解度。例如,在疏水性涂层和周围介质之间的界面附近的治疗剂可以出现化学势梯度,其能够推动治疗剂离开油基涂层和进入周围介质中的溶液中。因此,在不同的实施方案中,治疗剂的释放不是通过涂层的分解或本体溶蚀来限速的。
在不同的实施方案中,本发明的基于脂肪酸的、预固化物衍生的生物材料的分解产物是非炎性副产物,例如游离脂肪酸和甘油酯,它们自己可以通过溶出机制释放一种或多种治疗剂。
在不同的实施方案中,基于脂肪酸的、预固化物衍生的生物材料根据受控的表面溶蚀机制分解,从而通过溶出机制向周围介质、例如组织释放一种或多种治疗剂。
治疗剂
在本文应用时,短语“治疗剂”是指现有的许多不同药物或药剂,以及未来可能对与本发明的基于脂肪酸的、预固化生物材料(例如涂层和独立膜)一起使用有益的药剂。治疗剂组分可以采取许多不同的形式,包括抗氧化剂、抗炎剂、抗凝剂、改变脂类代谢的药物、抗增殖剂、抗肿瘤剂、组织生长刺激剂、功能蛋白/因子递送剂、抗感染剂、抗显像剂、麻醉剂、治疗剂、组织吸收增强剂、抗粘连剂、杀菌剂、抗菌剂、止痛剂、其前体药物,和任何另外希望的治疗剂,例如下表1中列出的那些。
可用于抗再狭窄领域的治疗剂的一些具体例子包括西立伐他汀、西洛他唑、氟伐他汀、洛伐他汀、紫杉醇、普伐他汀、雷帕霉素、雷帕霉素碳水化合物衍生物(例如,如美国专利No.7,160,867所述)、雷帕霉素衍生物(例如,如美国专利No.6,200,985所述)、依维莫司、seco-雷帕霉素、seco-依维莫司、和辛伐他汀。采用全身给药,所述治疗剂口服或静脉给药,被患者全身处理。但是,治疗剂的全身递送有缺点,其中之一是治疗剂运行到患者身体的所有部分,并可以在不是治疗剂治疗靶向的区域处具有不希望的效应。此外,大剂量治疗剂在非靶区域只会放大不希望的效应。因此,当全身给药时,可能不得不减少产生施加到患者特定靶位置的治疗剂的量,来减少较高剂量治疗剂导致的毒性引起的并发症。
术语“mTOR寻靶化合物”是指直接或间接调节mTOR的任何化合物。“mTOR寻靶化合物”的例子是与FKBP 12结合形成例如复合物,该复合物随后抑制磷脂酰肌醇(PI)-3激酶,即mTOR。在不同的实施方案中,MTOR寻靶化合物抑制mTOR。合适的mTOR寻靶化合物包括例如雷帕霉素和它的衍生物、类似物、前体药物、酯和可药用盐。
钙调神经磷酸酶是丝氨酸/苏氨酸磷酸蛋白质磷酸酶,由催化性(钙调神经磷酸酶A)和调节性(钙调神经磷酸酶B)亚单位(分别是大约60kDa和大约18kDa)组成。在哺乳动物中,已经鉴定了催化性亚单位的三个不同的基因(A-α,A-β,A-γ),每个都可以经历可变剪接以产生另外的变体。虽然所有三个基因的mRNA呈现出在大多数组织中表达,但在大脑中最主要的是两种同工型(A-α和A-β)。
钙调神经磷酸酶信号传导途径涉及免疫应答以及通过神经元细胞中谷氨酸兴奋性毒性来诱导凋亡。钙调神经磷酸酶的酶水平低已经与阿尔茨海默氏病(Alzheimers disease)有关联。在心脏中或脑中,钙调神经磷酸酶也在缺氧或缺血后的应激反应中发挥关键作用。
能够阻断钙调神经磷酸酶信号途径的物质可能是本发明的合适的治疗剂。这样的治疗剂的例子包括但不限于FK 506、他克莫司、环孢菌素并包括其衍生物、类似物、酯、前体药物、可药用盐,和它们的具有或其代谢产物具有相同作用机制的结合物。环孢菌素衍生物的其它例子包括但不限于,通过全合成或半合成手段或通过应用改良的培养技术制备的天然存在的和非天然的环孢菌素。包括环孢菌素的类别包括,例如,天然存在的环孢菌素A至Z,以及各种各样的非天然环孢菌素衍生物、人工或合成环孢菌素衍生物。人工或合成环孢菌素可以包括二氢环孢菌素、衍生化环孢菌素和在肽序列内特定位置处结合了氨基酸变体的环孢菌素,例如二氢环孢菌素D。
在不同的实施方案中,治疗剂包含一种或多种mTOR寻靶化合物和钙调神经磷酸酶抑制剂。在不同的实施方案中,MTOR寻靶化合物是化合物D或其衍生物、模拟物、酯、前体药物、可药用盐,或它的具有或其代谢产物具有相同作用机制的结合物。在不同的实施方案中,钙调神经磷酸酶抑制剂是他克莫司化合物或其衍生物、模拟物、酯、前体药物、可药用盐或它的具有或其代谢产物具有相同作用机制的结合物,或环孢菌素化合物或其衍生物、模拟物、酯、前体药物、可药用盐,或它的具有或其代谢产物具有相同作用机制的结合物。
可以和本发明的脂肪酸衍生、预固化的生物材料一起使用的治疗剂还可以包括抗微生物剂,包括抗病毒剂、抗菌素、抗真菌剂和抗寄生虫剂。可以和本发明的脂肪酸衍生的、预固化的生物材料一起使用具体的抗微生物剂,包括青霉素G、头孢噻吩、氨苄青霉素、羟氨苄青霉素、沃格孟汀、氨曲南、亚胺培南、链霉素、庆大霉素、万古霉素、氯林可霉素、红霉素、阿奇霉素、多粘菌素、杆菌肽、两性霉素、制霉菌素、利福平、四环素、脱氧土霉素、氯霉素、萘啶酸、环丙沙星、磺胺、磺胺异恶唑、甲氧苄氨嘧啶、异烟肼(INH)、对氨基水杨酸(PAS)和庆大霉素。
治疗有效量和剂量水平
治疗有效量是指化合物的量足以引起症状改善,例如治疗、愈合、预防或改善相关的医疗状况,或增加治疗、愈合、预防或改善这样的状况的比率。当应用于单独给药的单一活性成分时,治疗有效量是指该单独成分。当应用于组合时,治疗有效量可以指引起疗效的活性成分的组合量,不管是以组合、相继或同时给药。在不同的实施方案中,在制剂包含两种以上治疗剂的情况下,这样的制剂可以描述为对适应症A的治疗有效量化合物A和对适应症B的治疗有效量化合物B,这样的说明是指A的量对适应症A具有疗效,但不一定对适应症B具有疗效,而B的量对适应症B具有疗效,但不一定对适应症A具有疗效。
本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层和独立膜)中活性成分的实际剂量水平可以变化,以便获得有效达到所需治疗应答而没有不可接受的毒性的活性成分量。选定的剂量水平将根据各种各样的药代动力学因素的不同而异,所述因素包括使用的具体治疗剂(药物)或其酯、盐或酰胺的活性,药物作用机制,给药时间,涂层的药物释放模式,使用的具体化合物的排泄速度,疗程,与所使用的具体化合物组合使用的其它药物、化合物和/或材料,和医疗领域已知的类似的因素。例如,本发明提供基于脂肪酸的、预固化物衍生的生物材料,其包含部分交联的脂肪酸和治疗剂,其中治疗剂按重量计占生物材料组合物的至少30%,例如至少40%,例如至少50%,例如至少60%,例如至少70%。除了治疗剂之外,生物材料可以包含治疗剂以外的维生素E。
其它试剂
本发明的预固化物衍生的生物材料(例如涂层和独立膜),除了治疗剂之外,还可以包含一种或多种其它化学物质和实体,包括但不限于以下一种或多种:可药用载体,赋形剂,表面活性剂,粘合剂,佐剂,和/或稳定剂(包括防腐剂,缓冲剂和抗氧化剂)。所述其它试剂可以执行一种或多种功能,例如,佐剂也可以用作稳定剂。
在不同的实施方案中,本发明的涂层和独立膜包含自由基清除剂和摄取增强剂的一种或多种。在不同的实施方案中,涂层和独立膜包含维生素E。
应该注意,在本文用于描述本发明时,术语维生素E和术语α-生育酚是用来指相同或基本上类似的物质,使得它们可互换,以及使用其中一种包括隐含提到二者。与术语维生素E相关的,还包括这样的变体,其包括但不限于以下一种或多种:α-生育酚,β-生育酚,δ-生育酚,γ-生育酚,α-生育三烯酚,β-生育三烯酚,δ-生育三烯酚,γ-生育三烯酚,α-乙酸生育酚,β-乙酸生育酚,γ-乙酸生育酚,δ-乙酸生育酚,α-乙酸生育三烯酚,β-乙酸生育三烯酚,δ-乙酸生育三烯酚,γ-乙酸生育三烯酚,α-琥珀酸生育酚,β-琥珀酸生育酚,γ-琥珀酸生育酚,δ-琥珀酸生育酚,α-琥珀酸生育三烯酚,β-琥珀酸生育三烯酚,δ-琥珀酸生育三烯酚,γ-琥珀酸生育三烯酚,混合生育酚,维生素ETPGS,其衍生物、类似物和可药用盐。
化合物太快移动通过组织可能不会在目标区有效提供充分浓度的剂量。反之,化合物不迁移到组织中可能决不会到达目标区。细胞摄取增强剂例如脂肪酸和细胞摄取抑制剂诸如α-生育酚可以单独或组合使用,以提供给定化合物有效运送到给定的区域或位置。脂肪酸和α-生育酚二者均可被包含在本文的本发明的脂肪酸衍生的、预固化生物材料(例如涂层和独立膜)中。因此,脂肪酸和α-生育酚可以用不同的量和比例组合,以向涂层和在其中混合的任何治疗剂的细胞摄取特性提供控制的方式,对脂肪酸衍生的、预固化生物材料(例如涂层和独立膜)作出贡献。
例如,涂层中α-生育酚的量可以变化。已知α-生育酚在鱼油中通过减少氢过氧化物形成来减慢自氧化,导致固化的脂肪酸衍生的、预固化生物材料中的交联量降低。另外,α-生育酚可用于增加药物在形成涂层的油中的溶解度。在不同的实施方案中,α-生育酚在固化期间实际上可以保护治疗性药物,其增加涂层固化后所得到的药物载量。此外,对于某些治疗性药物,由于所述药物在涂层的α-生育酚组分中的溶解度增加,涂层中的α-生育酚的增加可以用来减慢和延长药物释放。因为药物的摄取随着时间减慢和延长,这反映了α-生育酚的细胞摄取抑制剂功能。
预固化物和基于脂肪酸的、预固化物衍生的生物材料的固化和形成
现有几种方法来固化油起始材料,然后固化所述预固化物(任选含有一种或多种治疗剂)来生产本发明的用于药物释放的基于脂肪酸的、预固化物衍生的生物材料和递送涂层或独立膜(例如,如美国专利申请公布2008/0118550、2007/0202149、2007/0071798、2006/0110457、2006/0078586、2006/0067983、2006/0067976、2006/0067975所述)。用于固化起始材料以生产预固化物、然后生产基于脂肪酸的、预固化物衍生的生物材料的优选方法,包括但不限于,加热(例如使用烘箱,宽频带红外线(IR)光源,相干IR光源(例如激光),和其组合)和紫外线(UV)辐射。起始材料可以通过自氧化而交联(即氧化交联)。
根据本文描述的不同的实施方案,本发明的药物释放涂层由预固化物衍生的生物材料形成,该生物材料可以源自于饱和和不饱和的脂肪酸化合物(例如,游离脂肪酸,脂肪酸酯,甘油一酯,甘油二酯,甘油三酯,金属盐等等)。优选,本文中描述的脂肪酸来源是各种油(例如鱼油)中的饱和和不饱和的脂肪酸,例如容易以甘油三酯形式得到的那些。形成预固化物衍生的生物材料的一种方法是通过油的自氧化完成的。在加热含不饱和脂肪酸的液体油时,随着氧气吸收到油中发生自氧化,产生氢过氧化物,其量取决于油中不饱和(C=C)位点的量的不同而异。但是,在这个初始反应中不消耗(C=C)键。与形成氢过氧化物同时发生的是(C=C)双键的异构化,除了双键共轭之外,还从顺式转变成反式。持续加热油,通过形成交联导致涂层固化,并通过氢过氧化物的进一步反应以及C=C双键的裂解,将它们转变成低分子量二次氧化副产物,包括醛、酮、醇、脂肪酸、酯、内酯、醚和烃,它们可以留在涂层内和/或在所述过程期间挥发。
油氧化期间形成的交联的类型和量可以根据所选的条件(例如,涂层厚度,温度,金属组合物等等)定制。例如,加热油可以在鱼油不饱和链之间利用过氧化物(C-O-O-C)、醚(C-O-C)和烃(C-C)桥的组合产生交联(参见,例如,F.D.Gunstone,"Fatty Acid and Lipid Chemistry.(脂肪酸和脂类化学)"1999.)。但是,在较低温度下(即,低于150℃)加热导致主要形成过氧化物交联,而在较高温度下(即,超过150℃)加热导致过氧化物和C=C的热降解,主要形成醚交联(F.D.Gunstone,1999)。不同的交联机制和方案的示意图显示在图1-2中。
除了热固化过程之外,油的氧化还可以通过光(例如光致氧化)引起。光致氧化限于C=C碳原子并导致固化期间从顺式向反式C=C异构体的转变(与热启动的固化所发生的相同)。但是,使用紫外线进行光致氧化是比从热固化进行自氧化相对更迅速的反应,在快大约1000-1500倍的范围内。更迅速的反应对于被亚甲基所中断的多不饱和脂肪酸例如EPA和DHA尤其适用,EPA和DHA见于本发明基于鱼油的实施方案中。
当与热固化相比时,紫外线固化的重要方面是虽然通过两种固化方法获得的副产物类似,但它们的量或化学结构不一定相同。对此的一个原因应归于光致氧化在更多可能的C=C位点处产生氢过氧化物的能力。
光致氧化,例如由紫外线固化引起的,由于它提高了产生内部氢过氧化物的能力,也导致形成相对更大量的环状副产物的能力,环状副产物也与鱼油烃链之间过氧化物的交联有关。例如,亚麻酸盐的光致氧化导致形成6种不同类型的氢过氧化物,而自氧化导致只形成4种。利用光致氧化产生的更大量的氢过氧化物,导致相对于热固化的自氧化,形成的二次副产物的结构和量类似但稍有不同。具体地说,这些副产物是醛、酮、醇、脂肪酸、酯、内酯、醚和烃。
根据油固化条件和起始油的脂肪酸组成的不同而异,脂肪酸衍生生物材料(即预固化物和预固化物衍生的生物材料)可以通过固化所述油、使得不饱和脂肪酸链的双键氧化同时基本保留甘油三酯的酯官能团而产生。不饱和脂肪酸链的氧化导致形成氢过氧化物,氢过氧化物随着持续固化,转变成醛、酮、醇、脂肪酸、酯、内酯、醚和烃。随着氧化油的持续加热,副产物挥发,导致在形成酯交联之外,涂层粘度也增加。酯交联和内酯交联的形成可以通过不同类型的机制(即,如F.D.Gunstone,1999,第8章所述的酯化、醇解、酸解、酯交换,所述文献合并作为参考),在氧化过程生成的涂层中的羟基和羧基功能组分(即甘油酯和脂肪酸)之间发生。交联反应可以形成不同类型的酯键,例如酯、酐、脂族过氧化物、和内酯。图3-4分别地概括了油衍生的生物材料的形成和反应化学。如图3所描述,油氧化后,即形成预固化物后,可以任选添加治疗剂。除了治疗剂之外,还可以添加维生素E,其将保护所述药剂和预固化的油免于进一步氧化,但不抑制油的脂肪酸和/或甘油酯组分的进一步交联。图5出于说明性的目的,提供了从油反应方案形成酯的不同方法的示意图,但不是意味着限制本发明的范围。
本发明的预固化物衍生的生物材料涂层和独立膜由油组分形成。术语“油组分”在本文中还指“含油的起始材料”。“含油的起始材料”可以是天然的或得自合成来源。优选,“含油的起始材料”包含不饱和脂肪酸。油组分可以是油或油组合物。油组分可以是天然存在的油,例如鱼油、亚麻籽油、葡萄籽油、合成油,或具有所需特征的其它油。本发明的一个实施方案利用鱼油,部分是由于ω-3脂肪酸的含量高,如本文所述,ω-3脂肪酸可以提供损伤组织的愈合支持。鱼油还可以用作抗粘连剂。另外,鱼油还保持抗炎或非炎性性质。本发明不局限于用鱼油作为天然存在的油来形成脂肪酸衍生的预固化生物材料。然而,下面的描述参考使用鱼油作为一个示例实施方案。其它天然存在的油或合成油可以根据本文描述的本发明来利用。
基于脂肪酸的、预固化物衍生的生物材料的涂层水解和生物吸收化学
带有酯、内酯和酐官能团的生物可降解的和生物可吸收的可植入材料典型通过化学和/或酶水解机制分解(K.Park等,"Biodegradable Hydrogels for Drug Delivery.(用于药物递送的生物可降解水凝胶)"1993;J.M.Andersen,"Perspectives on the In-Vivo Responses of Biodegradable Polymers.(对生物可降解聚合物体内反应的展望)",Jeffrey O.Hollinger.1995年主编的“Biomedical Applications of Synthetic Biodegradable Polymers(生物可降解的合成聚合物的生物医学应用)”,p223-233)。当脂肪酸衍生生物材料中存在的官能团被水裂解时,所述生物材料发生化学水解。甘油三酯在碱性条件下化学水解的例子呈现在图6中。酶水解是通过与特定酶反应引起的脂肪酸衍生生物材料中官能团的裂解(即甘油三酯被脂酶(酶)分解,产生游离脂肪酸,然后其可以跨细胞膜运送)。生物可降解的和/或生物可降解的脂肪酸衍生生物材料水解所花费的时间长度取决于几个因素,例如材料的交联密度、涂层的厚度和水合能力、脂肪酸衍生生物材料的结晶度、和水解产物被身体代谢掉的能力(K.Park等,1993和J.M.Andersen,1995)。
生物可吸收物质与生物可降解物质不同。生物可降解通常定义为能够通过生物因素分解、或能够通过微生物或生物过程分解。生物可降解的物质由于母体物质或分解期间形成的物质,可以引起炎性反应,并且它们可以或不可以被组织吸收。一些生物可降解物质的水解限于本体溶蚀机制。例如,通常使用的生物可降解的聚合物PLGA(乳酸-羟基乙酸共聚物)在体内经历化学水解,形成两种α-羟酸,具体是羟基乙酸和乳酸。虽然羟基乙酸和乳酸是身体内不同代谢途径的副产物,但在以前的医疗植入物和局部药物递送应用中以前已经证明,这些产物的局部浓度导致产生酸性环境,从而可以引起炎症和对局部组织的损害(S.Dumitriu,"Polymeric Biomaterials.(聚合物生物材料)"2002)。临床上,这可以引起有害的临床结果例如在冠状动脉支架应用中的再狭窄(D.E.Drachman和D.I.Simon.Current Atherosclerosis Reports.2005,Vol 7,p44-49;S.E.Goldblum等Infection and Immunity.1989,Vol.57,No.4,p1218-1226)和损害愈合,这可以引起后期支架血栓形成,或在腹疝修复中形成粘连(Y.C.Cheong等Human Reproduction Update.2001;Vol.7,No.6:p556-566)。因此,理想的预固化物衍生的生物材料应当不仅在植入后表现出极好的生物相容性,而且还应当在它的植入寿命期间,与它的可被局部组织吸收的水解副产物保持生物相容性。
用作独立膜、医疗装置用涂层或用于药物递送应用中的预固化物衍生的生物材料的生物可吸收性质,导致所述生物材料随着时间被身体组织的细胞吸收。在不同的实施方案中,在涂层中、或在涂层的体内转变的副产物中基本上没有引起炎性反应的物质,例如,涂层在体内转变成非炎性组分。例如,在不同的实施方案中,本发明的涂层在吸收和水解后不产生可测出量的乳酸和羟基乙酸分解产物。本发明描述的预固化物衍生的生物材料的化学组成主要由脂肪酸和甘油酯组分构成,可以在体内通过化学和/或酶手段水解,并且导致可以跨细胞膜运送的脂肪酸和甘油酯组分的释放。随后,从预固化物衍生的生物材料洗脱的脂肪酸和甘油酯组分直接被细胞代谢(即,它们是生物可吸收的)。本发明的涂层和独立膜的生物可吸收性质导致涂层随着时间被吸收,只留下底下的递送结构或生物相容的其它医疗装置结构。在本发明的优选实施方案中,对所述生物可吸收的涂层或它的水解产物基本上没有异物炎性反应。
基于脂肪酸的、预固化物衍生的生物材料的生物相容性和体内性能
从有关油氧化的文献中的传统科学报告看来,本发明描写的制造预固化物衍生的生物材料(例如涂层或独立膜)的过程产生一些出乎意料的化学过程和特征(J.Dubois等JAOCS.1996,Vol.73,No.6.,p787-794;H.Ohkawa等,Analytical Biochemistry,1979,Vol.95,p351-358.;H.H.Draper,2000,Vol.29,No.11,p1071-1077)。油氧化形成反应性副产物例如氢过氧化物和α-β不饱和醛,它们被认为是生物不相容的,因此油氧化是油固化过程的传统问题(H.C.Yeo等Methods in Enzymology.1999,Vol.300,p70-78.;S-S.Kim等Lipids.1999,Vol.34,No.5,p489-496。)。然而,来自油和脂肪的脂肪酸的氧化在体内生化过程控制下是正常和重要的。例如。调控某些生化途径,以致促进或减少炎症,是通过不同的脂质氧化产物控制的(V.N.Bochkov和N.Leitinger.J.MoI.Med.2003;Vol.81,p613-626)。另外,已知ω-3脂肪酸对人类健康重要,特别是已知EPA和DHA在体内具有抗炎性质。然而,EPA和DHA它们本身不抗炎,但它们以生化方式转变成的氧化副产物在体内产生抗炎效应(V.N.Bochkov和N.Leitinger,2003;LJ.Roberts II等The Journal of Biological Chemistry.1998;Vol.273,No.22,p13605-13612。)。因此,虽然有某些不生物相容的油氧化产物,但也有几种在体内具有积极的生化特性的其它氧化产物(V.N.Bochkov和N.Leitinger,2003;F.M.Sacks和H.Campos.J Clin Endocrinol Metab.2006;Vol.91,No.2,p98-400;A.Mishra等Arterioscler Thromb Vase Biol.2004;p1621-1627。)。因此,通过选择适当的工艺条件,可以利用油氧化化学产生和控制脂肪酸衍生的、交联的、疏水性的脂肪酸衍生的预固化物生物材料(来自例如鱼油),其最终的化学特征将具有有利的体内生物性能。
制造本发明所述的预固化物衍生的疏水性非聚合物生物材料的方法产生的最终化学特征是,生物相容、最小化粘连形成、充当组织隔离屏障、以及材料化学物质和通过身体体内水解和吸收后产生的产物是非炎性的。这些性质的原因应归于本发明脂肪酸衍生的、预固化的生物材料(例如涂层或独立膜)的几个独有的特性。
本发明的一个重要的方面是使用无毒性的短链交联剂(例如戊二醛)来形成本发明的脂肪酸衍生的、预固化的生物材料(例如涂层或独立膜)。在文献中以前已经证明,在生物可降解的聚合物的水解期间,短链交联剂可以洗出,引起局部组织炎症。因为利用油自氧化或光致氧化化学,唯有油被固化成涂层,所以产生预固化物衍生的生物材料的方法不涉及外部交联剂。所述氧化过程导致形成羧基和羟基官能团,其使得预固化物衍生的生物材料变得极迅速水合并变得光滑,可以明显减少和/或消除植入期间和植入后的摩擦损伤。制造本文描述的预固化物衍生的生物材料的方法使得存在于涂层中的脂肪酸、甘油酯和其它脂质副产物的烷基链成为不规则的,这产生挠性的涂层,在植入时有助于所述材料的操作。
涂层有几种个体化学组分有助于在体内观察到的涂层的生物相容性和它的低至没有的炎性反应。一个关键的方面是产生本文描述的预固化物衍生的生物材料的方法导致有生物相容性担心的氧化脂质副产物、例如醛的量低至不可检测。这些产物如本发明所述,在固化过程期间几乎被完全反应或挥发。产生预固化物衍生的生物材料的方法在很大程度上保留了天然油甘油三酯的酯,并形成酯和/或内酯交联,它们是生物相容的(K.Park等,1993;J.M.Andersen,1995)。
除了预固化物衍生的生物材料有助于它的生物相容性的一般化学性质之外,还有具有积极生物学性质的特定化学组分。生产预固化物衍生的生物材料后产生的脂肪酸化学的另一个方面类似于组织的脂肪酸化学,如图7所示。因此,随着脂肪酸从涂层洗脱,它们不会被身体视为“异物”并引起炎性反应。事实上,在文献中已经显示,涂层中存在的C14(肉豆蔻)脂肪酸和C16(棕榈)脂肪酸减少炎性细胞因子α-TNF的产生。α-TNF的表达已经被鉴定为是在疝气修复后负责“开启”腹膜炎症的关键细胞因子之一,然后可以引起异常愈合和粘连形成(Y.C.Cheong等,2001)。α-TNF也是血管损伤和炎症中重要的细胞因子(D.E.Drachman和D.I.Simon,2005;S.E.Goldblum,1989),例如支架放置期间引起的血管损伤。除了刚才指定的脂肪酸之外,还鉴定出有抗炎性质的其他氧化脂肪酸。从本发明描述的脂肪酸衍生涂层鉴定到的另一个组分是δ-内酯(即,6-元环的环状酯)。δ-内酯已被鉴定为具有抗肿瘤性质(H.Tanaka等Life Sciences 2007;Vol.80,p1851-1855)。
这些鉴定出的组分不意味着限制本发明的范围,因为起始的油组成和/或工艺条件的改变总是能够改变脂肪酸和/或氧化副产物谱,并可以根据脂肪酸衍生的、预固化的生物材料的预定目的和应用部位而按需定制。
总之,本发明描述的预固化物衍生的生物材料的生物相容性和观察到的体内性能应归于在植入和愈合期间所述材料的水解过程中脂肪酸的洗脱,并且不仅由于材料的脂肪酸组成与天然组织的相似性,使得对于防止体内异物反应有益(即生物“隐形”涂层),而且特定的脂肪酸和/或其它脂质氧化组分从所述涂层的洗脱,有助于防止异物反应并减少或消除炎症,从而产生患者预后改善。另外,从预固化物衍生的生物材料洗脱的脂肪酸和甘油酯组分能够被局部组织吸收和被细胞代谢,例如,通过柠檬酸循环(M.J.Campell,"Biochemistry:Second Edition."(生物化学,第二版)1995,p366-389)。因此,本发明描述的预固化物衍生的生物材料(例如涂层或独立膜)也是生物可吸收的。
因此,在一个方面,本发明提供了生物可吸收的、基于油的医疗装置用涂层,其包含具有预固化的组分的交联脂肪酸油衍生的生物材料以及治疗剂。本发明还提供生物可吸收的、基于油的独立膜,其包含具有预固化的组分的交联脂肪酸油衍生的生物材料以及治疗剂。所述涂层和独立膜可以根据本文论述的方法制备。
使用脂肪酸衍生材料的治疗方法
本文还提供了适于治疗或防止与血管损伤和/或血管炎症相关的病症的基于脂肪酸的、预固化物衍生的生物材料。所述基于脂肪酸的、预固化物衍生的生物材料还可以用来治疗或防止对组织、例如软组织造成的损伤。基于脂肪酸的、预固化物衍生的生物材料可以是医疗装置用涂层或独立膜。在另一个实施方案中,用于生物材料的脂肪酸的来源是油,例如鱼油。
一般而言,人存在四种类型的软组织:上皮组织,例如皮肤以及血管和许多器官的内衬;结缔组织,例如腱、韧带、软骨、脂肪、血管和骨;肌肉,例如骨骼肌(横纹肌)、心肌或平滑肌;和神经组织,例如大脑、脊髓和神经。本发明的基于脂肪酸的、预固化物衍生的生物材料(例如独立膜)可用于治疗这些软组织区域的损伤。因此,在一个实施方案中,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如独立膜)可以用于促进软组织的伤口愈合性增殖。此外,在急性外伤之后,软组织可以由于愈合和复原过程而经历改变和适应。这样的改变包括而不局限于,化生,这是将一种组织转变成该组织的非正常形式;发育异常,是组织的异常发育;增生,是在正常组织排列中正常细胞的过度增殖;和萎缩,是组织的尺寸由于细胞死亡和再吸收或细胞增殖降低而缩小。因此,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如独立膜)可以用于减弱或减轻与软组织急性外伤有关或由其引起的至少一种症状。
在一个实施方案中,如下所述,基于脂肪酸的、预固化物衍生的生物材料可以用于,例如防止组织粘连。组织粘连可能是钝性分离的结果。钝性分离可以一般性描述为不用切割,沿着天然皮纹线分离组织而完成的分离。钝性分离使用许多不同的钝性外科工具执行,这是本领域的普通技术人员所了解的。在心血管、结肠直肠、泌尿、妇科、上消化道和整形外科应用等中,经常执行钝性分离。
钝性分离将目标组织分离成分开的区域后,经常需要保持那些组织的分离。事实上,在几乎任何类型的手术之后都可能发生术后粘连,导致严重的手术后并发症。手术粘连的形成是复杂的炎性过程,其中在身体中正常保持分离的组织由于手术创伤而变得互相物理接触和彼此粘连。
据认为,损伤的组织流出的血和渗漏的血浆蛋白质沉积在腹腔中并形成所谓纤维素性渗出物时,形成粘连。修复受损伤组织的纤维蛋白是粘性的,因此纤维素性渗出物可以粘连腹中相邻的解剖结构。创伤后或持续的炎症放大了这个过程,因为纤维蛋白沉积是对局部炎症的统一宿主反应。在损伤后最初几天期间,因为纤维素性渗出物经历由纤溶因子、最显著的是组织型纤溶酶原激活物(t-PA)释放所引起的酶促降解,这种粘连似乎是可逆的。在t-PA和纤溶酶原激活物抑制剂之间有恒定的作用。手术创伤通常降低t-PA活性并增加纤溶酶原激活物抑制剂。当这种情况发生时,纤维素性渗出物中的纤维蛋白被胶原代替。血管开始形成,导致粘连发展。一旦发生这种情况,粘连被认为是不可逆的。因此,在创伤后最初几天期间纤维蛋白沉积和降解之间的平衡对于粘连的发展是关键的(Holmdahl L.Lancet 1999;353:1456-57)。如果可以保持或迅速恢复正常的纤溶活性,纤维性沉积物裂解并可以避免永久性粘连。粘连可以表现为薄的组织片或厚的纤维条带。
炎性反应也经常由体内的外来物质、例如植入的医疗装置引发。身体将这个植入物看成是异物,炎性反应是将所述异物隔离开的细胞反应。这种炎症可以引起与植入的装置形成粘连;因此需要引起的炎性反应小直至无的材料。
因此,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如独立膜)可以用作保持组织分离的屏障,以避免粘连例如手术粘连的形成。防止粘连的应用例子包括腹腔外科、脊椎修复、整形外科、肌腱和韧带修复、妇产科和盆腔外科、以及神经修复用途。基于脂肪酸的、预固化物衍生的生物材料(例如独立膜)可以敷在创伤部位上或包裹在组织或器官周围,以限制粘连形成。可以利用向用于这些防止粘连用途的基于脂肪酸的、预固化物衍生的生物材料添加治疗剂,来添加有益的效应,例如缓减疼痛或最小化感染。基于脂肪酸的、预固化物衍生的生物材料的其它外科用途可以包括使用独立膜作为硬膜贴片、支撑材料、内部伤口护理(例如移植物吻合部位)、以及内部药物递送系统。基于脂肪酸的、预固化物衍生的生物材料也可以用于透皮、伤口愈合和非外科领域的应用。基于脂肪酸的、预固化物衍生的生物材料可以用于外部伤口护理,例如治疗烧伤或皮肤溃疡。基于脂肪酸的、预固化物衍生的生物材料可以没有任何治疗剂,作为干净、不可渗透、不粘连、无炎性、抗炎的敷料使用,或基于脂肪酸的、预固化物衍生的生物材料可以和一种或多种治疗剂一起使用,以增加有益效应。当基于脂肪酸的、预固化物衍生的生物材料载有或涂覆有一种或多种治疗剂时,所述基于脂肪酸的、预固化物衍生的生物材料也可以用作透皮药物递送贴片。
伤口愈合的过程包括组织响应损伤进行修复,它包含许多不同的生物过程,包括上皮细胞生长和分化、纤维组织产生和发挥功能、血管生成和炎症。因此,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如独立膜)提供了适于伤口愈合应用的极好的材料。
受调愈合
本文还提供了适于在有需要的组织区域中达到受调愈合的基于脂肪酸的、预固化物衍生的生物材料,其中所述组合物以足以达到所述受调愈合的量施用。在一个实施方案中,基于脂肪酸的、预固化物衍生的生物材料是医疗装置用涂层或独立膜。在另一个实施方案中,用于生物材料的脂肪酸的来源是油,例如鱼油。
受调愈合可被描述为是在植入后观察到的体内效应,其中生物反应改变,导致异物反应明显减少。在本文运用时,短语“受调愈合”和这个措辞的变体一般是指调节(例如改变、延迟、妨碍、减少、阻止)响应局部组织损伤的过程,所述过程涉及天然发生的组织修复中的不同级联或顺序,从显著减少了它们的炎性效应。受调愈合包括许多不同的生物学过程,包括上皮细胞生长、纤维蛋白沉积、血小板活化和粘附、抑制、增殖和/或分化、结缔纤维组织产生与发挥作用、血管生成、和急性和/或慢性炎症的几个阶段、以及它们彼此的相互作用。例如,本文描述的脂肪酸可以改变、延迟、妨碍、减少、和/或阻止与医疗过程引起的血管损伤的愈合有关的一个或多个期,包括但不限于炎性期(例如血小板或纤维蛋白沉积)和增殖期。在一个实施方案中,“受调愈合”是指脂肪酸衍生生物材料改变组织愈合过程开始时显著的炎性期(例如血小板或纤维蛋白沉积)的能力。在本文使用时,短语“改变显著炎性期”是指脂肪酸衍生生物材料显著减少损伤部位的炎性反应的能力。在这样的情况中,可以响应组织损伤发生少量炎症,但与不存在脂肪酸衍生生物材料时发生的炎症相比,这个炎性反应、例如血小板和/或纤维蛋白沉积的水平显著降低。
例如,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如基于脂肪酸的、预固化物衍生的涂层,或基于脂肪酸的、预固化物衍生的独立膜)已经在动物模型中经试验显示出延迟或改变与血管损伤有关的炎性反应,以及组织损伤之后结缔纤维组织的过度形成。本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)可以延迟或减少血管损伤之后的纤维蛋白沉积和血小板与血液接触面的粘附。
因此,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)提供适合与外科器械或医疗装置一起使用的优异的可吸收细胞界面,产生受调愈合效应,在损伤后时间的受调或延迟时段,避免产生疤痕组织并促进健康组织的形成。不受理论制约,这个受调愈合效应可以归于调节(例如改变、延迟、妨碍、减少、阻止)与血管损伤的愈合过程有关的任何分子过程。例如,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如基于脂肪酸的、预固化物衍生的涂层,或基于脂肪酸的、预固化物衍生的独立膜)可以充当医疗装置植入物(例如外科用网片,移植物或支架)或外科器械、与构成血管壁的细胞和蛋白质例如血管内表面内衬的内皮细胞和平滑肌细胞之间的屏障层或阻挡层。该屏障层防止外科植入物和血管表面之间的相互作用,从而防止血管壁的细胞和蛋白质引发愈合过程。在这个方面,屏障层充当与血管壁结合并阻断血管壁的细胞和蛋白质识别手术植入物的贴片(即屏障层阻断细胞-装置和/或蛋白-装置相互作用),从而阻断血管愈合过程的启动,并避免纤维蛋白活化和沉积以及血小板活化和沉积。
在另一个非结合实施例中,受调愈合效应可以归于调节(例如改变、延迟、妨碍、减少、阻止)构成血管壁的细胞和蛋白质与原本将引发血管愈合过程的各种血流组分之间的信号传导。换句话说,在血管损伤部位,本发明的脂肪酸衍生生物材料(例如涂层或独立膜)可以调节血管壁的细胞例如内皮细胞和/或平滑肌细胞与原本将与损伤细胞相互作用来引发愈合过程的血液其它细胞和/或蛋白质的相互作用。另外,在血管损伤部位处,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)可以调节血管壁的蛋白质与血液的其它细胞和/或蛋白质的相互作用,从而调节愈合过程。
在另一个非结合实施例中,受调愈合效应可以归于调节(例如改变、延迟、妨碍、减少、阻止)构成血管壁的细胞和蛋白质与原本将引发血管愈合过程的各种血流组分之间的信号传导。换句话说,在血管损伤部位,本发明的脂肪酸衍生生物材料(例如涂层或独立膜)可以调节血管壁的细胞例如内皮细胞和/或平滑肌细胞与原本将与损伤细胞相互作用来引发愈合过程的血液其它细胞和/或蛋白质的相互作用。另外,在血管损伤部位处,本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)可以调节血管壁的蛋白质与血液的其它细胞和/或蛋白质的相互作用,从而调节愈合过程。
本发明的基于脂肪酸的、预固化物衍生的生物材料(例如涂层或独立膜)可被设计成在期望的时间段能保持它的完整性,然后开始水解并被包围它的组织吸收。或者,基于脂肪酸的、预固化物衍生的生物材料可被设计成使得在一定程度上,所述基于脂肪酸的、预固化物衍生的生物材料插入对象中后立即被周围组织吸收。取决于基于脂肪酸的、预固化物衍生的生物材料的配制,它可以在1天至24个月的时期内、例如1周至12个月、例如1个月至10个月、例如3个月至6个月之内,被周围的组织完全吸收。动物研究已经显示,脂肪酸衍生生物材料的再吸收在植入后发生,并持续3至6个月时期,以及更长。
定制药物释放模式
在不同的方面中,本发明提供了固化脂肪酸衍生涂层、优选鱼油的方法,以提供含一种或多种治疗剂并可以定制治疗剂从涂层或膜的释放模式的脂肪酸衍生的、预固化的生物材料涂层或独立膜。可以例如通过改变涂层组成、温度和固化时间而改变脂肪酸(例如油,如鱼油)的化学,来定制释放模式。覆层装置上含药层的位置提供了改变非聚合物的、交联的、脂肪酸衍生的、预固化的生物材料涂层的释放模式的附加机制。这可以例如通过将药物负载到固化的底涂层中,并在以前固化的包封型底层上涂上顶层覆盖固化涂层来实现。
本发明不同的实施方案中的固化鱼油涂层和独立膜的优点在于所使用的固化条件(即固化时间和温度)可以直接影响涂层交联密度和副产物形成的量,这进而影响涂层降解。因此,通过改变使用的固化条件,还可以改变涂层中包含的目的治疗化合物的溶出速率。
在本发明的不同的实施方案中,药剂、例如自由基清除剂,可被加入到起始材料中,以定制所形成的脂肪酸衍生的、预固化的生物材料的药物释放模式。在不同的实施方案中,维生素E被加入到起始材料中,其通过例如减少氢过氧化物形成而减慢鱼油的自氧化,可以引起固化的鱼油涂层中观察到的交联量降低。另外,其它药剂也可用于增加治疗剂在起始材料的油组分中的溶解度,防护药物在固化过程期间的降解,或用于二者目的。例如,维生素E还可以用来增加某些药物在鱼油起始材料中的溶解度,从而促进定制最终的固化涂层的药物载量。因此,改变涂层中存在的维生素E的量,提供了附加的机制来改变本发明的脂肪酸衍生的、预固化的生物材料(例如涂层和独立膜)的交联和化学组成。
在不同的实施方案中,本发明提供了涂层和独立膜,其中脂肪酸衍生的、预固化的生物材料的药物释放模式是通过提供两个或更多个涂层和选择治疗剂的位置而定制的。药物位置可以改变,例如通过用第一种起始材料涂布医疗装置的裸露部分并产生第一个固化涂层,然后用药物-油制剂涂布第一个固化涂层的至少一部分,产生第二个覆盖层涂层。第一种起始材料可以包含一种或多种治疗剂。在不同的实施方案中,第二个覆盖涂层也是固化的。第一个涂层、覆盖涂层或二者的药物载量、药物释放模式或二者,可以通过如本文所述使用不同的固化条件和/或添加自由基清除剂(例如维生素E)来定制。提供两个层的过程可以扩展至提供三个或更多个层,其中至少一个层包含从含脂肪酸的油例如鱼油制备的疏水性的、交联脂肪酸衍生的、预固化的生物材料。另外,一个或多个所述层可以是药物洗脱性的,这样的层的药物释放模式可以使用本文描述的方法来定制。
在不同的实施方案中,本发明提供了涂层,其中整体涂层的药物释放模式是通过提供具有不同的药物释放模式的两个或更多个涂层区域并选择治疗剂的位置而定制的。在不同的实施方案中,具有不同的药物释放性质的不同涂层区域的形成通过下列方法获得:位置特异性固化条件、例如位置特异性紫外线照射,和/或起始材料在涂层装置上的位置特异性沉积,例如通过喷墨印刷法。
涂层方法
图8示出根据本发明的一个实施方案制造本发明的医疗装置、例如药物洗脱型覆层支架的方法。过程包括提供医疗装置,例如支架(步骤100)。然后将起始材料——非聚合物的、交联脂肪酸衍生的、预固化的生物材料涂层施加到医疗装置上(步骤102)。本领域普通技术人员将领会,将涂层施加至医疗装置例如支架上的这种基本方法可以具有在所述过程范围内的许多不同的变化。在医疗装置上施加涂层物质以形成涂层的步骤可以包括许多不同的施加方法。例如,可以将医疗装置浸在涂层物质的液体溶液中。涂层物质可被喷涂至所述装置上。另一种施加方法是将涂层物质涂抹在医疗装置上。本领域普通技术人员将领会,可以利用其它方法、例如静电吸附将涂层物质施加至医疗装置。一些施加方法可能对涂层物质和/或接受所述覆层的医疗装置的结构是特定的。因此,本发明不局限于本文描述的施加起始材料的特定实施方案,而是打算一般性应用于将成为医疗装置的脂肪酸衍生的、预固化的生物材料涂层的起始材料的施加上,并要采取使得所产生的涂层保持希望的特征所必需的任何防范措施。
图9是流程图,示出了实行图8的方法的一个实例。根据图9中说明的步骤,提供了生物可吸收的载体组分(例如,脂肪酸来源,例如天然存在的油)(步骤110)。然后所述载体预固化(“部分固化”),以产生初始量的交联(步骤112)。生成的材料然后可以与治疗剂组合,以形成将要成为基于脂肪酸的、预固化物衍生的生物材料涂层的预固化的材料(步骤114)。将预固化的材料施加到医疗装置例如支架10上,以形成涂层(步骤116)。然后通过本文描述的任何固化方法进行涂层固化(步骤118),形成脂肪酸衍生的、预固化的生物材料涂层。
在某些情况下,想要并入脂肪酸衍生的生物材料涂层中的治疗剂对用来产生装置涂层的热/UV固化过程不稳定(例如,观察到有大量的药物降解)。为了保持治疗剂组成和使得治疗剂的降解最小化,可以首先在治疗剂不存在下部分地固化(“预固化”)脂肪酸起始材料(例如鱼油),以氧化油中的不饱和组分。这样的过程通过使油中的脂肪酸部分地交联,而增加了油的粘度和减少它的反应性,以供例如医疗装置涂层应用。然后治疗剂可以与预固化物在有机溶剂中组合,并被喷涂和/或浇铸在医疗装置上和/或作为独立膜材料,随后被加热形成最终的交联材料(即,基于脂肪酸的、预固化物衍生的涂层),用于它的预期应用。这个过程导致治疗剂掺入脂肪酸衍生的、预固化的生物材料中,以供药物从涂层延长释放。或者,在预固化物产生后,抗氧化剂例如维生素E可以与治疗剂和有机溶剂组合,用于施加到医疗装置上或产生独立膜。该涂层然后也终固化成脂肪酸衍生的、预固化的生物材料。同时抗氧化剂(例如维生素E)在终固化步骤期间被氧化,它防止治疗剂和油组分进一步氧化并且保护所述药物组成和活性。虽然抗氧化剂防止治疗剂和预固化的油组分进一步氧化,但它不抑制固化后在脂肪酸之间形成酯交联,因为在油起始材料的初始的热/紫外线固化处理期间,即产生预固化物期间,产生了生成脂肪酸衍生的、预固化的生物材料所需要的反应性的羧基和羟基官能团。
然后使用许多不同的灭菌过程,将涂层的医疗装置消毒(步骤118)。例如,消毒可以利用氧化乙烯、γγ辐射、电子束、蒸汽、气体等离子体或汽化过氧化氢来执行。本领域普通技术人员将领会,也可以运用其它消毒方法过程,本文列出的那些只是引起涂层支架的消毒、优选对涂层20没有不利影响的消毒过程的实例。
应该注意,可以多次添加脂肪酸组分(例如鱼油)以在涂层形成中产生多个层。例如,如果想要较厚的涂层,可以在步骤100、102、110、112、114、116、118和/或120后添加脂肪酸组分的附加连接层。在许多不同的工艺构造中,可能有与脂肪酸固化时和添加其它物质有关的不同变化。因此,本发明不局限于示出的具体顺序。相反,本发明预期了所示出的基本步骤的不同组合。
图10A-10E示出了上述的医疗装置与本发明的涂层10组合的一些其它形式。图10A显示了结合有或附有涂层10的移植物50。图10B显示了结合有或附有涂层10的导管球囊52。图10C显示结合有或附有涂层10的支架54。图10D示出了根据本发明的一个实施方案的支架10。支架10是适合在其上施加涂层来实现治疗结果的代表性医疗装置。支架10由一系列互连的支杆12形成,在支杆之间具有缝隙14。支架10一般是圆柱形状。因此,支架10保留了内表面16和外表面18。图10E示出覆层的外科用网片,根据本发明的一个实施方案表现为生物相容的网片结构10。生物相容的网片结构10是挠性的,挠性程度达到它可以在患者内以平面、弯曲、或卷起的构型放置。生物相容的网片结构10是可植入的,用于短期和长期应用。根据生物相容的网片结构10的具体配制,所述生物相容的网片结构10将在植入后存在数小时到数天的时间,或可能是数月,或永久地存在。
示出的各种医疗装置,以及没有专门示出或论述的其它医疗装置,还可以使用本文描述的方法或其变体与涂层10组合。因此,本发明不局限于所说明的范例性实施方案。相比之下,说明的实施方案只是实施本发明的例子。
在另一个实施方案中,本发明的生物材料,即预固化物生物材料、或基于脂肪酸的、预固化物衍生的生物材料可以使用乳液的形式。“乳液”,其作为一类悬浮液,是两种或更多种不溶混液体在非常不稳定的状态下的组合。虽然乳液可以是两种或更多种不溶混液体的组合,但为了清楚起见,假定只是两种液体的乳液,提供了下列解释。第一种液体分散或悬浮在第二种液体的连续相中。这可以被认为是在第二种液体的连续“池”中,遍布了第一种悬浮的液体的“液滴”。第一种液体可以包括任何数量的可溶混液体的混合物,第二种液体可以包括任何数量的可溶混液体的混合物,只要第一种液体的混合物相对于第二种液体的混合物不混溶即可。本领域普通技术人员将领会,乳液可以使用三种或更多种不溶混液体的组合来配制,虽然本文没有进一步描述这样的实施方案,但它们被认为属于本发明的范围。
利用下列实施例,进一步描述了本发明不同的方面和实施方案。提供实施例作为说明,而不是作为限制。
实施例
下列实施例表征本文描述的新的脂肪酸衍生生物材料的化学,并说明与形成和如何改变影响最终产物的性质(例如治疗效益和/或药物释放模式)的那些机制的化学机制有关的一些界限。一些水解产物的身份是通过体外实验鉴定的,并与体内实验相关联,证明涂层或独立膜被生物吸收的能力。最后,介绍了显示本文描述的脂肪酸衍生生物材料在冠状动脉支架和疝气网片装置上药物递送应用中的实用性的实施例。
下列实施例是用于论证的目的,不是意味着限制。
实施例1:分析来源于鱼油的新生物材料在0.1M PBS溶液中的体外水解化学
在下面实施例中,覆层的医疗装置(例如聚丙烯网片)在高气流烘箱中在200°F下固化24小时,然后通过在鱼油中存在的C=C键的氧化,导致形成氧化副产物(即烃、醛、酮、甘油酯、脂肪酸),同时很大程度上保留来源于原料油甘油三酯的酯,从而将鱼油转变成包封聚丙烯网片的交联生物材料涂层。副产物挥发后形成的酯交联和内酯交联,引起油固化成生物可吸收的疏水性交联生物材料。使用0.1M PBS溶液研究涂层缓慢水解的能力。油衍生的生物材料在PBS中水解30天后,使用GC-FID脂肪酸谱和GPC色谱测量值分析所述PBS溶液。
图11归纳了干燥PBS溶液并然后按照AOCS官方的方法Ce l-89b所述执行GC-FID脂肪酸谱分析以鉴定溶液中存在的脂肪酸之后,获得的脂肪酸谱结果。图11显示从PBS溶液鉴定的脂肪酸与从涂层本身检测到的脂肪酸相同。对水解溶液还实施了GPC分析,结果概括在表5中。GPC结果显示,鉴定到的绝大多数组分的分子量(80%)低于分子量500,这与涂层的脂肪酸组分一致。此外,可以鉴定涂层的甘油酯组分的分子量在1000左右(涂层的15%)。GPC结果还显示,高分子量凝胶的量可忽略不计(大约4%)。GPC结果支持对油衍生的涂层的其它分析性表征实验,该实验显示,油衍生的生物材料包含交联甘油酯和脂肪酸,而且大部分涂层是非聚合物的(即,鉴定的组分有大约80%具有小于500的分子量)。
实施例2:载有治疗剂并被施加到金属支架上的基于脂肪酸的、预固化物衍生的涂层
在本发明的这个具体实施方案中,介绍了载有治疗剂并被施加到心脏支架上的固化油涂层的应用。图13概括了介绍在支架上产生载有治疗剂的固化涂层的过程的流程图。简要而言,在反应容器中,在200°F和氧的存在下边加热边搅拌20小时,产生预固化的鱼油涂层。该涂层与目的治疗剂和有溶剂的维生素E混合,然后被喷涂至支架上产生涂层。通过在200°F加热7小时将涂层退火至支架表面上,以产生均匀涂层。带有典型抗炎药剂的涂层显示出,利用从装置提取的药物进行HPLC分析确定,该过程在固化后可以回收到90%的药物。图14显示了该涂层在0.01M PBS缓冲液中长达20天的药物释放曲线,利用该过程回收的药物有超过90%的回收率。
实施例3:基于脂肪酸的、预固化物衍生的涂层的受控释放
对3批16mm不锈钢支架的药物释放进行定量,支架包被有化合物C药物涂层制剂,该制剂由60%化合物C、30%预固化的鱼油、10%生育酚组成。预固化的鱼油使用鱼油在93℃预固化产生,预固化物的粘度在22℃测量达到1.3X105cps。将所述涂层通过喷涂施加到16mm Atrium Flyer不锈钢支架的表面上,实现每支架大约100μg化合物C的总支架药物载量。将覆层支架进行第二个热固化过程,从而使涂层在烘箱中在93℃后固化7.5小时的时段。在含有0.01M纯化的缓冲盐水(PBS)的4ml溶液中,在37℃温度下进行溶出。
使用HPLC法定量测量化合物C药物覆层支架的体外药物溶出。药物释放模式数据显示在图15中,其说明药物从化合物C药物涂层的释放延长遍及20天的时段,而且释放模式在批与批之间是可再现的。
实施例4:裸金属、涂层支架和药物覆层支架的跟踪力(trackability force)
定量测量了安装在球囊导管上的3.0mm X 13mm CoCr支架装置的跟踪力。定量测量了3个不同的支架涂层组的跟踪力:裸金属CoCr支架,包被有75%预固化鱼油、25%生育酚涂层的CoCr支架,和包被有60%化合物B、22.5%预固化鱼油、12.5%生育酚涂层的CoCr支架。使用鱼油在93℃预固化产生预固化鱼油,获得在22℃测量达到1.0×106cps的预固化物粘度。将75%预固化鱼油与25%生育酚在MTBE溶剂中溶解来制备脂肪酸衍生的预固化的生物材料,获得1%固体制剂。将所述制剂以3000RPM涡旋1分钟。然后将所述制剂通过喷雾法施加到支架上,达到大约167μg的总支架涂布重量。将覆层支架在93℃进行热式后固化6小时。在后固化过程之后,将支架压接到球囊导管上,使用12点压接仪施加16至22psi的压缩载荷,获得大约0.04英寸的支架剖面尺寸。将75%预固化鱼油与25%生育酚在MTBE溶剂中溶解,来制备化合物B、预固化鱼油、生育酚制剂,获得25%固体制剂。在合适的小玻璃管中称出一定量的化合物B,将一定体积的预固化鱼油和生育酚制剂添加到小玻璃管中,获得60%化合物B、40%预固化鱼油-生育酚比率。向小玻璃管添加额外的MTBE,达到1%的总固体比率。将制剂在3000rpm涡旋1分钟。然后将制剂通过喷雾法施加到支架上,获得大约167μg的总支架涂布重量。将覆层支架在93℃进行热式后固化6小时。后固化过程之后,将支架压接到球囊导管上,获得大约0.04英寸的支架剖面尺寸。然后将带有安装在球囊段上的支架的导管用线穿过6Fr Medtronic Launcher引导导管,插入由解剖模型构成的曲折(torturous)路径内,该路径包含半径为22mm和14mm的2个弯曲,总的设置行进距离为395mm。使用去离子水作为测试环境。通过用于驱动导管向前的机构上的测压元件测量力。
跟踪力数据显示在图16中。该数据表明,推动掺有含生育酚、化合物B和预固化鱼油的脂肪酸衍生的预固化生物材料涂层所需要的跟踪力,与裸金属支架相比整体较低,提示所述涂层显著减少了支架表面的摩擦系数、和随后球囊导管在引导导管内通过曲折途径前进的过程期间支架与引导导管壁之间的摩擦力。
实施例5:后固化时间和温度对力学性质的影响
后固化时间和温度对涂层机械性质的影响在支架用油衍生的预固化生物材料涂层包被的研究中评价,所述涂层是化合物B/预固化鱼油/生育酚。CoCr支架预先用丙酮清洁,并包被60%化合物B、30%预固化鱼油、10%生育酚的制剂。将75%预固化鱼油与25%生育酚在MTBE溶剂中溶解,来制备化合物B、预固化鱼油、生育酚制剂,获得25%固体制剂。在合适的小玻璃管中称出一定量的化合物B,将一定体积的预固化鱼油和生育酚制剂添加到小玻璃管中,获得60%化合物B、40%预固化鱼油-生育酚比率。向小玻璃管添加额外的MTBE,达到1%的总固体比率。将制剂在3000rpm涡旋1分钟。然后将制剂通过喷雾法施加到支架上,获得大约167μg的总支架涂布重量。然后将覆层支架在60℃至100℃的温度范围内进行热式后固化。
后固化过程之后,使用12点压接仪器将支架压接到球囊导管上,需要16至22psi的压接力,获得大约0.043英寸的支架剖面尺寸。随后,将球囊导管在空气中充气到9个大气压的标称充气压力。在压接和膨胀之后,视觉评价药物涂层的物理损坏。该测试结果证明,支架在超过80℃的温度下进行后固化显示出在压接和随后的膨胀之后,涂层的损坏比在80℃以下进行后固化的支架显著减少,证明通过改变涂层后固化时的温度来改变涂层的最终交联密度,可以明显改变涂层的机械性质。
实施例6:固化时间和温度对热敏感性药物的药物回收率的影响
评价和定量测量固化时间和温度对疏水性交联凝胶涂层内掺入的热敏感性药物的药物回收率的影响。在反应器中93℃加热鱼油总共26小时,同时通过扩散器输入氧,制备预固化的鱼油(PCFO)。产生的预固化鱼油的粘度在22℃测量是5x106cps。如下制作由60%化合物B、30%PCFO和10%维生素E组成的制剂:将3.76g PCFO和1.3g维生素E组合,形成75%PCFO、25%维生素E的底涂料。添加15.04g甲基叔丁基醚(MTBE),生产75%溶剂、25%固体的底涂料。将该溶液涡旋30分钟直至澄清。接着,将529mg底涂料溶液添加至198.8mg化合物B中。用32.8g甲基叔丁基醚(MTBE)稀释该混合物,生产1.0%固体的最终溶液用于喷涂。CoCr支架(3.0x13mm)使用超声喷雾系统(SonoTek,Inc.)喷涂,化合物B的目标载量是l00μg。每个覆层支架在涂层之前和涂层后称重,从重量分析确定施加到每个支架的涂层的实际重量。将覆层支架在60℃至100℃的温度范围内在烘箱进行后固化,后固化时间从0小时至24小时。后固化之后,药物涂层在100%乙腈溶液中提取,并通过HPLC分析,以确定溶液中的药物浓度,从中确定从支架提取的总药物质量。从支架提取的总药物质量连同重量分析确定的支架上的实际涂层重量一起,用来计算被施加到支架上的在后固化过程之后被回收的药物在涂层中的百分比。药物百分比回收率数据显示在图18中。该数据说明,药物在喷涂至支架后和后固化之前被100%回收。但是,随着后固化和后固化时间增加,药物回收率下降。数据还显示,药物回收率随着时间下降的速度直接受到进行后固化时的温度的影响。
实施例6A:通过粘度测量固化时间对预固化鱼油的交联密度的影响
评价和定量测量固化时间对预固化鱼油粘度的影响。在反应器中在93℃加热鱼油(Ocean Nutrition 18/12TG鱼油)总共33小时,同时通过扩散器输入氧,制备预固化鱼油(PCFO)。该反应期间,发生油的氧化和形成交联。反应的持续时间直接影响发生的氧化和交联的程度,并导致反应期间油的粘度随着时间增加。因此,预固化鱼油的最终粘度能够与交联和氧化的程度相关。鱼油在93℃与氧反应23小时、26小时、30.5小时和33小时。粘度在22℃测量。结果(图19)显示,粘度的增加与较长的反应时间对应,因此间接证实了与较高粘度相关联的交联密度的增加,也随着固化时间而增加。
实施例7:使用治疗剂化合物C在支架上产生基于脂肪酸的、预固化物衍生的涂层的方法
在反应器中在93℃加热鱼油(Ocean Nutrition 18/12TG鱼油)共23小时,同时通过扩散器输入氧,制备预固化的鱼油(PCFO)。所得到的预固化鱼油的粘度在22℃测量为1×106cps。将3.7561g PCFO和1.2567g维生素E(DSM Nutritional Products)组合,形成75%PCFO、25%维生素E底涂料,制备由70%化合物、22.5%PCFO和7.5%维生素E组成的化合物C药物涂料制剂。添加15.04g甲基叔丁基醚(MTBE),生产75%溶剂、25%固体的底涂料溶液。将该溶液涡旋30分钟直至澄清。接着,将767.6mg底涂料溶液添加至447.8mg化合物C中。用7.84g甲基叔丁基醚(MTBE)稀释该混合物,生产7.6%固体的最终溶液用于喷涂。Atrium CinatraTM CoCr支架(3.5x13mm)使用装备有中号针头的Badger喷枪进行喷涂。目标涂层载量是每支架100μg化合物C。使用30psi的气压,同时旋转支架,将每个支架喷涂1.5秒。这产生了化合物C的平均涂层载量为95.2μg。覆层支架在烘箱中在93℃固化7小时。该过程产生当使用扫描电子显微术(SEM)成像时,具有平滑表面特征的共形支架涂层。图20A是化合物C药物覆层支架在93℃后固化7小时后,在50X放大倍数下的SEM。
实施例8:使用治疗剂化合物B在支架上产生基于脂肪酸的、预固化物衍生的涂层的方法
在反应器中在93℃加热鱼油(Ocean Nutrition 18/12TG鱼油)共23小时,同时通过扩散器输入氧,制备预固化的鱼油(PCFO)。所得到的预固化鱼油的粘度为1×106cps。将3.7582g PCFO和1.2562g维生素E(DSM Nutritional Products)组合,形成75%PCFO、25%维生素E的底涂料,制作由60%化合物B、30%PCFO和10%维生素E组成的制剂。添加15.04g甲基叔丁基醚(MTBE),生产75%溶剂、25%固体的底涂料。将该溶液涡旋30分钟直至澄清。接着,将529mg底涂料溶液添加至198.8mg化合物B中。用32.8g甲基叔丁基醚(MTBE)稀释该混合物,生产1.0%固体的最终溶液用于喷涂。CoCr支架(3.0x 13mm)使用超声喷雾系统(SonoTek,Inc.)喷涂,化合物B的目标载量是l00μg。覆层支架在烘箱中在93℃固化6小时。该过程产生当使用扫描电子显微术(SEM)成像时,具有平滑表面特征的共形支架涂层。图20B是化合物B药物覆层支架在93℃后固化6小时后,在50X放大倍数下的SEM。
实施例9:基于脂肪酸的、预固化物衍生的支架涂层过程对单独的制剂组分的化学影响的模拟
在终固化之前和之后研究每个单独的制剂组分(即,预固化鱼油、维生素E和化合物B),以了解所述过程对化合物B油衍生的预固化生物材料涂层的化学的影响。在这组实验中,每个单独组分都在甲基叔丁基醚(MBTE)中稀释后被喷涂至试样片上,以模拟覆层支架。在200°F下终固化六小时之前和之后,使用适当的分光镜和色谱技术分析各组分。
图21A、21B和21C呈现了将预固化鱼油溶解在MTBE溶剂中并喷涂至不锈钢试样片上,在终固化之前和之后使用FTIR分析的影响。预固化鱼油在固化之前和之后的FTIR分析揭示,油中双键被氧化并从小时固化过程引起内酯/酯交联形成。氧化是通过OH谱带吸收增加以及顺式和反式C=C峰降低(图21A和21C)证明的,羰基峰变宽表明形成了羰基副产物(图21B)。终固化物中交联的证据是通过内酯/酯峰吸收谱带增大(图21B)观察到的。试样片的GC脂肪酸谱分析也符合终固化过程之前和之后油的氧化。图22呈现了被喷涂至试样片上的预固化鱼油在固化过程之前和之后的脂肪酸组成谱。GC脂肪酸谱结果显示,谱中的变化显示终固化后不饱和脂肪酸减少和饱和脂肪酸增加(图22),这符合不饱和脂肪酸的氧化。这个结果也被反映在预固化和后固化GC色谱中,其中C16:1和C18:1不饱和脂肪酸峰在色谱中降低(图23)。
将维生素E溶解在MTBE中并喷涂至试样片上,在有和没有终固化的情况下的FTIR光谱呈现在图24A、24B和24C中。FTIR结果显示,终固化过程导致氧化,其依据是在1800-1600cm-1处形成峰(图24C)。这个结果进一步得到终固化步骤后酚OH吸收谱带消失的支持(图24B),其在维生素E的氧化后出现。涂在试样片上的维生素E在固化之前和之后从试样片上被提取,并通过HPLC进行分析(表8)。每个测试提供三个样品的平均值。该研究的结果显示,当固化(即氧化)维生素E时,回收率降至81%。图25A、25B和25C呈现了维生素E对照与被喷涂至试样片上的维生素E在固化之前和之后在292nm处重叠的HPLC色谱。
图26A、26B和26C呈现了化合物B药物粉末在喷涂至试样片上后在固化之前和之后的FTIR分析。FTIR揭示,与对照药物能谱相比,将化合物B溶解在MBTE溶剂中并喷涂至试样片上,改变了药物结构的构象。具体地说,FTIR结果显示,喷涂过程之后,酰胺谱带向左移动,与化合物B粉末对照(图26B)相比,表明峰分裂的开始迹象。这看来与指纹区中~1375cm-1处的峰有关,该峰与对照样品相比形状改变(图26C,峰1)。还在~1280cm-1处形成了对照样品中不存在的峰(图26C,峰2)。在化合物B样品固化之后,可以注意到几个其它的光谱改变。羟基谱带从两个峰合并成一个峰(图26B)。这个峰比化合物B粉末对照明显更宽(图26B)。此外,在固化过程之后,~1025cm-1处的C-O峰消失。这些改变表明化合物B由于固化而发生结构改变。在大约990cm-1处的反式C=C三烯峰发生改变,它的强度在固化后大幅降低(图26C),表明化合物B发生氧化。这些改变表明化合物B结构中有结构变化。
通过HPLC测定化合物B药物载量揭示,将化合物B喷涂至试样片上之前和之后、终固化之前的化合物B回收率相等。检查原样色谱(图27B)后,在喷涂后没有显出任何显著的降解产物形成。(图27A是对照。)但是,固化过程之后,化合物B药物粉末回收率降至大约9%(表9),通过HPLC检测形成了几个新的副产物峰(图27C)。这些结果与图26C呈现的FTIR数据一致,表明化合物B在终固化过程后发生了降解。
总之,这些研究显示,油衍生生物材料涂层中单独固化的每个组分在固化过程期间均被氧化,特别是不在油衍生支架涂层制剂中的化合物B治疗性化合物因固化过程而被明显降解。这证明了根据本发明,本文描述的预固化过程的保护性质。
实施例10:组合并被喷涂至试样片上的化合物B的基于脂肪酸的预固化物衍生的涂层制剂组分的分析
在这个系列的实验中,研究了化合物B的油衍生的、预固化的生物材料涂层中每个组分的化学改变。将组分混合在一起,喷涂至试样片上,并经受支架涂层制造过程的不同阶段。在30%预固化鱼油和10%维生素E中的60%化合物B被溶解在MTBE中并被喷涂至试样片上。在93℃终固化6小时之前和之后分析样品。在涂层上执行FTIR、HPLC和GC分析。图28A、28B和28C呈现了化合物B的油衍生的、预固化的生物材料涂层在终固化之前和之后的FTIR光谱。有趣的是,终固化后光谱的光谱改变很少,特别是被归属于化合物B治疗性化合物的官能团。特别是反式C=C谱带没有明显的强度改变,并且在FTIR指纹区的结构中没有显出任何显著的变化(图28C)。化合物B生物材料涂层在加热后的最大差异是在大约1780cm-1的吸收增加,这符合固化的鱼油组分中的内酯/酯交联,并且鱼油本身在固化后也观察到这种现象(图21B)。这些结果与化合物B粉末单独获得的在终固化后出现显著结构改变的那些结果形成对比(图26),表明化合物B被混合在油衍生生物材料制剂中在化学上更加稳定。
通过表10提供的化合物B的HPLC测定结果,显示了化合物B中的药物结构得到保存的进一步证据。制剂中化合物B的平均回收率在试样片上是大约62%,而它单独作为药物粉末存在时仅仅是大约9%。但是,涂层中的平均维生素E回收率趋势从它单独时在终固化后的81%下降至在制剂中时的68%。对来自基于脂肪酸的、预固化物衍生的涂层制剂的化合物B的HPLC色谱的分析表明,与单独的药物结果相比,药物降解大幅降低(图27C对比图29B)。
化合物B的油衍生生物材料制剂在终固化之前和之后的GC脂肪酸组成分析揭示,与单独固化相比,鱼油在制剂中时脂肪酸氧化显著减少(图23对比图30)。因为维生素E是抗氧化剂(即氧化速率比鱼油快),这个结果不出乎意料。在终固化之前和之后的原样GC色谱中,也观察到对油组分中的不饱和脂肪酸的氧化的抑制(图12)。
实施例11:化合物B的基于脂肪酸的、预固化物衍生的涂层使用FTIR的原位动力学分析,和HPLC分析
在这个试验中,为了将实施例3和4的模型试样片实验与化合物B的油衍生生物材料支架涂层方法相关联,将在30%预固化鱼油和维生素E中的60%化合物B溶解在MTBE中并喷涂至3.5x13mm钴铬支架上。将覆层支架放入烘箱中,在200°F固化,在6小时固化过程的每个小时取出样品。在每个时间点执行FTIR光谱分析。在T=0小时、3小时和6小时的固化点执行化合物B和维生素E的HPLC测定检验。
在不同时间点执行的FTIR分析(图31A、31B和31C)揭示了与化合物B的油衍生制剂在试样片上获得的最终化学趋势(图28)类似。具体地说,在吸收谱带中可以注意到只有小的移位,但注意到与化合物B药物粉末的FTIR试样片实验相比,化合物B的结构没有极大损失(图26对比图31)。图17呈现了在支架样品上在T=0小时、3小时和6小时处执行的化合物B的HPLC测定检验。化合物B显示,作为固化时间的函数的回收率降低,化合物B的终固化回收率由于药物的氧化平均为75%,但是氧化程度远低于单独经受加热的化合物B药物粉末,后者仅仅产生9%的回收率。维生素E测定结果的趋势与化合物B类似,其中作为时间的函数的回收率降低,获得的最终回收率是69%。
实施例12:基于脂肪酸的、预固化物衍生的支架涂层形成机制的总结
从实施例11-13执行的实验中,可以从数据得到几个结论,来阐明化合物B的油衍生的、预固化的生物材料支架涂层的形成化学。在实施例11中,每个制剂组分在MTBE中被喷涂至试样片上,然后在试样片表面上后固化,以便确定每个组分在所述过程中的化学改变。仅仅分析试样片的预固化鱼油揭示了,终固化进一步氧化了存在的双键,因为没有保留顺式C=C键。检测到了额外的内酯交联和羰基副产物形成。在固化之前和之后仅对试样片的预固化鱼油进行的GC脂肪酸谱分析也符合鱼油脂肪酸双键的氧化。仅对试样片的维生素E进行的FTIR分析也确定了终固化过程导致维生素E氧化。这通过在羰基吸收区域形成维生素E副产物峰和酚OH吸收谱带的消失来证明。通过HPLC测定证实了氧化,其显示终固化后维生素E回收率损失了20%。最后,对喷涂至试样片上的化合物B药物粉末的检验显示,当与对照粉末光谱相比时,将药物溶解在溶剂中并喷涂至试样片上,改变了化合物B的结构(即酰胺吸收谱带发生移位)。终固化后,通过FTIR的几个吸收模式改变证明了,化合物B药物粉末的化学结构明显改变,通过HPLC测定获得化合物B的回收率仅为9%,HPLC色谱中存在指示降解的副产物峰。虽然这些研究的结果清楚显示了维生素E、预固化鱼油和化合物B药物粉末组分通过终固化过程的氧化,但这些结果提示,当混合在一起然后进行终固化过程时,在制剂组分(即维生素E和预固化鱼油)之间有额外的相互作用,因为典型的化合物B的HPLC测定产生来自油衍生支架的化合物B的回收率在75-85%之间。
在第二组实验中,化合物B、预固化鱼油和维生素E在MTBE中混合,并被喷涂至试样片上,并在最终的后固化处理步骤之前和之后分析样品。这些数据揭示,FTIR光谱证明了药物结构的保存显著增加,HPLC测定确定了药物从涂层的回收率更大(即~62%)。化合物B的副产物峰仍然通过HPLC检测,但强度比当药物单独受到最终的后固化过程时小得多。通过GC脂肪酸组成分析的检测,预固化的鱼油,当与维生素E一起配制时,与不用维生素E的预固化鱼油相比,显示出制剂中的氧化减少(图23对比图12)。但是仍然观察到内酯/酯交联。
总之,从支架获得的结果除了化合物B的平均回收率增加至75%以外,均反映出从试样片制剂研究获得的结果。
根据在此研究中实施的实验,可以获得几个结论。喷涂后,施加到支架上的涂层显得不均匀,并且加热后所述涂层铺满支架的表面,预固化的鱼油发生交联,产生均匀涂层。化合物B从制剂的回收率明显大于分析单独的化合物B时获得的回收率(9%),显示制剂(即维生素E)提供了一定的保护药物稳定性的能力。
使用FTIR和HPLC检验对制剂中维生素E的分析显示,它由于终固化过程而被氧化,但通过GC脂肪酸谱的检测表明,预固化鱼油的氧化较少。与化合物B分析数据相似,这个结果表明维生素E在氧化过程期间提供了对油的保护。但是,尽管存在维生素E,终固化后仍然可以检测到试样片上的制剂中的鱼油组分的内酯/酯交联。因为用于制剂的鱼油在使用之前被预固化,在油衍生生物材料涂层中仍然可以发生内酯/酯交联。鱼油的部分固化导致形成内酯/酯交联所需要的羧基和羟基官能团,因此终固化步骤中存在维生素E仅起到减少额外氧化的作用,但不能逆转预固化油中已经形成的氧化或分子物质。
可以看出,通过例如保存治疗剂的结构,治疗剂当从涂层释放时,将具有增强的释放模式。
实施例13:使用化合物E在支架上产生基于脂肪酸的、预固化物衍生的涂层的方法
在反应器中在93℃加热鱼油共23小时,同时通过扩散器输入氧,制备预固化的鱼油(PCFO)。生成的预固化鱼油的粘度是1×106cps。将18.5mg PCFO、6.4mg维生素E、57.9mg化合物E和8.20g甲基叔丁基醚(MTBE)(Sigma Chemicals)组合,制备由70%化合物E、22.5%PCFO和7.5%维生素E组成的涂层制剂,产生具有99%溶剂、1%固体的涂料溶液用于喷涂。将该溶液涡旋30分钟直至澄清。使用SonoTek Medicoat DES 1000超声喷雾系统,喷涂Atrium CinatraTM CoCr支架(3.5x13mm)。目标涂层载量是每一支架100μg化合物E,实际涂层重量是133.28μg,基于计算出的涂层中最终药物分数,得到计算的药物载量是93.2μg。覆层支架在烘箱中在93℃固化6小时。这个过程产生干燥、不发粘的共形支架涂层,使用扫描电子显微术(SEM)成像时,具有平滑表面的特征。
在相关的但单独的试验中,将20μL上面描述的同样的药物涂层制剂移液到钴铬试样片上,目标药物载量为100μg化合物E。覆层的试样片在烘箱中在93℃后固化6小时。覆层试样片在最终的6小时后固化过程之后的重力测量证明,根据计算的药物分数69.92%化合物E,平均涂层载量152.603μg产生每一试样片的化合物E的平均药物载量为106.7μg。后固化之后,在100%乙腈溶液中从试样片提取药物涂层,并通过HPLC分析,以确定溶液中的药物浓度,从中确定从试样片提取的总药物质量。从试样片提取的总药物质量连同重量分析确定的支架上的实际涂层重量一起,用来计算被施加到试样片上的在后固化过程之后被回收的药物在涂层中的百分比。经计算,从CoCr试样片上在93℃固化6小时的涂层的药物回收百分率为96.7%。药物回收数据清楚显示,药物通过涂层制剂、施加和最重要的热式后固化过程时的完整性得以保持。
实施例14:使用治疗剂化合物D在支架上产生基于脂肪酸的、预固化物衍生的涂层的方法
在反应器中在93℃加热鱼油共23小时,同时通过扩散器输入氧,制备预固化的鱼油(PCFO)。生成的预固化鱼油的粘度是1×106cps。将55.4mg PCFO、18.5mg维生素E、74.3mg化合物D、和由60%甲基叔丁基醚(MTBE)、40%丙酮组成的14.67g溶剂溶液组合,制备由50%化合物D、37.5%PCFO和12.5%维生素E组成的化合物D药物涂层制剂,产生具有99%溶剂、1%固体的涂料溶液用于喷涂。将该溶液涡旋30分钟直至澄清。使用SonoTek Medicoat DES 1000超声喷雾系统,喷涂Atrium CinatraTM CoCr支架(3.5x13mm)。目标涂布载量是每一支架100μg化合物E,实际涂布重量是164.16μg,基于计算出的涂层中最终药物分数,得到计算的药物载量是82.3μg。覆层支架在烘箱中在93℃固化6小时。这个过程产生干燥、不发粘的共形支架涂层,使用扫描电子显微术(SEM)成像时,具有平滑表面的特征。
在相关的但单独的试验中,将40μL上面描述的同样的药物涂层制剂移液到钴铬试样片上,目标药物载量为100μg西罗莫司药物。覆层的试样片在烘箱中在93℃后固化6小时。覆层试样片在最终的6小时后固化过程之后的重力测量证明,根据计算的药物分数即50.13%西罗莫司的平均涂层载量305.59μg产生每一试样片的西罗莫司平均药物司载量为153.1μg。后固化之后,在80%乙腈、20%(0.2%乙酸)溶液中从试样片提取药物涂层,并通过HPLC分析,以确定溶液中的药物浓度,从中确定从试样片提取的总药物质量。从试样片提取的总药物质量连同重量分析确定的支架上的实际涂层重量一起,用来计算被施加到试样片上的在后固化过程之后被回收的药物在涂层中的百分比。经计算,从CoCr试样片上在93℃固化6小时的涂层的药物回收百分率为71.5%。药物回收数据清楚显示,药物通过涂层制剂、施加和最重要的热式后固化过程时的完整性得到保持。虽然在这个实施例中西罗莫司的药物回收率小于100%,但该回收率远好于除去鱼油预固化步骤和在包含药物的最终涂层中进行所有涂层固化时获得的接近零的回收率。
实施例15:被掺入治疗剂的、基于交联脂肪酸的涂层包被的冠状动脉支架的体内性能和生物反应
在这个研究中,使用在25℃测量时粘度为1×105cps的预固化鱼油,制备含50%化合物D、37.5%预固化鱼油和12.5%生育酚的涂层制剂。随后使用装备有中号针头的Badger喷枪,将所述涂层制剂喷涂至3.0mm x 13mm和3.5mm x 13mm Atrium Cinatra CoCr支架上。将涂层喷涂施加至支架之后,将覆层的支架在烘箱中在93℃后固化6小时,以获得均匀的和共形的药物涂层。每一支架最终的药物载量通过HPLC测量,为68μg的化合物D。后固化之后,将覆层的支架分别压接到3.0mm x 14mm和3.5mm x 14mm PTCA导管上,随后包装所述装置并通过用标称剂量35kgy的电子束灭菌进行消毒。无菌的涂有药物的支架装置然后用于在猪模型中进行临床前研究,其中在猪心脏的三根冠状血管:左前降支动脉(LAD)、左旋动脉支(LCX)和右冠状动脉(RCA)中各植入一个支架。植入三组支架:1)裸金属支架,2)只有涂层的支架(没有药物)和3)涂有药物的支架(DCS),评价它们的比较生物反应。植入全部支架,适当扩开,以获得支架-血管直径比为1.10:1。植入后,动物进行恢复和保养28±2天,此时处死动物,获得心脏,固定在福尔马林中。固定之后,从心脏分离和剖出放支架的血管。剖出放支架的动脉,包埋在甲基丙烯酸甲酯中用于切片和组织病理学评价。切片取自每个支架的近端部分、中间部分和远端部分。图32中的图像是一组具有BMS支架的代表性血管横截面。另一组是只有涂层(没有药物)的支架的代表性血管横截面。还有一组是具有DCS支架的代表性血管横截面。从这些比较性图像可以看出,除DCS中发现纤维蛋白水平较高(下面讨论)之外,三组之间在整体组织反应上没有显著的差异。本研究的一部分是评价组织形态计量学和组织病理学的全面的和定量的分析,具体是所有三组的平均损伤计分、平均内膜炎症、平均直径狭窄百分比、平均纤维蛋白计分和内皮化%的结果,结果列于表11中。从表11中可以看出,三组间的平均损伤计分非常类似(没有统计差异),表明组之间在支架植入期间引起的机械血管损伤的水平方面没有显著差异。一般而言,损伤计分小于1被认为是低的。与损伤计分相似,平均内膜炎症计分在所有组间相似(没有统计差异),表明与只有涂层(没有药物)和DCS相关的炎症与根本没有涂层的支架相同。直径狭窄%平均值数据表明组之间的细胞增殖没有显著差异,在第28天的时间点处,所有组显示低的总体直径狭窄%。不同的实验组之间这种细胞增殖水平不出乎意料,因为在支架植入过程期间,1.10:1的过度拉伸引起相对低的损伤。平均纤维蛋白计分,其作为药物的生物反应指标,清楚显示了BMS组和仅有涂层的组具有类似的低纤维蛋白计分,而DCS组的纤维蛋白计分明显高,表明药物已经有效被递送至放支架的局部血管段,证明了对化合物D有明显的生物反应。这种反应与用含有化合物D或具有类似作用机制的类似物的其它商业支架产品观察到的反应一致。最后,内皮化百分比表明支架和放支架的血管段为被单层内皮所覆盖的程度(单层内皮是正常发挥功能的动脉血管中存在的最内膜的细胞/组织层,对于防止血栓形成至关重要)。内皮化数据显示,所有三个组之间放支架的血管段基本100%再内皮化,表明底涂层和药物涂层均不干扰内皮愈合过程。
鉴于以上描述,本发明的众多更改和替换方案对本领域技术人员而言是显而易见的。因此,该描述应仅仅解释为说明性的,并且出于教授本领域技术人员的目的,是实行本发明的最佳方式。结构的细节可以在不背离发明的精神的情况下作出显著改变,并且保留对归入权利要求书范围之内的所有更改的专属使用。目的是本发明只在权利要求书和适用的法律规则要求的程度上受到限制。
本申请援引的全部文献和类似的材料,包括专利、专利申请、论文、书籍、论著、专题和网页,不管这样的文献和类似的材料的形式如何,均明确地以它们的全文引入作为参考。在一个或多个引入的文献和类似的材料,包括定义的术语、术语用法、描述的技术等等,与
本申请不同或抵触的情况下,以本申请为准。
本文使用的章节题头仅仅是为了组织的目的,不应以任何方式解释为限制所描述的主题。
虽然本发明已经结合不同的实施方案和实施例进行了描述,但并没有打算本讲授内容限于这样的实施方案或实施例。恰恰相反,正如本领域的技术人员所领会的,本发明包括不同的替换物、更改和等价物。
权利要求不应该当作限于所描述的顺序或要素,除非说明是那个意思。应该理解,可以不背离权利要求书的范围作出形式和细节的各种改变。因此,请求保护归于权利要求书及其等价物的范围和精神内的全部实施方案。
- 还没有人留言评论。精彩留言会获得点赞!