红芪或红芪多糖用于治疗缺血性血管疾病的用途的制作方法
本发明涉及红芪或红芪多糖在制备预防和/或治疗缺血性血管疾病的药物中的用途。本发明进一步涉及含有红芪或红芪多糖作为活性成分的药物组合物。
背景技术:
缺血性血管疾病已经成为威胁人类健康的主要疾病之一,其主要包括缺血性脑血管疾病、缺血性心肌病和缺血性周围血管疾病,具有高发病率、高死亡率、高致残率、高复发率等特点。缺血性血管疾病往往对组织、血管造成不可逆的损失,因血流量和氧供应中断,显著损害其生理功能或活性,从而导致一系列复杂的病理生理过程,包括能量代谢紊乱、自由基损失、细胞凋亡、炎症反应等,这些均由缺血缺氧及血流的再灌注引发,在不同时间点发生,彼此重叠并相互联系。
目前对于缺血性血管疾病治疗方法主要集中在药物治疗、介入治疗和外科手术治疗,尽管这些治疗手段在最近几十年都取得了很大的进步,但疗效仍然不是很明显,特别是对病变严重、缺血面积广泛的患者。怎么才能够发现有效的治疗手段,成为人类共同寻找的目标之一。随着对缺血性血管疾病病理学、病理生理学和细胞分子学研究的日益深入,人们逐渐发现血管再生对损伤后组织的修复起着重要的作用。新生血管不仅为局部带来氧和营养物质,而且还增强局部的免疫力、清除坏死组织,加速伤口愈合和组织修复。促血管再生是治疗缺血性血管疾病的一种有效手段,积极有效的发展、发现促血管再生的治疗方法和药物,是治疗缺血性血管疾病的有效路径。
在成年动物体内根据再生血管来源的不同,可分为血管新生(Vasculogenesis)、血管生成(Angiogenesis)和动脉生成(Arteriogenesis)。血管新生是指一些相对比较幼稚的祖细胞通过外周血液循环,到达局部周围组织,在微环境作用下在组织间隙中进一步分化成内皮细胞,进而形成血管,如内皮祖细胞、髓系祖细胞。血管生成是指在原有血管基础上内皮细胞增生、迁移,以出芽的方式而形成新的血管。动脉生成是指以前存在的动脉相对比较小的血管侧枝通过重构而形成更大的血管,表现为血管增粗、管腔增大,管腔内血流量和血流产生剪切力增加,所属侧枝进一步成熟。在新生血管方面,血管生成方式占有很重要的地位,故观察药物对血管内皮细胞的出芽情况,可为筛选出治疗缺血性血管疾病药物提供参考。
缺血性血管疾病属于中医的“虚”证的范畴,目前一致认为是本虚标实,本虚指的是五脏虚损、气血亏虚;标实指的是痰、瘀血或有风、火。治疗的重点是补虚、祛痰、化瘀、熄风、清火等。因此临床多选择补益药、活血化瘀药、豁痰开窍、熄风止痉和清热解毒药进行组分配伍治疗缺血性疾病,而且具有一定的疗效,然而从现代医药理论的角度来看,这些中药治疗缺血性血管疾病的作用机理仍不清楚,它们的中医功效用现代医学阐释是否恰当准确,或者还有更丰富的内涵,都需要我们利用现有的医学技术进行验证和探索。这种验证或者探索既丰富了中医理论,也有可能与现代医学碰撞出新的理论,扩大现代医学的认知领域。
中医药治疗血管生成相关疾病有着悠久的历史,且近年来不断发现有中药单体或者复方对血管生成有促进、抑制或双向调节的效应,虽然对治疗缺血性血管疾病有很大的促进作用,但还需进一步研究和开发。红芪作为传统中药,在中医临床上主要用于补气升阳,固表止汗,利尿消肿,生津养血,行滞通痹,托毒排脓,敛疮生肌。用于气虚乏力,食少便溏,中气下陷,久泻脱肛,便血崩漏,表虚自汗,气虚水肿,内热消渴,血虚萎黄,半身不遂,痹痛麻木,痈疽难溃,久溃不敛。现代药理学研究发现,红芪具有抗炎、耐缺氧、镇痛、免疫调节、减低血糖、防治老年性痴呆等作用,其主要提取物红芪多糖在免疫调节方面更有突出的表现,能显著减少体内的氧自由基、抑制肿瘤生成,减低血糖,防治老年性痴呆,并能较好的保护心、肝等重要脏器。
关于红芪及其提取物对于缺血性血管疾病的研究较少,通过实验我们首先在观察到红芪多糖有促进原代血管环出芽生长情况的基础上,以缺血性血管疾病中常见的缺血性脑血管疾病(缺血性脑卒中/脑梗塞)和下肢缺血性疾病为研究载体,通过组织形态学、免疫组化、神经功能评分及脑梗死体积变化等指标考察,发现红芪多糖对其均有明显的保护作用,从而为红芪多糖防治缺血性血管疾病提供依据。由于至今仍无红芪多糖治疗缺血性疾病的报道,因此研究红芪多糖防治缺血性血管疾病的作用极具价值。
技术实现要素:
因此,本发明一个目的为提供红芪或红芪多糖在制备预防和/或治疗缺血性血管疾病的药物中的用途。
其中所述缺血性血管疾病为缺血性脑血管疾病、缺血性心肌病和缺血性周围血管疾病。所述缺血性脑血管疾病可以为短暂性脑缺血发作、动脉硬化性血栓、可逆性缺血性神经功能损失、分水岭脑梗死、脑栓塞、小脑梗死等;所述缺血性心肌病可以为充血型缺血性心肌病和限制型缺血性心肌病;所述缺血性周围血管疾病可以为动脉硬化性闭塞症、糖尿病下肢血管病变、血栓闭塞性脉管炎、多发性大动脉炎、动脉栓塞、静脉曲张及其并发病等。
术语“缺血性脑血管疾病”是指各种原因造成的脑组织缺血性疾病的总称。引起缺血性脑血管病的病因可分为血管因素、血液动力学因素及血液因素。1.血管因素:主要是动脉硬化,包括动脉粥样硬化和高血压小动脉硬化,其他血管因素有脑动脉炎、动脉栓塞(主要来自心脏)。糖尿病及高脂血症可以促使动脉硬化形成。药物过敏、中毒以及外伤等也可造成血管损害。2.血液动力学因素:主要是高血压及低血压。高血压造成细小动脉硬化及玻璃样变损失血管内膜,促进动脉粥样硬化。血压突然下降可造成严重脑缺血或脑梗死。3.血液因素:主要为血液病及血液流变学的异常,如贫血、血粘度增高及糖尿病等因素。
术语“缺血性心肌病”属于冠心病的一种特殊类型或晚期阶段,是指由冠状动脉粥样硬化引起长期心肌缺血,导致心肌弥漫性纤维化,产生与原发性扩张型心肌病类似的临床综合征。
术语“缺血性周围血管疾病”是指除心血管和脑血管之外的其他血管因缺血导致的相关疾病。
为临床服用方便,所述红芪可以按照中药制剂的一般工艺:如直接粉碎,或者经常规的溶媒提取后浓缩制成提取物,也包括常规溶媒提取后再进一步精制的方法,如过大孔树脂柱,聚酰胺凝胶。这种制备工艺和方法对本领域技术人员是公知的。
例如,所述红芪多糖可以如下方法制备:红芪药材粉碎,过200目筛,加10、8、6倍量水煎煮3次,每次1小时,过滤,收集滤液,滤液浓缩至1:1后;加无水乙醇至含醇量达20%,静置,离心,弃去沉淀;继续加无水乙醇至含醇量达70%,静置24h,抽滤,得到沉淀,将沉淀干燥,称重,10倍量水加热溶解,趁热过滤,滤液加胃蛋白酶降解大分子蛋白质,然后用Sevag法除蛋白(氯仿:戊醇4:1混合),得到溶液;将溶液减压回收去除氯仿和戊醇,加无水乙醇至含醇量70%,静置24h,抽滤,得到沉淀;将沉淀冷冻干燥,即得。
本发明进一步涉及一种用于预防和/或治疗缺血性血管疾病的药物组合物,其含有红芪或红芪多糖作为活性成分,以及药学上可接受的载体。
本领域技术人员能够理解,本发明的药物组合物可以根据具体的施用方式被配制成各种本领域熟知的制剂形式,例如口服剂型(粉剂、片剂、胶囊、软胶囊、液体药物、糖浆、酏丸、散剂、囊剂、粒剂),或局部施用制剂(乳膏、软膏、洗剂、凝胶、香脂、膏药、糊剂、喷雾剂、气雾剂等等),或注射制剂(溶液、悬浮剂、乳剂)。
根据本发明的药物组合物可以包含药学上可接受的载体、佐剂或稀释剂,例如:填充剂、崩解剂、润滑剂、助悬剂、粘合剂、甜味剂、矫味剂、防腐剂、基质等。填充剂例如:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂例如:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯、低取代羟丙纤维素、交联羧甲基纤维素钠等;润滑剂例如:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂例如:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂例如,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等。本发明的组合物可以通过利用本领域任何已知方法制成,以使病人用药后能提供快速、持久或缓慢释放的活性成分。
例如,本发明的组合物可以溶解在油、丙烯乙二醇或其它通常用于制备注射剂的溶剂中,适合的载体实例包括生理盐水、聚乙烯乙二醇、乙醇、植物油、异丙基十四酸酯等等,但不限于它们。
红芪或红芪多糖在所述药物剂型中可以单独使用,也可以与其它药学上有活性的化合物联合使用。
本发明活性成分红芪或红芪多糖的给药剂量可以根据个体的情况和重量、病情的严重程度、药物形式、给药途径以及给药周期的不同而不同,其也可以由本领域技术人员进行选择。剂量可以是每天单次给药或每天分多次给药。
本发明的药物组合物通过各种途径给药至个体动物如哺乳动物(大鼠、小鼠、驯化动物或人类),所有的给药方式均是预期的,例如,给药可以是口服、直肠给药或经静脉、肌肉内、经皮、鞘膜内、硬膜外或脑室内注射。
以下将结合附图和具体实施例进一步阐明本发明,但应理解其仅是举例说明的作用,并不以任何方式限制本发明的范围。
附图说明
图1为显微镜(×100)下观察不同处理组中血管生成的照片,其分别是,A:蒸馏水组;B:红芪多糖低浓度组;C:红芪多糖中浓度组;D:红芪多糖高浓度组。
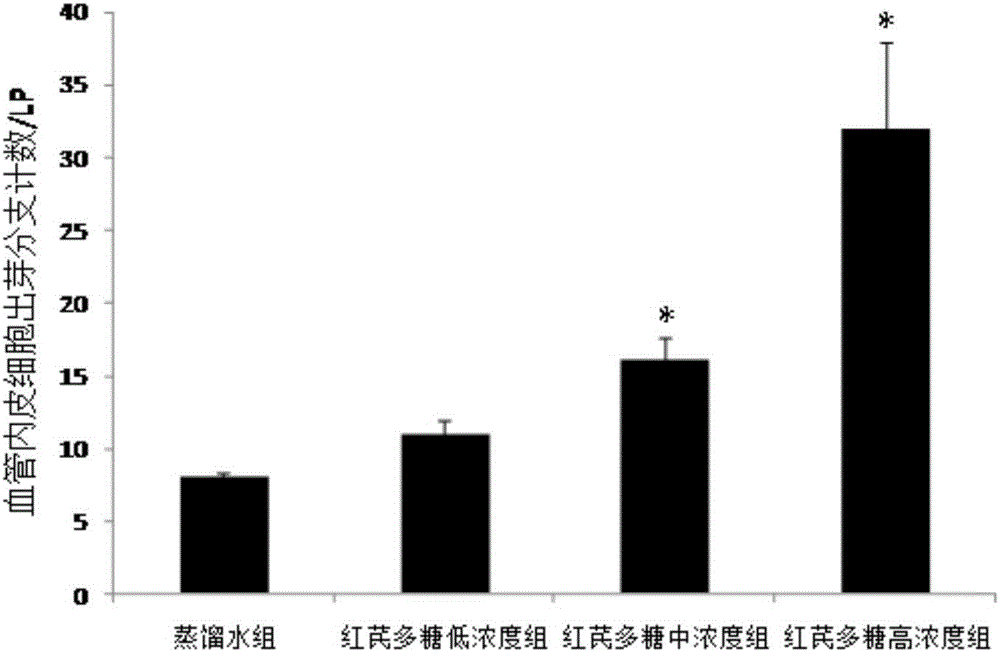
图2为显微镜(×100)下观察不同处理组中血管内皮细胞出芽分支计数图表。
图3为显微镜(×100)下观察下肢缺血损失模型中各个处理组处理后的苏木素-伊红(HE)染色组织切片,其分别是,A:蒸馏水组;B:红芪多糖低剂量组;C:红芪多糖中剂量组;D:红芪多糖高剂量组。
图4显示显微镜(×400)下观察的下肢缺血损失模型中各个处理组处理后的Endoglin染色切片,其分别是,A:蒸馏水组;B:红芪多糖低剂量组;C:红芪多糖中剂量组;D:红芪多糖高剂量组。
图5显示下肢缺血损失模型中经各组经免疫组化染色后的血管数图表。
图6显示各组对脑缺血作用后的神经功能评分图表。
图7显示预防给药后各组MCAO手术24h后脑缺血大鼠脑片TTC染色结果。
图8显示各组对脑缺血作用后的脑梗死体积图表。
具体实施方式
本发明体外实验部分以培养Wistar雄性大鼠原代血管环作为研究的对象,用不同浓度红芪多糖的水溶液干预,发现红芪多糖不同浓度均有不同程度的促进血管内皮细胞出芽生长。
本发明采用鼠类制作BALB/C小鼠股动脉低位结扎下肢缺血损伤模型来评价红芪多糖治疗下肢缺血性疾病作用,结果表明红芪多糖对下肢缺血损伤模型具有很好的保护作用。
本发明采用鼠类制作脑缺血模型是抗脑缺血研究最为常用的手段,常用模型有全脑缺血、永久性局灶脑缺血和局灶脑缺血再灌,它们各有特点,从不同角度模拟了缺血性中风急性期的发病机制。本发明运用了大鼠永久性脑缺血模型(pMCAO)来评价红芪多糖抗脑缺血药物的疗效,结果表明预防性给予永久性脑缺血大鼠红芪多糖,可改善脑缺血损伤后的神经功能缺失,减小脑梗死体积,实现缺血后的脑保护作用。
本发明使用的红芪购自陇南市瑞达中药材专业合作社(甘肃武都),经甘肃中医学院中药资源学教研室晋玲教授鉴定为豆科植物多序岩黄芪(Hedysarum polybotrys Hand-Mazz.)的干燥根,使用的红芪多糖由甘肃中医学院药学院中药化学教研室邵晶副教授制备并提供。
本发明使用的试剂若无特殊说明,均为本领域常规试剂,可以容易地商购获得。
下述实施例用于进一步说明本发明。
实施例1红芪多糖的提取制备
将红芪药材,粉碎,过200目筛,加10、8、6倍量水煎煮3次,每次1小时,过滤,收集滤液。滤液浓缩至1:1后,加无水乙醇至含醇量达20%,静置,离心,弃去沉淀。继续加无水乙醇至含醇量达70%,静置24h,抽滤,得到沉淀,将沉淀干燥,称重。10倍量水加热溶解,趁热过滤,滤液加胃蛋白酶降解大分子蛋白质,然后用Sevag法除蛋白(氯仿:戊醇=4:1混合),得到溶液。将溶液减压回收去除氯仿和戊醇,加无水乙醇至含醇量70%,静置24h,抽滤,得到沉淀,将沉淀冷冻干燥,即得红芪多糖。精密称取1.0g红芪多糖,用苯酚-硫酸法测定,其纯度为85.4%。
实施例2胶囊剂
红芪多糖50g与280g淀粉混合均匀,用淀粉浆(取淀粉220g用水制成淀粉浆)制颗粒,过筛,干燥,装胶囊。
实施例3片剂1
红芪多糖80g与淀粉340g混合均匀,用淀粉浆(取淀粉210g用水制成淀粉浆)制颗粒,过筛,干燥,加6%硬脂酸镁,混匀,压制成片,包薄膜衣即可。
实施例4片剂2
红芪多糖100g,淀粉100g和纤维素适量过筛,并充分混匀,将适量聚乙烯吡咯烷酮溶液与上述的粉混合,过筛,制得湿颗粒与60℃干燥,将羟甲基淀粉钠盐,6%硬脂酸镁和滑石粉预先过筛,然后加入到上述的颗粒中压片。
实施例5缓释制剂
将十八烷醇50g加热融化,加入75g红芪多糖、微晶纤维素25g等辅料,冷却后研磨粉碎过40目筛,加入卡波姆75g混匀,直接压片。
实验例1红芪多糖对原代培养大鼠血管环作用的研究实验
1.材料
1.1实验动物及来源
8周龄,SPF级雄性Wisrt大鼠,体重280-330g,购自兰州大学实验动物中心。
1.2药品及试剂
鼠尾胶原(购自杭州生友生物技术有限公司);MCDB131培养基(购自美国GIBCO公司);红芪多糖由甘肃中医学院药学院中药化学教研室提供;胎牛血清(FBS,购自浙江天杭生物科技有限公司);氢氧化钠、乙醇等其它常规试剂均购自于北京化工厂。
1.3试验仪器
倒置显微镜(型号:IX2-SLP,奥林巴斯,日本),超速低温离心机(Thermo,美国),二氧化碳培养箱(STIK,美国),超净工作台(型号:HFsafe-1500生物安全柜,海尔,中国),数码相机(型号:DC300,莱卡,德国)。
2方法
2.1红芪多糖水溶液的配制
取上述制备的红芪多糖用蒸馏水配成0.5mg/ml、1.0mg/ml、2.0mg/ml不同浓度的水溶液,用0.22μm微孔滤器过滤除菌,4℃冰箱保存备用。
2.2实验步骤
雄性Wistar大鼠一只,断颈处死,在碘伏中浸泡1分钟,放入75%乙醇中清洗,在超净台用弯镊和眼科剪剪开胸腹皮肤,开胸剪开膈膜、腹膜,取腹主动脉在3cm以上。
将血管至于3ml含有10%FBS培养液的培养皿中,用直镊剥掉动脉外的结缔组织,使血管外膜光滑,取出管腔内的血凝块,将血管剪成十六段,每段长0.1mm,用直镊放入六孔板底胶上;每孔放四个血管环。
在四个氨瓶中分别加入20μl 0.1N的NaOH,然后再加入400μl I型鼠尾胶原,混匀后加入1600μL含有5%FBS的MCDB131培养基,吹打混匀后分别在1号瓶中加入20μL蒸馏水(蒸馏水组),2号瓶中加入20μl 0.5mg/ml红芪多糖水溶液(红芪多糖低浓度组),3号瓶中加入20μl 1.0mg/ml红芪多糖水溶液(红芪多糖中浓度组),4号瓶中加入20μl2.0mg/ml红芪多糖水溶液(红芪多糖高浓度组),混匀后加入六孔板盖住血管环并铺平,静置十分钟至凝胶凝固;然后,将其放入37℃5%CO2孵箱中培养,培养第二天换液一次。48小时后,观察出芽的情况,进行拍照,记数。
2.3统计方法
SPSS19.0统计软件进行统计分析,实验数据均以表示。多组间比较采用单因素方差分析,组间两两比较,方差齐性用LSD检验,方差不齐用Tamhane's T2检验。P<0.05为差异有统计学意义。
3结果
不同浓度红芪多糖水溶液对原代培养大鼠血管环的作用
图1为不同处理组中血管生成的照片,在显微镜下可见内皮细胞通过增殖、出芽、分支连接成网的新生血管。对各组进行一、二级血管计数统计(见图2)的结果表明,与对照组(蒸馏水组)相比,红芪多糖低、中、高浓度组都具有促进血管生成的作用,且红芪多糖中、高浓度组与蒸馏水组之间的差别具有统计学意义(P<0.05)。因此,确定红芪多糖有促进血管生成的作用。
实验例2红芪多糖对小鼠下肢缺血的实验研究
1.材料
1.1实验动物及来源
8周龄,SPF级雄性BALB/C小鼠,体重28-33g,购自兰州大学实验动物中心。
1.2药品及试剂
红芪多糖由甘肃中医学院药学院中药化学教研室提供(制备方法如实施例1);Endoglin(CD105)单克隆抗体、兔抗大鼠二抗均购自abcam公司;山羊血清购自北京诺博莱德科技有限公司;PBS缓冲液、苏木素染色液均购自武汉博士德生物工程有限公司;伊红染色液购自上海碧云天生物技术有限公司;曲拉通(trixon)购自Sigma公司;二氨基联苯胺(DAB)购自Amersco公司;盐酸、乙醇、丙酮、过氧化氢(H2O2)均购自于北京化工厂;水合氯醛、多聚甲醛均购自于国药集团化学试剂有限公司;松节油型透明剂(TO)I和II购自广州市中南化工仪器有限公司;氨水购自天津市致远化学试剂有限公司。
1.3试验仪器
倒置显微镜(型号:IX2-SLP,奥林巴斯,日本),体视显微镜(型号:XTZ-05,上海光学仪器六厂),恒温冷冻切片机(型号:DC300,莱卡,德国)。
2方法
2.1红芪多糖水溶液的配制
取红芪多糖用蒸馏水配成不同剂量的水溶液,4℃冰箱保存备用。
2.2实验步骤
SPF级雄性BALB/C小鼠40只,饲养环境:室温22-25℃,相对湿度50%-60%,12小时明暗交替,适应环境3天后进入实验,造模。
BALB/c雄性小鼠秤重以后,按照0.3ml/kg的剂量,用1%水合氯醛腹腔注射麻醉。小鼠麻醉以后,以仰卧位的形式用皮筋固定在手术板上,用备皮刀片刮去小鼠一侧后肢腹股沟至大腿内侧的毛,然后使用碘伏消毒,铺无菌洞巾,使用眼科镊轻轻提起皮肤,并用眼科剪从大腿内侧沿着血管走形剪开一纵形切口,长约5mm,切口远端靠近膝关节。在10×或20×的体视显微镜视野下,使用尖镊轻轻的刺破膜状血管鞘。使用显微器械弯镊和直镊分离、游离股动脉,防止损伤股静脉和股神经,在股深动脉起始点的远端靠近膝关节处用7号手术缝线结扎股动脉。使用碘伏消毒并缝合皮肤,并给小鼠编号;待小鼠清醒以后放入饲养间饲养,给普通饲料和自由饮水。
模型小鼠被随机分成四组,分别为蒸馏水组、红芪多糖高(6g/kg)、中(3g/kg)、低(1.5g/k)剂量组。从术后第二天开始,各组给药体积均为10ml/kg,红芪多糖各组灌服相应浓度的红芪多糖,蒸馏水组灌服等体积的蒸馏水,连续灌胃7天后,处死动物,取材。
取材时将小鼠其余三个肢体固定在手术板上,抬起手术肢,剪开皮肤,完全暴露小腿肌肉。从跟腱到腘窝,使用眼科剪快速游离腓肠肌,并用剪刀修平跟腱部位,将肌肉放在包有铝箔的硬纸片上,保证肌肉的横切面;将肌肉和包有铝箔的硬纸片一同放在液氮罐中保存,其中的标本一部分作石蜡切片,另一部分作后冰冻切片,进行苏木素-伊红(HE)染色和Endoglin染色(又名CD105染色),进行组织学观察。
其中苏木素-伊红(HE)染色步骤如下:
将石蜡切片放置在60℃的孵箱中烤12小时;分别用松节油型透明剂(TO)I和II透明十分钟;用100%乙醇浸泡五分钟;用95%浸泡乙醇五分钟;用90%浸泡乙醇五分钟;用80%浸泡乙醇五分钟;流水冲洗拍干;使用苏木素染色10分钟;用流水冲洗去苏木素染液,约1分钟,拍干;用0.5%盐酸-乙醇分化,约5秒钟;流水冲洗,约1分钟,拍干;使用氨水返蓝,约2分钟;流水冲洗,约1分钟,拍干;使用伊红染色约10分钟;流水冲洗,约1分钟,拍干;80%乙醇洗5分钟;90%乙醇洗5分钟;95%乙醇洗5分钟;100%乙醇(I)洗5分钟;100%乙醇(II)洗5分钟;松节油型透明剂(TO)(I)透明十分钟;松节油型透明剂(TO)(II)透明十分钟;中性树胶封片。
其中Endoglin染色(又名CD105染色)步骤如下:
将冰冻切片用PBS缓冲液水化10分钟;用3%H2O2淬灭内源性过氧化物酶,约15分钟;用1%曲拉通(trixon)洗10分钟;用PBS缓冲液洗三次,每次5分钟;使用山羊血清封闭30分钟;在4℃下与Endoglin的单克隆抗体按一定浓度温孵过夜;用PBS洗涤三次,每次5分钟;使用兔抗大鼠二抗试剂盒在37℃下温孵1小时;用PBS洗涤三次,每次5分钟;使用二氨基联苯胺(DAB)在显微镜下控制显色;将DAB冲洗收集在废液缸中;苏木素复染细胞核3分钟;用流水稍洗去苏木素染液;约1分钟;用1%的盐酸-酒精分化,约5秒钟;流水稍洗,约1分钟;使用氨水返蓝,约5秒钟;流水稍洗,约1分钟;80%乙醇洗5分钟;95%乙醇(I)洗5分钟;95%乙醇(II)洗5分钟;100%乙醇洗5分钟;松节油型透明剂(TO)(I)透明10分钟;松节油型透明剂(TO)(II)透明10分钟;中性树胶封片;用PBS缓冲液代替一抗,作为阴性对照。
2.3统计方法
SPSS19.0统计软件进行统计分析,实验数据均以表示。多组间比较采用单因素方差分析,组间两两比较,方差齐性用LSD检验,方差不齐用Tamhane's T2检验。P<0.05为差异有统计学意义。
3结果
3.1红芪多糖对下肢缺血损失模型组织学观察结果
图3为各个处理组苏木素-伊红(HE)染色的组织切片,各剂量组标本苏木素-伊红(HE)染色的组织切片上均见大面积的肌肉发生凝固性坏死,在坏死组织周围,可见不同分化程度的再生横纹肌细胞。在蒸馏水处理组标本中可见少许再生的骨骼肌呈条带状分布在坏死组织周围,条带比较窄(箭头所示)。在红芪多糖低、中和高剂量组标本中增生的横纹肌呈带状分布在坏死组织周围,且高剂量处理组标本中增生的横纹肌条带明显增宽,再生的骨骼肌细胞胞浆也比较丰富(箭头所示)。
3.2红芪多糖对下肢缺血损失模型免疫组化染色结果
膜抗原CD105(Endoglin)作为新生血管的标记,主要表达在新生血管内皮细胞或活化的小血管内皮细胞细胞膜中,以细胞膜染成棕色作为阳性标准。图4显示处理后各组的Endoglin染色切片,图5显示免疫组化染色的血管数,从图4和图5可以看出,分别用6g/kg、3g/kg、1.5g/kg的红芪多糖和蒸馏水灌胃处理各组标本中,Endoglin阳性血管内皮细胞主要位于坏死的周边区;通过采用“热区法”计数血管密度。结果显示红芪多糖高剂量组中Endoglin阳性血管密度高于其他三组,并有显著性差异(P<0.05);3g/kg和1.5g/kg红芪多糖剂量组中Endoglin阳性血管数比蒸馏水处理组多,但没有统计学差异。
综上,确定了红芪多糖对下肢缺血损失模型具有保护作用。
实验例3红芪多糖抗脑缺血实验研究
1.材料
1.1实验动物及来源
6周龄,SPF级雄性SD大鼠,体重200-220g,购自北京维通利华实验动物公司,合格证号:SCXK(京)2012-0001,饲养于中国中医科学院中药研究所实验动物中心。
1.2药品及试剂
TTC(氯化2,3,5-三苯基四氮唑)购自南京绿合生化技术有限公司产品;红芪多糖由甘肃中医学院药学院中药化学教研室提供(制备方法同实施例1);银杏提取物EGB761(天津泰阳制药有限公司,批号:H20130206)。
2方法
2.1动物分组及给药
SPF级SD雄性大鼠40只,饲养环境:室温22-25℃,相对湿度50%-60%,12小时明暗交替,适应环境3天后进入实验。分为假手术组、模型组、50mg/kg银杏提取物组、50mg/kg红芪多糖组。实验过程中动物自由摄食和饮水,各组均以8ml/kg体积灌胃,其中假手术和模型组灌服蒸馏水,50mg/kg银杏提取物组(即625mg银杏提取物用蒸馏水定容置100ml容量瓶中),50mg/kg红芪多糖组(即625mg红芪多糖用蒸馏水定容置100ml容量瓶中),灌服相应药物,连续灌胃5天,每天早上8:00和20:00各灌胃一次。于第6天早上7:00灌胃,每组于灌胃1小时后,麻醉,采用大脑中动脉阻塞(MCAO)造模方法,并于晚上19:00各组开始第二次灌胃,并于造模后24h,神经功能评分后,取脑,切片,染色。
2.2 MACO模型的建立
大鼠称重,10%水合氯醛(0.35ml/kg)腹腔注射麻醉,将其仰卧位固定在解剖手术台上,以左侧大脑中动脉为手术测,颈部备皮,碘伏消毒。行颈部前正中切口,钝性分离,分离皮下组织,暴露鼓泡腺并将其推向两侧,钝性分离组织,暴露颈总动脉鞘。钝性分离颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)、颈外动脉(external carotid artery,ECA)及ECA的主要分支动脉、枕动脉、甲状腺上动脉等,保护周围神经如迷走神经不受损伤。先结扎ECA的主要分支动脉,结扎CCA近心端,在远心端置一备用丝线略做结扎,留作固定线栓用,在ICA近心端置一备用丝线,留作止血用。在CCA上两条结扎线之间剪一V型切口,将已备好的线栓插入CCA内,稍收紧远心端结扎线,将线栓越过ECA和ICA的分叉处进入ICA管腔,缓慢送入颅内,遇到轻微阻力时即到达大脑中动脉(middle cerebral artery,MCA)的起始部(插入的平均深度为距颈内外动脉分叉处18±0.5mm),收紧并结扎CCA上的结扎线。确认伤口无渗血,逐层缝合肌肉与皮肤,碘伏消毒手术切口,线栓末端暴露在皮肤外面,并将其标记,术后注意保温及切口的护理,手术动物苏醒后单笼饲养,保持鼠笼干燥清洁,供应流质,密切观察。
假手术组模型制备同上,但经ECA侧壁插入线栓仅约10mm,即线栓并不插入ICA颅内段。
2.3 MACO模型入选标准
参照Bederson评分,在大鼠手术麻醉清醒后进行四个功能等级评分:
0分:无神经损伤症状;
1分:悬尾试验不能完全伸展对侧前爪;
2分:前肢抵抗对侧推力能力下降;
3分:向对侧转圈。
2.4 MACO模型的排除标准
取脑时发现并发现蛛网膜下腔出血者;
TTC染色未见缺血灶者。
因上述因素导致各实验组动物数不足者,随时补齐动物数并重新造模。
3统计方法
SPSS19.0统计软件进行统计分析,实验数据均以表示。多组间比较采用单因素方差分析,组间两两比较,方差齐性用LSD检验,方差不齐用Tamhane's T2检验。P<0.05为差异有统计学意义。
4结果
4.1神经功能缺损评分
最后一次给药后24h采用盲法进行神经功能评分,进行Bederson评分,Bederson评分分为四个功能等级,0分:无神经损伤症状;1分:悬尾试验不能完全伸展对侧前爪;2分:前肢抵抗对侧推力能力下降;3分:向对侧转圈。
4.2大鼠脑梗死体积的评价
应用TTC染色对脑梗死体积进行评价。
MCAO大鼠缺血24h后,以10%水合氯醛过量麻醉取脑,去除嗅球、小脑和低位脑干,-20℃冰箱内冷冻20分钟后取出,自前脑额极起向后连续切出5片厚度约2mm的冠状位脑切片,将脑片放入预先配制的2%TTC溶液中,37℃避光孵育约15分钟,然后将脑片置于新鲜配制的4%多聚甲醛溶液中固定24h,观察并拍照,正常脑组织呈鲜红色,坏死区不染色而呈苍白色。
分析:应用IPWIN 32图像处理软件计算梗死体积占同侧脑体积的百分比。
梗死率=(Vc-Vl)/(Vc×2)×100%
Vc=d×∑Ac(Ac-正常侧半脑片面积)
Vl=d×∑Al(Al-患侧半脑片红色面积)。
表1为红芪多糖对脑缺血作用后的神经功能评分及脑梗死率。结果显示,与模型组比:50mg/kg银杏提取物组、50mg/kg红芪多糖组的神经功能评分及脑梗死率均减低(P<0.05,参见图6~8)
表1红芪多糖对脑缺血作用后的神经功能评分及脑梗死率
注:与假手术组比较,*P<0.05,**P<0.01,***P<0.001;与模型组比较,△P<0.05,△△P<0.01,△△△P<0.001
综上,确定红芪多糖对脑缺血具有保护作用。
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的优选实施例,并不用以限制本发明。凡在本发明的申请范围内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!