药物涂层医疗器械的制作方法
本发明属于药物涂层医疗器械领域,具体涉及药物涂层球囊导管,及其制备方法和在医疗中的应用。
背景技术:
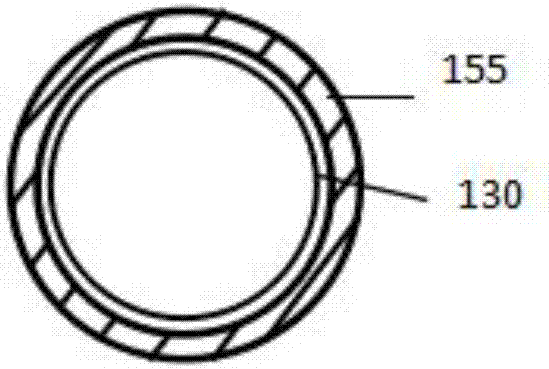
:冠状动脉及外周血管疾病是一种常见血液循环系统疾病,斑块积聚在冠状动脉管壁内,限制血液流向身体各个部位。目前典型治疗措施包括动脉旁路移植术,支架植入术或球囊血管成形术。接受支架植入术和球囊血管成形术的几个月后,有些患者的介入治疗位点出现血管壁变窄,称为血管狭窄。血管狭窄的再发生,可能由原来的支架植入术和球囊血管成形术造成,或由于原支架的拆除或新指支架的安装,引起的血管壁狭窄,称为血管再狭窄。对血管狭窄和血管再狭窄相关问题的认识形成了药物洗脱支架的发展。药物洗脱支架被设计为可以释放一种或更多种药物,用来在最大持续时间下抑制细胞繁殖(因此造成血管狭窄/再狭窄)。然而,药物洗脱支架的使用存在来自永久性植入管的慢性刺激所引发的炎症的风险。因此,能在治疗位点快速释放药物量的装置将优于永久性植入管。典型的药物洗脱支架包括一系列的支柱单元,支柱可压缩利于被传送到治疗位点,可伸展利于达到动脉管腔里的治疗位点进行运用,还包括支柱上的一个包含了一种或多种洗脱药物的涂层。这种典型支架的设计还造成了药物洗脱支架使用的另一种重要的限制,即药物在涂层的聚合物基质中分布不均。药物过度地集中在支架的支柱上,造成药物无法均匀地释放到血管壁组织,在药物过量的区域会导致组织损伤和血栓形成,在未治疗区域会导致增生和血管狭窄或再狭窄(当治疗位点已经狭窄)。因此,需要一个装置能使药物均匀地被传送到靶组织。最近,药物洗脱球囊(deb)的概念被引进表面附有活性剂的血管形成术球囊中。在实践中,球囊膨胀且紧贴在血管壁上时,deb将活性成分传送到血管壁上。在实践中证明了一些debs是有效的,但这类设备还显示了一些新的难题和问题。这些问题和难题概括如下。药物在处理和传送过程中仍充分留存在球囊表面,以及球囊到达靶组织前减少活性成分损失是十分重要的。在血管形成术程序中,治疗药物能在很短的接触时间内,迅速释放治疗药物剂量到血管的靶点位置是十分重要的。理论上,药物被吸收到血管壁之前,会被流经血管的血液稀释/冲走,药物量需要在靶点位置上持续作用一段时间(例:确保减少或抑制发生血管狭窄/血管再狭窄的必要时间)。涂层药物颗粒在是否在能良好的控制情况下释放也是十分重要的,如果随着球囊膨胀,产生许多大颗粒或颗粒聚集体发生脱落,脱落的涂层颗粒可能造成微血管血栓。药物涂层必须具有稳定性,不会在球囊伸展和收缩时断裂,在在血管中输送过程中不会脱落。药物涂层的断裂或脱落可能释放颗粒(例:活性成分颗粒)到血流中,这可能造成由于全身性毒性或远端栓塞所导致的不良和潜在的严重反应。所述的药物涂层球囊已通过各种研究方法,提高了涂层的药物转移效率或减少药物损失。上述的球囊大多由单一药物活性层,用小而亲水的分子作为载体(例如尿素,山梨糖醇,聚山梨酯,胶束,油或脂赋形剂,造影剂,碘普罗胺,碘伏醇,白藜芦醇,表面活性剂,吐温20,吐温40,吐温80和海藻酸钠多糖)组成。大多数情况下,提高药物转移效率会造成药物损失增加,反之亦然,目前使用这种方法,两者之间还无法达到平衡。在国际申请公布号wo2013/007273专利中,描述了虫胶的基底涂层的使用,该涂层包括第一虫胶底层,具有浓度梯度的活性成分的第二层,和顶层虫胶。其中所述所述基底涂层技术更像作为载体以提高药物传送到血管靶点位置效率。因此,由wo2013/007273所描述的技术限制于当前设计,并且如果药物活性层需要载体,那此技术可能不可行。此外,此设计所存在的问题可能包括,由于聚合物存在于基底层和药物层中,可能造成大块药物碎片移位,或随着药物的使用大块药物颗粒聚集体聚合在一起。现有技术的药物涂层球囊面临的其他问题包括药物颗粒分布不一致和治疗结果不一致。理想的deb可以定义为实现涂层均匀,理想涂层可以实现最大限度地减少释放颗粒数量,并最大限度的保留药物和实现最小血管毒性。因此,上述药物涂层球囊无法在药物的高转移效率和药物的低损失率中保持平衡,例如存在药物碎片的损失,大块药物颗粒聚集体等进入血液中的问题。因此仍然需要开发一个稳定的、球囊涂层均匀的、能有效且高效地迅速释放药物的球囊导管,且药物在传送中的损失小,不会产生药物颗粒物聚集或随着使用产生大块药物碎片。技术实现要素:本发明提供一个能使药物球囊表面更均匀的涂层,在所述药物球囊的使用中,药物能均匀、以离散的颗粒形式发挥作用,不易聚集为药物碎片遭受损失和/或在体腔内形成大块药物颗粒聚集体。本发明第一发明目的,提供了一个药物涂层医疗器械包括:一个具有一个内表面和一个疏水性外表面的球囊;一个直接连接在所述球囊的所述外表面的粘附平衡层,包括一个亲水性聚合物和/或一个亲水性化合物,所述亲水性化合物的分子量小于1000道尔顿;和一个直接连接在所述粘附平衡层的药物活性层,包括一个药物和一个药学上可接受的载体,其中:所述药物是一个具有一个或多个氢键体系的疏水性药物,且作为药物活性层中离散的药物颗粒;所述药物颗粒至少有一个尺寸小于25μm,且均匀的分布在所述球囊表面;和所述药学上可接受的载体具有亲水性,且分子量小于1000道尔顿。在本发明的实施方案中,所述医疗器械可以是一个球囊导管的球囊,也可以是球囊导管。在本发明的进一步实施方案中:1.粘附平衡层的厚度在0.01至30μm之间,例如在干燥状态下测量,粘附平衡层的厚度在0.01至10μm之间(例如0.01至4μm,或者0.1至2μm);2.所述粘附平衡层中的所述亲水性聚合物和/或所述亲水性化合物包含氢键体系;3.所述药物颗粒大多至少有一个尺寸小于15μm(例如:小于10μm);4.所述药物活性层中的所述药物的载体量在1:8至8:1wt/wt之间(例:1:4至3:1wt/wt);5.所述粘附平衡层遇水时可膨胀或吸水;6.所述亲水聚合物可由以下物质的一种或者多种组成:聚乙烯(内酰胺类),聚氨酯,丙烯酸和甲基丙烯酸的均聚物和共聚物,聚乙烯醚,聚醚,马来酸酐共聚物,乙烯胺类,聚乙烯亚胺,聚(羧酸),聚酰胺,聚酸酐,聚磷腈,纤维物质,肝素,葡聚糖,多肽,多糖,聚酯,寡肽,寡核苷酸,寡核苷酸,和共聚物及其衍生物【例:一类聚醚的一个衍生物或一个共聚物,如一类聚醚可由以下物质的一种或者多种组成:聚甲醛(pom)、聚乙二醇(聚乙二醇)、聚丙二醇(ppg)、聚四氢呋喃(pthf),衍生物及其共聚物(例:聚醚可由以下物质的一种或者多种组成:普林特二醇、聚乙二醇衍生物及其共聚物)】;7.所述粘附平衡层还包括一个疏水聚合物(例:所述聚合物层可能包含小于30wt%的疏水性聚合物,和/或其中所述亲水聚合物和/或疏水聚合物不一定是虫胶);8.所述亲水性聚合物是嵌段共聚物,包括疏水嵌段和亲水嵌段,其中,疏水性聚合物和疏水嵌段可选择性的小于30wt%的亲水性聚合物;9.所述亲水性聚合物的数均分子量在10,000至10,000,000道尔顿之间,例如从100,000至5,000,000道尔顿,或者从500,000至2,000,000道尔顿;10.所述药物活性层的药物可由以下物质的一种或者多种组成:抗增殖物,免疫抑制剂,抑制血管生成物,抗炎和抗血栓形成剂【例如:所述药物可以选自以下一种或多种:紫杉醇,雷帕霉素,依维莫司,佐他莫司,优米莫司(umirolimus),他克莫司,和吡美莫司(例如药物可由以下物质的一种或者多种组成:紫杉醇,雷帕霉素,佐他莫司和优米莫司(umirolimus),例如紫杉醇和雷帕霉素)】;11.所述粘附平衡层还包括一个药物,可选择性的,在所述粘附平衡层中的所述药物可与所述药物活性层的所述药物为同一定义;12.分子量小于1000道尔顿的所述亲水性化合物可由以下物质的一种或者多种组成:糖,糖醇,和聚乙二醇【例如:分子量小于1000道尔顿的所述亲水性化合物可由以下物质的一种或者多种组成:果糖、葡萄糖、蔗糖、乳糖、麦芽糖、赤藓醇,苏糖醇,阿拉伯糖醇,核糖醇、甘露醇、半乳糖醇,岩藻糖醇,艾杜醇,肌醇,庚七醇,异麦芽酮糖醇,麦芽糖醇,乳糖醇,麦芽三糖醇,伏格列波糖,木糖醇,山梨糖醇和聚乙二醇(例如可由以下物质的一种或者多种组成:果糖,葡萄糖,蔗糖,木糖醇,甘露醇和山梨糖醇)】13.所述药学上可接受的载体可由以下物质的一种或者多种组成:酒石酸,一种糖和一种糖醇【例如:所述药学上可接受的载体可由以下物质的一种或者多种组成:果糖、葡萄糖、蔗糖、乳糖、麦芽糖、赤藓醇,苏糖醇,阿拉伯糖醇,核糖醇、甘露醇、半乳糖醇,岩藻糖醇,艾杜醇,肌醇,异麦芽酮糖醇,麦芽糖醇,乳糖醇,麦芽三糖醇,伏格列波糖,尤其是木糖醇,酒石酸,山梨糖醇(例如选自以下一种或多种:果糖,葡萄糖,蔗糖,甘露醇,或尤其是山梨糖醇,或更尤其是木糖醇和酒石酸)】;14.所述药物的在所述球囊上的总负载量在1μg/mm2至10μg/mm2之间(例如1.5μg/mm2至4μg/mm2,或者:2μg/mm2至3μg/mm2)15.所述药物活性层和所述粘附平衡层可在球囊外表面形成均匀涂层,所述均匀涂层可选择性地被球囊折叠线所打断;16.球囊可以是球囊导管整体的构成部分亦或是可拆卸部分;17.所述药物颗粒可由以下一种或者多种形式组成:微粒针,微颗粒和纳米粒。应了解的是,上述实施方案可由本领域技术人员以合理的技术方式结合。所有上述技术方案的合理组合也应明确地作为本发明的一部分。本发明第二发明目的,提供了一种制备药物涂层器械的方法,其中所述方法包括:a提供一个未涂覆的球囊;b提供一个粘附平衡层的前驱混合物,至少在球囊表面的一部分涂覆粘附平衡层的前驱混合物以组成粘附平衡层前驱层,干燥粘附平衡层前驱层用于为球囊涂层提供粘附平衡层。c提供一个药物混合物和将所述药物溶液涂覆在覆有粘附平衡层的球囊的外表面,随后干燥所述粘附平衡层前驱层用于为球囊涂层提供粘附平衡层;所述药物混合物包括一个具有一个或多个氢键体系的疏水性药物,一个溶剂,和一个亲水性药学上可接受的载体,所述载体的分子量小于1000道尔顿;和所述粘附平衡层的前驱混合物包括一个亲水聚合物和/或亲水性化合物,其中所述亲水性化合物分子量小于1000道尔顿。应了解的是,此处所使用的球囊为折叠状态,所以球囊可以是在折叠状态下进行涂覆的。另一种方法包括步骤如下:i在步骤a和步骤b之间给球囊充气,膨胀气压可选择性的为2个大气压(2.0265x105p);ii步骤c结束后球囊泄压iii球囊的折叠接着步骤ii在本发明的实施方案中,所述粘附平衡层的前驱混合物包括亲水性聚合物和/亲水性化合物与以下物质的一种或多种组合结合:水,丙酮,乙腈或c1-4醇(如乙醇)。所述粘附平衡层前体混合物中的所述亲水性聚合物的浓度大概在0.167mg/ml至20mg/ml(例如0.2mg/ml至20mg/ml)。在某些实施方案中,所述粘附平衡层前体混合物还包括一个疏水性聚合物。在本发明的进一步实施方案中,所述药物混合物包括一个药物和一个由以下物质的一种或多种组合的溶剂:二氯甲烷,或更具的是,水,丙酮,乙腈,四氢呋喃(thf)或一种c1-4醇(乙醇或甲醇),所述治疗及混合物中的所述药物的浓度可选择性的在5mg/mlto100mg/ml之间。所述药物活性层中的所述药物可由以下物质的一种或者多种组成:抗增殖物,免疫抑制剂,抑制血管生成物,抗炎和抗血栓形成剂【例如:所述药物可以选自以下一种或多种:紫杉醇,雷帕霉素,依维莫司,佐他莫司,优米莫司(umirolimus),他克莫司,和吡美莫司(例如药物可由以下物质的一种或者多种组成:紫杉醇,雷帕霉素,佐他莫司和优米莫司(umirolimus),例如紫杉醇和雷帕霉素)】在本发明的进一步实施方案中:a所述药物混合物中的载体的浓度在0.5mg/ml至100mg/ml之间(例10mg/ml至50mg/ml,或者20mg/ml至25mg/ml);和/或b所述药物混合物中的药物的浓度在0.5mg/ml至100mg/ml之间(例20mg/ml至80mg/ml,或者35mg/ml至65mg/ml)。在本发明的进一步实施方案中,步骤b和步骤c的涂覆可由以下方法的一种或多种组合完成:刷涂,喷涂,浸涂,注射沉积或吸管沉积,可选择性的:i步骤b的涂覆是由浸涂方法完成;和/或ii步骤c的涂覆是由喷涂方法完成。在进一步的本发明的实施方案中,本发明的第二发明目的的步骤c的球囊干燥,所采用的温度在35℃至100℃,或者40℃至60℃(如45℃)。在本发明的进一步实施方案中:a所述医疗器械可以是球囊导管整体的构成部分亦或是可拆卸部分;或b该方法还包括将球囊固定在球囊导管,球囊亦可以是球囊导管整体的构成部分或是可拆卸部分。本发明的第三发明目的,提供一种根据本发明第一发明目的制作的药物球囊医疗器械的使用,以及将第一发明目的用于医疗的实施方案的可行技术组合。本发明的第四发明目的,提供了一种治疗方法,所述治疗方法使用了一种本发明的第一实施例所述的医疗器械,和可将药物传送至所待治疗组织的实施方案的可行技术组合。例如,所述方法还包括以下步骤:a将药物涂层医疗器械插入治疗目标的中空组织内;b将医疗器械推进组织中的靶组织;c将球囊撑开并保持球囊为膨胀状态,使所述药物有足够的时间段粘附到所述靶组织;d将球囊泄压,将球囊从治疗目标移出。在某些实施方案中,所述时间段在1秒到2分钟之间,例如在30秒到1分钟。在本发明的实施方案中,所述方法可用于治疗和/或预防血管狭窄或血管再狭窄。本发明的第五发明目的,根据本发明的第一发明目的和用于传送药物至所需治疗的靶组织的实施方案的可行技术组合,提供了一种使用药物涂层医疗器械的方法。例如,所述治疗可以是治疗或是血管狭窄或血管再狭窄的预防。本发明的第六发明目的,根据本发明的第一发明目的及其用于传送药物至所需治疗的靶组织的制备药物的实施方案的可行技术组合,提供了一种使用一种药物涂层医疗器械的方法。例如,所述治疗可以是治疗或是血管狭窄或血管再狭窄的预防。附图说明下面结合附图进一步阐述本发明,应理解这些附图仅用于说明本发明而不限制本发明的范围。图1描述了现有技术的球囊导管上的药物涂层的横截面图,所述涂层包括一个药物和一个载体的单层膜。图2描述了现有技术的球囊导管上的药物涂层的横截面图,所述涂层包含一个药物的单层膜。图3根据本发明的一个实施方案,描绘了一个球囊导管上药物涂层的横截面图,所述涂层具有两层,一层为粘附平衡层,另一层为包含了药物和载体的可良好控制的颗粒层。图4根据本发明的一个实施方案中,描绘了一个球囊导管上药物涂层的横截面图,所述涂层具有两层,一层为包含了药物的粘附平衡层,另一层为包含了药物和载体的可良好控制的颗粒层。图5是本发明所述球囊的体外药物损失量和对比案例药物损失量的对比图表,图5a是药物涂层球囊1(dcb1)和dcb3的比较图;图5b是dcb2和dcb4的比较图;图5c是dcb2和dcb5的比较图。图6是本发明所述球囊的体外药物吸收和对比案例药物吸收的对比图,图6a是dcb1和dcb3的比较图;图6b是dcb2和dcb4的比较图;图6c是dcb2和dcb5的比较图。图7是本发明所述球囊的体内药物损失量和对比案例药物损失量的对比图表。图8是本发明所述球囊的体内药物吸收量和对比案例药物吸收量的对比图表。图9提供了本发明球囊上涂层形态的sem图像。图9a和图9b药物洗脱球囊8(deb8)的sem图像相关联;图9c和图9d与deb9相关联。图9b和9d分别是图9a和9c显示的图像进一步放大。图10提供了本发明球囊上涂层形态的sem图像。图10a和图10b药物洗脱球囊10(deb10)的sem图像相关联;图10c和10d与deb11相关联。图10b和10d分别是图10a和10c显示的图像进一步放大。图11提供了本发明球囊中损失的药物粒径的图像。图11a与药物洗脱球囊8(deb8)的sem图像相关联;图11b与deb9相关联;图11c与deb10相关联;和图11d与deb11相关联。图12提供了随着药物的使用本发明球囊的体外药物存留量与对比案例药物存留量的对比图(deb12-14)。图13提供了本发明球囊的体外药物传送损失量与对比案例药物传送损失量的对比图(deb12-14)。图14提供了本发明球囊的体外药物吸收量和对比案例药物吸收量的对比图(dcb12-14)。具体实施方式本发明涉及由一个粘附平衡层和一个疏水性药物活性层组成的一个药物涂层(或药物洗脱)球囊导管。在处理和递送过程中,有必要实现所述粘附平衡层实现球囊的疏水性表面的疏水药物活性层的粘附性可控。在通常情况下,用于组成药物活性层的涂层溶液与球囊表面的表面自由能不相等。鉴于这种情况,如果单独使用所述药物活性层,它会形成一个非均匀的层,要么强力附着在球囊表面,要么微弱地附着在所述球囊表面,使得治疗涂层要么很难从所述球囊表面移出,要么轻易从球囊表面脱落。而且当载体被用于药物活性层的一部分,移除药物的控制程度很难调节,从而导致药物释的放性能不一致。令人惊讶的是,人们已经发现解决药物释放性能不一致问题的方法,即引入一个独立层到球囊表面,它存在于治疗球囊表面和药物活性层之间。这个独立层可能包含一个亲水聚合物材料或亲水性化合物(例如小于1000道尔顿),这个独立层被称为“粘附平衡层”。所述粘附平衡层用于平衡存在于药物活性层和球囊表面(当药物活性层还包括一个亲水性载体材料)的疏水性相互作用。因此,在干燥状态下形成了一个稳定的涂层,并且以可控的方式吸收水,以实现当球囊运用在目标物上时能将药物活性层的粘附力降低。换句话说,粘附平衡层增加了球囊表面的表面能,从而提高球囊的药物活性层上的润湿度,这反过来又提供了一个更均匀的治疗涂层。通过控制粘附平衡层的化学性质,可以很好地调节药物活性层的粘附力。也就是说,药物活性层的粘附力可根据所使用的特定药物的需求而进行调整。因此,药物损失,药物释放和药物组织吸收是可以调整和平衡的,这样可以使更多的药物被释放到靶位点而不会造成潜在的有害副作用。所述药物活性层包括一个疏水性药物混合物和一个亲水性载体,所述亲水性载体具有存在于单分子中的一个或多个氢键体系。这种亲水性载体材料的功能是防止药物颗粒之间产生强粘附力,和防止释放大块药物颗粒聚集体和大块药物碎片,不论是在传送药物至治疗位点或是在球囊在治疗位点扩张,此功能都能发挥作用。此外,在粘附平衡层的结合使用中,此载体能有助于确保药物有效的输送。除此之外,研究人员惊讶地发现,能通过控制球囊表面的药物活性层的形成条件从而控制药物活性层的形态。这点是十分重要的,因为该药物的形态会显著影响药物的释放,溶解和吸收。药物的溶解速率主要取决于球囊表面形成的颗粒/晶体的表面体积比。通过控制药物活性层的形成条件,能实现良好的药物活性层形态,譬如药物活性层形态为一层针状晶体,一层由针状晶体组成的微粒层,一层纳米粒子,一层微观颗粒和可以实现上述物质混合的混合物。在此种情况下发现,不是以颗粒形式组成,而是以单一薄膜的形式组成的涂层效果不佳,因为薄膜可能会造成在传送药物至目标位点或是球囊撑开的过程中,药物涂层以大块药物碎片形式遭受损失。因此,同时使用粘附平衡层和形态可控的药物颗粒(结合载体材料使用)能惊人有效地控制药物的溶解,并且还能有效地预防药物涂层的大颗粒,颗粒聚集体,药物碎片损失,预防了体腔内血管堵塞的潜在危险,例如血管的毛细血统的远端栓塞。因此,在本发明的实施方案中,涂覆有粘附平衡层和药物活性层的药物涂层球囊导管可使药物充分、均匀和快速地释放,以减少靶组织中的血管狭窄/再狭窄的发生。因此本发明提供了一种药物涂层医疗器械,包括:一个具有一个内表面和一个疏水性外表面的球囊;一个直接连接在所述球囊的所述外表面的粘附平衡层,包括一个亲水性聚合物和/或一个亲水性化合物,所述亲水性化合物的分子量小于1000道尔顿;和一个直接连接在所述粘附平衡层的药物活性层,包括一个药物和一个药学上可接受的载体,其中:所述药物是一个具有一个或多个氢键体系的疏水性药物,且作为药物活性层中离散的药物颗粒;所述药物颗粒至少有一个面的尺寸小于25μm,且均匀的分布在所述球囊表面;和所述药学上可接受的载体具有亲水性,且分子量小于1000道尔顿。显然,所述的医疗器械可以是气囊导管的导管球囊,也可以是气囊导管。不管哪种形式下,涂层都是在球囊上。所述球囊的外表面上涂覆着一层包括了亲水性小分子和/或亲水性聚合物。这个涂层在上述中称为“粘附平衡层”。不希望受理论束缚,可以推测粘附平衡层以干燥的状态强力地粘附在球囊表面和药物活性层,但在传送时,粘附平衡层吸水后粘附性下降,球囊充气时药物能迅速地释放和转移到把血管上。因此,通过控制粘附平衡层的吸水能力,由粘附平衡层提供的粘附力也可受控,所以,因为药物涂层球囊的粘附平衡层的粘附性可控,以及药物活性层的分布均匀(药物和载体),可以有效地调整药物损失和药物转移。如上文所讨论的,球囊导管将治疗药物传送到把靶点中的过程中,很难取得药物粘附(传送过程)和药物有效传送(在靶点中的运用)之间的平衡。本发明的药物涂层球囊导管或球囊导管,具有稳定的涂层,由此减少了药物在处理和递送至靶部位时的损失。由此可见粘附平衡层的亲水性有助于改善药物活性层的润湿性,从而提供了一个更均匀的药物涂层。由于药物损失较低和涂层形态更加均匀,本发明的药物球囊确保了更一致和可预测的治疗效果,以及降低了远端栓塞和全身毒性的风险。不希望受理论束缚,可以认为粘附平衡层的粘附性能提供以下良好效果:在干燥情况下,粘附平衡层强力地黏附在球囊上和活性成分(药物)上,在与水接触时,涂层能膨胀(例如吸水),从而有效地将活性物质层释放到血管壁上。这使得药物能高效地转移到血管壁上,减少了所需药物的剂量。本文使用的“亲水性”和“疏水性”分别指在遇水情况下,物质会膨胀(吸水)或不膨胀/收缩(不吸水)。另外,本文使用的“亲水性”和“疏水性”涉及到根据戴维斯法利用公式计算值(1)的亲水亲油平衡值(hlb)。如果聚合物的hlb值>10为亲水性,hlb值<10为疏水性。其中:m是分子中亲水基团的数目;hi是亲水基团的值(例如:基于由戴维斯所提供的表);n是分子中亲脂基团的数量。本文使用的“包括”一词要求所有提及的组分都存在,但允许有进一步组件的添加。应了解的是,“由...组成”和“主要由...组成”作为子集被“包括”一词涵盖,分别限制在所提及的组分或者含有杂质的组分。为了避免疑义,我们明确地考虑了“包含”一词的用法,“包含”可以用“由...组成”和“主要由...组成”及其变体替换。本发明的球囊导管在到达目标组织中所需的作用部位时,能够立即释放其表面上含有的活性剂。此外,由球囊导管提供的剂量是可持续治疗有效量。本文使用的“立即释放”意为从球囊表面释放,为在很短的时间内从1秒到2分钟,例如从30秒到1分钟。本文中的术语“可持续治疗有效量”是指针对治疗组织(例如血管组织)的疾病或病症(例如:血管狭窄/再狭窄)持续多达28天的治疗或预防效果。图1(现有技术)描绘了一个球囊130的横截面,其上涂覆有包含药物和载体的单层膜层150。图2(现有技术)描绘了一个球囊130的横截面,其上涂覆有仅包含药物的单层膜层155。如上所述,这种涂层存在的问题包括:药物在到达目标位点前的损失,和/或目标位点吸收过少的药物,和/或释放大块药物碎片或颗粒导致微血管栓塞。这些问题使得药物球囊不论是产自同一生产批次或是不同生产批次,都难以保证不同的球囊能够提供均匀给药。图3根据本发明描绘了球囊130的横截面,其中球囊具有两层:156层和160层。160层是粘附平衡层,包括亲水性聚合物和/或亲水性化合物(即小于1000道尔顿),粘附平衡层直接连接在球囊130的外表面,药物活性层156包括一个药物和一个载体,其中药物是以理想的大小,均匀的颗粒形式组成的(即至少有一个尺寸小于25μm)。图4根据本发明描绘了球囊130的横截面,其中球囊具有两层:156层和165层。165层是粘附平衡层,包括亲水性聚合物和/或亲水性化合物(即小于1000道尔顿),和直接连接在球囊130的外表面的药物,药物活性层156包括一个药物和一个载体,其中药物是以理想的大小,均匀的颗粒形式组成(即:任何一个面尺寸都小于25μm,例如:任何一个面尺寸都小于25μm)在干燥状态下测量,图3和图4的粘附平衡层的厚度在0.01到10μm之间(例如:在0.01至4μm之间,如在0.1至2μm之间)。用于本发明球囊涂层的亲水性聚合物和/或亲水性化合物(即小于1000道尔顿)是以一层膜的形式涂在球囊表面,在接触水(例如血液中的水分子)之后能吸水(即膨胀)。本发明的另外实施方案或替代实施方案中,亲水性聚合物和/或亲水性化合物(即小于1000道尔顿)的hlb值大于10。应了解的是,在粘附平衡层中的亲水性聚合物和/或亲水性化合物包含氢键体系。不希望受理论束缚,可以推测这些氢键体系能使得粘附平衡层提供上文中所提及的良好的作用效果。亲水性化合物用于组成粘附平衡层,可由以下物质的一种或者多种组成:糖,糖醇,和聚乙二醇。运用于本文所述的亲水性化合物的分子量可能小于1000道尔顿。当该化合物以聚合材料(或低聚物材料)的形式存在时,则分子量应参考数均分子量。尤其是亲水性化合物可用于组成粘附平衡层,亲水性化合物可由以下物质的一种或者多种组成:果糖、葡萄糖、蔗糖、乳糖、麦芽糖、赤藓醇,苏糖醇,阿拉伯糖醇,核糖醇、甘露醇、半乳糖醇,岩藻糖醇,艾杜醇,肌醇,庚七醇,异麦芽酮糖醇,麦芽糖醇,乳糖醇,麦芽三糖醇,伏格列波糖,木糖醇,山梨糖醇和聚乙二醇。更尤其亲水化合物可用于组成粘附平衡层,且可由以下物质的一种或者多种组成:果糖,葡萄糖,蔗糖,木糖醇,甘露醇和山梨糖醇。运用于本文所述的亲水聚合物可由以下物质的一种或者多种组成:聚(内酰胺类)(例如聚乙烯基吡咯烷酮(pvp)),聚氨酯,丙烯酸和甲基丙烯酸的均聚物和共聚物,聚乙烯醚,聚醚,马来酸酐共聚物,乙烯胺类,聚乙烯亚胺,聚(羧酸类),聚酰胺,聚酸酐,聚磷腈,纤维物质(例如甲基纤维素、羧甲基纤维素、羟甲基纤维素、羟丙基纤维素),肝素,葡聚糖,多肽,多糖,聚酯,寡肽,寡核苷酸,寡核苷酸,和共聚物及其衍生物。尤其是运用于上文所述的亲水聚合物可由以下物质的一种或者多种组成:聚酸酐、聚磷腈、聚四氢呋喃、聚酰胺(特别是多肽(例如蛋白质、胶原蛋白(如胶原),白蛋白、纤维蛋白(如纤维蛋白),和弹性蛋白)、聚酯(如聚乳酸(如聚乳酸(pla))、聚乙交酯(聚乙交酯(pga)),聚(乳酸-乙醇酸)(plga)、聚(对二氧环己酮)(pdo,pds)和聚己内酯(如聚己内酯(pcl))、多糖(如壳聚糖、淀粉、透明质酸、海藻酸盐、明胶、甲壳素),或其衍生物,共聚物和两者混合物,优选聚乙二醇及其衍生物和聚合物。在本发明的某些实施方案中,亲水性聚合物可以是聚醚、聚醚衍生物或聚醚共聚物。上文所述聚醚包括:多聚甲醛,聚乙二醇(聚乙二醇)、聚丙二醇(ppg)、聚丁二醇(ptmg)或高分子量形式的聚甲醛(pom)、聚氧化乙烯(peo),聚环氧丙烷(ppox)、聚四氢呋喃(pthf),以及其分别的衍生物及其分别的共聚物。在本发明的具体实施方案中,聚醚可由以下物质的一种或者多种组成:聚乙二醇/聚氧化乙烯(peo)、聚乙二醇/聚氧化乙烯(peo)衍生物和聚乙二醇/聚氧化乙烯(peo)共聚物。本文所述的“聚乙二醇/聚氧化乙烯(peo)衍生物和聚乙二醇/聚氧化乙烯(peo)共聚物”可由以下物质的一种或者多种组成:嵌段共聚物(例如聚乙二醇-pla,聚乙二醇-plga,聚乙二醇-pcl),三嵌段共聚物(例如聚乙二醇-ppg-聚乙二醇,ppg-ppg-聚乙二醇,pla-聚乙二醇-pla,plga-聚乙二醇-plga,pcl-聚乙二醇-pcl,pga-聚乙二醇-pga),多嵌段共聚物(例如聚乙二醇-ppg-聚乙二醇),无规共聚物,单官能聚乙二醇【例如聚(乙二醇)2-溴异丁酸甲酯,聚(乙二醇)甲醚乙炔,聚(乙二醇)甲基丙烯酸,甲氧基聚乙二醇叠氮化物,甲氧基聚乙二醇胺,甲氧基聚乙二醇马来酰亚胺】,同型双官能团聚乙二醇【例如聚(乙二醇)双(2-溴异丁酸),聚(乙二醇)二乙炔,聚(乙二醇)二甲醚,聚(乙二醇)双(胺),聚(乙二醇)双叠氮,聚(乙二醇)二缩水甘油醚】,双官能团聚乙二醇(例如聚乙二醇羧基胺,t-丁氧胺聚乙二醇胺)和甲氧基聚乙二醇(例如甲氧基聚乙二醇琥珀酰亚胺乙酸酯,甲氧基聚乙二醇琥珀酰亚胺碳酸酯,甲氧基-聚乙二醇-巯基,甲氧基聚乙二醇胺).上面提到的“聚乙二醇”可被“聚环氧乙烷”取代。在本发明的实施方案中,亲水性聚合物的数均分子量可在10,000至10,000,000道尔顿之间,或者100,000至5,000,000道尔顿之间,或者,从500,000至2,000,000道尔顿之间。由于聚乙二醇和聚氧化乙烯是同型聚合物,二者可以互换使用。聚乙二醇通常指的是一种数均分子量小于或等于20000道尔顿的聚合物和聚乙烯氧化物通常是指具有数均分子量大于20000道尔顿的聚合物。当然,在本发明的实施方案中,这些术语可以互换使用,并用于涵盖上面所提到的所有分子量。也适用于上述所提及的其他疏水性聚合物。在本发明的进一步实施方案中,粘附平衡层还可包括疏水性聚合物。在本发明的进一步实施方案中,疏水性聚合物是与水接触时不膨胀的聚合物。本发明的另外实施方案或替代实施方案中,疏水性聚合物和/或疏水性化合物(即小于1000道尔顿)的hlb值小于10。这里所提到的疏水性聚合物是案例中的疏水性聚合物,可由以下物质的一种或者多种组成:聚酸酐,聚醚【例如聚(丙二醇)(ppg)、聚四氢呋喃(四氢呋喃)】,聚酯【例如聚(丙二醇)(ppg)、聚四氢呋喃(四氢呋喃)】、聚酯(如聚乳酸(pla)、聚(对二氧环己酮)(pdo,pds)、聚己内酯(pcl)、聚乙醇酸(pga)、聚(乳酸-羟乙酸)(plga)、聚羟基丁酸酯(phb))、多糖(如淀粉),及其衍生物、聚合物和两者混合物。在本发明的某些实施方案中,粘附平衡层含有小于疏水性聚合物的30wt%。在本发明的实施方案中,亲水性聚合物和/或疏水性聚合物可以不是虫胶。在本发明的进一步实施方案中,亲水性聚合物包括疏水性嵌段共聚物和亲水性嵌段共聚物。嵌段共聚物的分子量作为上述疏水性聚合物。在本发明中可能提到的某些实施方案中,疏水性聚合物和疏水性聚合物嵌段小于聚合物层的30wt%。在本发明的实施方案中,药物层中的药物可以由以下物质的一种或者多种组成:抗增殖物,免疫抑制剂,抑制血管生成物,抗炎和抗血栓形成剂。例如,药物可以选自以下一种或多种:紫杉醇,雷帕霉素,依维莫司,佐他莫司,优米莫司(umirolimus),他克莫司,和吡美莫司(例如药物可由以下物质的一种或者多种组成:紫杉醇,雷帕霉素,佐他莫司和优米莫司(umirolimus)),尤其在本发明的具体实施方案中,所述药物为紫杉醇。在本发明的进一步实施方案中,所述粘附平衡层还包括药物,所述药物可选择性地选自以下物质:抗增殖物,免疫抑制剂,抑制血管生成物,抗炎和抗血栓形成剂。例如,药物可以选自以下一种或多种:紫杉醇,雷帕霉素,依维莫司,佐他莫司,优米莫司(umirolimus),他克莫司,和吡美莫司(例如药物可由以下物质的一种或者多种组成:紫杉醇,雷帕霉素,佐他莫司和优米莫司(umirolimus)),尤其在本发明的具体实施方案中,所述药物为紫杉醇。此处提及的“药物”是一种疏水性药物,但具有一个或多个氢键体系。正如上文所说,药物层包括一个药学上可接受的载体。所述药学上可接受的载体可由以下物质的一种或者多种组成:酒石酸,一种糖和一种糖醇。在本发明的具体实施方案中,所述药学上可接受的载体可由以下物质的一种或者多种组成:果糖、葡萄糖、蔗糖、乳糖、麦芽糖、赤藓醇,苏糖醇,阿拉伯糖醇,核糖醇、甘露醇、半乳糖醇,岩藻糖醇,艾杜醇,肌醇,异麦芽酮糖醇,麦芽糖醇,乳糖醇,麦芽三糖醇,伏格列波糖,尤其是木糖醇,酒石酸,山梨糖醇。正如上文所说,载体分子量小于1000道尔顿。当载体为聚合物时,则分子量应参考数均分子量。在本文中所使用的药物活性层中的药物中的载体在1:8至8:1wt/wt之间(例如在1:4至3:1wt/wt之间)。在本发明的实施方案中,药物在球囊上的总载荷量在1μg/mm2至10μg/mm2之间(例如在1.5μg/mm2至4μg/mm2之间,或者在2μg/mm2至3μg/mm2之间)。所述总载荷量可以确定为在药物活性层和粘附平衡层的药物的总载荷量。正如上文所说,亲水性载体材料与疏水性药物的结合使用可以防止药物颗粒聚集体的形成等。所述药物颗粒至少有一个尺寸小于25μm,(例如至少有一个尺寸小于15μm或小于10μm)。应了解的是,药物颗粒至少有一个尺寸小于(即每一个面)都小于25μm。物颗粒可均匀分布在球囊的表面上。正如上文所说,所述药物颗粒可由以下物质的一种或者多种组成:微粒针,微颗粒和纳米粒的形式组成。在此提及的本发明得具体实施方案中,药物颗粒以“细胞”的形式存在,其中微颗粒提供多种囊泡状的二维结构,囊泡至少有部分由纳米粒子填充(如图10c和10d)。在本发明的实施方案中,所述药物活性层和所述粘附平衡层可以使球囊表面的涂层均匀,其中均匀的表面可选择性地被球囊折叠所形成的线所打断。在本发明的进一步实施方案中,球囊可以是球囊导管整体的构成部分或是可拆卸部分;上文所述的药物涂层医疗器械可由以下构成:a提供一个未涂覆的球囊;b提供一个粘附平衡层的前驱混合物,至少在球囊表面的一部分涂覆粘附平衡层的前驱混合物以组成粘附平衡层前驱层,干燥粘附平衡层前驱层用于为球囊涂层提供粘附平衡层。c提供一个药物混合物和将所述药物溶液涂覆在覆有粘附平衡层的球囊的外表面,随后干燥所述粘附平衡层前驱层用于为球囊涂层提供粘附平衡层,其中所述药物混合物包括一个具有一个或多个氢键体系的疏水性药物,一个溶剂,和一个亲水性药学上可接受的载体,所述载体的分子量小于1000道尔顿;和所述粘附平衡层的前驱混合物包括一个亲水聚合物和/或亲水性化合物,其中所述亲水性化合物分子量小于1000道尔顿。所述疏水性药物,所述亲水性的药学上可接受的载体,所述亲水性聚合物和所述亲水性化合物,都与上文所述的带涂层的医疗器械相对应物质的性质相同。应了解的是,此处所使用的球囊为折叠状态,所以球囊可以是在折叠状态下进行涂覆的。另一种方案包括步骤如下:i在步骤a和步骤b之间给球囊充气,任选的,膨胀气压为2个大气压(2.0265x105p);ii步骤c结束后球囊泄压;iii球囊的折叠接着步骤ii。如上文所述,球囊可以在展开和充气的状态下涂覆涂层,或者在折叠状态下将涂层涂覆在褶皱上。在本发明的实施方案中,所述粘附平衡层的前驱混合物包括亲水性聚合物和/或亲水性化合物与以下物质的一种或多种结合的组合物:水,丙酮,乙腈或c1-4醇(例如:非限制性的c1-4,如上文所提及的乙醇)。所述粘附平衡层前体混合物中的所述亲水性聚合物的浓度大概在0.167mg/ml至20mg/ml(例如从0.2mg/ml至20mg/ml)。在某些实施方案中,粘附力平衡层前驱混合物还包括一个疏水性聚合物材料,此疏水性聚合物材料所用的类型和使用量已在上文的医疗器械中描述。在进一步实施方案中,所述药物混合物可能包括一个药物和一个由以下物质的一种或多种组合的溶剂:二氯甲烷,或更具的是,水,丙酮,乙腈,四氢呋喃(thf)或一种c1-4醇(例:乙醇或甲醇),所述药物及混合物中的所述药物的浓度可选择性的在5mg/ml至100mg/ml之间。亲水性载体可以是一种或多种已在上文的医疗器械中描述的物质。药物混合物中的载体的浓度在在0.5mg/ml至100mg/ml之间(例如在10mg/ml至50mg/ml之间,或者20mg/ml至25mg/ml之间)。所述药物活性层的药物可由以下物质的一种或者多种组成:抗增殖物,免疫抑制剂,抑制血管生成物,抗炎和抗血栓形成剂【例如:所述药物可以选自以下一种或多种:紫杉醇,雷帕霉素,依维莫司,佐他莫司,优米莫司(umirolimus),他克莫司,和吡美莫司(例如药物可由以下物质的一种或者多种组成:紫杉醇,雷帕霉素,佐他莫司和优米莫司(umirolimus),例如紫杉醇和雷帕霉素)】所述药物混合物中的药物的浓度在0.5mg/ml至100mg/ml之间(例20mg/ml至80mg/ml之间,或者35mg/ml至65mg/ml之间)。在某些实施方案中,步骤b和步骤c的涂覆可由以下方法的一种或多种组合完成:刷涂,喷涂,浸涂,注射沉积或吸管沉积。例如步骤b的涂覆是由浸涂方法完成;和/或步骤c的涂覆是由喷涂方法完成。在本发明的实施方案中,上文所述的步骤c的干燥温度通过控制药物活性层的形成条件,得到良好的药物活性层形态,譬如是一层针状晶体,一层由针状晶体组成的微粒层,一层纳米粒子,一层微观颗粒和实现上述物质混合的混合物(例:可见图9和图10)。例如步骤c的温度在35℃至100℃,例如35℃至80℃,或者40℃至60℃(如45℃)。在所述方法的某些实施方案中,医疗器械可以是球囊导管整体的构成部分亦或是可拆卸部分。在另一实施方案中,该方法还可包括将球囊固定在球囊导管上,球囊亦可以是球囊导管整体的构成部分或是可拆卸部分,以组成医疗器械。应了解的是,本发明的球囊具有一个消耗性药物的涂层,因此,上文所述的药物涂层医疗器械可用于医学。也就是说,根据本发明的第一实施例和用于医学的,实施案例的任何技术可行结合,本发明提供了一种药物涂层医疗器械的用途。在本发明的各个方面中,提供了:(a)一种使用药物涂层医疗器械的治疗方法,所述治疗方法使用一种能利用上述药物涂层医疗器械将药物传送到需治疗的组织上。(b)一种药物涂层医疗器械,所述药物涂层医疗器械用于将药物传送到需治疗的组织上;和(c)将所述药物涂层医疗器械应用于制备向需要治疗的组织给药的药物中。在本发明的实施方案中,活性成分的使用和传送可用于治疗或预防血管狭窄或血管再狭窄,可选择性地使用一种或多种上文所提及的药物。在进一步的实施方案中,待治疗组织可以是中空组织(例如带有管腔的组织)。上文所述的组织尤其包括血管组织。在本发明的某些实施方案中,治疗的方法包括以下步骤:a将药物涂层医疗器械插入治疗目标的中空组织内;b将医疗器械推进组织中的靶组织;c将球囊撑开并保持球囊为膨胀状态,使所述药物有足够的时间段粘附到所述靶组织;d将球囊泄压,将球囊从治疗目标移出。在某些实施方案中,所述时间段可以在1秒至2分钟之间,例如在30秒至1分钟之间。实施方案常规制备1粘附平衡层前驱混合物(abl)abl的制备是通过加入指定成分且用常规手段混合。详情于如下表1。表1常规制备2药物混合物(tam)tam的制备是通过加入指定成分且用常规手段混合。详情于如下表2。表2常规制备3仅用tam涂覆的球囊步骤如下:1)提供一个折叠的无涂层球囊;2)用空气将所述球囊充气至两个大气压;3)使用常规制备2中的tam1-8溶液,将其分别以3μg/mm2的剂量涂覆于步骤2的球囊表面,然后干燥球囊表面涂层(4)完成步骤(3)以后,将球囊放气;和(5)完成步骤(4)以后,将球囊折叠,以备使用。步骤3的涂覆和应用由常规涂覆方法完成,例如,刷涂,喷涂,浸渍,注射沉积或吸管沉积。步骤3的干燥可以在室温或在高温下和在大气压或减压下进行。常规制备4用abl和tam涂覆球囊1)提供一个折叠的无涂层导管球囊;2)用空气将所述球囊充气至两个大气压;3)使用常规制备1的abl1-9中的一种溶液,涂覆于步骤2的球囊,随后干燥涂层球囊表面涂层;4)使用常规制备2中的atm1-8溶液,将其分别以3μg/mm2的剂量涂覆于步骤3的球囊表面,然后干燥球囊表面涂层;5)完成步骤(4)以后,将球囊放气;和6)完成步骤(5)以后,将球囊折叠,以备使用。步骤3和步骤4进行的涂覆和应用由常规涂覆方法完成,例如,涂刷涂覆,更尤其是,喷雾涂覆,浸渍涂覆,注射沉积或吸管沉积。步骤3的干燥可以在室温或在高温下和在大气压或减压下进行。实施方案1tam的预备如下:a)混合70mg的紫杉醇,2ml乙醇,50mg山梨醇。b)混合70mg的紫杉醇,2ml乙醇,50mg尿素。球囊1-2(无聚合物层)球囊1-2根据常规制备3预备,即:将药物混合物直接涂覆在未涂覆的导管球囊的表面上。球囊的详细信息见表3.球囊号所使用的tam1(a)2(b)表3球囊1和球囊2的构造对应图1。球囊3-5(包括粘附平衡层)球囊3-5根据常规制备4预备,即:将abl直接涂覆在未涂覆的导管球囊的表面上得粘附平衡层,继而将药物混合物涂覆在上述粘附平衡层。球囊的详细信息见表4.表4球囊的构造3-5对应图3。所有的测试球囊(1-5)3mm×15mm。方法体外试验方法引用于seidlitz等人的《药物涂层球囊的体外药物转移》plosone8(12):e83992(doi:10.1371/journal.pone.0083992)。本试验做了以下改变:用硅管代替血管壁模型血管壁模型的图像没有进行成像,因此球囊没有用荧光物质处理。药物内容用乙腈(acn)提取和在227nm紫外光谱下进行分析。球囊充气至12个大气压。也对残留在球囊上的药物进行了分析,从而推导出药物在导入和传送过程中的损失量。结果如图5所示,与没有粘附平衡的球囊3-5相比,具有存在于球囊表面和药物活性层之间的粘附平衡层(即亲水性聚合物,或小于1000道尔顿的亲水性分子)的药物涂层球囊3-5,球囊3-5的药物损失量显著较低。此作用适用于所有具有载体的药物活性层和不具有载体的药物活性层。图5所示的结果清楚地表明,粘附平衡层显著提高了治疗涂层的稳定性。如图6所示,对于药物活性层有载体的球囊,具有存在于球囊表面和药物活性层的粘附平衡层的药物涂层球囊3-5,与无粘附平衡层的球囊(球囊1-2)相比,球囊3-5比球囊1-2高出50%的药物吸收量。结果表明,具有粘附平衡层的球囊能减少药物在传送至靶位点时的损失,以及提高在作用位点的药物吸收量。实施方案2表5为在体内实验所使用的球囊表5球囊6根据常规制备3预备(球囊6的构造对应图2)。球囊7根据常规制备4预备(球囊7的构造对应图3)。所有球囊的规格为3mmx15mm。样品在动物体内进行评估测试。用7只重量为3-4kg的新西兰白兔进行试验,将12个球囊随机分配到白兔的左髂动脉和右髂动脉。球囊一组(第1组)用于研究涂层的药物转移,球囊二组(第2组)用于研究球囊在传送过程中的药物损失。方法试验计划引用自granadajf等人的《紫杉醇涂层球囊的组织吸收和保留机制:内膜增生和愈合的影响》openheart(2014)aug6;1(1):e000117(doi:10.1136/openhrt-2014-000117.ecollection2014).所述试验计划的第1组引用如下:由于试验采用了较小的球囊,所以用兔髂动脉代替腹主动脉只收集了急性的数据(5分钟时间点)还另外分析了球囊上药物的残留量。用甲醇提取球囊中的残留药物,并用lc/ms分析。对于第2组引用,药物涂层球囊的安置中与第1组相类似。不同的是,球囊没有在髂动脉中保持60秒的膨胀时间。继而慢慢取出球囊,将球囊从导管上剪下,保存以供分析。结果如图7所示,具有存在于球囊表面和药物活性层之间的粘附平衡层(即分子量小于1000道尔顿的亲水性聚合物或亲水性分子)的药物涂层球囊7,在体内研究中与没有中间粘附平衡层的球囊6相比,球囊7比球囊6有近100%的药物损失降低。正如在实施方案1中的所观察到的结果,具有中介的粘附平衡层的药物涂层球囊7更具有显著的稳定性。此外,如图8所示,与球囊6的样品相比,球囊7增加60%的药物转移到靶血管。这表中介聚合物层不仅提高了药物涂层球囊的药物转移效率,还大大增强了涂层对球囊的干粘附性,从而减少药物损失。实施方案3表6为在体外实验所使用的球囊。球囊8-11根据常规制备4预备,其中abl直接涂覆在未涂覆的导管球囊表面得粘附平衡层,药物混合物涂覆在粘附平衡层的顶部。常规制备4中的步骤4的干燥温度也提供在表6下。体外药物损失和吸收的检测方法与实施方案1中相同。表6如图9和图10所示(图片采用jeoljsm-5600lv扫描电镜扫描),不同的溶剂,载体类型,载体浓度,干燥温度,球囊8-11会显示出不同的形态。球囊8的药物活性层在25℃下干燥,无载体,会形成膜。球囊的药物活性层9-11在高温下干燥,使用较高的载体浓度和不同溶剂。这些条件能调整溶剂的蒸发速率,从而产生不同的球囊表面结构,如针状晶体(deb9),纳米粒子(deb10)和微米颗粒/纳米粒子混合物(deb11)。这表明,表面形态可通过涂层配方(溶剂,活性载体及其在该溶剂中浓度)和常规制备4的步骤4的干燥温度的组合所控制。值得一提的是,对药物活性层采用浸渍、刷涂,喷涂或吸管沉积的方法进行涂覆以达成这些形态。实施方案4表7列出了在体外试验中使用的球囊。所有球囊根据常规制备4预备。体外药物损失和吸收的检测方法与实施方案1相同。表7如图11、图12和图13所示,通过改变载体与药物的比例关系,可以优化药物的吸收和药物的损失。球囊13的载体与药物的比例为2:1,比其他样品具有更高的药物转移效率,更低的药物残留量,更低的药物损失量。结果表明,一定量的载体可以平衡药物颗粒之间的表面相互作用,以及药物颗粒和粘附层之间的表面相互作用。如果载体含量过高,会影响药物层的稳定性,导致药物损失大,药物吸收率低。根据本发明的具体步骤,影响药物涂层性能的必要因素可由本领域技术人员调整,以优化转移效率。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1