用于治疗胃肠道疾病的药物组合物的制作方法
本发明涉及一种用于治疗胃肠道疾病的药物组合物,其包括雷尼替丁(ranitidine)、斯克拉非(sucralfate)及次枸橼酸铋(bismuthsubcitrate)作为活性成分。
背景技术:
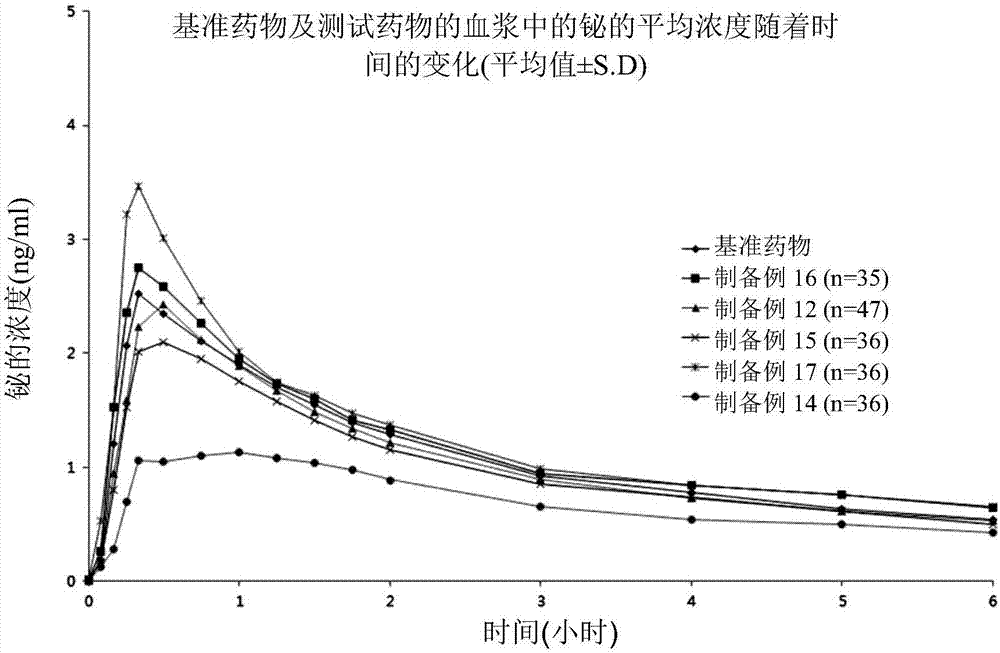
:雷尼替丁为一种经由h2受体阻断而抑制胃酸的产生的药物,且其用于治疗胃溃疡或逆流性食道炎。事实上,当将雷尼替丁与次枸橼酸铋及斯克拉非一起服用作为组合治疗时,已知对于胃溃疡及十二指肠溃疡显示出优异的治疗效果(专利文献1:韩国专利公开号1997-006083)。因此,目前市面上可购得包含这三种药物作为活性成分的组合药物。然而,雷尼替丁具有强烈的吸湿性,因而在储存时引起水分吸收,且引起片剂的重量及特性改变(pdaj.pharm.sci.tech.2009may-jun:63(3):223-33)。因此,其存在改变片剂的崩解时间的问题。并且,当雷尼替丁与次枸橼酸铋混合时,存在由于次枸橼酸铋而改变雷尼替丁的物性的问题。因此,专利文献1公开了如下方法:其中将雷尼替丁制备作为核心片剂,并混合次枸橼酸铋及斯克拉非以制备含有核心片剂的片剂内片剂。此外,专利文献2(韩国专利号10-0453179)公开了一种方法,其中问题在于,当雷尼替丁在胃中释出时,雷尼替丁被斯克拉非吸附而确定降低了雷尼替丁的吸收率,因而将含有雷尼替丁的核心片剂用膜成形组合物进行包衣,且然后与次枸橼酸铋及斯克拉非混合以制备片剂内片剂。然而,问题在于,当将含有雷尼替丁的核心片剂用膜包衣以制备片剂内片剂时,制备过程变得复杂且制备成本增加。再者,由于片剂内片剂具有比具有相同剂量的骨架片剂更大的片剂尺寸,若药剂量增加,则片剂尺寸会过度增加且对于患者吞咽而言较不舒适。因此,需要制备一种能够解决下列问题的组合药物:1)雷尼替丁本身的吸湿性问题;2)由于与次枸橼酸铋混合而降低雷尼替丁的稳定性问题;以及3)当制备雷尼替丁、次枸橼酸铋及斯克拉非的组合药物时,由于混合三种药物而降低药物吸收率的问题。此外,需要制备具有简单的制备过程、使病患吞咽更舒适以及具有优异的生物可利用性的组合药物。[专利文献](专利文献1)韩国专利公开号1997-006083(专利文献2)韩国专利号10-0453179[非专利文献](非专利文献1)pdaj.pharm.sci.tech.2009may-jun:63(3):223-33技术实现要素:技术问题本发明提供一种组合药物,其能够解决关于雷尼替丁、次枸橼酸铋及斯克拉非的组合药物在制剂稳定性及生物可利用性方面的问题,具有简单的制备过程并使患者吞咽更加舒适。技术方案根据本发明的研究结果,事实上确认了,当制备雷尼替丁、次枸橼酸铋和斯克拉非的组合药物时,若控制次枸橼酸铋及斯克拉非的粒径,则会抑制雷尼替丁的水分吸收以实现制剂稳定性,且可避免药物的间的物理相互作用以实现药物生物可利用性,而无需制备片剂内片剂。具体地,在下列实施例中,使用各类型的研磨器或筛子对各粒径的斯克拉非及次枸橼酸铋进行分类、测量粒径,使用以各尺寸分类的斯克拉非及次枸橼酸铋并与雷尼替丁混合,接着观察雷尼替丁的含水量、制剂稳定性及生物可利用性。结果,确认了,雷尼替丁的含水量在斯克拉非及次枸橼酸铋的特定粒径范围内得以抑制,维持了制剂稳定性,且药物生物可利用性优异。然后,选择作为最佳粒径的尺寸。因此,本发明提供一种用于治疗胃肠道疾病的药物组合物,其包括雷尼替丁、斯克拉非及次枸橼酸铋作为活性成分,且满足下列条件中的至少一个:(a)斯克拉非具有1μm至25μm的平均粒径,(b)次枸橼酸铋具有5μm至90μm的平均粒径。在本发明的药物组合物中,斯克拉非可具有1μm至25μm的平均粒径,例如1μm至20μm、2μm至25μm、2μm至20μm、2μm至15μm、3μm至15μm、2μm至10μm、3μm至10μm、3μm至8μm、4μm至10μm或4μm至8μm。在本发明的药物组合物中,次枸橼酸铋可具有5μm至90μm的平均粒径,例如5μm至80μm、5μm至75μm、5μm至70μm、10μm至75μm、10μm至60μm、10μm至50μm、15μm至75μm、20μm至75μm、25μm至70μm、25μm至65μm、25μm至60μm、25μm至55μm或25μm至50μm。在实施方式中,斯克拉非可具有2μm至25μm或2μm至10μm的平均粒径。在实施方式中,次枸橼酸铋可具有5μm至75μm、25μm至70μm或25至50μm的平均粒径。在实施方式中,斯克拉非可具有1μm至25μm的平均粒径,且次枸橼酸铋可具有5μm至90μm的平均粒径。在另一实施方式中,斯克拉非可具有2μm至25μm的平均粒径,且次枸橼酸铋可具有5μm至75μm的平均粒径。在又一实施方式中,斯克拉非可具有2μm至10μm的平均粒径,且次枸橼酸铋可具有25μm至70μm的平均粒径。虽然没有指定作为特别实施例,当结合及使用具有在上述列举范围内的平均粒径的斯克拉非及次枸橼酸铋时,可得到作为本发明目的的药物组合物。在此说明书中,平均粒径为体积或质量的平均值,并且是指相对于重量分布的体积加权平均d[4,3]值。当药物的粒径需要被微粒化时,可以使用能够使颗粒微粒化的普通研磨机,例如z磨机、锤磨机、球磨机、流体能量磨机等用于研磨。此外,当利用筛子进行的筛选法或使用例如气流分类的尺寸分类法时,可以将药物的粒径细分。在该相关领域中已知调整期望的粒径的方法。例如,参考下述文献:[pharmaceuticaldosageforms:volume2,2ndedition,ed.:h.a.lieberman,l.lachman,j.b.schwartz(chapter3:sizereduction)]。在该说明书中,药物的粒径可基于例如d(x)=y(在此,x及y为正数)的粒径分布表示。d(x)=y是指,当通过测量在制剂中的特定药物的粒子直径所得到的药物的粒径分布表示为累积曲线时,粒径以升序累积且其结果达到x%(%为基于数量、体积或重量所计算)所在的点具有y的粒子直径。例如,d(10)表示药物粒子直径以升序累积的且其结果到达10%所在的点的粒子直径。d(50)表示药物粒子直径以升序累积且其结果到达50%所在的点的粒子直径。d(90)表示药物粒子直径以升序累积且其结果到达90%所在的点的粒子直径。在此说明书中,d(x)可替选地表示为d(0.x),且d(x)及d(0.x)可互换。例如,d(50)表示为d(0.5),且d(10)以及d(90)分别表示为d(0.1)以及d(0.9)。当粒径分布d(x)表示相对于总累积粒子的百分比时,用作基准的数量、体积或重量根据使用于测量粒径分布的方法而改变。测量粒径分布的方法以及与其相关的类型%在该相关领域中为已知。例如,当用已知的激光衍射法测量粒径分布时,d(x)的x值表示根据体积平均计算的百分比。本领域技术人员已知,通过特定方法所得到的粒径分布测量结果与从基于通过常规实验的经验的其它技术得到的结果具有相关性。例如在激光衍射法中,当密度恒定时,将体积平均粒径设置成与对应于重量平均粒径的粒子的体积对应。在本发明中,为了测量次枸橼酸铋和斯克拉非粒子的平均粒径及粒径分布,可以使用基于mie理论的激光衍射及散射法的市售装置。例如,可使用例如malvern仪器的mastersizer激光衍射装置的市售装置用于测量。此装置用以获得粒子直径分布,使得当氦氖激光束被向粒子发射或蓝色发光二极管向粒子发射光时,引起散射,在检测器中显示光散射图样,并根据mie理论分析该光散射图样。可使用干式法或湿式法中的任一种作为测量方法,但通过湿式法测量的结果示于下面的实施例中。在实施方式中,本发明的药物组合物可具有另外满足下列条件中的至少一种的斯克拉非的粒径分布:1)d(10)为1μm至10μm,2)d(50)为3μm至25μm,3)d(90)为5μm至50μm。在实施方式中,本发明的药物组合物可具有另外满足下列条件中的至少一种的次枸橼酸铋的粒径分布:1)d(10)为5μm至17μm,2)d(50)为20μm至70μm,3)d(90)为40μm至130μm。在另一实施方式中,本发明的药物组合物可具有另外满足下列条件中的至少一种的斯克拉非的粒径分布:1)d(10)为1μm至10μm,2)d(50)为3μm至25μm,3)d(90)为5μm至50μm;以及可满足下列条件中的至少一种的次枸橼酸铋的粒径分布:1)d(10)为5μm至17μm,2)d(50)为20μm至70μm,3)d(90)为40μm至130μm。与斯克拉非和次枸橼酸铋的平均粒径或粒径分布优选在特定范围内不同,对于在本发明的药物组合物中包含的雷尼替丁的粒径并无特别限制。本发明也提供一种药物组合物,其中斯克拉非及次枸橼酸铋的平均粒径或粒径分布在上述范围内,且斯克拉非具有与albistm片剂的斯克拉非的溶解速率等效水平的溶解速率。在此,药物等效试验控制指南可用于确定溶解速率是否显示等效水平。本发明也提供一种药物组合物,其中斯克拉非及次枸橼酸铋的平均粒径或粒径分布在上述范围内,并且与具有相同活性成分剂量的albistm片剂相比,雷尼替丁及次枸橼酸铋显示出生物等效性水平的浓度-时间曲线(auc)下的面积及观察到的血浆浓度最大值(cmax)。在此,药物等效标准可用于确定浓度-时间曲线(auc)的下的面积及观察到的血浆浓度最大值(cmax)是否显示生物等效性水平。例如,当根据药物相关法规的药物等效测试标准的生物等效性测试对基准药物和测试药物的浓度-时间曲线(auc)下的面积以及观察到的血浆浓度最大值(cmax)进行对数转换及统计性处理时,若两项在对数转换平均值差异的90%置信区间方面处于log0.8至log1.25内时,则确定药物等效测试为等效。然而,根据除用于生物等效性之外的指南,当满足如下两个条件时确定为等效:1)当基准药物及测试药物的比较评价项值的对数转换平均值差异在log0.9至log1.11内时,以及2)当根据药物等效测试标准进行比较溶解试验时,在所有限定条件下的结果为等效。同时,作为本发明的药物组合物的活性成分的雷尼替丁、斯克拉非及次枸橼酸铋的含量可以为1重量份至2重量份的雷尼替丁、6重量份至12重量份的斯克拉非以及2重量份至4重量份的次枸橼酸铋,以有效药理地起作用。具体地,优选将本发明的药物组合物制备为包含50mg至300mg的雷尼替丁、240mg至1200mg的斯克拉非及80mg至400mg的次枸橼酸铋,并且特别优选地制备成包含50mg至150mg的雷尼替丁、240mg至600mg的斯克拉非及80mg至200mg的次枸橼酸铋。本发明的药物组合物包含除活性成分的外的至少一种赋形剂。稀释剂增加固体药物组合物的体积,并且使得患者及护理者能够更容易处理包含组合物的药物剂型。用于固体组合物的示例性稀释剂包括微晶纤维素(例如,)、微细纤维素、乳糖、淀粉、预糊化淀粉、碳酸钙、硫酸钙、糖、葡萄糖结合剂(dextrate)、糊精、右旋糖、磷酸氢钙二水合物、磷酸三钙、高岭土、碳酸镁、氧化镁、麦芽糊精、甘露醇、聚甲基丙烯酸酯(例如,)、氯化钙、粉状纤维素、氯化钠、山梨醇及滑石。压缩成例如片剂的剂型的固体药物组合物可包含赋形剂,其有助于在压缩的后使活性成分结合至另一赋形剂。用于固体药物组合物的粘合剂包括阿拉伯树胶、海藻酸、卡波姆(carbomer)(例如,卡波普(carbopol))、羧甲基纤维素钠、糊精、乙基纤维素、明胶、瓜尔豆胶、氢化植物油、羟乙基纤维素、羟丙基纤维素(例如,)、羟丙基甲基纤维素(例如,)、液态葡萄糖、硅酸镁铝、麦芽糊精、甲基纤维素、聚甲基丙烯酸酯、聚维酮(例如,及)、预糊化淀粉、海藻酸钠及淀粉。当将崩解剂添加至组合物时,可在患者的胃中增大压缩固体药物组合物的溶解速率。崩解剂包含羟丙基纤维素、羧甲基纤维素钙、羧甲基纤维素钠(例如,及)、微晶纤维素、甲基纤维素、粉状纤维素、胶体二氧化硅、交联羧甲基纤维素钠、交聚维酮(例如,及)、瓜尔豆胶、硅酸镁铝、波拉克林钾、预糊化淀粉、海藻酸、海藻酸钠、羟基乙酸淀粉钠(例如,)及淀粉。当压缩粉状组合物以制备例如片剂的剂型时,组合物接收来自冲压机及染料的压力。一些赋形剂及活性成分易于黏着至冲压器及染料的表面,这可能造成产物的凹陷及其它表面不规则性。为了降低黏着性及容易地从染料提取产物材料,可向组合物加入润滑剂。润滑剂包括例如硬脂酸镁、硬脂酸钙、硬脂酸铝及硬脂酸锌、单硬脂酸甘油酯、硬脂酸棕榈酸甘油酯、氢化蓖麻油、氢化植物油、矿物油、聚乙二醇、苯甲酸钠、十二烷基硫酸钠、硬脂酰富马酸钠、滑石等硬脂酸盐。为了增加储存稳定性,在安全摄入水平内可加入储存制剂及螯合制剂,例如乙醇、苯甲酸钠、丁基化羟基甲苯、丁基化羟基茴香醚及乙二胺四乙酸。本发明的药物组合物不限于此,但可配制成片剂。在实施方式中,本发明的药物组合物可配制成骨架片剂。根据下列实施例,本发明的药物组合物不被配制成含有核心片剂的片剂内片剂,而是可在控制斯克拉非和次枸橼酸铋的粒径后被配制成骨架片剂。然而,可确认的是,已解决在相关领域中组合制剂的所有问题。包含根据本发明的药物组合物的片剂可另外用包衣剂进行包衣。本发明的实施方式提供一种片剂,其中包括雷尼替丁、斯克拉非和次枸橼酸铋作为活性成分的未包衣片剂被用聚乙烯醇包衣。在下列实施例中,可确定的是,利用聚乙烯醇作为包衣剂进行包包衣,能够确保更优异的稳定性。根据本发明的药物组合物的配制过程将如下例示。将雷尼替丁、斯克拉非和次枸橼酸铋以150:600:200的混合比例制成颗粒。在此,作为粘合剂,可使用羟丙基甲基纤维素、羟丙基纤维素、聚乙烯吡咯烷酮等作为其它粘合剂。此外,在本发明的制备方法中,优选在30℃至60℃的温度下进行干燥,使得颗粒组合物的含水量相对于总重为11%以下,并且最优选在50℃的温度下进行干燥。本发明提供一种治疗胃肠道疾病的方法,其包含:将包含具有上述例示的粒径范围的雷尼替丁、斯克拉非和次枸橼酸铋作为活性成分的药物组合物给药于所需的个体受体;以及一种包含雷尼替丁、斯克拉非和次枸橼酸铋作为活性成分的组合物用于制备用于治疗胃肠道疾病的药物的用途。在本发明中,术语“胃肠道疾病”包括在消化器官中出现的症状或疾病例如发炎和溃疡。例如,胃肠道疾病包括胃溃疡、胃炎、十二指肠溃疡、佐林格-埃利森症候群、逆流性食道炎、麻醉前的药物治疗(预防mendelson’s症候群)、术后溃疡及非类固醇抗炎药物(nsaid)引起的胃十二指肠溃疡,但本发明不限于此。在本发明中,术语“受体”是指温血动物,例如患有特定疾病、失调或疾病的哺乳动物,并且包括例如人类、猩猩、黑猩猩、小鼠、大鼠、狗、牛、鸡、猪、山羊、绵羊等,但本发明不限于此。在本发明中,术语“治疗”包括缓解症状、暂时或永久性消除症状原因、预防或减缓症状的发生以及及疾病、失调或不适的发展,但本发明不限于此。本发明的药物组合物的活性成分的有效剂量是指治疗疾病所需的量。因此,有效剂量可根据以下多种因素进行调整:例如疾病类型、疾病严重度、活性成分以及包含在组合物中的其它成分的类型及含量、剂型的类型、患者的年龄、体重、通常的健康状况及性别、饮食、给药时间、给药途径、成分的释放速率、治疗周期以及同时使用的药物。例如,本发明的药物组合物可一天给药一次至三次,且一次可给药基于雷尼替丁的50mg至150mg的剂量,但本发明不限于此。有益效果根据本发明,当制备雷尼替丁、斯克拉非及次枸橼酸铋的组合药物时,可以制备一种组合药物,其通过控制斯克拉非及次枸橼酸铋的粒径而能够解决雷尼替丁的吸湿性和制剂稳定性问题,并且具有简单的制备过程和优异的生物可利用性。附图说明图1及图2示出在给药了制备例12、制备例15及制备例16与制备例14及17的片剂的受体血浆中的次枸橼酸铋的平均浓度的变化。图2示出图1的放大图。图3至图5示出在给药了制备例12、制备例15及制备例16的片剂的受体血浆中的雷尼替丁的平均浓度改变。具体实施方式将参考下列详细实施例而清楚地理解本发明的优点与特征及其实现方法。然而,本发明不限于以下公开的实施例,而是可以多种不同形式实施。提供实施例是用于对本领域技术人员充分地解释本发明且充分地解释本发明的范围。本发明的范围由所附权利要求限定。[实施例]实施例1:斯克拉非及次枸橼酸铋的粒径的调整将表1的微粒化之前的具有原料粒径的雷尼替丁、斯克拉非及次枸橼酸铋用于实验。【表1】在微粒化之前的原料粒径粒径分布雷尼替丁斯克拉非次枸橼酸铋d(10)2.59μm21.172μm18.565μmd(50)8.55μm75.135μm72.380μmd(90)20.74μm176.62μm195.559μm平均10.54μm89.154μm95.563μm利用粒径测量装置(malvernmastersizer2000/hydros)在下列条件下根据湿式法测量原料粒径。<粒径分布测量条件>装置:激光衍射粒径分布测量装置malvernmastersizer2000/hydros(malvern)湿式单元:hydro2000s使用样品量:1g样品折射系数:1.520样品测量时间:10秒背景测量时间:10秒分析模式:一般用途计算灵敏度:正常粒子形状:不规则分析范围:0.020μm至2000μm将雷尼替丁在没有特定的粒径调整下直接用于实验。将斯克拉非及次枸橼酸铋利用z磨机及研磨器或利用筛孔进行微粒化以调整粒径。在微粒化后,根据平均粒径及粒径分布,将斯克拉非及次枸橼酸铋的原料分类成斯克拉非1至斯克拉非6及次枸橼酸铋1至次枸橼酸铋5,并在下列表2及表3中描述。【表2】在微粒化之前及之后的斯克拉非的粒径分布【表3】在微粒化之前及之后的次枸橼酸铋的粒径分布制备包含具有不同原料粒径组合的雷尼替丁、斯克拉非及次枸橼酸铋的制剂,以选择能够确保制剂稳定性、适当的药物溶解速率及生物可利用性的药物的粒径。因此,在下面的实施例中,根据表4的组成使用及配制具有不同粒径组合的原料并然后进行实验。【表4】包括雷尼替丁、斯克拉非及次枸橼酸铋的片剂的组成(wt%)实验例1:斯克拉非的粒径的调整为了根据斯克拉非的粒径调整来验证斯克拉非的溶解速率改变,如表5所示,根据表4的组成使用及配制具有粒径组合的原料,其中仅改变斯克拉非的粒径,同时雷尼替丁及次枸橼酸铋的粒径固定,并然后进行实验。【表5】雷尼替丁、斯克拉非及次枸橼酸铋的粒径组合除了原料具有不同的粒径的外,根据如表4所示的相同组成,根据通常方法利用纯水(或纯水及乙醇的混合溶剂)以制备干式颗粒或湿式颗粒、在50℃下干燥并然后过18目筛。然后,将制备的颗粒进行压片及包衣以制备骨架片剂。用3%pva进行包衣。最后,得到黄绿色矩形膜包衣片剂。将制备例1至制备例6的片剂用于进行斯克拉非的比较溶解测试。由于斯克拉非不是在体内被吸收,因此不进行生物等效性测试,但可替选地使用比较溶解结果。使用albistm片剂作为基准药物(可商购自daewoongpharmaceuticalco.,ltd)。根据第1部分第1节第3条(药物等效试验控制指南)(article3,section1,no1(theguidelinesfordrugequivalencetestcontrol))进行比较溶解测试。使用具有ph1.2的溶解溶液。根据韩国药典指南(koreanpharmacopeiaguideline)的溶解测试(第二方法(桨法)),在37±0.5℃的温度的溶解溶液及50rpm下进行hplc方法2小时。#溶解装置-制造商:varian-型号名称:vk7025vk8000-hplc分析法-hplc设备:沃特斯(waters)-分析柱:氨基丙基甲硅烷基硅胶(4.6×250mm,5μm)-移动相:缓冲溶液:乙腈=9:(利用0.45μm的膜过滤器的过滤器)(缓冲溶液:得到79.3g的硫酸铵、输入1000ml的水并然后以磷酸调整ph至3.5)-柱温:25℃-流速:1.0ml/分钟-探测器:差示折射计-注入体积:50μl【表6】斯克拉非的比较溶解测试结果如上所述进行比较溶解测试。结果如表6所示,验证了,使用了具有如斯克拉非4至斯克拉非6表示的粒径的斯克拉非的制备例4至制备例6的片剂,显示出斯克拉非的溶解速率等效于基准药物的溶解速率。作为等效测定标准,当根据第1节第21条(药物等效测试控制指南)进行比较时,如果基准药物的平均溶解速率在限定测试时间的内为85%以上,并且测试药物在基准药物的平均溶解速率为约40%及85%的两个时间点的平均溶解速率为基准药物的平均溶解速率的±15%的内,则定义为等效。实验例2:次枸橼酸铋的粒径的调整基于实验例1的结果,定义了将具有如表2的斯克拉非4至斯克拉非6表示的粒径的原料优选用作斯克拉非。因此,将斯克拉非的粒径固定成“斯克拉非6”的粒径,并然后调整次枸橼酸铋的粒径以根据铋的粒径评价片剂的稳定性。使用具有表7的粒径组合的原料且根据表4的组成配制,并然后进行实验。【表7】雷尼替丁、斯克拉非及次枸橼酸铋的粒径组合除了原料具有不同的粒径的外,根据如表4所示的相同组成,根据通常方法利用纯水(或纯水及乙醇的混合溶剂)将雷尼替丁、斯克拉非及次枸橼酸铋制备成干式颗粒或湿式颗粒、在50℃下干燥并然后过18目筛。然后,将制备的颗粒压片并制备为骨架片剂,并评价室温稳定性。结果,如表8所示,验证了,如在制备例8、制备例9及制备例10的特定粒径下具有令人满意的特性及含水量。这表示,当雷尼替丁与次枸橼酸铋混合时次枸橼酸铋改变雷尼替丁的物性的问题得以解决,这被认为是因为以特定粒径抑制了药物间的物理相互作用。【表8】雷尼替丁、斯克拉非及次枸橼酸铋的组合药物的室温稳定性测试结果据观察,制备例8、制备例9及制备例10的制剂的粒径组合解决了由于次枸橼酸铋改变雷尼替丁的物理特性的问题。为了另外确认组合物在制剂稳定性、水分吸收及生物可利用性的方面是否适宜,接着进行实验。实验例3:用于选择包衣剂的比较稳定性测试基于制备例9的未包衣片剂,为了避免雷尼替丁的额外含水量,进行用于选择包衣剂的测试。将制备例9的未包衣片剂用聚乙烯醇(pva)(制备例12)及hpmc(制备例13)(3wt%用于未包衣片剂)包衣。然后,对包衣片剂进行室温稳定性测试。结果,其可验证两个样品具有适宜的特性,但是用pva包衣的制备例12的片剂在含水量测试方面无显著变化并显示出优异的防潮效果。【表9】用于选择包衣剂的比较稳定性测试结果基于上述进行的测试,选择pva作为包衣剂,且将制备例7、制备例8、制备例10及制备例11的未包衣片剂用3wt%pva包衣,以制备制备例14、制备例15、制备例16及制备例17的包衣片剂。然后,将这些包衣片剂用于进行以下实验例。实验例4:制剂稳定性的评价对制备例12、制备例14、制备例15、制备例16及制备例17的包衣片剂进行室温/加速的稳定性测试。结果示于表10。观察到,制备例12、制备例15及制备例16的片剂的特性及含量、崩解测试相对于标准具有适宜的结果。在制备例14及制备例17中,特性为不佳,且因此中止随后的含量及崩解测试。【表10】室温/加速的稳定性测试结果实验例5:制剂中的含水量根据药物粒径的变化使用制备例12、制备例14、制备例15、制备例16及制备例17的包衣片剂进行如下的含水量测试。在室温下进行测试6个月。为了测定含水量,使用根据韩国药物指南的通常测试方法中的卡尔费休法(karlfishermethod)作为水分测定方法。实际上是利用将水与碘及二氧化硫在低级醇(例如甲醇)与有机碱(例如吡啶)的存在下进行定量地反应,使用用于水分测定的甲醇作为用于水分测定法的试剂。通过研磨片剂得到样品且将其约200mg用于测试。【表11】包衣片剂的含水量测试结果如表11的结果所示,制备例12、制备例15及制备例16的片剂对于含水量标准为适宜。然而,制备例14及制备例17的片剂在6个月的室温稳定性测试下具有不佳的特性,且因此不进行另外的水分测试。基于此结果,验证了,斯克拉非以及次枸橼酸铋的粒径抑制了雷尼替丁的含水量,且通过pva包衣能够确保产物更加优异的稳定性。实验例6:根据粒径的差异的pk测试结果将制备例12、制备例14、制备例15、制备例16及制备例17的包衣片剂用于进行健康受体的pk测试。相对于两个比较评价项目的auc及cmax的对数转换值,用次枸橼酸铋及雷尼替丁进行变量分析。作为药物等效标准,当根据药物相关法规的药物等效测试标准的生物等效性测试对基准药物及测试药物的浓度-时间曲线(auc)的下的面积及观察到的血浆浓度最大值(cmax)进行对数转换及统计处理时,若两项在对数转换平均值差异的90%置信区间方面处于log0.8至log1.25内,则确定药物等效测试为等效。然而,根据除用于生物等效性之外的指南,当满足如下两个条件时确定为等效:1)当基准药物及测试药物的比较评价项值的对数转换平均值差异在log0.9至log1.11内时,以及2)当根据药物等效测试标准进行比较溶解试验时,在所有限定条件下的结果为等效。使用albistm片剂(可购自daewoongpharmaceuticalco.,ltd)作为基准药物。图1和图2为综合图表,其统计性地示出了由给药了制备例12、制备例14、制备例15、制备例16及制备例17的片剂的个体的血液中药物浓度数据获得的次枸橼酸铋的浓度-时间曲线(auc)的下的面积及观察到的血浆浓度最大值(cmax)的生物可利用性参数。图3至图5为图表,其统计性地示出了由给药了制备例12、制备例15及制备例16的片剂的个体的血液中药物浓度数据获得的雷尼替丁的浓度-时间曲线(auc)的下的面积及观察到的血浆浓度最大值(cmax)的生物可利用性参数。在制备例12、制备例15及制备例16的片剂中以及制备例14及制备例17的片剂中,雷尼替丁及斯克拉非的粒径相同,赋形剂及包衣剂也相同,但仅次枸橼酸铋的粒径不同。基于图1及图2的pk测试结果,能够验证,生物可利用性根据次枸橼酸铋的粒径不同。亦即,可以验证其中次枸橼酸铋通过粒径具有适宜的生物可利用性,且能够验证另外测试的雷尼替丁的生物可利用性也是等效的。将制备例12的片剂的pk测试结果与基准药物的pk测试结果进行比较。结果,在次枸橼酸铋中,auc为0.8749至1.1967,且cmax为0.8681至1.12342。因此,确定pk为等效。在雷尼替丁中,auc为0.9282至1.1213,cmax为0.9282至1.1539,因此其亦为等效。基于制备例15的片剂的pk测试结果,在次枸橼酸铋中,auc为0.7672至1.1624且cmax为0.7717至1.1633。由于下限为不佳,因此pk为非等效。然而,根据用于等效之外的指南确认等效性。在雷尼替丁中,auc为0.9029至1.0108,cmax为0.8151至1.0280,因此其为等效。基于制备例16的片剂的pk测试结果,在次枸橼酸铋中,auc为1.1058至1.2785且cmax为1.0545至1.3188。由于上限为不佳,因此pk为非等效。然而,根据用于生物等效性之外的指南确认等效性。在雷尼替丁中,auc为0.9085至1.0084,cmax为0.8912至1.0411,因此其为等效。同时,基于制备例14的片剂的pk测试结果,在次枸橼酸铋中,auc为0.5906至0.7805,且cmax为0.4538至0.6794。由于下限为不佳,因此pk为非等效。同时,基于制备例17的片剂的pk测试结果,在次枸橼酸铋中,auc为1.8565至2.7649,且cmax为2.0868至3.1544。由于上限为不佳,因此pk为非等效。因此,可确定的是,制备例12、制备例15及制备例16的片剂通过适当地调整斯克拉非及次枸橼酸铋的粒径而抑制了雷尼替丁的含水量,且能够用作抑制因药物混合而造成的物性改变的组合药物,并提供优异生物可利用性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1