用于实体瘤治疗的可生物降解的药物洗脱微球的制作方法
依照美国法典第35章第119条,本申请要求由曾红霞(hongxiazeng等人)于2015年1月5日提交的美国临时专利申请第62/099,719的优先权。前述专利申请的全部内容以参考的方式并入本文中并且用于所有目的。
本申请涉及医疗装置的领域。更具体地,本申请涉及用于血管的封堵和/或将药物输送给患者的装置和方法。
背景技术:
栓塞术牵涉到血管的部分或完全封堵,从而限制经过血管的血液流动。血管的有意图封堵(“治疗性栓塞”)可用于治疗多种血管性和非血管性病况,包括脑动脉瘤和周围性动脉瘤、脑动静脉畸形、子宫肌瘤,并且可用于减小流动到实体瘤(包括肝肿瘤)的血流量。栓塞可通过任意数量的方式而实现,包括通过聚合物微球的使用。
在典型的栓塞术中,首先经过总动脉给予局部麻醉。然后,将该动脉穿刺,再将导管插入并利用荧光透视法引导入感兴趣的区域。通过经过导管注射造影剂而执行血管造影,由此使在导管远端的下游位置的动脉树部分可视化。一旦导管被定位在其中需要沉积栓塞组合物或栓塞剂的部位,则经过导管使该栓塞组合物或栓塞剂沉积。通常基于要被封堵血管的尺寸、封堵的期望持续时间、和/或被治疗疾病或病况的类型、及其它因素来选择栓塞剂。在将栓塞剂输送至在要被封堵的血管内部的部位之后,可以执行后继的血管造影,以判断封堵的特异性和完全性。
栓塞微球通常是由合成聚合物所构成,包括但不限于:聚乙烯醇(pva)、缩醛化聚乙烯醇(例如,contoursetm栓塞剂,bostonscientific公司,美国麻萨诸塞州纳提克市)、和交联丙烯酸水凝胶(例如,
虽然载药微球具有若干有用的特性,但它们也具有若干限制因素。例如,市售的药物洗脱微球通常是生物稳定的,并且往往会停留在原地,甚至在它们已传输了大部分的其药物预加载之后。而且,它们相对较快地传输那些药物预载物:目前可获得的用化疗药物加载的药物洗脱微球的体外测试表明,这些微球在约5小时内在单次突释中释放全部或大部分的其药物预载物;在其中希望延长的局部给药的情况下,该快速药物释放可导致短暂但高度的全身给药。另外,目前销售的药物洗脱微球不必是存贮稳定的,并且必须在它们被使用前不久用药物进行加载。最后,目前批准的微球产品通常局限于输送阳离子药物,这意味着仅窄子集的化疗药物(阿霉素和依利替康)适合于目前使用的微球。
技术实现要素:
本发明,在其各种方面,通过提供在约1个月至约1年范围内的时间区间中发生降解并且在2-4周至1或多个月范围内的时间区间中洗脱药物的聚乳酸-羟基乙酸共聚物(plga)微球,而克服了用于栓塞的现有药物洗脱微球的缺点。这些微球优选地是用亲脂性药物(例如紫杉醇(“ptx”)进行加载,该亲脂性药物是在颗粒的制造期间被加入到plga聚合物相,并且在使用前为存贮稳定达数月的时间段。
在一个方面,本发明涉及一种包含plga50∶50和ptx(或者在一些情况下基本上由plga50∶50和ptx组成)的聚合物微球,其中plga和ptx两者大体上均匀地分布(即,在整个微球中它们的浓度是大致相同的)。该聚合物微球可以具有光滑的表面,并且可包含具有5,600、16,000或8300道尔顿的平均分子量的plga。ptx可从微球中以多种方式被体外释放,包括在大约3周的时间段中、在约2天或更少内的初始突释中、并且/或者作为在15-20天内的稳态过程。在一些情况下,可以通过其中将ptx和plga于有机相中共同地乳化的乳化工艺而形成微球。可以含有5-10重量%的ptx(即,它们可以含有5wt%、10wt%、或者在这两个值之间的任意值的ptx)的微球可使用于用于肿瘤(例如肝细胞癌)治疗的一些情况,并且可以是套件的一部分,在这种情况下将微球布置在容器中,该容器含有气体(例如氩气或氮气)并且任选地与具有尺寸被设计成允许聚合物微球流入的孔的注射器一起包装。本发明的套件(可以采用具有上述特征的任意组合的微球)也可以包括用于执行包括将聚合物微球置于体腔内部的步骤的方法的书面指导集。
在另一个方面,本发明涉及一种对患者进行治疗的方法,该方法包括将包含plga50∶50和ptx(或者在一些情况下,基本上由plga50∶50和ptx组成)的聚合物微球置于患者体腔中的步骤,该体腔可以是(除其它以外)给肝细胞癌提供血液的血管。例如,可以通过使聚合物微球在悬浮液中经过导管流入血管中而传递聚合物微球,并且该方法还可包括利用荧光透视法使在血管内部的聚合物微球成像、和/或至少部分地将血管封堵的步骤。
附图说明
下面参考以下的附图来描述本发明的各方面,在附图中用类似的附图标记来标示类似的元件,并且其中:
图1示出了根据本发明的一个实施方式的药物洗脱微球的扫描电子显微照片(sem)。
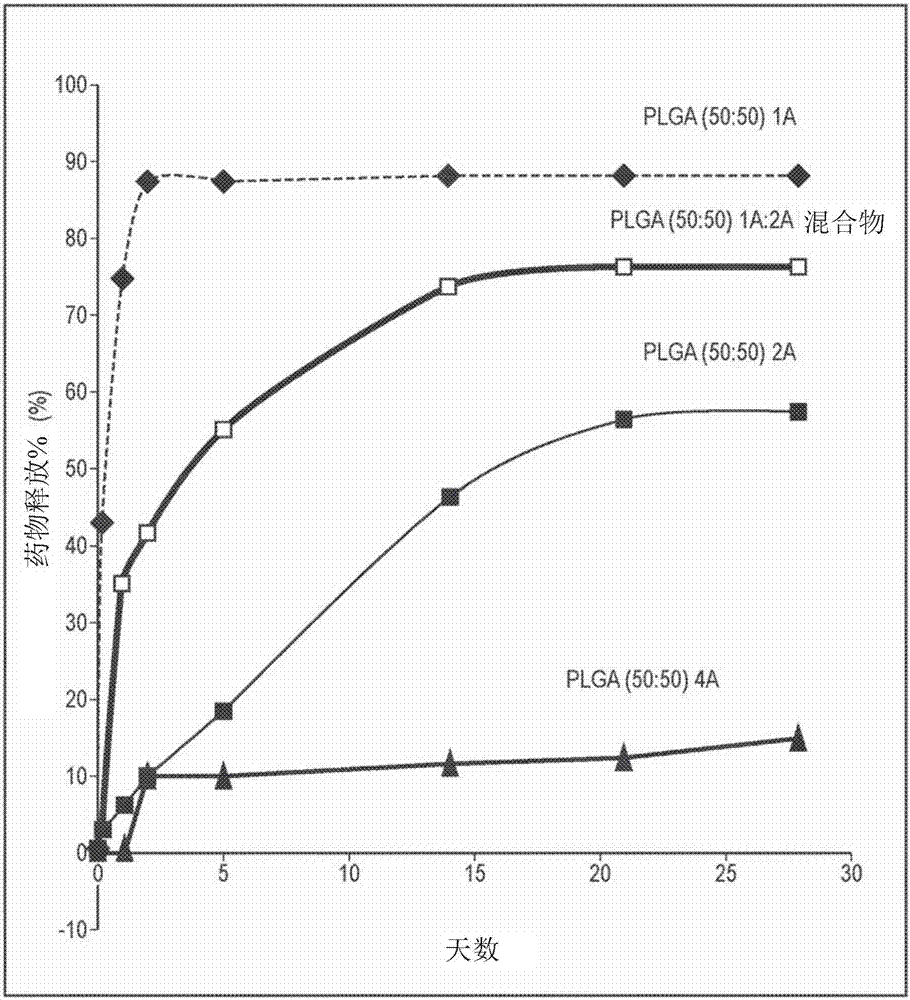
图2示出了根据本发明的微球的体外药物洗脱曲线,该药物洗脱微球包含平均分子量为5,600da(“1a”)、16,000da(“2a”)或50,000da(“4a”)的50∶50plga聚合物相。
图3a至图3c示出了使用本发明的药物洗脱微球的猪肾的栓塞效果,该药物洗脱微球包含仅聚合物(图3a)、聚合物和5%紫杉醇(图3b)或10%紫杉醇(图3c)。
图4a和图4b示出了根据本发明的不透射线药物洗脱微球的低放大倍数(图4a)和高放大倍数(图4b)计算机断层扫描(“ct”)图像。
除非在下面的说明书中另有说明,附图未必按比例绘制,并且重点是放在对本发明原理的说明上。
具体实施方式
微球的概述:
在本发明中所公开的药物洗脱微球是基于生物相容性的、亲水性的、且无毒的聚合物。这些微球可以具有基于它们的期望用途的任何合适的尺寸或形状,即使在优选实施方式中微球是用一个或多个的以下特征来表征:它们可经过18号或更小的针进行注射,它们通常呈球形,并且能够发生侵蚀、水解,并且/或者通过内生过程(例如吞噬作用)而被再吸收或降解。
虽然本发明的优选实施方式采用plga50∶50,但也可以使用任何合适的聚合物或共聚物组合物(包括但不限于含有plga85∶15、75∶25、50∶50和聚乳酸(“pla”)的组合物),该组合物遵循以下优先条件:首先,该聚合物优选地能够利用乳化工艺而形成微球;第二,该聚合物优选地是治疗剂(例如小分子药物)与之相容的聚合物;第三,该聚合物优选地是生物相容性的。优选的聚合物通常是疏水性的,以便于药物在身体内部的延长的驻留和释放。
根据本发明各种实施方式的药物洗脱微球具有可以在制造过程期间通过改变一个或多个生产变量而稍微变化的药物释放动力学,所述生产变量包括:(1)所使用plga聚合物的平均分子量,(2)在制造期间最初被加载入颗粒中的药物的量(可表示为用于形成微球的聚合物相的总质量的分数;即wt%),和(3)颗粒的尺寸(小颗粒通常具有更大的表面积-体积比,由此允许药物更快地从颗粒中扩散出)。药物的释放通常也随着聚合物的降解速率而变化,因为更快的降解速率往往将会导致更快的药物释放。一般来说,乙交酯与丙交酯的比例越大,微球的降解就越快,因此药物的释放越快。另外,通过包含赋形剂,例如聚乙烯吡咯烷酮(“pvp”),可以调整药物释放速率。
在使用中,本发明的微球和栓塞组合物是用于将期望栓塞和药物治疗的任何结构或区域加以栓塞并且任选地将药物传递至该结构或区域。在一些情况下,微球不包含任何治疗剂,而仅仅是用于将实体瘤或者在肝、子宫、前列腺、肾等中的生长加以栓塞。例如,没有任何药物加载的本发明的plga微球可用于将部分或全部的前列腺加以栓塞,从而治疗良性前列腺增生。
然而,在优选的实施方式中,plga/ptx微球用于将肝细胞癌或在肝中生长的另一种肿瘤加以栓塞并且将ptx传递至肝细胞癌或在肝中生长的另一种肿瘤。在其它情况下,微球(加载了ptx或另一种药物)用于治疗在不同区域(例如口腔和/或颈、肾、胰腺、乳房、肺、和前列腺)中的一种或多种其它实体瘤类型。在这些情况下,可以基于肿瘤的类型和位置,对尺寸和药物加载量进行调整。
最后,除使用化学治疗药物或抗增殖药物的各种癌症治疗之外,本发明的微球也可以用任何其它治疗剂(例如镇痛药)进行加载,以便止痛药物的局部输送。可以加载入本发明微球中的其它药物包括但不限于:酮咯酸、坦索罗辛、依维莫司和索拉非尼。
实施例
在以下的非限制性实施例中进一步说明了本发明的原理:
实施例1.plga/ptx微球的制备
单乳化法可以用于plga/ptx微球制备。首先,以10-30%的浓度将plga和ptx溶解入二氯甲烷溶剂,然后在适当的搅拌下将此溶液加到0.2%pva水溶液中以形成“液滴”。随后,将此液滴转移至0.02%pva的水溶液,以便通过从聚合物相中除去二氯甲烷溶剂而进一步使微球“硬化”;该硬化步骤持续达数(例如2-6)小时,接着用水清洗而除去pva,之后在室温下将微球真空干燥一夜(例如10-14小时)之前。所形成的微球主要地(即,基本上)是由plga和ptx组成。它们的粒度分布是在50微米至250微米的范围内。基于该制剂中所采用的聚合物与药物比,在微球内部的药物加载量可以在0至90%的范围内。用于微球形成的plga包括具有各种分子量的plga50∶50、plga75∶25、和plga85∶15。图1示出了plga/ptx微球的扫描电子显微镜(sem)图像。
实施例2.plga/ptx微球的药物释放曲线
为了证明可以对本发明的微球的药物释放曲线和持续时间进行调整,对由不同分子量等级的plga(1a、2a和4a)所构成微球的体外药物洗脱进行了测量。将不同等级的plga对药物释放曲线的影响总结于图2中,该附图表明虽然由不同等级plga所制成的微球都表征为某种程度的突释以及稳态释放,但在给定的时间点由微球所释放药物的量(用wt%表示)往往会随着所使用plga的分子量增大而减小。该减小影响药物释放的初始突释以及接下来的较慢稳态药物释放这两者。如附图中所示,非常少的药物从由4aplga所构成的微球中洗脱,同时在1a微球中几乎全部的药物内容物在单次快速突释中洗脱。令人感兴趣地,由2aplga所构成的微球具有相对较小程度的突释但具有长时间段(~20天)的稳态释放,而由1a和2a的50/50混合物所制成的微球表现为突释和约15天的稳态释放这两者。
实施例3.在动物研究中的体内栓塞和药物作用
将仅聚合物的微球(plga50∶504a)和药物加载微球(将5%和10%的药物加载到plga50∶501a∶2a混合物制剂中)注射入猪的肾,以评估它们的体内作用。在第30天将肾外植,从而研究微球栓塞和药物作用的总体效果。图3a-图3c表明所有三个微球组合物导致某种程度的坏死,但加载5%和10%ptx的微球至少定性地显示与仅聚合物的微球相比更大程度的坏死。
实施例4.不透射线微球的制备和评估
除了将碘化油连同plga溶解于二氯甲烷(dcm)以提供~40%(wt/wt)的在微球中的碘化油加载量外,其余以实施例1中所描述的方式制备微球。将微球注射入猪的肝和肾并且利用2dct进行死后成像。图4示出了在肾中的微球的ct图像。如该图像表明,微球可容易地看见并且似乎将其中已沉积微球的血管完全地封堵。
本文中所使用的短语“和/或”已被理解成表示如此联接的元件中“一个或两个”,即,在一些情况下结合地存在而在其它情况下分离地存在的元件。除具体地由“和/或”从句所确定的元件外,其它元件可任选地存在,无论是否与具体确定的元件有关或者无关,除非明确地指出相反的情况。因此,作为一个非限制性例子,对“a和/或b”的引述,当结合开放式语言(例如“包括”)使用时,可以在一个实施方式中指有a无b(任选地包括除b外的元件);在另一个实施方式中指b无a(任选地包括除a外的元件);在又一个实施方式中指代a和b两者(任选地包括其它元件)等。
术语“基本上由……组成”表示排除促成功能的其它材料,除非本文中另有规定。但是,这种其它材料可共同地或单独地以痕量而存在。
本说明书中所使用的术语“大体上”或“大约”表示加或减10%(例如,重量%或体积%),在一些实施方式中表示加或减5%。在整个本说明书中,对“一个实施例(oneexample)”、“一个实施例(anexample)”、“一个实施方式(oneembodiment)”或“一个实施方式(anembodiment)”的引述表示结合该实例所描述的特定的特征、结构、特性被包括在本发明的至少一个实施例中。因此,短语“在一个实施例中(inoneexample)”、“在一个实施例中(inanexample)”、“一个实施方式(oneembodiment)”或“一个实施方式(anembodiment)”在整个本说明书中各种位置的出现未必都是指代相同的实施例。此外,在本发明的一个或多个实施例中,可以以任何合适的方式将特定的特征、结构、例行程序、步骤、或特性加以组合。本文中所提供的标题只是为了方便的目的,而并非意图限制或解释要求专利保护的本发明的范围或含义。
上面已描述了本发明的某些实施方式。然而,应明确地指出的是,本发明并不局限于这些实施方式,相反意图是对本文中明确描述内容的添加和修改也包括在本发明的范围内。此外,应当理解的是,本文中所描述各种实施方式的特征并非是相互排他的,并且在不背离本发明的精神和范围的前提下可以存在各种组合和变更,即使这种组合或变更在本文中未有表述。实际上,在不背离本发明的精神和范围的前提下,本文中所描述内容的变型、修改和其它实施例对于本领域技术人员而言将是显而易见的。因此,本发明不应仅由前面的说明性描述所限定。
- 还没有人留言评论。精彩留言会获得点赞!