低分子量肽或蛋白质的纳米沉淀物的制备方法与流程
本发明涉及肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子(优选二价金属离子)纳米共沉淀物的非变性制备方法,其中肽或蛋白质具有低分子量,并且涉及可通过这种方法获得的纳米沉淀物或纳米共沉淀物。本发明还涉及一种药物组合物,特别是控释药物组合物,其包含所述纳米沉淀物或纳米共沉淀物,并且涉及所述药物组合物在人和动物健康领域中的用途。
背景技术:
肽和蛋白质是复杂的,高度有机化的结构,对它们的环境高度敏感,并且可容易地变性。肽或蛋白质的变性通常导致活性的确定性或暂时性丧失。然而,迄今已知的用于沉淀肽或蛋白质的方法是引起变性的,因为它们包括对肽/蛋白质的结构潜在有害的条件,因此使它们失去活性,诸如高温,快速搅拌或与疏水性表面、水性/有机界面或洗涤剂接触的条件。
肽或蛋白质,特别是治疗性肽或蛋白质的纳米沉淀使得能够例如改善它们在受体生物体中的释放特征及它们的生物利用度。它还能实现浓缩的肽/蛋白质悬浮液的冻干和高度富集肽或蛋白质同时具有低的或没有粘度的药物组合物的制备,所述药物组合物包括在不存在变性聚集的情况下获得的纳米沉淀物。
在文献中存在蛋白质纳米沉淀的方法,例如蛋白质去溶剂化技术,其产生尺寸通常大于一微米的蛋白质沉淀物。然而,这些方法通常导致蛋白质的变性,或不可能在没有所必需的除了非溶剂之外的聚合物的情况下获得蛋白质沉淀物。
例如,专利申请wo2009/043874公开了一种制备平均直径为50至200nm的泊洛沙姆-蛋白纳米颗粒的方法,其中蛋白质的分子量优选高于8kda,并且不变性。所述纳米颗粒是泊洛沙姆-蛋白复合物;因此除了非溶剂之外的另外的聚合物是获得它们所必需的。
因此,亟需开发用于低分子量肽或蛋白质的非变性纳米沉淀的技术,所述低分子量肽或蛋白质不与促进它沉淀或与金属离子(优选二价金属离子)共沉淀的另一分子复合。肽或蛋白质优选是治疗性肽或蛋白质,例如胰岛素。
技术实现要素:
在本发明的上下文中,本发明人发现了一种分子量为20kda或更低,优选15kda或更低,有利地为10kda或更低,更有利地为8kda或更低的肽或蛋白质的纳米沉淀物的非变性制备的新方法,使得能够获得非变性肽或蛋白质的纳米沉淀物,或所述非变性肽或蛋白质和金属离子(优选二价金属离子)的纳米共沉淀物,可将其掺入药物组合物中,优选控释药物组合物中。
本发明能够在温和、非变性条件下获得低分子量肽或蛋白质的纳米沉淀物或低分子量肽或蛋白质和金属离子的纳米共沉淀物。它包括接触低分子量肽或蛋白质的溶液,肽或蛋白质的有机非溶剂,例如选自低分子量聚乙二醇或聚乙二醇衍生物的有机二醇,特别是peg550,以及选自己二醇、丁烷-1,4-二醇、戊烷-1,5-二醇、乙基己二醇、2-甲基戊烷-2,4-二醇(己二醇)、3-环戊烯-1,2-二醇、顺-4-环戊烯-1,3-二醇、反-1,4-二噁烷-2,3-二醇、1,3-二噁烷-5,5-二甲醇、(3s,4s)-吡咯烷-3,4-二醇、(3r,4r)-(-)-1-苄基-3,4-吡咯烷二醇、(3s,4s)-(+)-1-苄基-3,4-吡咯烷二醇、3-环戊烯-1,2-二醇、2-甲基-丁烷-1,3-二醇的有机二醇。
根据本发明的纳米沉淀方法能够获得可用作用于单次肠胃外施用的药用产品的肽或蛋白质纳米沉淀物或纳米共沉淀物,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用之后的血浆浓度在治疗窗内的持续时间。因此,根据本发明的纳米沉淀能够控制肽或蛋白质的释放速率,特别是为了获得生物活性形式的肽或蛋白质的缓释持续至少2天,优选2天至几个月。
根据本发明的纳米沉淀还能够制备高度富集所述肽或蛋白质同时具有低粘度的药物组合物。药物组合物的低粘度,特别可用于其肠胃外施用,特别是其非静脉内肠胃外施用。
在第一方面中,本发明涉及平均直径小于1μm的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物的非变性制备方法,其包括以下步骤:
a)制备肽或蛋白质的水溶液、肽或蛋白质的非溶剂以及任选的水溶性金属盐的混合物;
b)温和搅拌在步骤a)中获得的混合物;
c)固液分离在步骤b)中获得的混合物;和
d)任选地,收集肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共淀物,
其中所述肽或蛋白质的分子量为20kda或更低,优选为15kda或更低,有利地为10kda或更低,更有利地为8kda或更低,并且所述非溶剂选自分子量小于2000da,有利地为200至2000da,更有利地为550da的聚乙二醇或聚乙二醇衍生物,以及选自己二醇、丁烷-1,4-二醇、戊烷-1,5-二醇,乙基己二醇、2-甲基戊烷-2,4-二醇(己二醇)、3-环戊烯-1,2-二醇、顺-4-环戊烯-1,3-二醇、反-1,4-二噁烷-2,3-二醇、1,3-二噁烷-5,5-二甲醇、(3s,4s)-吡咯烷-3,4-二醇、(3r,4r)-(-)-1-苄基-3,4-吡咯烷二醇、(3s,4s)-(+)-1-苄基-3,4-吡咯烷二醇、3-环戊烯-1,2-二醇、2-甲基-丁烷-1,3-二醇的有机二醇。
在本发明的上下文中,“非变性制备方法”意思是不会使所述肽或蛋白质变性的肽或蛋白质的纳米沉淀或纳米共沉淀的方法。因此,根据本发明的纳米沉淀或纳米共沉淀的方法能够获得保留它们的正常三维构象以及它们的完整性及它们的生物活性的肽或蛋白质。优选地,根据本发明的方法能够获得其中85%,特别是90%,更特别是100%的蛋白质或肽不变性的肽或蛋白质纳米沉淀物或纳米共沉淀物。更优选地,根据本发明的方法能够获得其中100%的蛋白质或肽不变性的蛋白质或肽纳米沉淀物或纳米共沉淀物。
在本发明的上下文中,“肽或蛋白质纳米沉淀物”意指平均直径小于1μm,有利地为5nm至500nm,更有利地为5nm至200nm,甚至更有利地为5nm至170nm,特别地为5nm至150nm的颗粒,这是一种或多种肽和/或一种或多种蛋白质在非溶剂中沉淀的结果。根据本发明的肽或蛋白质纳米沉淀物基本上由(多种)肽或(多种)蛋白质组成。
根据有利的实施方案,根据本发明的肽或蛋白质纳米沉淀物由大于90%,特别地大于95%,更特别地大于99%的(多种)肽或(多种)蛋白质组成,其余为杂质,例如所使用的非溶剂的杂质。
有利地,本发明涉及一种低分子量肽或蛋白质的纳米沉淀物或低分子量肽或蛋白质和金属离子的纳米共沉淀物的非变性制备方法,平均直径为小于1μm,有利地为5nm至500nm,更有利地为5nm至200nm,甚至更有利地为5nm至170nm,特别地为5nm至150nm。
根据另一方面,本发明涉及肽或蛋白质和金属离子纳米共沉淀物的非变性制备方法,其中所述肽或蛋白质的分子量为20kda或更低,优选15kda或更低,有利地为10kda或更低,更有利地为8kda或更低,并且所述金属离子选自锌(zn)、锰(mn)、镁(mg)、钙(ca)、铁(fe)、锂(li)和铜(cu)。优选地,所述金属离子是选自锌(zn)、锰(mn)、镁(mg)、钙(ca)、铁(fe)和铜(cu),优选锌(zn)或锰(mn)的二价金属离子。
“一价金属离子”意指具有一价的离子,因此可以与另一个离子或分子形成键。例如,一价金属阴离子是相对于它的元素态具有一个附加电子的离子。同样地,一价金属阳离子是相对于它的元素态缺失一个电子的离子。
同样地,“二价金属离子”意指具有二价的离子。例如,二价金属阴离子是相对于它的元素态具有两个附加电子的离子。同样地,二价金属阳离子是相对于它的元素态缺失两个电子的离子。
“肽或蛋白质和金属离子纳米共沉淀物”还称为“肽或蛋白质/金属离子纳米共沉淀物”意指一种或多种蛋白质或肽与金属离子共沉淀的结果。因此,这些纳米共沉淀物基本上由(多种)肽或(多种)蛋白质,所述金属离子和任选地所使用的非溶剂的残留物组成。
“低分子量肽或蛋白质”意指分子量为20kda或更低,优选为15kda或更低,有利地为10kda或更低,更优选为8kda或更低的蛋白质或肽。
肽或蛋白质的有机非溶剂意指蛋白质或肽在其中不可溶的溶剂,其导致沉淀物,优选地纳米沉淀物的形成。
根据本发明的“非溶剂”包括选自分子量小于2000da,有利地为200至2000da,更有利地为550da的聚乙二醇或聚乙二醇衍生物的有机二醇,以及选自己二醇、丁烷-1,4-二醇、戊烷-1,5-二醇,乙基己二醇、2-甲基戊烷-2,4-二醇(己二醇)、、3-环戊烯-1,2-二醇、顺-4-环戊烯-1,3-二醇、反-1,4-二噁烷-2,3-二醇、1,3-二噁烷-5,5-二甲醇、(3s,4s)-吡咯烷-3,4-二醇、(3r,4r)-(-)-1-苄基-3,4-吡咯烷二醇、(3s,4s)-(+)-1-苄基-3,4-吡咯烷二醇、3-环戊烯-1,2-二醇、2-甲基-丁烷-1,3-二醇的有机二醇。优选地,根据本发明的肽或蛋白质的非溶剂选自peg550、三缩四乙二醇(glycofurol)和己二醇((±)-2-甲基-2,4-戊二醇),优选peg550和己二醇。更优选地,根据本发明的肽或蛋白质的非溶剂是peg550。
在本发明的上下文中,表述“低分子量聚乙二醇或聚乙二醇衍生物”是指选自分子量小于2000da,有利地为200至2000da,更有利地为500da的聚乙二醇或聚乙二醇衍生物和己二醇的有机二醇。根据本发明的低分子量聚乙二醇或聚乙二醇衍生物选自peg100、peg200、peg300、peg400、peg550、peg600、peg900、peg1000、peg2000、三缩四乙二醇。优选地,根据本发明的低分子量聚乙二醇或聚乙二醇衍生物选自peg550和三缩四乙二醇,优选地根据本发明的低分子量聚乙二醇是peg550。
在本发明的上下文中,以足够的量使用肽或蛋白质的非溶剂以平均直径小于1μm的纳米颗粒形式沉淀所述肽或蛋白质,或纳米共沉淀所述肽或蛋白质和金属离子。可通过本领域技术人员已知的方法测定肽或蛋白质溶液/肽或蛋白质非溶剂体积比。纳米沉淀或纳米共沉淀产率特别地依赖待转变为纳米沉淀物或纳米共沉淀物的肽或蛋白质的量。实际上,如图1所示,待转变为纳米沉淀物或纳米共沉淀物的肽或蛋白质的量越小,纳米沉淀或纳米共沉淀越容易,且产率越高。待转变为纳米沉淀物或纳米共沉淀物的肽或蛋白质的量的增加可导致产率的降低。
优选地,本发明涉及治疗性肽或蛋白质纳米沉淀物或治疗性肽或蛋白质/金属离子纳米共沉淀物的非变性制备方法。
“治疗性肽或蛋白质”意指任何这样的肽或任何蛋白质,其施用能实现一种或多种病理的治疗。在治疗性肽或蛋白质中,可提及的是酶、细胞因子、生长因子、激素、抗体和凝血因子,以及诊断剂,特别是肽类激素,例如胰岛素和衍生物,胰高血糖素和类似物(胰高血糖素样肽)、生长激素、生长抑素、加压素,降钙素,lhrh(促黄体激素释放激素)激动剂和拮抗剂、acth(促肾上腺皮质激素)、acth-协同肽、促生长激素、促黄体激素、促甲状腺激素、促卵泡激素、间质细胞刺激激素(icsh)、促甲状腺素释放素、促肾上腺皮质素释放素、促生长素释放素、促黄体素释放素(luteoliberin)、催乳激素抑制因子、短杆菌酪肽a、青霉素、短杆菌肽、催产素、疫苗肽及它们的天然和合成衍生物或它们的片段。有利地,本发明涉及一种选自人胰岛素、生长激素、胰高血糖素、肽激素或它们的治疗有效的衍生物或其片段的肽或蛋白质的纳米沉淀物的非变性制备方法。更有利地,本发明涉及一种人胰岛素或其治疗有效的衍生物或其片段的纳米沉淀物或人胰岛素或其治疗有效的衍生物或其片段和金属离子的纳米共沉淀物的非变性制备方法,优选人胰岛素/锌纳米共沉淀物。
肽或蛋白质的表述“治疗有效的衍生物”是指这样的肽或蛋白质,其中一个或多个氨基酸残基已被其他氨基酸残基取代和/或其中肽或蛋白质的一个或多个氨基酸残基已被除去和/或其中一个或多个氨基酸残基已被添加到所述肽或蛋白质。特别地,肽或蛋白质的表述“治疗有效的衍生物”是指peg化、糖基化、乙酰化、磷酸化的衍生物、环状衍生物、偶联至一种或多种天然或合成的脂质、至一种或多种适体、至一种或多种肽序列、至一种或多种核酸(rna或dna)的衍生物,或与具有特征化学结构的支架型结构(例如树枝状大分子和多价结构)偶联的蛋白质或肽。有利地,肽或蛋白质的表述“治疗有效的衍生物”是指peg化、糖基化和乙酰化肽或蛋白质。
肽或蛋白质的“治疗有效的片段”意指比处于天然状态的肽或蛋白质的长度短并且具有有效的治疗活性的多肽、肽或蛋白质的一部分。例如,“胰岛素的治疗有效的片段”意指比处于天然状态的胰岛素蛋白的长度短的胰岛素多肽的一部分,并且具有有效的治疗活性,特别是针对糖尿病。
根据本发明,肽或蛋白质的纳米沉淀或肽或蛋白质和金属离子的纳米共沉淀在宽的温度范围内发生,特别是在-20至37℃的温度下,更特别地在0至20℃的温度下。该温度范围能够限制肽或蛋白质变性的任何风险。
在优选的实施方案中,根据本领域技术人员已知的方法,特别是通过机械或磁力搅拌,更特别地通过以50rpm或更低搅拌,进行温和的搅拌。因此,根据本发明的方法在温和、非变性条件下进行,包括非常低的剪切力(雷诺数低于2000)。
在另一个优选的实施方案中,根据本发明的方法的步骤b)是在a步骤之后,在此期间在0℃至10℃的温度下将混合物有利地在冰浴中冷却1分钟至60分钟。
在另一个优选的实施方案中,根据本发明的方法的步骤c)的固/液分离是离心,特别是在约500至50000g的离心力范围内。同样地,通过膜过滤或切向过滤进行步骤d)的收集纳米沉淀物。
可任选在诸如zncl2、mgcl2、cacl2、mncl2、fecl2、cuso4或licl的水溶性金属盐存在下进行纳米沉淀。优选地,水溶性金属盐是氯化锌(zncl2)或氯化锰((mncl2)。这被称为根据本发明的纳米共沉淀。
有利地,通过形成金属离子/蛋白质(或肽)复合物,联合使用水溶性盐和肽或蛋白质的非溶剂来促进和/或改善肽或蛋白质的沉淀。特别地,盐能够获得更好的沉淀产率,同时在沉淀和再溶解后保持肽或蛋白质的活性。
水溶液的盐浓度可在宽的间隔内变化。对于给定量的肽或蛋白质,在溶液的固定ph,固定的温度和固定的水/水可混溶非溶剂体积比下,本领域技术人员可通过常规实验确定合适的最小盐浓度,通常通过添加增加量的盐直到观察到肽或蛋白质的沉淀。然而,当在水溶性盐存在下进行纳米沉淀时,纳米共沉淀产率依赖肽或蛋白质的量以及盐浓度。如图2、图3、图4和图5所示,当肽或蛋白质的量很少时,纳米共沉淀产率强烈依赖盐浓度并且它随盐浓度的降低而增加。
因此,根据本发明的方法的特征在于,步骤a)的所述混合物还包含至少一种选自zncl2、mgcl2、cacl2、mncl2、fecl2、licl和cuso4,有利地zncl2或mncl2的水溶性金属盐。
本发明还涉及可通过根据本发明的方法获得的蛋白质或肽纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,其中所述肽或蛋白质具有20kda或更低,优选15kda或更低,有利地10kda或更低,更有利地8kda或更低的分子量。
优选地,根据本发明的纳米沉淀物或纳米共沉淀物由大于85%,特别地大于90%,更特别地100%的非变性蛋白质或肽组成。
优选地,根据本发明的纳米沉淀物或纳米共沉淀物具有小于1μm,有利地5nm至500nm,更有利地5nm至200nm,甚至更有利地5nm至170nm,特别地5nm至150nm的平均直径。特别地,收集它们以掺入到合适的药物制剂中。
更具体地,根据本发明的肽或蛋白质纳米沉淀物或纳米共沉淀物可用作缓释药用产品,用于在体内控制所述肽或蛋白质的递送。
在另一方面中,本发明涉及用作药用产品的根据本发明的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物。
本发明还涉及用作单次肠胃外施用特别是通过非静脉内肠胃外途径的药用产品的根据本发明的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用(特别是通过非静脉内肠胃外途径)之后的血浆浓度在治疗窗内的持续时间。
在本发明的上下文中,活性成分的“治疗窗”意指所述活性成分的所有血浆浓度在所述活性成分的最小治疗血浆浓度和所述活性成分的最大治疗血浆浓度之间,最小治疗血浆浓度是指活性成分具有有效治疗活性的最小血浆浓度,最大治疗血浆浓度是指可达到而不导致麻烦的副作用的所述活性成分的最大血浆浓度。
特别地,本发明涉及用作单次肠胃外施用特别是通过非静脉内肠胃外途径的药用产品的根据本发明的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于2天,优选大于7天,优选大于21天,更优选大于30天。
更具体地,本发明涉及用作单次肠胃外施用特别是通过非静脉内肠胃外途径的药用产品的根据本发明的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于21天,更优选大于30天。
在另一方面中,本发明涉及用作单次肠胃外施用特别是通过非静脉内肠胃外途径的药用产品的根据本发明的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间比未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用特别是通过非静脉内肠胃外途径之后的血浆浓度在治疗窗内的持续时间长2天,优选长7天,更优选长21天,甚至更优选长30天。
特别地,本发明涉及用作单次肠胃外施用特别是通过非静脉内肠胃外途径的药用产品的根据本发明的肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间比未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用特别是通过非静脉内肠胃外途径之后的血浆浓度在治疗窗内的持续时间长21天,优选长30天。
在另一方面中,本发明涉及用作单次肠胃外施用特别是通过非静脉内肠胃外途径的药用产品的根据本发明的纯肽或蛋白质纳米沉淀物或肽或蛋白质和金属离子纳米共沉淀物,在tmax和tmax+2天之间、优选地在tmax和tmax+7天之间、更优选地在tmax和tmax+21天之间、甚至更优选地在tmax和tmax+30天之间。
更具体地,在根据本发明的纳米沉淀物或纳米共沉淀物的单次肠胃外施用特别是通过非静脉内肠胃外途径之后,在tmax和tmax+2天之间、优选地在tmax和tmax+7天之间、更优选地在tmax和tmax+21天之间、甚至更优选地在tmax和tmax+30天之间,血浆肽或蛋白质浓度优选大于90%且更优选大于98%的最大血浆浓度(cmax)值。
术语“最大血浆浓度(cmax)”是指表示其中血浆浓度在整个动力学中最高的点的峰值浓度。当吸收和消除的量相等时达到该峰值;在施用单一剂量后测量它。
“tmax”是达到最大血浆浓度所需时间的值。该值表示药物活性物质的吸收速率。
“tmax+x天”对应于达到最大血浆浓度所需的时间tmax加上x天,x对应于整数,特别地x等于2、7、21或30。例如,“tmax+2天”对应于时间tmax加上2天的值。
在本发明的优选方面中,本发明人调整了时间,在该时间期间必须保持血浆浓度大于cmax值的至少85%作为所用的活性成分的函数。例如并且以非限制性方式,根据本发明的纯胰岛素纳米沉淀物或胰岛素/锌纳米共沉淀物可用作通过肠胃外途径特别是通过非静脉内肠胃外途径仅施用一次的胰岛素释放药用产品,使得血浆胰岛素浓度在tmax和tmax+2天之间、优选地在tmax和tmax+5天之间,特别地在tmax和tmax+7天之间大于85%,优选大于90%,更优选大于98%的cmax值。同样地,根据本发明的纯生长激素纳米沉淀物或生长激素/金属离子纳米共沉淀物用作通过肠胃外途径特别是通过非静脉内肠胃外途径施用的生长激素释放药用产品,使得血浆生长激素浓度在tmax和tmax+21天之间、优选地在tmax和tmax+30天之间大于85%,优选大于90%,更优选大于98%的cmax值。
在一个具体实施方案中,根据本发明的纳米沉淀物或纳米共沉淀物能实现所述肽或蛋白质体内缓释至少2天,有利地至少5天,更有利地至少30天,甚至更有利地90天。以有利的优选方式,根据本发明的纳米沉淀物或纳米共沉淀物能实现所述肽或蛋白质体内缓释至少7天,有利地至少21天,更有利地30天。
根据本发明的纳米沉淀物或纳米共沉淀物与能够随时间以受控的方式释放蛋白质或肽的任何系统或任何聚合物基质的使用相容。因此,在优选的实施方案中,将根据本发明的纳米沉淀物或纳米共沉淀物掺入到能实现它们在体内的缓释的聚合物基质中。
在本发明的上下文中,“聚合物基质”意指聚合物网络,当聚合物交联时任选地是三维的,例如凝胶。优选地,聚合物基质特别地包括天然或合成的生物相容性聚合物,其选自基于乙醇酸、基于乳酸、基于普朗尼克酸、基于聚乙二醇,基于诸如透明质酸的多糖、基于多肽、peo-ppo(聚(环氧乙烷)-聚(环氧丙烷))三嵌段共聚物、基于异丙基丙烯酰胺、脂质基质、树枝状大分子或它们的混合物的聚合物。优选地,聚合物基质是可生物降解的。
更具体地,聚合物基质是凝胶,特别是可注射凝胶,更具体地热敏凝胶或脂质基质,甚至更具体地透明质酸凝胶。
“掺入到聚合物基质中的纳米沉淀物或纳米共沉淀物”意指在聚合物基质中被包封、分散、接枝或交联的根据本发明的纳米沉淀物或纳米共沉淀物。
本发明还涉及包含根据本发明的纳米沉淀物或纳米共沉淀物的药物组合物,并且有利地药学上可接受的赋形剂。有利地,根据本发明的药物组合物包括掺入到聚合物基质中的根据本发明的纳米沉淀物或纳米共沉淀物。
根据有利的实施方案,根据本发明的药物组合物是缓释药物组合物。更具体地,根据本发明的组合物以延长的方式释放肽或蛋白质大于2天,有利地大于5天,更有利地大于30天,甚至更有利地大于90天。
药物组合物特别适合通过肠胃外,优选非静脉内、口服、舌下、鼻、透皮、局部、直肠、眼和粘膜途径施用,优选通过非静脉内肠胃外途径施用。以有利的优选方式,根据本发明的纳米沉淀物或纳米共沉淀物能实现体内缓释肽或蛋白质7天,有利地21天,更有利地30天。
在优选的实施方案中,根据本发明的药物组合物在单次肠胃外施用特别是通过非静脉内肠胃外途径之后释放根据本发明的蛋白质或肽,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用特别是通过非静脉内肠胃外途径之后的血浆浓度在治疗窗内的持续时间。
特别地,根据本发明的药物组合物在单次肠胃外施用,特别是通过非静脉内肠胃外途径之后释放根据本发明的蛋白质或肽,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于2天,优选大于7天,优选大于21天,更优选大于30天。
特别地,根据本发明的药物组合物在单次肠胃外施用,特别是通过非静脉内肠胃外途径之后释放根据本发明的蛋白质或肽,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间比未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用特别是通过非静脉内肠胃外途径之后的血浆浓度在治疗窗内的持续时间长2天,优选长7天,更优选长21天,甚至更优选长30天。
在另一方面中,根据本发明的药物组合物在单次肠胃外施用,特别是通过非静脉内肠胃外途径之后释放根据本发明的蛋白质或肽,使得血浆肽或蛋白质浓度在tmax和tmax+2天之间、优选地在tmax和tmax+7天之间,优选地在tmax和tmax+21天之间,甚至更优选地在tmax和tmax+30天之间大于85%,优选大于90%,更优选大于98%的cmax值。
有利地,本发明涉及包含肽或蛋白质的根据本发明的纳米沉淀物或纳米共沉淀物的药物组合物,所述肽或蛋白质选自人胰岛素、生长激素、胰高血糖素、肽激素或它们的治疗有效的衍生物或它们的片段。更有利地,本发明涉及包含人胰岛素或其治疗有效的衍生物或其片段的根据本发明的纳米沉淀物或人胰岛素或其治疗有效的衍生物或其片段和金属离子的根据本发明的纳米共沉淀物,优选人胰岛素/锌纳米共沉淀物的药物组合物。
更具体地,适于局部施用的组合物包括:乳膏、乳液、乳剂、软膏、洗剂、油、水性或水醇或乙醇酸溶液、粉末、贴剂、喷雾剂、棒状物或任何其他用于外部施用的产品。适合于口服施用的制剂可以胶囊,特别是软胶囊,特别是明胶或植物、粉末、片剂,特别是吞咽或嚼,咀嚼或泡腾的形式出现。它们也可以液体、乳液、乳膏、贴剂、粉末、凝胶或悬浮液形式出现。最后,适合通过非静脉内肠胃外途径施用的组合物,即通过皮下、皮内或肌肉内注射,特别地以悬浮液、可注射溶液或植入物形式出现。根据本发明的组合物还可与诸如支架的医疗器械组合。
可根据在建立适于受试者的药物治疗(例如患者的年龄或体重、他的一般病况的严重性、对治疗的耐受性、注意的副作用)中通常考虑的标准来确定根据本发明的药物组合物的施用方式、给药方案和最佳的盖仑形式。
药学上可接受的赋形剂是本领域技术人员已知的,并且根据药物组合物的施用方式进行选择。因此,药学上可接受的赋形剂可选自稀释剂、分散剂、润湿剂、粘结剂、崩解剂、染料、润滑剂、增溶剂、吸收促进剂、成膜剂、胶凝剂及它们的混合物。
举例来说,片剂形式的固体组合物包含药物载体,例如明胶、淀粉、乳糖、硬脂酸镁、滑石、阿拉伯树胶或类似物;和任选地蔗糖或其他合适材料的涂层。同样地,胶囊制剂特别地包含较薄和软或硬胶囊。糖浆或酏剂形式的制剂可包含活性成分连同甜味剂、防腐剂以及调味剂和合适的染料。水可分散的粉末或颗粒可包含与分散剂或润湿剂或悬浮剂以及风味增强剂或甜味剂混合的活性成分。对于直肠施用,使用在直肠温度下熔化的粘结剂制备栓剂,例如可可脂或聚乙二醇。最后,对于肠胃外、鼻内或眼内施用,使用包含药理学相容的分散剂和/或润湿剂的水性悬浮液、等渗盐溶液或无菌可注射溶液。
有利地,根据本发明的药物组合物包含掺入到聚合物基质中的优选胰岛素或其治疗有效的衍生物或其片段的根据本发明的纳米沉淀物或纳米共沉淀物,或胰岛素和金属离子的纳米共沉淀物,优选胰岛素和锌的纳米共沉淀物,其是足够流动以容易地注射和灭菌的稳定的缓释体系。它特别包括选自基于乙醇酸、基于乳酸、基于普朗尼克酸、基于聚乙二醇,基于诸如透明质酸的多糖、基于多肽、peo-ppo(聚(环氧乙烷)-聚(环氧丙烷))三嵌段共聚物、基于异丙基丙烯酰胺、脂质基质,树枝状大分子或它们的混合物的聚合物的聚合物。更具体地,根据本发明的纳米沉淀物配制在透明质酸凝胶内。
在一个特定方面中,本发明还涉及用作药用产品的根据本发明的缓释药物组合物。
本发明还涉及用于人和动物健康领域,特别地用于肿瘤学、组织和骨变性、眼科学、内分泌学(包括i型和ii型糖尿病)、心血管疾病、皮肤病学、皮肤美容学、感染学、寄生虫学、心脏病学、免疫学、肝脏病学、血液学、胃病学、肠病学、风湿病学、创伤学、肺病学、妇科学、耳鼻喉科学、诊断产品中的根据本发明的纳米沉淀物或纳米共沉淀物或根据本发明的药物组合物。
此外,本发明还涉及根据本发明的纳米沉淀物或纳米共沉淀物或根据本发明的药物组合物用于制备药用产品的用途,特别旨在用于治疗和/或预防人类和动物健康领域中的疾病,特别是在肿瘤学、组织和骨变性、眼科学、内分泌学(包括i型和ii型糖尿病)、心血管疾病、皮肤病学、皮肤美容学、感染学、寄生虫学、心脏病学、免疫学、肝脏病学、血液学、胃病学、肠病学、风湿病学、创伤学、肺病学、妇科学、耳鼻喉科学、诊断产品中。
本发明还涉及用于治疗和/或预防有需要的受试者中的人和动物健康领域中的疾病的方法,特别是在肿瘤学、组织和骨变性、眼科学、内分泌学(包括i型和ii型糖尿病)、心血管疾病、皮肤病学、皮肤美容学、感染学、寄生虫学、心脏病学、免疫学、肝脏病学、血液学、胃病学、肠病学、风湿病学、创伤学、肺病学、妇科学、耳鼻喉科学、诊断产品中,其包括对受试者施用治疗有效量的根据本发明的纳米沉淀物或纳米共沉淀物或根据本发明的药物组合物。
更具体地,本发明涉及用于治疗和/或预防糖尿病的根据本发明的胰岛素或其治疗有效的衍生物或其片段的纳米沉淀物或胰岛素和金属离子,优选胰岛素和锌的纳米共沉淀物或根据本发明的药物组合物。
以有利的优选方式,根据本发明的胰岛素纳米沉淀物或胰岛素/金属离子纳米共沉淀物能够在单次胃肠外施用,特别是通过非静脉内肠胃外途径之后实现胰岛素的缓释,使得血浆胰岛素浓度在治疗窗内的持续时间大于未根据本发明的制备方法进行制备的胰岛素在单次胃肠外施用之后的血浆浓度在治疗窗内的持续时间。特别地,根据本发明的胰岛素纳米沉淀物或胰岛素/金属离子纳米共沉淀物能在单次肠胃外施用,特别是通过非静脉内肠胃外途径之后实现胰岛素的缓释,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间大于2天,优选大于7天,更优选大于21天,甚至更优选大于30天。
特别地,根据本发明的胰岛素纳米沉淀物或胰岛素/金属离子纳米共沉淀物能够在单次肠胃外施用,特别是通过非静脉内肠胃外途径之后实现胰岛素的缓释,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间比未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用特别是通过非静脉内肠胃外途径之后的血浆浓度在治疗窗内的持续时间长2天,优选长7天,更优选长21天,甚至更优选长30天。
在另一方面中,根据本发明的胰岛素纳米沉淀物或胰岛素/金属离子纳米共沉淀物能够在单次肠胃外施用,特别是通过非静脉内肠胃外途径之后实现胰岛素的缓释,使得血浆胰岛素浓度在tmax和tmax+2天之间、有利地在tmax和tmax+5天之间,甚至更有利地在tmax和tmax+7天之间大于85%,优选大于90%,更优选大于98%的cmax值。
在优选的实施方案中,本发明涉及用于治疗和/或预防糖尿病的根据本发明的胰岛素或其治疗有效的衍生物或其片段的纳米沉淀物或胰岛素和金属离子,优选胰岛素和锌的纳米共沉淀物的缓释药物组合物。优选地,根据本发明的药物组合物能实现胰岛素的体内缓释持续大于2天,有利地大于5天,更有利地大于30天,甚至更有利地持续90天。
有利地,根据本发明的药物组合物能实现胰岛素或其治疗有效的衍生物或其片段或根据本发明的胰岛素/金属离子,优选胰岛素/锌复合物在单次胃肠外施用,特别是通过非静脉内肠胃外途径之后的缓释,使得血浆胰岛素浓度在治疗窗口内的持续时间大于未根据本发明的制备方法进行制备的胰岛素在单次肠胃外施用之后的血浆浓度在治疗窗内的持续时间。
特别地,根据本发明的药物组合物能实现胰岛素或其治疗有效的衍生物或其片段或根据本发明的胰岛素/金属离子,优选胰岛素/锌复合物在单次胃肠外施用,特别是通过非静脉内肠胃外途径之后的缓释,使得所述肽或蛋白质的血浆浓度在治疗窗口内的持续时间大于2天,优选大于7天,优选大于21天,更优选大于30天。
特别地,根据本发明的药物组合物能实现胰岛素或其治疗有效的衍生物或其片段或根据本发明的胰岛素/金属离子,优选胰岛素/锌复合物在单次胃肠外施用,特别是通过非静脉内肠胃外途径之后的缓释,使得所述肽或蛋白质的血浆浓度在治疗窗内的持续时间比未按照本发明的制备方法进行制备的相同肽或蛋白质在单次胃肠外施用特别是通过非静脉内肠胃外途径之后的血浆浓度在治疗窗内的持续时间长2天,优选长7天,更优选长21天,甚至更优选长30天。
在另一方面中,根据本发明的药物组合物能实现胰岛素或其治疗有效的衍生物或其片段或根据本发明的胰岛素/金属离子,优选胰岛素/锌复合物在单次胃肠外施用,特别是通过非静脉内肠胃外途径之后的缓释,使得血浆胰岛素浓度在tmax和tmax+2天之间、有利地在tmax和tmax+5天之间,甚至更有利地在tmax和tmax+7天之间大于85%,优选大于90%,更优选大于98%的cmax。
在本发明的上下文中,“糖尿病”意指由导致过量血糖的胰岛素缺乏或缺乏使用引起的不可治愈的慢性疾病。存在两种类型的糖尿病:i型糖尿病的特征在于完全没有胰岛素产生,2型糖尿病(非胰岛素依赖性糖尿病或nidd)是特征在于血液中葡萄糖水平升高、高血糖的葡萄糖代谢障碍。
本发明还涉及根据本发明的胰岛素或其治疗有效的衍生物或其片段或胰岛素/金属离子,优选胰岛素/锌复合物的纳米沉淀物或根据本发明的药物组合物在制备旨在用于治疗和/或预防糖尿病的药用产品中的用途。
此外,本发明涉及对有需要的受试者治疗和/或预防糖尿病的方法,其包括向受试者施用治疗有效量的根据本发明的纳米沉淀物或纳米共沉淀物或根据本发明的药物组合物。
附图说明
图1.作为所使用的胰岛素质量的函数的胰岛素纳米沉淀产率。
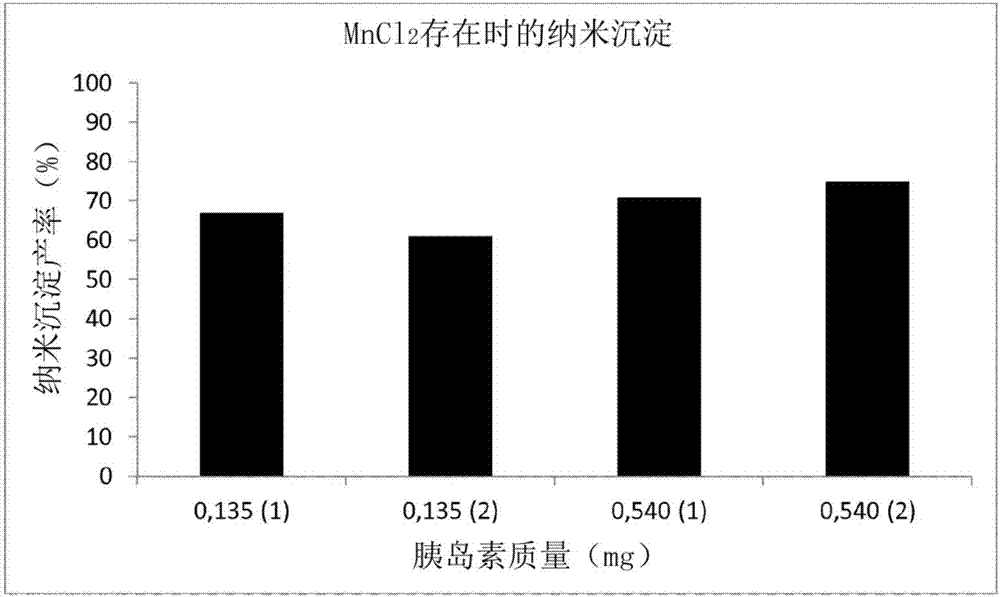
图2.在氯化锰(mncl2)的存在下(条件(1)0.12mg的mncl2;条件(2)0.25mg的mncl2),作为胰岛素质量的函数的胰岛素纳米共沉淀产率。
图3.在氯化钙(cacl2)的存在下(条件(1)0.12mg的cacl2;条件(2)0.25mg的cacl2),作为胰岛素质量的函数的胰岛素纳米共沉淀产率。
图4.在氯化锌(zncl2)的存在下(条件(1)0.12mg的zncl2;条件(2)0.25mg的zncl2),作为胰岛素质量的函数的胰岛素纳米共沉淀产率。
图5.氯化锌浓度对胰岛素纳米沉淀产率的影响。
图6.使用0.12mg的zncl2时,温度对胰岛素纳米沉淀或纳米共沉淀产率的影响。
图7.负载有胰岛素纳米沉淀物的聚合物微球的光学显微镜照片。
图8.来自根据本发明的包含三缩四乙二醇(◆)或peg550(■)的胰岛素纳米沉淀物,来自1%透明质酸凝胶的胰岛素释放的曲线。
图9.来自根据本发明的包含三缩四乙二醇(◆)或peg550(■)的胰岛素纳米沉淀物,来自2%透明质酸凝胶的胰岛素释放的曲线。
图10.与来自透明质酸凝胶的天然形式的胰岛素的释放曲线(■)比较,来自在透明质酸凝胶内,使用三缩四乙二醇和zncl2(●)、三缩四乙二醇和mncl2(◆)、peg550和zncl2(○)或peg550和mncl2(◇)制备的根据本发明的胰岛素和金属离子纳米共沉淀物的胰岛素释放的曲线。
图11.胰岛素释放曲线作为纳米沉淀物的再悬浮步骤的存在或不存在的函数。在将胰岛素纳米沉淀物分散在透明质酸基质内之前进行该悬浮步骤。没有预先稀释的条件(◆)仅对应于纳米沉淀形式的胰岛素。具有预先稀释的条件(■)对应于溶液中纳米沉淀的胰岛素和非沉淀的胰岛素的混合物。
图12.通过动态光散射获得的胰岛素纳米沉淀物的尺寸分布。
图13.以5iu/kg/d的剂量皮下施用液体胰岛素(
图14a.以5iu/kg/d的剂量皮下施用液体胰岛素(
图14b.以5iu/kg/d的剂量皮下施用液体胰岛素(
图15.以5iu/kg/d的剂量皮下施用液体胰岛素(
图16.冻干胰岛素纳米沉淀物的扫描电子显微镜图像。
图17.来自包含根据本发明制备的白介素-2纳米沉淀物的三个基质的白介素-2(分子质量为15kda)释放的曲线。(菱形:3%的丙二醇海藻酸盐,正方形:10%的透明质酸,三角形:4%的卡波姆)。
具体实施方式
以下实施例旨在说明本发明。
实施例
实施例1:胰岛素纳米沉淀物的制备
在烧瓶中,将0.468mg的人胰岛素(100iu/ml,来自lilly的umuline
将纳米沉淀产率表示为相对于开始时引入的胰岛素质量的百分比。
为了测量胰岛素量对纳米沉淀产率的影响,使用0.936mg、1.404mg、1.874mg和2.340mg的胰岛素质量重复上述方法,并计算各个纳米沉淀的产率。
结果示于图1。因此,可以注意到,沉淀的胰岛素的量越小,则纳米沉淀的产率越高。
通过动态光散射测量所获得的纳米沉淀物的平均直径并在图12中示出。可以注意到,该平均直径小于200nm。
图16是冻干的胰岛素纳米沉淀物的扫描光学显微镜图像。冻干物由彼此凝聚的根据上述方法制备的所有胰岛素纳米沉淀物组成。可以观察到,各个纳米沉淀物具有球形并且具有50至100nm的直径。这些尺寸接近由光散射技术确定的那些尺寸。
实施例2:在纳米沉淀过程中水溶性盐的存在的影响
胰岛素和mncl2、cacl2或zncl2的纳米共沉淀
为了测量水溶性盐的存在对作为盐的量和胰岛素的量的函数的根据本发明的胰岛素纳米沉淀的产率的影响,研究了三种盐:氯化锰(mncl2)、氯化钙(cacl2)和氯化锌(zncl2)。对于各个盐,根据下表1中给出的量制备产生纳米沉淀物的四种溶液:
表1.产生纳米沉淀物的溶液a、b、c和d的组成
对于各个溶液,以表1中提供的量将人胰岛素(100iu/ml,来自elililly的umuline
将纳米共沉淀产率表示为相对于开始时引入的胰岛素的量的百分比。
结果如图2、3和4所示:
-从图2和图3可以看出,使用mncl2或cacl2能够获得胰岛素纳米沉淀物,产率接近60-70%,而不需要考虑所使用的mncl2、cacl2或胰岛素的量;
-从图4可以看出,使用zncl2能够获得胰岛素纳米沉淀物,产率接近80-90%,而不需要考虑所使用的mncl2或胰岛素的量。
因此,使用mncl2、cacl2或zncl2具有双重优点:
-纳米沉淀产率的最大化,
–形成的纳米共沉淀物具有与在没有盐的情况下制备的纳米沉淀物不同的性质。
一般来说,图2、3和4说明了根据本发明的方法相对于使用的盐的性质的灵活性。此外,相同的方法(相同的胰岛素质量、相同的非溶剂体积和性质)能够通过仅改变盐而获得在物理化学性质和生物化学性质方面不同的产物。
胰岛素和zncl2的纳米共沉淀
为了补充实施例2中得到的结果,以下表2中给出的量根据实施例2的方法制备新溶液:
表2.产生纳米沉淀物的溶液e、f、g、h、i、j、k、l、m、n、o、p的组成
将纳米共沉淀产率表示为相对于开始时引入的胰岛素质量的百分比。
结果示于图5。从这些结果可以注意到,对于最大质量的胰岛素获得最高的产率。因此,氯化锌浓度的影响可以忽略不计。
因此,我们可以得出结论:
-氯化锌能够优化纳米沉淀产率,获得的产率接近100%;
-氯化锌能够形成具有特定性质的纳米共沉淀物。
实施例3:温度对纳米沉淀或纳米共沉淀产率的影响
为了测量在存在或不存在水溶性盐的情况下,温度对根据本发明的胰岛素纳米沉淀的产率的影响,针对两种不同的温度条件研究了两种不同溶液的纳米沉淀产率:在4℃下和在室温下。根据实施例1中所述的方法制备第一溶液,并包含1.404mg的人胰岛素(100iu/ml,来自lilly的umuline
将纳米沉淀产率表示为相对于开始时引入的胰岛素质量的百分比。
结果示于图6。它们说明了可在室温下进行纳米沉淀的事实,其采用了两个重要概念:
-根据本发明的方法的灵活性,从而易于使用和按比例缩放;
-与文献中描述的方法有显着差异,其中温度是关键因素。
实施例4:从来自透明质酸凝胶的根据本发明的胰岛素纳米沉淀物或纳米共沉淀物释放胰岛素的曲线
为了研究来自在聚合物基质内配制的根据本发明的胰岛素纳米沉淀物的胰岛素释放的曲线,以及胰岛素非溶剂的性质的影响,使用peg550或三缩四乙二醇作为胰岛素非溶剂,在1%的透明质酸凝胶内配制根据实施例1中描述的方法获得的胰岛素纳米沉淀物。
图7显示了包含胰岛素纳米沉淀物(光学显微镜)的微球。
图8显示胰岛素从1%的透明质酸凝胶基质中配制的所述胰岛素纳米沉淀物释放。这些结果表明
-释放发生超过20天的时间,并且
-非溶剂的性质影响释放速率;使用peg550作为胰岛素非溶剂能够在超过20天的时间内获得接近70%的血浆胰岛素浓度,因此高于使用三缩四乙二醇时(在超过20天的时间内血浆浓度接近30-40%)。
图9显示胰岛素从2%的透明质酸凝胶基质中配制的所述胰岛素纳米沉淀物释放。
同样地,为了研究来自在聚合物基质内配制的根据本发明的胰岛素和水溶性盐的纳米共沉淀物的胰岛素释放的曲线以及胰岛素非溶剂和水溶性盐的性质的影响,使用peg550或三缩四乙二醇作为胰岛素非溶剂以及zncl2或mncl2作为水溶性盐,在1%的透明质酸凝胶内配制根据实施例2中描述的方法获得的胰岛素纳米共沉淀物。
与天然形式的胰岛素的释放曲线相比,在图10中观察到来自在1%的透明质酸凝胶基质内配制的胰岛素和水溶性盐的所述纳米共沉淀物的胰岛素释放的曲线。这些结果表明
-胰岛素从纳米共沉淀物中的释放发生超过20天的时间
而天然形式的胰岛素的释放少于1天;
-非溶剂的性质影响释放速率。使用peg550能够获得比使用三缩四乙二醇时更高的血浆胰岛素浓度;且
-水溶性盐的性质也影响释放速率。使用zncl2能够获得比使用mncl2时更高的血浆胰岛素浓度。
实施例5:胰岛素释放曲线作为存在或不存在的根据本发明的纳米共沉淀物的再悬浮步骤的函数
进行本研究以确定根据本发明的纳米沉淀或纳米共沉淀方法的可逆性的优点。实际上,当将根据本发明的纳米沉淀物或纳米共沉淀物悬浮在溶液中时,它们恢复它们的天然的,即非沉淀的形式。
对于本研究,将来自在透明质酸凝胶基质中配制(无稀释条件)的根据本发明的胰岛素和mncl2的纳米共沉淀物的胰岛素释放的曲线与在透明质酸凝胶基质中配制之前悬浮在溶液中(有稀释条件)的这些相同的纳米共沉淀物的释放曲线比较。结果示于图11。
根据本发明的纳米沉淀或纳米共沉淀的可逆性是关键过程,几个关键原因如下:
-保留蛋白质或肽的生物活性;
-纳米沉淀物作为来自药性持久形式(depotform)的生物治疗剂的体内来源的能力;
-通过发挥该可逆性(纳米沉淀物、部分悬浮的纳米沉淀物、游离在溶液中的肽或蛋白质)调节蛋白质或肽的释放速率的能力。
实施例6:胰岛素纳米沉淀物施用后大鼠的血糖和胰岛素血症的演变的研究.
以5iu/kg/d的剂量将在股静脉插管的三组的六只大鼠皮下注射测试的制剂:
-在1%透明质酸凝胶中的实施例1中制备的胰岛素
-在聚合物溶液(175mg/ml的plga-peg-plga聚合物,
-在1%透明质酸、10%pluronicf127凝胶中在实施例1中制备的胰岛素
以5iu/kg将在股静脉插管的6只大鼠的对照组皮下注射商业
在测试和对照体系的注射之前和之后的精确时间,按照以下时间表采集血液样品:
-在测试的体系的注射之前三天,测定所有研究大鼠的基础血糖。
-注射前六分钟,采集血液样品并指定为在t=0分钟的样品。
-在测试的体系的注射后,在以下时间采集血液样品:5分钟、30分钟、1小时、3小时、8小时、12小时、24小时、48小时、72小时和96小时。
使用来自roche的accu–chek
使用由mercodia销售的elisa试剂盒测定胰岛素血症。
图13至15显示在皮下施用液体胰岛素(
进行的实验能够比较各种制剂中所含的胰岛素的生物学作用。商业液体胰岛素制剂在30至60分钟对血糖具有快速作用,并且呈现引起低血糖症的风险。实际上,药代动力学谱在30分钟时具有峰值活性。在注射后5分钟至1小时递送大多数胰岛素剂量,这大大增加了低血糖症的风险。基于胰岛素纳米沉淀物的制剂对血糖具有较慢的作用,并且能够在某些情况下限制低血糖症发生的风险。例如,基于图14a中提供的胰岛素纳米沉淀物的制剂就是这样的情况:胰岛素的作用减慢,且血糖控制更好,因为在5分钟至12小时递送大多数胰岛素剂量。
与商业
关于胰岛素血症的演变(图14b),基于胰岛素纳米沉淀物的制剂的使用能够平滑药代动力学分布并将胰岛素的血浆循环时间增加3倍。
实施例7:白介素-2纳米沉淀物的制备
通过添加三缩四乙二醇(cas3169–2–85–0)沉淀白介素–2(
通过抽吸除去上清液,然后将白介素-2纳米沉淀物溶于100μl的milli-q水中,并通过加入5ml的bradford试剂测定100μl体积。将样品置于黑暗中5分钟,然后在595nm下测量吸光度。在5至20μg/ml的白介素-2浓度范围内制备标准品范围,r2=0.99)。测定结果提供在下面的表3中:
表3.纳米沉淀产率
将纳米沉淀产率表示为相对于开始时引入的白介素-2的质量的百分比
使用来自malvern的nanosizerz测量获得的纳米沉淀物的平均直径。该平均直径为14nm。
实施例8:从包含白介素-2纳米沉淀物的凝胶基质释放白介素-2的研究
在37℃下进行释放实验。将根据实施例7中描述的方法制备的198μg的白介素-2纳米沉淀物与200μl的凝胶基质(10%的透明质酸,3%的丙二醇海藻酸盐或4%的卡波姆)混合,然后置于1.5ml的聚丙烯管中。然后,加入1ml的补充有甘露醇(1g/l)和sds(十二烷基硫酸钠,150mg/l)的无菌dpbs(杜氏磷酸盐缓冲盐水,ph7.4)。在30天的时间内以一定的时间间隔采集样品(1ml);在采集各个样品后,加入新鲜培养基以维持恒定的总体积。使用市售的elisa试剂盒(thermo
图17显示来自包含根据本发明制备的白介素-2纳米沉淀物的三个基质的白介素-2(分子质量为15kda)的释放。这些结果表明,释放发生超过30天。
该图表明基于白介素-2纳米沉淀物的制剂能够获得白介素-2的体外缓释。作为所使用的聚合物的类型的函数,释放速率可更快或稍慢。在该实施例中,基于透明质酸和卡波姆的制剂能够获得白介素-2的连续释放而在等于30天的持续时间内没有“突释”效应。
- 还没有人留言评论。精彩留言会获得点赞!