用于溶解或增溶治疗剂的方法和组合物与流程
相关申请
本发明根据35u.s.c.§119(e)要求于2014年12月18日提交的美国临时专利申请u.s.s.n.62/094,063的优先权,其全部内容通过引用并入本文。
背景技术:
患有某些医学病症的个体常常需要就近存放自动注入器(auto-injector)或预填充注射器(prefilledsyringe)以解决医疗需要。其一些实例是糖尿病患者的胰岛素笔(insulinpen)、食物和昆虫叮咬变态反应患者的肾上腺素自动注入器,以及处于暴露于野外化学和/或生物毒素风险中的士兵的解毒剂。
暴露于某些物质(例如,花生、贝类、蜂毒、某些药物、毒素等)可引起敏感个体的变态反应。此类变态反应可导致过敏性休克。这可引起血压急剧下降、荨麻疹和/或严重的气道收缩并且可以是威胁生命的病症。敏感个体对变应原的响应可随时间逐渐或突然提高或降低,使得那些敏感个体中的大部分需要解决方案以减轻过敏性休克的影响。迅速响应以减轻由于此类暴露的影响可防止损伤和/或死亡。例如,在某些情况下,注射肾上腺素(epinephrine,即adrenaline)可提供基本上和/或完全的变态反应缓解。
对于变态反应,例如,变态反应可发生在物理上远离最近的医院或医疗设施的地方。例如,蜂蜇伤更有可能发生在室外而不是室内。含有花生的食品更有可能被供应给远离受控家居环境(如在棒球场)的个体。
因为当个体遭受变态反应时紧急医疗设施可能不可得,因此一些个体携带药物递送装置(例如,自动注入器)以响应于变态反应而迅速自我施用肾上腺素。附近具有肾上腺素自动注入器使得在暴露于变应原后可紧急介入以降低和/或逆转威胁生命的过敏反应的副作用。
对于需要随身携带肾上腺素自动注入器的患者,药物的热稳定性特征可存在问题。患者必须以防止其药物暴露于受控室温以外的过热或过冷的方式照管它们。不这样做可使药物迅速降解并导致药物不具有应对过敏性休克发作的推荐效力。
发明概述
本发明提供了可迅速重构成用于向对象(例如人对象)递送(例如,通过注射)之溶液的干药物组合物(例如,干粉组合物)。在一些实施方案中,干药物组合物包含干药物与一种或更多种干ph调节剂的组合。在一些实施方案中,通过与第一溶液混合可将干药物组合物重构成溶液。在一些实施方案中,第一溶液具有迅速溶解干药物的ph。在一些实施方案中,干ph调节剂没有干药物溶解得迅速,导致在干药物溶解之后进行溶液的ph调节。本公开内容的一些方面用于促进干药物(例如,肾上腺素)在可能不是生理学上可接受的ph下迅速溶解,随后通过更慢的ph变化来达到生理学上可接受的范围。根据本公开内容,可通过将溶液与适当的药物和ph调节剂的干组合混合来在单个步骤中获得该过程。
在一些实施方案中,干药物组合物包含一种或更多种可药用载体。此外,本文中提供了包含本文中所述的药物组合的药盒和系统。根据本发明的一些方面,干药物组合物具有优于液体组合物若干优点,包括随时间和暴露于温度变化之后的稳定性(例如,长货架期、效力和/或手性稳定性)提高。
在一些方面,本公开内容提供了包含治疗有效量的干药物和一种或更多种ph调节剂(例如,一种或更多种干ph调节剂)的药物组合物。在一些实施方案中,ph调节剂为固体。在一些实施方案中,药物组合物在与第一液体混合后达到第一ph。在一些实施方案中,第一ph低于约7.0。在一些实施方案中,第一ph低于约6.0。在一些实施方案中,第一ph低于约5.0。在一些实施方案中,第一ph低于约4.0。在一些实施方案中,第一ph低于约3.0。在一些实施方案中,第一ph低于约2.0。在一些实施方案中,第一ph低于约2.2。在一些实施方案中,第一ph为约2.2至约5.0。在一些实施方案中,第一ph低于约1.0。在一些实施方案中,第一ph高于约7.0。在一些实施方案中,第一ph高于约8.0。在一些实施方案中,第一ph高于约9.0。在一些实施方案中,第一ph高于约10.0。在一些实施方案中,第一ph高于约11.0。在一些实施方案中,第一ph高于约12.0。在一些实施方案中,第一ph高于约13.0。在一些实施方案中,所述干药物比所述一种或更多种干ph调节剂更易溶解于所述第一液体中。在一些实施方案中,在与第一液体混合后,干药物形成容易溶解的盐。例如,在与包含酸的第一液体混合后,游离碱肾上腺素形成更易溶的盐。
在一些实施方案中,由药物组合物或干药物和第一液体形成的溶液进一步与一种或更多种ph调节剂接触以达到第二ph。在某些实施方案中,第二ph为生理学上可接受的ph。在一些实施方案中,第二ph为生理ph。在一些实施方案中,第二ph为约2.2至约5.0,并且干药物为肾上腺素。在一些实施方案中,第二ph为约4.2至约5.3,并且干药物为舒马曲坦。在一些实施方案中,第二ph为约0.1至约3.0或者9.5至13.5,并且干药物为胰高血糖素。
在另一方面,本文中提供了包含如本文中所述的药物组合物和第一液体的医疗药盒(medicalkit)。
在另一方面,本公开内容提供了制备医用溶液(medicalsolution)的方法,其包括将如本文中所述的药物组合物与第一液体混合。在某些实施方案中,通过医疗装置(medicaldevice)向对象施用药物组合物。在某些实施方案中,药物组合物位于医疗装置的第一室中。在某些实施方案中,第一液体位于医疗装置的第二室中。注射之前,将药物组合物与第一液体混合以使干药物溶解,随后通过一种或更多种干ph调节剂进行ph调节以达到生理学上可接受的ph。溶解和ph调节过程通常在小于5分钟内完成。在一些实施方案中,溶解和ph调节过程通常在小于1分钟内完成。在一些实施方案中,溶解和ph调节过程通常在小于30秒内完成。在一些实施方案中,溶解和ph调节过程通常在小于10秒内完成。在一些实施方案中,溶解和ph调节过程通常在小于5秒内完成。在一些实施方案中,溶解和ph调节过程通常在小于1秒内完成。在某些实施方案中,医疗装置为自动注入器。
在某些实施方案中,ph调节剂与干药物完全分开。在某些实施方案中,ph调节剂是与干药物颗粒不同的颗粒。在某些实施方案中,ph调节剂是与干药物颗粒相缔合的(associated)颗粒。在某些实施方案中,ph调节剂是在干药物颗粒内的颗粒。在某些实施方案中,ph调节剂是嵌入干药物颗粒内的颗粒。在某些实施方案中,ph调节剂与干药物的颗粒尺寸不同。在某些实施方案中,ph调节剂与干药物的颗粒尺寸类似。在某些实施方案中,ph调节剂比干药物溶解得更慢。
本申请的这些方面和其他方面通过以下非限制性附图来举例说明并在发明详述中描述。
附图简述
图1举例说明了用于单级混合(singlestagemixing)和注射过程的非限制性方法。
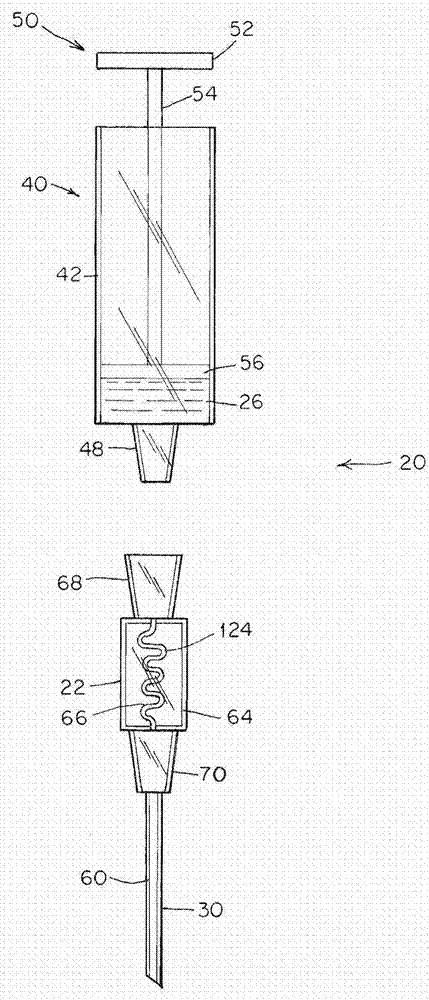
图2示出了使用本文中所述方法的注射系统的一个非限制性实施方案。
图3示出了第一液体中的非限制性示例酸的表1。
图4示出了非限制性示例ph调节剂的表2。
图5示出了在与第一液体混合之后具有提高的溶解性溶解性的非限制性示例干药物及盐形式的表3。
图6示出了干药物与第一液体和ph调节剂的非限制性示例反应的表4。具体地,药物与酸、其共轭碱、碱或其共轭酸形成盐以提高溶解性,并且所得的交换盐和弱酸形成用于施用(例如,注射)的溶液。在某些实施方案中,可添加过量的酸或共轭盐(conjugatesalt)以调节最终溶液ph。
图7示出了具有各组分的摩尔比的非限制性示例反应类型1和5。
图8示出了另外的非限制性示例反应类型1和5。
图9示出了ph调节剂的非限制性示例性干药物包衣,其中一种或更多种干药物颗粒存在于ph调节剂的颗粒上(a),或者ph调节剂包被有一个或更多个干药物层(b)。
图10描述了包含干药物和干ph调节剂的混合物的一个非限制性实施方案,其中相对于ph调节剂,药物颗粒尺寸更小(a)或更大(b)。
法明详述
本文中提供了包含治疗剂的药物组合物和药盒。本文中还提供了使用本文中所述药物组合物和药盒来治疗或预防疾病或病症的方法。
在一些实施方案中,本发明的一些方面涉及通过制备治疗剂的干药物组合物(例如,干盐形式)使治疗剂稳定并使其不易发生温度引起的降解,所述干药物组合物可容易地重构(例如,在自动注入器的情况下)以用于向患者递送。
在一些方面,本公开内容提供了以固体形式储存药物并因此防止其降解的可用的药物组合物。本公开内容还提供了由如本文中所述的药物组合物制备医用溶液的方法。在一些实施方案中,如图1中的方案所示,单级混合发生注射之前。在一些实施方案中,当在将药物组合物与第一液体混合后,所述干药物比所述一种或更多种ph调节剂溶解得更快(例如,在其之前)。在一些实施方案中,使用注射系统(例如,如图2中举例说明的或者任何其他合适的注射器/自动注入器),其中保持干药物组合物与液体组分分离,直至它们在注射前被混合。表1至3(图3至5)提供了可使用的酸(例如,可以以液体形式提供的)、ph调节剂(例如,可以以固体形式提供的)和药物(例如,可以以固体形式提供的)的非限制性实例。表4和5(例如,图6至8)举例说明了涉及表1至3的试剂或其他合适的试剂可发生的不同反应类型的非限制性实例。在一些实施方案中,ph调节剂起到将混合物的ph值从用于溶解干药物的有利的第一ph调节至适合向对象注射的第二ph的作用。
在一些实施方案中,干药物一般不易溶于水。在某些实施方案中,干药物是肾上腺素。在某些实施方案中,干药物是游离碱形式的肾上腺素。在某些实施方案中,干药物是胰高血糖素。在某些实施方案中,干药物是舒马曲坦。
在某些实施方案中,干药物与一种或更多种ph调节剂不相缔合。在某些实施方案中,所述干药物与所述一种或更多种ph调节剂处于不同的颗粒中。在某些实施方案中,所述干药物处于小于所述一种或更多种ph调节剂的颗粒中。在某些实施方案中,干药物颗粒的尺寸大于1nm。在某些实施方案中,干药物颗粒的尺寸大于5nm。在某些实施方案中,干药物颗粒的尺寸大于10nm。在某些实施方案中,干药物颗粒的尺寸大于50nm。在某些实施方案中,干药物颗粒的尺寸大于100nm。在某些实施方案中,干药物颗粒的尺寸大于500nm。在某些实施方案中,干药物颗粒的尺寸大于1μm。在某些实施方案中,干药物颗粒的尺寸大于5μm。在某些实施方案中,干药物颗粒的尺寸大于10μm。在一些实施方案中,干药物颗粒的尺寸为约20μm至约40μm(例如,约20μm、22.5μm、25μm、27.5μm、30μm、32.5μm、35μm或约40μm)。在某些实施方案中,干药物颗粒的尺寸大于50μm。在某些实施方案中,干药物颗粒的尺寸大于100μm。在某些实施方案中,干药物颗粒的尺寸大于500μm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于1nm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于5nm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于10nm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于50nm。在一些实施方案中,一种或更多种ph调节剂颗粒的尺寸为约40μm至约60μm(例如,约40μm、45μm、47.5μm、50μm、52.5μm、55μm、57.5μm或约60μm)。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于100nm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于500nm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于1μm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于5μm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于10μm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于50μm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于100μm。在某些实施方案中,一种或更多种ph调节剂颗粒的尺寸大于500μm。
如本文使用的,颗粒尺寸的数值是指使用已知技术(例如,激光衍射)和仪器(例如,尺寸范围装置,例如malvern提供的)测量的粒径。在一些实施方案中,颗粒的尺寸代表颗粒(例如,干组合物)群体(例如,平均数、中值或平均值)。在一些实施方案中,干组合物包含无定形固体。在一些实施方案中,干组合物包含结晶固体。在一些实施方案中,干组合物包含无定形固体和结晶固体的混合物。在一些实施方案中,干组合物为固体饼状物(solidcake)。在一些实施方案中,干组合物为多孔基质(porousmatrix)。
在某些实施方案中,干药物处于在一种或更多种ph调节剂之前溶解的颗粒中。在某些实施方案中,干药物颗粒比一种或更多种ph调节剂颗粒溶解得更快。在某些实施方案中,干药物处于大于一种或更多种ph调节剂的颗粒中。在某些实施方案中,干药物处于与一种或更多种ph调节剂尺寸类似的颗粒中。应理解,干药物和ph调节剂的不同制剂(例如,包衣、笼装(caging)等)可改变这些物质的固有溶解性以达到不同的溶解速率。
在某些实施方案中,ph调节剂包被有一个或更多个可药用载体层。在某些实施方案中,可药用载体为固体。可药用载体包括适合于期望特定剂型的任何和所有的稀释剂、分散剂、混悬助剂、表面活性剂、等张剂、增稠剂或乳化剂、防腐剂、固体黏合剂、润滑剂等。药物组合物试剂的配制和/或制造方面的一般考虑可见于例如remington’spharmaceuticalsciences,第16版,e.w.martin(mackpublishingco.,easton,pa.,1980)和remington:thescienceandpracticeofpharmacy,第21版(lippincottwilliams&wilkins,2005)。
在某些实施方案中,ph调节剂包被有一个或更多个可药用聚合物层。在某些实施方案中,ph调节剂在与第一液体混合后在干药物溶解之后释放。
在某些实施方案中,干药物与ph调节剂相缔合(例如,图9a)。在某些实施方案中,ph调节剂包被有一个或更多个干药物层(例如,图9b)。在某些实施方案中,柠檬酸钠包被有一个或更多个肾上腺素层。
在一些实施方案中,通过不同的颗粒尺寸来实现干药物与ph调节剂不同的溶解速率。在一些实施方案中,相对于ph调节剂的颗粒尺寸,干药物的颗粒尺寸更小,使得较小的药物颗粒首先和/或更快溶解(例如,图10a)。在一些实施方案中,相对于ph调节剂的颗粒尺寸,干药物的颗粒尺寸更大(例如,图10b)。例如,在某些实施方案中,可通过在ph调节剂上包含慢释放包衣来实现干药物与ph调节剂的不同溶解速率。某些慢释放包衣的特性可以是使得较小的颗粒尺寸提供更有利的ph调节剂溶解速率。
本文中使用的ph优化剂是指具有优化溶液ph之能力的试剂。在某些实施方案中,ph优化剂促进干药物的溶解。在某些实施方案中,ph优化剂为如本文一般描述的酸。在某些实施方案中,ph优化剂为如本文一般描述的碱。在某些实施方案中,ph优化剂是缓冲剂。
本文中使用的ph调节剂是可改变溶液的ph值的试剂。在某些实施方案中,ph调节剂将溶液的ph调节至适于施用的生理学上可接受的ph。在某些实施方案中,ph调节剂为如本文一般描述的酸。在某些实施方案中,ph调节剂为如本文一般描述的碱。在某些实施方案中,ph调节剂为如本文一般描述的缓冲剂。在某些实施方案中,ph调节剂为盐。
本文中一般定义的酸是在水溶液中解离以给出h+的化学物质。在某些实施方案中,酸是有机酸。在某些实施方案中,酸是无机酸。酸的实例包括但是不限于:1-羟基-2-萘甲酸、2,2-二氯乙酸、2-羟基乙磺酸、2-氧代戊二酸、4-乙酰氨基苯甲酸、4-氨基水杨酸、乙酸、己二酸、抗坏血酸、天冬氨酸、苯磺酸、苯甲酸、樟脑酸、樟脑-10-磺酸、癸酸、己酸、辛酸、碳酸、肉桂酸、柠檬酸、环己烷氨基磺酸(cyclamicacid)、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、甲酸、富马酸、半乳糖二酸(galactaricacid)、龙胆酸、葡庚糖酸、葡糖酸、葡糖醛酸、谷氨酸、戊二酸、甘油磷酸、乙醇酸、马尿酸、氢溴酸、盐酸、异丁酸、乳酸、乳糖酸、月桂酸、马来酸、苹果酸、丙二酸、扁桃酸、甲磺酸、萘-1,5-二磺酸、萘-2-磺酸、烟酸、硝酸、油酸、草酸、棕榈酸、扑酸(pamoicacid)、磷酸、丙酸、焦谷氨酸、水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、酒石酸、硫氰酸、甲苯磺酸或十一碳烯酸。在一些实施方案中,酸是盐酸、硫酸、磷酸、马来酸、1-羟基-2-萘甲酸、2,2-二氯乙酸、2-羟基乙磺酸、2-氧代戊二酸、4-乙酰氨基苯甲酸、4-氨基水杨酸、乙酸、己二酸、抗坏血酸(l)、天冬氨酸(l)、苯磺酸、苯甲酸、樟脑酸(+)、樟脑-10-磺酸(+)、癸酸(capricacid、decanoicacid)、己酸(caproicacid、hexanoicacid)、辛酸(caprylicacid、octanoicacid)、碳酸、肉桂酸、柠檬酸、环已烷氨基磺酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸(d)、葡糖酸(d)、葡糖醛酸(d)、谷氨酸、戊二酸、甘油磷酸、乙醇酸、马尿酸、氢溴酸、盐酸、异丁酸、乳酸(dl)、乳糖酸、月桂酸、马来酸、苹果酸(-l)、丙二酸、扁桃酸(dl)、甲磺酸、萘-1,5-二磺酸、萘-2-磺酸、烟酸、硝酸、油酸、草酸、棕榈酸、扑酸、磷酸、丙酸、焦谷氨酸(-l)、水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、酒石酸(+l)、硫氰酸、甲苯磺酸(p)或十一碳烯酸。在一些实施方案中,酸是硫酸、盐酸、氢溴酸、硝酸、磷酸、高氯酸、甲酸、乙酸、丙酸、草酸、马来酸、柠檬酸、琥珀酸、丙二酸、酒石酸或其组合。在某些实施方案中,酸是盐酸、硝酸、硫酸、磷酸、酒石酸、苹果酸、丙二酸、马来酸、富马酸、琥珀酸或甲酸(例如,图5)。
本文中一般定义的碱是在水溶液中解离以给出oh-的化学物质。在某些实施方案中,碱是有机碱。在某些实施方案中,碱是无机碱。在某些实施方案中,碱是强碱型碱(alkalinebase)。碱的实例包括但不限于:柠檬酸钠、乙酸钠、氢氧化钠、氢氧化钾、氢氧化锂、氢氧化铵、氢氧化钙、氢氧化镁、氢氧化铁、氢氧化锌、氢氧化铜、氢氧化锰、氢氧化铝、异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己基胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、哈胺(hydrabamine)、胆碱、甜菜碱、乙二胺、葡糖胺、甲基葡糖胺、可可碱、嘌呤、哌嗪、哌啶、n-乙基哌啶、氨丁三醇、n-甲基葡糖胺或其组合。在一些实施方案中,碱是氢氧化钠或氢氧化钾。
本文中使用的术语“缓冲剂”指缓冲试剂或包含一种或更多种缓冲试剂的缓冲溶液。本文中一般定义的缓冲试剂是在添加另一种酸或碱之后用于保持溶液ph接近所选值的弱酸或弱碱。缓冲试剂的作用是当将酸或碱添加到溶液中时防止ph迅速变化。示例的缓冲试剂包括但不限于:柠檬酸盐缓冲溶液、乙酸盐缓冲溶液、磷酸盐缓冲溶液、氯化铵、碳酸钙、氯化钙、柠檬酸钙、葡乳醛酸钙(calciumglubionate)、葡庚糖酸钙、葡糖酸钙、d-葡糖酸、甘油磷酸钙、乳酸钙、丙酸、乙酰丙酸钙、戊酸、磷酸氢钙、磷酸、磷酸钙(tribasiccalciumphosphate)、氢氧化钙磷酸盐、乙酸钾、氯化钾、葡糖酸钾、钾混合物、磷酸氢二钾、磷酸二氢钾、钾磷酸盐混合物(potassiumphosphatemixture)、乙酸钠、碳酸氢钠、氯化钠、柠檬酸钠、乳酸钠、磷酸氢二钠、磷酸二氢钠、钠磷酸盐混合物(sodiumphosphatemixture)、氨丁三醇、氢氧化镁、氢氧化铝、海藻酸、无热原水、等张盐水、林格液(ringer’ssolution)、乙醇、及其混合物。在某些实施方案中,缓冲剂是钠盐、钙盐、钾盐或铵盐。在某些实施方案中,缓冲剂是柠檬酸盐、乙酸盐、磷酸盐、硫酸盐、硝酸盐、酒石酸盐、琥珀酸盐、苹果酸盐或马来酸盐(例如,图4)。在某些实施方案中,缓冲剂是柠檬酸钠、乙酸钠、氢氧化钾、柠檬酸钾、乙酸钾、琥珀酸钠或琥珀酸钾。
本文中使用的第一液体可以是溶剂或溶液。在一些实施方案中,第一液体是单一溶剂。在一些实施方案中,第一液体是包含ph优化剂和单一溶剂的溶液。在一些实施方案中,第一液体包含水。在一些实施方案中,第一液体包含水和ph优化剂。在一些实施方案中,ph优化剂是本文中一般定义的酸。在一些实施方案中,ph优化剂是hcl。在一些实施方案中,第一液体是包含hcl的水溶液。在一些实施方案中,ph优化剂是本文中一般定义的碱。在一些实施方案中,ph优化剂是强碱型碱。
在一些实施方案中,第一液体的ph为约0.1至约6.9。在一些实施方案中,第一液体的ph为约0.5至约5.0。在一些实施方案中,第一液体的ph为约1.0至约5.0。在一些实施方案中,第一液体的ph为约2.0至约5.0。在一个实施方案中,第一液体的ph为约0.1至约6.0。在一个实施方案中,第一液体的ph为约0.1至约5.0。在一个实施方案中,第一液体的ph为约0.1至约4.0。在一个实施方案中,第一液体的ph为约0.1至约3.0。在一个实施方案中,第一液体的ph为约0.1至约2.0。在一个实施方案中,第一液体的ph为约0.1至约1.0。在一个实施方案中,第一液体的ph为约0.01至约2.2并且干药物是肾上腺素。在一些实施方案中,第一液体的ph为约0.25至约0.50。在一些实施方案中,第一液体的ph为约0.50至约0.75。在一些实施方案中,第一液体的ph为约0.75至约1.0。在一些实施方案中,第一液体的ph为约1.0至约1.25。在一个实施方案中,第一液体的ph为1.25。在一些实施方案中,第一液体的ph为约1.25至约1.5。在一些实施方案中,第一液体的ph为约1.5至约1.75。在一些实施方案中,第一液体的ph为约1.75至约2.0。在一些实施方案中,第一液体的ph为约2.0至约2.25。在一些实施方案中,第一液体的ph为约2.25至约2.5。在一些实施方案中,第一液体的ph为约2.5至约2.75。在一些实施方案中,第一液体的ph为约2.75至约3.0。
在一些实施方案中,第一液体的ph为约7.0至约13.5。在一些实施方案中,第一液体的ph为约8.0至约13.5。在一些实施方案中,第一液体的ph为约9.0至约13.5。在一些实施方案中,第一液体的ph为约9.5至约13.5。在一些实施方案中,第一液体的ph为约9.5至约13.5并且干药物是胰高血糖素。
在一些实施方案中,当将药物组合物和第一液体混合后,干药物比一种或更多种ph调节剂溶解得更快。在一些实施方案中,ph调节剂起到将混合物的ph值从用于溶解干药物的有利ph调节至适合向对象注射的ph的作用(例如,通过图3至8举例说明的试剂和反应举例说明的)。在某些实施方案中,最终溶液的ph为生理学上可接受的ph。在一些实施方案中,最终溶液的ph为约2.2至约5.0并且干药物为肾上腺素。在一些实施方案中,最终溶液的ph为约2.2至约5.0并且干药物为肾上腺素游离碱形式。在一些实施方案中,最终溶液的ph为约2.2至约5.0并且干药物为肾上腺素的盐形式。在一些实施方案中,最终溶液的ph为约2.2至约5.0并且干药物为盐酸肾上腺素形式。在一些实施方案中,最终溶液的ph为约2.2至约5.0并且干药物为重酒石酸肾上腺素形式。在一些实施方案中,最终溶液的ph为约4.2至约5.3并且干药物是舒马曲坦。在一些实施方案中,最终溶液的ph为约0.1至约3.0并且干药物是胰高血糖素。
干药物组合物可由如用于药物制剂的任何合适方法来制备。例如,药物可以是化学来源的、冻干的(冷冻干燥的)和/或喷雾干燥的和/或使用任何其他技术将药品和/或药物制成干燥形式。然而,在一些实施方案中,经干燥的药品可容易且迅速地溶解以使得干组合物可用于还包含液体组分的自动注入器是重要的,所述液体组分可在激活自动注入器之后(例如,临注射之前或在注射时)与干药品混合以将其溶解。
存在许多包含某种形式的肾上腺素的常见药物制剂,包括用于治疗心脏骤停以及过敏反应的那些。由于肾上腺素游离碱的不溶性,用于医疗保健的肾上腺素成品剂型通常使用酸配制以形成盐酸盐、重酒石酸盐或硼酸盐。
在一些实施方案中,包含l-肾上腺素游离碱的药物组合物放置在医疗装置(例如,自动注入器)的室内。包含ph优化剂(例如,酸如hcl)的第一液体放置在另一室内。在一个实施方案中,hcl溶液为1m或更高。在一些实施方案中,hcl溶液为0.1m或更高。在一些实施方案中,hcl溶液为0.01m或更高。在一些实施方案中,hcl溶液为0.001m或更高。在一些实施方案中,hcl溶液为0.0001m或更高。在一些实施方案中,hcl溶液为0.00001m或更高。在一些实施方案中,hcl溶液为0.000001m或更高。
在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约100μl至约200μl(例如,约100μl、125μl、150μl、175μl或约200μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约200μl至约300μl(例如,约200μl、225μl、250μl、275μl或约300μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约300μl至约400μl(例如,约300μl、325μl、350μl、375μl或约400μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约400μl至约500μl(例如,约400μl、425μl、450μl、475μl或约500μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约500μl至约600μl(例如,约500μl、525μl、550μl、575μl或约600μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约600μl至约700μl(例如,约600μl、625μl、650μl、675μl或约700μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约700μl至约800μl(例如,约700μl、725μl、750μl、775μl或约800μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约800μl至约1000μl(例如,约800μl、850μl、900μl、950μl或约1000μl)。在一些实施方案中,第一液体(例如,在自动注入器中)的体积为约1ml至约1.5ml(例如,约1ml、1.1ml、1.2ml、1.3ml、1.4ml或约1.5ml)。在一些实施方案中,液体的体积大于1.5ml。
在一个实施方案中,另外的组分(例如偏亚硫酸氢盐(metabisulfite)、氯化钠和其他物质)还可包含在用于溶解治疗剂(例如肾上腺素)的溶液中。
在一个实施方案中,肾上腺素游离碱溶解在包含ph优化剂的第一液体中以使溶解物质的ph低于ph6、低于ph5、低于ph4、低于ph3、低于ph2、为ph2至5。在一个实施方案中,其次用ph调节剂对溶解的肾上腺素溶液进行调节以使最终ph对于施用是生理学上可接受的。
在某些实施方案中,将第一溶液添加至包含干药物和干ph调节剂的干组合物。在一些实施方案中,第一溶液包含ph优化剂。在某些实施方案中,ph优化剂是酸。在某些实施方案中,ph优化剂是碱。在某些实施方案中,ph优化剂是缓冲剂。
在某些实施方案中,干药物比干ph调节剂在第一溶液中溶解得更快。然而,当ph调节剂溶解时,其调节所得溶液的ph,例如调节至较第一溶液的ph生理学上更加可接受的ph范围。在一些实施方案中,干ph调节剂是酸。在一些实施方案中,干ph调节剂是碱。在一些实施方案中,干ph调节剂是缓冲剂。在某些实施方案中,缓冲剂包含弱酸的盐或弱碱的盐,例如乙酸钠(例如,以干粉末形式)。在一些实施方案中,缓冲剂可包含弱酸及其共轭碱的混合物,或者弱碱及其共轭酸的混合物(例如,以干粉末形式)。在一些实施方案中,缓冲剂可包含柠檬酸及其共轭碱的混合物(例如,以干粉末形式)。在一些实施方案中,缓冲剂可包含乙酸及其共轭碱的混合物(例如,以干粉末形式)。在一些实施方案中,缓冲剂可包含酒石酸及其共轭碱的混合物(例如,以干粉末形式)。在一些实施方案中,用于调节溶解的药物溶液的ph的缓冲剂(例如,以干粉末形式)已经与如本文中所述的干药物混合。然而,在一些实施方案中,缓冲剂(例如,以干粉末形式)包含在接收溶解溶液的储库(reservoir)内部。在一些实施方案中,如果溶解之后ph降至低于ph2,则缓冲剂可用于使溶解的溶液的ph提高至高于ph2。在一些实施方案中,干ph调节剂是碱。在一些实施方案中,干ph调节剂是氢氧化钠。在一些实施方案中,通过ph调节剂来调节溶液的ph以使所得溶液适于注射。应理解,在一些实施方案中,特征是:药物以酸或碱提供以促进药物溶解,以及缓冲剂将混合物调节至的适于注射的ph。
在某些实施方案中,肾上腺素的一种粉末状形式为例如-(-)肾上腺素游离碱。-(-)肾上腺素(epi)难溶于水。然而,向水溶液中添加ph优化剂可提高溶解性。在某些实施方案中,添加酸例如盐酸(hcl)使环境更酸,从而提高肾上腺素的溶解性。
酸的添加促进肾上腺素更快地溶解。如果在进行注射之前需要快速溶解肾上腺素(例如,在自动注入器或预填充注射器内),则提高的溶解速率是重要的。在某些实施方案中,通过将ph降低至低于约2.2来实现肾上腺素的快速溶解,所述ph在注射之前可被调回到约2.2至约5的ph值。在一个实施方案中,溶解肾上腺素的ph值为约2.2或更低。在一个实施方案中,包含肾上腺素的注射溶液的ph值为约2.2或更低。在一个实施方案中,包含肾上腺素的注射溶液的ph值为约5.0或更高。
可采用数种方法以将ph值从低于约2.2调节至约2.2至约5的范围。在一些实施方案中,一种或更多种ph调节剂(例如,以干形式)存在于包含药物的干组合物中并形成缓冲系统。在某些实施方案中,ph调节剂是缓冲剂。在某些实施方案中,ph调节剂是缓冲试剂。在某些实施方案中,缓冲试剂为钠缓冲剂或钾缓冲剂。某些实施方案中,缓冲试剂为柠檬酸钠或乙酸钠。在某些实施方案中,缓冲系统包含柠檬酸三钠和柠檬酸。
在一些实施方案中,本文中提供的方法通过使用第一液体(例如,酸溶液)来溶解肾上腺素而允许医疗装置(例如,自动注入器或预填充注射器)内的药物(例如,肾上腺素)快速溶解,随后由于ph调节剂(例如,缓冲剂)溶解更慢而进行ph调节以达到用于注射的约2.2至约5的ph范围。
在一些实施方案中,涉及以下反应类型。
c9h13no3+hcl→c9h13no3·hcl(式2)
na3c6h5o7+4hcl+c9h13no3→c9h13no3·hcl+3nacl+h3c6h5o7(式3)
如式1至式3中所示,柠檬酸钠和肾上腺素粉末与盐酸反应以生成在柠檬酸溶液中盐酸肾上腺素和氯化钠。柠檬酸是具有三个酸解离常数(pka)的三元弱酸。解离反应示于式4至式6中。
柠檬酸的pka值在目标注射溶液ph内。包含柠檬酸的系统具有更好的缓冲能力和对ph漂移(phdrift)的抗性。组合的平衡反应(式3)为溶液提供了用于注射的目标ph值和肾上腺素浓度。可通过改变hcl∶柠檬酸钠和/或柠檬酸钠∶肾上腺素的相对比例来调节溶液的ph和氯化钠的浓度。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约80∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约60∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约40∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约20∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约10∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约5∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约10∶1至约1∶100。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶80。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶60。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶40。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶20。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶10。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶5。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约100∶1至约1∶1。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约50∶1至约1∶50。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约20∶1至约1∶20。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约10∶1至约1∶10。在某些实施方案中,hcl∶柠檬酸钠的摩尔比为约5∶1至约1∶5。
在一些实施方案中,肾上腺素和柠檬酸钠二者均与包含酸(例如,hcl)的第一液体混合。可通过柠檬酸与其共轭碱(柠檬酸钠)之间的可逆反应(式4)来实现缓冲效应。在某些实施方案中,添加柠檬酸三钠以提高超过hcl的柠檬酸根离子,以便促进溶液平衡向左,从而提高溶液的ph(例如,提高至约2.2至约5.0)。在一些实施方案中,肾上腺素和乙酸钠二者均与包含酸(例如,hcl)的第一液体混合。在一些实施方案中,肾上腺素和重酒石酸钠均与包含酸(例如,hcl)的第一液体混合。
在某些实施方案中,本文中提供了在第一室中储存干药物且在第二室中储存第一液体的医疗装置。干粉药物可快速溶解在第一液体中,随后由于ph调节剂(例如,在干组合物中与药物混合来提供)溶解更慢而通过ph调节至适于注射的ph。在一些实施方案中,粉末状药物的热稳定性的益处以及恰好在递送之前粉末状药物迅速溶解成液体剂量的能力,为患者提供了具有低得多的储存要求和更长货架期的药物。在某些实施方案中,医疗装置是自动注入器。在某些实施方案中,粉末状形式的肾上腺素位于自动注入器的第一室中并且包含酸的水溶液位于自动注入器的第二室中。在一些实施方案中,粉末状形式的肾上腺素与粉末状形式的ph调节剂(例如,干形式的缓冲剂)混合。
在一些实施方案中,以约25mg至约50mg的重量(例如,约25mg、27.5mg、30mg、32.5mg、35mg、37.5mg、40mg、42.5mg、45mg、47.5mg或约50mg)来提供(例如,在自动注入器中)包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)的干组合物。在一些实施方案中,以约15mg至约25mg的重量(例如,约15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg或约25mg)来提供(例如,在自动注入器中)包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)的干组合物。在一些实施方案中,以约5mg至约15mg的重量(例如,约5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg或约15mg)来提供(例如,在自动注入器中)包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)的干组合物。在一些实施方案中,以约3mg至约5mg的重量(例如,约3mg、3.25mg、3.5mg、3.75mg、4mg、4.1mg、4.2mg、4.3mg、4.4mg、4.5mg、4.75mg或约5mg)来提供(例如,在自动注入器中)包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)的干组合物。在一些实施方案中,以约1mg至约3mg的重量(例如,约1mg、1.25mg、1.5mg、1.75mg、2mg、2.1mg、2.15mg、2.17mg、2.2mg、2.3mg、2.4mg、2.5mg、2.75mg或约3mg)来提供(例如,在自动注入器中)包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)的干组合物。在一些实施方案中,以约0.1mg至约1mg的重量(例如,约0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg或约1mg)来提供(例如,在自动注入器中)包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)的干组合物。
在某些实施方案中,本文中提供了包含干组合物的医疗装置。在一些实施方案中,干组合物包含干药物。在一些实施方案中,干组合物包含干药物(例如,肾上腺素、胰高血糖素或其他药物)和干ph调节剂(例如,柠檬酸盐、乙酸盐或其他ph调节剂)。在一些实施方案中,干组合物包含按重量计约1%的干药物和按重量计约99%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约2%的干药物和按重量计约98%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约3%的干药物和按重量计约97%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约4%的干药物和按重量计约96%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约5%的干药物和按重量计约95%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约6%的干药物和按重量计约94%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约7%的干药物和按重量计约93%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约8%的干药物和按重量计约92%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约9%的干药物和按重量计约91%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约10%的干药物和按重量计约90%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约10%至约15%的干药物和按重量计约85%至约90%的干ph调节剂。例如按重量计约10%、11%、12%、13%、14%或约15%的干药物和按重量计约85%、86%、87%、88%、89%或约90%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约15%至约20%的干药物和按重量计约80%至约85%的干ph调节剂。例如按重量计约15%、16%、17%、18%、19%或约20%的干药物和按重量计约80%、81%、82%、83%、84%或约85%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约20%至约25%的干药物和按重量计约75%至约80%的干ph调节剂。例如按重量计约20%、21%、22%、23%、24%或约25%的干药物和按重量计约75%、76%、77%、78%、79%或约80%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约25%至约40%的干药物和按重量计约60%至约75%的干ph调节剂。例如按重量计约25%、27.5%、30%、32.5%、35%、37.5%或约40%的干药物和按重量计约60%、62.5%、65%、67.5%、70%、72.5%或约80%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约40%至约55%的干药物和按重量计约45%至约60%的干ph调节剂。例如按重量计约40%、42.5%、45%、47.5%、50%、52.5%或约55%的干药物和按重量计约45%、47.5%、50%、52.5%、55%、57.5%或约60%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约55%至约70%的干药物和按重量计约30%至约45%的干ph调节剂。例如按重量计约55%、57.5%、60%、62.5%、65%、67.5%或约70%的干药物和按重量计约30%、32.5%、35%、37.5%、40%、42.5%或约45%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约70%至约85%的干药物和按重量计约15%至约30%的干ph调节剂。例如按重量计约70%、72.5%、75%、77.5%、80%、82.5%或约85%的干药物和按重量计约15%、17.5%、20%、22.5%、25%、27.5%或约30%的干ph调节剂。在一些实施方案中,干组合物包含按重量计约85%至约99%的干药物和按重量计约1%至约15%的干ph调节剂。例如按重量计约85%、87.5%、90%、92.5%、95%、97.5%或约99%的干药物和按重量计约1%、2.5%、5%、7.5%、10%、12.5%或约15%的干ph调节剂。
在一些实施方案中,干组合物包含按重量计约1%的肾上腺素和按重量计约99%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约2%的肾上腺素和按重量计约98%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约3%的肾上腺素和按重量计约97%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约4%的肾上腺素和按重量计约96%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约5%的肾上腺素和按重量计约95%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约6%的肾上腺素和按重量计约94%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约7%的肾上腺素和按重量计约93%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约8%的肾上腺素和按重量计约92%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约9%的肾上腺素和按重量计约91%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约10%的肾上腺素和按重量计约90%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约10%至约15%的肾上腺素和按重量计约85%至约90%的柠檬酸盐。例如,按重量计约10%、11%、12%、13%、14%或约15%的肾上腺素和按重量计约85%、86%、87%、88%、89%或约90%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约15%至约20%的肾上腺素和按重量计约80%至约85%的柠檬酸盐。例如,按重量计约15%、16%、17%、18%、19%或约20%的肾上腺素和按重量计约80%、81%、82%、83%、84%或约85%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约20%至约25%的肾上腺素和按重量计约75%至约80%的柠檬酸盐。例如,按重量计约20%、21%、22%、23%、24%或约25%的肾上腺素和按重量计约75%、76%、77%、78%、79%或约80%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约25%至约40%的肾上腺素和按重量计约60%至约75%的柠檬酸盐。例如,按重量计约25%、27.5%、30%、32.5%、35%、37.5%或约40%的肾上腺素和按重量计约60%、62.5%、65%、67.5%、70%、72.5%或约80%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约40%至约55%的肾上腺素和按重量计约45%至约60%的柠檬酸盐。例如,按重量计约40%、42.5%、45%、47.5%、50%、52.5%或约55%的肾上腺素和按重量计约45%、47.5%、50%、52.5%、55%、57.5%、或约60%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约55%至约70%的肾上腺素和按重量计约30%至约45%的柠檬酸盐。例如,按重量计约55%、57.5%、60%、62.5%、65%、67.5%或约70%的肾上腺素和按重量计约30%、32.5%、35%、37.5%、40%、42.5%或约45%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约70%至约85%的肾上腺素和按重量计约15%至约30%的柠檬酸盐。例如,按重量计约70%、72.5%、75%、77.5%、80%、82.5%或约85%的肾上腺素和按重量计约15%、17.5%、20%、22.5%、25%、27.5%或约30%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约85%至约99%的肾上腺素和按重量计约1%至约15%的柠檬酸盐。例如,按重量计约85%、87.5%、90%、92.5%、95%、97.5%或约99%的肾上腺素和按重量计约1%、2.5%、5%、7.5%、10%、12.5%或约15%的柠檬酸盐。
在一些实施方案中,干组合物包含按重量计约1%的胰高血糖素和按重量计约99%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约2%的胰高血糖素和按重量计约98%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约3%的胰高血糖素和按重量计约97%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约4%的胰高血糖素和按重量计约96%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约5%的胰高血糖素和按重量计约95%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约6%的胰高血糖素和按重量计约94%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约7%的胰高血糖素和按重量计约93%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约8%的胰高血糖素和按重量计约92%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约9%的胰高血糖素和按重量计约91%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约10%的胰高血糖素和按重量计约90%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约10%至约15%的胰高血糖素和按重量计约85%至约90%的柠檬酸盐。例如,按重量计约10%、11%、12%、13%、14%或约15%的胰高血糖素和按重量计约85%、86%、87%、88%、89%或约90%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约15%至约20%的胰高血糖素和按重量计约80%至约85%的柠檬酸盐。例如,按重量计约15%、16%、17%、18%、19%或约20%的胰高血糖素和按重量计约80%、81%、82%、83%、84%或约85%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约20%至约25%的胰高血糖素和按重量计约75%至约80%的柠檬酸盐。例如,按重量计约20%、21%、22%、23%、24%或约25%的胰高血糖素和按重量计约75%、76%、77%、78%、79%或约80%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约25%至约40%的胰高血糖素和按重量计约60%至约75%的柠檬酸盐。例如,按重量计约25%、27.5%、30%、32.5%、35%、37.5%或约40%的胰高血糖素和按重量计约60%、62.5%、65%、67.5%、70%、72.5%或约80%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约40%至约55%的胰高血糖素和按重量计约45%至约60%的柠檬酸盐。例如,按重量计约40%、42.5%、45%、47.5%、50%、52.5%或约55%的胰高血糖素和按重量计约45%、47.5%、50%、52.5%、55%、57.5%或约60%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约55%至约70%的胰高血糖素和按重量计约30%至约45%的柠檬酸盐。例如,按重量计约55%、57.5%、60%、62.5%、65%、67.5%或约70%的胰高血糖素和按重量计约30%、32.5%、35%、37.5%、40%、42.5%或约45%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约70%至约85%的胰高血糖素和按重量计约15%至约30%的柠檬酸盐。例如,按重量计约70%、72.5%、75%、77.5%、80%、82.5%或约85%的胰高血糖素和按重量计约15%、17.5%、20%、22.5%、25%、27.5%或约30%的柠檬酸盐。在一些实施方案中,干组合物包含按重量计约85%至约99%的胰高血糖素和按重量计约1%至约15%的柠檬酸盐。例如,按重量计约85%、87.5%、90%、92.5%、95%、97.5%或约99%的胰高血糖素和按重量计约1%、2.5%、5%、7.5%、10%、12.5%或约15%的柠檬酸盐。
应理解,本文中所述的药物、酸、碱、缓冲剂或其他化合物的干形式是指化合物的粉末、固体形式、结晶形式、丸粒(pellet)、颗粒或其他干形式中的一种或更多种。
在一些实施方案中,干组合物包含干肾上腺素游离碱。在一些实施方案中,干药物组合物包含干l-肾上腺素游离碱。在一些实施方案中,干药物组合物包含干肾上腺素盐。在一些实施方案中,肾上腺素盐是肾上腺素的马来酸盐、苹果酸盐、富马酸盐、酸式酒石酸盐、酒石酸氢盐或硫酸盐。在一些实施方案中,肾上腺素盐是盐酸肾上腺素。在一些实施方案中,肾上腺素盐是重酒石酸肾上腺素。在一些实施方案中,肾上腺素盐是硼酸肾上腺素。在一些实施方案中,肾上腺素是l-肾上腺素。在一些实施方案中,干药物组合物还包含干ph调节剂。在一些实施方案中,干药物组合物还包含盐和/或抗氧化剂。在一些实施方案中,干药物组合物包含偏亚硫酸氢钠和/或甘露醇。
在一些实施方案中,干组合物通过干燥溶液(例如,通过真空干燥、冷冻干燥、冻干或任何合适的干燥技术,本发明的一些方面并不受限于该方面)来制备。在一些实施方案中,将干组合物作为干粉置于自动注入器内。在一些实施方案中,干组合物可具有允许高效且迅速溶解、增溶或重构的任何合适的颗粒尺寸。在一些实施方案中,干组合物的颗粒尺寸可通过将药物溶液在有限容积内干燥来控制。例如,在一些实施方案中,将药物溶液在自动注入器的界限内(例如,在自动注入器的一个或更多个微流控通道内)干燥。结果,干燥的药物组合物的颗粒尺寸与微流控通道的直径可在同一量级上(例如,直径为约1微米至约500微米)。然而,在一些实施方案中可使用更小或更大的颗粒尺寸。
应理解,可根据使用条件和组合物(例如,组合物的药物和其他组分)的性质将组合物干燥至不同程度。在一些实施方案中,干组合物具有按重量计小于50%的水、按重量计小于40%的水、按重量计小于30%的水、按重量计小于20%的水、按重量计小于10%的水、按重量计小于5%的水、按重量计小于1%的水、按重量计小于0.1%的水、按重量计小于0.01%的水或更少。
在一些实施方案中,在干燥成粉末形式以前,将药物和ph调节剂在溶液中混合。在一些实施方案中,将药物和ph调节剂分别进行干燥。在一些实施方案中,使用已知技术(例如,微粉化、辗磨、撞击、研磨)将干药物和干ph调节剂分别进行加工以获得期望的颗粒尺寸比例。
在一些实施方案中,将组合物的组分称重并测量以使溶液中治疗剂或药物(例如,l-肾上腺素)的最终浓度为1mg/ml。在一个实施方案中,治疗剂或药物(例如,l-肾上腺素)的最终浓度为0.8mg/ml至1.2mg/ml。在一个实施方案中,治疗剂或药物(例如,l-肾上腺素)的最终浓度为0.7mg/ml至1.3mg/ml。在一些实施方案中,治疗剂或药物(例如,l-肾上腺素)的最终浓度为小于0.8mg/ml,例如小于0.7mg/ml。在一些实施方案中,治疗剂或药物(例如,l-肾上腺素)的最终浓度为大于1.2mg/ml,例如大于1.3mg/ml。
在一些实施方案中,取决于组分和/或应用(例如,在溶解之后的最终溶液中),一种或更多种组分(例如,一种或更多种酸、碱、缓冲剂、盐、赋形剂、治疗剂、药物、药品或本文中所述的其他组分)的浓度为1nm至1m,例如1nm至1μm、1μm至1mm、1mm至10mm、10mm至100mm、100mm至500mm、500mm至1m、约1mm、约5mm、约10mm、约50mm、约100mm、约500mm、约1m或者更高或更低。
注射系统(例如,注射器/自动注入器装置)的非限制性实例示于图2中。注射系统20具有注射器40(例如,用于容纳液体组分)和混合器(mixer)22(例如,用于容纳干药物组合物)。注射器40具有限定体积的圆柱形管42。注射器40的圆柱形管42向下渐缩至出口端48。注射器40具有柱塞50,所述柱塞50具有按压手柄52、轴54和用于迫使液体组分26从出口端48出来的活塞56。注射器30显示为作为混合器22的一部分的针60,尽管针60可与混合器22分离。注射器30还可以是用于递送混合的组合药物28的喷嘴或管道。示出混合器22具有壳体64,所述壳体64限定具有入口68和出口70的内部流动室66。示出了具有单一通道(例如微通道124)的混合器22。在该实施方案中,混合装置22的微通道124是蛇形通道,其限定入口68与出口70之间的流体路径。流体可以进入出口70和从其中出来,也可进入入口68和从其中出来。蛇形通道124有两个功能:第一个功能使得能够通过弯曲流体流动方向以便通道可往返折回(doubleback)使通道结构小型化,因此,较长的通道更高效地利用较小的区域。第二个功能是每当通道中有弯曲或弯头时自然流动被扰乱,这导致混合依赖于通道的截面。在某些实施方案中,推动液体通过混合器22并从针60中出来。在一些实施方案中,出口端48与入口68连接,推动来自注射器40的液体通过混合器22中的干药物,从而使干药物溶解、增溶和重构。在一些实施方案中,通过构造(例如,包括密封件、膜、一个或更多个阀门、或其他系统、或其任意组合)使干药物与液体分离,所述构造保持干药物干燥直到注射至对象之前其与液体混合(例如,通过破裂或刺穿密封件或膜和/或打开一个或更多个阀门来使液体组分与干药物组合物连接)。图2所示系统是非限制性的,并且本文中所述的组合物可用于与任何合适的注射系统(例如,其中使例如包含药物和ph调节剂的干药物组合物与液体组分分离并且其中液体组分与干药物组合物在注射之前被混合的系统)连接。在一些实施方案中,注射系统包含用于提高药物组合物与液体组分的物理混合的一个或更多个特征以促进溶解。然而,在一些实施方案中,当液体组分与干药物组合物接触时发生充分混合。
在某些实施方案中,粉末状的药物包含位于注射器/自动注入器装置的第一室中的肾上腺素和至少一种粉末状的ph调节剂(例如,缓冲剂)。在某些实施方案中,缓冲剂为柠檬酸钠、乙酸钠、柠檬酸钾、乙酸钾、琥珀酸钠或琥珀酸钾。在一些实施方案中,第一液体包含位于第二室中的溶剂(例如,水)和ph优化剂(例如,酸)。在一些实施方案中,ph优化剂为hcl。
施用之前,医疗装置的第一室中的药物组合物与第二室中的第一液体接触以形成用于注射的溶液。在某些实施方案中,接触在第一室中进行。在某些实施方案中,接触在第二室中进行。在某些实施方案中,接触在第三室中进行。在某些实施方案中,药物组合物与第一液体部分地混合。在某些实施方案中,药物组合物与第一液体完全混合以形成溶液。在某些实施方案中,肾上腺素位于第一室中,并且与来自第二室的ph为约2.2或更低的酸性第一液体接触。在某些实施方案中,肾上腺素在第一液体中溶解之后,ph调节剂的释放使最终的ph为约2.2至约5.0。
在一些实施方案中,通过不同的颗粒尺寸来实现肾上腺素和ph调节剂的不同溶解速率。在一些实施方案中,相对于ph调节剂的颗粒尺寸,肾上腺素的颗粒尺寸更小,使得在初始ph低于2.2时较小的肾上腺素颗粒更可能首先和/或更快地溶解,具有更大的颗粒尺寸的ph调节剂溶解得更慢,然后使得组合溶液的ph提高至约2.2至约5.0的目标范围。
本文中提供的药物组合物可通过肠胃外、静脉内、肌内或皮下途径施用。在某些实施方案中,施用途径为皮下。在某些实施方案中,施用途径为静脉内。
可根据已知技术使用合适的分散剂或润湿剂和混悬剂来配制可注射制剂(例如无菌可注射水性或油性混悬剂)。无菌可注射制剂可以是无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液剂、混悬剂或乳剂,例如,作为1,3-丁二醇中的溶液。可使用的可接受的载体和溶剂是水、林格液(u.s.p.)和等张氯化钠溶液。
可注射制剂可以例如通过细菌截留过滤器来过滤,或通过并入无菌固体组合物形式的灭菌剂来灭菌,所述固体组合物在使用前可溶解或分散在无菌水或其他无菌可注射介质中。
本公开内容还涵盖药盒(例如,药物包装(pharmaceuticalpack))。本发明的药盒可用于预防和/或治疗疾病或病症(例如,变态反应)。所提供的药盒可包含本发明的药物组合物和容器(例如,小瓶、安瓿、瓶、注射器和/或配药器包装或其他合适的容器)。所提供的药盒可包含在医疗装置(例如,自动注入器)中的本发明的药物组合物。在某些实施方案中,药盒还包含用于施用组合物的说明书。
在某些实施方案中,治疗剂选自:agrylin(阿那格雷hcl)、akten(盐酸利多卡因)、apokyn(盐酸阿朴吗啡)、arestin(盐酸米诺环素)、avandamet(马来酸罗格列酮和二甲双胍hcl)、aveloxi.v.(盐酸莫西沙星)、cardizem(r)(注射用地尔硫
可药用赋形剂包括适合于期望特定剂型的任何和所有的稀释剂、分散剂、悬浮助剂、表面活性剂、等张剂、增稠剂或乳化剂、防腐剂、固体黏合剂、润滑剂等。制剂和/或药物组合物药剂制造方面的一般考虑可见于例如remington’spharmaceuticalsciences,第16版,e.w.martin(mackpublishingco.,easton,pa.,1980)和remington:thescienceandpracticeofpharmacy,第21版(lippincottwilliams&wilkins,2005)。
所提供的医用溶液可通过皮内、肌内、鼻内、静脉内、经口、经直肠、皮下、经表面或经阴道施用递送。在某些实施方案中,所提供的医用溶液皮内或肌内施用。用于皮内或肌内递送本文中所述医用溶液的合适装置包括常规注射器或短针装置,例如美国专利4,886,499、5,190,521、5,328,483、5,527,288、4,270,537、5,015,235、5,141,496和5,417,662中描述的那些。
在一些实施方案中,医用溶液中治疗剂的量是足以引起期望的生物应答(即,治疗病症)的有效量。在一些实施方案中,医用溶液中治疗剂的量是足以在治疗病症中提供治疗益处或者延迟或最小化与所述病症相关的一种或更多种症状的治疗有效量。术语“治疗有效量”可涵盖改善总体治疗、降低或避免病症之症状或病因或者增强其他治疗剂的治疗效力的量。在一些实施方案中,有效量是足以防止病症或与所述病症相关的一种或更多种症状或防止其复发的预防有效量。
本文中使用的治疗剂的有效量将因对象而异,例如,取决于对象的物种、年龄和一般状况、副作用或病症的严重程度、特定化合物的性质、施用方式等。期望的剂量可一天三次、一天两次、一天一次、每隔一天、每三天、每周、每两周、每三周或每四周递送。在某些实施方案中,期望的剂量可使用多次施用(例如,两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次、十二次、十三次、十四次或更多次施用)递送。
在某些实施方案中,用于向70kg成人一天一次或更多次施用的化合物有效量可包括约0.0001mg至约3000mg、约0.0001mg至约2000mg、约0.0001mg至约1000mg、约0.001mg至约1000mg、约0.01mg至约1000mg、约0.1mg至约1000mg、约1mg至约1000mg、约1mg至约100mg、约10mg至约1000mg、或约100mg至约1000mg的化合物/单位剂型。
在某些实施方案中,本发明的化合物可处在这样的剂量水平:每天足以递送约0.001mg/kg对象体重至约100mg/kg对象体重,约0.01mg/kg对象体重至约50mg/kg对象体重,优选约0.1mg/kg对象体重至约40mg/kg对象体重,优选约0.5mg/kg对象体重至约30mg/kg对象体重,约0.01mg/kg对象体重至约10mg/kg对象体重,约0.1mg/kg对象体重至约10mg/kg对象体重,并且更优选约1mg/kg对象体重至约25mg/kg对象体重(一天一次或更多次)以获得期望的治疗效果。
应理解,本文中所述的剂量范围为向成人施用所提供的药物组合物提供了指导。待施用于例如儿童或青少年的量可由执业医师或本领域技术人员确定并且可低于或等于施用于成人的量。
在一些实施方案中,将医用溶液施用于人对象。在一些实施方案中,将医用溶液施用于非人对象。
在某些实施方案中,当温度变化后,如本文中所述的干药物或药物组合物是稳定的。在一些实施方案中,当经受以下温度暴露长达1年、2年、3年、5年、7年、长达10年或多于10年时,本文中所述和/或实例中示例的干组合物保持高于90%的效力、高于95%的效力、90%至100%的效力或者90%至115%的效力:低于-30℃、或-30℃至-25℃、或低于-25℃、或-25℃至-20℃、或低于-20℃、或-20℃至-15℃、或低于-15℃、或-15℃至-10℃、或低于-10℃、或-10℃至-5℃、或低于-5℃、或-5℃至0℃、或低于0℃、或0℃至5℃、或低于5℃、或5℃至10℃、或低于10℃、或10℃至15℃、或低于15℃、或15℃至20℃、或低于20℃、或20℃至25℃、或高于25℃、或25℃至30℃、或高于30℃、或30℃至35℃、或高于35℃、或35℃至40℃、或高于40℃、或40℃至45℃、或高于45℃、或45℃至50℃、或高于50℃、或50℃至55℃、或高于55℃、或55℃至60℃、或高于60℃。
在一些实施方案中,在注射器装置中溶解l-肾上腺素粉末之后,即使当干l-肾上腺素先前已经受以下温度暴露长达1年、2年、3年、5年、7年、长达10年或多于10年时,所得溶液保持高于90%的效力、高于95%的效力、90%至100%的效力或者90%至115%的效力:低于-30℃、或-30℃至-25℃、或低于-25℃、或-25℃至-20℃、或低于-20℃、或-20℃至-15℃、或低于-15℃、或-15℃至-10℃、或低于-10℃、或-10℃至-5℃、或低于-5℃、或-5℃至0℃、或低于0℃、或0℃至5℃、或低于5℃、或5℃至10℃、或低于10℃、或10℃至15℃、或低于15℃、或15℃至20℃、或低于20℃、或20℃至25℃、或高于25℃、或25℃至30℃、或高于30℃、或30℃至35℃、或高于35℃、或35℃至40℃、或高于40℃、或40℃至45℃、或高于45℃、或45℃至50℃、或高于50℃、或50℃至55℃、或高于55℃、或55℃至60℃、或高于60℃。
在某些实施方案中,本文中所述的干药物或药物组合物包含手性治疗剂。在某些实施方案中,本文中所述的干药物或药物组合物包含手性l-肾上腺素。在一些实施方案中,当l-肾上腺素经受以下温度暴露长达1年、2年、3年、5年、7年、长达10年或多于10年时,本文中所述的干组合物保持大于60%、大于70%、大于75%、大于80%、大于85%、大于90%、大于95%、95%至100%的手性纯度:低于-30℃、或-30℃至-25℃、或低于-25℃、或-25℃至-20℃、或低于-20℃、或-20℃至-15℃、或低于-15℃、或-15℃至-10℃、或低于-10℃、或-10℃至-5℃、或低于-5℃、或-5℃至0℃、或低于0℃、或0℃至5℃、或低于5℃、或5℃至10℃、或低于10℃、或10℃至15℃、或低于15℃、或15℃至20℃、或低于20℃、或20℃至25℃、或高于25℃、或25℃至30℃、或高于30℃、或30℃至35℃、或高于35℃、或35℃至40℃、或高于40℃、或40℃至45℃、或高于45℃、或45℃至50℃、或高于50℃、或50℃至55℃、或高于55℃、或55℃至60℃、或高于60℃。
在一些实施方案中,在注射器装置中溶解l-肾上腺素粉末之后,即使当干l-肾上腺素先前已经受以下温度暴露长达1年、2年、3年、5年、长达7年、10年或多于10年时,所得溶液保持大于60%、大于70%、大于75%、大于80%、大于85%、大于90%、大于95%、95%至100%的手性纯度:低于-30℃、或-30℃至-25℃、或低于-25℃、或-25℃至-20℃、或低于-20℃、或-20℃至-15℃、或低于-15℃、或-15℃至-10℃、或低于-10℃、或-10℃至-5℃、或低于-5℃、或-5℃至0℃、或低于0℃、或0℃至5℃、或低于5℃、或5℃至10℃、或低于10℃、或10℃至15℃、或低于15℃、或15℃至20℃、或低于20℃、或20℃至25℃、或高于25℃、或25℃至30℃、或高于30℃、或30℃至35℃、或高于35℃、或35℃至40℃、或高于40℃、或40℃至45℃、或高于45℃、或45℃至50℃、或高于50℃、或50℃至55℃、或高于55℃、或55℃至60℃、或高于60℃。
等同方案和范围
在权利要求书中,除非相反地指出或从上下文中显而易见,否则没有数量词修饰的名词表示一个/种或更多个/种。除非相反地指出或从上下文中显而易见,否则在一组的一个或更多个成员之间包括“或”的权利要求书或说明书被视为满足在给定产物或方法中存在、使用一个、多于一个或全部组成员,或者一个、多于一个或全部组成员与给定产物或方法有关。本公开内容包括在给定产物或方法中存在、使用正好一个组成员,或者正好一个组成员与给定产物或方法有关的实施方案。本公开内容包括在给定产物或方法中存在、使用多于一个或全部组成员,或者多于一个或全部组成员与给定产物或方法有关的实施方案。
此外,本公开内容涵盖将一项或更多项所列权利要求的一个或更多个限制、要素、条款和描述性术语引入其他项权利要求的所有变化、组合和排列。例如,任何从属于其他项权利要求的权利要求可经修改以包括见于从属于同一基本权利要求的任何其他权利要求中的一个或更多个限制。当以列表(例如,以马库什组格式)提供要素时,还公开了所述要素的每个子组,并且可从该组中除去任何要素。应理解,一般而言,本公开内容或者本公开内容的一些方面被称为包含特定要素和/或特征,本公开内容或本公开内容的一些方面的某些实施方案由这样的要素和/或特征组成或基本上由其组成。为简单起见,在本文中未在这些话中具体地陈述那些实施方案。还应注意,术语“包括”和“包含”旨在是开放的并且允许包含另外的要素或步骤。在给出范围的情况下包括端点。此外,除非另有说明或者另外从上下文和/或本领域普通技术人员的理解显而易见,否则表示为范围的值可推断本公开内容的不同实施方案中规定范围内的任何特定值或子范围至范围下限单位的十分之一,除非上下文另外明确说明。
本申请引用多个授权专利、公开的专利申请、期刊论文和其他出版物,所有这些均通过引用并入本文。如果在任何并入的参考文献和本说明书之间存在冲突,则以本说明书为准。此外,落入现有技术范围内的本公开内容的任何特定实施方案可明确地从任何一项或更多项权利要求中排除。因为认为这样的实施方案是本领域普通技术人员已知的,即使本文未明确陈述排除也可将其排除在外。出于任何原因,不论与现有技术的存在是否相关,本公开内容的任何特定实施方案可从任何权利要求中排除。
本领域技术人员将认识到或仅使用常规实验就能够确定本文中所述的具体实施方案的许多等同方案。本文中所述的当前实施方案的范围并非旨在限于上述说明书,而在于由所附权利要求书限定。本领域普通技术人员将认识到,可对本说明书作出多种改变和修改而不脱离如在所附权利要求书中限定的本公开内容的精神或范围。
- 还没有人留言评论。精彩留言会获得点赞!