用于治疗神经变性疾病的西酞普兰或艾司西酞普兰的制作方法
本公开涉及使用西酞普兰或艾司西酞普兰作为活性成分治疗神经变性疾病,特别是多聚谷氨酰胺疾病,特别是马查多-约瑟夫病(mjd)或脊髓小脑共济失调3型(sca3)。
背景技术:
多聚谷氨酰胺疾病是一类显性遗传的神经变性疾病,对其没有有效的治疗。三核苷酸cag重复序列的扩增引起遗传性成年型神经变性疾病,例如亨廷顿舞蹈病(hd)、脊髓延髓肌萎缩症、齿状核红核苍白球路易体萎缩症和六种形式的脊髓小脑共济失调。mjd/sca3是世界上最常见的显性遗传性sca,其特征在于与肌张力障碍、痉挛、周围神经病变和肌萎缩相关而无认知减退的共济失调、眼肌麻痹和锥体束征。病理上,存在小脑深部核团、脑桥和丘脑底核、黑质和脊髓小脑核的变性。mjd的遗传基础是蛋白质脊髓小脑共济失调蛋白-3(atxn3)中的多聚谷氨酰胺(polyq)链的扩增。当polyq链超过60个连续的谷氨酰胺时,atxn3变得高度易聚集,导致细胞的蛋白内稳态的不平衡,因为聚集相关的蛋白质毒性优于折叠和清除。
目前,没有有效地减缓疾病进展的mjd的治疗。改善患者生活质量和维持独的努力解决了不宁腿和锥体外束综合征、痉挛的治疗和疲劳影响(d'abreu,a.,franca,m.c.,jr.,paulson,h.l.&lopes-cendes,i.caringformachado-josephdisease:currentunderstandingandhowtohelppatients.parkinsonismrelatdisord16,2-7(2010))。还没有转化为临床实践的是包括药理学伴侣和动力学稳定剂方法的治疗策略,以及使用小分子或基因靶向来操纵atxn3的浓度、构象和/或位置(costam.do,c.&paulson,h.l.towardunderstandingmachado-josephdisease.progneurobiol97,239-257(2012))。对于许多提出的治疗方法,转化为临床实践将进一步受到长期治疗时的人身安全和毒性缺乏的限制。包括从新鉴定和验证新分子靶标的药物发现的传统方法是昂贵和耗时的,从而限制了引入诊所的新药的数量。此外,由于药物开发所需的平均时间持续增加,存在对旧药新用策略的复兴的兴趣。另一方面,在过去几年,新的候选药物失败的主要原因是在临床试验中的治疗效果较差。对该缺点的最常提出的原因之一是在整个生物体系统中缺乏体外转译和体内的治疗效果的重组药物活性。
为了说明本公开所解决的技术问题,公开了这些事实。
技术实现要素:
此处对5-羟色胺能信号的活化在mjd的动物模型中是有益的事实提供了证据。西酞普兰,选择性5-羟色胺再摄取抑制剂(ssri),被认为具有有益作用,在先前描述的突变型脊髓小脑共济失调蛋白-3诱导的神经毒性的秀丽隐杆线虫(c.elegans)模型中减少神经元功能障碍和蛋白质聚集(teixeira-castro,a.etal.neuron-specificproteotoxicityofmutantataxin-3inc.elegans:rescuebythedaf-16andhsf-1pathways.hummolgenet20,2996-3009(2011))。mod-5,5-羟色胺转运体的秀丽隐杆线虫直系同源物和西酞普兰的细胞靶标,以及5-羟色胺受体ser-1和ser-4被证明是mjd的强遗传修饰因子并且是治疗功效所必需的。此外,使用西酞普兰的cmvmjd135小鼠的长期治疗(silva-fernandes,a.etal.chronictreatmentwith17-dmagimprovesbalanceandcoordinationinanewmousemodelofmachado-josephdisease.neurotherapeutics(2014))减少atxn3神经元包涵体和星形细胞增生,显着减轻了运动症状,并挽救体重减轻。这些结果表明,5-羟色胺能信号的小分子调控代表了mjd的治疗靶标。此外,5-羟色胺重获抑制调节蛋白质毒性的发现可能与其它蛋白质构象无序相关。
本公开主题涉及西酞普兰或艾司西酞普兰、其药用盐或衍生物在治疗受蛋白质错误折叠和/或聚集的减少的积极影响的神经变性疾病中的用途,即用于改善运动症状,即患者的平衡、运动协调和/或运动表现的缺乏。
在一个实施方式中,西酞普兰或艾司西酞普兰的用途是用于预防和延迟神经变性疾病。
在一个实施方式中,西酞普兰或艾司西酞普兰用于治疗神经变性疾病,其中所述疾病受蛋白质错误折叠和/或聚集的控制的积极影响。
在一个实施方式中,西酞普兰或艾司西酞普兰用于治疗神经变性疾病,其中所述疾病受蛋白质错误折叠和/或聚集的控制的积极影响,其中所述控制是由受影响的蛋白质的多聚谷氨酰胺片段的扩增引起的蛋白质聚集的控制。
在一个实施方式中,西酞普兰或艾司西酞普兰用于治疗脊髓小脑共济失调3型,也称为马查多-约瑟夫病。
在一个实施方式中,西酞普兰或艾司西酞普兰用于治疗亨廷顿舞蹈症、帕金森病、肌萎缩性脊髓侧索硬化症、马查多-约瑟夫病、脊髓延髓肌萎缩症、齿状核红核苍白球路易体萎缩和脊髓小脑共济失调1型,脊髓小脑共济失调2型、脊髓小脑共济失调6型,脊髓小脑共济失调7型和脊髓小脑共济失调17型。即,用于改善运动症状,即患者的平衡、运动协调和/或运动表现的缺乏。
所公开的主题还涉及包含治疗有效量的西酞普兰、艾司西酞普兰或它们的盐和药用载体、佐剂、赋形剂或它们的混合物的药物组合物,用于治疗神经变性疾病。
在一个实施方式中,组合物包含对具有受蛋白质错误折叠和/或聚集的减少的积极影响的神经变性疾病的人给予的每日剂量,其中该剂量小于40mg/天,优选为20-40mg/天,更优选为30-38mg/天,特别地通过口腔给予。
在一个实施方式中,每日形式由片剂、栓剂、安瓿或其它装置组成,其包含限定量的西酞普兰或艾司西酞普兰,其全部旨在以单一剂量形式给予。
在整个说明书和权利要求书中,词语“包含”和词语的变化形式不旨在排除其它技术特征、添加剂、组分或步骤。本发明的另外的目的、优点和特征对于本领域的技术人员来说在检查说明书时将变得显而易见或可以通过本发明的实施知晓。通过说明的方式提供以下实施例和附图,并且它们不旨在限制本发明。此外,本发明涵盖了本文所述的特定和优选实施方式的所有可能的组合。
附图说明
图1.西酞普兰和其它ssri在mjd的秀丽隐杆线虫模型中恢复运动表现。(a)用西酞普兰治疗时,at3q130动物的运动缺陷。(b)西酞普兰治疗时at3q130动物的运动缺陷的剂量响应曲线,(c)用s-西酞普兰(艾司西酞普兰)、氟西汀和齐美利定治疗时,at3q130动物的运动缺陷。(d)在西酞普兰、s-西酞普兰(艾司西酞普兰)和氟西汀治疗时,at3wt的运动性表现(n=3±s.d.),p>0.05(学生t检验)。at3q130,突变型txn3动物;at3wt,野生型atxn3动物、cit,西酞普兰;s-cit,s-西酞普兰;fluox,氟西汀;zimel,齐美利定。
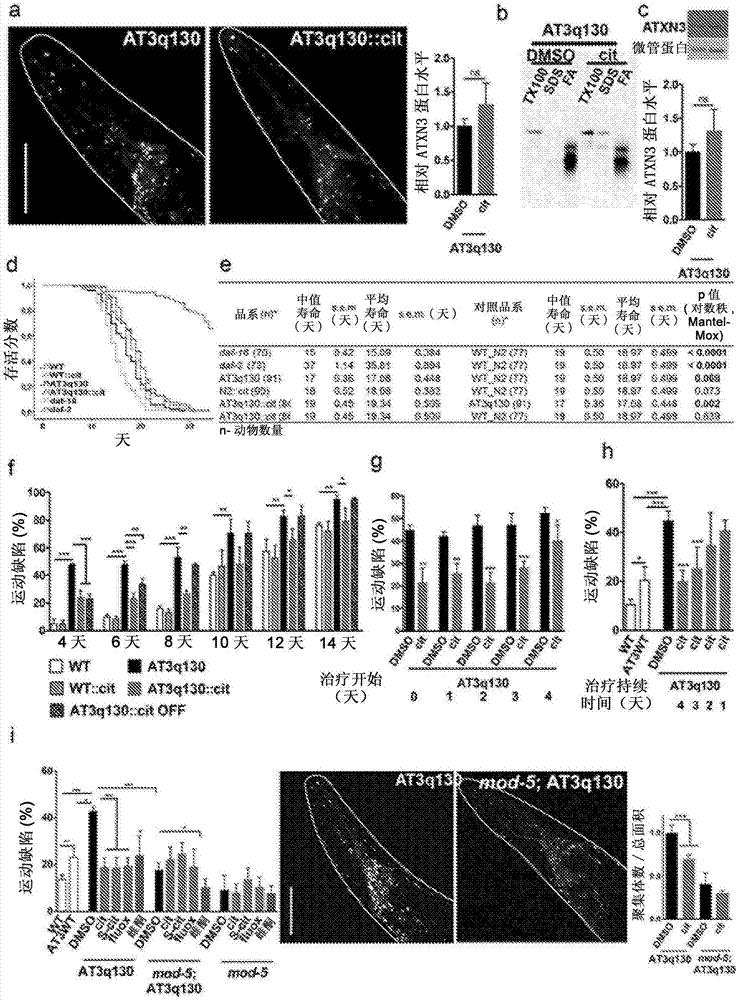
图2.秀丽隐杆线虫中早期寿命慢性西酞普兰治疗抑制的突变型atxn3聚集和神经元功能障碍。(a)西酞普兰治疗时,at3q130动物的中的聚集量化;(b)在at3q130蛋白提取物(n=3之中)的生物化学分级分离时,atxn3蛋白的代表性免疫印迹分析;(c)at3q130西酞普兰动物中的人atxn3蛋白水平;(d)西酞普兰治疗时,at3q130动物的存活和(e)统计学;(f)西酞普兰治疗的wt和at3q130动物的运动性和疾病进展时的去药物作用;(g)治疗4天的at3q130西酞普兰动物的运动行为,其中在指定的天数时开始治疗和(h)指定天数的治疗持续时间;(i)在mod-5背景中和用西酞普兰、s-西酞普兰和氟西汀治疗时,at3q130动物的运动损伤和聚集负荷。对于运动行为测定:(n=3-4,±s.d.),*p<0.05,**p<0.01,***p<0.001(学生t检验)。对于聚集量化:(n≥8,±s.d.),*p<0.05,**p<0.01,<0.001(anova,bonferroni检验)。对于免疫印迹:(n=4,±s.d.),p>0.05(学生t检验)。tx100,tritonx-100;fa,甲酸;cit,西酞普兰;s-cit,s-西酞普兰(艾司西酞普兰);fluox,氟西汀;wt,野生型。
图3.5-羟色胺能信号以g蛋白结合受体依赖性方式改善atxn3发病机制。(a)显示5-ht被合成并释放到突触间隙,其中其活化突触后5-ht受体的5-羟色胺能突触的示意图。戊卡色林可以活化与ser-1结合的调控信号。吲哚洛尔、麦角醇和dhe可能拮抗5-ht自身受体ser-4,而5-ht1ar激动剂丁螺环酮可能使受体脱敏,阻断由突触前神经元中的5-ht自身受体介导的停止产生信号;(b)用戊卡色林、丁螺环酮、dhe、吲哚洛尔和麦角醇治疗的at3q130动物的运动行为;(c)具有和没有西酞普兰、s-西酞普兰和雌酮治疗的ser-1遗传背景中的at3q130动物的运动性缺陷和聚集负荷;(d)在不存在ser-4的情况下,at3q130动物的运动性表现和突变型atxn3聚集表型。对于运动行为测定:(n=3-4,±s.d.),*p<0.05,**p<0.01,<0.001(学生t检验)。对于聚集量化:(n≥12,±s.d.)*p<0.05,**p<0.01,<0.001(anova与bonferroni检验)。dhe、二氢麦角胺;cit,西酞普兰;s-cit,s-西酞普兰(艾司西酞普兰)。
图4.cmvmjd135小鼠在疾病的完全症状阶段显示5-ht和5-ht代谢转换的正常水平。在24周龄时,在(a)小脑(n=5wt;n=7cmvmjd135),(b)延髓(n=6wt;n=8cmvmjd135)和(c)黑质(n=5wt;n=5cmvmjd135)中通过hplc测量5-ht、5-羟基吲哚乙酸(5-hiaa)和5-ht周转水平(通过5-hiaa/5-ht比率评估)。数据显示为平均值±s.e.m。p>0.05(学生t检验)。to,转换。wt,野生型。
图5.8mg/kg的西酞普兰治疗对cmvmjd135小鼠的神经功能缺损的影响,(a)临床前治疗试验的示意图,(b)在介质(n=13)和西酞普兰处理的cmvmjd135小鼠(n=16)之间观察到体重的显著差异(p=0.001,20-34周);(c)在14周龄时,爪子拖动的轻度改善。(d)探查活动没有改善,(e)对肌力测试:挂线和前肢力量,以及(f)后肢张力没有影响,(g)在介质(n=13)和西酞普兰治疗的cmvmjd135小鼠(n=16)之间观察到步长的显著差异(p=0.015,30周),(h)震颤,(i)肢体抱握和(j)步态在晚期用表型改进评价18至34周龄。(n=13-16,±s.d.),*p<0.05,**p<0.01且***p<0.001(非参数变量的曼-惠特尼u检验和anova,连续变量的杜凯氏校正。对于挂线测试:cmvmjd135组的对数模型的r平方比较),cit,西酞普兰。
图6.西酞普兰治疗减轻了mjd小鼠中的平衡和协调的损伤,以突变型atxn3聚集。在(a)平衡梁行走测试(p<0.001,20-34周)和(b)游泳(p<0.001,14-34周)测试中,观察到介质(n=13)和西酞普兰处理的cmvmjd135小鼠(n=16)之间的显著差异;(c)来自wt的sn,介质体和西酞普兰处理的cmvmjd135小鼠(每组n=5)中的每面积的gfap阳性细胞免疫组织化学和定量,(d)介质和cit处理的cmvmjd135小鼠(n=4,34周)的pn、ttg、7n和lrt中的神经元包涵体;(e)来自介质和cit处理的cmvmjd135小鼠(n=5,34周)的总人atxn3蛋白的脑干免疫印迹和定量。数据表示为平均值±s.e.m.,*p<0.05且**p<0.01(anova,杜凯氏校正(a,b)和单向anova(c-e))。比例尺,20μm。cit,西酞普兰;wt,野生型;sn,黑质;pn,脑桥核;rttg,脑桥的网状被盖核;7n,面部运动核;lrt,外侧网状核。
图7.8mg/kg下的西酞普兰治疗对wt小鼠的体重和运动行为的影响。介质和西酞普兰处理的wt小鼠的(a)体重,(b)横梁行走和(c)运动游泳测试。西酞普兰治疗导致体重显著增加(处理:f1,18=5.337,p=0.033)。在横梁行走(处理:f1,16=0.748,p=0.40)和运动游泳测试(处理:f1,14=0.043,p=0.839)中没有观察到wt和西酞普兰处理的wt小鼠之间的差异。(n=10±s.e.m.),*p<0.05,**p<0.01和***p<0.001(重复测量anova)。cit,西酞普兰;wt,野生型。
图8.用更高剂量的西酞普兰(13mg/kg)处理导致cmvmjd135小鼠的神经学症状的有限改善。介质(n=14)和西酞普兰处理的(13mg/kg)wt(wtcit13)小鼠(n=17)以及介质(n=16)和西酞普兰处理的(13mg/kg)cmvmjd135小鼠(cmvmjd135cit13)(n=13)的(a)体重,(b)步长,(c)横梁行走和(d)的运动游泳测试。没有观察到cmvmjd135和cmvmjd135cit13小鼠之间的体重差异(基因型:f1,67=31.335,p<0.001;处理:f2,67=14.181,p=0.000007;基因型*治疗f1,67=1.425,p=0.237;事后杜凯氏检验(介质对照cit处理的cmvmjd135,p=0.431)。西酞普兰处理的wt小鼠显示体重显著增加(杜凯氏检验,p=0.007)。没有观察到在治疗时步长的差异。对于横梁行走测试,在20和24周龄时检测到表现的轻微改善(单向anova,杜凯氏检验,分别为p=0.03和p=0.031;基因型:f1,49=124.181,p<0,001;处理:f1,49=2.478,基因型*处理:f1,49=2.478,p=0.122)。在运动游泳测试中,仅在22周和34周龄时观察到处理时的显著差异(单向anova,杜凯氏检验,分别为p=0.016和p=0.041,基因型:f1,64=118.157,p<0,001,处理:f2,64=19.959,p<0,001;基因型*处理:f1,64=6.3,p=0.015)。数据表示为平均值±s.e.m.,*p<0.05,**p<0.01和***p<0.001(重复测量anova,杜凯氏校正)。cit13,13mg/kg下的西酞普兰;wt,野生型。
具体实施方式
本公开涉及使用西酞普兰或艾司西酞普兰作为活性成分治疗神经变性疾病,特别是多聚谷氨酰胺疾病,特别是马查多-约瑟夫病(mjd)或脊髓小脑共济失调3型(sca3)。
秀丽隐杆线虫sert的药理和遗传阻碍抑制atxn3的发病机制
西酞普兰是具有经证实的安全记录的ssri,其广泛用于治疗抑郁症(mandrioli,r.,mercolini,l,saracino,m.a.&raggi,m.a.selectiveserotoninreuptakeinhibitors(ssris):therapeuticdrugmonitoringandpharmacologicalinteractions.),currmedchem19,1846-63(2012))。西酞普兰的主要分子靶标是5-ht转运蛋白(sert),其负责5-羟色胺能神经元的5-ht再摄取。该目标特异性和保守性促使我们在该模型的无脊椎动物模型中检查西酞普兰对mjd发病机制的影响。用西酞普兰处理引起突变体atxn3介导的神经元功能障碍的完全挽救(图1a),其中剂量响应曲线和得出的半最大有效浓度(ec50)值为45μm(图1b)。西酞普兰以外消旋体混合物形式存在,但其效果主要是由于s-对映异构体、艾司西酞普兰;这种和其它ssri也对at3q130动物具有有益的影响(图1c)。wt动物的正常行为和运动性、发育和繁殖不受ssri治疗影响(图1d)。重要的是,如通过生物化学分级分离评估的,西酞普兰治疗显著降低了秀丽隐杆线虫神经元中的突变型atxn3聚集(图2a),并增加了atxn3溶解度(图2b),而不影响蛋白质的总体水平(图2c)。
在连续暴露于西酞普兰时,at3q130动物的存活被挽救(图2d,e),并且在直到第14天龄,atxn3动物中的神经元功能障碍恢复(图2f)。当撤回西酞普兰时,这种有益效果下降,并且在离开治疗3至4天后恢复神经毒性(图2f)。最大的保护需要早期治疗(从卵阶段直到成年的第四天)(图2g);此外,药物暴露期的长度是重要的,因为两天的治疗不足以产生有益效果(图2h)。
在秀丽隐杆线虫中,存在脊椎动物sert的一种5-ht转运蛋白直系同源物mod-5。为了证实5-羟色胺重获的药理学抑制的有益效果,我们证明mod-5的基因切除拯救了秀丽隐杆线虫中的突变体atxn3介导的运动功能障碍和聚集(图2i)。药物遗传分析也支持mod-5作为线虫中的西酞普兰的细胞靶标,因为在没有mod-5的情况下,使用该药物治疗没有进一步改善突变体atxn3介导的发病机制。相反,雌酮(甾体激素)能够进一步降低mod-5;at3q130动物的运动性障碍(图2i),这与这两种化合物的独立的作用模式一致。
使用药理学和药物遗传学方法检查5-ht受体(5-htr)的作用(图3a)。通过5-ht2cr激动剂戊卡色林活化突触后5htr,并通过丁螺环酮、二氢麦角胺、麦角醇或吲哚洛尔刺激突触前5-ht自身受体(图3b)改善了atxn3介导的运动功能障碍。与此一致,5-ht突触后g蛋白结合的受体ser-1的基因切除增强了at3q130聚集和运动缺陷(图3c)。同样地,西酞普兰的作用也取决于这些受体。此外,通过消除负反馈的ser-4自身受体的切除可能增加5-ht可用性,恢复运动并降低体内atxn3聚集(图3d)。总之,这些结果支持mod-5的药理学和遗传学抑制恢复运动性并通过调节5htr活性抑制at3q130的聚集的想法。
西酞普兰治疗改善cmvmjd135小鼠的运动平衡和协调
为了进一步证实西酞普兰的治疗效果,我们使用mjd、cmvmjd135的转基因小鼠模型,其显示进展型mjd样运动衰竭和神经病理学,包括中枢神经系统(cns)中的atxn3阳性核内包涵体。尽管cmvmjd135小鼠没有显示出通过hplc测量的基线5-ht水平的变化(图4),但对这些动物的西酞普兰(8mg/kg)的口服给予(研究设计-图5a)防止了它们的体重增加的减少(图5b),并且对运动表型有显著的有益作用。虽然爪的拖动(图5c)仅有小幅改善且对探查活动(图5d)、抓握力(图5e)和后肢张力(图5f)的影响有限,但在试验的晚期阶段西酞普兰治疗恢复步长到wt水平(图5g)。此外,治疗的动物显示减少的震颤(图5h)、减少的肢体抱握(图5i)和改善的步态质量(图5j)。与介质治疗的cmvmjd135小鼠相比,西酞普兰治疗也导致平衡和运动协调的显著改善。在平衡梁行走测试中,我们观察到20至34周龄在跨越12mm方形梁所花费的时间的显著改善(图6a)。在运动游泳测试中观察到西酞普兰最显著的益处(图6b),因为在许多时间点并且直到相当晚,无法区分试验西酞普兰治疗的动物与wt。总体上,这些结果表明,西酞普兰可减少mjd小鼠的运动协调的损伤,对力量的益处较少,表明对脑干、中脑或小脑水平的影响,而不是对脊髓小脑束和肌肉神经支配的影响。治疗也显著延缓小鼠的疾病进展。
在一个实施方式中,西酞普兰处理的wt小鼠与它们的未经处理的同窝仔畜的行为类似,证实了该效应的特异性(图7)。此外,与上述的所有范例中的介质处理的对照相比,以13mg/kg的剂量治疗的cmvmjd135小鼠显示出更有限的改善(图8)。
在一个实施方式中,来自cmvmjd135小鼠的脑组织的分析显示,西酞普兰治疗(8mg/kg)减轻了脑干中的反应性星形胶质细胞增生(图6c)并且降低脑干中的atxn3核内包涵体(图6d),类似于减少秀丽隐杆线虫中的神经元聚集。当与它们的介质处理的对应物相比时,在cmvmjd135处理的小鼠的脑桥核(pn)、脑桥的网状被盖核(rttg)和面部运动核(7n)中观察到这种减少(图6d);西酞普兰在外侧网状核(lrt)中的影响较不明显。该减少的atxn3聚集不对应于脑干中的atxn3蛋白水平的较低水平(图6e),表明西酞普兰在小鼠中的效果与秀丽隐杆线虫相似,影响突变型atxn3的折叠和稳定性,而不是蛋白质的清除。
本主题显示在秀丽隐杆线虫和小鼠模型中西酞普兰和其它ssri抑制mjd发病机制,显示对运动性/协调、突变型atxn3的聚集和疾病进展的有益效果。通过西酞普兰的mod-5(和sert)抑制导致增加的细胞外5-ht水平和增强的5-羟色胺能神经传递,其可以引起对神经元活动、适应和重塑的5-ht依赖性影响。
用于改善秀丽隐杆线虫和小鼠中的突变型atxn3介导的神经毒性的ssri的治疗作用需要长期治疗;同样,西酞普兰长期治疗对于抑郁症是必需的。这种ssri治疗模式导致5-ht1a自身受体脱敏,其钝化在突触前神经元中发生的负反馈机制,从而增加5-ht可用性并活化突触后受体。吲哚洛尔,具有5-ht1a受体拮抗剂性质的β-肾上腺素能受体部分激动剂,当与ssri组合时导致与单独的ssri相比至首次响应的时间显著降低。此外,直接激动剂(例如,丁螺环酮)对5-ht1a自身受体的更快的脱敏也可以加速ssri的治疗功效。一致地,通过长期治疗靶向5-ht自身受体改善了秀丽隐杆线虫中的突变型atxn3介导的发病机制。
mjd中对于慢性和早期症状治疗的需要表明神经保护机制,而不是对mjd小鼠中的信号级联或5-ht的不平衡的校正的立即影响。此外,西酞普兰和mod-5灭活对聚集atxn3的影响与5-羟色胺能神经传递对生物体的蛋白内稳态的再平衡的影响是一致的。事实上,最近已经描述了来自神经元的5-羟色胺向远端组织的释放活化保护机制的信号以防止蛋白质毒性。
将用西酞普兰获得的效果与文献中描述的对mjd模型中具有积极作用的那些比较,该ssri看上去具有更高的治疗效果。从我们自己的工作,当我们比较目前的结果与先前对hsp90抑制剂17-dmag的发现时(silva-fernandes,a.etal.chronictreatmentwith17-dmagimprovesbalanceandcoordinationinanewmousemodelofmachado-josephdisease,neurotherapeutics(2014)),我们观察到西酞普兰的更显著的治疗效果。即,与通过西酞普兰治疗的至少20周相比,通过17-dmag治疗,运动游泳缺陷的表现延迟8周;此外,在30周时,在该测试中17-dmag的作用的百分比为33%,且西酞普兰为79%。在两个实验中,治疗组(归一化至相应的未治疗组)之间的性能差异在该年龄时具有统计学显著性(p=0.018)。
总之,西酞普兰在两种疾病模型中抑制atxn3发病机制的功效以及其广泛用于抑郁症患者的安全记录促使我们建议该药物用于mjd患者的临床试验。
方法
线虫品系和一般方法。用于该工作中的菌株和名称缩写的列表参见表1。将所有品系与bristol品系n2回交5至8次。使用标准方法培养和观察秀丽隐杆线虫,除非另有说明。在20℃下在大肠杆菌op50菌株接种的线虫生长培养基(ngm)板上生长线虫。
表1.本工作中使用的品系、缩写和杂交的列表
化合物.所有的化合物都是从以下所示的商业供应商获得的,并且不经进一步纯化使用:雌酮cas53-16-7(sigma,usa),氟西汀cas56296-78-7(kemprotecldt,uk),齐美利定cas61129-30-4(sigma,usa),麦角醇cas602-85-7(sigma,usa),吲哚洛尔cas13523-86-9(sigma,usa),盐酸曲唑酮cas25332-39-2(sigma,usa),氢溴酸西酞普兰cas59729-32-7(kemprotecldt,uk),氢溴酸艾司西酞普兰(s-citalopram)cas219861-08-2(kemprotecldt,uk)。由lundbeck(denmark)友情提供用于小鼠中的研究的西酞普兰和戊卡色林。
药物毒性测定.使用bristol菌株n2来测定化合物毒性并测定使用的安全浓度。在液体培养中以96孔板形式进行测定。每个孔含有60μl的最终体积,包含20-25只卵阶段的动物,适当浓度的药物和op50细菌,达到在酶标仪(bio-rad酶标仪680)中测量的0.6-0.8的最终od595nm。为了获得年龄同步的卵的群体,用碱性次氯酸盐溶液(0.5mnaoh,约2.6%的naclo)将妊娠成虫处理7分钟。然后,将动物在m9缓冲液中洗涤,重新悬浮于s-培养基中至适当的卵数并转移到96孔板中。将op50细菌在luria肉汤(lb)培养基中在37℃和150rpm下生长过夜,通过离心造粒,通过4-6个循环的冷冻/解冻灭活,在-80℃下冷冻,然后重新悬浮于补充有胆固醇、链霉素、青霉素和制霉菌素的s-培养基中(sigma,usa)。在20℃下以180rpm连续摇动(shellab),在7天期间使虫生长。在100%的dmso(sigma,usa)中制备化合物,并在对应于1%dmso的最大浓度的稀释液下测试,以避免溶剂特异性发育缺陷和毒性。对于每种化合物,测试两种最终浓度(50μm和25μm)。通过消耗大肠杆菌食物悬浮液的速率来监测化合物对秀丽隐杆线虫生理学的影响,作为秀丽隐杆线虫生长、存活或繁殖力的读数。每天测量吸光度(od595nm)。使用仅op50(s-培养基,无介质)和dmso1%(介质)对照。
运动性缺陷和聚集的秀丽隐杆线虫测定.如上所述,将动物(n2、at3wt或at3q130)与化学化合物在液体培养基中以96孔板形式生长。将四日龄的动物从96孔板转移到未接种的ngm板上(在20℃下平衡)。在开始测定之前使板干燥1小时。如前所述,在20℃下进行运动性测定。一式三份或一式四份地(n=3或4)运行运动行为测定,其中每种基因型和/或化合物测试总共至少150只动物。对于atxn3聚集的共聚焦动态成像和定量,将活动物用3mm左旋咪唑(sigma,usa)固定并安装在3%的琼脂糖垫上。所有图像均在olympusfv1000(japan)或zeisslsm510(germany)共焦显微镜上,在60x油(na=1.35)或63x水(na=1.0)物镜下获取。对于所有介质和化合物处理的动物,使用用于yfp融合蛋白的515/514nm激光激发线获取z系列成像。将针孔调整为1.0艾里单位(airyunit)的光学切片,并且沿着z轴每约0.5μm获得扫描。对于聚集体的定量,测量三个参数:聚集体的面积/总面积;聚集体的数量/聚集体的总面积和数量。显示的值是每组8只或更多只动物的平均值(归一化至介质处理的对照),除非另有说明。
秀丽隐杆线虫西酞普兰时程测定.对于时程实验,将动物在具有补充有西酞普兰的op50的ngm板上生长。如以上描述的制备op50培养物,并用补充有链霉素、青霉素和制霉菌素的s培养基(sigma)浓缩10倍。制备西酞普兰(2.5mm和0.5mm)(kemprotec,uk)或介质(dmso,sigma,usa)的储备溶液并加入op50培养物中至25μm或5μm的终浓度。用200μl的op50-西酞普兰/介质接种板,并在室温下放置(rt)以干燥至少三天。每周制备2至3次新鲜板以防止药物降解。通过将动物处理4天,此后将动物转移到dmso板(介质)上来评估去药物作用。在生殖期间,每天将动物转移到新鲜板中。
免疫印迹分析.为了测定atxn3的稳态蛋白水平,将动物在如上所述的96孔板形式的具有西酞普兰的液体培养基中温育。将四日龄的动物从液体培养基转移到未接种的ngm板上(在20℃下平衡)。如前所述,在驯化1小时后,挑选25只个体年轻成年动物,在sds样品缓冲液中煮沸15分钟(为了破坏所有聚集体),并将所得提取物在10%的sds凝胶上溶解。用抗atxn3小鼠(1h9,mab5360,milipore,usa;1:1000或1:150)和抗微管蛋白小鼠抗体(t5168,sigma,usa;1:5000)探测免疫印迹;并用辣根过氧化物酶结合的第二抗体(biorad,usa)和化学发光(ecl免疫印迹检测试剂,amershampharmacia,uk)检测。如我们的团队之前描述的,进行小鼠脑干组织的蛋白质分离和免疫印迹。将印迹阻断,并在4℃下用一级抗体兔抗脊髓小脑性共济失调蛋白-3血清(由henrypaulson博士友情提供)(1:5000)和小鼠抗gapdh(g8795,sigma,usa,1:1000)温育过夜。作为加载对照,使用小鼠脊髓小脑性共济失调蛋白-3和gapdh。根据制造商的说明,使用chemidocxrs软件与imagelab软件(biorad,usa)或imagej软件(nih,usa)进行免疫印迹定量。如前所述进行atxn3分级分离试验,具有以下修改:将at3q130动物在ngm-西酞普兰/介质板中生长4天。收集线虫并在m9缓冲液中洗涤,并在液氮中休克冷冻之前将其悬浮于ripa缓冲液(50mmtris,150mmnacl,0.2%tritonx-100,25mmedta,补充有完全蛋白酶抑制剂(roche,usa))中。在三次冻融循环后,用机动研杵将虫的丸粒研磨,并在0.025u/ml的核酸酶(sigma,usa)的存在下在冰上溶解。将溶解物在台式离心机中以1000rpm离心1分钟以将残骸制成丸状。使用bradford测定(bio-rad,usa)测定蛋白质浓度,并在所有实验条件下设定为3-4μg/μl的终浓度,然后在4℃下以22,000g离心30分钟。从上清液(tritonx-100可溶性部分)中分离丸粒部分,并在含有2%的sds的150μl的ripa缓冲液中均化,然后在室温下进行第二离心步骤。除去上清液(sds可溶性部分),并将剩余丸粒在37℃下在100%甲酸(fa)中温育16小时。在37℃下fa蒸发后,将丸粒溶解在25μl的laemmli缓冲液(sds不溶性部分)中,然后用2mtris-碱进行ph调节用于sds-page分析。将凝胶用50μg的tritonx-100部分、40μl的sds可溶性部分和完全sds不溶性部分加载。如上描述的进行免疫印迹分析。
寿命.如前所述,在20℃下进行测定。在每个皮氏培养皿上培养约100只雌雄同体,每天转移到新鲜板中,直到后代产生停止以及此后每约1-3天。如果动物在刺激时没有表现出自发的运动或反应,则被评为死亡。显示内部孵化的后代、突出的性腺或干枯的死亡动物排除在外。
转基因小鼠模型和药物给予.如前所述的产生cmvmjd135小鼠。如前所述进行dna提取、动物基因型分型和cag重复尺寸分析。所有使用的小鼠的平均重复尺寸(±s.d.)为130±2。将年龄匹配和遗传背景匹配的wt动物用作对照。本研究中仅使用雄性小鼠。我们以两种剂量(8和13mg/kg/天),在饮用水中给予氢溴酸西酞普兰cas59729-32-7(lündbeck,denmark),其大致等于规定为人类抑郁症患者的高剂量范围。在五周龄时开始治疗,其为第一次神经学症状的预期发作前一周。根据为未治疗的cmvmjd135小鼠确立的人道终点,该试验在34周龄时结束。所有动物程序均根据欧洲法规(欧盟指令86/609/eec)进行。动物设施和直接参与动物实验的人员(atc、se、asf、sds)经葡萄牙监管机构
神经化学定量.将cmvmjd135和wt雄性同窝小鼠(n=5-8)在24周龄时通过断头处死,将它们的脑快速去除,快速冷冻在液氮中并切片。如前所述,通过高效液相色谱,结合电化学检测(hplc/ec)测量在黑质、延髓和小脑中的5-ht和5-羟基吲哚乙酸(5-hiaa)水平。使用标准曲线计算神经递质的浓度,结果以单位量的蛋白质的5-ht和代谢物含量表示。
行为评估.在昼夜期间,以每笼五只雄性的组,包括用西酞普兰或用介质(水)处理的cmvmjd135半合子转基因小鼠和wt同窝仔畜(每基因型n=13-16)进行行为分析。所有行为测试均在症状发生前期(4周)开始,并进行直到30或34周龄(图5a)。使用shirpa方案进行神经病学测试和一般健康评估,使用吊线测试丰富。用足印分析评估爪的拖曳和步长。使用平衡梁步行测试(12mm的正方形和17mm的圆形梁)和运动游泳测试进一步评估运动行为。如前所述进行所有行为测试(silva-fernandes,a.etal.chronictreatmentwith17-dmagimprovesbalanceandcoordinationinanewmousemodelofmachado-josephdisease,neurotherapeutics(2014))。对每个评估时间点还登记了体重。
神经元内涵体的免疫组织化学和定量.用盐酸氯胺酮(150mg/kg)加美托咪定(0.3mg/kg)的混合物将介质和西酞普兰处理的34周龄的wt和cmvmjd135同窝小鼠(每组n=4)深度麻醉,并用磷酸盐缓冲盐水(pbs),然后用4%多聚甲醛(pfa)(panreac,usa)心脏灌注。去除大脑并在pfa中后固定过夜并包埋在石蜡中。将具有4μm厚的石蜡切片的载玻片经受抗原修复,然后与小鼠抗atxn3(1h9,mab5360,milipore,usa;1:100)或兔抗gfap(dakocorporation,carpinteria;1:1000)一起温育,将其通过与生物素化的抗多价抗体温育,然后通过与辣根过氧化物酶结合的生物素-链霉亲和素的检测和与dab(3,3'-二氨基联苯胺)底物(labvisiontmultra-visiontm检测试剂盒,thermoscientific)反应来检测。根据标准程序,用苏木精25%将载玻片复染色。如前所述,将脑桥核(pn)、脑桥的网状被盖核(rttg)、面部运动核(7n)和外侧网状核(lrt)中的atxn3阳性内涵体;和介质或西酞普兰处理的动物(每种条件n=4,每个动物4个载玻片)的黑质(sn)中染色的星形胶质细胞(gfap阳性)定量并使用olympusbx51体视学显微镜(olympus,japan)和visiopharma积分器系统软件(visopharm,denmark)将整个区域归一化。
统计学分析.当变量不连续或连续变量不表现为正态分布时(kolmogorov-smirnov检验,p<0.05),通过非参数曼-惠特尼u检验分析数据。使用重复测量anova用于纵向多重比较和单向anova或学生t检验用于成对比较,使用杜凯氏或bonferroni检验用于事后比较,分析了具有正态分布和均匀性方差的连续变量(levene检验)。当不假定后两种假设时,应用适当的数据变换(例如,对数),并重新分析数据(体重、平衡梁步行测试和运动游泳测试)。当对数数据变换没有减小方差的不均一性(挂线测试)时,应用几种数学模型。在该测试中,最佳拟合模型为对数,并根据cmvmjd135组的r平方使用正态残差分布分析治疗差异。使用对数秩(mantel-cox)检验进行秀丽隐杆线虫生存测定的统计学分析。采用spss20.0/22.0(spssinc.,chicago,il)和g-power3.1.9.2(universitykiel,germany)进行所有统计学分析。在整个研究中使用p<0.05的显着性的临界值。
本发明显然不以任何方式限于本文描述的实施方式,并且本领域的一般技术人员可预测本发明的许多可能的修改和通过其它等同物的技术特征的替代,这取决于如所附权利要求所限定的每种情况的要求。
上述实施方式可彼此组合。以下权利要求进一步限定本发明的优选实施方式。
- 还没有人留言评论。精彩留言会获得点赞!