两亲性嵌段共聚物胶束复方载药递药系统及脑靶向水溶性胶束的制备方法与流程
本发明涉及脑靶向制剂领域,具体地,涉及一种两亲性嵌段共聚物胶束复方载药递药系统及脑靶向水溶性胶束的制备方法。
背景技术:
紫杉类药物(紫杉醇、多西紫杉醇)是目前治疗转移性乳腺癌的主要用药之一,尽管紫杉类药物应用广泛,但其有很多无法避免的毒副作用,包括:脱发、疲乏、肌肉痛、骨髓抑制、神经毒、过敏反应等。
同时,紫杉类药物高度不溶于水,其在水中溶解度为0.5μg/ml,因而在给药时需要以聚氧乙烯蓖麻油及无水乙醇(1:1,V/V)为助溶剂,而聚氧乙烯蓖麻油可能会诱发患者产生致命的过敏反应,因而,为预防过敏反应,需要用大剂量抗组胺药物及糖皮质激素对患者进行预处理。以上诸多不良因素则会降低患者的顺应性,进而在一定程度上限制了紫杉类药物的应用。
拉帕替尼是一种口服的小分子表皮生长因子(EGFR:ErbB-1,ErbB-2)酪氨酸激酶抑制剂。临床主要用于Her-2阳性且既往接受过包括蒽环类,紫杉醇,曲妥珠单抗(赫赛汀)治疗的晚期或转移性乳腺癌。
基于一系列临床试验的结果,拉帕替尼对于复发转移、对赫赛汀耐药的HER2阳性乳腺癌患者,均有很好的临床效果,因此目前拉帕替尼可以作为单药或与化疗药物联合在临床上应用。
拉帕替尼在晚期或转移性Her-2阳性的乳腺癌的治疗中,具有不可替代的优势。但是,拉帕替尼的水溶性很差,在水中的溶解度仅为0.007mg/ml,难以制备水溶性注射剂,只能以口服片剂的方式给药。不仅如此,拉帕替尼的生物利用度还很低(小于20%),需要增加给药剂量(单次给药剂量达1.25g)和给药频次。由于该药物价格昂贵,因此目前服用拉帕替尼极大增加了肿瘤患者的毒副作用及经济负担,并在一定程度上减弱了患者的依从性。
对于晚期乳腺癌患者而言,上述药物的副作用极大地降低了依从性从而使疗效大打折扣,更重要的是,由于紫杉醇、拉帕替尼很难在脑转移病灶中达到有效剂量,这些难以忍受的药物剂型,对乳腺癌脑转移瘤基本无效。
因此,研发紫杉醇、拉帕替尼复方水溶性注射给药系统及具有脑靶向功能的递药系统,有望提高生物利用度和抗肿瘤效果,降低毒副作用,提高药物经济效益,具有良好的研究价值和临床意义。
发明的内容
本发明旨在克服上述缺陷,将紫杉醇、拉帕替尼制成复方水溶注射剂及具有脑靶向功能的递药系统,当在该上递药系统连接亲大脑内皮细胞的短肽分子Angiopep-2,使得载药胶束具有脑靶向功能,能够跨越血脑屏障并且到达脑转移病灶部位,发挥疗效。
此外,在本发明中,以不同的抗癌机制发挥疗效,不仅能够克服单药易耐药的缺点,并且由于靶向给药,能够减少化疗药物对全身的不良作用,有望进一步提高生物利用度和抗肿瘤效果,降低毒副作用,提高药物经济学效益。
本发明提供了一种脑靶向水溶性胶束,其特征在于:将载紫杉醇和拉帕替尼的复方纳米胶束与亲大脑内皮细胞的短肽分子Angiopep-2相连接。
进一步地,本发明提供的一种脑靶向水溶性胶束的制备方法,其特征在于,具体制造工序如下所示:
步骤一、在载紫杉醇和拉帕替尼的复方纳米胶束溶液中投入活化剂,活化胶束外层聚合物上的羧基键;
步骤二、在活化好的载拉帕替尼的两亲性嵌段纳米胶束溶液中投入Angiopep-2,于10-40℃的温度下孵化,使胶束的羧基键与短肽的氨基键连接,形成具有靶向功能的胶束;
步骤三、除去活化剂,得到纯净的脑靶向纳米胶束水溶液。
进一步地,本发明提供的一种脑靶向水溶性胶束的制备方法,还具有这样的特点:即、上述活化剂的添加量为拉帕替尼用量的1-10倍;优选为3-6倍。
上述Angiopep-2的用量为拉帕替尼用量的0.1-5倍;优选为0.3-0.7倍。该Angiopep-2的用量一般为活化剂添加量的0.08-0.5倍。上述用量均为质量比。
其中,上述拉帕替尼指用于制备载拉帕替尼的两亲性嵌段纳米胶束溶液的过程中所使用的拉帕替尼的量。
进一步地,本发明提供的一种脑靶向水溶性胶束的制备方法,还具有这样的特点:即、在上述步骤一中,活化剂选自可活化羧基的任何试剂,最优选使用N-羟基琥珀酰亚胺和1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐。
进一步地,本发明提供的一种脑靶向水溶性胶束的制备方法,还具有这样的特点:即、上述步骤一的活化时间为0.5-2小时,活化温度为10-80℃;
上述步骤二的孵化时间为4-12小时。
此外,本发明提供的一种脑靶向水溶性胶束,还具有这样的特点:即、上述载紫杉醇和拉帕替尼的复方纳米胶束由拉帕替尼、紫杉醇和聚合物通过薄膜水化法制备而成;
其中,上述聚合物选自聚乙二醇、聚乙二醇马来酰亚胺或甲氧基聚乙二醇与聚乳酸、聚L-丙交酯-乙交酯、聚ε-己内酯、聚(DL-丙交酯-乙交酯)、聚L-丙交酯、聚L-丙交酯中的一种或几种的共聚产物;形成如:PEG-PLA、mPEG-PLA、malePEG-PLA(聚乙二醇马来酰亚胺)等等结构的聚合物;
和/或
上述聚合物选自聚乙二醇或甲氧基聚乙二醇与聚乳酸、聚L-丙交酯-乙交酯、聚ε-己内酯、聚(DL-丙交酯-乙交酯)、聚L-丙交酯、聚L-丙交酯中的一种或几种的末端进行羧基封端的共聚产物。形成如:HOOC-PEG-PLA、HOOC-mPEG-PLA等等结构的聚合物。
其中,上述共聚物中,聚乙二醇或甲氧基聚乙二醇选自分子量为500-50000的聚乙二醇或甲氧基聚乙二醇;优选自分子量为1000-10000范围内的聚乙二醇或甲氧基聚乙二醇;最优选自分子量为1000、2000、3000、4000、5000的聚乙二醇或甲氧基聚乙二醇。
上述共聚物中,聚乳酸、聚L-丙交酯-乙交酯、聚ε-己内酯、聚(DL-丙交酯-乙交酯)、聚L-丙交酯或聚L-丙交酯选自分子量为100-50000的上述化合物;优选自分子量为200-20000范围内的上述化合物中的一种或多种,与聚乙二醇或甲氧基聚乙二醇形成的嵌段聚合的产物。
此外,本发明提供的一种脑靶向水溶性胶束,还具有这样的特点:即、上述载紫杉醇和拉帕替尼的复方纳米胶束的具体制备方法如下所示:
步骤一、将拉帕替尼、紫杉醇和聚合物共同溶解于有机溶剂中;
步骤二、于10-60℃的温度下,除去有机溶剂,得到薄膜;
步骤三、于10-60℃的恒温水浴条件下,使薄膜全部溶解于水中,得到载药胶束液体;水的用量根据后续反应的需要进行添加,优选为有机溶剂用量的0.5-5倍。
步骤四、通过过滤,获得纯净的载药胶束液体。
此外,本发明提供的一种脑靶向水溶性胶束,还具有这样的特点:即、上述拉帕替尼、紫杉醇和聚合物的质量比为1:0.2-1:5-20。优选为1:0.3-0.6:8-14。上述比例均指质量比。
此外,本发明提供的一种脑靶向水溶性胶束,还具有这样的特点:即、上述有机溶剂选自低沸点的容易,优选为醇类溶剂,最优选为甲醇;
上述聚合物选自共聚产物和末端进行羧基封端的共聚产物;这两种聚合物温度混合物;
其中,上述共聚产物和末端进行羧基封端的共聚产物的质量比为10:0.1-5。
最优选自所述聚合物选自PEG-PLA和COOH-PEG-PLA=10:0.8-2(质量比)的混合物,或malePEG-PLA和COOH-PEG-PLA=10:0.8-2(质量比)的混合物。
此外,本发明还提供了上述的一种脑靶向水溶性胶束的应用,其特征在于:具有双重脑靶向功能,应用于治疗乳腺癌脑转移的病症。
本发明的作用和效果:
在本发明中,通过制备复方的水溶性载药纳米胶束,并在此基础上制备连接有脑靶向功能的载药胶束。利用氨基和羧基键将胶束与靶向分子Angiopep-2连接,制备成具有双重脑靶向功能的纳米载药胶束。经靶向载药胶束透体外血脑屏障的能力研究实验可知,本发明涉及的接有靶向分子的胶束具有良好的穿透血脑屏障的功能。
此外,目前胶束的制备方法主要是透析法、自组装法、静电作用法、化学结合法,但是,这些方法都存在各种各样的缺点,比如:透析法静电作用法,不适合大规模生产;自组装法,仅依靠范德华力等非共价键连接,所得胶束不稳定,化学结合法对材料的要求性很高。
为了克服上述缺陷,在本发明中,采用薄膜水化法制备载紫杉醇和拉帕替尼的复方水溶性胶束,利用聚合物的生物特性,形成疏水内壳包裹药物紫杉醇和拉帕替尼,亲水外壳提供良好的水溶性,能提高紫杉醇和拉帕替尼这两类水溶性极差的药物的水溶解性能,从而能扩展该类药物的应用。此外,经检测该薄膜水化法制备的复方胶束的粒径及电镜图发现,其载药量包封率完全能满足临床需求。
此外,通过研究发现,本发明提供的此类复方载药胶束比空白胶束的粒径更小,能使该药物在应用的过程中,顺利的到达目标靶点位置,因此,大大提高了其临床上的应用。
其后,该水溶性的胶束以氨基羧基键形成的共价键连接胶束与靶向短肽分子,使得胶束具有亲大脑内皮细胞功能。而载药胶束具有的脑靶向功能,能够跨越血脑屏障并且到达脑转移病灶部位,发挥疗效。
由此可见,采用本发明的方法获得的脑靶向纳米胶束,即能够满足水溶性强可注射的要求,提高生物利用度减少单次给药剂量,降低患者经济负担,提高患者依从性。
而且,本发明提供的脑靶向水溶性胶束,还具有脑靶向功能,可用于临床乳腺癌脑转移的治疗,提高脑转移患者的生存率和生活质量。
更重要的是,在本发明中,提供的一种水溶性载药胶束,以不同的抗癌机制发挥疗效,不仅能够克服单药易耐药的缺点,并且由于靶向给药,能够减少化疗药物对全身的不良作用,有望进一步提高生物利用度和抗肿瘤效果,降低毒副作用,提高药物经济学效益。
由此可见,本发明的产品,拥有良好的稳定性及生物相容性,既可以解决紫杉醇和拉帕替尼难溶性的实际问题,又能提供了一种能够主动靶向脑转移病灶的递药系统,贡献了一种全新的给药剂型,解决乳腺癌脑转移患者无药可用的困境。
附图说明
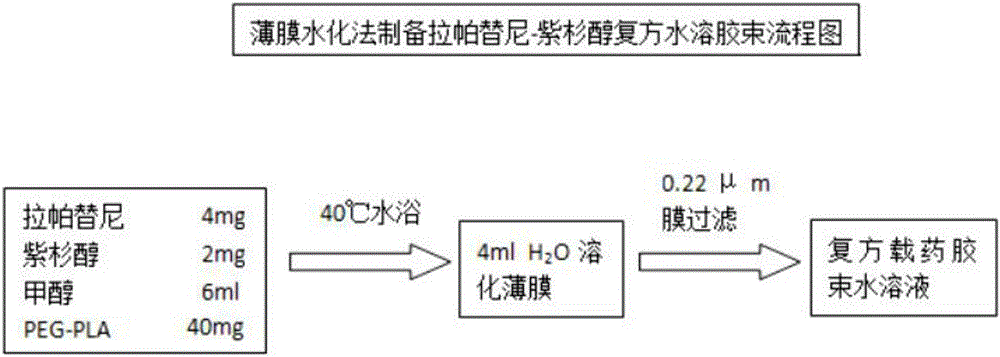
附图1、实施例一涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束1#的制备流程图;
附图2、实施例一涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束1#的粒径;
附图3、实施例一涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束1#的电镜图;
附图4、实施例二涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束2#和脑靶向纳米胶束的制备流程图。
附图5、实施例二涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束2#的粒径;
附图6、实施例二涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束2#的Zeta电位图;
附图7、靶向载药胶束透体外血脑屏障的能力研究图,即、建立体外血脑屏障模型后,两种胶束在相同时间内穿透BBB模型并进入Skbr-3细胞的定性比较图,其中,a为载cou-6的空胶束在细胞质内的分布,b为DAPI在细胞质内的分布,c为a,b图片叠加。
具体实施方式
实施例一、载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束1#
A.制备阶段:本实施例一涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束1#采用如图1所示的制备流程进行制备。
在本实施例中,采用薄膜水化法,使用甲醇作为溶剂,将聚合物malePEG-PLA和拉帕替尼、紫杉醇共溶解,旋转蒸发除尽有机溶剂并使用蒸馏水将薄膜溶于水中,形成载药胶束,过滤得到纯净的水溶性的载拉帕替尼纳米胶束。
具体工艺步骤如下:
步骤一、将4mg拉帕替尼、2mg紫杉醇和40mg聚合物malePEG-PLA共同溶解于6ml的甲醇中(在研究中发现,拉帕替尼在多种溶剂中均不能达到实验所需的溶解度,而在甲醇中溶解状态好);
步骤二、将混合溶液用移液器转移至250ml茄形瓶中,在40℃的恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的淡黄色薄膜。
步骤三、取下茄形瓶,用移液枪吸取4ml的蒸馏水,在40℃的恒温水浴条件下使薄膜全部溶解于水中,得到淡黄色透明的载药胶束液体。
步骤四、将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体。
B.胶束理化性能测定
B-1.胶束粒径电位测定
(i).加双蒸水将载药胶束LPTN+PTX-MIC稀释至适当浓度,采用粒度/Zeta电位测定仪测定粒径值。
如图2所示,载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束1#的粒径为16.3nm。
作为比对,在本实施例中还采用薄膜水化法,将适量的malePEG2000-PLA200溶于甲醇后,制备成的空白胶束,其粒径为20nm左右>载药胶束的粒径。
由此可以,看出,在载入紫杉醇和拉帕替尼后,胶束粒径反而降低了。
(ii).将胶束溶液稀释后滴加于覆盖碳膜的铜网上,用磷钨酸(pH 7.0,2%,w/v)负染,室温干燥后置于透射电子显微镜下观察胶束外部形态,如图3所示,其分散性佳。
B-2.载药量包封率的测定
(i).紫杉醇HPLC分析的色谱条件
色谱柱:Dikma Diamonsil C18(4.6×250mm,5μm)
流动相:乙腈∶双蒸水(50∶50)
流速:1.0mL/min
检测器:紫外检测器
检测波长:228nm
柱温:35℃
进样量:20μL
(ii).拉帕替尼HPLC分析的色谱条件
色谱柱:Dikma Diamonsil C18(4.6×250mm,5μm)
流动相:乙腈∶0.01MKH2PO4溶液(PH=6.2)(65∶35)
流速:1.0ml/min
检测器:紫外检测器
检测波长:253nm
柱温:35℃
进样量:20μL
精密吸取过滤后的LPTN+PTX-MIC溶液,加入定量甲醇稀释并释放出拉帕替尼,超声5min使聚合物溶解完全,0.45μm微孔滤膜过滤,取溶液进样测定。按照下式分别计算包封率(Entrapping Efficiency,EE)与载药量(Drug Loading Capacity,DLC):
紫杉醇的载药量DLC为2%,包封率EE为79%,
拉帕替尼的载药量DLC为5%,包封率EE为81%。
实施例二、载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束2#和脑靶向纳米胶束
A.制备阶段:本实施例二涉及的载紫杉醇和拉帕替尼的两亲性复方嵌段纳米胶束2#和脑靶向纳米胶束采用如图4所示的制备流程进行制备。
在本实施例二中,同样采用薄膜水化法,使用甲醇作为溶剂,将聚合物malePEG-PLA,COOH-PEG-PLA,紫杉醇和拉帕替尼按照比例共同溶解于甲醇中,旋转蒸发除尽有机溶剂并使用蒸馏水将薄膜溶于水中,形成载药胶束,并利用氨基和羧基键形成的共价键将胶束与靶向分子Angiopep-2连接,制备成具有脑靶向功能的纳米载药胶束。
具体工艺步骤如下:
步骤一、将4mg拉帕替尼、2mg紫杉醇和40mg聚合物malePEG-PLA、4mg聚合物COOH-PEG-PLA共同溶解于6ml的甲醇中(因拉帕替尼在多种溶剂中均不能达到实验所需的溶解度,而在甲醇中溶解状态好)
步骤二、将混合溶液用移液器转移至250ml茄形瓶中,在恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的淡黄色薄膜。
步骤三、取下茄形瓶,用移液枪吸取4ml蒸馏水,在恒温水浴条件下使薄膜全部溶解于水中,得到淡黄色透明的载药胶束液体。
步骤四、将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体。
步骤五、在胶束溶液中投入过量的14.2mg的EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和4mg的NHS(N-羟基琥珀酰亚胺),室温孵化0.5小时,用于活化胶束外层聚合物上的羧基键(COOH-)。
步骤六、在活化好的胶束溶液中投入2mg的Angiopep-2,室温孵化6小时,使胶束的羧基键与短肽的氨基键连接,形成具有靶向功能的胶束。
步骤七、超滤,除去活化剂EDC,NHS,得到纯净的靶向载药胶束水溶液。
B.胶束理化性能测定
B-1.靶向载药胶束的粒径电位测定
(i).加双蒸水将靶向载药胶束ANG-LPTN+PTX-MIC稀释至适当浓度,采用粒度/Zeta电位测定仪测定粒径值。
如图5所示,载拉帕替尼的两亲性嵌段纳米胶束2#的粒径为19.9nm。
从上述数据可以看出,按本实施例二的方法制造的复方两亲性嵌段纳米胶束2#的粒径也小于空白胶束的粒径。
(ii).将胶束溶液稀释后滴加于覆盖碳膜的铜网上,用磷钨酸(pH 7.0,2%,w/v)负染,室温干燥后置于透射电子显微镜下观察胶束外部形态,如图6所示,其分散均匀。
B-2.靶向载药胶束透体外血脑屏障的能力研究
根据文献利用Transwell细胞培养板构建体外血脑屏障模型,按照上述方法制备载荧光香豆素6的两种胶束,一种不接靶向分子,一种接载靶向分子。
利用香豆素6能进入细胞浆但不能进入细胞核,而染料DAPI主要染色细胞核的特性,观察两种胶束在相同时间内穿越血脑屏障模型的量。
如图7所示,建立体外血脑屏障模型后,两种胶束在相同时间内穿透BBB模型并进入Skbr-3细胞的定性比较。
a为载cou-6的空胶束在细胞质内的分布,b为DAPI在细胞质内的分布,c为a,b图片叠加,可以直观地观察到下图,即接有靶向分子的胶束在相同时间内对BBB的穿透能力明显强于未接靶向分子的胶束。
由此可见,本实施例提供的复方载药胶束具备良好的物理性能,在此基础上制备的脑靶向复方载药胶束,具有良好的穿透血脑屏障的功能。
利用两种具有不同的抗肿瘤机制的药物,并且已经证实具有协同作用的药物,制备成复方智能给药系统,能够满足降低毒副作用减少给药剂量,治疗脑转移病灶的需求。
上述实施例一和二中,选用的malePEG-PLA为malePEG2000-PLA200,而研究者还通过采用不同的聚合物来合成纳米胶束,并经测定发现,此类纳米胶束均拥有良好的稳定性及生物相容性,既可以解决紫杉醇和拉帕替尼难溶性的实际问题,又提供了一种能够主动实现双重靶向脑转移病灶的递药系统。
具体示例如下:
实施例三、载拉帕替尼的两亲性嵌段纳米胶束3#
在本实施例三中,将4mg拉帕替尼、2mg紫杉醇和40mg聚合物mPEG2000-PLA200共同溶解于6ml的甲醇中;将混合溶液用移液器转移至250ml茄形瓶中,在40℃的恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的淡黄色薄膜;取下茄形瓶,用移液枪吸取4ml的蒸馏水,在40℃的恒温水浴条件下使薄膜全部溶解于水中,得到淡黄色透明的载药胶束液体;将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体。
实施例四、载拉帕替尼的两亲性嵌段纳米胶束4#
在本实施例四中,将4mg拉帕替尼、1mg紫杉醇和20mg聚合物PEG(2000)-b-PLGA(10000)共同溶解于5ml的甲醇中;将混合溶液用移液器转移至250ml茄形瓶中,在40℃的恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的薄膜;取下茄形瓶,用移液枪吸取5ml的蒸馏水,在40℃的恒温水浴条件下使薄膜全部溶解于水中,得到透明的载药胶束液体;将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体。
实施例五、载拉帕替尼的两亲性嵌段纳米胶束5#
在本实施例五中,将4mg拉帕替尼、4mg紫杉醇和80mg聚合物PEG(5000)-b-PCL(10000)共同溶解于10ml的甲醇中;将混合溶液用移液器转移至250ml茄形瓶中,在40℃的恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的薄膜;取下茄形瓶,用移液枪吸取8ml的蒸馏水,在60℃的恒温水浴条件下使薄膜全部溶解于水中,得到透明的载药胶束液体;将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体。
上述载拉帕替尼的两亲性嵌段纳米胶束3#-5#的粒径均小于20nm。
紫杉醇的载药量DLC为2-4%,包封率EE为77-80%,
拉帕替尼的载药量DLC为5-7%,包封率EE为79-83%。
实施例六、载拉帕替尼的两亲性嵌段纳米胶束6#和其脑靶向纳米胶束
在本实施例六中,将4mg拉帕替尼、2mg紫杉醇和40mg聚合物mPEG2000-PLA200、4mg聚合物COOH-mPEG2000-PLA200共同溶解于6ml的甲醇中,将混合溶液用移液器转移至250ml茄形瓶中,在恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的淡黄色薄膜。取下茄形瓶,用移液枪吸取4ml蒸馏水,在恒温水浴条件下使薄膜全部溶解于水中,得到淡黄色透明的载药胶束液体。将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体6#。在胶束溶液中投入过量的14.2mg的EDC和4mg的NHS,室温孵化0.5小时。在活化好的胶束溶液中投入2mg的Angiopep-2,室温孵化6小时,超滤除去活化剂EDC,NHS,得到纯净的靶向载药胶束水溶液6#。
实施例七、载拉帕替尼的两亲性嵌段纳米胶束7#和其脑靶向纳米胶束
在本实施例七中,将4mg拉帕替尼、3mg紫杉醇和21mg聚合物PEG(2000)-b-PLGA(10000)、5mg聚合物COOH-PEG(2000)-b-PLGA(10000)共同溶解于7ml的甲醇中,将混合溶液用移液器转移至250ml茄形瓶中,在恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的薄膜。取下茄形瓶,用移液枪吸取6ml蒸馏水,在恒温水浴条件下使薄膜全部溶解于水中,得到透明的载药胶束液体。将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体7#。在胶束溶液中投入过量的4mg的EDC和4mg的NHS,室温孵化1小时。在活化好的胶束溶液中投入4mg的Angiopep-2,室温孵化8小时,超滤除去活化剂EDC,NHS,得到纯净的靶向载药胶束水溶液7#。
实施例八、载拉帕替尼的两亲性嵌段纳米胶束8#和其脑靶向纳米胶束
在本实施例七中,将4mg拉帕替尼、4mg紫杉醇和55mg聚合物PEG(5000)-b-PCL(10000)、15mg聚合物COOH-PEG(5000)-b-PCL(10000)共同溶解于6ml的甲醇中,将混合溶液用移液器转移至250ml茄形瓶中,在恒温水浴条件下旋转蒸发除尽有机溶剂,得到附着于茄形瓶内的薄膜。取下茄形瓶,用移液枪吸取8ml蒸馏水,在恒温水浴条件下使薄膜全部溶解于水中,得到透明的载药胶束液体。将所得的胶束液体过滤,除去游离药物,得到纯净的载药胶束液体8#。在胶束溶液中投入过量的25mg的EDC和8mg的NHS,室温孵化2小时。在活化好的胶束溶液中投入1mg的Angiopep-2,室温孵化12小时,超滤除去活化剂EDC,NHS,得到纯净的靶向载药胶束水溶液8#。
上述载拉帕替尼的两亲性嵌段纳米胶束6#-8#的粒径均小于20nm。
紫杉醇的载药量DLC为1-4%,包封率EE为76-82%,
拉帕替尼的载药量DLC为4-9%,包封率EE为78-85%。
通过上述实验可以发现,以上为本专利提供的一种新型的复方水溶性载药胶束递药系统,均拥有良好的稳定性及生物相容性,既可以解决紫杉醇和拉帕替尼难溶性的实际问题,此外还可利用两种药物不同的抗肿瘤原理,通过协同作用加强对肿瘤的杀伤作用,并且因为连接了靶向分子,能够主动穿透血脑屏障,聚集于脑部肿瘤组织部位,通过双重靶向作用对乳腺癌脑转移患者发挥作用,即便既往使用过紫杉醇,已经产生耐药的患者,也能从中获益。由此,贡献了一种全新的给药剂型,解决乳腺癌脑转移患者无药可用的困境。
- 还没有人留言评论。精彩留言会获得点赞!