用于与外部成像集成的机器人医疗系统的系统和方法与流程
相关申请的交叉引用
本申请要求2013年5月16日提交的美国临时申请61/824,298的权益,其通过引用方式被完全并入本文。该专利文件还涉及并且以引用方式并入都在2011年10月14日提交的以下共同拥有且共同待决的专利申请:标题为“Catheter with Removable Vision Probe(具有可拆卸的视觉探头的导管)”的美国专利申请号13/274,208;标题为“Catheters with Control Modes for Interchangeable Probes(具有用于可互换探头的控制模式的导管)”的美国专利申请号13/274,198;标题为“Vision Probe and Catheter Systems(视觉探头和导管系统)”的美国专利申请号13/274,229;以及标题为“Catheter Sensor Systems(导管传感器系统)”的美国专利申请号13/274,237。
技术领域
本公开涉及用于在医疗程序期间跟踪医疗装置在患者解剖结构内的系统和方法,并且更具体地涉及用于将外部成像与机器人手术系统有效地集成的系统和方法。
背景技术:
微创医疗技术旨在减少在诊断或手术程序期间受损的组织量,从而缩短患者的恢复时间、减轻患者的不适并且减少有害的副作用。此类微创技术可以通过在患者解剖结构中的自然孔口,或通过一个或多个手术切口执行。通过这些自然孔口或切口,临床医生可以将手术器械插入到达目标组织位置。为了到达目标组织位置,微创手术器械可以在解剖系统中的自然的或手术创建的通道中导航,其中解剖系统诸如肺、结肠、肠、肾脏、心脏、循环系统等。导航辅助系统帮助临床医生按路线传送手术器械,并且避免对解剖结构的损伤。这些系统能够结合使用形状传感器以更准确地描述手术器械在真实空间中的形状、姿态和位置或手术器械相对于术前图像或者同步图像的形状、姿态和位置。在动态解剖系统中和/或在布满许多解剖通道的解剖区域中,将微创器械准确配准到解剖系统中是一项耗时且处理密集的任务。需要提高将微创器械配准到解剖系统的系统和方法的准确性和效率的改进的系统和方法。
技术实现要素:
通过使来自外部成像系统的成像数据与术中的手术系统数据相关,能够实现手术系统相对于实际的患者解剖结构的更准确的配准和/或控制。
一种医疗系统能够包括(一个或多个)机器人可控制的医疗器械,所述机器人可控制的医疗器械包括传感器系统(例如,位置传感器、形状传感器等),用于提供关于(一个或多个)器械的姿态和/或解剖结构的术中信息。如在本文中所使用的,术语“姿态”指的是对象的位置或对象在至少一个平移自由度的部分,并且指的是该对象的取向或对象在至少一个旋转自由度(多达六个总自由度)的部分。如在本文中所使用的,术语“形状”指的是沿对象测量的一组姿态、位置或取向。
伴随着(一个或多个)医疗器械设置在患者内,外部成像系统(例如,计算机断层扫描术(CT)扫描仪、正电子发射型计算机断层显像(PET)扫描仪、荧光镜检查扫描仪(例如,C形臂、O形臂)、磁共振成像(MRI)扫描仪、锥形波束CT扫描仪,和/或超声系统、以及其他)提供(一个或多个)手术器械被定位在其中的解剖结构的术中图像。在一些实施例中,外部成像系统还能够被安装在铰接的(例如,机器人可控制的)支持结构上,以提供更大范围的成像取向。
一种医疗机器人系统和用于操作该系统的方法能够涉及接收针对患者解剖结构的至少一部分的术中的外部图像数据,以及基于所述术中的外部图像数据(可选地从在处理目标位置或医疗机器人系统器械的相关部分(诸如远侧尖端或工具区段)周围的预定区域获得)至少半自动地(即,在没有用户手动介入的情况下至少部分地)控制所述医疗机器人系统。
该系统能够利用从外部图像数据提取的数据进行控制,然后涉及:至少半自动地调节物质(例如,治疗剂、镇痛剂、植入物、或标记、以及其他)到目标位置的递送,将处理模式(例如,消融、辐射、超声、或电泳、以及其他)应用于目标位置,在目标位置处调整器械姿态,调整病灶性治疗参数(例如,辐射波束焦点或横截面、以及其他),和/或跟踪器械与组织在目标位置处的交互。
一种医疗机器人系统和用于该系统的方法能够涉及接收针对患者解剖结构的至少一部分的术中的外部图像数据,以及基于所述术中的外部图像数据(可选地从在处理目标位置或医疗机器人系统器械的相关部分(诸如远侧尖端或工具区段)周围的预定区域获得)至少半自动地将建模调整应用于所述医疗机器人系统的控制系统。
利用从外部图像数据提取的数据的建模调整能够涉及:基于术中的外部图像数据(例如,通过利用图像处理技术从术中的外部图像数据提取解剖结构特征和/或器械姿态数据)自动地或半自动地更新被用于术中导航的患者解剖结构的解剖结构模型,和/或细化(refine)患者、器械和/或解剖结构模型之间的配准(例如,通过从术中的外部图像数据提取对应于基准要素(诸如人造标记或已知的解剖界标/解剖结构)的数据以在适当情况下为患者、器械和/或解剖结构模型建立共同的参考系)。
附图说明
当与附图一起阅读时,本公开的各方面从以下具体实施方式中更好理解。要强调的是,依照在行业中的标准惯例,各种特征未按比例画出。实际上,为使讨论清晰,各种特征的尺寸可以随意增大或减小。此外,在各种示例中,本公开可以重复参考数字和/或字母。这种重复是为了简单且清晰的目的,本身并不指定所讨论的各种实施例和/或配置之间的关系。
图1A是根据本公开的实施例的机器人医疗系统。
图1B图示了利用本公开的方面的医疗器械系统。
图2A示出了图1A和/或图1B的与外部成像系统相配合的机器人医疗系统。
图2B-2F示出了图2A的机器人医疗系统的各种操作和控制方面。
图3A-3D示出了用于涉及诸如在图2A-2F中示出的与外部成像相配合而使用机器人医疗系统的各种程序性方法的流程图。
具体实施方式
在本发明的实施例的下列具体实施方式中阐述许多具体细节,以便提供对公开的实施例的透彻理解。然而,对本领域中的技术人员显而易见的是,本公开的实施例可以在没有这些具体细节的情况下实践。在其他实例中,未详细描述众所周知的方法、程序、部件和电路,以便不会不必要地模糊本发明的实施例的各方面。
以下实施例就各种器械和器械部分的三维空间下的状态而言对其进行描述。如在本文中所使用的,术语“位置”涉及对象或对象的一部分在三维空间(例如,沿着笛卡尔X、Y、Z坐标的三个平移自由度)中的位置。如在本文中所使用的,术语“取向”指的是对象或对象的一部分的旋转布置(三个旋转自由度——例如,滚动、俯仰和偏航)。如在本文中所使用的,术语“姿态”指的是对象或对象的一部分在至少一个平移自由度中的位置,并且指的是对象或对象的一部分在至少一个旋转自由度中的取向(多达六个总自由度)。如在本文中所使用的,术语“形状”指的是沿对象测量的一组姿态、位置或取向。
参考附图中的图1A,机器人手术系统一般由参考数字100指示。注意,如在本文中所使用的,“手术”能够指任何对患者执行的医疗程序,包括但不限于操作程序(例如,组织提取或操纵)、治疗程序(例如,药物递送)和诊断程序(例如,组织检查或活检)。如图1A所示,机器人系统100一般包括对患者P执行各种程序时操作手术器械104的手术驱动器组件102。组件102被安装到操作台O或靠近操作台O。主组件106允许临床医生S(例如,外科医生或介入医生)查看手术部位并且控制驱动器组件102。
在替代性实施例中,机器人系统可以包括不止一个驱动器组件。驱动器组件的确切数量和配置将取决于手术室内的手术程序和空间限制以及其他因素。
主组件106可以位于临床医生的控制台C处,该控制台C通常与操作台O位于同一个房间中。然而,应该清楚,临床医生S能够位于与患者P不同的房间中或完全不同的建筑物中。主组件106一般包括可选的支持物108和用于控制驱动器组件102的一个或多个控制装置112。(一个或多个)控制装置112可以包括任何数量的各种输入装置,诸如操纵杆、跟踪球、手套、触发手枪、手动操作的控制器、语音识别装置等。在一些实施例中,(一个或多个)控制装置112将提供有与相关联的手术器械104一样的自由度,以提供给临床医生远程呈现或(一个或多个)控制装置112与器械104成为一体的感知,使得临床医生具有直接控制器械104的强烈感觉(但是在其他实施例中,(一个或多个)控制装置112可以具有比相关联的手术器械104更多或更少的自由度)。在一些实施例中,控制装置112为以六个自由度移动的手动输入装置,并且该手动输入装置也可以包括用于致动器械的可致动手柄(例如,用于关闭抓取钳、应用电势到电极、输送药物处理等)。
可视化系统110可以包括可见范围组件(在下面更详细地进行描述),使得手术部位的同步图像或实时原位(in-situ)图像(即,在手术部分处获得的图像)被提供给临床医生控制台C。同步图像可以例如是由设置在手术部位内的内窥镜或类似成像元件捕获的二维或三维图像。在该实施例中,可视化系统100能够包括可整体耦连到或可拆卸地耦连到手术器械104的内窥镜部件。然而,在替代性实施例中,附接到单独的驱动器组件的单独的内窥镜可以和手术器械一起使用,以对手术部位成像。可视化系统110可以作为硬件、固件、软件或其组合实现,其与一个或多个计算机处理器交互,或以其他方式由一个或多个计算机处理器执行,其中计算机处理器包括控制系统116(在下面进行描述)的处理器。
显示系统111可以显示由可视化系统110捕获的手术部位和手术器械的图像。显示系统111和主控制装置112可以被取向使得成像装置在范围组件和手术器械中的相对位置与临床医生的眼睛和手的相对位置类似,因此操作者能够犹如观察在基本真实存在的工作空间一样来操纵手术器械104和手动控制。通过真实的存在,就意味着图像的呈现是模拟物理操纵手术器械104的操作者的观察点的真实透视图像。
替代地或额外地,显示系统111可以通过外部成像系统160呈现术前和/或术中记录和/或建模的手术部位的图像,所述外部成像系统160能够使用成像技术,诸如计算机断层扫描术(CT)、磁共振成像(MRI)、正电子发射型计算机断层显像(PET)、荧光镜检查、热敏成像、超声、光学相干断层扫描术(OCT)、热成像、阻抗成像、激光成像、或纳米管X射线成像、以及其他。所呈现的图像可以包括二维图像、三维图像或四维图像。注意,如在本文中所使用的,相比于从在患者内获得的“原位”图像,不管特定的成像模式如何(例如,超声能够被用于外部成像和/或原位成像两者),“外部成像”或“外部图像”指从患者外部获得的目标解剖结构的图像。
在一些实施例中,显示系统111可以替代地或额外地显示虚拟导航图像,在该图像中手术器械的实际位置与术前或术中图像配准(即,动态参考),以将手术器械尖端位置处的内部手术部位的虚拟图像呈现给临床医生S。手术器械尖端的图像或其他图形或字母数字指示符可以被叠加在虚拟图像上,以辅助临床医生控制手术器械。替代地,手术器械在虚拟图像中不可见。
在其他实施例中,显示系统111可以替代地或额外地显示虚拟导航图像,在该图像中手术器械的实际位置与术前图像或同步的术中图像配准,以从外部观察点将在手术部位内的手术器械的虚拟图像呈现给临床医生S。手术器械的一部分的图像或其他图形或字母数字指示符可以被叠加在虚拟图像上,以辅助临床医生控制手术器械。
如图1A所示,控制系统116包括至少一个处理器116P,并且通常包括多个处理器,用于实现在手术驱动器组件102、主组件106和图像与显示系统110之间的控制。控制系统116也包括实施在本文中描述的方法中的一些或全部的软件编程指令。在各种实施例中,这种软件编程指令能够被存储在非临时性计算机可读介质116C上,所述非临时性计算机可读介质诸如(一个或多个)光盘、(一个或多个)磁光或固态硬盘驱动器、闪存或(一个或多个)任何其他介质类型。在各种实施例中,控制系统116能够包括一个或多个计算机存储器116M,用于接收和/或存储输入数据,诸如模型数据、传感器数据、图像数据、以及其他。
虽然控制系统116在图1A的简化视图中被示为单个方框,但该系统可以包括若干数据处理电路(例如,在手术驱动器组件102上和/或在主组件106上),其中至少一部分处理可选地邻近输入装置执行,一部分邻近驱动器组件执行等等。可以使用任何各种集中式数据处理架构或分步式数据处理架构。类似地,编程代码可以作为若干单独的程序或子程序实施,或可以集成到若干在本文中描述的机器人系统的其他方面。在一个实施例中,控制系统116可以支持无线通信协议,诸如蓝牙、IrDA、家庭射频、IEEE 802.11、DECT和无线遥测。
在一些实施例中,控制系统116可以包括伺服控制器,以将来自手术器械104的力和转矩反馈提供给手动操作的控制装置112。可以使用任何适当的常规或专用伺服控制器。伺服控制器可以与驱动器组件102分离,或与驱动器组件102一体。在一些实施例中,伺服控制器和驱动器组件作为邻近患者身体设置的机器人臂推车的一部分提供。伺服控制器传输指示驱动器组件移动器械的信号,其中器械经由身体内的开口延伸到在患者体内的内部手术部位。
支持手术器械104的驱动器组件102中的每个可以包含通常称为安装接头的一个或多个可铰接(通常,尽管不一定专门地,但是手动可铰接的)定位/支持联动装置。驱动器组件102可以包括一系列致动器(例如,马达)。可以与手术器械104集成在一起或被可拆卸地耦接到手术器械104的这些致动器响应于来自控制系统116的命令而主动移动手术器械104。具体地,致动器能够将手术器械104推进到自然解剖结构孔口或手术创建的解剖结构孔口,和/或以多自由度移动手术器械104的远端,其中所述多自由度可以包括三个直线运动度(例如,X、Y、Z直线运动)和三个旋转运动度(例如,滚动、俯仰和偏航)。额外地或替代地,致动器能够被用来致动器械104的可铰接或可部署的末端执行器(例如,用于抓取在活检装置等的钳口中的组织等)。
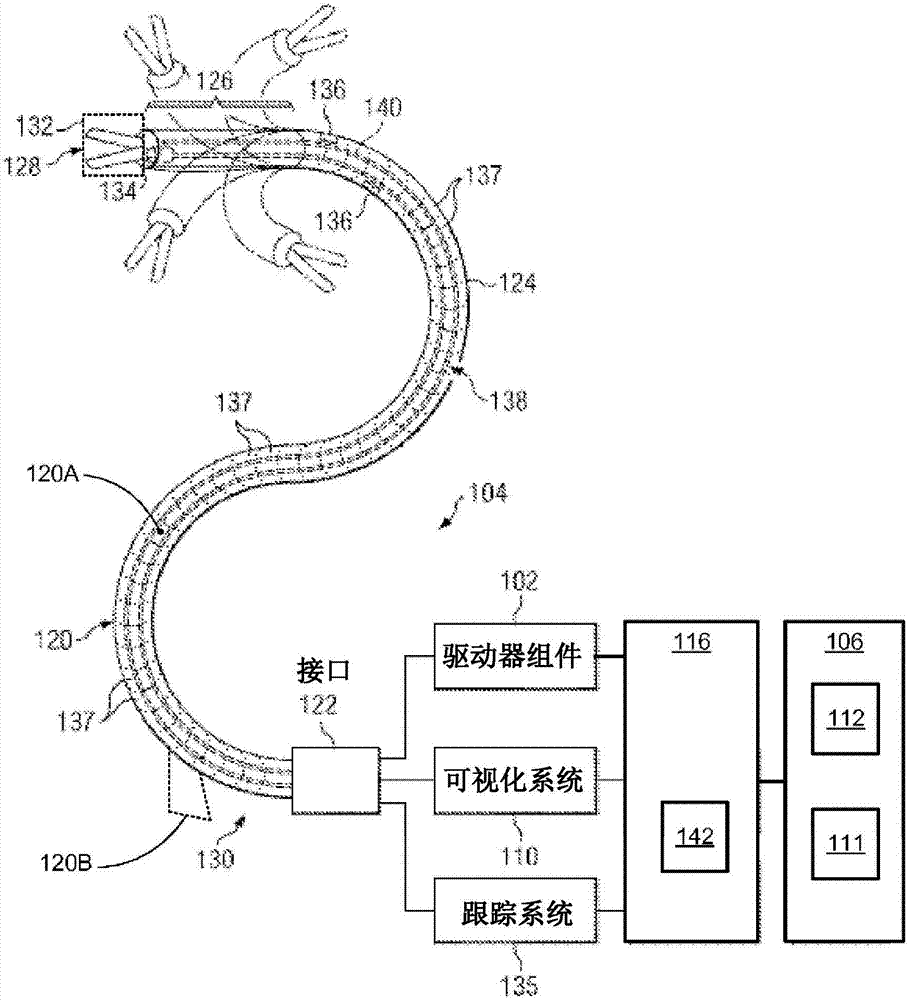
图1B图示了手术器械系统104及其接合系统的实施例。手术器械系统104包括由接口122耦连到驱动器组件102和可视化系统110的柔性器械120。器械120具有柔性主体124、在其远端128处的尖端126和在其近端130处的接口122。
在一些实施例中,主体124能够由柔性管(例如,编织结构,诸如具有柔性或低摩擦材料(诸如聚四氟乙烯(PTFE))的内或外层的编织丝管、通过诸如聚醚嵌段酰胺(Pebax)的材料制成的编织套和回流(即,通过融化来融合)套保持在一起的一束管腔或管、诸如Pebax的聚合物材料制成的挤出件、金属线圈、一系列联动元件、具有切口的金属管、和/或任何其他细长的柔性结构)形成,在各种实施例中,所述柔性管能够在其长度上表现出各种不同的构造。在各种其他实施例中,柔性主体能够进一步容纳电缆、联动装置或其他转向控件(未示出)或与电缆、联动装置或其他转向控件集成在一起,所述转向控件在接口122与尖端126之间至少部分地延伸以可控制地弯曲或转动尖端,如例如通过弯曲尖端126的虚线变体所示的,并且在一些实施例中,控制可选的末端执行器132。
柔性器械可以是可转向的,包括先前描述的转向控件,或可以是不可转向的,不具有用于操作者控制器械弯曲的集成机构。尽管被描绘为一组夹钳用于示例性目的,但是可选的末端执行器132可以是可操作用于医疗功能(例如,用于实现关于目标组织的预定用途)的任何工作远侧零件。例如,一些末端执行器具有单个工作构件,诸如手术刀、刀片、针或电极。例如,诸如在图1B的实施例中示出的其他末端执行器具有一对或多个工作构件,诸如手术钳、抓紧器、剪刀、缝合器、血管闭合器、活检工具、缝合工具或施夹器。电激活或启用的末端执行器的示例包括电手术电极、消融(ablation)元件、换能器、传感器、摄像机、探头等。末端执行器还可以包括运送液体、气体或固体以执行例如抽吸、吹入、冲洗、需要流体递送的处理、附件引入、活检提取等的管道。
在其他实施例中,柔性主体124能够限定一个或多个工作腔120A,通过所述一个或多个工作腔120A,手术器械(诸如可选的末端执行器132)能够被部署(例如,经由可选的辅助输入端口120B)并且用在目标手术位置处。在各种实施例中,这种工作腔120A能够与可选的末端执行器132和/或其他功能元件一起被集成到器械120中。
器械120还能够包括图像采集元件134,所述图像采集元件134可以包括被设置在远端128处的用于采集原位图像的立体或单视场摄像机,所述原位图像被传输给可视化系统110并且被可视化系统110处理,以便由显示系统111进行显示。替代地,图像采集元件134可以是耦接到器械120(诸如纤维内窥镜)的近端上的成像和处理系统的相干的光纤束。图像采集元件134可以单或多谱段的,用于采集可见或红外线/紫外线光谱中的图像数据。在各种其他实施例中,图像采集元件134能够包括任何类型的成像系统,诸如共聚焦显微镜、OCT系统、超声探头、以及其他。
在一些实施例中,器械120能够用作具有工作腔120A的导管或引导管,所述工作腔120A容纳与一个或多个医疗探头或工具可互换的视觉探头。例如,在一些实施例中,图像采集元件134能够被实施为视觉探头,所述视觉探头被定尺为适合在工作腔120A内,使得视觉探头能够被移除,并且用在医疗程序中使用的医疗探头来替换。视觉探头与医疗探头的互换可以允许器械120具有更小的直径,并且因此导航比同时容纳视觉系统和医疗系统两者的类似系统更小的通道。替代地,与必须同时容纳视觉系统和医疗系统两者的导管相比,互换探头可以允许用于具有更多功能的视觉系统和医疗系统的更多空间。
跟踪系统135能够包括位置传感器系统136(例如,电磁(EM)传感器系统)和/或形状传感器系统138、用于沿着器械120确定远端128和可选地一个或多个节段137(区域)的位置、取向、速度、姿态和/或形状的传感器系统。尽管图1B仅描绘出一组示例性节段137,但在远端128和近端130之间的并且包括尖端126的器械120的整体长度可以被有效地划分成节段。跟踪系统135可以作为硬件、固件、软件或其组合实施,其可以与一个或多个计算机处理器交互,或以其他方式由一个或多个计算机处理器执行,其中一个或多个计算机处理器可以包括控制系统116的处理器。
在一些实施例中,位置传感器系统136能够是EM传感器系统,所述EM传感器系统包括可以经受外部生成的电磁场的一个或多个导电线圈。然后,每个线圈产生感应的电信号,该电信号具有取决于线圈相对于外部生成的电磁场的位置和取向的特征。在一个实施例中,EM传感器系统可以被配置和设置以测量六个自由度,例如,三个位置坐标X、Y、Z和指示基点的俯仰、偏航和滚动的三个取向角。示例性EM传感器系统的进一步描述被提供在于1999年8月11日提交的美国专利号6,380,732中,其公开了“Six-Degree of Freedom Tracking System Having a Passive Transponder on the Object Being Tracked(具有在正被跟踪的对象上的无源应答机的六自由度跟踪系统)”,其全部内容通过引用而并入本文。
在一些实施例中,形状传感器系统138包括与柔性主体124对准的光纤140(例如,在内部通道(未示出)内提供或外部安装)。跟踪系统135被耦连到光纤140的近端。在该实施例中,光纤140具有约200μm的直径。在其他实施例中,该尺寸可以更大或更小。
光纤140形成光纤弯曲传感器,用于确定器械120的形状。在一个替代方案中,包括光纤光栅(FBG)的光纤用于提供在一个或多个维度下的结构中的应变测量。用于监测光纤在三维中的形状和相对位置的各种系统和方法被描述在2005年7月13日提交的美国专利申请11/180,389中,其公开了“Fiber optic position and shape sensing device and method relating thereto”(光纤位置和形状感测装置以及与其相关的方法);2004年6月16日提交的美国临时专利申请号60/588,336中,其公开了“Fiber-optic shape and relative position sensing(光纤形状和相对的位置感测)”;以及1998年6月17日提交的美国专利号6,389,187中,其公开了“Optical Fibre Bend Sensor(光纤弯曲传感器)”,以上文献的全部内容通过引用的方式被并入本文。在其他的替代方案中,使用其他的应变感测技术(诸如瑞利散射、拉曼散射、布里渊散射和荧光散射)的传感器可以是合适的。在其他可替代的实施例中,器械120的形状可以通过使用其他技术来确定。例如,如果器械尖端姿态的历史以小于用于更新导航显示的周期或交替运动(吸入和呼出)的周期的时间间隔储存,则姿态历史能够用于在该时间间隔内重构装置的形状。作为另一个示例,针对沿着交替运动(诸如呼吸)的循环的器械的已知点,历史的姿态、位置或取向数据可以被储存。这个储存的数据可以用于开发关于器械的形状信息。替代地,沿着器械设置的一系列位置传感器(诸如EM传感器)能够用于形状感测。替代地,来自程序期间在器械上的位置传感器(诸如EM传感器)的数据历史可以用于表示器械的形状,特别是如果解剖结构通道一般为静态时。替代地,具有外部磁场控制的位置或取向的无线装置可以用于形状感测。其位置的历史可以用于确定导航通道的形状。
在该实施例中,光纤140可以包括在单个包层146内的多个芯。每个芯可以是具有足够距离和将芯分开的包层的单模式,使得在每个芯中的光与在其他芯中携带的光无显著的影响。在其他实施例中,芯的数量可以变化,或者每个芯可以包含在单独的光纤中。
在一些实施例中,FBG阵列提供在每个芯内。每个FBG包括一系列芯折射指数的调制,以便生成折射指数的空间周期性。间隔可以被选择,以便来自每个指数变化的部分反射相干地添加波长的窄带,并且因此,当穿过更宽的带时仅反射波长的该窄带。在FBG的制造期间,调制由已知的距离隔开,从而引起波长的已知带的反射。然而,当在光纤芯上引起应变时,调制的间隔将根据芯中的应变的量而变化。替代地,随着光纤的弯曲而变化的反向散射或其他光学现象能够用于确定每个芯内的应变。
因此,为测量应变,将光沿着光纤向下发送并且测量返回的光的特征。例如,FBG产生为在光纤上的应变及其温度的函数的反射的波长。这种FBG技术从各种来源(诸如英格兰的布拉克内尔的智能纤维有限公司(Smart Fibres Ltd.))商购到。FBG技术在用于机器人手术的位置传感器中的使用被描述在2006年7月20日提交的美国专利号7,930,065中,其公开了“Robotic Surgery System Including Position Sensors Using Fiber Bragg Gratings(包括使用光纤光栅的位置传感器的机器人手术系统)”,其全部内容通过引用的方式被并入本文。
当应用到多芯光纤时,光纤的弯曲引起芯上的应变,该应变能够通过监测每个芯中的波长偏移而被测量。通过具有在光纤中偏轴设置的两个或多个芯,光纤的弯曲引起每个芯上的不同应变。这些应变是光纤的局部弯曲度的函数。例如,如果包含FBG的芯的区域位于光纤弯曲的点处,则该芯的区域从而能够用于确定在那些点处弯曲的量。与FBG区域的已知间隔结合的这些数据能够用于重构光纤的形状。弗吉尼亚州布莱克斯堡的Luna Innovations.Inc.已经描述了此类系统。
如所描述的,光纤140用于监测器械120的至少一部分的形状。更具体地,穿过光纤140的光由跟踪系统135处理,用于检测手术器械120的形状,并且用于利用该信息辅助手术程序。跟踪系统135可以包括生成和检测用于确定器械120的形状的光的检测系统。该信息进而能够用于确定其他相关的变量,诸如手术器械的零件的速度和加速度。通过实时获得这些变量中的一个或多个的准确测量,控制器能够提高机器人手术系统的准确性并且补偿在驱动部件零件时引入的误差。感测仅可被限制于由机器人系统致动的自由度,或可应用到被动自由度(例如,在接头之间的刚性构件的未致动弯曲)和主动自由度(例如,器械的致动运动)两者。
来自跟踪系统135的信息可以被发送到导航系统142,在导航系统142中,来自跟踪系统135的信息与来自可视化系统110信息和/或术前获得的图像和/或术中获得的图像结合,以在显示系统111上给临床医生或其他操作者提供实时的位置信息,用于器械120的控制中。控制系统116可以利用位置信息作为设置器械120的反馈。使用光纤传感器配准并显示手术器械与手术图像的各种系统被提供在2011年5月13日提交的美国专利申请号13/107,562中,其公开了“Medical System Providing Dynamic Registration of a Model of an Anatomical Structure for Image-Guided Surgery(提供用于图像引导的手术的解剖结构的模型的动态配准的医疗系统)”,其全部内容通过引用的方式被并入本文。
在图1B的实施例中,器械104能够在机器人手术系统100中远程操作。在替代性实施例中,驱动器组件和相关联的控制系统/主组件可以由直接操作者控制取代。在直接操作的替代方案中,可以包括各种手柄和操作者接口,用于器械的手持操作。
控制系统116控制致动器(例如,被包括在驱动接口122、驱动器组件102、控制系统116、和/或主组件106)以使远侧尖端126转向。一般来说,控制逻辑响应于来自用户(例如,临床医生或使用系统100的其他医疗人员)的命令并且可选地响应于传感器信号(例如,来自(一个或多个)EM传感器136和/或形状传感器系统138)而操作。然而,如上面提及的,在一些实施例中,控制系统116能够响应于传感器信号而操作—例如维持或获得先前识别的工作配置。
图2A示出了手术系统100的实施例,在该手术系统100中,外部成像系统150被用来增强对患者P的手术程序的性能。注意,虽然驱动器组件102和器械104在本文中被描绘并且被描述为具有柔性器械的“单臂”系统用于示例性目的,但是各种其他实施例能够包括更刚性的器械系统(例如,Mako系统)和/或多臂机器人系统(例如,Intuitive Surgical da手术系统)、以及其他。在各种其他实施例中,驱动器组件102和器械104甚至能够是替代性微创或无创处理或诊断系统,诸如病灶性治疗系统(例如,间质性激光治疗系统、病灶性冷冻消融系统,高强度聚焦超声(HIFU)系统、电穿孔系统、光动力治疗系统,和/或外部波束放射疗法系统、以及其他)。
如图2A所示,驱动器组件102将器械104引导到患者P的目标解剖结构A内(这里出于示例性目的被描绘为肺)。驱动器组件102和器械104的行为通过控制系统116来控制,其中来自器械104(并且可选地驱动器组件102)的传感器数据(例如,位置数据、形状数据、动态数据等)被收集并且被提供给控制系统116(例如,通过跟踪系统135)。类似地,通过器械104获得(例如,经由被集成到器械104中、或被设置在器械104上/器械104中的一个或多个摄像机获得)的图像能够被可视化110处理并且提供给控制系统116。该图像数据能够作为现场原位图像(例如,图像A)被呈现在显示系统111(例如,计算机或视频监视器)上。在各种实施例中,基于由跟踪系统135提供的传感器数据和解剖结构A的计算机模型,虚拟的原位图像(例如,图像B)能够额外地或替代地被显示在显示系统111上。在各种其他实施例中,显示系统111能够示出任何其他相关信息,诸如解剖结构A的导航概览(例如,图像C)、指示器械104在患者P体内的预先计划的和/或实际的轨迹。
通常,组合从不同来源获得的器械和解剖结构信息两者的合成图像(诸如图像C)(例如,基于传感器的器械姿态信息与术前或术中产生的解剖结构模型相组合)是微创手术程序的重要要素。这种描绘为临床医生提供一般不能通过基于器械的成像设备(例如,内窥镜摄像机、放射超声探头等)提供的程序的总体进展的视觉指示,因为这种设备提供相对短程的、局部的成像。相比于这种局部成像,合成图像C能够示出器械相对于整个解剖结构(或至少相对于解剖结构的更大部分)的更全局的透视图。例如,如在图像C中指示的,在分支的解剖结构(诸如肺中的气道树)中,合成图像C能够不仅指示器械104的远端区域相对于目标结节的姿态,而且指示被器械104所获得的路径,包括被器械104横穿的特定气道分支。注意,虽然图像C出于示例性目的被描绘为额骨视图(即,解剖结构A的额骨面),但是在各种其他实施例中,图像C能够为矢状面视图、3D视图、或提供器械/解剖结构关系的期望表示的任何其他透视图。
自然地,合成图像C的准确性依赖于器械与患者解剖结构之间的准确配准和/或器械与解剖结构模型之间的准确配准。通常,这种配准基于器械传感器数据(例如,EM或形状传感器,其具有已知关系的参考位置/基准且被附接到患者解剖结构,并且与解剖结构模型中的参考位置/基准相关)。然而,由于患者解剖结构的顺应性和可变形性并且还由于固有的传感器容差,这种基于传感器的配准能够显著偏离器械相对于患者解剖结构的实际姿态。为了减轻感测的配准与实际的配准之间的这种差异,各种算法和/或数据分析方法能够被使用,诸如在共同拥有的、共同待决的美国专利申请13/892,924、13/893,040、13/892,871和13/893,008中所描述的,其全部都通过引用的方式被并入本文。此类方法虽然在许多情况下提供了准确配准,但是仍然会由于解剖结构/传感器变化而遭受不准确性。
相应地,与患者体内的(一个或多个)手术器械的操作(例如,定位和/或致动)相配合,外部成像系统150(例如,计算机断层扫描术(CT)扫描仪、正电子发射型计算机断层显像(PET)扫描仪、荧光镜检查扫描仪(例如,C形臂、O形臂)、磁共振成像(MRI)扫描仪、锥形波束CT扫描仪和/或超声系统以及其他)能够被用来提供解剖结构A和/或器械104的术中图像(例如,2D、3D、静态视图、现场视图、360°视图、楔形视图或任何其他类型的视图)。在一些实施例中,外部成像系统也能够被安装在铰接的(例如,机器人可控制的)支持结构上,以提供更大范围的成像取向。
成像系统150包括用于采集并产生外部图像数据的外部成像器160(例如,具有x-射线源和接收器的台架)和用于将该数据处理为可用的图像数据(例如,扫描部位的层析成像的重构)的外部成像器控制器170。在一些实施例中,外部成像器160能够被安装在铰接的(例如,机器人可控制的)支持结构上,以提供更大范围的成像取向。控制系统116然后能够利用这种来自外部图像控制器170的图像数据增强对患者P执行的程序。
在一些实施例中,成像系统150能够配合器械104和/或驱动器组件102工作,以细化并局部化成像区域,例如增加在给定暴露时间内的成像分辨率,或减少辐射暴露时间。例如,在一些实施例中,与器械104的远侧尖端区域126相关联的姿态数据(例如,直接来自基准、跟踪装置、信标、或在器械104的远端处或附近的其他指示符的信号、或传感器数据(诸如用于远侧尖端区域126的EM传感器、形状传感器、光学传感器数据))能够引导成像系统150的操作。
例如,如图2B所示,扫描区域SR能够被限定在尖端126周围(例如,在尖端126周围的预定的、可选择的或用户指示的区域)。外部成像器160然后能够刚好在扫描区域SR周围之内扫描(例如,仅在扫描区域SR内获得CT切片或楔片),以产生相关的外部图像数据,如图2C所示。注意,虽然扫描区域SR出于示例性目的被描绘为圆形或球形区域,但是在各种其他实施例中,扫描区域SR能够具有任何尺寸或形状,并且不必在尖端126周围居中(例如,在一些实施例中,扫描区域SR可以延伸越过远侧尖端126某一距离,以确保器械104的工作区域被外部成像器160所成像)。在其他实施例中,扫描区域SR可以关于解剖结构A中的目标位置或特征T1进行限定,诸如节结、肿瘤、气道分支部、器官或甚至解剖结构A中的用户识别的位置。
不管局部的或总体的外部图像数据是否由成像系统150来提供,该数据然后都能够被控制系统116用来增强对患者P的程序的性能。例如,在一些实施例中,来自成像系统150的术中的外部图像数据能够配合解剖结构A的现有模型(例如,术前产生的CT模型,可选地术中更改的模型)来使用,以提供即刻的术中环境的更准确表示。
例如,图2D示出了由成像系统150(例如,通过关于图2C描述的扫描操作)针对出于比较目的而被叠加在解剖结构A的现有模型M上的解剖结构A的至少一部分产生的外部图像数据E。注意,现有模型M能够是解剖结构A的原始(术前)模型,或是术中产生的更改的/更新的模型。进一步注意,虽然外部图像数据E在本文中被描绘并且被描述为解剖结构A的模型M的一部分或子集,但是在各种其他实施例中,外部图像数据E能够是完整的解剖结构A,但是如上面提及的,仅扫描解剖结构A的局部部分能够提供有益效果(例如,减少辐射暴露、增加扫描速度和/或增强扫描精度以及其他)。此外,虽然外部图像数据E出于示例性和描述性目的被示为被叠加到模型M上,但是在各种其他实施例中,仅外部图像数据E或仅模型M的更改的变体(即,基于外部图像数据E)可以被显示。
如在图2D中指示的,外部图像数据E进一步指示实际的器械姿态P与基于传感器的器械姿态S(即,从传感器数据获得的器械姿态)之间的差别。注意,虽然解剖结构-模型状态和器械-传感器姿态差异出于示例性目的都在图2D中被描绘,但是在各种实施例中,任何一种或两种类型的差异可以存在于外部图像数据中(或显著的)。
在任何情况下,在各种实施例中,外部图像数据与测量的/建模的状态之间的任何差别都能够被用来更新术中的建模,并且有益地增强程序的准确性(例如,细化解剖结构模型与患者解剖结构、器械、和/或器械摄像机视图之间的配准,调整/维持器械的姿态,和/或建立用于器械的轨迹)。当解剖结构A可能由于器械104(例如,在肺的气道树内或在动脉网络内)的存在和/或移动而变形、和/或器械104的姿态难以根据传感器或动态数据(例如,柔性器械)准确地建立时,这能够是尤其有益的。
例如,响应于该器械引起的变形的建模和配准更新能够基于器械传感器数据来实施,诸如在共同拥有的、共同待决的专利申请13/893,008中所描述的。然而,在许多情况下,这种基于传感器的更新可能不能精确地表示实际的解剖结构状况和/或相关的器械位置。在此类情况下,外部图像数据E能够被用来细化术中的解剖结构模型M、改善器械104与解剖结构A之间的配准和/或更准确地表征器械104的远端与手术目标T2之间的关系。例如,响应于通过外部图像数据E(诸如在图2D中描绘的)指示的建模或配准差异,模型M、模型M本身、器械104的姿态和/或器械104与模型M之间的配准能够被更新,以更接近地匹配外部图像数据E。
在一些实施例中,模型M的质量和/或准确性能够基于外部图像数据E来增强。例如,在基本水平下,原始模型产生(例如,通过术前的CT扫描分割)可能不能充分采集感兴趣的解剖结构。在此情况下,来自原始模型M的无关的和/或缺失的解剖结构能够基于从外部图像数据E提取的解剖结构数据分别被移除和/或被添加。例如,分支的解剖结构(诸如肺的气道树)的术前的成像和分割可够不能充分建模该解剖结构的较小要素(分支),从而导致缺失的要素。在此情况下,术中的外部成像能够通过例如识别并将缺失的腔添加到分支的解剖结构而被用来更充分地完成解剖结构模型。
在许多情况下,来自形状传感器的形状数据提供器械姿态和解剖结构状态的指示,诸如在美国专利号7,720,322、美国专利申请序列号12/839,642和美国专利申请序列号13/107,562中描述的,所有都通过引用的方式被并入本文。在其他示例中,从术中产生的外部图像数据E(例如,经由分割、特征提取或任何其他处理技术)提取的解剖结构和/或器械形状数据可以配合来自器械104的形状传感器数据使用,以(例如,经由平均、过滤或任何其他算法)产生解剖结构A和/或器械104的准确的3D模型或表示。
在各种其他实施例中,在模型M中建模的解剖结构中的一些或所有(例如,利用诸如边缘检测、角点检测、形状匹配、曲线演变或任何其他方法的特征提取技术)能够在外部图像数据E中被识别,并且然后(例如,通过使模型M更接近地匹配提取的图像数据)被用来更新模型M中的对应结构。在其他实施例中,在患者解剖结构和/或器械中、上或周围的可识别的基准要素能够从外部图像数据E被提取,从而为模型和外部图像数据提供共同的配准参考。
在各种其他实施例中,外部图像数据E能够被用来可选地结合对模型M的更新和/或基于传感器的姿态S来识别或确认当前术中的器械104与解剖结构A之间的关系。例如,当跟踪柔性器械通过分支的解剖结构(例如,气管镜通过气道树或导管通过动脉网络)的进展时,传感器精度的固有限制能够引起姿态数据的跳动或抖动。为了为此类系统提供更清楚的、更稳定的图形用户接口(GUI),“抠图/抓取(snapping)”算法能够基于器械传感器数据和解剖结构的模型被用来显示器械在最近的解剖结构通道中的虚拟描绘。然而,由于前述的传感器精度限制、解剖结构建模不准确和/或存在配准误差,因此这种抠图显示可能将器械放置在错误的解剖结构通道中。
因此,在一些实施例中,术中的外部图像数据E能够被用来增加抠图算法的可靠性,这通过利用提取的解剖结构图像数据和/或器械图像数据来细化解剖结构模型和/或器械姿态以使器械在解剖结构内的测量的和建模的放置能被调整,或通过从外部图像数据提取在解剖结构内的器械放置数据,从而提供器械在解剖结构内的实际放置的快照(snapshot)。
外部图像数据E的这种处理可以由控制系统116、外部图像控制器170和/或任何其他处理单元来执行。在其他实施例中,器械104的姿态和/或解剖结构A的状态可以利用此类特征提取技术从外部图像数据E进行提取,并且此类提取的信息被控制系统116用来更新模型M、器械104的姿态和/或器械104到模型M的配准。
在各种其他实施例中,外部图像数据能够被用来仅仅提供增强的直接程序性监测和/或性能控制。在一些实施例中,外部图像数据能够示出被并入器械104或通过器械104递送的辐射线透不过的(或以其他方式通过外部成像器160可视化)诊断或治疗工具或物质(例如,治疗剂、可植入装置或基准)的术中的进展和/或活动。
例如,在图2E中,外部图像数据E示出了示例性工具132(例如,活检、抽吸或皮下注射针)通过处理目标T2的轨迹。器械姿态可以被调整以基于从外部图像数据E提取的特征数据来优化程序性能(例如,器械104(和/或远端区域126和/或工具132)、解剖结构A和目标T2的相对位置信息可以从外部图像数据E被提取,并且然后被用来调整器械104的姿态以关于目标T2正确地对齐并定位工具132)。以此方式,外部图像数据E的术中递送能够最小化工具132与目标T2失配的机会。
在其他实施例中,外部成像数据可以提供目标T2实际上受工具132影响从而确保适当的程序完整的确认(例如,从目标T2采样组织或递送物质到目标T2的确认)。确认可以是纯粹虚拟的(例如,工具132和目标T2的同步显示),或可以是至少半自动的确认(例如,与工具132和目标T2中的至少一个有关的图像数据经由外部图像数据E的特征提取或其他分析被识别,以确定指示两者之间接触的叠加)。
在各种其他实施例中,程序的进展和活动能够被监测。例如,如图2F所示,由于器械104的操作而产生的受影响区域AR通过外部成像器160(例如,经由温度、材料分布/合成、细胞改性和/或密度的变化)可检测,并且在外部图像数据E中被指示。
在一些实施例中,受影响区域AR可以指示通过器械104递送的治疗剂(例如,药物或细胞毒素)、诊断剂、麻醉剂、生物学制剂、成像剂(例如,吲哚菁绿(ICG)、对比剂、或放射性示踪剂)、处理剂(例如,放射性籽源植入物或辐射激活的纳米颗粒)、植入物(例如,结构支持物、功能机构、或时间释放胶囊)、基准、或任何其他物质的质量、活动、弥散配置和/或其他行为。受影响区域AR的尺寸、形状、位置、强度、取向或任何其他特性然后可以是用于调整物质递送应用的参数的基础(例如,连续递送、增加/降低递送速率、停止递送、调整位置/取向或改变物质的含量)。
例如,通过监测由于细胞毒素到目标T2的递送而产生的受影响区域AR,总细胞毒素剂量能够通过当外部图像数据E中的受影响区域AR开始膨胀超过目标T2时停止递送而被最小化。响应于受影响区域AR的监测,这种递送终止可以是用户引导的(例如,响应于观察到的受影响区域AR的状态,临床医生手动地终止递送),或可以是至少半自动的(例如,当特征提取或其他算法确定区域AR(部分地或全部地)超过目标T2预定量时,提供告知或终止递送)。
在各种其他实施例中,受影响区域AR可以指示目标区域中由于温度增加、辐射剂量、密度变化或所应用的处理模式的任何其他影响引起的组织变化。类似于上述的物质递送监测方法,受影响区域AR的尺寸、位置、强度或任何其他特性可以是用于调整处理模式的参数的基础(例如,调整递送速率、功率/强度、操作模式或者甚至简单地继续或停止治疗)。
例如,通过监测由于在消融程序期间增加温度而产生的受影响区域AR,伴随的组织损伤能够通过当目标T2的足够部分达到期望的温度时终止消融而被最小化。类似于如上,响应于监测受影响区域AR,治疗的这种终止能够是用户引导的(例如,响应于观察到的受影响区域AR的状态,临床医生手动地终止治疗),或可以是至少半自动的(例如,当特征提取或其他算法确定区域AR达到最大尺寸、强度和/或分布型式时,提供告知或终止治疗)。
图3A示出了外部成像用在手术机器人程序中的示例性流程图。在可选的“系统数据产生”步骤300中,基于术前建模数据或术中建模数据提供患者解剖结构和使用中的手术器械的术中模型,诸如在上面关于图2A描述的。外部成像系统然后被用来在“外部成像”步骤310中术中产生针对患者解剖结构的至少一部分的图像数据,诸如在上面关于图2C描述的。在一些实施例中,步骤310的成像对用于产生在步骤300中提供的初始模型的整个解剖结构区域执行。在各种其他实施例中,步骤310的成像只对最初建模的解剖结构区域的一部分执行。
例如,如在图3B的示例性实施例中指示的,步骤310能够包括“局部化成像”步骤312,在步骤312中最初建模的解剖结构中的仅一部分能够成像,诸如在上面关于图2B和图2C描述的。在一些情况下,局部化成像能够有益地减少辐射暴露或扫描时间,和/或能够实现期望的区域的更详细的成像。在一些实施例中,在可选的“器械定位”步骤311中,手术器械的姿态(例如,位置和/或取向)被用作用于限定在步骤312中要成像的解剖结构的一部分的参考,诸如在上面关于图2B描述的。在其他实施例中,实际的患者解剖结构(例如,解剖结构特征或期望的程序目标)能够被用作用于限定在步骤312中成像的区域的参考。
返回到图3A,在步骤310中产生的外部图像数据然后能够被用来术中引导在“程序控制”步骤320中被执行的手术程序。该程序控制能够涉及可以受益于在步骤310中产生的术中的外部图像数据的给定程序的任何方面。例如,在一些实施例中,步骤320能够包括可选的“物质递送”步骤320A,在步骤320A中物质(例如,处理剂、诊断剂或成像剂、植入物、基准或其他要素)被递送到目标位置。如在上面关于图2F描述的,来自步骤310的图像数据然后可以被用来监测和/或调节在步骤320A中执行的物质递送。
在各种其他实施例中,步骤320能够包括可选的“处理递送”步骤320B,其中处理(例如,消融、辐射、电穿孔等)被应用于目标位置。如在上面关于图2F描述的,来自步骤310的图像数据然后可以被用来监测和/或调节在步骤320B中的处理模式的应用。
在各种其他实施例中,步骤320能够包括可选的“器械定向化”步骤320C,在步骤320C中器械(例如,器械104或任何其他诊断、手术、或治疗器械)相对于患者解剖结构和/或目标手术位置被定位/被取向。如在上面关于图2E描述的,器械相对于患者解剖结构(例如,整体解剖结构或特定目标位置)的姿态能够基于术中的外部图像数据来调整以增强程序结果。
在各种其他实施例中,步骤320能够包括可选的“器械致动”步骤320D,在步骤320D中器械(例如,器械104或任何其他诊断、手术、或治疗器械)被致动(例如,组织采样、切除、切开、闭合、或缝合、以及其他),其中外部图像数据在此器械致动期间被获得以确认成功的性能。如在上面关于图2E描述的,器械与目标解剖结构之间的交互能够被检测以确认程序结果。注意,可选的步骤320A-320D能够被单独地或以任何组合使用。另外,用于步骤320的各种其他可选的控制操作将会是显而易见的,包括上述的控制效果中的任何一个/所有的图形显示。
在一些实施例中,外部图像数据能够被用来增强和/或细化在医疗机器人系统的操作和控制中使用的(一个或多个)模型。例如,图3C示出了用在手术机器人程序中的外部成像的另一示例性流程图。在可选的“系统数据产生”步骤300中,基于术前建模数据或术中建模数据提供患者解剖结构和使用中的手术器械的术中模型,诸如在上面关于图2A描述的。外部成像系统然后被用来在“外部成像”步骤310中术中产生针对患者解剖结构的至少一部分的图像数据,诸如在上面关于图2C描述的。在一些实施例中,步骤310的成像对用于产生在步骤300中提供的初始模型的整个解剖结构区域执行。在各种其他实施例中,步骤310的成像只对最初建模的解剖结构区域的一部分执行(例如,如关于图3B描述的)。
然后,在“建模调整”步骤330中,对建模的解剖结构/系统的更新被产生和/或被应用。步骤330的建模调整能够是用于在该程序被执行期间使用的建模环境的任何引导或对该建模环境的任何更改。例如,在一些实施例中,如图3D所示,步骤330能够仅仅是可选的“特征提取”步骤330A,在步骤330A中用于该程序的感兴趣特征(例如,解剖结构、手术目标、器械、基准等)在外部图像数据内被识别。如上面提及的,步骤330A的这种识别能够利用任何数量的特征提取技术(诸如边缘检测、角点检测、形状匹配和/或曲线演变、以及其他)来执行。
该提取的特征数据然后能够被用来例如更新/细化在步骤300中提供的模型,诸如在上面关于图2D描述的。例如,从外部图像数据提取的解剖结构特征数据能够被用来更新解剖结构模型以更准确地表示解剖结构的术中状态,和/或更新器械配置的基于传感器的模型以更准确地表示器械的术中姿态。
然而,在各种其他实施例中,从外部图像数据提取的特征数据能够被用来更准确地配准程序环境的各种建模要素。换言之,术中的外部图像数据能够被用来细化/建立医疗机器人系统、患者解剖结构和/或患者解剖结构的模型之间的(一个或多个)关系。
在一些实施例中,步骤330能够包括可选的“模型-患者配准”步骤330B,在步骤330B中患者解剖结构的解剖结构模型被更接近地配准到实际的患者解剖结构。例如,对应于相对于患者解剖结构具有已知位置和/或取向的基准要素(例如,衬垫、线圈、标记、解剖结构或通过外部成像器160可见的任何其他要素)的基准数据能够从如上所述的外部图像数据被提取。图像基准数据然后能够为对应于感兴趣的患者解剖结构的图像数据提供参考系,从而允许患者解剖结构的模型被正确地配准到实际的患者解剖结构。例如,通过配准内部的患者解剖结构(例如,气道树)的解剖结构模型与(一个或多个)外部的参考基准,关于器械尺寸、程序路径或可能会受患者的内部解剖结构状态影响的任何其他方面,能够提供引导,或能够识别潜在的组织(例如,提供关于器械尺寸、程序路径规划优化或该程序的可能会受患者的内部解剖结构状态影响的任何其他方面的引导)。
在其他实施例中,步骤330能够包括可选的“系统-患者配准”步骤330C,在步骤330C中医疗机器人系统和/或该系统的(一个或多个)器械被更接近地配准到实际的患者解剖结构。例如,对应于相对于患者解剖结构和医疗机器人系统/(一个或多个)器械具有已知位置和/或取向的基准要素的基准数据能够从如上所述的外部图像数据被提取。图像基准数据然后能够为系统/(一个或多个)器械和感兴趣的患者解剖结构建立或细化公共的参考系,从而允许该系统相对于患者解剖结构更精确地操作。例如,通过将器械配准到患者解剖结构,到患者体内的通常将手动地执行的初始切口(例如,为了插入用于机器人器械的套管)可以在具有或不具有减小的手动介入的情况下由医疗机器人系统来执行。
在其他实施例中,步骤330能够包括可选的“系统-模型配准”步骤330D,在步骤330D中医疗机器人系统和/或该系统的(一个或多个)器械被更接近地配准到患者解剖结构的模型。例如,对应于相对于患者解剖结构和医疗机器人系统/(一个或多个)器械具有已知位置和/或取向的基准要素的基准数据能够从如上所述的外部图像数据被提取。图像基准数据然后能够为系统/(一个或多个)器械和解剖结构模型建立或细化公共的参考系,从而当直接的或外部的可视化不可用时,允许该系统被更有效地操作。例如,通过将器械准确地配准到解剖结构模型,器械在患者解剖结构内的移动能够仅仅经由与器械相关联的传感器(例如,形状传感器、EM传感器等)被准确地表征、控制和/或监测。
注意,可选步骤330A-330D能够被单独地或以任何组合使用。另外,用于步骤320的各种其他可选的建模调整将会是显而易见的。此外,在各种其他实施例中,步骤320的(一个或多个)建模调整能够与步骤320的程序控制操作中的任何一个/所有结合使用,如在图3C中指示的,并且各种反馈和调整循环在步骤300-330之中是可能的,如通过虚线指示的。
尽管本公开的系统和方法已经图示了在肺的连接支气管通道中使用,但在包括结肠、肠、肾脏、大脑、心脏、循环系统等的各种解剖系统中的任何一个中经由自然的连接通道或手术创建的连接通道,它们也适合于其他组织的导航和处理。本公开的方法和实施例也适合于非手术应用。
在本发明的实施例中的一个或多个要素可以以软件实施,以在诸如控制系统116的计算机系统的处理器上执行。当以软件实施时,本发明的实施例的要素本质上为执行必要任务的代码段。程序或代码段能够被存储在处理器可读存储介质或装置中,该程序或代码段已经通过嵌入在载波中计算机数据信号的方式经由传输介质或通信链路被下载。处理器可读存储装置可以包括能够储存包括光介质、半导体介质和磁介质的信息的任何介质。处理器可读存储装置示例包括电子电路;半导体装置、半导体存储器装置、只读存储器(ROM)、闪存、可擦除可编程只读存储器(EPROM);软磁盘、CD-ROM、光盘、硬盘或其他存储装置。代码段可以经由诸如互联网、内联网等的计算机网络下载。
注意,所提出的过程和显示不可与任何特定的计算机或其他装置内在地相关。根据本文的教导,各种通用的系统可以与程序一起使用,或其可以证明便于构建更专用的装置,以执行所描述的操作。用于各种这些系统的所需结构在权利要求中将表现为要素。此外,本发明的实施例未参考任何特定的编程语言描述。应该清楚,如在本文所述的,各种编程语言均可以用于实施本发明的教导。
虽然已经描述并且在附图中示出了本发明的某些示例性实施例,但应该明白,此类实施例仅为说明的目的而非限制宽泛的发明,并且由于本领域的技术人员可以想到各种其他的修改,所以本发明的实施例并非限于示出和描述的具体构造和布置。
- 还没有人留言评论。精彩留言会获得点赞!