药物洗脱球囊和球囊导管的制作方法
本发明涉及医疗器械领域,特别涉及一种药物洗脱球囊和球囊导管。
背景技术:
心血管疾病是影响人体健康的重要疾病,经皮冠脉介入治疗(percutaneouscoronaryintervention,pci)由于其创伤小、血管再狭窄率低等优点逐渐成为了阻塞性冠心病治疗的首选方案。目前主流的治疗方案是药物洗脱支架(drugelutingstent,des)。药物洗脱支架的初衷是为了解决裸金属支架(baremetalstent,bms)治疗后的支架内再狭窄(in-stentrestenosis,isr)的高发生率问题,药物洗脱支架负载有抗增生药物,可显著的抑制血管的内膜增生,减少支架内再狭窄的发生率。然而,药物洗脱支架同样面临着一些难题,例如后期支架内血栓,血管愈合时间长等。与此同时,随着接受经皮冠状动脉介入术的患者数量逐年增加,isr问题亟待解决。
最近,将传统球囊扩张技术与最新的药物释放技术相结合的药物洗脱球囊(drugelutingballoon,dcb)由于其介入而不植入、无血栓风险和治疗效果快等优点越来越受到人们关注。药物洗脱球囊与药物洗脱支架的作用类似,可将涂覆在球囊表面的抗增生药物均一地输送到病患部分的血管壁,从而抑制内膜增生,减少支架内再狭窄的发生率。
然而,药物洗脱球囊的设计需要平衡药物在球囊上的粘附能力和在植入治疗时药物从球囊表面脱附的能力。由于药物洗脱球囊在治疗过程中的扩张时间很短,大约仅有30-60s,使得药物和血管壁接触时间很短,在这较短的时间内药物难以脱落完全,同时有血流的冲刷,使得最终被血管壁吸收的药物量较少,致使抑制内膜增生效率不佳。若增加药物在球囊上的涂覆量,虽可使药物的吸收量增加,但由此带来的大剂量的药物会产生一定的毒副作用。
技术实现要素:
本发明的目的在于提供一种药物洗脱球囊和球囊导管,通过隔离层的设置,将水溶性胶层和药物层隔离开,能促进药物在病患部位时从球囊表面脱离,同时还能够减少血液对药物的冲刷,使药物被血管壁最大摄取,从而提高药物层的利用率,达到最佳治疗效果,同时避免药物毒副作用。
为解决上述技术问题,本发明提供一种药物洗脱球囊,其包括球囊本体和涂层,所述涂层设置于所述球囊本体的外表面;其中,所述涂层由内向外依次包括水溶性胶层、隔离层和药物层;所述水溶性胶层覆盖所述球囊本体的外表面的全部或部分,所述隔离层完全或不完全覆盖所述水溶性胶层。
可选的,所述隔离层包括防水可降解材料,所述防水可降解材料选择以下组合中的一种或多种:纤维素类材料、聚酯类材料、壳聚糖类材料、聚氨基酸、甲壳素、聚乙烯醇缩醛。
可选的,所述隔离层还包括增塑剂,所述增塑剂选自甘油、蓖麻油和橄榄油中的一种或多种组合。
可选的,所述隔离层占所述涂层的质量分数为1%-20%,优选的,所述隔离层占所述涂层的质量分数为5%-10%。所述防水可降解材料和所述增塑剂的质量比为1:1~1:2,可选的,所述防水可降解材料和所述增塑剂的质量比为1:1.2~1:1.5。
可选的,所述水溶性胶层的至少一端未覆盖所述隔离层。
可选的,所述水溶性胶层网格状或条纹状或螺旋状覆盖于所述球囊本体的外表面。
可选的,所述水溶性胶层包括水溶性高分子材料,所述水溶性高分子材料选自淀粉类天然高分子材料和合成水溶性高分子材料中的一种或两种组合。
可选的,所述水溶性胶层占所述涂层的质量分数为15%~50%,优选的,所述水溶性胶层占所述涂层的质量分数为30%~40%。所述水溶性高分子材料包括淀粉类天然高分子和合成水溶性高分子材料,且质量比为1:1~5:1。可选的,所述淀粉类天然高分子和所述合成水溶性高分子材料的质量比为2:1~4:1。
可选的,所述药物层包括药物和高分子辅料,高分子辅料选自部分水解的聚乙烯醇和聚乙烯吡咯烷酮中的一种或多种组合。
可选的,所述药物层占所述涂层的质量分数为30%-80%。可选的,所述药物层占所述涂层的质量分数为50%-75%。
可选的,所述药物和所述高分子辅料的质量比为1:1~1:5。可选的,所述药物和所述高分子辅料的质量比为1:2~1:3。
为解决上述技术问题,本发明还提供一种球囊导管,其包括如上所述的药物洗脱球囊。
在本发明提供的药物洗脱球囊和球囊导管中,在球囊本体的外表面上设置有涂层,且所述涂层由内向外包括水溶性胶层、隔离层和药物层,进而当所述药物洗脱球囊推送至病患部位后,球囊本体扩张,水溶性胶层在血流的冲刷下溶解,使隔离层和药物层从球囊本体的外表面脱离并粘附于血管壁上,此外,通过隔离层能有效的减少水溶性胶层在溶解的过程中带走部分药物层,同时当药物层粘附接触于血管壁后,还可以减少血流对药物层的冲刷作用,减少药物的损失,使药物被血管壁最大摄取,从而在不增加药物剂量的情况下,使药物的利用率得到了较大的提高,达到最佳治疗效果,同时也避免大剂量药物带来的毒副作用。此外,隔离层的设置还可显著避免血流对药物层的冲刷,从而实现药物层的缓释,使药物层能较长时间的发挥治疗作用,可取得较佳的治疗效果。还需要说明的是,药物层中的高分子辅料交联后水溶性降低并形成药物贮存网络,可有效的减少在植入球囊过程中药物的洗脱。
附图说明
本领域的普通技术人员将会理解,提供的附图用于更好地理解本发明,而不对本发明的范围构成任何限定。其中:
图1是本发明一实施例提供的药物洗脱球囊的局部剖面的示意图。
附图中:
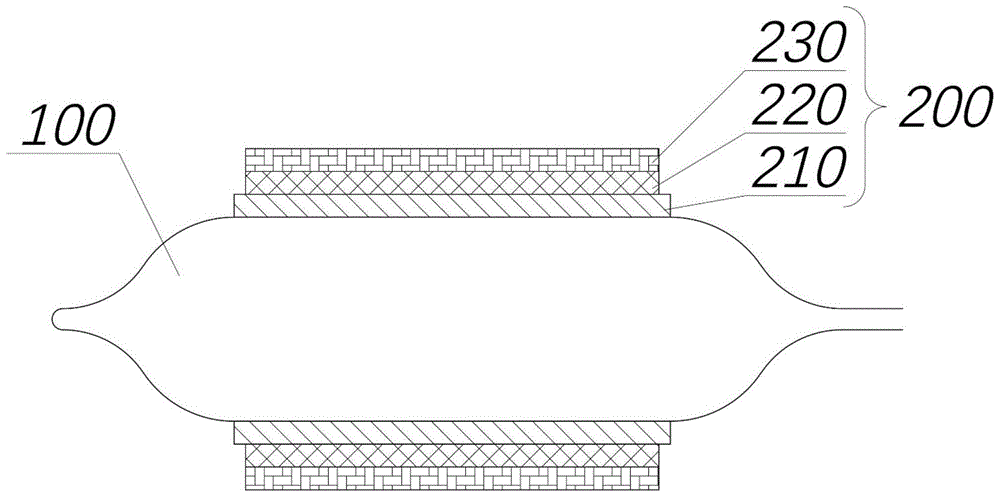
100-球囊本体;200-涂层;210-水溶性胶层;220-隔离层;230-药物层。
具体实施方式
为使本发明的目的、优点和特征更加清楚,以下结合附图和具体实施例对本发明作进一步详细说明。需说明的是,附图均采用非常简化的形式且未按比例绘制,仅用以方便、明晰地辅助说明本发明实施例的目的。此外,附图所展示的结构往往是实际结构的一部分。特别的,各附图需要展示的侧重点不同,有时会采用不同的比例。
如在本说明书和所附权利要求书中所使用的,单数形式“一”、“一个”以及“该”包括复数对象,除非内容另外明确指出外。如在本说明书和所附权利要求中所使用的,术语“或”通常是以包括“和/或”的含义而进行使用的,除非内容另外明确指出外,术语“近端”通常是靠近术者的一端,术语“远端”通常是靠近患者病变部位的一端。术语“向内”通常是靠近球囊轴线的方向,“向外”是与“向内”相对的方向。
本发明所涉及的“药物洗脱球囊”或“球囊导管”的使用环境包括但不限于血管、管腔,所述血管包括冠状动脉血管、外周动脉血管、脑动脉血管;所述的管腔包括食道、气道、肠道、胆道、宫颈、泌尿道、前列腺、关节腔、脊椎间等:具体使用类型包括但不限于:用于经皮冠脉介入治疗的药物洗脱球囊或球囊导管、外周血管球囊或球囊导管、颅内血管球囊或球囊导管、尿道球囊或球囊导管或球囊导管、食道球囊或球囊导管、椎体球囊或球囊导管、肩袖球囊或球囊导管等。
请参考图1,本发明实施例提供一种药物洗脱球囊,其包括球囊本体100和涂层200,所述涂层200设置于所述球囊本体100的外表面;所述涂层200包括由内向外依次叠合(叠合是指一层层叠加组合)的水溶性胶层210、隔离层220和药物层230;所述药物层230具有粘附性,用以与病变部位(即预定部位)粘附接触,所述水溶性胶层210用以在所述球囊本体100扩张后,在血流的冲刷下溶解,以使所述隔离层220和所述药物层230与所述球囊本体100脱离;所述隔离层220用以减少所述水溶性胶层210在溶解的过程中带走所述药物层230,以及在所述水溶性胶层210溶解后,减少血流对所述药物层230的冲刷。
因此,当所述药物洗脱球囊推送至病变部位后,球囊本体100扩张,使水溶性胶层210在血流的冲刷下溶解,从而使隔离层220和药物层230从球囊本体100的外表面脱离并粘附于血管壁上,而隔离层210的设置,能有效的减少水溶性胶层210在溶解的过程中带走药物层230,同时当药物层230粘附接触于血管壁后,还可以减少血流对药物层230的冲刷作用,减少药物的损失,使药物被血管壁最大摄取,从而提高药物的利用率,达到最佳治疗效果,而且也无需增加涂覆的药物剂量,避免大剂量药物带来的毒副作用。此外,隔离层220在显著避免血流对药物层230的冲刷时,可实现药物层230的缓释,使药物层230能较长时间的发挥治疗作用,取得较佳的治疗效果。
因此,相比现有的药物洗脱球囊,本发明提供的药物洗脱球囊解决了药物在球囊上的粘结和脱落的矛盾,可实现药物可控的脱离。具体地,在储存和输送的过程中,利用水溶性胶层的粘结性,可将隔离层和药物层牢固地粘接在球囊本体的表面,从而防止隔离层和药物层脱落;而在药物洗脱球囊输送到达预定植入部位,并将球囊本体扩张后,水溶性胶层可在血流冲刷下溶解,实现隔离层和药物层的脱离。在一种实施例中,所述隔离层220选自可降解且具有成膜防水特性的材料,可选自以下组群:纤维素类、聚酯类、聚氨基酸、甲壳素、壳聚糖类、丝素蛋白、聚乙烯醇缩醛(包括聚乙烯醇缩甲醛和聚乙烯醇缩丁醛)。所述的纤维素类材料包括但不限于低取代硝化纤维素、醋酸纤维素、甲硅烷基化纤维素、乙酰化纤维素等;所述的聚酯类材料包括但不限于聚乳酸、聚羟基乙酸、聚乳酸-羟基乙酸共聚物、聚己内酯、医用聚氨酯、聚羟基戊酸酯、聚-3-羟基丁酸酯或其共聚物等;所述的壳聚糖类材料包括但不限于壳聚糖或在壳聚糖中添加其他物质,该些物质包括但不限于聚醚、明胶、绿球藻多糖、果胶、苹果多酚等。
优选的,隔离层220可以包括增塑剂,所述增塑剂选自甘油、蓖麻油和橄榄油中的一种或多种组合。优选的,所述隔离层220占所述涂层200的质量分数为1%-20%,更优选的,所述隔离层220占所述涂层200的质量分数为5%-10%。所述防水可降解材料和所述增塑剂的质量比优选为1:1~1:2,所述防水可降解材料和所述增塑剂的质量比为1:1.2~1:1.5。
在一种实施例中,隔离层220可以在底侧接枝肝素等抗血栓功能分子,达到抗血栓的效果。
在一种实施例中,所述水溶性胶层210由水溶性高分子材料和助剂组成。优选的,所述水溶性高分子材料选自淀粉类天然高分子材料和合成水溶性高分子材料中的一种或两种组合。优选的,所述水溶性胶层210占所述涂层200的质量分数为15%~50%,更优选的,所述水溶性胶层210占所述涂层200的质量分数为30%~40%。所述水溶性高分子材料较佳地由淀粉类天然高分子和/或合成水溶性高分子材料共同组成。淀粉类天然高分子材料选自小麦淀粉、玉米淀粉、木薯淀粉以及他们的改性淀粉中的一种或多种;所述的合成水溶性高分子材料选自聚丙烯酰胺、水解聚丙烯酰胺、聚丙烯酸、卡波姆、海藻酸钙中的一种或多种。淀粉类天然高分子材料和合成水溶性高分子材料的质量比优选为1:1~5:1,所述淀粉类天然高分子材料和所述合成水溶性高分子材料的质量比为2:1~4:1。水溶性的胶层既可以在干燥状态起粘合作用,减少运输和球囊输送过程中的药物损失,又可以利用输送过程中的逐渐溶解特性将药物层完整脱落下来,实现靶向可控的释放。
在一种实施例中,为了增加/调整所述水溶性胶层的溶解速度,水溶性胶层210可以为网状涂布、条纹状涂布、螺旋状涂布或其他规则或不规则的图案涂布于球囊本体外表面。
一种实施例中,所述药物层230由抗增殖的、抗炎的、消炎的、抗增生的、抗菌的、抗肿瘤的、抗有丝分裂的、抑制细胞的、具有细胞毒的、抗骨质疏松症药物、抗血管生成的、抗再狭窄的、抑制微管的、抗转移的或者抗血栓的药物和高分子辅料共同组成,使得药物层能够和血管壁接触紧密牢固,在隔离层的保护下,具有缓释长时间的治疗作用。所述药物包括但不限于地塞米松、泼尼松龙、皮质酮、布地奈德、雌激素、柳氮磺吡啶和氨水杨酸、阿西美辛、七叶皂苷、氨基蝶呤、抗霉菌素、三氧化二砷、马兜铃酸、阿司匹林、小糪碱,银杏酚,雷帕霉素及其衍生物(包括佐他莫司、依维莫司、比欧莫斯、7-o-去甲基雷帕霉素、替西罗莫司、地磷莫司等),内皮他汀、血管他汀、血管肽素、能够阻断平滑肌细胞增殖的单克隆抗体、左氧氟沙星、紫杉醇,多西紫杉醇,羟基喜树碱、长春花碱、长春新碱、阿霉素、5-氟尿嘧啶、顺铂、胸苷激酶抑制剂抗生素(特别是放线菌素-d)、激素、抗体治癌药物、双膦酸盐、选择性雌激素受体调节剂、雷尼酸锶、环孢霉素a、环孢霉素c、布雷菲德菌素a。
优选的,所述高分子辅料选自部分水解的聚乙烯醇(87%-89%水解度)和聚乙烯吡咯烷酮中的一种或多种组合。优选的,所述药物层230占所述涂层200的质量分数为30%-80%,更优选的,所述药物层230占所述涂层200的质量分数为40%-50%。所述药物和所述高分子辅料的质量比为1:1~1:5,更优选的,所述药物和所述高分子辅料的质量比为1:2~1:3。
进一步的,本发明实施例还提供一种药物洗脱球囊的制备方法,其包括:
步骤一:在球囊本体的外表面上设置水溶性胶层;水溶性胶层可以直接涂覆在球囊本体上,且水溶性胶层沿球囊本体的整个周向包覆;
步骤二:在所述水溶性胶层上设置隔离层;隔离层可直接涂覆在水溶性胶层上,且隔离层涂覆长度略短于水溶性胶层,即水溶性胶层的两端部分裸露,裸露部分以便与液体接触后溶解,便于球囊本体与水溶性胶层脱离。
步骤三:在所述隔离层上设置药物层;首先通过紫外辐射使所述高分子辅料交联,然后将所述药物涂覆于交联后的高分子辅料上形成药物层,且药物层也完全包覆隔离层。
此外,本实施例还提供一种球囊导管,包括如上所述的药物洗脱球囊,本领域技术人员可根据现有技术配置所述的球囊导管除药物洗脱球囊外的其它结构部分,因此这里对所述球囊导管的结构和原理不再赘述。由于本实施例提供的球囊导管包括如上所述的药物洗脱球囊,因此亦具有所述药物洗脱球囊所带来的有益效果,具体可参考上述实施例。
接下去,结合具体的制备方法,通过多个实施例,对本发明的药物洗脱球囊的制备方式作进一步地说明,以更凸显上述实施例的特点和特征。
【实施例一】
本实施例提供一种药物洗脱球囊的制备方法,具体包括如下步骤:
步骤一:水溶性胶层的制备和涂布
首先将5g植物淀粉溶于100ml水中,边加热边搅拌,而后升温至90℃并保温30分钟;随后将润胀的1wt%(即质量百分比1%)聚乙烯醇水溶液加入其中,得到水溶性胶液;之后将球囊本体100浸入水溶性胶液中,经过若干时间后,取出球囊本体100并干燥固化,即完成水溶性胶层210在球囊本体100的涂布。其中,所述植物淀粉选自小麦淀粉、玉米淀粉和木薯淀粉中的一种或多种组合。在本实施例中,水溶性高分子材料仅由淀粉类天然高分子材料构成,助剂为聚乙烯醇。
步骤二:隔离层的制备和涂布
首先取硝化纤维素6g和甘油5ml溶于60ml乙醇-乙酸正丁酯(1:2,v:v)(即乙醇-乙酸正丁酯的体积比为1:2)的混合溶液,并搅拌均一,得到成膜溶液;随后使用超声喷涂方法在步骤一所制备的水溶性胶层210的部分表面(在此,水溶性胶层210的两端部分裸露),喷涂一层成膜溶液,之后干燥固化,即完成隔离层220的制备和涂布。
步骤三:药物层的制备和涂布
首先将1.5g聚乙烯吡咯烷酮(pvp)溶于100ml氯仿,并搅拌均一;随后使用超声喷涂方法在步骤二所制备的隔离层220的表面(涂布范围不超过涂布有隔离层220的范围)进行喷涂,干燥后放置在紫外灯下辐射交联10min,制得pvp交联层;另取西罗莫司溶于乙醇-水(8:2,v:v),浓度为6mgml-1;随后,吸取100μl西罗莫司溶液均匀滴涂在所述pvp交联层的表面,之后在40℃下真空干燥,即完成药物层230的制备和涂布。
完成步骤一至步骤三后,即完成了整个涂层200的制备和涂布,亦即完成了整个药物洗脱球囊的制备过程。
【实施例二】
本实施例提供的药物洗脱球囊的制备方法与实施例一基本相同,以下仅针对不同点进行描述。
步骤一和步骤二与实施例一相同,不同在于步骤三:药物层的制备和涂布
首先将1.5g聚乙烯吡咯烷酮(pvp)溶于100ml氯仿,并搅拌均一;随后使用超声喷涂方法在步骤二所制备的隔离层220的表面(涂布范围不超过涂布有隔离层220的范围)进行喷涂,干燥后放置在紫外灯下辐射交联10min,制得pvp交联层;另取佐他莫司溶于乙醇-水(8:2,v:v),浓度为6mgml-1;随后吸取100μl佐他莫司溶液均匀滴涂在所述pvp交联层的表面,之后在40℃下真空干燥,即完成药物层230的制备和涂布。
【实施例三】
本实施例提供的药物洗脱球囊的制备方法与实施例一基本相同,以下仅针对不同点进行描述。
步骤一和步骤二与实施例一相同,不同在于步骤三:药物层的制备和涂布
首先将1.5g聚乙烯吡咯烷酮(pvp)溶于100ml氯仿,并搅拌均一;随后使用超声喷涂方法在步骤二所制备的隔离层220的表面(涂布范围不超过涂布有隔离层220的范围)进行喷涂,干燥后放置在紫外灯下辐射交联,制得pvp交联层;另取紫杉醇溶于乙醇-水(8:2,v:v),浓度为6mgml-1;随后吸取100μl紫杉醇溶液均匀滴涂在所述pvp交联层的表面,之后在40℃下真空干燥,即完成药物层230的制备和涂布。
【实施例四】
本实施例提供的药物洗脱球囊的制备方法与实施例一基本相同,以下仅针对不同点进行描述。
步骤一和步骤三与实施例一相同,不同在于步骤二:隔离层的制备和涂布
首先取壳聚糖1g、聚乙烯醇5g、卡波姆0.5g和橄榄油8ml溶于60ml乙醇-乙酸正丁酯(1:3,v:v)的混合溶液,并搅拌均一,得到成膜溶液;随后使用超声喷涂方法在步骤一所制备的水溶性胶层210的部分表面(在此,水溶性胶层210的两端部分裸露),喷涂一层成膜溶液,之后干燥固化,即完成隔离层220的制备和涂布。
【实施例五】
本实施例提供的药物洗脱球囊的制备方法与实施例一基本相同,以下仅针对不同点进行描述。
步骤一和步骤三与实施例一相同,不同在于步骤二:隔离层的制备和涂布
首先取壳聚糖1g、医用聚氨酯5g和蓖麻油5ml溶于60ml二甲基甲酰胺(dmf)中,并搅拌均一,得到成膜溶液;随后使用超声喷涂方法在步骤一所制备的水溶性胶层210的部分表面(在此,水溶性胶层210的两端部分裸露),喷涂一层成膜溶液,之后干燥固化,即完成隔离层220的制备和涂布。
【对比例】
取西罗莫司和碘普罗胺的1:1(w/w)混合的丙酮溶液,使用超声喷涂将其喷涂在普通球囊表面,随后自然干燥,即得药物涂层球囊。
【输送损失测试】
将上述实施例1-5及对比例中制备的药物球囊插入体外血管模型中,控制达到靶标的时间为60s,不扩张,随后取出,使用高效液相色谱(hplc)测球囊表面的药物残留,计算输送过程的药物损失率。
【组织吸收测试】
取离体的猪动脉血管段,保持37℃恒温,取灭菌的裸球囊扩张血管1min,6atm,随后泄压取出。将上述不同实施例制备的药物球囊置入扩张过的血管,扩张1min,6atm,随后泄压取出。立即使用pbs冲洗。然后通过气相色谱-质谱联用仪(gc-ms)测组织药物浓度和球囊表面的药物残留。
【组织滞留时间测试】
取离体的猪动脉血管段,将上述不同实施例制备的药物球囊置入血管,扩张1min,6atm,随后泄压取出。立即使用pbs冲洗。然后放置在培养基中培养,培养7天和28天,样品取样后使用气相色谱-质谱联用仪(gc-ms)测组织药物浓度。
表1不同实施例药物涂层球囊输送药物损失率、即刻组织药物浓度和药物的组织吸收率
表2不同实施例药物涂层球囊长时间组织浓度
bql:指低于检测限。
实验结果表明,通过以上各实施例的制备方法所制得的药物洗脱球囊,在输送过程中药物的损失率均小于4%,组织药物吸收率均大于41%,能取得较小的药物损失率和较大的药物吸收率,此外,隔离层的设置,可使药物缓释,以长时间的发挥治疗作用。
需要说明的是,本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可,此外,各个实施例之间不同的部分也可互相组合使用,本发明对此不作限定。
上述描述仅是对本发明较佳实施例的描述,并非对本发明范围的任何限定,本发明领域的普通技术人员根据上述揭示内容做的任何变更、修饰,均属于权利要求书的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!