胎儿浓度定量的方法和装置及胎儿基因分型的方法和装置与流程
本发明涉及高通量测序技术领域,具体而言,涉及一种胎儿浓度定量的方法和装置及胎儿基因分型的方法和装置。
背景技术:
2012年发布的中国出生缺陷防治报告显示我国出生缺陷总发生率为5.6%,每年新增患儿约90万例,给患儿、家庭及社会带来严重的经济和精神负担。约有15-25%的出生缺陷与染色体异常相关,因此准确有效的胎儿基因分型方法,将能够对这部分出生缺陷的诊断提供有力的证据,极大的降低出生缺陷发生率。
目前用于胎儿基因分型的产前诊断方法所用的胎儿样本多通过有创的方式获取,如羊水穿刺、绒毛取样及脐带血穿刺,均有相当比例的流产及宫内感染风险。
1997年,香港中文大学卢煜明教授发现在孕妇血浆游离dna中含有胎儿的遗传物质,胎儿遗传物质的比例约占10%,具有个体差异性,并且随孕妇的孕周而变化。由此,打开了通过孕妇血浆游离dna对胎儿进行无创检测的大门,目前,该技术已经广泛应用于胎儿染色体非整倍体检测。
也有利用孕妇血浆中含有的胎儿遗传物质进行单基因遗传病检测的报道,不过大多集中于已知的无母体背景的来源于父亲的突变或者新发突变的检测。对于具有母体突变背景的位点检测,有报道通过单倍型的方法实现,不过需要构建父亲及母亲的单倍型费时费力,过程繁琐。因此,需要开发一种简单准确的胎儿基因分型方法,满足临床应用。
技术实现要素:
本发明的主要目的在于提供一种胎儿浓度定量的方法和装置及胎儿基因分型的方法和装置,以解决现有技术对胎儿基因分型过程繁琐,需要构建双亲单倍型信息的问题。
为了实现上述目的,根据本发明的一个方面,提供了一种胎儿浓度定量的方法,该方法包括:获取含有多个snp位点的测序数据;统计测序数据中在各snp位点的变异频率,并将变异频率为1%~25%的snp位点归为第一类频率,将变异频率为75%~99%的snp位点归为第二类频率,第二类频率=1-变异频率;计算第一类频率和第二类频率形成的数据集的中位数或均值,中位数或均值的2倍即为胎儿浓度。
进一步地,在获取含有多个snp位点的测序数据之前,方法还包括挑选多个snp位点;优选地,挑选多个snp位点包括:从千人基因组数据库中挑选多个候选snp位点;以及从多个候选snp位点中剔除符合以下至少之一情形的snp位点:(1)位于参考基因组重复区域的snp位点;(2)覆盖snp位点侧翼100~150bp区域,且比对到参考基因组多个位置的snp位点;更优选地,多个候选snp位点的等位基因频率为0.4~0.6。
进一步地,多个snp位点为表1所示的150个snp位点中的100~150个。
根据本申请的第二个方面,还提供了一种胎儿基因分型的方法,方法包括:分别获取来源于孕妇的血浆游离dna和白细胞基因组dna的测序数据;将两组测序数据与参考基因组比对,获得变异snp位点;计算各变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型;其中,胎儿浓度按照上述任一种方法进行定量。
进一步地,计算变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型,推断得出胎儿的基因型包括:根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa,计算变异snp位点在白细胞中的变异基因型频率fre_wbc和在血浆游离dna中的变异基因型频率fre_plasma,δ=frq_plasma-frq_wbc;判断||δ|-ff/2|是否满足第一阈值,优选第一阈值大于0.03,若是,则胎儿基因型为aa;若否,则进一步判断δ是大于0还是小于0,若是大于0,则胎儿基因型为aa,若是小于0,胎儿基因型为aa,其中,ff为胎儿浓度。
进一步地,计算变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型还包括:根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;计算变异snp位点在血浆游离dna中的变异基因型频率fre_plasma;若fre_plasma满足第二阈值,优选第二阈值大于0.005,则胎儿基因型为aa,若fre_plasma满足第三阈值,优选第三阈值小于0.005,则胎儿基因型为aa。
进一步地,计算变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型还包括:根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;计算变异snp位点在血浆游离dna中的参考基因型频率fre_ref;若fre_fre满足第四阈值,优选第四阈值大于0.005,则胎儿基因型为aa,若fre_ref满足第五阈值,优选第五阈值小于0.005,则胎儿基因型为aa。
为了实现上述目的,根据本发明的第三个方面,提供了一种胎儿浓度定量的装置,装置包括:第一获取模块,用于获取含有多个snp位点的测序数据;统计归类模块,用于统计测序数据中在各snp位点的变异频率,并将变异频率为1%~25%的snp位点归为第一类频率,将变异频率为75%~99%的snp位点归为第二类频率,第二类频率=1-变异频率;第一计算模块,用于计算第一类频率和第二类频率形成的数据集的中位数或均值,中位数或均值的2倍即为胎儿浓度。
进一步地,装置还包括挑选模块,用于挑选多个snp位点;优选地,挑选模块包括:挑选单元,用于从千人基因组数据库中挑选多个候选snp位点;以及剔除单元,用于从多个候选snp位点中剔除符合以下至少之一情形的snp位点:(1)位于参考基因组重复区域的snp位点;(2)覆盖snp位点120bp区域能比对到参考基因组多个位置的snp位点;更优选地,多个候选snp位点的等位基因频率为0.4~0.6。
进一步地,多个snp位点为表1所示的150个snp位点中的100~150个。
为了实现上述目的,根据本发明的第四个方面,提供了一种胎儿基因分型的装置,装置包括:第二获取模块,用于分别获取来源于孕妇的血浆游离dna和白细胞基因组dna的测序数据;比对模块,用于将测序数据与参考基因组比对,获得变异snp位点;推断模块,用于计算各变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型;其中,胎儿浓度按照上述任一种的定量装置进行定量。
进一步地,推断模块包括:第一孕妇基因型确定模块,用于根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa,第二计算模块,用于计算变异snp位点在白细胞中的变异基因型频率fre_wbc和在血浆游离dna中的变异基因型频率fre_plasma,δ=frq_plasma-frq_wbc;第一判断模块,用于判断||δ|-ff/2|是否满足第一阈值,优选第一阈值大于0.03,若是,则胎儿基因型为aa;若否,则进一步判断δ是大于0还是小于0,若是大于0,则胎儿基因型为aa,若是小于0,胎儿基因型为aa。
进一步地,推断模块还包括:第二孕妇基因型确定模块,用于根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;第三计算模块,用于计算变异snp位点在血浆游离dna中的变异基因型频率fre_plasma;第二判断模块,用于判断fre_plasma是满足第二阈值还是满足第三阈值,若fre_plasma满足第二阈值,优选第二阈值大于0.005,则胎儿基因型为aa,若fre_plasma满足第三阈值,优选第三阈值小于0.005,则胎儿基因型为aa。
进一步地,推断模块还包括:第三孕妇基因型确定模块,用于根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;第四计算模块,用于计算变异snp位点在血浆游离dna中的参考基因型频率fre_ref;第三判断模块,用于判断fre_ref是满足第四阈值还是满足第五阈值,若fre_ref满足第四阈值,优选第四阈值大于0.005,则胎儿基因型为aa,若fre_ref满足第五阈值,优选第五阈值小于0.005,则胎儿基因型为aa。
为了实现上述目的,根据本发明的第五个方面,提供了一种存储介质,存储介质上存储有计算机可执行的程序,程序被设置为运行时,执行上述任一种胎儿浓度定量的方法,或上述任一种的胎儿基因分型的方法。
为了实现上述目的,根据本发明的第六个方面,提供了一种电子装置,包括存储器和处理器,存储器中存储有计算机程序,计算机程序执行上述任一种的胎儿浓度定量的方法,或上述任一种的胎儿基因分型的方法。
应用本发明的技术方案,基于孕妇血浆游离dna中胎儿与母体的差异snp位点,实现对男胎和女胎胎儿浓度的准确定量;同时利用孕妇白细胞样本,可以准确反映孕妇本身的遗传背景,结合孕妇血浆游离dna信息和胎儿浓度,不仅可以检测胎儿在无母亲突变背景下是否遗传来源于父亲的突变以及新发突变,还可以准确检测出胎儿在有母亲突变背景下是否遗传来源于母亲或者父亲的突变;本发明采用高通量测序的方法,可一次对多个样本进行检测;该方法易于扩展,可同时对基因组中多个区域的位点进行检测。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
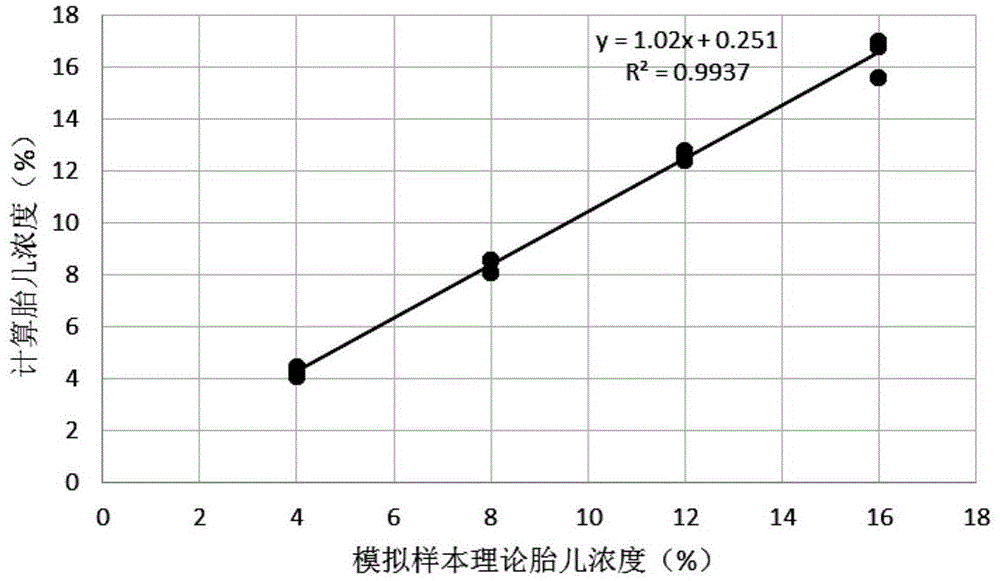
图1示出了根据本发明的一种优选实施例中模拟样本计算胎儿浓度和理论胎儿浓度具有高度一致性;
图2示出了根据本发明的一种优选实施例中临床样本计算胎儿浓度和y染色体定量胎儿浓度具有高度一致性。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。
实施例1
如背景技术中所提到的,现有方法要么是对已知致病位点进行检测,临床扩展性差;要么是还需要构建双亲单倍型信息,该过程复杂,费时费力,也极大限制其在临床上的推广应用。为改善这一现状,本实施例提供了一种胎儿浓度定量的方法,该方法包括:
步骤s101,获取含有多个snp位点的测序数据;
步骤s102,统计测序数据中在各snp位点的变异频率,并将变异频率为1%~25%的snp位点归为第一类频率,将变异频率为75%~99%的snp位点归为第二类频率,第二类频率=1-变异频率;
步骤s103,计算第一类频率和第二类频率形成的数据集的中位数或均值,中位数或均值的2倍即为胎儿浓度。
上述方法中,通过基于母体aa基因型和胎儿aa基因型,母体aa基因型和胎儿aa基因型,这两种情况下,胎儿浓度是测序数据中基因型a或a的基因频率的两倍的原理,利用多个snp位点中变异基因频率在1%~25%的第一类频率和变异基因频率在75%~99%,参考基因频率在1%~25%的snp位点,计算出这些位点频率的中位数或均值的两倍,即可得到胎儿浓度。这种胎儿浓度的定量方法不受胎儿性别的限制,不仅可以对男胎的胎儿浓度进行定量,也可以对女胎的胎儿浓度进行定量,而且计算方法简单准确。
上述方法中,选择变异基因频率或参考基因频率在1%~25%的snp位点,而不选择其他频率的snp位点,比如变异基因频率35%或者40%的位点的原因是,在上述两种基因型情况下,假设两者浓度相等,变异基因频率或参考基因频率也仅为25%,目前绝大多数情况下,胎儿浓度低于50%,因此基本不可能出现高于25%的变异频率的。
上述方法中,snp位点可以根据现有方法进行选择,但为了进一步提高定量的准确性,在一优选的实施例中,在获取含有多个snp位点的测序数据之前,该方法还包括挑选多个snp位点;优选地,挑选多个snp位点包括:从千人基因组数据库中挑选多个候选snp位点;以及从多个候选snp位点中剔除符合以下至少之一情形的snp位点:(1)位于参考基因组重复区域的snp位点;(2)覆盖snp位点侧翼100~150bp区域,且比对到参考基因组多个位置的snp位点;更优选地,多个候选snp位点的等位基因频率为0.4~0.6。
千人基因组数据库中等位基因频率在0.4-0.6之间的snp位点,表明这些snp位点是人群多态性位点,出现频率相对较高,便于在对人群中的随机个体进行检测时,大概率能利用到这些位点。由于不具有单一比对位置或位于重复序列区域的snp的位置不确定性,容易导致变异频率计算出现偏差,因而剔除这些snp位点,有助于提高胎儿浓度定量的准确性。
上述能够用来进行胎儿浓度定量的snp位点可以按照上述原则进行挑选,以挑选的snp位点尽量在基因组上均匀分布为佳,具体的位点数量无特别限定,可以是100~200个中的任意数量,也可以是120~180个,或者是110个、130个、140个、150个、160个、170个、180个、190个。在一优选的实施例中,多个snp位点为表1所示的150个snp位点。表1所示的150个snp位点可以用来作为胎儿浓度定量的定量snp位点。在具体使用时,可以通过捕获探针捕获待测基因位点的序列和含有这些定量snp位点的序列来得到捕获测序文库,从而使得测序数据中利用定量snp位点来对胎儿浓度定量,并利用胎儿浓度结合待测基因位点频率实现对待测基因位点的胎儿基因型判定。
表1:
实施例2
在本申请一种优选的实施例中,还提供了一种胎儿基因分型的方法,该方法包括:分别获取来源于孕妇的血浆游离dna和白细胞基因组dna的测序数据;将两组测序数据与参考基因组比对,获得变异snp位点;计算各变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型;其中,胎儿浓度按照上述任一种方法进行定量。
上述胎儿基因分型的方法中,通过利用白细胞基因组dna的测序数据获得母本的基因型,从而准确反映孕妇本身的遗传背景,结合孕妇血浆游离dna信息和前述的胎儿浓度定量方法获得胎儿浓度,不仅可以检测胎儿在无母亲突变背景下是否遗传来源于父亲的突变以及新发突变,还可以准确检测出胎儿在有母亲突变背景下是否遗传来源于母亲或者父亲的突变。本实施例采用高通量测序的方法,可一次对多个样本进行检测;该方法易于扩展,还可以同时对基因组中多个区域的位点进行检测。
上述方法中,利用孕妇白细胞基因组dna的测序数据可以获得母本的三种基因型,分别是aa、aa和aa基因型,进而根据各待测基因位点的变异基因型频率或参考基因型频率及胎儿浓度即可推断得到胎儿的基因型。
在一优选的实施例中,计算变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型,推断得出胎儿的基因型包括:根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa,计算变异snp位点在白细胞中的变异基因型频率fre_wbc和在血浆游离dna中的变异基因型频率fre_plasma,δ=frq_plasma-frq_wbc;判断||δ|-ff/2|是否满足第一阈值,优选第一阈值大于0.03,若是,则胎儿基因型为aa;若否,则进一步判断δ是大于0还是小于0,若是大于0,则胎儿基因型为aa,若是小于0,胎儿基因型为aa。
该实施例中,能够对母本是杂合体的情况下,准确确定胎儿的基因型,且方法相对更简单。
在一优选的实施例中,计算变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型还包括:根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;计算变异snp位点在血浆游离dna中的变异基因型频率fre_plasma;若fre_plasma满足第二阈值,优选第二阈值大于0.005,则胎儿基因型为aa,若fre_plasma满足第三阈值,优选第三阈值小于0.005,则胎儿基因型为aa。
在一优选的实施例中,计算变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型还包括:根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;计算变异snp位点在血浆游离dna中的参考基因型频率fre_ref;若fre_fre满足第四阈值,优选第四阈值大于0.005,则胎儿基因型为aa,若fre_ref满足第五阈值,优选第五阈值小于0.005,则胎儿基因型为aa。
需要说明的是,上述第一阈值至第五阈值的具体数值的确定,可以通过大量的已知胎儿基因型和母本基因型的样本采用上述方法进行检测确定。
实施例3
在本实施例中,提供了一种详细的胎儿浓度定量的方法,具体如下:
基于孟德尔遗传定律,胎儿基因型判断的理论如表2所示(对一个个体,假设某位点杂合突变情况下的突变频率为0.5,纯合突变情况下的突变频率为1),在母亲基因型一定的情况下,胎儿基因型的差异体现在孕妇血浆游离dna中突变基因型a的频率为胎儿浓度的一半,可见胎儿浓度对胎儿基因型的判断至关重要,特别是在胎儿浓度较低的时候,影响更为明显。
表2.基于孟德尔遗传定律的胎儿基因型判断的理论
注:a为参考基因型,a为突变基因型。
(1)snp位点的挑选:
从千人基因数据库挑选af(allelefrequency)在0.4~0.6之间的snp位点,剔除位于参考基因组重复区域的snp位点,剔除覆盖snp位点120bp区域能比对到参考基因组多个位置的snp位点,最终挑选出150个snp位点(如表1所示),比较均匀分布在各条染色体上。
(2)胎儿浓度的计算
本实施中,计算胎儿浓度的基本原理是:胎儿和母亲是具有亲缘关系的两个个体,根据胎儿和母亲存在差异的snp位点,即可计算出孕妇血浆游离dna中胎儿dna的含量。假设在基因组某一位置的参考基因型为a,突变基因型为a,当母亲基因型为aa,胎儿基因型为aa时,胎儿浓度为a基因型频率的2倍;当母亲基因型为aa,胎儿基因型为aa时,胎儿浓度为a基因型频率的2倍。本实施例主要是利用这两种情况下的snp位点来实现孕妇血浆游离dna中胎儿dna含量的准确计算。
(3)示例一:
挑选3对母子血液样本,分别提取基因组dna,分别按照子代dna比例为4%、8%、12%、16%与对应的母亲基因组dna混合;片段化后,构建二代高通量测序文库,利用包含胎儿浓度定量的150个snp位点和待测基因位点的dna探针杂交,于illuminanova平台双端150bp测序,下机数据过滤掉接头序列、低质量的测序序列、和未比对到基因组及比对到基因组多个区域的序列,计算150个snp位点在基因组位置上相对于参考基因组的变异位点频率;当检出变异位点频率在1%~25%时,该变异位点频率(标记为第一类频率)可直接用于胎儿浓度计算,当检出变异位点频率在99%到75%时,需要计算该位点上参考基因型的频率(标记为第二类频率);胎儿浓度为所有第一类频率和第二类频率的中位数或者平均值的2倍。由图1可见,计算的胎儿浓度和理论的胎儿浓度具有很好的一致性。
(4)示例二:
挑选19例临床不同孕周且均为怀孕男胎的孕妇样本,提取血浆游离dna,构建二代高通量测序文库,同模拟样本后续流程完成文库杂交及测序、质控后,计算胎儿浓度,与目前作为胎儿浓度定量金标准的基于y染色体定量的胎儿浓度相比如图2,可见两者具有高度的一致性。
以上具有母子关系的dna模拟出的不同胎儿dna含量样本和临床孕妇血浆游离dna样本,均验证了该方法的准确性。
实施例4
本实施例中,提供了一种胎儿基因分型的方法,具体如下:
从孕妇全血中分离出血浆和白细胞,分别提取血浆游离dna和白细胞基因组dna,白细胞基因组dna片段化(血浆游离dna已经是片段化dna,无需进一步片段化),和血浆游离dna分别构建二代高通量测序文库,利用包含胎儿浓度定量的150个snp位点和待测基因位点的dna探针杂交,于illuminanova平台双端150bp测序,下机数据过滤掉接头序列、低质量的测序序列、和未比对到基因组及比对到基因组多个区域的序列,计算各位点变异基因型b的频率(或者参考基因型a的频率)和胎儿浓度为ff。对于待测位点分3种情况:
1)孕妇白细胞基因型为aa:
对于某一待测位点计算的白细胞位点变异基因型a频率为fre_wbc,计算的血浆位点变异基因型a频率为fre_plasma,δ=frq_plasma-frq_wbc,胎儿基因型判断如下:先计算||δ|-ff/2|,当其大于0.03时,胎儿基因型为aa,如果不满足上述条件,则看δ的值,当δ大于0时,胎儿基因型为aa,当δ小于0时,胎儿基因型为aa。
2)孕妇白细胞基因型为aa:
对于在血浆中计算的位点变异基因型a的频率fre_plasma,若该值大于0.005,则胎儿基因型为aa,如果该值小于0.005,则胎儿基因型为aa。
3)孕妇白细胞基因型为aa:
对于在血浆中计算的位点参考基因型a频率,如果该值大于0.005,则胎儿基因型为aa,如果该值小于0.005,则胎儿基因型为aa。
实施例5
对8例孕妇的血浆和对应的白细胞,提取血浆游离dna和白细胞基因组dna,按照以下实验流程建库,上机测序。
将孕妇全血分离出血浆和白细胞,白细胞基因组dna采用qiaampdnabloodminikit提取,血浆游离dna采用qiaampcirculatingnucleicacidkit提取,白细胞基因组dna打断成150-200bp左右的片段。
片段化的白细胞基因组dna和血浆游离dna采用kapahyperprepkit建库,具体步骤如下:
(1)末端修复&加a反应
将末端修复缓冲液置于室温融化彻底后,vortex10s,瞬时离心3s;按照下表配制末端修复反应液:
表3:
配好末端修复反应液后,vortex10s,瞬时离心3s,放入pcr仪,按照下表程序进行末端修复反应(pcr仪器热盖温度70℃);
表4:
(2)接头连接
末端修复反应结束后,从pcr仪中拿出样本,按紧pcr管盖,vortex10s,瞬时离心3s;
按下表配制连接反应液:
表5:
配制好的连接反应液vortex10s,瞬时离心3s,置于pcr仪上,20℃温浴30min;
(3)连接产物纯化
a.连接反应结束后,将连接产物转移到1.5ml的离心管中,加入1.2倍体积(132μl)的室温平衡30min的ampurexp磁珠,vortex5s,室温放置5min;
b.短时离心,将离心管置于磁力架上,静置3min直至溶液变澄清;
c.小心吸取离心管中的上清并丢弃,枪头避免碰触磁珠;
d.保持离心管在磁力架上,加入200μl80%乙醇;
e.静置30s待磁珠沉降后,吸除乙醇;
f.重复步骤d-e一次;
g.室温晾干,直至离心管中残留的乙醇完全挥发;
注意:磁珠不要过于干裂,否则易造成回收效率降低;
h.加入22μlnuclease-freewater,votex混匀5s,室温放置5min;
i.短时离心,将管子放在磁力架上,静置约2min至溶液变澄清;
j.吸取20μl上清到一个新的pcr管中。
(4)pcr扩增和纯化
在上一步的pcr管中,按下表配制pcr反应液:
表6:
配好后votex10s,瞬时离心3s,放入pcr仪,按照下表中的程序进行扩增:
表7:
pcr反应结束后,按下述方案对pcr产物进行纯化:
a.将pcr产物转移到1.5ml的离心管中,加入1.2倍体积(60μl)的室温平衡30min的ampurexp磁珠,vortex5s,室温放置5min;
b.短时离心,将离心管置于磁力架上,静置3min直至溶液变澄清;
c.小心吸取离心管中的上清并丢弃,枪头避免碰触磁珠;
d.保持离心管在磁力架上,加入200μl80%乙醇;
e.静置30s待磁珠沉降后,吸除乙醇;
f.重复步骤d-e一次;
g.室温晾干,直至离心管中残留的乙醇完全挥发;
注意:磁珠不要过于干裂,否则易造成回收效率降低;
h.加入22μlnuclease-freewater,votex混匀5s,室温放置5min;
i.短时离心,将管子放在磁力架上,静置约2min至溶液变澄清;
j.吸取20μl上清到一个新的离心管中,标记好名称。
3.文库杂交采用idt公司的杂交捕获试剂,所用dna探针覆盖用于胎儿浓度定量的150个snp位点和待测基因位点,具体杂交捕获流程如下:
3.1实验流程:将制备好的文库与cot-1dna、封闭试剂和idt
杂交反应要求1000ng-1500ngdna起始量,过高或过低的杂交起始量均会显著降低捕获效率。
3.2杂交前文库准备
3.2.1实验前准备
3.2.1.1打开浓缩仪预冷。
3.2.2浓缩
3.2.2.1取1000ng-1500ng中间出库的dna文库到一个新的1.5ml管中,再按照下表加入其它成份:
表8:
3.2.2.2完全的冷冻干燥。用真空浓缩仪在低热条件下(≤45℃)进行抽干。
3.2.2.3浓缩好的文库可置于4℃过夜。
3.3文库杂交
3.3.1实验前准备
3.3.1.1将xgenlockdownreagentsbuffer(2xhybridizationbuffer、hybridizationbufferenhancer、2xbeadwashbuffer、10xwashbufferi,10xwashbufferii,10xwashbufferiii,10xstringentwashbuffer)置于室温融化。
注:如果2xhybridizationbuffer中有结晶析出,置于65℃温浴1-2h后,立即摇匀至溶液澄清。
3.3.1.2准备2台pcr仪(其中1台必须可以调盖温)。
3.3.2对于每一个浓缩后的dna文库,按下表加入其它组分:
表9:
3.3.3轻轻涡旋混匀后室温孵育5min。
3.3.4用移液枪沿着管壁上下吹吸8-10次,然后盖紧管盖,高速涡旋振荡5s,短暂离心将管壁液体收集到管底,将文库混合液转移到一个干净的0.2mlpcr管中。
3.3.5将装好文库的pcr管置于pcr仪上95℃孵育10min(盖温105℃)。
3.3.6从pcr上拿出pcr管,立即加入4ulxgenlockdownprobepool(肺癌panel)。
3.3.7涡旋混匀,短暂离心。
3.3.8盖紧管盖,立即放入pcr仪,按下表程序进行反应。使用75℃热盖,反应体系设置为20ul。
重要:pcr程序必须先暂停,用以放入杂交文库。
表10:
务必保证管盖盖紧,最小化减少杂交混合液体积的蒸发,否则将会影响杂交效果。
3.4文库洗脱
3.4.1准备洗脱buffers
3.4.1.1按下表配置1xworkingsolutions(单个反应量):
表11:
3.4.1.2按下表的体积预热washbufferi和stringentwashbuffer(单个反应量):
表12:
3.4.1.3配好的1xbuffers可室温保存1个月。
3.4.2准备m-270beads
重要:冲洗好的beads需立即使用,避免放置长时间放置。
3.4.2.1m-270streptavidinbeads室温孵育30分钟。
3.4.2.2beads在保存的时候会沉降,votex震荡混匀,让其重新悬浮。
3.4.2.3对每个杂交反应,取100ulm-270streptavidinbeads到1.5ml离心管中。
3.4.2.4将管子放在磁力架上,至溶液变澄清后吸除上清。
3.4.3冲洗bead:
3.4.3.1加入200ul1xbeadwashbuffer,votex震荡10sec。
3.4.3.2将管子放在磁力架上,至溶液变澄清后吸除上清。
3.4.3.3重复步骤3.4.3.1和3.4.3.2两遍,总共冲洗2次。
3.4.3.4用100ul1xbeadwashbuffer重新悬浮bead。
3.4.3.5将100ul重悬的磁珠转移至0.2mlpcr管中。
3.4.3.6将管子放在磁力架上,至溶液变澄清后吸除上清(少量的washbuffer残留不影响文库和beads结合)。
3.4.4捕获
3.4.4.1将杂交混合液直接加到beads管里,轻轻涡旋充分混匀。
3.4.4.2将pcr管置于杂交pcr仪上,65℃孵育45min(盖温75℃)。
3.4.4.3每12min涡旋混匀3s。
3.4.5洗脱
3.4.5.1向杂交管中加入100ul预热的1xwashbufferi,短暂离心。
3.4.5.2将将混合液转移到1.5ml离心管中,短暂离心。
3.4.5.3把管子放在磁力架上,静置至溶液澄清,吸除上清。
3.4.5.4加入200ul预热的1xstringentwashbuffer,轻轻涡旋混匀(注:不要产生气泡)。
3.4.5.5在加热块上65℃温浴5min。
3.4.5.6短暂离心。
3.4.5.7把管子放在磁力架上,静置2min至溶液澄清,吸除上清。
3.4.5.8重复步骤3.4.5.4-3.4.5.7一遍,总共冲洗2次。
3.4.5.9加入200ul室温的1xwashbufferi,涡旋振荡2min。
3.4.5.10短暂离心。
3.4.5.11把管子放在磁力架上,静置2min至溶液澄清,吸除上清。
3.4.5.12加入200ul室温的1xwashbufferii,涡旋振荡1min。
3.4.5.13短暂离心。
3.4.5.14把管子放在磁力架上,静置2min至溶液澄清,吸除上清。
3.4.5.15加入200ul室温的1xwashbufferiii,涡旋振荡30s。
3.4.5.13短暂离心。
3.4.5.14把管子放在磁力架上,静置2min至溶液澄清,吸除上清。
3.4.5.15加入45ulnuclease-freewater,上下吹吸8-10次让bead重新悬浮。
3.5杂交后pcr扩增
3.5.1使用的试剂:
3.5.1.1kapahifihotstartreadymix(kapa)
3.5.2在pcr管(置于冰上)里按下表配方配制pcr反应液(每个样本分2管进行扩增),涡旋混匀。
post-capturepcrreactionmix配方
表13:
3.5.2.1将library-boundbeads加入装有pcr反应液的管中,用移液器上下吹吸每个dna样本,保证bead溶液混合均匀。
3.5.3将pcr管放入pcr仪进行扩增(盖温105℃),参数设置如下表:
表14:
3.6用1.5倍的agencourtampurexp磁珠纯化dna样本
3.6.1让ampurexpbead在室温放置至少30min。
3.6.2充分混匀ampurexpbead悬浮液,直至悬浮液颜色均一。
3.6.3在干净的1.5ml离心管中加入75ul混匀的ampurexpbead悬浮液和扩增后的dna文库(~100ul)。votex混匀,室温放置5min。
3.6.4将管子放在磁力架上,静置大约2min至溶液变澄清。
3.6.5在磁力架上小心地吸除管中的上清,枪头不要碰到磁珠。
3.6.6在磁力架上,在每个管中分加200ul80%乙醇。用新鲜现配的乙醇可以获得更好的效果。
3.6.7静置1min让磁珠沉降后,吸除乙醇。
3.6.8重复步骤3.6.6和3.6.7一次。
5.6.9室温晾干乙醇(磁珠过干会导致洗脱的效率显著下降)。
3.6.10加入21ulnuclease-freewater,votex震荡混匀,室温放置5min。
3.6.11将管子放在磁力架上,静置大约2min至溶液变澄清。
3.6.12吸取20ul上清到一个新的1.5ml离心管中,并在管壁上贴好相应的条形码。如果不进行后续步骤,将文库保存在-20℃冰箱。
3.7文库出库浓度测定和稀释,文库质量检测定量及上机:测定文库浓度后,取部分原液做成终浓度为3ng/ul的稀释液,用agilent2100分析文库插入片段的大小,用qpcr仪器定量文库的摩尔浓度,根据上机数据量的不同,混合不同摩尔量的文库,于illuminanova平台采用双端150bp测序策略测序,得到测序数据。
然后,按照前述方法计算对应的snp位点的变异基因型频率和胎儿浓度,同时对胎儿基因分型。将利用该方法判定的胎儿基因型与有创的羊水穿刺获得的羊水细胞基因组dna一代测序金标准进行比较,结果如下表所示,两种方法检测结果一致。
表15:
表3.胎儿基因型判断实例结果
注:下标1和2代表同一个基因的不同位点
需要说明的是,上述实施例中,所用的测序数据是靶向捕获文库的测序数据。具体的靶向捕获文库中的目标序列可以根据研究目的不同,涵盖不同目标基因的序列,可以是单一基因的,也可以是多个基因的。多个基因的,可以根据针对的对象的不同或研究兴趣的不同,设计成不同的基因panel。构建靶向捕获文库的方法采用现有方法即可,本申请中不做特殊限定。
通过以上的实施方式的描述,本领域的技术人员可以清楚地了解到根据上述实施例的方法可借助软件加必需的通用硬件平台的方式来实现,当然也可以通过硬件,但很多情况下前者是更佳的实施方式。基于这样的理解,本发明的技术方案本质上或者说对现有技术做出贡献的部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质(如rom/ram、磁碟、光盘)中,包括若干指令用以使得一台终端设备(可以是手机,计算机,服务器,或者网络设备等)执行本发明各个实施例所述的方法。
对应于上述方式,本申请还分别提供了一种胎儿浓度定量的装置及一种胎儿基因分型的装置,这些装置用于实现上述实施例及优选实施方式,已经进行过说明的不再赘述。如以下所使用的,术语“模块”可以实现预定功能的软件和/或硬件的组合。尽管以下实施例所描述的装置较佳地以软件来实现,但是硬件,或者软件和硬件的组合的实现也是可能并被构想的。
下面结合可选的实施例进一步说明。
实施例6
在一种优选的实施例中,还提供了一种胎儿浓度定量的装置,该装置包括:第一获取模块、统计归类模块及第一计算模块,第一获取模块,用于获取含有多个snp位点的测序数据;统计归类模块,用于统计测序数据中在各snp位点的变异频率,并将变异频率为1%~25%的snp位点归为第一类频率,将变异频率为75%~99%的snp位点归为第二类频率,第二类频率=1-变异频率;第一计算模块,用于计算第一类频率和第二类频率形成的数据集的中位数或均值,中位数或均值的2倍即为胎儿浓度。
在一种优选的实施例中,该装置还包括挑选模块,用于挑选多个snp位点。
在一种优选的实施例中,挑选模块包括:挑选单元及剔除单元,挑选单元,用于从千人基因组数据库中挑选多个候选snp位点;以及剔除单元,用于从多个候选snp位点中剔除符合以下至少之一情形的snp位点:(1)位于参考基因组重复区域的snp位点;(2)覆盖snp位点120bp区域能比对到参考基因组多个位置的snp位点;更优选地,多个候选snp位点的等位基因频率为0.4~0.6。
在一种优选的实施例中,多个snp位点为表1所示的150个snp位点。
实施例7
本实施例中,提供了一种胎儿基因分型的装置,该装置包括:第二获取模块、比对模块及推断模块,其中,第二获取模块,用于分别获取来源于孕妇的血浆游离dna和白细胞基因组dna的测序数据;比对模块,用于将测序数据与参考基因组比对,获得变异snp位点;推断模块,用于计算各变异snp位点的变异基因型的频率及胎儿浓度,并根据白细胞基因组dna的测序数据确定各变异snp位点上孕妇的基因型,推断得出胎儿的基因型;其中,胎儿浓度按照上述任一种胎儿浓度定量的装置进行定量。
上述装置,通过基于孕妇血浆游离dna中胎儿与母体的差异snp位点,实现对男胎和女胎胎儿浓度的准确定量;同时利用孕妇白细胞样本,可以准确反映孕妇本身的遗传背景,结合孕妇血浆游离dna信息和胎儿浓度,不仅可以检测胎儿在无母亲突变背景下是否遗传来源于父亲的突变以及新发突变,还可以准确检测出胎儿在有母亲突变背景下是否遗传来源于母亲或者父亲的突变。
在一种优选的实施例中,推断模块包括:第一孕妇基因型确定模块,用于根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa,第二计算模块,用于计算变异snp位点在白细胞中的变异基因型频率fre_wbc和在血浆游离dna中的变异基因型频率fre_plasma,δ=frq_plasma-frq_wbc;第一判断模块,用于判断||δ|-ff/2|是否满足第一阈值,优选第一阈值大于0.03,若是,则胎儿基因型为aa;若否,则进一步判断δ是大于0还是小于0,若是大于0,则胎儿基因型为aa,若是小于0,胎儿基因型为aa。
在一种优选的实施例中,推断模块还包括:第二孕妇基因型确定模块,用于根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;第三计算模块,用于计算变异snp位点在血浆游离dna中的变异基因型频率fre_plasma;第二判断模块,用于判断fre_plasma是满足第二阈值还是满足第三阈值,若fre_plasma满足第二阈值,优选第二阈值大于0.005,则胎儿基因型为aa,若fre_plasma满足第三阈值,优选第三阈值小于0.005,则胎儿基因型为aa。
在一种优选的实施例中,推断模块还包括:第三孕妇基因型确定模块,用于根据白细胞基因组dna的测序数据确定变异snp位点上孕妇的基因型为aa;第四计算模块,用于计算变异snp位点在血浆游离dna中的参考基因型频率fre_ref;第三判断模块,用于判断fre_ref是满足第四阈值还是满足第五阈值,若fre_ref满足第四阈值,优选第四阈值大于0.005,则胎儿基因型为aa,若fre_ref满足第五阈值,优选第五阈值小于0.005,则胎儿基因型为aa。
在一种优选的实施例中,还提供了一种存储介质,存储介质上存储有计算机可执行的程序,程序被设置为运行时,执行上述任一种胎儿浓度定量的方法,或上述任一种胎儿基因分型的方法。
在一种优选的实施例中,还提供了一种电子装置,包括存储器和处理器,存储器中存储有计算机程序,计算机程序执行上述任一种胎儿浓度定量的方法,或上述任一种胎儿基因分型的方法。
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:通过基于孕妇血浆游离dna中胎儿与母体的差异snp位点,实现对男胎和女胎胎儿浓度的准确定量;同时利用孕妇白细胞样本,可以准确反映孕妇本身的遗传背景,结合孕妇血浆游离dna信息和胎儿浓度,不仅可以检测胎儿在无母亲突变背景下是否遗传来源于父亲的突变以及新发突变,还可以准确检测出胎儿在有母亲突变背景下是否遗传来源于母亲或者父亲的突变;本发明采用高通量测序的方法,可一次对多个样本进行检测;该方法易于扩展,可同时对基因组中多个区域的位点进行检测。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测白血病相关融合基因的引物和探针、及其试剂盒的制作方法
- Rala基因的小干扰rna在制备抗白血病药物中的应用的制作方法
- 定量检测白血病融合基因tel-aml1荧光rt-pcr试剂盒的制作方法
- 用于检测慢性粒细胞白血病bcr/abl融合基因的电化学dna生物传感器的制作方法
- 检测白血病广谱标记物WT1基因mRNA表达的试剂盒的制作方法
- 一种用于检测白血病易感的基因组合、引物、探针和用途的制作方法
- 白血病融合基因的联合并行检测方法及诊断试剂盒的制作方法
- 一种L型PML/RARα融合基因检测试剂盒及相应的检测方法
- 包含最优化的猫白血病病毒包膜基因的重组猫白血病病毒疫苗的制作方法
- 一种检测白血病融合基因的多重pcr试剂盒的制作方法