一种用于病毒基因分型检测的探针组合、试剂盒以及方法与流程
本发明涉及基因检测技术领域,具体而言,涉及一种用于病毒基因分型检测的探针组合、试剂盒以及方法。
背景技术:
宫颈癌是女性生殖道最常见的恶性肿瘤之一,已有研究表明,高危型人乳头瘤病毒(Human Papillomavirus,HPV)持续感染及多重感染是导致宫颈癌变的重要原因之一,全球范围的研究结果显示,在99.7%的宫颈癌患者体内检测到高危型HPV DNA的存在。目前已经发现的HPV有200多种型别,主要包括低危型和高危型两大类。不同型别与不同疾病的相关性也不一样,低危型HPV感染可能会引起生殖道湿疣病变,高危型HPV感染则与宫颈癌、阴道癌相关。目前还缺乏针对HPV公认的有效治疗手段,因此宫颈HPV早发现、早预防是阻断癌变的关键。
多年来,国际上通用的宫颈上皮内瘤变及宫颈癌的诊断主要遵循“三阶梯式”诊断程序,即宫颈细胞学、阴道镜及组织病理学检查。由于HPV不能体外培养,HPV检测方法主要基于HPV DNA的分子分型。HPV核酸检测技术主要包括杂交捕获法,PCR-荧光探针法、转录介导的核酸扩增技术以及PCR-杂交法等。
宫颈癌的早期筛查方式是采用巴氏涂片以及改进后的TCT技术,这些方法只能从细胞学病变的角度来评估宫颈癌的发病情况,也就是说需要等到遭受病毒感染的细胞开始出现明显变化时才可以检测出来,特异性和灵敏度均不够理想。随着对HPV感染导致宫颈癌的认识加深以及分子诊断技术的发展,HPV基因检测作为宫颈癌的一种筛查手段得到了更广泛的应用。目前HPV分型检测技术主要基于聚合酶链反应,如荧光定量、反向斑点杂交和基因芯片技术等,这些技术表现出高灵敏度、高特异性,可以进行多重感染检测等优点,但这些技术对实验条件和检验人员素质要求高,检测费用也较高,不太适用于大量的临床检测和大规模的流行病学筛查。第二代基因杂交捕获技术检测采用美国Digene公司的HC2技术试剂盒,HC2是一种应用微孔板化学发光进行信号放大的核酸杂交检测方法,被公认为评价HPV检测新技术的金标准。然而,HC2检测方法价格昂贵,且其方法操作繁琐,操作过程中容易交叉污染而出现假阳性。
技术实现要素:
本发明的第一目的在于提供一种用于病毒基因分型检测的探针组合,该探针组合能够对待测样本中的病毒进行基因型检测,具有较强的特异性、较高的灵敏度以及较低的假阳性率,且检出结果准确可靠。
本发明的第二目的在于提供一种用于病毒基因分型检测的试剂盒,该试剂盒能够对待测样本中的病毒进行基因型检测,其具有较强的特异性和较高的灵敏度,且检出结果准确可靠、假阳性率低、操作简单方便。
本发明的第三目的在于提供一种病毒基因分型检测的方法,该方法能够对待测样本中的病毒进行基因型检测,具有较强的特异性和较高的灵敏度,且检出结果准确可靠,检测方法简单易操作。
本发明解决其技术问题是采用以下技术方案来实现的。
一种用于病毒基因分型检测的探针组合,其包括至少一个探针对,每个探针对包括用于结合目标序列的捕获探针(Capture Probe,CP)和与捕获探针相对应的且可结合目标序列的检测探针(Detector Probe,DP),每个探针对的检测探针的3’端或5’端标记有用于结合催化酶的亲和物,催化酶用于催化底物产生化学反应形成电子流。
一种用于病毒基因分型检测的试剂盒,其包括上述的用于病毒基因分型检测的探针组合。
一种用于病毒基因分型检测的方法,其包括如下步骤:
先将用于结合目标序列的捕获探针通过电场作用固定至检测孔板的反应孔内;
将待测样本加入至反应孔内;
加入与捕获探针对应的且可结合目标序列的检测探针至反应孔内,检测探针的3’端或5’端标记有可用于结合用于催化相应底物产生化学反应形成电子流的催化酶的亲和物;
加入催化酶和底物,通过电流检测装置检测反应孔内的电流。
本发明提供的用于病毒基因分型检测的探针、试剂盒以及方法的有益效果是:本发明提供的用于病毒基因分型检测的探针组合包括至少一个探针对,每个探针对包括有用于结合目标序列的捕获探针和与捕获探针相对应的且可结合目标序列的检测探针,捕获探针通过碱基互补原则与目标序列结合,将目标序列捕获固定,进行第一次特异性结合固定;检测探针通过碱基互补原则与目标序列第二特异性结合,检测探针被结合固定;检测探针的3’端或5’端的通过标记的亲和物将催化酶结合,催化酶催化底物释放电流信号,检测释放的电流信号,进而检测出病毒基因型。由于,目标序列只有与捕获探针和检测探针同时准确配对后即经过两次特异性结合,才能有信号的产生,这大大地提高了检测的特异性,使得检出结果准确可靠,假阳性率非常低。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1的检测结果;
图2为本发明实施例2的检测结果;
图3为本发明实施例3的检测结果;
图4为本发明实施例4的检测结果;
图5为本发明实施例5的检测结果。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的用于病毒基因分型检测的探针、试剂盒以及方法进行具体说明。
本发明提供的用于病毒基因分型检测的探针组合,其包括至少一个探针对。每个探针对包括用于结合目标序列的捕获探针和与捕获探针相对应的且可结合目标序列的检测探针。每个探针对的检测探针的3’端或5’端标记有用于结合催化酶的亲和物,该催化酶用于催化其底物产生化学反应形成电子流。
其中,检测探针与捕获探针相对应是指,一个捕获探针和一个检测探针组成一个探针对,即可用于检测某类型的病毒。捕获探针和检测探针均根据同一类型的病毒的同一个保守基因或保守DNA片段即目标序列进行设计的,捕获探针和检测探针能够与该病毒类型的同一个保守基因或保守DNA片段的不同区域或结合位点通过碱基互补原则结合,但捕获探针与检测探针并不互补,碱基序列也不相同,二者与目标序列的结合位点不重合、也不重叠。另外,捕获探针和检测探针与目标序列的结合区域可以是相邻,也可以是间隔多个碱基。只要捕获探针和检测探针能够与同一类型的病毒的同一个保守基因或同一段保守DNA片段通过碱基互补原则结合即可。
具体地,本发明针对各HPV亚型,根根其DNA保守区域设计出了用于检测HPV基因型的探针组合,探针组合包括多个探针对,该多个探针对分别是:第1探针对、第2探针对、选自第3~11探针对中的至少一种、以及选自第12~16探针对中的至少一种。以下对各探针对检测的HPV亚型及其捕获探针和碱基探针的序列进行详细说明。
具体地,用于检测HPV16亚型的第1探针对,其捕获探针的碱基序列如SEQ ID NO.1所示,其检测探针的碱基序列如SEQ ID NO.2所示。
用于检测HPV18亚型的第2探针对,其捕获探针的碱基序列如SEQ ID NO.3所示,其检测探针的碱基序列如SEQ ID NO.4所示。
用于检测HPV31亚型的第3探针对,其捕获探针的碱基序列如SEQ ID NO.5所示,其检测探针的碱基序列如SEQ ID NO.14所示。
用于检测HPV33亚型或52亚型或58亚型的第4探针对,其捕获探针的碱基序列如SEQ ID NO.6所示,其检测探针的碱基序列如SEQ ID NO.15所示,该三种亚型共用第4探针对。
用于检测HPV35亚型的第5探针对,其捕获探针的碱基序列如SEQ ID NO.7所示,其检测探针的碱基序列如SEQ ID NO.14所示。
用于检测HPV39亚型的第6探针对,其捕获探针的碱基序列如SEQ ID NO.8所示,其检测探针的碱基序列如SEQ ID NO.16所示。
用于检测HPV45亚型的第7探针对,其捕获探针的碱基序列如SEQ ID NO.9所示,其检测探针的碱基序列如SEQ ID NO.17所示。
用于检测HPV51亚型的第8探针对,其捕获探针的碱基序列如SEQ ID NO.10所示,其检测探针的碱基序列如SEQ ID NO.18所示。
用于检测HPV 56亚型的第9探针对,其捕获探针的碱基序列如SEQ ID NO.11所示,其检测探针的碱基序列如SEQ ID NO.18所示。
用于检测HPV59亚型的第10探针对,其捕获探针的碱基序列如SEQ ID NO.12所示,其检测探针的碱基序列如SEQ ID NO.19所示。
用于检测HPV68亚型的第11探针对,其捕获探针的碱基序列如SEQ ID NO.13所示,其检测探针的碱基序列如SEQ ID NO.16所示。
用于检测HPV26亚型的第12探针对,其捕获探针的碱基序列如SEQ ID NO.20所示,其检测探针的碱基序列如SEQ ID NO.26所示。
用于检测HPV53亚型的第13探针对,其捕获探针的碱基序列如SEQ ID NO.21所示,其检测探针的碱基序列如SEQ ID NO.25所示。
用于检测HPV66亚型的第14探针对,其捕获探针的碱基序列如SEQ ID NO.22所示,其检测探针的碱基序列如SEQ ID NO.25所示。
用于检测HPV73亚型的第15探针对,其捕获探针的碱基序列如SEQ ID NO.23所示,其检测探针的碱基序列如SEQ ID NO.27所示。
用于检测HPV82亚型的第16探针对,其捕获探针的碱基序列如SEQ ID NO.24所示,其检测探针的碱基序列如SEQ ID NO.28所示。
需要说明的是,上述各探针对的捕获探针序列和检测探针序列的碱基序列可以是不相互对应的,也就是说,在其他的实施例中,各探针对的捕获探针序列可以是上述所述的碱基序列,而其相应的检测探针的碱基序列可以是取自同一检测亚型病毒的同一DNA保守区域其他的序列的互补;或者在其他的实施例中,各探针对的检测探针序列可以是上述所述的碱基序列,而其相应的捕获探针的碱基序列可以是其他的序列选择自同一检测亚型病毒的同一DNA保守区域其他的序列的互补序列。但本发明给出的各探针对的捕获探针和检测探针的碱基序列,在其进行检测时,其具有更强的特异性、更高的灵敏度等优点,具有检测结果可见实施例。
其中,根据各亚型病毒在宫颈癌患者出现的概率大小,一般情况下将上述各亚型病毒作如下分类。HPV16、18亚型是临床最常见的,也是该两类型病毒在宫颈癌患者出现的概率最大;HPV31、33、52、58、35、39、45、51、56、59、68亚型是高等风险型型别的(可统称为高危型组),HPV26、53、66、73、82亚型是中等风险型别的(可统称为中高危型组)。在对这些亚型病毒检测中,可以进行分组检测例如仅检测出样本含有某个危险级别(例如高危型组或中高危型组)的病毒,而不必检测出其含有那个组别中的具体某类型病毒。当然,也可以进行具体亚型的检测,例如检测出样本中具体含有高危型组中的某类亚型例如HPV53亚型病毒。具体采用何种检测方法检测至何种程度,得到何种程度的检测结果,检测人员可以根据具体情况来选择,以提供较合理的指导意义,具体分组检测的情况见实施例。
本发明提供的用于病毒基因分析检测的探针组合包括第1探针对,第2探针对,选自第3~11探针对中的至少一种,选自第12~16探针对中的至少一种。这样,本发明的探针组合可对HPV常见亚型的HPV16和18亚型,高危型的HPV31、33、52、58、35、39、45、51、56、59、68亚型中的至少一种,以及中高危型的HPV26、53、66、73、82亚型中的至少一种,共至少4种HPV亚型进行检测。
当然,在其他的实施例中,用于病毒基因分析检测的探针组合可以仅包括第1探针对~第16探针对中的一种或二种或三种。
另外,较佳地,上述每个检测探针的3’端或5’端标记的亲和物是生物素,生物素的作用在于与链霉亲和素标记的催化酶结合,通过催化酶催化底物产生的电流释放检测信号。当然,在其他的实施例中,检测探针可以不通过生物素-链霉亲和素的识别系统结合催化酶,可以通过其他的例如抗体/抗原、配体/受体等结合系统来结合催化酶,因此,亲和物可以抗原/抗体中的一种。例如亲和物可以是地高辛或者异硫氰酸荧光素,对应地,催化酶上标记有高辛抗体或异硫氰酸荧光素抗体即可。且亲和物可以标记在检测探针的3’端记,也可以标记在其5’端,二者均可以。
还有需要说明的是,在其他的实施例中,可根据其他病毒例如艾滋病毒(Human Immunodeficiency Virus,HIV)、乙肝病毒(Hepatitis Bvirus,HBV)等病毒基因组序列的保守区域设计出相应的捕获探针和检测探针,用于检测其具体的病毒亚型,其也属于本发明的保护范围。
本发明提供的用于病毒基因分型检测的试剂盒,其包括上述所述的任意一项探针组合。优选地,各探针以溶液的形式独立存在,例如捕获探针以含有捕获探针的捕获探针溶液的形式存在,检测探针以含有检测探针的检测探针溶液的形式存在。各探针溶液含有的探针浓度为可以根据实际情况设置。优选地,各探针溶液含有的探针终浓度为0.5~1.5μM。
另外,本发明提供的用于病毒基因分型检测的试剂盒还可包括将探针对的捕获探针固定至检测孔板的固定物。固定物包括导电聚合物和离子化合物。导电聚合物选自吡咯、苯胺和噻吩中的一种,当然,导电聚合物也可以是其他的导电聚合物材料。离子化合物选自氯化钠和氯化钾中的任一种。导电聚合物带正电,其在电场的作用下形成网状交联结构,被沉积在反应孔的底部,网状交联结构能够稳定地将捕获探针固定在底部,有助于提高捕获探针的稳定性和捕获能力。
另外,本发明提供的用于病毒基因分型检测的试剂盒还可包括检测孔板,检测孔板的反应孔内固定有探针对的捕获探针。检测孔板的具体结构可参考如申请号为201620769829.2公开的名称为检测电极以及检测孔板中的检测孔板所示。
另外,本发明提供的用于病毒基因分型检测的试剂盒还可包括催化酶,催化酶是带有标记物的辣根过氧化物酶,优选地,催化酶是带有链霉亲和素标记的辣根过氧化物酶。当然,催化酶也可以是带有标记物的碱性磷酸酶,标记物为地高辛抗体、异硫氰酸荧光素抗体或链霉亲和素中的任一种,标记物与亲和物相对应,其可根据检测探针上的亲和物的类别进行选择。当亲和物是生物素时,标记物为链霉亲和素;当亲和物是地高辛时,标记物为地高辛抗体;当亲和物是异硫氰酸荧光素时,标记物为异硫氰酸荧光素抗体。只要亲和物与标记物相对应,可相互结合即可。
另外,本发明提供的用于病毒基因分型检测的试剂盒还可包括底物,底物的类别根据催化酶的类别选择。
当催化酶为辣根过氧化物酶时,底物是TMB(Tetramethylbenzidine、四甲基联苯胺)、ABTS(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)和OPD(o-Phenylenediamine、邻苯二胺)中的任一种。TMB、ABTS和OPD均是辣根过氧化物酶的底物,在辣根过氧化物酶的催化作用下发生显色反应并伴随电流产生,有助于提高检测信号的释放。
当催化酶为碱性磷酸酶时,底物是对BCIP(5-Bromo-4-Chloro-3-Indolyl Phosphate、5-溴-4-氯-3-吲哚基-磷酸盐)和NBT(Nitrotetrazolium Blue chloride、四唑硝基蓝)的组合物、硝基苯磷酸盐、4-硝基苯磷酸二钠、萘酚AS-BI磷酸盐、萘酚-AS-MX-磷酸盐中的任一种。
另外,本发明提供的用于病毒基因分型检测的试剂盒还可包括清洗液,清洗液包括洗液A和洗液B,洗液A是含SDS的SSC缓冲液,洗液B是含Tween20的PBS缓冲液。
另外,本发明提供的用于病毒基因分型检测的试剂盒还可包括稀释液,稀释液是含酪蛋白的PBS缓冲液。
本发明提供的用于病毒基因分型检测的方法,其包括:
捕获探针固定步骤:先将用于结合目标序列的捕获探针通过电场作用固定至检测孔板的反应孔内。捕获探针在电场作用下,往反应孔底部移动沉积,并被固定在反应孔底部。
样本杂交步骤:将待测样本加入至反应孔内。待测样本中的目标序列与捕获探针通过碱基互补原则被捕获固定在反应孔底部;
检测探针结合步骤:加入与捕获探针对应的且可结合目标序列的检测探针至反应孔内,检测探针的3’端或5’端标记有可用于结合用于催化相应底物产生化学反应形成电子流的催化酶的亲和物。检测探针通过碱基互补原则与目标序列结合固定在反应孔内。
酶催化反应检测步骤:加入催化酶和底物至反应孔内,通过电流检测装置检测反应孔内的电流。检测探针通过亲和物与催化酶结合,催化酶再催化底物产生电流释放检测信号,该信号被电流检测装置识别放大,进而检出结果。
需要说明的是,上述方法中所采用的检测孔板和电流检测装置均可通过市面上购买得到。
本发明的检测原理是利用电场诱导释放和测量(Electric Field–Induced Release and Measurement,EFIRM)技术快速检测病毒基因型,尤其是对18种高危型HPV进行检测。EFIRM的基本原理是:
在电场作用下捕获探针被固定在检测孔板上的反应孔的孔底;CP在电场作用下通过碱基互补配对原则捕获待测样本中的目标序列即病毒DNA;带有生物素标记的检测探针再与目标序列结合;催化酶通过其标记的链霉亲合素与生物素识别,结合;往反应孔加入催化酶的底物,产生氧化还原反应,有电流产生,仪器检测电流信号,进而判断出待测样本中有相应的目标序列,由于捕获探针和检测探针均是根据特定病毒类型的保守区域进行设计的,进而可知该病毒的类型。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例以检测HPV基因型为例,对本实施例提供的用于病毒基因分型检测的试剂盒进行说明。本实施例对取自两个不同的宫颈癌患者的宫颈口处的细胞(即待测样本)检测其HPV亚型,取自两个不同患者的待测样本分别命名为样本1和样本2,并对样本1和样本2同时检测,取好的样本1和样本2于-20℃存储。
本实施例提供的病毒基因分型检测的试剂盒包括探针组合,该探针组合包括16个用于对HPV亚型检测的探针对,各探针对的捕获探针和检测探针以溶液形式独立存在,探针的终浓度均为1μM。该16个探针对分别是:用于检测HPV 16亚型的第1探针对,其捕获探针的碱基序列如SEQ ID NO.1所示,其检测探针的碱基序列如SEQ ID NO.2所示;用于检测HPV 18亚型的第2探针对,其捕获探针的碱基序列如SEQ ID NO.3所示,其检测探针的碱基序列如SEQ ID NO.4所示;用于检测HPV 31亚型的第3探针对,其捕获探针的碱基序列如SEQ ID NO.5所示,其检测探针的碱基序列如SEQ ID NO.14所示;用于检测HPV 33亚型或52亚型或58亚型的第4探针对,其捕获探针的碱基序列如SEQ ID NO.6所示,其检测探针的碱基序列如SEQ ID NO.15所示;用于检测HPV 35亚型的第5探针对,其捕获探针的碱基序列如SEQ ID NO.7所示,其检测探针的碱基序列如SEQ ID NO.14所示;用于检测HPV 39亚型的第6探针对,其捕获探针的碱基序列如SEQ ID NO.8所示,其检测探针的碱基序列如SEQ ID NO.16所示;用于检测HPV 45亚型的第7探针对,其捕获探针的碱基序列如SEQ ID NO.9所示,其检测探针的碱基序列如SEQ ID NO.17所示;用于检测HPV 51亚型的第8探针对,其捕获探针的碱基序列如SEQ ID NO.10所示,其检测探针的碱基序列如SEQ ID NO.18所示;用于检测HPV 56亚型的第9探针对,其捕获探针的碱基序列如SEQ ID NO.11所示,其检测探针的碱基序列如SEQ ID NO.18所示;用于检测HPV 59亚型的第10探针对,其捕获探针的碱基序列如SEQ ID NO.12所示,其检测探针的碱基序列如SEQ ID NO.19所示;用于检测HPV 68亚型的第11探针对,其捕获探针的碱基序列如SEQ ID NO.13所示,其检测探针的碱基序列如SEQ ID NO.16所示;用于检测HPV 26亚型的第12探针对,其捕获探针的碱基序列如SEQ ID NO.20所示,其检测探针的碱基序列如SEQ ID NO.26所示;用于检测HPV 53亚型的第13探针对,其捕获探针的碱基序列如SEQ ID NO.21所示,其检测探针的碱基序列如SEQ ID NO.25所示;用于检测HPV 66亚型的第14探针对,其捕获探针的碱基序列如SEQ ID NO.22所示,其检测探针的碱基序列如SEQ ID NO.25所示;用于检测HPV 73亚型的第15探针对,其捕获探针的碱基序列如SEQ ID NO.23所示,其检测探针的碱基序列如SEQ ID NO.27所示;用于检测HPV 82亚型的第16探针对,其捕获探针的碱基序列如SEQ ID NO.24所示,其检测探针的碱基序列如SEQ ID NO.28所示。各HPV亚型类别及其检测对应的捕获探针和检测探针的碱基序列见表1。
表1.检测HPV亚型的捕获探针和检测探针的碱基序列
其中,检测33、52和58亚型的捕获探针碱基序列相同,检测33、52和58亚型的检测探针碱基序列相同,也就是说用SEQ ID NO.6所示的捕获探针和SEQ ID NO.15所示的检测探针能够检测出HPV33、52和58亚型病毒,检出结果说明的是样品具有HPV33、52和58亚型中的至少一种,但具体是该三种亚型病毒中的哪一种亚型病毒并不能检测出。39和68亚型的检测探针序列相同,51和56亚型的检测探针序列相同,53和66亚型的检测探针序列相同。此外,用于检测16和18亚型的检测探针的5’端标记生物素,其余亚型的检测探针的3’端标记生物素(如表1所示)。
采用本实施例提供的病毒基因分型检测试剂盒对样本1和样本2的具体检测步骤如下。
1捕获探针固定
1.1配制吡咯(pyrrole)与CP的混合液
取1个1.5mL离心管,依次加入超纯水885μl,离子化合物100μl 3M KCl,涡旋震荡混匀,离心;加入导电聚合物5μl pyrrole(≥98.0%,购自Sigma,货号W338605),涡旋震荡混匀,离心;加入10μl CP(100μM)(在分组检测的情况下,将每种CP各加入10μl至检测孔中);涡旋震荡混匀后离心,备用。
1.2固定捕获探针
在96孔的检测孔板(E-plate)(其结构和工作原理可见参考文献201620769829.2)上,按其操作说明书,往反应孔加入30μl的已配制好的pyrrole与CP的混合液,加样时枪头贴近孔的底部,但是不接触到底部电极,加完后倾斜或拍打E-plate使液体在孔里的电极表面均匀覆盖,然后立刻到EFIRM仪器上(其工作原理和结构可参考申请日为2016年8月11日、申请号为201610658321.X、名称为保持结构及包括保持结构的检测仪的专利文献),按其操作说明书,进行电场操作。
1.3EFIRM电场处理
在EFIRM软件上选择进行实验的对应列,电场参数设置为:电压A:350mV,1s;电压B:950mV,1s;进行9个循环。电场处理完毕,立刻取出,清洗E-plate板。
1.4E-plate板清洗:
在洗板机程序上选择对应的实验列,清洗程序选择(2bottom,2top),清洗液选择洗液A。清洗完毕,立刻进行下一步,样本上样操作。其中,洗液A为含0.05%(质量百分比)SDS的2×SSC缓冲液。
2样本杂交
2.1杂交buffer预处理
杂交buffer(购自thermo fisher)在水浴锅中90℃水浴处理10min,然后室温放置冷却20min。
2.2配制待测样本
待测样本从-20℃冰箱取出,放进4℃冰箱解冻。完全溶解后,使用煮沸法或0.4M NaOH预处理待测样本,然后将待测样本与杂交buffer按体积比1:2混合,涡旋振荡后离心,即可上样进行检测。
2.3加待测样本
在E-plate上,在对应的孔里加入上述待测样本与杂交buffer混合后的混合液30μl。(需要注意的是:加样时枪头贴近孔的底部,但是不接触到底部电极,加完后倾斜或拍打E-plate使液体在孔里的电极表面均匀覆盖,然后立刻到EFIRM上进行电场操作。)
在本实施例中,设置4个检测组,分别是16亚型组、18亚型组、11种高危型组以及5种中高危型组。每个检测组设置一个阳性对照孔,一个阴性对照孔(重复4次),一个样本1的检测孔以及一个样本2的检测孔。其中,16亚型组用于检测HPV16亚型(该组每个孔中对应加入第1探针对),18亚型组用于检测HPV18亚型(该组每个孔对应加入第2探针对),11种高危型组用于检测11种高危型HPV中的一种(该组每个孔对应加入第3~11探针对,5种中高危型用于检测5种中高危型HPV中的一种(该组每个孔对应加入第12~16探针对)。需要说明的是,检测组的数量可根据需要的检测结果准确程度进行设计。如果仅需检测出待测样本是否含有常见型HPV、高危型病毒以及中高危型病毒,则可按本实施例的检测组的设置方法进行设置。如果仅需检测出样本是否含有HPV,则可仅设置一个检测组,具体检测方法参考实施例2。如果需要检测出样本具体含有某类型的病毒,则可设置18个检测组,具体检测方法参考实施例3。
其中,阳性对照孔中加入对应的30μl含终浓度为1pM的阳性寡核苷酸(其能够与对应的捕获探针和检测探针互补配对结合)的杂交buffer作为阳性对照(需要说明的是,11种高危型组的阳性对照仅选择52亚型核苷酸序列(表2中的第9行),5种中高危型组的阳性对照仅选择26亚型核苷酸序列(表2中的第13行),即可起到阳性对照的作用),各HPV亚型对应的阳性寡核苷酸的碱基序列见表2,阴性对照孔中加入30μl杂交buffer作为阴性对照。
表2.用于检测HPV基因型的阳性对照的阳性寡核苷酸的碱基序列
2.4EFIRM电场处理
在EFIRM软件上选择进行实验的对应列,电场参数设置为:电压A:300mV,1s;电压B:500mV,1s;进行150个循环。电场处理完毕,立刻取出,清洗E-plate板。
2.5室温孵育
盖上E-plate盖子,实验台上室温孵育30min。
2.6E-plate板清洗
在洗板机程序上选择对应的实验列,清洗程序选择(2bottom,2top),清洗液选择洗液A。清洗完毕,立刻进行DP加样操作。
3DP结合
3.1DP溶液配制
从4℃冰箱取出稀释液,取1个1.5mL离心管,加入990μl的稀释液,往各检测组的反应孔中加入对应的10μl DP(100μM),涡旋震荡混匀,离心,备用。其中,稀释液为含0.1%(质量体积比)酪蛋白的PBS缓冲液(pH7.4)。酪蛋白的作用是封闭非特异性位点,以提高检测的灵敏性和准确度。
3.2加样
根据实验设计在对应的孔加入对应DP溶液30μl,加样时枪头贴近孔的底部,但是不接触到底部电极,加完后倾斜或拍打E-plate使液体在孔里的电极表面均匀覆盖,然后立刻到EFIRM上进行电场操作。
3.3室温孵育
盖上E-plate盖子,实验台上室温孵育30min。
3.4E-plate板清洗
在洗板机程序上选择对应的实验列,清洗程序选择(2bottom,2top),清洗液选择洗液A。清洗完毕,立刻进行加样操作。
4链霉亲和素标记的辣根过氧化物酶(Poly-HRP)与生物素结合
4.1Poly-HRP溶液配制
从4℃冰箱取出稀释液,取1个1.5mL离心管,加入999μl的稀释液,加入1μl的酶液(含Poly-HRP,浓度为0.5mg/ml,购自thermo fisher,产品名称为PierceTMStreptavidin Poly-HRP,货号为21140,单位规格为0.5mL),涡旋震荡混匀,离心,备用。
4.2加酶液
在对应的各孔加入上述稀释液和酶液混合后的混合液30μl,Poly-HRP通过其标记的链霉亲和素与检测探针上的生物素识别并结合。
4.3室温孵育
盖上E-plate盖子,实验台上室温孵育30min。
4.4E-plate板清洗
在洗板机程序上选择对应的实验列,清洗程序选择(3bottom,3top),清洗液选择洗液B。清洗完毕,立刻进行TMB加样操作。其中,洗液B为含0.1%(质量百分比)Tween20的PBS缓冲液。
5数据读取
5.1加底物
在对应的各孔加入底物60μl,加样时枪头贴近孔的底部,但是不接触到底部电极。加完立刻到EFIRM上进行电场操作。其中,底物为含TMB的溶液(购自thermo fisher,产品货号为34028,名称为1-StepTM Ultra TMB-ELISA)。加入酶的底物,发生氧化还原反应,产生电流,检测各孔内电流值即完成整个检测过程。以阴性对照孔重复4次的电流平均值+3倍标准差的和作为阳性判定值,阳性判定值=AVG+3×SD,其中AVG为阴性对照孔重复4次的电流平均值,SD为阴性对照孔重复4次的标准差。若加入有待测样本的检测孔的电流值大于或等于该阳性判定值,则判定位阳性结果,说明待测样本中含有相应的HPV亚型病毒。
5.2 EFIRM电场读数
在EFIRM软件上选择进行实验的对应列,电场参数设置为:电压A:-200mV,60s;电压B:0mV,0s;进行1个循环。电场处理完毕,立刻取出,清洗E-plate板。
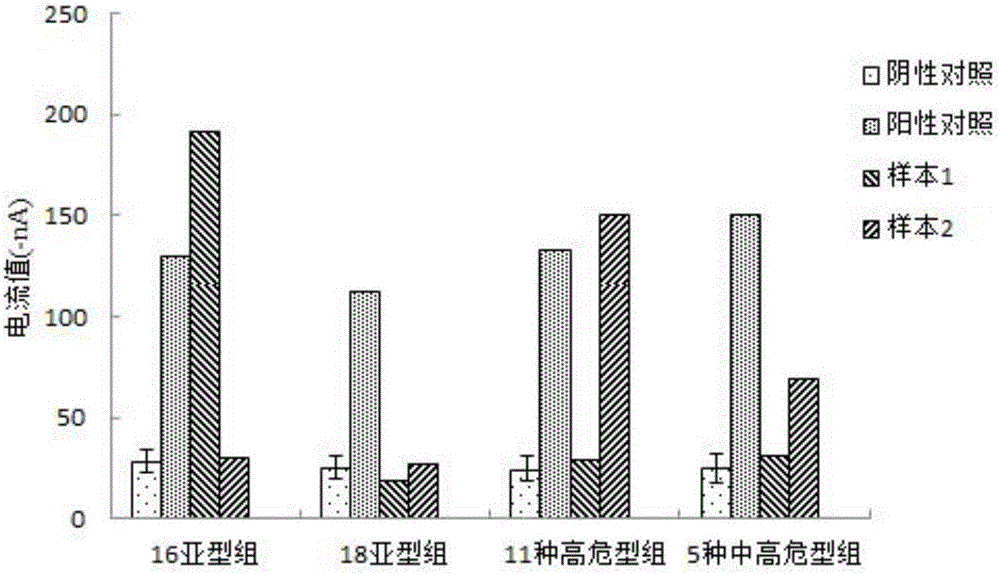
仪器将自动完成检测工作,检测数据自动上传到云计算平台。根据检测数据绘制柱状图,横坐标为检测组的类别,纵坐标为各检测组中各检测孔的电流值(Current),单位为纳安(-nA、负号表示方向)。本实施例的检测结果如图1所示。
由图1可知,在16亚型组中,样本1的检测结果呈阳性,其含有HPV16亚型病毒(阴性对照电流值为28.67nA、其标准差为5.62,阳性对照电流值为130.22nA,样本1的电流值为192.05nA,样本2的电流值为30.53nA);在11种高危型组中,样本2的检测结果呈阳性(阴性对照电流值为24.94nA、其标准差为5.91,阳性对照电流值为132.94nA,样本1的电流值为29.57nA,样本2的电流值为151.30nA),说明其含有高危型HPV31、33、52、58、35、39、45、51、56、59、68亚型中的至少一种。
实施例2
本实施例提供的用于病毒基因分型检测的试剂盒包括同探针组合(同实施例1)、固定物、链霉亲和素标记的辣根过氧化物酶(以溶液形式存在)及其底物,固定物是导电聚合物和离子化合物,其中,导电聚合物是吡咯,离子化合物是氯化钾。底物是含TMB的溶液。其余同实施例1。
在本实施例中,检测组设置为1个,命名为18种亚型同时检测组,检测组包括一个阳性对照孔,一个阴性对照孔(重复4次),一个样本1的检测孔以及一个样本2的检测孔。每个孔中都加入实施例1所述的16种探针对,18种HPV亚型同时检测)。其余同实施例1。如果有阳性检出结果,则检出的结果能说明待测样本含有HPV16、18、31、33、52、58、35、39、45、51、56、59、68、26、53、66、73、82亚型中的至少一种(如图2所示)。本实施例的检测结果如图2所示。
由图2说明,样本1的检测结果呈阳性(阴性对照电流值为26.59nA、其标准差为7.91,阳性对照电流值为110.46nA,样本1的电流值为189.66nA),说明其含有HPV16、18、31、33、52、58、35、39、45、51、56、59、68、26、53、66、73、82亚型中的至少一种;样本2的检测结果呈阳性(阴性对照电流值为26.59nA、其标准差为7.91,阳性对照电流值为110.46nA,样本2的电流值为80.60nA),说明样本2含有HPV16、18、31、33、52、58、35、39、45、51、56、59、68、26、53、66、73、82亚型中的至少一种。
实施例3
本实施例提供的用于病毒基因分型检测的试剂盒包括同探针组合(同实施例1)、固定物、链霉亲和素标记的辣根过氧化物酶(以溶液形式存在)及其底物、清洗液。
固定物是导电聚合物和离子化合物,其中,导电聚合物是吡咯,离子化合物是氯化钾。底物是含TMB的溶液。清洗液包括包括洗液A和洗液B,洗液A是含SDS的SSC缓冲液,洗液B是含Tween20的PBS缓冲液。其余同实施例1。
在本实施例中,检测组设置为16个组,分别是16亚型组、18亚型组、26亚型组、31亚型组、35亚型组、39亚型组、45亚型组、51亚型组、52亚型组、53亚型组、56亚型组、59亚型组、66亚型组、68亚型组、73亚型组以及82亚型组。每个检测组设置一个阳性对照孔(每个检测组分别加入表2中所示的对应的阳性寡核苷酸),一个阴性对照孔(重复4次),一个样本1的检测孔以及一个样本2的检测孔,每个检测孔内加入其相应的探针对。其余同实施例1。如果各检测组有阳性检出结果,则检出的结果则能够说明待测样本含有的相应的HPV亚型病毒。需要说明的是,由于,HPV 33、52和58亚型的探针对通用,因此52亚型组检测出的阳性结果说明待测样本中含有HPV33、52和58亚型中的一种或几种。本实施例的检测结果如图3所示。
由图3说明,在16亚型组中,样本1的检测结果呈阳性(阴性对照电流值为28.67nA、其标准差为5.62,阳性对照电流值为130.22nA,样本1的电流值为192.05nA,样本2的电流值为30.53nA),说明样本1含有HPV 16亚型病毒;在52亚型组中,样本2的检测结果呈阳性(阴性对照电流值为25.58nA、其标准差为5.33,阳性对照电流值为75.70nA,样本1的电流值为23.90nA,样本2的电流值为166.10nA),另外,在66亚型组中,样本2的检测结果呈阳性(阴性对照电流值为25.92nA、其标准差为6.20,阳性对照电流值为115.75nA,样本1的电流值为34.47nA,样本2的电流值为72.72nA),说明样本2含有HPV 33、52、58亚型中的一种和HPV 66亚型。本实施例通过设置18检测组来检测待测样本的检测结果能够将其含有的具体病毒亚型检测出,其检测结果准确可靠。
实施例4
本实施例提供的用于病毒基因分型检测的试剂盒包括同探针组合、检测孔板、异硫氰酸荧光素抗体标记的辣根过氧化物酶(以溶液形式存在)及其底物(ABTS、以溶液形式存在)、清洗液。
其中,探针组合包括9个探针对,该9个探针对分别是:用于检测HPV 16亚型的第1探针对、用于检测HPV 18亚型的第2探针对、用于检测HPV 31亚型的第3探针对、用于检测HPV 33亚型或52亚型或58亚型的第4探针对、用于检测HPV 51亚型的第8探针对、用于检测HPV 56亚型的第9探针对、用于检测HPV 26亚型的第12探针对、用于检测HPV 53亚型的第13探针对、用于检测HPV 73亚型的第15探针对。各检测探针的3’端带有异硫氰酸荧光素。各探针对相应的捕获探针和检测探针的碱基序列见实施例1中的表1。
检测孔板的反应孔内固定有上述探针对的捕获探针,捕获探针固定至检测孔板的的方法同实施例1中的“1捕获探针固定”步骤,当然,在其他的实施例中,采用其他的方法将本发明的捕获探针固定至检测孔板上得到的检测孔板也属于本发明的保护范围。
清洗液包括洗液A和洗液B,洗液A是含SDS的SSC缓冲液,洗液B是含Tween20的PBS缓冲液。其余同实施例1。
采用本实施例对样本1和样本2同时检测,检测步骤与实施例1基本一致,检测结果如图4所示。
由图4可知,在16亚型组中,样本1的检测结果呈阳性(阴性对照电流值为25.22nA、其标准差为4.43,阳性对照电流值为108.10nA,样本1的电流值为166.03nA),说明样本1含有HPV16亚型病毒;在6种高危型组中,样本2的检测结果呈阳性(阴性对照电流值为24.25nA、其标准差为5.27,阳性对照电流值为115.92nA,样本2的电流值为170.42nA),说明其含有高危型HPV31、33、51、52、58以及56亚型中的至少一种。
实施例5
本实施例提供的用于病毒基因分型检测的试剂盒包括同探针组合、固定物、地高辛抗体标记的碱性磷酸酶酶(以溶液形式存在)及其底物(以含BCIP和NBT的组合物的溶液存在)、清洗液。
其中,探针组合包括4个探针对,该4个探针对分别是:用于检测HPV 16亚型的第1探针对、用于检测HPV 18亚型的第2探针对、用于检测HPV 33亚型或52亚型或58亚型的第4探针对、用于检测HPV 26亚型的第12探针对。各检测探针的5’端带有地高辛。各探针对相应的捕获探针和检测探针的碱基序列见实施例1中的表1。
固定物是导电聚合物和离子化合物,其中,导电聚合物是噻吩,当然,在其他的实施例中可以是苯胺。离子化合物是氯化钠。清洗液包括包括洗液A和洗液B,洗液A是含SDS的SSC缓冲液,洗液B是含Tween20的PBS缓冲液。其余同实施例1。
采用本实施例对样本1和样本2同时检测,检测步骤与实施例1基本一致,检测结果如图5所示。
由图5可知,在16亚型组中,样本1的检测结果呈阳性(阴性对照电流值为26.31nA、其标准差为5.29,阳性对照电流值为118.74nA,样本1的电流值为185.47nA),说明样本1含有HPV16亚型病毒;在3种高危型组中,样本2的检测结果呈阳性(阴性对照电流值为27.45nA、其标准差为5.15,阳性对照电流值为122.62nA,样本2的电流值为150.07nA),说明样本2含有高危型HPV33、51、52以及58亚型中的至少一种。
综上,本发明提供的病毒基因分型检测试剂盒具有以下优点:
1、检测灵敏度高:传统的探针固定方法是把探针的一端固定在平面支持物上,此方法由于支持物表面的疏水性等原因会降低探针与待测靶标DNA的杂交效率,本发明通过电荷吸附作用将捕获探针固定在聚吡咯孔内,可保证捕获探针具有超高活性;传统的核酸杂交过程通过控制杂交温度、盐离子、反应时间等提高杂交效率,本发明增加电场作为第四个控制条件,在电场的作用下提高了捕获探针对目的序列DNA的捕获效率;本方法中通过测定HRP催化TMB氧化过程中产生的电子信号作为检测结果,由于酶的催化效率很高,间接地放大了杂交反应的结果,增加了测定方法的敏感度。瞬间靶标分子捕获、超高活性分子探针固定、捕获分子信号特异放大这三大核心技术保证了本方法具有超高的灵敏性,远高于巴氏涂片、TCT技术和HC2等技术,与聚合酶链反应和基因芯片等技术相当。
2、检测特异性强:本发明中,每一个亚型HPV的检测过程均包含一条捕获探针和一条检测探针,探针长度在25-40bp之间,杂交效率受错配碱基的影响明显,只有目标序列DNA与两条探针同时准确配对后才能有检测信号,大大提高了检测的特异性。
3、操作简便、反应快速:本发明中电场的引入,一方面省略了杂交过程中对样品纯度要求,使得临床样本不经过核酸提取即可直接进行检测;另一方面降低了杂交过程中对反应时间的要求,加快了反应速率。整个检测过程可以在半小时内完成,缩短了总体反应时间,减少门诊病人的等待时间,为患者争取宝贵的治疗时间。
4、降低了对临床客户硬件及人员的要求:本发明中检测过程中不需要对样本进行纯化和PCR扩增等前处理,有效避免因环境污染造成的假阳性,且试验操作无需在专门的具有分区的PCR实验室进行,操作人员亦不需要获得临床基因扩增的上岗许可,可以由一般技术人员操作,对实验环境和操作人员的素质要求较低。
5、成本低:首先,在检测设备方面,目前无论是ARMS-PCR还是数字PCR都采用荧光信号检测,检测设备需配备昂贵的荧光检测系统,荧光定量PCR仪市场售价都在数十万元左右,而数字PCR仪更达100多万元。与之相比,EFIRM平台采用独创的电场引导的释放与测量技术,检测过程利用电场作用,反应快速,最终结果以电信号的形式检测,因而设备的成本大幅降低,仅相当于荧光定量PCR仪的一半左右。
其次,在检测试剂方面EFIRM技术基于核酸杂交的原理,采用独特设计的电化学技术。本发明中使用的核酸探针长度在25-40bp之间,选择于HPV亚型之间差异较大的E7区或L1区,均采用人工合成寡核苷酸探针,其中CP无需修饰,DP采用较常见的Biotin修饰方法,探针的制备委托商业化的DNA化学合成公司完成,技术难度低,稳定性较好,且部分亚型别共用CP或DP,减少了总探针数量,降低成本。以PCR为基础的荧光定量需要对探针进行两端修饰,且一端为荧光集团,合成成本较高;反向斑点杂交和基因芯片技术大都需要将杂交探针固定到固相载体上,处理工艺复杂,增加了检测成本,且探针经过固定后活性有一定的降低;HC2使用的探针为全长的RNA探针,长度为7000-8000个碱基,制备工艺复杂,耗时多,成本很高,而且由于探针非常长,杂交效率受错配碱基的影响小,可能出现亚型间的交叉。此外,在检测过程中EFIRM技术节省了DNA提取与纯化的步骤,因此检测试剂成本与其它技术相比相比大幅降低。
总之,本方法提供的以EFIRM为基础的HPV探针检测方法具有灵敏度高、特异性强、检测耗时短、实验场地要求低、成本低等特点,适用于大量的临床检测和大规模的流行病学筛查。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!