一种疫苗组合物及其应用的制作方法
本发明涉及疫苗领域,具体涉及一种能够同时预防百日咳、白喉、破伤风以及脊髓灰质炎的疫苗组合物。
背景技术:
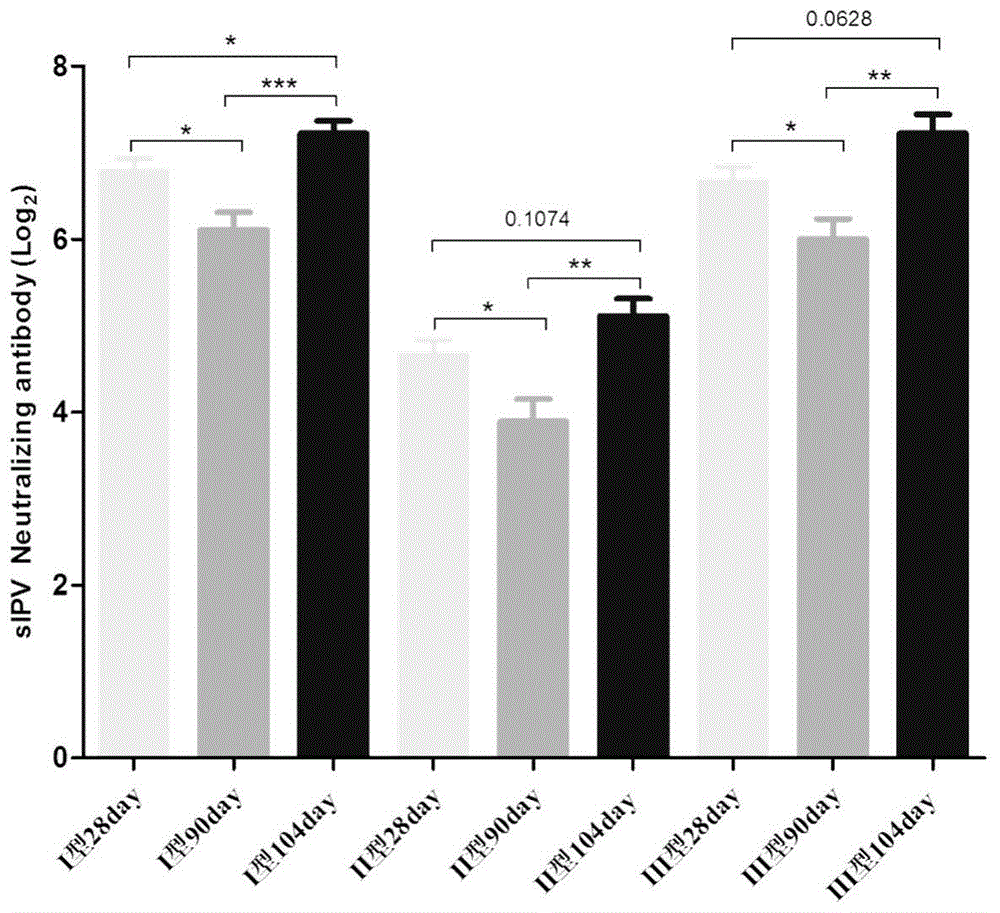
:及时进行疫苗接种是有效的预防保护性措施。百日咳、白喉和破伤风联合疫苗(dtp)作为最早纳入who扩大免疫计划(epi)的疫苗,已经在预防和控制这三种传染病方面发挥了重要作用。20世纪70年代,由于接种全细胞百白破疫苗(dtwp)后出现了严重的不良反应,日本及荷兰等国家出现了抵制疫苗接种及停用的现象,导致接种率下降,致使百日咳的发病率出现反弹。目前,绝大多数发达国家均通过共纯化或层析纯化制成副反应较小的无细胞百白破疫苗(dtap),作为基础的联合疫苗和常规免疫用疫苗。无细胞百日咳疫苗从生产工艺来讲可分为共纯化疫苗和层析纯化疫苗。目前中国和日本部分企业采用的是共纯化工艺,即细菌培养后,盐析沉淀pt、fha及prn等保护性抗原,然后用蔗糖密度梯度离心去除杂质,同时收集富含pt、fha和prn的有效成分。层析纯化是采用柱层析将不同的保护性抗原分别纯化,然后再将各抗原定量配比成疫苗。分离纯化法的成本较高,但优点是成分明确,容易进行质量控制,副作用更小。目前大多数发达国家均采用柱层析分离纯化各组份来生产无细胞百日咳疫苗。脊髓灰质炎(wpv)是由脊髓灰质炎病毒i、ii、iii型引起的传播广泛且危害极大的急性传染病,能侵袭任何年龄段人群,但主要是3岁以下的儿童(占所有病例的50%),严重造成肢体不可逆转的麻痹甚至死亡。在疫苗问世前,该病在全世界范围内流行。50年代中后期,美国的两位科学家salk和sabin先后研制成功脊髓灰质炎灭活疫苗(inactivatedpoliovirusvaccine,简称ipv)和口服脊髓灰质炎减毒活疫苗(oralpoliovirusvaccine,简称opv)。从此人们有了预防和消灭脊髓灰质炎的有力武器,实践证明这两种疫苗都是有效的。世界卫生组织(worldhealthorganization,who)1988年发起全球范围内消灭脊髓灰质炎的倡议,此后,消灭脊髓灰质炎的活动在降低脊髓灰质炎的发病率和减少脊髓灰质炎病毒的传播范围方面都取得了重大进展。2007年1月~2008年6月,16个国家从afp病例的粪便标本中检测到野毒株(wpv),只检测到wpvi型和wpviii型,自1999年以来在全球范围内未检测到wpvii型,这些进步的取得归功于全世界共同实施的消灭脊髓灰质炎策略。在全球消灭脊髓灰质炎(wpv)行动中,口服脊髓灰质炎减毒活疫苗(opv)得到广泛应用,已大幅度降低全球脊髓灰质炎的发病率。然而,由于疫苗相关麻痹型脊髓灰质炎(vaccineassociatedparalyticpoliomyelitis,vapp),和疫苗衍生脊髓灰质炎病毒(vaccine-derivedpoliovirus,vdpv)风险,今后必须停止口服脊髓灰质炎减毒活疫苗opv的使用,以彻底根除脊髓灰质炎。只有使用脊髓灰质炎灭活疫苗ipv才能避免vapp和vdpv风险。脊髓灰质炎灭活疫苗可预防脊髓灰质炎ipv爆发,并能产生群体免疫力,是消灭脊髓灰质炎后续阶段的最佳选择。目前全球有生产厂商在生产ipv,但所使用的生产毒种均为野毒株。用野毒株生产ipv需达到生物安全水平3级(bsl-3)的要求,全世界消灭脊髓灰质炎后,甚至bsl-4的条件亦非绝对保证。对于疫苗生产厂家难以达到如此严格的生物安全要求,目前国内批准上市的联合疫苗中,ipv疫苗选用的毒株为salk株,但salk株属于强野毒株,毒性较强,因而who鼓励疫苗生产厂家研发减毒株脊髓灰质炎灭活疫苗sabinipv(inactivatedpoliovirusvaccine,sabinstrain,简称sipv)。目前,开发安全性和稳定性更高的dtap-sipv联合疫苗具有重要意义。技术实现要素:本发明的目的在于提供一种能够同时预防百日咳、白喉、破伤风以及脊髓灰质炎的疫苗组合物。具体而言,本发明提了一种液体疫苗组合物,其中包含白喉类毒素,破伤风类毒素,百日咳毒素,丝状血凝素,百日咳杆菌黏附素,灭活的i型脊髓灰质炎病毒sabin毒株,灭活的ii型脊髓灰质炎病毒sabin毒株,灭活的iii型脊髓灰质炎病毒sabin毒株。本发明还提了一种液体疫苗组合物,其抗原由如下物质组成:白喉类毒素,破伤风类毒素,百日咳毒素,丝状血凝素,百日咳杆菌黏附素,灭活的i型脊髓灰质炎病毒sabin毒株,灭活的ii型脊髓灰质炎病毒sabin毒株,灭活的iii型脊髓灰质炎病毒sabin毒株。本发明根据sabin毒株具有安全性高的优势,为保证sabin毒株的免疫原性,同时尽量避免其与联合疫苗中的其他抗原的干扰作用,本发明所述组合物中,i型、ii型和iii型sabin株脊髓灰质炎病毒的抗原比例优选为(4~15):(11~45):(11~45)。作为本发明的一种具体优选方案,每0.5ml的所述液体疫苗组合物中包括如下组分:i型sabin株脊髓灰质炎病毒4~15du,ii型sabin株脊髓灰质炎病毒11~45du,iii型sabin株脊髓灰质炎病毒11~45du。本发明通过实验发现,当液体疫苗组合物中i型、ii型和iii型sabin株脊髓灰质炎病毒的抗原比例为1:(2.5~3.5):(2.5~3.5)时,液体疫苗组合物整体具有最佳的免疫效果。作为本发明的一种优选方案,所述疫苗组合物包含如下组分:更优选地,其中i型、ii型和iii型sabin株脊髓灰质炎病毒的抗原比例为1:(2.5~3.5):(2.5~3.5)。本发明提供的疫苗组合物既可用于基础免疫,也可以用于加强免疫。本发明通过大量实践发现,当对所述组合物中所含有的百日咳毒素、丝状血凝素、百日咳杆菌黏附素的比例和用量进行优化调整时,可以在确保安全性的基础上,使疫苗组合物更进一步地满足基础免疫或加强免疫的需要。本发明所述液体疫苗组合物用于制备基础免疫疫苗时,所述组合物中所含有的百日咳毒素、丝状血凝素、百日咳杆菌黏附素的质量比优选为(20~25):(20~25):(3~8)。作为本发明的一种优选方案,所述疫苗组合物用于基础免疫,每0.5ml单剂量所述组合物中含有百日咳毒素20~25μg,丝状血凝素20~25μg,百日咳杆菌黏附素3~8μg。作为本发明的一种优选方案,所述疫苗组合物用于基础免疫,每0.5ml单剂量所述组合物中含有百日咳毒素25μg,丝状血凝素25μg,百日咳杆菌黏附素8μg。作为本发明的一种优选方案,所述疫苗组合物用于基础免疫,每0.5ml单剂量所述组合物中含有如下组分:本发明所述液体疫苗组合物用于制备加强免疫疫苗时,所述组合物中所含有的百日咳毒素、丝状血凝素、百日咳杆菌黏附素的质量比优选为(2.5~8):(5~8):(2.5~3)。作为本发明的一种优选方案,所述疫苗组合物用于加强免疫,每0.5ml单剂量所述组合物中含有百日咳毒素2.5~8μg,丝状血凝素5~8μg,百日咳杆菌黏附素2.5~3μg。作为本发明的一种优选方案,所述疫苗组合物用于加强免疫,每0.5ml单剂量所述组合物中含有百日咳毒素8μg,丝状血凝素8μg,百日咳杆菌黏附素2.5μg。作为本发明的一种优选方案,所述液体疫苗组合物用于加强免疫,每0.5ml单剂量所述组合物中含有如下组分:本发明提供的疫苗组合物在含有上述抗原原液的基础上,还可以包括m199培养基。本发明经实践发现,当所述联合疫苗中添加m199培养基时,脊髓灰质炎病毒抗原的稳定性显著提高,从而对液体疫苗组合物整体的稳定性有重要作用。所述m199培养基的添加量优选为,在组合物中添加5%~20%的10x的m199培养基浓缩液。本发明提供的疫苗组合物在含有上述抗原原液的基础上,还可以包含佐剂。所述佐剂可以选用氢氧化铝和/或磷酸铝的佐剂。本发明经实践发现,当佐剂中的铝含量为0.3~1.25mg/ml、优选为0.4~0.8mg/ml时,可以在确保液体疫苗组合物安全性的同时,使各型抗原的效价均在较高的质量标注。本发明提供的疫苗组合物在含有上述抗原原液的基础上,还可以含有可溶性磷酸盐缓冲液,用以调节疫苗组合物的ph值。本发明提供的疫苗组合物在含有上述抗原原液的基础上,还可以含有一定量的氯化钠或等效的物质,用以维持渗透压。本发明同时提供了制备所述疫苗组合物的方法。作为本发明的一种优选方案,所述方法具体包括如下步骤:将包括百日咳毒素、丝状血凝素、百日咳杆菌黏附素、白喉类毒素原液、破伤风类毒素原液、灭活的i型sabin株脊髓灰质炎病毒原液、灭活的ii型sabin株脊髓灰质炎病毒原液、灭活的iii型sabin株脊髓灰质炎病毒原液在内的液体原料混合。其中各种原料以液体的形式制备,然后直接混合。将所述液体原料混合后,进一步加入佐剂等物质,可以获得稳定、适于人体使用的液体疫苗组合物。具体而言,可以进一步加入用氯化钠水溶液稀释的铝盐佐剂,再加入磷酸盐缓冲液,调ph至5.8~7.2。本发明保护所述疫苗组合物在制备基础免疫疫苗中的应用。本发明保护所述疫苗组合物在制备加强免疫疫苗中的应用。本发明提供一种疫苗试剂盒,包括第一室和第二室;所述第一室中含有由上述疫苗组合物制备而成的基础免疫疫苗;所述第二室中含有由上述疫苗组合物制备而成的加强免疫疫苗。本发明提供一种疫苗试剂盒,包括第一室、第二室和第三室;所述第一室和第二室中各自含有由上述疫苗组合物制备而成的基础免疫疫苗;所述第三室中含有由上述疫苗组合物制备而成的加强免疫疫苗。本发明提供一种疫苗试剂盒,包括第一室、第二室、第三室和第四室;所述第一室、第二室和第三室中各自含有由上述疫苗组合物制备而成的基础免疫疫苗;所述第四室中含有由上述疫苗组合物制备而成的加强免疫疫苗。在实际接种时,采用本发明提供的疫苗试剂盒,可以高效完成疫苗接种,避免错接种或漏接种。例如:使用试剂盒中第一室(或依次使用第一室和第二室,或依次使用第一室、第二室和第三室)内的基础免疫疫苗进行基础免疫,再使用试剂盒中第二室(或第三室,或第四室)内的加强免疫疫苗进行加强免疫。与现有技术相比,本发明提供的疫苗组合物为液体制剂,在制备、运输、储存、使用的各个环节可维持液体制剂性质的稳定。进一步而言,本发明提供的疫苗组合物可以用于基础免疫或加强免疫,可以在确保安全性的基础上提高被免疫者血清中抗体的滴度。附图说明图1为实施例10中sipv的i型、ii型、iii型中和抗体滴度检定结果;图2为实施例10所述免疫程序百日咳(ap)抗体滴度检定结果;其中,ap-pt代表百日咳毒素,ap-fha代表丝状血凝素,ap-prn代表百日咳杆菌黏附素;图3为实施例10所述免疫程序白喉(dt)、破伤风(tt)抗体滴度检定结果。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。实施例1本实施例提供了一种液体疫苗制剂,每1人次用量包含如下组分:百日咳毒素8μg,丝状血凝素8μg,百日咳杆菌黏附素2.5μg,白喉类毒素2lf,破伤风类毒素5lf,灭活的i型脊髓灰质炎病毒原液4du,灭活的ii型脊髓灰质炎病毒原液11du,灭活的iii型脊髓灰质炎病毒原液11du,铝含量0.6mg/ml,氯化钠水溶液适量。使用前将联合疫苗混匀后,用于肌肉注射。本实施例提供的液体疫苗制剂可以用于加强免疫。实施例2本实施例提供了一种液体疫苗制剂,每1人次用量包含如下组分:百日咳毒素8μg,丝状血凝素8μg,百日咳杆菌黏附素2.5μg,白喉类毒素2lf,破伤风类毒素5lf,灭活的i型脊髓灰质炎病毒原液15du,灭活的ii型脊髓灰质炎病毒原液45du,灭活的iii型脊髓灰质炎病毒原液45du,铝含量0.8mg/ml,氯化钠水溶液适量。使用前将联合疫苗混匀后,用于肌肉注射。本实施例提供的液体疫苗制剂可以用于加强免疫。实施例3本实施例提供了一种液体疫苗制剂,每1人次用量包含如下组分:百日咳毒素25μg,丝状血凝素25μg,百日咳杆菌黏附素8μg,白喉类毒素12.5lf,破伤风类毒素3.5lf,灭活的i型脊髓灰质炎病毒原液15du,灭活的ii型脊髓灰质炎病毒原液45du,灭活的iii型脊髓灰质炎病毒原液45du,铝含量0.8mg/ml,氯化钠水溶液适量。使用前将联合疫苗混匀后,用于肌肉注射。本实施例提供的液体疫苗制剂可以用于基础免疫。实施例4本实施例提供了一种液体疫苗制剂,每1人次用量包含如下组分:百日咳毒素25μg,丝状血凝素25μg,百日咳杆菌黏附素8μg,白喉类毒素12.5lf,破伤风类毒素3.5lf,灭活的i型脊髓灰质炎病毒原液7.5du,灭活的ii型脊髓灰质炎病毒原液22.5du,灭活的iii型脊髓灰质炎病毒原液22.5du,铝含量0.8mg/ml,氯化钠水溶液适量。使用前将联合疫苗混匀后,用于肌肉注射。本实施例提供的液体疫苗制剂可以用于基础免疫。实施例5本实施例提供了实施例1~4中涉及的各单价疫苗原液的制备方法。1、白喉类毒素原液开启白喉杆菌,先在产毒培养基种子管中传1~3代再转至产毒培养基制成生产用种子采用培养罐液体培养,培养基采用麦芽糖综合培养基,34~36℃培养45~52小时,培养结束后加入甲醛杀菌,在培养物中加入硫酸铵沉淀杂蛋白,离心收集上清上清液超滤浓缩后再加入硫酸铵盐析沉淀白喉毒素蛋白,离心收集沉淀,加pb缓冲液进行溶解,超滤去除毒素中的硫酸铵,加入甲醛,置35~37℃,脱毒30天,超滤去除类毒素中的甲醛,除菌过滤即为白喉类毒素原液。2、破伤风类毒素原液开启破伤风梭状芽抱杆菌,先在产毒培养基种子管中传1~3代,再转至产毒培养基制成生产用种子采用培养罐液体培养,培养基采用双陈培养基,34~36℃培养62~72小时培养结束后加入甲醛杀菌,培养液经过滤去除菌体,加入硫酸铵沉淀毒素蛋白,离心收集沉淀,超滤去除毒素中的硫酸铵后加入甲醛,置35~37℃,脱毒30天,超滤去除类毒素中的甲醛,除菌过滤即为破伤风类毒素原液。3、无细胞百日咳疫苗原液1)开启百日咳杆菌,接种于改良包-姜培养基或活性炭半综合培养基,于35~37℃培养不超过48小时,再接种于cpb培养基中传两代,每代培养时间18~26小时,进行扩增培养以制备足够的生产用种子,然后接种到发酵罐中液体培养,培养基采用cpb培养基,37℃培养两天,培养结束后在培养物中加入硫柳汞或甲醛进行杀菌处理,将收获的培养物离心,离心收获的菌体和上清液2~8℃保存待下一步纯化。2)百日咳毒素和丝状血凝素的纯化:将上清液超滤浓缩后上清上样于captosp层析柱,流动相采用含尿素的磷酸盐缓冲液,以氯化钠梯度洗脱,分别收集含百日咳毒素和丝状血凝素的洗脱组份,将含百日咳毒素的洗脱组份上样于captommc层析柱,缓冲液采用tris-hcl缓冲液,以氯化钠梯度洗脱,收集百日咳毒素洗脱峰;将含丝状血凝素的洗脱峰上样于羟基磷灰石层析柱纯化,收集洗脱峰。3)百日咳黏附素的分离纯化:将菌体采用60℃热释放,超滤浓缩后,上样于captoadhere层析柱,以醋酸缓冲液为流动相,收集含百日咳黏附素的洗脱组份,再上样于captosp层析柱,以醋酸缓冲液为流动相,以氯化钠梯度洗脱,收集洗脱峰,即为分离纯化的百日咳黏附素。4)制备无细胞百日咳原液:将百日咳毒素采用戊二醛脱毒、丝状血凝素和百日咳黏附素采用甲醛进行处理,除菌过滤后即为无细胞百日咳原液。4、脊髓灰质炎病毒原液i型脊髓灰质炎病毒原液:1)细胞制备:取工作细胞库中的1支或几支细胞管,复苏后至第一级细胞反应器中,于36.5℃±0.5℃培养,直至细胞浓度为1~5×106细胞/ml;将第一级细胞反应器中细胞经胰蛋白酶消化,接种至第二级细胞反应器,于36.5℃±0.5℃培养,直至细胞浓度为2~10×106细胞/ml;将第二级细胞反应器细胞经胰蛋白酶消化,接种至第三级细胞反应器,于36.5℃±0.5℃培养,至细胞浓度为1~5×106细胞/ml时,接种病毒。2)病毒培养及收获:将第三级细胞反应器内细胞培养液置换为维持液,取i型脊髓灰质炎病毒工作种子批毒种按moi=0.002~0.02接种vero细胞,置32.5℃±0.5℃培养。病毒培养2-4天,收获细胞上清,即为脊髓灰质炎病毒sabin株单价收获液。3)病毒收获液澄清及纯化:收获液经离心澄清后用300-500kda超滤膜包浓缩50-200倍。浓缩完成后采用蔗糖密度梯度离心纯化分离病毒,所用蔗糖梯度具体为蔗糖密度梯度液的第一梯度为30%蔗糖,第二梯度为55%蔗糖,30000rpm离心10小时,收集病毒所在区带。密度梯度离心收集到的病毒液经阴离子交换层析,监测波长为280nm和254nm,收集流穿液,获得病毒层析液。将病毒层析液进行浓缩,即得纯化液。所述阴离子交换层析具体可为deaesepharosefastflow、qsepharosefastflow或其他阴离子交换层析。在本发明的一个实施例中,采用的阴离子交换层析为deaesepharosefastflow。4)病毒灭活:纯化液经0.22μm除菌过滤后加入甲醛溶液,使游离甲醛终浓度为90μg/ml,置37.0℃±1.0℃灭活6天,经除菌过滤后,继续置37.0℃±1.0℃灭活6天,即得单价原液。ii型脊髓灰质炎病毒原液:1)细胞制备:取工作细胞库中的1支或几支细胞管,复苏后至第一级细胞反应器中,于36.5℃±0.5℃培养,直至细胞浓度为1~5×106细胞/ml;将第一级细胞反应器中细胞经胰蛋白酶消化,接种至第二级细胞反应器,于36.5℃±0.5℃培养,直至细胞浓度为2~10×106细胞/ml;将第二级细胞反应器细胞经胰蛋白酶消化,接种至第三级细胞反应器,于36.5℃±0.5℃培养,至细胞浓度为1~5×106细胞/ml时,接种病毒。2)病毒培养及收获:将第三级细胞反应器内细胞培养液置换为维持液,取ii型脊髓灰质炎病毒工作种子批毒种按moi=0.01~0.1接种vero细胞,置32.5℃±0.5℃培养。病毒培养2-4天,收获细胞上清,即为脊髓灰质炎病毒sabin株单价收获液。3)病毒收获液澄清及纯化:收获液经离心澄清后用300-500kda超滤膜包浓缩50-200倍。浓缩完成后采用蔗糖密度梯度离心纯化分离病毒,所用蔗糖梯度具体为蔗糖密度梯度液的第一梯度为30%蔗糖,第二梯度为55%蔗糖,30000rpm离心10小时,收集病毒所在区带。密度梯度离心收集到的病毒液经阴离子交换层析,监测波长为280nm和254nm,收集流穿液,获得病毒层析液。将病毒层析液进行浓缩,即得纯化液。所述阴离子交换层析具体可为deaesepharosefastflow、qsepharosefastflow或其他阴离子交换层析。在本发明的一个实施例中,采用的阴离子交换层析为deaesepharosefastflow。iii型脊髓灰质炎病毒原液:1)细胞制备:取工作细胞库中的1支或几支细胞管,复苏后至第一级细胞反应器中,于36.5℃±0.5℃培养,直至细胞浓度为1~5×106细胞/ml;将第一级细胞反应器中细胞经胰蛋白酶消化,接种至第二级细胞反应器,于36.5℃±0.5℃培养,直至细胞浓度为2~10×106细胞/ml;将第二级细胞反应器细胞经胰蛋白酶消化,接种至第三级细胞反应器,于36.5℃±0.5℃培养,至细胞浓度为1~5×106细胞/ml时,接种病毒。2)病毒培养及收获:将第三级细胞反应器内细胞培养液置换为维持液,取iii型脊髓灰质炎病毒工作种子批毒种moi=0.05~0.5接种vero细胞,置32.5℃±0.5℃培养。病毒培养2-4天,收获细胞上清,即为脊髓灰质炎病毒sabin株单价收获液。3)病毒收获液澄清及纯化:收获液经离心澄清后用300-500kda超滤膜包浓缩50-200倍。浓缩完成后采用蔗糖密度梯度离心纯化分离病毒,所用蔗糖梯度具体为蔗糖密度梯度液的第一梯度为30%蔗糖,第二梯度为55%蔗糖,30000rpm离心10小时,收集病毒所在区带。密度梯度离心收集到的病毒液经阴离子交换层析,监测波长为280nm和254nm,收集流穿液,获得病毒层析液。将病毒层析液进行浓缩,即得纯化液。所述阴离子交换层析具体可为deaesepharosefastflow、qsepharosefastflow或其他阴离子交换层析。在本发明的一个实施例中,采用的阴离子交换层析为deaesepharosefastflow。5)病毒灭活:纯化液经0.22μm除菌过滤后加入甲醛溶液,使游离甲醛终浓度为90μg/ml,置37.0℃±1.0℃灭活6天,经除菌过滤后,继续置37.0℃±1.0℃灭活6天,即得单价原液。实施例6本实施例提供了实施例1~4中液体疫苗组合物的制备方法,包括如下步骤:1)将实施例5提供的百日咳毒素、丝状血凝素、百日咳黏附素、白喉类毒素原液、破伤风类毒素原液、灭活的i型脊髓灰质炎病毒原液、灭活的ii型脊髓灰质炎病毒原液以及灭活的iii型脊髓灰质炎病毒原液混合,加入用氯化钠水溶液稀释的铝盐佐剂,再加入磷酸盐缓冲液,调ph至5.8~7.2,得半成品;2)将所述半成品分装与西林瓶或者预灌装注射器中,即可。实施例7本实施例分析了不同sabin毒株抗原含量对联合疫苗的ipv免疫效果的影响。本实施例制备含有不同i、ii、iii型d抗原的dtap-sipv联合疫苗供试品(供试品1、2、3),三种联合疫苗的抗原含量如表1所示,以市售ipv疫苗为对照。三种供试品和对照分别免疫wistar大鼠,每组10只,每只注射0.5ml,免疫后21天采血分离血清,用细胞发检测大鼠体内脊髓灰质炎中和抗体效价,计算ed50值。表1:三种联合疫苗的抗原含量i型、ii型和iii型脊髓灰质炎中和抗体效价的检测结果如表2、表3和表4所示,结果表明,采用三种dtap-sipv联合疫苗免疫的大鼠体内的i型、ii型和iii型脊髓灰质炎中和抗体均不低于对照市售ipv疫苗。表2:大鼠sipv-i型中和效价检测样品名称供试品1供试品2供试品3对照ed50稀释倍数7.85.25.54.9表3:大鼠sipv-ii型中和效价检测样品名称供试品1供试品2供试品3对照ed50稀释倍数6.85.15.64.7表4:大鼠sipv-iii型中和效价检测样品名称供试品1供试品2供试品3对照ed50稀释倍数3.82.72.81.9实施例8本实施例研究了m199培养基对联合疫苗稳定性的影响。具体而言,本实施例在实施例5制备得到的i型、ii型和iii型sabin毒株的混合sipv吸附液中添加不同浓度的m199培养基,考察其对病毒抗原稳定性的影响。加入不同体积的m199培养基浓缩液(10×m199培养基,即所有组分终浓度为常规m199培养基的10倍的浓缩m199培养基),分别设置不添加m199的对照组以及每0.5ml的sipv吸附液分别添加5%、10%和20%(体积百分含量)的m199浓缩液的试验组,将含有不同浓度m199的sipv吸附液放置于37℃条件下,考察时间点为0天、7天、14天,分别测定sipv吸附液中d抗原含量。由测试结果可知,在不添加m199时,d抗原含量随着放置时间的延长而不断下降,当sipv吸附液在37℃条件下放置14天后,脊髓灰质炎病毒i型、ii型、iii型的原液中d抗原下降幅度在20%-30%之间。当ipv吸附液中浓缩m199添加量为5%、10%和20%时,i型、ii型、iii型的ipvd抗原含量在0-1天基本稳定,sipv吸附液在37℃条件下放置14天后,i型、ii型、iii型的d抗原含量都没有明显下降,结果表明,m199培养基的添加对于脊髓灰质炎病毒抗原的稳定性具有重要作用。实施例9本实施例提供了实施例1~4提供的液体疫苗制剂的成品检验方法。1鉴别试验采用酶联免疫法检测pt、fha、prn抗原,应含有相应抗原(《中国药典》2015版三部“吸附百白破联合疫苗”中附录)。采用免疫双扩散法(《中国药典》2015版三部),本品应与白喉类毒素、破伤风类毒素及破伤风类毒素免疫血清形成明显沉淀线。2物理检查2.1外观:振摇后应呈均匀乳白色混悬液,无摇不散的凝块或异物2.2装量:依法检查,应不低于标示量(≥0.5ml)。3化学检查3.1ph值:应为5.8~7.2。3.2铝含量:应不高于0.8mg/剂。3.3游离甲醛含量:应不高于0.2g/l。3.4戊二醛含量:应小于0.01g/l。4效价测定4.1无细胞百日咳疫苗:以适宜的稀释倍数稀释至第一个免疫剂量,再按5倍系列稀释。免疫时间为21天。每1次人用剂量的免疫效价应不低于4.0iu,且95%可信限的低限应不低于2.0iu。如达不到上述要求时可进行复试,但所有的有效试验结果必须以几何平均值(如用概率分析法时,应用加权几何平均)来计算。达到上述要求即判为合格。4.2白喉疫苗:每1次人用剂量中白喉类毒素的免疫效价应不低于30iu。4.3破伤风疫苗:每1次人用剂量中破伤风类毒素的免疫效价应不低于40iu。5效力实验吸附sabin株脊髓灰质炎灭活疫苗:每批疫苗进行系列梯度倍比稀释后,分别免疫180~220g清洁级以上wistar大鼠,每组稀释度10只,雌雄各半,每只动物免疫0.5ml供试品。21天采血,分离血清,-20℃保存。分别检测血清中抗ⅰ/ⅱ/ⅲ型3个型别病毒的中和抗体滴度,计算血清阳转率。同法对内部参比品进行效力试验。供试品的免疫原性应与内部参比品相当,即:供试品ed50值不高于参比品的400%。6无菌检查:依法检查,应无菌生长。7热原检查依法检查,注射剂量按家兔体重每lkg注射1.0μg多糖,在初试的三只家兔中,体温升高均低于0.6℃,并且3只家兔体温升高综合低于1.3℃;或在复试的5只家兔中,体温升高0.6℃或高于0.6℃的家兔不超过1只,并在初试、复试合并8只家兔的体温升高总和为3.5℃或低于3.5℃,均判定供试品的热原检查符合规定。8特异性毒性检查8.1无细胞百日咳疫苗:毒性参考品按照每批标示进行稀释。用体重14~16gnih小鼠(雌性或雌雄各半),毒性参考品的每一稀释度和供试品各用一组,每组至少10只。每只小鼠腹腔注射0.5ml,分别进行a~b项试验。a)小鼠白细胞增多试验于注射后3天分别取小鼠末梢血进行白细胞计数。试验结果经统计学方法处理后,注射供试品的小鼠白细胞增多毒性的活性应不高于0.5lpu/ml。b)小鼠组胺致敏试验于注射后4天,每只小鼠腹腔注射0.5ml溶液(含二盐酸组胺4mg或二磷酸组胺2mg),30分钟后分别测小鼠肛温。试验结果经统计学方法处理后,供试品的小鼠组胺致敏毒性的活性应不高于0.8hsu/ml,且无动物死亡。8.2白喉、破伤风疫苗用体重250~350g豚鼠,每批制品不少于4只,每只腹部皮下注射2.5ml,分两侧注射,每侧1.25ml,观察30天。注射部位可有浸润,经5~10天变成硬结,可能30天不完全吸收。在第10天、第20天、第30天称体重,到期体重比注射前增加,局部无化脓、无坏死、无破伤风症状及无晚期麻痹症者为合格。9毒性逆转实验:每批供试品置37℃放置4周,按规程中8.1b)项进行。10细菌内毒素检查:依《中国药典》三部通则1143检查,应不高于100eu/剂。检测结果参考表5所示。表5:疫苗检测结果实施例10本实施例提供了一种利用本发明提供的液体疫苗制剂进行混合免疫的方法。具体为:以实施例4提供的疫苗液体制剂作为基础免疫剂型疫苗,分别于第1天和第14天皮下注射免疫两次。于第28天经眼眶采血,经间接elisa法测定小鼠血清中的igg抗体滴度。于3个月后(即第90天)再次采血检定其血清中的igg滴度,并经皮下注射免疫实施例1提供的疫苗液体制剂作为加强免疫,于加强免疫后14天(即第104天)采血测定其血清中的igg滴度。结果如表6及图1~3所示。表6:抗体滴度检测结果28天90天104天i型sipv中和抗体滴度(log2)6.7786.1117.222ii型sipv中和抗体滴度(log2)4.6673.8895.111iii型sipv中和抗体滴度(log2)6.6676.0007.222ap-pt抗体滴度(lg)5.0774.5955.468ap-fha抗体滴度(lg)5.8905.8606.372ap-prn抗体滴度(lg)4.4754.0544.656dt抗体滴度(lg)5.6493.2496.200tt抗体滴度(lg)5.4085.4996.191图1~3中,*代表p<0.05;**代表p<0.01;***代表p<0.001。实验结果显示,经实施例4提供的疫苗液体制剂作为基础免疫剂免疫两次后,均能诱导小鼠产生显著的针对i/ii/iii型脊髓灰质炎病毒的中和性抗体、针对百日咳组份(pt、fha、prn)的抗体(igg)、针对dt的抗体(igg)和针对tt的抗体(igg)。在3个月后检测小鼠体内的抗体水平,我们发现i/ii/iii型脊髓灰质炎病毒的中和性抗体、针对百日咳组份(pt、prn)的抗体(igg)、针对dt的抗体(igg)均出现了显著性的降低。但经实施例1提供的疫苗液体制剂作为加强免疫剂型免疫一次后,能极显著的提高小鼠体内针对i/ii/iii型脊髓灰质炎病毒的中和性抗体、针对百日咳组份(pt、fha、prn)的抗体(igg)、针对dt的抗体(igg)和针对tt的抗体(igg)。虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1