可递送药物活性物质的近红外激发复合光敏纳米颗粒的制备方法及应用
1.本发明属于纳米生物医药材料领域,涉及了一种由近红外光激发的免疫调节纳米复合光敏剂的制备方法及应用。
背景技术:
2.肿瘤免疫治疗旨在调控免疫系统以实现对肿瘤细胞的识别并清除,达到治疗肿瘤的目的。近年来,光动力疗法因其具有消融肿瘤和激活抗肿瘤免疫反应的潜力而受到广泛关注。然而,光动力疗法的整体疗效受到肿瘤微环境中的免疫耐受和免疫抑制的限制,往往需要额外的治疗干预来增强抗肿瘤免疫反应。传统光动力疗法中使用的常规光敏剂(如肽菁,卟啉等)具有疏水性的刚性平面结构,在水溶液中易于通过π
‑
π堆积发生聚集,从而大大降低了活性氧(ros)产生效率,影响疗效。此外,这些光敏剂大多是由可见光激发的,由于组织对可见光的通透性较差,极大地限制了光动力疗法的实际应用。因此,迫切需要开发一种新的光免疫治疗策略,在提高激发光的组织穿透深度的同时产生足够的活性氧,并同时克服免疫抑制肿瘤微环境中的免疫耐受性问题。
3.具有聚集诱导发光性能(aie)的光敏剂因其独特的优势受到人们越来越多的关注,具有该特性的光敏分子可以有效克服由于聚集诱导猝灭而引起的活性氧产生能力下降问题。目前已开发出几种基于聚集诱导发光并同时具有良好生物相容性的纳米颗粒,并成功应用于生物医学领域。然而,当前所构建的基于聚集诱导发光特性的光敏纳米颗粒通常采用常规的聚合物包封方法。通过该方法构建的纳米颗粒往往会覆盖一层较厚的聚合物壳层,这极大的阻碍氧气的暴露,进而影响了活性氧的产生效率。除此之外,这类纳米颗粒通常由紫外光或可见光作为激发光源,这类光源组织通透性有限并且具有很强的光毒性,严重限制其实际应用。与此相较,近红外(nir)光具有深层组织穿透力,被认为是光动力治疗的理想光源,可有效解决紫外
‑
可见光源的组织穿透力差以及光毒性问题,因此开发基于近红外光激发的具有聚集诱导发光特性光敏剂的可能为提高光动力治疗疗效提供新的机会。
4.通过光动力治疗可直接杀伤肿瘤细胞,诱导局部肿瘤消退,此外,研究表明光动力治疗可触发免疫原性细胞死亡(icd)级联反应。经历icd的肿瘤细胞可通过大量分泌三磷酸腺苷(atp)募集t淋巴细胞(ctls),启动抗肿瘤免疫应答以消除残留肿瘤细胞及转移性肿瘤。同时,伴随光动力治疗产生的一系列免疫抑制信号会对光动力治疗疗效产生负性作用。这些免疫抑制信号可进一步诱导免疫抑制淋巴细胞如调节性t细胞(treg)的扩增以并抑制效应t细胞功能。这种生存机制导致肿瘤对光动力治疗不敏感,从而无法达到最佳的治疗效果。因此,在进行光动力治疗的同时对免疫抑制通路进行有效抑制可有效提高光免疫治疗疗效。
技术实现要素:
5.本发明目的旨在开发一种可递送药物活性物质的近红外激发复合光敏纳米颗粒
(neinp
‑
drug),为实现高效的光免疫治疗提供一种简便、安全、经济的新方法。
6.本发明可实现在980nm激光辐照下诱导纳米复合光敏剂产生大量ros杀伤肿瘤细胞,同时在肿瘤微酸性环境下触发聚合物壳层中叔胺基团(pc7a)质子化,诱导纳米复合光敏剂溶胀并释放药物活性物质。此发明的巧妙设计在于,当neinp
‑
drug富集在肿瘤部位后,在pdt同时快速释放药物活性物质,调节免疫抑制肿瘤微环境,并可以根据不同肿瘤类型对所负载的药物活性物质进行更换,提高免疫应答,消除残余肿瘤及转移性肿瘤,提高光免疫治疗疗效。该方法不同于传统的将光敏剂负载入纳米载体的包封方法,不仅能克服传统光动力治疗中存在光源的皮肤穿透性差等问题,还能实现小分免疫调节小分子快速且近精准释放,此外,其制备方法工艺简单,成本较低,易于推广应用,为实现高效的癌症光免疫治疗提供了一种新的思路。
7.本发明的技术方案
8.可递送药物活性物质的近红外激发复合光敏纳米颗粒,是将上转换纳米粒子以及具有聚集诱导发光特性的光敏分子(aieps)通过共价键包覆上具有ph响应性的聚合物壳层并在壳层中负载药物活性物质制备而成,能够实现光敏内核以及药物活性物质的共同递送。
9.所述复合光敏纳米颗粒的构筑单元包括上转换纳米粒子、光敏分子(aieps)和聚合物壳层;上转换纳米粒子的化学式为nayf4:yb,m,m=er,tm,aieps的化学式为c
60
h
38
f
12
n4o4,外层聚合物壳层的构筑单体甲基丙烯酸2
‑
(六亚甲基亚氨基)乙酯(c7a
‑
ma)、2
‑
甲基丙烯酰氧乙基磷酰胆碱(mpc)以及n
‑
(3
‑
氨基丙基)
‑
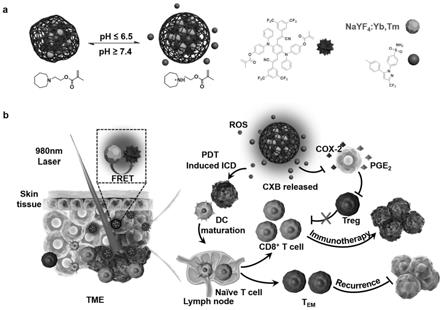
甲基丙烯酸胺盐酸盐(apm)的化学式分别为:c
12
h
21
no2、c
11
h
22
no6p、c7h
14
n2o。
10.aieps、c7a
‑
ma、mpc以及apm的结构式分别如下:
[0011][0012]
可递送药物活性物质的近红外激发复合光敏纳米颗粒的制备方法,具体步骤如下:
[0013]
第1步、上转换纳米粒子(ucnp)的合成。
[0014]
将ycl3,ybcl3和tmcl3等稀土元素氯化物以747:25:3的摩尔比例【例如:ycl3(0.747mmol),ybcl3(0.25mmol)tmcl3(0.003mmol)】分散在油酸和十八烯(ode)(v:v=2:5)【例如油酸6ml,十八稀15ml】中,在惰性气体保护下,通过295
‑
300℃,加热时间为1
‑
1.5h得到ucnp,经丙酮以及环己烷洗涤后分散在thf中备用。
[0015]
第2步、聚集诱导发光光敏分子的合成
[0016]
将n
‑
苯基
‑4‑
((四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)苯胺以及(2z,2'z)
‑
3,3'
‑
(2,5
‑
二溴
‑
1,4
‑
亚苯基)双(2
‑
(3,5
‑
双(三氟甲基))丙烯腈)以5:1的摩尔比【例如n
‑
苯基
‑4‑
((四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)苯胺(5.0mmol,1.347g),2z,2'z)
‑
3,3'
‑
(2,5
‑
二溴
‑
1,4
‑
亚苯基)双(2
‑
(3,5
‑
双(三氟甲基))丙烯腈)(1mmol,0.762g)】通过buchwald
–
hartwig反应进行偶联,随后在甲醇盐酸的作用下脱去羟基的保护基团,得到的中间产物与甲基丙烯酰氯反应制备聚集诱导发光光敏分子(aieps)。
[0017]
第3步、近红外光激发的光敏内核的制备
[0018]
按照20:1的质量比,将第2步得到的aieps和第1步得到的ucnp溶解分散在待用有机溶剂thf中。在超声状态下将上述溶液逐滴滴到适量水中,混合物搅拌过夜使有机溶剂thf充分挥发得到近红外光敏内核(nep),在使用前通过超滤浓缩并标定浓度。
[0019]
第4步、近红外激发复合光敏纳米颗粒的制备
[0020]
将nep分散在弱酸性磷酸缓冲液中,通过原位聚合的方法控制各反应物摩尔比nep/apm/c7a
‑
ma/bis/aps=1/2500/40000/30000/8000在光敏内核表面共价连接一层聚合物壳层。待聚合完成后,混合液用pbs透析,并通过琼脂糖凝胶6b(sepharose 6b)纯化获得未负载药物的近红外激发复合光敏纳米颗粒neinp。
[0021]
第5步、可递送小分子药物的近红外激发复合光敏纳米颗粒的制备
[0022]
取适量的第4步获得的neinp纳米颗粒溶解于pbs中,加入500ug/ml的药物活性物质,避光搅拌24h,并通过sepharose 6b纯化得到可递送小分子药物(药物活性物质)的近红外激发复合光敏纳米颗粒neinp
‑
drug。
[0023]
本发明提供的可递送药物活性物质的近红外激发复合光敏纳米颗粒可作为ph响应药物递送光敏平台;所递送的药物活性物质是选自治疗以下一种或多种疾病的药物:癌症、细菌感染、类风湿性关节炎、炎症性肠病或皮肤疾病。
[0024]
本发明的优点和有益效果:
[0025]
1.可递送药物活性物质的近红外激发复合光敏纳米颗粒可以改善ros的产生并调节免疫抑制微环境以改善光免疫治疗疗效;
[0026]
2.该发明可将近红外激发的具有聚集诱导发光特性的光敏剂内核以及药物活性物质共同递送至肿瘤部位,有效降低对正常组织的毒副作用;
[0027]
3.这一策略可以有效克服传统光动力治疗中激发光的组织穿透深度有限、ros产生不足和免疫耐受等问题;
[0028]
4.本发明提供了一种简单有效的通用治疗平台使高效和精确的光免疫治疗成为可能。该方法制备简单,成本较低,便于操作。
附图说明
[0029]
图1为neinp
‑
drug的制备示意图;
[0030]
图2为本发明所制备的可递送小分子药物的近红外激发复合光敏纳米颗粒的粒径分布图以及透射电镜图片;图中显示,纳米粒子呈球形,粒径在70nm左右,并且大小均一,具有较窄的粒径分布;
[0031]
图3为近红外激发复合光敏纳米颗粒或玫瑰红(rb)与abda混合溶液在不同时间间隔激光照射的紫外吸收光谱以及降解速率曲线;其中,a为neinp与abda混合溶液在980nm激光照射下的紫外吸收光谱,b显示neinp与abda混合溶液在980nm激光照射下的紫外吸收降解速度曲线;
[0032]
图4为近红外激发复合光敏纳米颗粒在体外对触发icd效应以及对树突状细胞(dc)的免疫刺激作用;其中,a显示4t1细胞中加入neinp在980nm激光辐照下诱导atp外流的图,b显示近红外激发复合光敏纳米颗粒在体外对dc细胞的刺激成熟作用;
[0033]
图5为可递送小分子药物的近红外激发复合光敏纳米颗粒在不同ph环境下的药物释放行为;
[0034]
图6为近红外激发复合光敏纳米颗粒在体内对诱导dc细胞成熟以及效应t细胞的免疫刺激作用;其中,a显示给药后各组小鼠脾脏中cd11b
+
cd80
+
cd86
+
细胞的比例,b显示给药后各组小鼠肿瘤中cd45
+
cd3
+
cd8
+
的比例;
[0035]
图7为可递送小分子药物的近红外激发复合光敏纳米颗粒在体内对免疫抑制微环境的免疫调控以及免疫记忆效应;其中,a显示给药后各组小鼠肿瘤中pge2的表达水平,b显示给药后各组小鼠肿瘤中调节t细胞(cd45
+
cd4
+
cd25
+
foxp3
+
)的比例,c显示给药后收集各小组小鼠的脾脏中效应记忆t细胞(cd8
+
cd62l
‑
cd44
+
)的百分比。
具体实施方式
[0036]
以下通过非限定性实例进一步详细说明本发明。
[0037]
实施例1:
[0038]
附图1显示出了本发明中的可递送药物活性物质的近红外激发复合光敏纳米颗粒的制备以及应用示意图,制备方法步骤及相关评估如下:
[0039]
1)、上转换纳米粒子(ucnp)的合成
[0040]
按文献方法以油酸为稳定剂合成ucnp(nayf4:yb,tm)。将ycl3(0.747mmol),ybcl3(0.25mmol)和tmcl3(0.003mmol)分散在6ml油酸和15ml 1
‑
十八烯(ode)中,将上述混合物在150℃下加热30分钟。形成均匀溶液后,将混合物冷却至室温,然后加入含naoh和nh4f的甲醇溶液中。将温度提高至110℃持续加热以蒸干甲醇,随后在惰性气体氛围下加热到300℃,保持温度1小时。将所得产物用丙酮和环己烷洗涤三次,最终分散在四氢呋喃(thf)中。
[0041]
2)、聚集诱导发光光敏分子的合成
[0042]
将4
‑
羟基二苯胺(5.39mmol,1.000g)3,4
‑
二氢
‑
2h
‑
吡喃(8.65mmol,0.728g)溶解于二氯甲烷中,随后加入吡啶对甲苯磺酸盐(0.28mmol,0.071g),于室温反应12小时。洗涤并萃取后通过柱层析提纯得到的白色固体n
‑
苯基
‑4‑
((四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)苯胺(5.0mmol,1.347g),再与(2z,2'z)
‑
3,3'
‑
(2,5
‑
二溴
‑
1,4
‑
亚苯基)双(2
‑
(3,5
‑
双(三氟甲基))丙烯腈)(1mmol,0.762g),2
‑
二环己基酮
‑2’
,6
’‑
二异丙氧基
‑
1,1
’‑
联苯(0.15mmol,0.070g),三(二亚苄基丙酮)钯(0.038mmol,0.022g),磷酸三钾(5.0mmol,1.061g)置于50ml圆底烧瓶中,在惰性气体保护下滴加2ml甲苯,回流18小时。冷却后,向上述混合物中加入50ml氯仿,萃取,重结晶后得到红色固体。将红色固体(3.0mmol,3.417mg)溶解于100mlthf中,再加入5ml甲醇和10ml 2n盐酸溶液,室温下反应12小时。提纯后将得到的化合物(7.2mmol,7.000g)溶解在含三乙胺(21.6mmol,2.181g)的thf中,并在冰水浴下逐滴滴加甲基丙烯酰氯(21.6mmol,2.258g),于室温反应12小时。反应结束后,过滤除去反应体系内的沉淀,通过硅胶层析柱进行提纯得到目标产物。
[0043]
3)、近红外光激发的光敏内核的制备
[0044]
使用改良的纳米共沉淀方法制备了近红外光激发的光敏内核(nep)。将
0.1mgaieps和0.005mg ucnp分散在1mlthf中。在超声波处理下(12w,120s)滴入10ml水中,混合物搅拌过夜使thf充分挥发。所得光敏内核在使用前进行超滤浓缩并标定浓度。通过动态光散射(dls)对胶束粒径进行表征,平均粒径为60nm。
[0045]
4)、将nep分散在ph=6.5的磷酸缓冲液中,按顺序加入apm,mpc,c7a,bis,temed以及aps的储备溶液,控制各反应物摩尔比nep/apm/c7a
‑
ma/bis/aps=1/2500/40000/30000/8000,质量比aps/temed=1/2,上述反应体系于4℃反应2h。反应结束后,混合液用pbs透析,并通过sepharose 6b处理以获得纯化的neinp。超滤浓缩,标定纳米粒子浓度备用。如图2,通过动态光散射(dls)和透射电镜(tem)对neinp粒径进行评估,平均粒径为90nm。
[0046]
5)、药物活性物质的负载与释放
[0047]
将10mgneinp分散在磷酸盐缓冲液(ph=6.5)中,加入塞来昔布(500μg ml
‑1),避光搅拌24小时。通过离心得到可递送小分子药物的近红外激发复合光敏纳米颗粒(neinp
‑
drug)。
[0048]
将2ml上述负载药物活性物质的近红外激发复合光敏纳米颗粒转移到透析袋中,并在37℃下分别浸入ph 6.5和ph 7.4的磷酸盐缓冲液中。为了监测药物的释放,在透析过程中重复收集一定量的释放介质并用相同体积的新鲜释放介质代替。
[0049]
dlc和dle的计算公式如下:
[0050]
dlc(wt%)=(weight ofloaded drug/total weight ofneinp)
×
100%
[0051]
dle(%)=(weight ofloaded/weight ofdrug in feed)
×
100%。
[0052]
实施例2:
[0053]
一种可递送药物活性物质的近红外激发复合光敏纳米颗粒的制备方法,该方法步骤及相关评估如下:
[0054]
1)、上转换纳米粒子(ucnp)的合成
[0055]
按文献方法以油酸为稳定剂合成ucnp(nayf4:yb,tm)。将ycl3(0.747mmol),ybcl3(0.25mmol)和tmcl3(0.003mmol)分散在6ml油酸和15ml 1
‑
十八烯(ode)中,将上述混合物在150℃下加热30分钟。形成均匀溶液后,将混合物冷却至室温,然后加入含naoh和nh4f的甲醇溶液中。将温度提高至110℃持续加热以蒸干甲醇,随后在惰性气体氛围下加热到295℃,保持温度1.5小时。将所得产物用丙酮和环己烷洗涤三次,最终分散在四氢呋喃(thf)中。
[0056]
2)、聚集诱导发光光敏分子的合成
[0057]
将4
‑
羟基二苯胺(5.39mmol,1.000g)3,4
‑
二氢
‑
2h
‑
吡喃(8.65mmol,0.728g)溶解于二氯甲烷中,随后加入吡啶对甲苯磺酸盐(0.28mmol,0.071g),于室温反应24小时。洗涤并萃取后通过柱层析提纯得到的白色固体n
‑
苯基
‑4‑
((四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)苯胺(5.0mmol,1.347g),再与(2z,2'z)
‑
3,3'
‑
(2,5
‑
二溴
‑
1,4
‑
亚苯基)双(2
‑
(3,5
‑
双(三氟甲基))丙烯腈)(1mmol,0.762g),2
‑
二环己基酮
‑2’
,6
’‑
二异丙氧基
‑
1,1
’‑
联苯(0.15mmol,0.070g),三(二亚苄基丙酮)钯(0.038mmol,0.022g),磷酸三钾(5.0mmol,1.061g)置于50ml圆底烧瓶中,在惰性气体保护下滴加2ml甲苯,回流24小时。冷却后,向上述混合物中加入50ml氯仿,萃取,重结晶后得到红色固体。将红色固体(3.0mmol,3.417mg)溶解于100mlthf中,再加入5ml甲醇和10ml 2n盐酸溶液,室温下反应24小时。提纯后将得到的化合物(7.2mmol,7.000g)溶解在含三乙胺(21.6mmol,2.181g)的thf中,并在冰水浴下逐滴滴加甲
基丙烯酰氯(21.6mmol,2.258g),于室温反应24小时。反应结束后,过滤除去反应体系内的沉淀,通过硅胶层析柱进行提纯得到目标产物。
[0058]
3)、近红外光激发的光敏内核的制备
[0059]
使用改良的纳米共沉淀方法制备了近红外光激发的光敏内核(nep)。将0.1mgaieps和0.005mg ucnp分散在1mlthf中。在超声波处理下(12w,150s)滴入10ml水中,混合物搅拌过夜使thf充分挥发。所得纳米粒子在使用前进行超滤浓缩并标定浓度。
[0060]
4)、将nep分散在ph=6.5的磷酸缓冲液中,按顺序加入apm,mpc,c7a,bis,temed以及aps的储备溶液,控制各反应物摩尔比nep/apm/c7a
‑
ma/bis/aps=1/2500/40000/30000/8000,质量比aps/temed=1/2,上述反应体系于0℃反应4h。反应结束后,混合液用pbs透析,并通过sepharose 6b处理以获得纯化的neinp。超滤浓缩,标定纳米粒子浓度备用。
[0061]
5)、药物活性物质的负载与释放
[0062]
将10mgneinp分散在磷酸盐缓冲液(ph=6.5)中,加入塞来昔布(500μg ml
‑1),避光搅拌24小时。通过离心得到可递送小分子药物的近红外激发复合光敏纳米颗粒(neinp
‑
drug)。
[0063]
将2ml上述负载药物活性物质的近红外激发复合光敏纳米颗粒转移到透析袋中,并在37℃下分别浸入ph 6.5和ph 7.4的磷酸盐缓冲液中。为了监测药物的释放,在透析过程中重复收集一定量的释放介质并用相同体积的新鲜释放介质代替。
[0064]
dlc和dle的计算公式如下:
[0065]
dlc(wt%)=(weight ofloaded drug/total weight ofneinp)
×
100%
[0066]
dle(%)=(weight ofloaded/weight ofdrug in feed)
×
100%。
[0067]
实施例3:
[0068]
一种可递送药物活性物质的近红外激发复合光敏纳米颗粒的制备方法,该方法步骤及相关评估如下:
[0069]
1)、上转换纳米粒子(ucnp)的合成
[0070]
按文献方法以油酸为稳定剂合成ucnp(nayf4:yb,tm)。将ycl3(1.494mmol),ybcl3(0.5mmol)和tmcl3(0.006mmol)分散在12ml油酸和30ml 1
‑
十八烯(ode)中,将上述混合物在150℃下加热30分钟。形成均匀溶液后,将混合物冷却至室温,然后加入含naoh和nh4f的甲醇溶液中。将温度提高至110℃持续加热以蒸干甲醇,随后在惰性气体氛围下加热到300℃,保持温度1小时。将所得产物用丙酮和环己烷洗涤三次,最终分散在四氢呋喃(thf)中。
[0071]
2)、聚集诱导发光光敏分子的合成
[0072]
将4
‑
羟基二苯胺(10.78mmol,2.000g)3,4
‑
二氢
‑
2h
‑
吡喃(16.3mmol,1.456g)溶解于二氯甲烷中,随后加入吡啶对甲苯磺酸盐(0.56mmol,0.142g),于室温反应12小时。洗涤并萃取后通过柱层析提纯得到的白色固体n
‑
苯基
‑4‑
((四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)苯胺(10.0mmol,2.694g),再与(2z,2'z)
‑
3,3'
‑
(2,5
‑
二溴
‑
1,4
‑
亚苯基)双(2
‑
(3,5
‑
双(三氟甲基))丙烯腈)(2mmol,1.524g),2
‑
二环己基酮
‑2’
,6
’‑
二异丙氧基
‑
1,1
’‑
联苯(0.3mmol,0.14g),三(二亚苄基丙酮)钯(0.076mmol,0.044g),磷酸三钾(10.0mmol,2.122g)置于100ml圆底烧瓶中,在惰性气体保护下滴加4ml甲苯,回流18小时。冷却后,向上述混合物中加入50ml氯仿,萃取,重结晶后得到红色固体。将红色固体(6.0mmol,6.834mg)溶解于200mlthf中,再加入10ml甲醇和20ml 2n盐酸溶液,室温下反应12小时。提纯后将得到的化
合物(14.4mmol,14.000g)溶解在含三乙胺(43.2mmol,4.362g)的thf中,并在冰水浴下逐滴滴加甲基丙烯酰氯(43.2mmol,4.516g),于室温反应12小时。反应结束后,过滤除去反应体系内的沉淀,通过硅胶层析柱进行提纯得到目标产物。
[0073]
3)、近红外光激发的光敏内核的制备
[0074]
使用改良的纳米共沉淀方法制备了近红外光激发的光敏内核(nep)。将0.2mgaieps和0.01mg ucnp分散在2mlthf中。在超声波处理下(12w,120s)滴入20ml水中,混合物搅拌过夜使thf充分挥发。所得纳米粒子在使用前进行超滤浓缩并标定浓度。
[0075]
4)、将nep分散在ph=6.5的磷酸缓冲液中,按顺序加入apm,mpc,c7a,bis,temed以及aps的储备溶液,控制各反应物摩尔比nep/apm/c7a
‑
ma/bis/aps=1/2500/40000/30000/8000,质量比aps/temed=1/2,上述反应体系于4℃反应2h。反应结束后,混合液用pbs透析,并通过sepharose 6b处理以获得纯化的neinp。超滤浓缩,标定纳米粒子浓度备用。
[0076]
5)、药物活性物质的负载与释放
[0077]
将20mgneinp分散在磷酸盐缓冲液(ph=6.5)中,加入塞来昔布(500μg ml
‑1),避光搅拌24小时。通过离心得到可递送小分子药物的近红外激发复合光敏纳米颗粒(neinp
‑
drug)。
[0078]
将2ml上述负载药物活性物质的近红外激发复合光敏纳米颗粒转移到透析袋中,并在37℃下分别浸入ph 6.5和ph 7.4的磷酸盐缓冲液中。为了监测药物的释放,在透析过程中重复收集一定量的释放介质并用相同体积的新鲜释放介质代替。
[0079]
dlc和dle的计算公式如下:
[0080]
dlc(wt%)=(weight ofloaded drug/total weight ofneinp)
×
100%
[0081]
dle(%)=(weight ofloaded/weight ofdrug in feed)
×
100%。
[0082]
实施例4:
[0083]
近红外激发复合光敏纳米颗粒的体外活性氧产生能力测定
[0084]
测试方法:紫外
‑
可见分光光谱法。
[0085]
测试工具:日本岛津uv
‑
3600紫外
‑
可见分光光度计(型号:ptc
‑
348wi),测试样品选用岛津自带石英比色皿,光程10mm。
[0086]
试剂及其来源:9,10
‑
蒽基
‑
双(亚甲基)二丙二酸(abda)以及均孟加拉玫瑰红(rb)购于上海阿拉丁生化科技股份有限公司
[0087]
具体方法:通过abda作为指示剂检测近红外激发复合光敏纳米颗粒在980nm激光(2.5mw cm
‑2)照射下活性氧产生效率(φ),以rb作为标准试剂进行检测。将abda的溶液(200μm)加入到nepin溶液或者rb水溶液中使最终浓度分别为200μg ml
‑1和5μg ml
‑1。在整个操作期间,abda在400nm处吸收值逐渐减弱,测试结果如图3所示,活性氧产生效率通过如下公式计算:φnepin=φ
rb
(k
nepin
·
a
rb
)/k
rb
·
a
nepin
[0088]
k
nepin
和k
rb
为降解速率常数,该常数通过计算ln(a0/a)对时间曲线的斜率获得。a0代表体系在400nm处初始吸收值,a代表体系在400nm处不同时间间隔下的吸收值。a
nepin
和a
rb
代表nepin纳米粒子和rb溶液在400
‑
800nm的吸收曲线积分面积。
[0089]
实施例5:
[0090]
近红外激发复合光敏纳米颗粒诱导肿瘤免疫原性死亡能力测定
[0091]
肿瘤免疫原性死亡(icd)的特征在于三磷酸腺苷(atp)的分泌
[0092]
atp的细胞外分泌水平用市售的atp测定试剂盒测定。将细胞以2
×
104细胞/孔的密度接种到24孔板中过夜,然后向细胞中加入40μm的neinp,培养6小时后进行激光辐照,继续培养12小时后。收集细胞培养上清液,并根据制造商的说明使用atp分析试剂盒测试atp含量。测试结果如图4a所示,经激光辐照后,neinp处理的细胞会atp分泌量升高,表明neinp经近红外激光照射条件下可特性诱导icd的产生。
[0093]
近红外激发复合光敏纳米颗粒诱导树突细胞成熟能力测定
[0094]
采用流式细胞仪检测nepin处理的肿瘤细胞诱导dc成熟情况。具体方法如下:将小鼠处死后,取后股骨和胫骨,剔除肌肉组织,在无菌条件下,减掉骨头两端,用注射器吸取培养基冲洗骨髓腔,用200目无菌筛网过滤,收集骨髓液,离心(1000rpm)并弃上清,加入红细胞裂解液(2ml),五分钟后离心,洗涤后收集细胞,用含有10%fbs,20ng/ml集落刺激因子(gm
‑
csf)以及20ng/ml的白介素
‑
4的1640培养基培养,连续培养六天,收集半贴壁的未成熟dc细胞,待用。
[0095]
将肿瘤细胞以2
×
104细胞/孔的密度接种到12孔板中。继续培养24小时后,向肿瘤细胞中加入nepins(2mg ml
‑1,40μl),孵育6小时后,用pbs洗涤3次,用980nm激光以2.5mw cm
‑2的光密度照射1分钟并做好标记,随后向上述处理的肿瘤细胞培养孔内以1
×
105细胞/孔的密度加入未成熟的dc细胞,孵育24小时后,离心收集半贴壁的dc细胞并用相应流式抗体染色,将细胞用4%多聚甲醛固定并通过流式细胞仪进行分析。如图4b所示,经980nm激光辐照的neinp可大幅度促进dc细胞成熟。
[0096]
实施例6:
[0097]
neinp
‑
drug不同ph条件下药物的体外释放研究
[0098]
将neinp
‑
drug(1mg ml
‑1)转移到透析袋(mwco 10000)中,然后将每个透析袋浸入到20ml相应ph条件下的磷酸盐缓冲液中,并在摇床(200rpm,37℃)中培育。为了模拟真实生理情况,在固定的时间间隔,吸取1ml透析液用于紫外吸收测量,并加入等体积的新鲜缓冲液。释放的药物活性物质量是通过测量特征吸收峰值确定,如图5所示,drug的释放速率在ph 6.5时比在ph 7.4时快,说明酸响应性药物控制释放的能力使neinp
‑
drug能够限制药物在弱酸性环境中的特异性释放。
[0099]
实施例7:
[0100]
nepin的抗肿瘤免疫响应研究
[0101]
将获取的经处理后的肿瘤切成小块,匀浆研磨成单细胞液,并通过细胞滤网以获得单细胞悬浮液。离心后将获得的细胞重悬于细胞染色缓冲液,用荧光标记的抗体对淋巴细胞染色;然后将准备好的样品进行流式细胞仪分析。
[0102]
nepin体内诱导肿瘤引流淋巴结中的dc细胞成熟情况评估
[0103]
将经上述处理的小鼠实施安乐死后,获取腹股沟淋巴结,研磨并将样品通过细胞滤网,以获得单细胞悬浮液。离心后收集细胞备用,获得的细胞重悬于细胞染色缓冲液,用荧光标记的抗体对处理后的单细胞细胞进行染色分析。染色结束后利用流式细胞仪检测dc细胞的成熟情况。如图6所示,经辐照的neinp可有效保留浸润t细胞活性,并可大幅度促进抗原提呈细胞成熟。
[0104]
实施例8:
[0105]
neinp
‑
drug调节免疫抑制微环境以及记忆效应研究
[0106]
通过酶联免疫吸附测定(elisa)经980nm激光辐照后neinp
‑
drug对体内前列腺素表达水平的影响。具体方法如下:将获取的经处理后的肿瘤切成小块,研磨成匀浆后离心,去上清液,用pbs液稀释10倍后遵循天津安诺瑞康生物技术有限公司公司提供的实验手册进行检测。如图7a所示,在980nm激光辐照下,nepin
‑
drug处理组可有效抑制pge2分泌量。
[0107]
treg细胞数量以及t
em
细胞数量通过流式细胞术手段表征,具体方法如下:将获取的经处理后的肿瘤以及脾脏分别切成小块,匀浆研磨成单细胞液,并通过细胞滤网以获得单细胞悬浮液。离心后将获得的细胞重悬于细胞染色缓冲液,用荧光标记的抗体对淋巴细胞染色;然后将准备好的样品进行流式细胞仪分析,如图7b以及7c所示,经辐照的neinp
‑
drug可有效减少treg细胞数量并大幅度提高记忆t细胞数量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1