金属粉末的熔融盐脱氧的制作方法
相关专利申请
本专利申请要求2014年12月2日提交的美国临时专利申请62/086,524以及2015年5月13日提交的pct国际申请pct/us15/30669的优先权,这两篇申请各自以引用方式并入本文。
背景技术:
粉末冶金常用于生产由纯金属或金属合金构成的产品。粉末状金属或共混在一起的多种粉末状金属被压制成所需形式。然后通过加热粉末状金属来烧结粉末状金属,直至金属颗粒粘结到一起。金属粉末最近已与增材制造技术一起使用,诸如3d打印和激光烧结。
金属粉末(尤其反应性金属,诸如钛(ti))中存在氧通常可损害烧结和最终产物特性诸如强度和韧性。许多脱氧工艺是已知的,并且包括基于钙的脱氧工艺。但是,当前脱氧工艺可能涉及相对高温(通常>900℃),并且可能实施起来很复杂。
技术实现要素:
从反应性金属中去除氧的方法可包括形成包括金属、钙脱氧剂和盐的混合物。可在脱氧温度下加热该混合物一段时间以降低金属中的氧含量,从而形成脱氧金属。脱氧温度可高于盐的熔点并且低于钙脱氧剂的熔点。然后可冷却脱氧金属,接着用水和酸浸出,以去除副产物并获得最终产物。
又如,从反应性金属粉末中去除氧的方法可包括通过将钙脱氧剂与待脱氧的金属粉末根据基于待去除氧的量的特定比率混合来形成粉末混合物。钙脱氧剂可包括固体钙(ca)和氢化钙(cah2)中的至少一者。粉末混合物可与熔点低于钙脱氧剂熔点的盐共混,以形成共混的混合物。可在惰性或还原性气氛中加热所共混的混合物至高温以产生熔融盐作为介质一段时间,该时间足以使金属粉末的氧含量降低至低于预定氧阈值,以形成脱氧金属粉末。该高温可高于盐的熔点并且低于钙脱氧剂的熔点。然后可冷却脱氧金属粉末,接着用水和酸浸出,以去除副产物并获得最终产物。
因此,已对本发明的较重要的特征进行了广义的概述,以更好地理解接下来的本发明的具体实施方式,并且更好地认识本发明对本领域的贡献。通过本发明的以下具体实施方式结合附图和权利要求,本发明的其他特征将变得更清晰,或者可通过本发明的实践了解到。
附图说明
图1为概述根据本发明的实施方案的从金属中去除氧的方法的流程图。
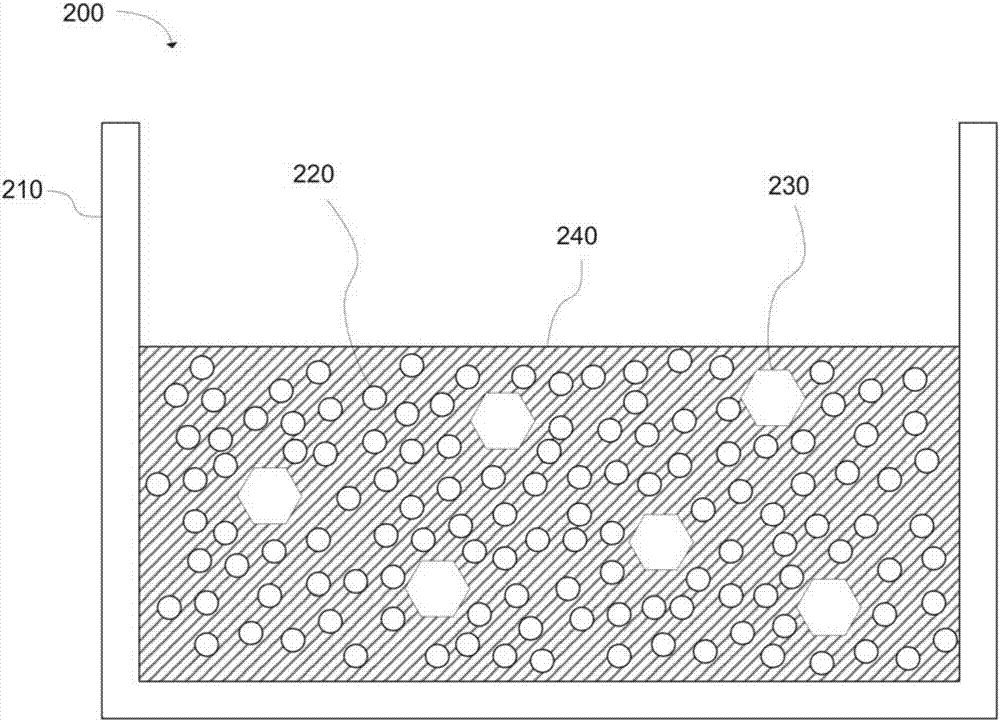
图2示出了根据本发明的实施方案的脱氧系统。
图3为示出氧化铝(al2o3)、氧化镁(mgo)、氧化钙(cao)和具有不同氧含量的钛(以实线示出,其氧含量写在每条线旁边)的吉布斯能(δg)随温度变化关系的埃林汉姆图。
图4为tih的p-c-t图。
图5为α钛和β钛中的氧扩散系数与温度的关系图。
图6为cacl2-cah2的相图。
图7为根据本发明的一个方面h2对ca、ti和cacl2盐的影响的示意图。红点表示氧,蓝点表示h,灰点表示钛,并且黄点表示钙。
图8为根据本发明的一个方面的在h2气氛中的钙脱氧机制的示意图。
图9为根据本发明的一个方面的在氩气气氛中的钙脱氧机制的示意图。
提供这些附图以说明本发明的各个方面而不是意图在尺寸、材料、构型、布置或比例方面进行范围的限制,除非权利要求另有限制。
具体实施方式
虽然这些示例性实施方案足够详细地描述以使本领域的技术人员能够实践本发明,但是应当理解,其他实施方案也可以实现并且在不脱离本发明的实质和范围的前提下可对本发明作出各种改变。因此,如权利要求书所要求的,本发明的实施方案的以下更详细的描述并不旨在限制本发明的范围,但是仅仅为了说明而非限制的目的而呈现以描述本发明的特征和特性,阐述本发明的最佳操作模式,并且充分地使本领域的技术人员能够实践本发明。因此,本发明的范围仅由所附的权利要求书来限定。
定义
在描述和要求保护本发明时,将使用下面的术语。
如本文所用,“烧结”一般是指加热压实的金属粉末以将金属粉末颗粒熔合在一起的过程。通常,“烧结”意指按照标准商业规范加热至足够高温并在足够高温下保持足够长时间以实现完全或几乎完全的致密化。而“部分烧结”是指实现部分致密化的加热,从而得到比完全烧结产物致密度低的部分烧结产物。
在本发明的一些实施方案中,平均值可相对于颗粒的特性给出。除非另外指明,否则此类特性的所有平均值为基于各个颗粒的数字平均值。例如,“平均粒度”是指数字平均粒度。
除非上下文另外明确规定,否则单数形式“一种”、“一个”和“该”包括复数指示物。因此,例如,提及“颗粒”包括提及一种或多种此类材料,并且提及“烧结”是指一个或多个此类步骤。
如本文相对于标识的特性或环境所用,“基本上”是指足够小的偏差程度,以便不可测量地减损所标识的特性或环境。在一些情况下,容许的精确偏差度取决于具体情况。
如本文所用,为方便起见,多个物品、结构元件、组成元件和/或材料可以在相同列表中表示。然而,这些列表应理解为列表的每个构件独立地识别为单独且唯一的构件。因此,在没有相反指示的情况下,不应单独地基于它们在相同组中的表现,将此类列表的任何单个构件理解为相同列表的任何其他构件的实际等同物。
本文可能以范围格式表示浓度、含量和其他数值数据。应当理解,此类范围格式的使用仅仅出于方便和简洁目的,并且应灵活解读为不仅包括明确引用为范围限值的数值,还包括涵盖在该范围内的所有单个数值或子范围,如同明确引用每个数值和子范围。例如,约1至约4.5的数值范围应被理解为不仅包括明确叙述的1至约4.5的限制,而且还包括单个数值(诸如2、3、4)和子范围(诸如1至3、2至4)等。相同原理适用于叙述仅一个数值的范围,诸如“小于约4.5,”,这应被理解为包括所有上述值和范围。另外,这样的解释应不管范围的宽度或所描述的特性而应用。
如本文所用,术语“…中的至少一个”旨在与“…中的一个或多个”同义。例如,“a、b和c中的至少一个”明确地包括仅a、仅b、仅c,以及每一个的组合(例如a+b、b+c、a+c和a+b+c)。
任何方法或工艺权利要求中所引用的任何步骤可以按任何顺序执行并且不限于权利要求中提供的顺序。装置加功能或步骤加功能限制仅仅用在特定的权利要求限制中,在这种限制中满足所有的下列条件:a)明确记载了“用于…的装置”或“用于…的步骤”;以及b)明确引用对应功能。在本文的说明中明确引用了支持装置加功能的结构、材料或行为。因此,本发明的范围应仅由所附权利要求及其合法等同条件确定,而非由本文给定的描述和例子确定。
金属粉末的熔融盐脱氧
粉末冶金可为传统熔融锻造冶金技术的低成本替代技术。但是,粉末冶金同样带来了挑战。使用某些源金属,生产用作源材料的粉末的成本可能非常高,从而极大地降低了粉末冶金方法的优势和竞争力。具体地讲,钛金属是用于粉末冶金的优良候选物,但生产钛金属粉末可能非常昂贵。
钛粉末生产成本高的一个原因在于钛对氧的化学亲和力。由于ti-o键能为2.12ev,相当于2.56ev的ti-ti键能,因此这种化学亲和力很明显。另外,氧在固态ti中具有高溶解度(高达14.3重量%),这对ti合金的机械性能不利。氧在ti中的溶解度可随温度升高而增大,这使得在保持低氧含量时进行ti粉末的高温处理更加困难。因此,在粉末处理过程中,ti金属粉末可易于结合氧。出于这些原因,可能很难生产具有低氧含量的ti金属粉末。
因此,本发明提供了从金属粉末中去除氧的方法。在一些实施方案中,该方法可涉及相对较低的温度。氧的溶解度以及金属粉末与氧的反应性在本发明方法中所采用的温度下可能相对较低。因此,本发明方法可实现具有极低氧含量的金属粉末的生产。在较低温度下去除氧也可降低该过程的能量消耗,从而使所得金属粉末的生产花费更低。
本发明方法也可用于生产用于增材制造方法诸如激光烧结和其他3d打印方法的金属粉末材料。例如,3d打印技术的进步增加了对具有特定粒度和粒度分布的球形钛粉末的需求。对于使用金属粉末的3d打印来讲,钛是用于制造产品的常见材料。例如,钛合金用于制作生物医学植入物和假体关节。3d打印可用于生产为特定患者量身定制的生物医学植入物。制造飞机的复杂部件是使用钛进行的3d打印的另一示例性用途。使用3d打印制造部件的优点包括:节约成本,因为不需要制造昂贵的模型或模具;构造使用常规机器很难制造的具有复杂几何形状的部件的能力;定制针对特定应用优化的部件而不需要很大的量的能力;以及其他优势。
但是,用于钛部件的3d打印的钛粉末通常经受相当严格的要求。一些3d打印应用需要球状颗粒。可能还需要特定粒度和窄粒度分布。另外,粉末的氧含量可能需要满足某些标准规范或最终用户要求,诸如针对钛的astm标准。
球形细钛粉末也可用于钛部件的注塑成型。金属粉末注塑成型(mim)是用于制造具有复杂几何形状的小部件并用于大批量生产的低成本制造技术。
本发明方法在相对较低的温度下使金属粉末脱氧。在一些情况下,此类低温可有助于保持颗粒的球形并避免在脱氧过程中烧结颗粒。当诸如在用于钛脱氧的一些钙热工艺中使用较高温度时,颗粒可变得与脱氧剂和/或盐烧结或结块在一起,这需要在脱氧之后研磨或碾磨来使颗粒分开。例如,已知的doss(固态脱氧)工艺需要过量液体钙和高温来确保在钙和钛之间的良好(固液)接触,以减少ti-6al-4v粉末中的氧。该工艺通常在高于900℃的温度下进行。在这种方法中,颗粒之间的烧结以及金属粉末与脱氧剂的整个混合物的结块会导致难以分开金属粉末并保持金属粉末的球形形态和流动性。这样可降低金属粉末用于增材造的有效性。相比之下,本发明提供了在较低温度下将金属粉末脱氧的方法,从而避免金属粉末颗粒在脱氧过程中烧结。
据此说明,图1为根据本发明的实施方案的从金属中去除氧的方法100的流程图。该方法包括形成包括金属、钙脱氧剂和含碱卤化物盐的混合物110;在脱氧温度下加热该混合物一段时间以降低金属的氧含量,从而形成脱氧金属,其中脱氧温度高于含碱卤化物盐的熔点并且低于钙脱氧剂的熔点120;以及冷却脱氧金属130。在许多情况下,该方法还可包括用水和酸浸出脱氧金属以获得最终脱氧产物140。
由于脱氧温度低于钙脱氧剂的熔点,因此钙脱氧剂在脱氧期间可为固态。另外,脱氧温度高于含碱盐的熔点,使得含钙盐在脱氧期间为熔融液体。在一些实施方案中,钙脱氧剂在熔融含碱盐中可为至少部分地可溶的。因此,至少一部分固体钙脱氧剂可溶解于熔融盐中。
不受特定机制的约束,据信钙脱氧剂可溶解于熔融盐中,以形成ca+离子、ca2+离子和电子。然后ca2+离子可与金属粉末中的氧原子反应形成cao,从而使金属粉末脱氧。这种机制可大致示于图9中,并且随后更加详细地进行描述。在一些情况下,电子可与金属粉末中的氧原子反应形成o2-离子,该离子在熔融盐中也是可溶的。当溶解于熔融盐中的o2-离子的量达到其溶解度限值时,o2-离子可与ca2+离子反应形成cao。氧原子与金属粉末颗粒表面处的电子反应并且氧与ca2+反应形成cao可降低金属粉末颗粒表面附近的氧浓度。这样形成浓度梯度,使得另外的氧原子扩散至金属粉末颗粒的表面。通过这种方式,可去除溶解在金属粉末中的氧,并使其转化成cao。
因此,在一些实施方案中,脱氧可通过钙热脱氧来进行。脱氧剂可包括钙金属(ca)、氢化钙(cah2)或它们的组合。
含碱卤化物盐通常可包括碱金属卤化物盐和碱土金属卤化物盐中的至少一者。另外,在其他实施方案中,含钙盐可充当助熔剂或介质,其有利于钙脱氧剂与金属中的氧之间的反应。在一些示例中,含钙盐可包括卤化钙盐,诸如cacl2、cabr2、cai2或它们的组合。在另外的示例中,含钙盐也可包括除钙之外的金属的二元卤化物盐。例如,二元盐可为碱卤化物盐,诸如kcl、kbr、ki、licl、libr、lii、nacl、nabr、nai、cscl、csbr、csi或它们的组合。在具体示例中,含钙盐可包括cacl2和二元盐(即kcl、licl或它们的组合)。在一些情况下,含卤化钙盐可为共晶盐混合物,诸如卤化钙-碱卤化物共晶盐、卤化钙-卤化钙共晶盐或这些盐的组合。
无论如何,含碱卤化物盐可具有低于钙脱氧剂熔点的熔点。在某些示例中,含卤化钙盐可具有约400℃至约770℃的熔点。当含碱盐是两种或更多种盐的混合物时,可对盐的类型和量进行选择,使得混合物的熔点低于钙脱氧剂的熔点。可使用多种不同盐类型和量的组合来实现合适的熔点。但是,在一些实施方案中,含卤化钙盐可包含至少0.01重量%的卤化钙盐。这可使得在熔融盐溶液中形成钙离子并与金属中的氧反应。二元盐诸如licl或kcl可降低盐混合物的总体熔点以形成低温反应环境。低温操作条件可提供许多优势,诸如能量需求较低;对反应容器造成的腐蚀性损害和热损害较低;反应容器材料和设备的选择更多;通过蒸发损失的钙脱氧剂减少;通过蒸发损失的钙脱氧剂减少可能实现连续敞口反应器生产;以及更易浸出、粉碎和保持金属粉末颗粒的原始尺寸和形态,这是因为颗粒之间发生的烧结更少。
因此,在一些示例中,使用两种盐的共晶混合物可实现比使用单一盐低的反应温度。但是,在一些情况下,使用单一盐可简化后续处理步骤,诸如在完成脱氧之后回收和循环利用盐。因此,在一些示例中,含钙盐可基本上仅为单一卤化钙盐。在一个示例中,含钙盐可为氯化钙。
根据本发明的方法可用于从对氧杂质敏感的多种金属中去除氧。适用于当前工艺的金属包括钛(ti)、氢化钛(tih2)、氧化钛(tio2)、铝(al)、钒(v)、铌(nb)、钽(ta)、锆(zr)、钨(w)、钼(mo)、铪(hf)、钍、铬、这些金属的合金,以及上述金属与一种或多种其他金属或非金属的合金。钛、铌、锆和钒可能需特别关注。反应性金属也可包括一些稀土金属诸如nd、dy,其氧化物形式比脱氧剂氧化物更不稳定。所列举反应性金属的反应性金属氢化物也可使用这些工艺进行脱氧。反应性金属氢化物可为上述金属的氢化物。在某些示例中,金属可为钛合金,诸如ti-6al-4v。在另外的示例中,金属可包括cp-ti、ti-6al-4v、钛屑、tio2、tih2、镍基高温合金或它们的组合。
在其他示例中,金属可为回收钛屑材料。在使用钛合金制造钛部件、结构和装置期间,常常会生成金属加工碎片。也可能仅是因为丢弃金属片而生成金属屑。钛屑(例如ti-6al-4v)和其他钛合金可用作源金属进行脱氧,以制造具有降低氧含量的钛材料。钛屑可经分选、清洁并准备以使用本文所述的方法进行处理。
金属或金属氢化物可为各种形式,包括大型或小型研磨制品或成品、碎屑材料、车床刨花、切屑、碎片、块体、粉末等。在一些实施方案中,金属可为金属粉末的形式。金属粉末可经脱氧,然后用于粉末冶金的各种方法中。金属粉末也可包括合金成分。例如,氢化钛粉末可与铝和钒粉末或al-v合金粉末(在行业内称为“母合金”粉末)以适当的量共混,以产生ti-6al-4v。用于ti的其他合金元素,包括fe、nb、zr、mo等,可共混以形成其他合金。
在某些示例中,金属粉末可用于增材制造方法,诸如激光烧结。在一些情况下,窄粒度分布和均一颗粒形状可有助于增材制造。因此,在一些示例中,金属粉末可具有窄粒度分布,使得金属粉末中多于约80%颗粒的粒度在金属粉末的平均粒度的20%内。金属粉末的平均粒度可为适合粉末冶金、增材制造中的特定应用或适合其他用途的任何尺寸。在一个示例中,金属粉末的平均粒度可为约1微米至约1000微米。又如,金属粉末的平均粒度可为约1微米至200μm,在一些情况下高达约10mm,并且在一些情况下高达3cm,并且在其他情况下高达5cm。如本文所用,对于球形颗粒,“粒度”是指粒径,或对于非球形颗粒,是指颗粒的最长维度或轴线。
在另外的示例中,金属粉末可以是大致球形的。在一个具体示例中,大致球形的金属粉末的平均颗粒纵横比小于1.5。在其他具体示例中,大致球形的金属粉末的平均颗粒纵横比小于1.2或小于1.1。如本文所用,“纵横比”是指颗粒的最长线性尺寸除以颗粒的最短线性尺寸。
可将金属、钙脱氧剂和含卤化钙盐组合,然后将该混合物加热至脱氧温度。或者,可将各成分单独加热,然后混合,或者可将这些成分的任何组合加热并以任何顺序混合。无论所用的具体混合和加热步骤如何,在一些实施方案中,金属、钙脱氧剂和含卤化钙盐可在脱氧温度下共存一段时间以降低金属的氧含量。因此,可在脱氧温度下加热混合物一段时间,或换句话讲,可施加热量以使混合物的温度升高至脱氧温度,以使混合物在脱氧温度下保持一段时间,或这两者。
在一些实施方案中,金属、钙脱氧剂和含钙盐可各自为丸粒或颗粒状材料。这些材料可混合在一起以提供含钙盐、金属和钙脱氧剂之间的良好接触。但是,在许多情况下,只需稍微混合或无需混合,因为含钙盐在脱氧过程中熔融,并且熔融盐提供了钙离子向金属颗粒扩散的良好速率,即使成分未完全混合。
图2示出了根据本发明的一个具体示例的脱氧系统200的示意性剖视图。反应容器210容纳钛粉末220、颗粒状钙230和熔融氯化钙240的混合物。在一些情况下,金属粉末可完全浸没在熔融盐内。但是,金属粉末不需要总是完全浸没在熔融盐中。例如,在每种粉末周围形成薄膜的少量盐可能足以完成脱氧。因此,在一些情况下,10重量%的盐便足够。在此示例中,钛粉末是待脱氧的金属,颗粒状钙是钙脱氧剂,并且氯化钙是作为熔融反应介质的含钙盐。熔融氯化钙与钛粉末和颗粒状钙两者接触。因此,由颗粒状钙形成的钙离子可扩散至钛粉末颗粒表面,以与来自钛粉末颗粒的氧反应。
在另外的实施方案中,可对金属、钙脱氧剂和含钙盐的量进行选择,以使得脱氧金属中的氧含量最低。所用钙脱氧剂的量可至少具有与待脱氧金属中的氧原子的摩尔量相当的钙原子摩尔量。每个钙原子与一个氧原子反应形成cao。因此,在一些示例中,钙脱氧剂中的钙原子与金属中的氧原子的摩尔比可为至少1。在另外的示例中,钙脱氧剂中的钙原子与金属中的氧原子的摩尔比为约1至约2,在一些情况下至3,并且在其他情况下至5。在一个具体示例中,摩尔比可为约1.1,以提供少量多余的钙原子。
所用含卤化钙盐的量不受特别限制。但是,在一些示例中,盐的量可足够多,使得在脱氧过程中,熔融盐与大部分金属颗粒和钙脱氧颗粒接触。在另外的示例中,含钙盐与金属的质量比可为约0.2至约1。在一个具体示例中,含钙盐与金属的质量比可为约0.5。
如上文所述,金属、钙脱氧剂和含钙盐的混合物可在脱氧温度下保持一段时间以降低金属的氧含量,从而形成脱氧金属。脱氧温度可高于含钙盐的熔点,但低于钙脱氧剂的熔点。在一些实施方案中,脱氧温度可为约400℃至约850℃,并且在一些情况下高达900℃。在另外的实施方案中,脱氧温度可至少高于含钙盐的熔点,在一些情况下至少高10℃,并且在其他情况下高30℃。
使脱氧温度降至最低具有诸如下列益处:能源使用降低;对反应容器造成的腐蚀性损害和热损害减小;钙脱氧剂的蒸发量减少;以及在脱氧过程中金属粉末颗粒的烧结减少。较低温度也可得到更纯的金属产物,因为在较高温度下一些杂质更有可能进入金属。例如,在1000℃下铁在钛中的扩散系数是在650℃下的100倍(5×10-11m2/sec与5×10-13m2/sec)。因此,在较低温度下进行脱氧时,杂质污染金属产物的可能性可大大降低。这样可扩大可用于脱氧的反应容器材料的选择范围。可在较高温度下污染钛或其他金属的材料诸如钢可在本发明方法的较低温度下使用,而几乎不污染脱氧金属。
另外,在一些情况下,较低温度可使得在脱氧金属中可达到的最终氧含量的热力学限值较低。图3为示出氧化铝(al2o3)、氧化镁(mgo)、氧化钙(cao)和具有不同氧含量的钛(以实线示出,其氧含量写在每条线旁边)的吉布斯能(δg)随温度变化关系的埃林汉姆图。根据cao和钛的吉布斯能,随着反应温度降低,钙可将钛的氧含量降低至较低水平。
在一些示例中,可将金属、钙脱氧剂和含钙盐的混合物加热至脱氧温度,然后等温保持一段时间以降低金属的氧含量,然而,在脱氧期间,某些温度波动也是可容许的。例如,脱氧温度可在含钙盐的熔点和钙脱氧剂的熔点之间的范围内变化。在一些示例中,可将脱氧温度保持在高于含钙盐的熔点约30℃的温度下。
一般来讲,可对发生脱氧的时间进行选择以实现任何期望水平的氧降低。在许多情况下,在约1分钟至约120小时的时间段之后,氧含量可降至可接受的水平。当颗粒具有相对较大粒度时,可采用较长时间。在一些情况下,时间段可为约1小时至约12小时。
脱氧可在受控的惰性或还原性气氛下进行。在一些示例中,受控气氛可包括流动或静止的氢气、氩气或它们的组合。在一个具体示例中,在h2气氛下进行在脱氧温度下加热混合物。又如,受控气氛包括h2和惰性气体混合气氛。虽然氩气通常可用作惰性气体,但也可使用其他惰性气体(例如稀有气体)。在另一示例中,加热混合物可包括在整个过程期间随氢气一起流动,在加热或冷却期间随氩气一起流动以及在等温保持期间随氢气一起流动,或者在加热、冷却和部分等温保持期间随氩气一起流动以及在部分等温保持期间随氢气一起流动。
如果使用还原性气氛,则在脱氧过程中,经脱氧的金属的一部分通常可转化成对应的金属氢化物。因此,产品脱氧金属可为金属氢化物,或者可进行另外的处理步骤以使金属氢化物脱氧。
在一个实施方案中,脱氧过程在氢气气氛中进行。据发现,在使用ca对ti脱氧的过程中,氢气的存在是特别有效的。氢气提高了热力学驱动力以及ca与ti中的氧之间的反应动力学。氢气的效应可如下推理。图4示出了ti和h之间的p-c-t关系。h2为β相稳定剂。例如,在1atmh2压力和750℃下,ti处于β相区内。从热力学上说,β-ti(o)的稳定性比α-ti(o)差。图5示出了在750℃下βti-0.2重量%o与αti-0.2重量%o相比存在约50kj/mol差异。另外,需要更低的活化能来使氧在β-ti(o)中扩散(138kj/mol,对于α-ti(o)为219kj/mol)。此外,氢气将钙转化成氢化钙,氢化钙为离子键化合物并具有类似盐的结构。在熔融形式中,氢化钙以ca2+和h-存在。另外,由于氢化钙作为离子键化合物溶解,因此它在其他盐(如氯化钙)中的溶解度很大。例如,氢化钙将与氯化钙反应形成氢化氯化钙。如图6中的氢化钙。氯化钙图所示,在750℃的反应温度下,存在由ca2+、cl-和h-组成的液体,该液体充当脱氧剂。在冷却至室温之后,盐由均匀地混合在一起的cah2+cahcl或cacl2+cahcl组成,由于cah2与h2o或cahcl与h2o之间发生剧烈反应,而不是cacl2溶解到h2o中,使得最终浸出步骤非常快。从动力学上讲,在500℃-800℃的范围内,o在β-ti中扩散的动力学与在a-ti相中相比提高了100倍,如图6所示。h2在这种体系中的总效应可示于图7中。h原子通过置于间隙位置中而使α-ti转化成β-ti,使得钛中的氧稳定性变差;h2与钙反应,以通过向钙提供h-来形成离子键化合物氢化钙;脱氧剂和具有一定氧含量的β-ti通过熔融盐连接,从而去除氧至相对较低水平并产生副产物cao。与图7类似,h2的脱氧机制可示于图8中。在一些情况下,正如在低于700℃的温度下,cahcl以固体形式存在。参见图8,氧化钛以及盐和ca脱氧剂示于步骤i和ii中。在步骤iii中,形成了熔融盐环境,并且钛材料内的氧从钛粉末(或其他钛材料)的中心位置扩散至外暴露表面,在该表面上发生所述的脱氧。
随着在ar中脱氧,钙可溶解到熔融盐中,从而与钛发生更有效的接触,ca2+可存在于该体系中以形成桥接,从而使ca易于溶解到盐中,如图9示意性地示出。因此,在ar中进行脱氧期间,盐可为含卤化钙盐。例如,氯化钙、溴化钙、碘化钙或这些盐的组合可用作一元盐。在一个方面,盐可由卤化钙盐组成。在一个具体示例中,卤化钙盐为氯化钙。或者,盐可包括卤化钙盐和至少一种另外的碱卤化物盐,使得其熔点降至低于脱氧剂的熔点(例如,广义上低于850℃)。
当在h2中脱氧时,钙转化成离子键化合物氢化钙,氢化钙在任何其他熔融盐中具有高溶解度,从而使ca2+和h-保留在熔融盐系统中。在这种情况下,盐组分中可省略ca2+,使得盐可为不含卤化钙的盐诸如碱卤化物盐。无论如何,低熔融温度盐用作介质以充当金属粉末和脱氧剂之间的桥梁。在氢气与氩气气氛中脱氧机制有所不同。例如,在ar中,包括ca2+。另外,如果反应温度高于盐的熔点,则可使用单一盐。例如,在800℃下,可使用单一cacl2盐(熔点:774℃)。如果需要较低温度,可使用二元盐甚至第三种盐(例如,三元共晶盐)来进一步降低熔融温度。二元盐和任何另外的盐可为熔点低于850℃的任何碱卤化物盐。更具体地讲,当使用ca时熔点低于842℃的盐,或当cah2用作脱氧剂时熔点低于816℃的盐。合适的碱卤化物盐可包括碱金属卤化物和碱土金属卤化物。合适的碱卤化物盐的非限制性示例可包括li、na、k、mg、ca的卤化物盐和这些盐的组合。对应卤素可包括cl、br和i,但cl可能最易得到。因此,碱卤化物盐的非限制性示例包括licl、kcl、cacl2、mgcl2和这些盐的组合。
相比之下,在h2气氛下,ca2+可通过可溶于多数盐中的离子键合盐cah2提供。因此,不影响脱氧的任何盐可与h2气氛一起使用,这些盐也具有低于脱氧剂熔点的熔点(例如,对于ca为842℃,或对于cah2为816℃)。碱卤化物盐可包括碱金属卤化物和碱土金属卤化物。合适的碱卤化物盐的非限制性示例可包括li、na、k、mg、ca的卤化物盐和这些盐的组合。对应卤素可包括cl、br和i,但cl可能最易得到。因此,盐的非限制性示例包括licl、kcl、cacl2、mgcl2和这些盐的组合。因此,在h2气氛中,盐可由卤化钙盐组成,但在一些情况下,盐可基本上不含钙(即,脱氧剂为钙源)。在一些情况下,在h2气氛下,可使用单一碱卤化物盐,诸如licl、cacl2、kcl或mgcl2。在一个具体示例中,盐可为licl。又如,在h2气氛中,盐可为二元或三元盐混合物,包括两种或更多种盐。在一个具体示例中,盐为mgcl2-licl混合物。值得注意的是,在h2气氛下,另外的盐可与碱卤化物盐组合使用,只要它们具有如本文所述适当低的熔点,在反应温度下作为液体存在并且不氧化金属即可。
当在h2中发生脱氧时,反应温度可低于所用盐的熔点。因为脱氧剂cah2也是一种盐,其可与所述盐反应以在所述盐的熔点之前形成某种共晶液体。例如,如cah2-cacl2盐中所示,在897k下,在cah2和cacl2之间存在共晶反应。因此,当使用cah2或在h2中使ca脱氧时,可考虑cah2对盐熔融的影响。例如,参见本文的实施例4和10,其中反应温度实际低于cacl2的熔点。此外,在一些情况下,气氛可包括氢气和氩气的混合物。
本发明方法可用于将金属的氧含量降低至商业上可接受的水平,即使起始氧含量高达14.3重量%(对于ti而言)。例如,钛中的氧含量按重量计可从高达20,000ppm降至低于1,000ppm,这超出了最高等级钛及其合金的要求。在另外的实施方案中,脱氧金属的氧含量可小于0.3重量%。在一些示例中,氧含量可小于0.15重量%或小于0.1重量%,以满足对具有极低含量间隙元素的金属的规格要求。例如,在eli级钛合金中,钛粉末的氧含量小于0.1重量%。较低氧含量也可允许在后续步骤(诸如采用粉末冶金法形成金属产品)中吸收氧。
在另外的示例中,本发明的脱氧方法可应用于氧含量为约0.2重量%至约40重量%的钛。在更多具体示例中,待脱氧金属的氧含量可为约0.2重量%至约3重量%。氧含量可降低至小于0.1重量%至小于0.3重量%的水平。因此,氧降低总量可为大于39.9重量%至约0.1重量%。
在脱氧过程之后,可将脱氧金属与含卤化钙盐、过量钙脱氧剂和在脱氧期间形成的cao分开。cao可在含有酸诸如hcl的水溶液中浸出,但其他浸出剂也可能是合适的。在一些示例中,金属可为金属粉末,并且该粉末可为松散的、能够流动的粉末,在浸出之后具有单独的颗粒。在一个具体示例中,最终脱氧产物可为氧含量小于0.3%或通常小于0.2%的球形钛或钛合金粉末。对于浸出,脱氧产物通常用水浸出以去除大多数盐和副产物cao。然后剩余副产物可用少量hcl或其他酸水溶液浸出。
在另外的示例中,本发明的脱氧方法可应用于来自多种源材料的钛粉末,诸如tih2、钛屑、tio2或其他形式的钛。另外,可使用任何粉末形态,诸如球形、不规则、颗粒状或其他粉末形态。
在一些示例中,脱氧金属可为部分烧结金属颗粒的易碎体形式。如果金属粉末经过脱氧并且颗粒在脱氧过程中变得部分烧结,则这种情况可能发生。当采用涉及金属颗粒部分烧结的方法制造金属粉末时,诸如通过使更小颗粒粒化并且部分地烧结钛颗粒而形成球形钛粉末时,这种情况也可能发生。在这类示例中,在进行脱氧过程之前,金属可为部分烧结体的形式。易碎体可经受球磨或其他压碎技术以断开烧结颗粒之间的接触。也可使用其他方法破碎易碎体。在一些示例中,破碎易碎体可得到大致球形的金属粉末。大致球形的粉末可包括球形或几乎球形的颗粒。球形或几乎球形的颗粒包括适合3d打印并且具有低纵横比的尺寸并且避免锯齿状或不规则形状的颗粒。
实施例
实施例1
在ar中,以cacl2作为熔融盐,使具有1.5重量%氧的ti粉末脱氧。将粒度为45-106μm、重10克的ti粉末与1克6目粒状钙和10克cacl2粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。将管式炉抽真空,接着用常规氩气吹扫,重复此操作三次,然后进行加热。接着,将管式炉以10℃/min的加热速率加热至800℃,并在流动ar气氛中保持12h。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,并用稀hcl浸出4小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物3次,并用乙醇冲洗,最后在真空下干燥。ti粉末的氧含量从初始值1.5重量%降低至最终浓度0.053重量%,降低了96.5%。
实施例2
在ar中,以cacl2-kcl共晶盐作为熔融盐,使具有4.98重量%氧的ti-6al-4v粉末脱氧。将粒度为25-106μm、重10克的ti-6al-4v粉末与1克6目粒状钙、8.5克cacl2粉末和1.5克kcl粉末混合,然后放入mo坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。将管式炉抽真空,接着用常规氩气吹扫,重复此操作三次,然后进行加热。接着,将管式炉以10℃/min的加热速率加热至750℃,并在流动ar气氛中保持15h。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,先用水浸出,再用稀乙酸浸出4小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空下干燥。粒状tih2的氧含量从初始值4.98重量%降低至最终浓度0.079重量%,降低了98.4%。
实施例3
在h2中,以cacl2-licl共晶盐作为熔融盐,使具有2.5重量%氧的ti粉末脱氧。将粒度为25-106μm、重10克的ti粉末与1克6目粒状钙、4.5克cacl2粉末、0.5克licl粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。将管式炉抽真空,接着用常规氩气吹扫,重复此操作三次,然后进行加热。接着,将管式炉以10℃/min的加热速率加热至700℃,并在流动h2气氛中保持4h。然后将管式炉冷却至室温,并用ar吹扫0.5小时,然后打开。随后从坩埚中取出所处理产物,先用水浸出,再用稀乙酸浸出1小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti粉末的氧含量从初始值2.5重量%降低至最终浓度0.12重量%,降低了95.2%。
实施例4
在ar和h2中,以cacl2共晶盐作为熔融盐,使具有2.5重量%氧的ti粉末脱氧。将粒度为25-106μm、重10克的ti粉末与3克6目粒状钙、5克cacl2粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。将管式炉抽真空,接着用常规氩气吹扫,重复此操作三次,然后进行加热。接着,将管式炉以10℃/min的加热速率加热至750℃,并在流动h2气氛中保持6h。然后将气体切换为ar。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,先用水浸出,再用稀乙酸浸出1小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti粉末的氧含量从初始值2.5重量%降低至最终浓度0.07重量%,降低了97.2%。
实施例5
在ar中,以cabr2-kbr共晶盐作为熔融盐,使具有1重量%氧的ti-6al-4v碎屑脱氧。将粒度<74μm、重10克的ti-6al-4v碎屑与2克6目粒状钙、9.5克cabr2粉末和0.5克kbr粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。在加热之前,将管式炉用常规氩气吹扫1h。接着,将管式炉以10℃/min的加热速率加热至800℃,并在流动ar气氛中保持1h。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,并用200ml稀hcl浸出4小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti-6al-4v碎屑的氧含量从初始值0.74重量%降低至最终浓度0.058重量%,降低了92.2%。
实施例6
在ar中,以cacl2-cabr2共晶盐作为熔融盐,使具有1重量%氧的ti-6al-4v-xh碎屑粉末脱氧。将粒度<74μm、重10克的ti-6al-4v-xh碎屑与2克6目粒状钙、7克cacl2粉末和3克cabr2粉末混合,然后放入钛坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。将管式炉抽真空,接着用常规氩气吹扫,重复此操作三次,然后进行加热。接着,将管式炉以10℃/min的加热速率加热至750℃,并在流动ar气氛中保持1h。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,并用200ml稀hcl浸出4小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti-6al-4v碎屑的氧含量从初始值0.74重量%降低至最终浓度0.0780重量%,降低了89.5%。
实施例7
在ar中,以cacl2-licl-kcl共晶盐作为熔融盐,使具有2重量%氧的ti-6al-4v碎屑脱氧。将粒度<74μm、重10克的ti-6al-4v-xh碎屑、2克6目粒状钙、5.66克cacl2粉末、1.22克kcl粉末和3.12克licl粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。将管式炉抽真空,接着用常规氩气吹扫,重复此操作三次,然后进行加热。接着,将管式炉以10℃/min的加热速率加热至600℃,并在流动ar气氛中保持4h。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,并用200ml稀hcl浸出4小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti-6al-4v碎屑的氧含量从初始值1.13重量%降低至最终浓度0.145重量%,降低了87.2%。
实施例8
以cacl2-kcl共晶盐作为熔融盐,使具有0.2重量%氧的nb-30重量%hf粉末脱氧。将粒度<37μm、重10克的nb-30重量%hf粉末、1克6目粒状钙、8.5克cacl2粉末、11.5克kcl粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。在加热之前,将管式炉用常规氩气吹扫1h。接着,将管式炉以10℃/min的加热速率加热至750℃,并在流动ar气氛中保持1h。然后将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,并用200ml稀hno3浸出4小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。nb-30重量%hf粉末的氧含量从初始值0.22重量%降低至最终浓度0.055重量%,降低了75%。
实施例9
在h2中,用licl盐使具有2.5重量%氧的ti粉末脱氧。
将粒度为25-106μm、重10克的ti粉末与3克6目粒状钙、5克licl粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。在加热之前,将管式炉用常规氩气吹扫1h。接着,将管式炉以10℃/min的加热速率加热至700℃,并在流动h2气氛中保持2h。然后用流动ar气氛将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,先用水浸出,再用稀乙酸浸出1小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti粉末的氧含量从初始值2.5重量%降低至最终浓度0.069重量%,降低了97.2%。
实施例10
在h2中,用mgcl2-licl盐使具有2.5重量%氧的ti粉末脱氧。
将粒度为25-106μm、重10克的ti粉末与3克6目粒状钙、4克mgcl2和1克licl粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。在加热之前,将管式炉用常规氩气吹扫1h。接着,将管式炉以10℃/min的加热速率加热至650℃,并在流动h2气氛中保持12h。然后用流动ar气氛将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,先用水浸出,再用稀乙酸浸出1小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti粉末的氧含量从初始值2.5重量%降低至最终浓度0.076重量%,降低了97.0%。
实施例11
在h2和ar气氛中,用cacl2盐使具有4重量%氧的ti-6al-4v粉末脱氧。
将粒度为45-106μm、重10克的ti-6al-4v粉末与4克6目粒状钙、5克cacl2粉末混合,然后放入不锈钢坩埚中。所有混合均通过手动振摇在干燥气氛下进行。将容纳有混合物的坩埚置于管式炉中。在加热之前,将管式炉用常规氩气吹扫1h。接着,将管式炉以10℃/min的加热速率加热至750℃,在流动h2气氛中保持2h,并在ar气氛中再保持2h。然后用流动ar气氛将管式炉冷却至室温并打开。随后从坩埚中取出所处理产物,先用水浸出,再用稀乙酸浸出1小时。将酸的ph值控制在2和5之间。然后用水洗涤所浸出产物三次,并用乙醇冲洗,最后在真空中干燥24h。ti粉末的氧含量从初始值4重量%降低至最终浓度0.063重量%,降低了98.4%。
上述具体实施方式和实施例参照具体示例性实施方案描述了本发明。然而,应当理解,在不脱离如所附权利要求中所述的本发明的范围的情况下,可进行各种修改和变化。具体实施方式和附图应视为仅仅是示例性的,而非限制性的,并且所有此类修改或更改(如果有的话)旨在落入如本文所述和示出的本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!