用于操纵细胞膜电位的石墨烯和石墨烯相关的材料的制作方法
本申请要求2014年6月17日提交的美国专利申请序列号61/998,089的优先权,该专利申请的内容以其全部内容结合在此。
背景技术:
细胞膜电位的变化是许多基本生理过程的基础,该基本生理过程包括心跳、脑功能、视觉和嗅觉转导、以及肌肉收缩。细胞经常使用电信号来彼此通信并根据外部线索改变其行为。
质膜确保一个细胞的结构完整性,并且将细胞内区室与细胞外环境物理分离。由于a)细胞内区室和细胞外区室之间的离子组成的显著差异以及b)包含细胞膜的磷脂双层的绝缘的物理特性,穿过该细胞膜存在电场(E场)梯度。在静息时,细胞内部的负电荷比外部更多,使得在不同类型的细胞中静息膜电位在-10至-80mV范围内。膜电位的变化可以由电信号和/或化学信号触发。确切地讲,这些信号引起电压门控离子通道或配体门控离子通道打开,从而引起膜渗透性的改变、离子在质膜的细胞内侧和细胞外侧的再分布、以及最终引起膜电位的改变。
控制膜电位就是控制一个细胞的激活状态。膜电位的变化可以引起多种下游效应,因为这些变化与此类基本功能紧密相关联,这些基本功能诸如细胞兴奋性、通过电压依赖性磷酸酶进行的蛋白质翻译后修饰、激素分泌、离子稳态、蛋白质表达的调节、以及细胞增殖。在可兴奋细胞(例如,神经元或心肌细胞(CM))中存在特殊情况,其中膜电位的相对较小的变化可以被扩大,并且以一种协同方式导致多种离子通道类型的链式激活,从而引起动作电位的产生。即使在不可兴奋细胞中,膜电位的变化也引起电化学离子梯度和离子浓度的变化,该变化可以触发许多看似电压无关的过程。
许多需要用于操纵细胞膜电位的先进方法的体外应用包括健康和疾病中的分子机制的基础研究;电压敏感性膜蛋白的功能探测;细胞间通信的研究,包括突触可塑性;心脏病相关的项目;视觉和嗅觉转导途径;用于细胞置换疗法的干细胞衍生细胞的生产和表征;干细胞衍生细胞的激活依赖的成熟和分化;以及候选药物评估其潜在的心脏毒性并支持个性化医疗的发展的高通量筛选。
用于操纵细胞膜电位的新方法也将在体内应用中在需要增强在疾病进展过程中受损的内源性激活触发的情况下极其有用。例如,对CM的膜电位的控制可以帮助克服错误的电信号传导,并因此控制异常心律。在色素性视网膜炎或年龄相关性黄斑变性过程中的光感受器的退化可以通过光驱动的电刺激视网膜中的下一行完整细胞进行补偿,从而潜在地引起视觉感知的恢复。刺激神经元可以帮助补偿患有脑血管疾病、神经退行性疾病和精神疾病的患者中的神经元活动方面的缺陷。
电生理学是控制细胞膜电位的最直接且最精确的方法。总体上,通过基于电极的技术(例如,膜片吸量管、多电极阵列或E-电场刺激)进行的电生理刺激表现出对细胞膜电位的一种高度控制。然而,这些技术具有显著的缺点,诸如有限的空间选择性、侵入性、低通过量、对自动化的低顺从性、以及当前多电极材料的一般机械刚度。此外,由于固定电极在经历正常生理运动的细胞中引起的损伤,基于电极的技术甚至不太适合于收缩CM的研究。
引起膜电位变化的化学方法利用此类方法诸如应用一种“高K+”细胞外溶液或药理学离子通道开放剂。该方法的关键性缺陷包括膜电位缺乏控制、引起的变化不可逆以及低时间和空间分辨率。
光学刺激方法利用光束作为执行器,并且因此,可以允许对细胞膜电位进行长期非侵入性控制。然而,现有的方法受制于严重的固有缺陷。该类别中最古老的方法之一是对化学修饰的信号分子光触发地“解除笼蔽(uncaging)”,这些信号分子诸如谷氨酸、ATP、多巴胺、5-羟色胺,环核苷酸。尽管该方法的时间分辨率是高的,但是其空间分辨率由于“解除笼蔽”分子从释放位点的扩散而受到限制。另外,“笼蔽”化学品显示前体不稳定性、光毒性,并且需要强烈的UV照射。并且,“解除笼蔽”过程是不可逆的和非迭代的。
最新且最有希望的光学刺激方法光遗传学是使用遗传编码的具有固有光敏感性或工程化光敏感性的跨膜蛋白。光遗传学允许以空前的时空精度控制在所选择的细胞亚群中的膜电位。然而,为了提供光介导的控制,光遗传学需要表达外源的功能活性蛋白,该蛋白成为细胞内机器的一个组成部分。换言之,研究者必须改变一个细胞的生理学以便能够控制其行为,这在使用干细胞衍生细胞的研究中可能是有害的。光遗传学的若干种技术挑战已经在过去几年的蛋白质工程和广泛工具开发的一个多重迭代过程中得到解决。然而,该方法固有一些问题:1)光遗传学不提供生理刺激,因为离子通量和初始膜电位变化由外源蛋白的特性而不是内源离子通道来决定。2)为了实现所期望的膜电位的变化,需要高表达水平的光敏感性蛋白。3)在许多情况下,添加内源性辅因子全反式视黄醛或可光致异构化合物对于光遗传学蛋白的光敏感性功能是必需的。4)光遗传学不适合于药理学分析新药物,因为它们可以替代感兴趣的靶标或除了感兴趣的靶标之外直接影响视蛋白。
材料科学:光诱导的神经元的电激发已经使用由无机块状半导体、半导体纳米颗粒和有机半导体聚合物制成的衬底来证明。例如,在硅晶片上培养的神经元可以被光激活,因为在穿过晶片施加的特定电压的存在下,光诱导的硅传导率的变化可以触发神经元中的电容瞬变,导致它们的膜去极化。遗憾的是,1)该平台不透明,并且因此与光学检测方法具有有限的相容性;2)在精密控制装置中非常昂贵且非常刚性的硅晶片极大地限制了其适用性;3)由光电流扩展的直径限定的空间分辨率≥50μm。这些问题中的一些在其中光敏层由有机半导体聚合物的一种混合物制成的一种衬底中得到解决。与一种基于硅的衬底相比,该平台不需要任何外部装置,表现出低热耗散性,并且在灵活性和制造简单性方面具有更大的潜力。其缺点包括a)由于低透明度和可见光范围激发而与光学检测的不相容性;以及b)由于聚合物层的机械脆性而潜在的小型化问题。基于半导体纳米颗粒的另一个光学刺激平台在其制造过程中提供最高程度的工程灵活性,但是由于纳米颗粒中的含镉成分的存在而具有有限的生物相容性。
总之,需要用于远程刺激细胞的新技术工具。最佳的生理刺激工具应该能够快速地、可逆地并且重复地改变膜电位;能够控制这些变化的幅度、持续时间和方向;能够最小程度地侵入并且与非侵入性检测方法相容。
为了满足这些要求,可以考虑具有合适特性的新材料。基于石墨烯的材料或石墨烯相关的材料(这里,术语“基于石墨烯的”和“石墨烯相关的”是可互换使用的)的家族最近在2010年诺贝尔物理学奖之后成为焦点,并且随后爆发了这些材料在能源、电子、传感器、光处理、医学、以及环境领域中的许多应用的发展。石墨烯,该家族的“起源”成员,是由以一种六边形蜂窝晶格排列的sp2-杂化的碳原子构成的一种二维材料。石墨烯相关的材料的扩展家族包括石墨烯(单层的和多层的)、石墨、多环芳烃、碳纳米管、富勒烯、不同尺寸的各种石墨烯纳米结构(例如,石墨烯纳米颗粒、或石墨烯量子点、石墨烯纳米带、石墨烯纳米网;石墨烯纳米盘;石墨烯泡沫;石墨烯纳米柱)、其他石墨烯相关的材料的任何组合、取代的石墨烯相关的材料(例如,用N、B、P、S、Si或其他原子取代碳原子)、以及用反应性官能团(羧基基团、酯、酰胺、硫醇、羟基基团、二醇基团、酮基团、磺酸酯基团、羰基基团、芳基基团、环氧基团、酚基团、膦酸、胺基团、卟啉、吡啶、聚合物以及其组合)官能化的石墨烯相关的材料。石墨烯相关的材料的具体实例包括氧化石墨烯(GO)、氧化石墨和还原性氧化石墨烯(rGO)。
石墨烯和石墨烯相关的材料表现出非凡的电子、机械和光学特性,这可以使得它们在各种生物医学应用中是无价的,这些生物医学应用包括构建用于使用电磁辐射远程刺激细胞的一种生物相容性界面。石墨烯是高度惰性的和化学稳定的,这产生优异的生物相容性。石墨烯独有的特性包括高电导率、高载荷子迁移率、优异的机械特性(例如,高刚度、强度和弹性)、高热导率、宽带吸收以及在可见光谱上的高透明度。此外,通过追求许多路线之一来调整用于特定应用的石墨烯的电子和光学特性是可能的,这些路线诸如改变石墨烯片的堆叠模式、改变石墨烯结构的形状、取代石墨烯晶格中的碳原子以及官能化石墨烯。
石墨烯具有零带隙,从而导致具有低于~3.5eV的能量的入射光的宽带吸收。这意味着具有高光吸收系数(7×105cm–1)的石墨烯可以有效地检测300至2500nm范围内的光的波长,该波长包括整个可见光谱、红外区以及甚至太赫兹区。
单层石墨烯是高度透明的,且在整个可见光谱中具有2.3%的吸收,并且在紫外线中具有超越~10%的吸收峰。当石墨烯吸收光子时,它通过经由光电机制和/或光电热机制产生光生激子将光子的能量转化成电流。由于单层石墨烯中的低光吸收和光生载荷子的短复合寿命(在皮秒的数量级上),石墨烯的光响应度略低(<10mAW-1),引起~6%-16%的低内量子效率。
GO是具有大量含氧官能团的一种高度氧化的石墨烯相关的材料。与具有零带隙和高电导率的石墨烯相反,GO是具有带隙>3.5eV和极差电导率的一种宽带隙半导体。含氧官能团的去除导致光学带隙从>3.5eV降低到<1eV,光吸收增加并且电导率恢复。该还原过程产生称为rGO或化学转化的石墨烯的另一种石墨烯相关的材料。虽然石墨烯和其他非官能化的石墨烯相关的材料(例如石墨、碳纳米管和富勒烯)是疏水的,但由于含氧官能团的存在,GO是亲水的。rGO是中度亲水的,因为rGO中剩余的含氧官能团的数目低于高度氧化的GO中含氧官能团的数目。
在目前石墨烯及其衍生物的生物医学应用中,它们用于组织工程学、抗细菌治疗、药物和基因递送、以及用作生物成像的造影剂。例如,结合石墨烯相关的材料作为用于细胞培养的平面支架或三维支架的结构元件极大地增强细胞粘附,改善细胞增殖,加速细胞成熟的速率,增强神经突出芽和向外生长,并且支持在干细胞分化过程中的神经元谱系。这些应用不仅利用纯石墨烯及其衍生物,而且利用它们具有不同纳米结构(例如,半导体量子点、碳纳米管)、蛋白质(例如,壳聚糖)、聚合物(例如,聚(碳酸亚丙酯))或其他化学实体(例如,PEG)的混合型纳米复合材料。据建议,石墨烯相关的材料对产生有利细胞的微环境的积极作用是基于它们的机械特性、微尺度地形特点和表面化学特征。
所有现有的生物医学应用均利用石墨烯及其衍生物的被动稳态特性。目前,没有利用外部刺激来主动改变石墨烯相关的生物界面的物理化学特性并随后改变与这些界面相互作用的细胞的功能状态的应用。
技术实现要素:
披露了一种包含石墨烯相关的材料的生物相容性界面(G-生物界面)用于在体外和体内操纵细胞膜的电性质的用途。
在一个实施例中,一个生物相容性界面可以包括石墨烯相关的材料的一种或多种结构。在另一个实施例中,石墨烯相关的材料可以用一种或多种化学实体掺杂、官能化和/或补充。在一个实施例中,G-生物界面可以被用作独立结构。在其他实施例中,G-生物界面结构可以沉积在一个衬底上。
在另一实施例中,一种经由G-生物界面操纵膜电位的方法可以包括以下步骤:在一个G-生物界面附近定位一个生物学靶标,并且将一个G-生物界面暴露于电磁刺激。在一个实施例中,电磁刺激可以是可见光谱电磁刺激。
一种执行生物学测定的方法可以包括以下步骤:经由一个G-生物界面引起膜电位变化,并且使用一种或多种检测方法监测所得变化。在一个实施例中,检测方法可以是光学方法,当与用于操纵膜电位的光激活的G-界面组合时,这些光学方法可以导致探测生物活性的全光学测定。在一个实施例中,检测方法可以是遗传学方法。在一个实施例中,检测方法可以是电生理学方法。
一种治疗患有医学病状的动物的方法可以包括以下步骤:向动物施用G-生物界面结构,并且将G-生物界面暴露于电磁刺激;其中该医学病状是各种病理学病状中的任一种,包括但不限于阿尔茨海默病;帕金森氏病;肌萎缩侧索硬化症;亨廷顿氏病;化疗诱导的神经病变;年龄相关性脑障碍;唐氏综合征;自闭症谱系障碍;大脑麻痹;癫痫和其他癫痫发作;情感障碍、抑郁症、TBI/PTSD/CTE(慢性创伤性脑病)以及其他压力、创伤或爆炸相关的损伤或疾病;精神分裂症和其他精神障碍;疼痛、痛觉过敏和伤害感受障碍;成瘾病症;神经元缺血;神经元再灌注损伤;神经元创伤;神经元出血;神经损伤;神经元感染;中风;癌症;心血管病症;心律失常;心力衰竭;心肌症;风湿性心脏病;冠状动脉疾病;先天性心脏病;眼病;年龄相关性黄斑变性;色素性视网膜炎;青光眼;糖尿病视网膜病变;钙稳态病症;胰高血糖素瘤;糖尿病;低血糖症;肾上腺病症;甲状腺病症;生长障碍;代谢性骨病;性激素失调;性功能障碍。
附图说明
为了更全面地理解本披露以及其优点,现在参考结合描述本披露的具体实施例的附图的以下说明,其中:
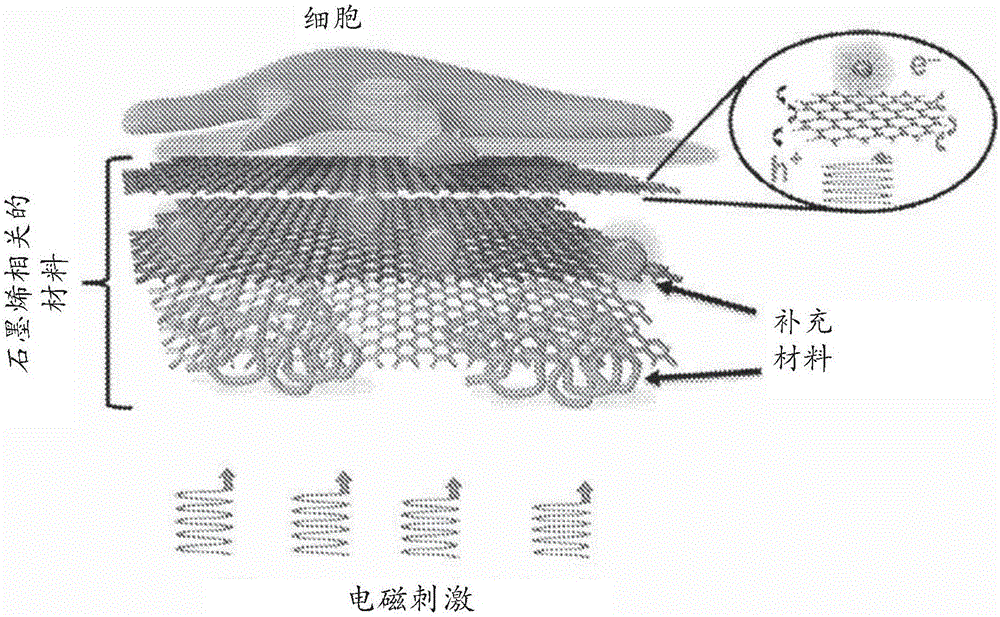
图1示出了在一个生物相容性的光电界面中利用石墨烯和石墨烯相关的材料以使用电磁刺激实现细胞的远程刺激的一般策略。
图2示出了在用石墨烯(左图)和rGO(右图)涂覆的玻璃盖玻片上的CM的明视场光学显微镜图像(A)和扫描电子显微镜图像(B)。
图3示出了基于rGO的衬底的高生物相容性。在不均匀的衬底上培养的CM的明视场光学显微镜图像(左图)和荧光光学显微镜图像(右图)中的CM长期培养物,正如所标记的(上部分是玻璃,而下部分是rGO涂覆的表面)。将CM用核染料赫斯特(Hoechst)(蓝色)和胞质染料钙黄绿素(绿色)标记。(B)通过评估在玻璃上培养的CM相对于在rGO涂覆的表面上培养的CM的归一化细胞密度(左图)和膜完整性(右图)来评价细胞活力。细胞密度被计算为归一化至在玻璃盖玻片上培养的细胞的对照值的在视野中的细胞数目。膜完整性值表示为在用钙黄绿素-AM和乙锭同二聚体-1(EthD-1)染色后显示荧光信号的细胞的百分比。数据表示为平均值±s.e.m.(每种条件n≥100个细胞)。
图4示出了在以下不同实验条件下光照射(蓝条)对CM中自发收缩的频率的影响:(A)在石墨烯涂覆的玻璃盖玻片上的CM的长期培养物、(B)在rGO涂覆的玻璃盖玻片上的CM的长期培养物、(C)rGO薄片与在“裸”玻璃盖玻片上培养的CM的短期界面连接。使用明视场显微镜图像来产生代表性迹线,该迹线反映了由于CM收缩而引起的在细胞边缘附近的光密度的变化。
图5示出了光照射对在玻璃盖玻片(A)和rGO涂覆的玻璃盖玻片(B、C)上培养的CM的动作电位的影响。垂直条,10mV。
图6示出了在rGO涂覆的玻璃盖玻片上培养并用Fluo4(一种荧光钙敏感性指示剂)标记的多个CM中的细胞内钙浓度的光触发变化的单个迹线。
图7示出了在rGO涂覆的玻璃盖玻片上涂布的诱导性多能干细胞(iPSC)衍生的神经元的长期培养物,如通过明视场光学显微镜图像(A)和扫描电子显微镜图像(B)所表示的。
图8示出了iPSC衍生的神经元的rGO涂覆的玻璃盖玻片的优异的生物相容性。(A)用钙黄绿素-AM和EthD-1对在玻璃盖玻片(左图)和rGO涂覆的玻璃盖玻片(右图)上培养的神经元染色以分别标记活细胞(绿色)和死细胞(红色)。(B)细胞活力实验的总结。数据表示为平均值±s.e.m.(每种实验条件n≥100个细胞)。
图9示出了光照射对在rGO涂覆的玻璃盖玻片上培养的神经元的膜电位的影响。(A)实验方案:使用光激活神经元,并且使用电生理学方法监测接着发生的电活动。(B)在rGO涂覆的玻璃盖玻片上的神经元中的光触发动作电位。
图10示出了对于在rGO涂覆的玻璃盖玻片上培养的神经元中的细胞内钙离子分布的光触发效应。(A)实验方案:使用光激活神经元,并且使用光学方法监测接着发生的细胞内钙离子浓度的变化。(B)在rGO涂覆的玻璃盖玻片上培养并用Fluo4(一种荧光钙指示剂)标记的多个神经元中的细胞内钙的光触发变化的各个迹线。
具体实施方式
本披露不限于所描述的特定系统、装置和方法,因为这些可以改变。在本说明中所用的术语是出于仅描述特定版本或实施例的目的,并不旨在限制其范围。
除其他事项之外,本披露呈现了基于石墨烯相关的材料的纳米结构生物相容性可切换界面、制备此类生物界面的方法、利用此类生物界面用于细胞的生产、探测和表征的方法、利用此类生物界面用于药理学分析细胞和化学实体的方法、以及使用此类生物界面治疗患有医学病状的动物的方法。
一般设计策略是基于如图1中所示的以下事件链。1)在暴露于电磁刺激过程中,石墨烯相关的材料吸收其能量,引起激子的产生,该激子随后分离成电子和空穴。2)由于细胞膜和石墨烯相关的材料的表面之间的电容耦合效应,来自G-生物界面的光生成自由载流子(例如,电子)置换在石墨烯/细胞膜界面附近的阳离子。3)此类电荷在细胞膜外部的重分布触发了细胞膜电位的变化。G-生物界面的大界面电容提供了一种有效的电容刺激。因此,在G-生物界面附近的外部光生成E-电场与跨膜E-电场梯度的相互作用导致细胞的非侵入性远程刺激。
G-生物界面中的石墨烯相关的材料总体上可以是来源于石墨烯的任何材料或可以使用各种制造、官能化或取代的方法转化为石墨烯的任何材料。石墨烯相关的材料的家族包含石墨、石墨烯、多环芳烃、取代的石墨烯相关的材料(其中一些碳原子被此类原子诸如N、B、P、S、Si或其他原子取代)以及用此类官能团诸如羧基基团、酯、酰胺、硫醇、羟基基团、二醇基团、酮基团、磺酸酯基团、羰基基团、芳基基团、环氧基团、酚基团、膦酸、胺基团、卟啉、吡啶、聚合物及其组合官能化的石墨烯相关的材料。官能化的石墨烯的实例是含有多个含氧官能团的GO。官能化的石墨烯的另一个实例是rGO,其通过从GO中除去至少一些含氧官能团来产生。
石墨烯相关的材料可以具有任何维度。在石墨烯的情况下,零维纳米结构的实例包括石墨烯纳米颗粒或石墨烯量子点;一维纳米结构的实例是石墨烯纳米带;二维纳米结构的实例是石墨烯片和石墨烯纳米网;三维纳米结构的实例是石墨,该石墨是一种石墨烯片堆叠;碳纳米管,该碳纳米管是一个或多个卷起的石墨烯片;富勒烯,该富勒烯是多个卷绕的石墨烯片;石墨烯泡沫;以及石墨烯纳米柱。
结合到G-生物界面中的任何石墨烯相关的材料可以单独使用或者可以是不同维度的不同石墨烯相关的材料的不同层数目的杂化组合的一部分。
石墨烯相关的材料可以与各种补充材料组合以便设计G-生物界面中的特定特性。此类特性可以包括增加的吸收效率、期望的光谱激活曲线、p型或n型官能性、开关切换的速度、可加工性、耐久性、相容性、电导性、用于产生特定生物界面的可能的化学官能化、以及一种三维配置。补充材料的实例可以包括由金属(例如,金、银、铁、氧化铁、二氧化钛、镧系氧化物、过渡金属、以及过渡金属氧化物)、石墨烯样材料(例如,二硫化钼、二硫化钨、二硒化铌、以及氮化硼)、半导体、二氧化硅、聚合物、或其组合制成的结构。
石墨烯相关的材料可以与聚合物组合,这些聚合物包括但不限于细胞外基质的天然存在的组分(例如,胶原、纤连蛋白和层粘连蛋白)或合成聚合物(例如,聚苯胺、聚吡咯和聚噻吩)。
石墨烯相关的材料可以用作没有任何外部结构支撑的独立结构,或直接沉积在衬底上。它们也可以与可提供独立结构支撑的其他材料组合。一个G-生物界面的特定空间构型可以通过利用各种石墨烯相关的材料的固有维度并且通过结合合适的补充材料来实现。
在X-Y平面中G-生物界面的外部尺寸的范围可以是从纳米尺寸(例如,一个纳米尺寸的石墨烯薄片)至仅受到制造能力限制的宏观尺寸。在X-Y平面中的最小尺寸是1nm×1nm。沿着Z轴的外部尺寸依赖于结合到G-生物界面中的石墨烯相关的材料的层数。沿着Z轴的最小尺寸由非官能化的石墨烯单层的厚度(0.34nm)限定。
靶标可以是一个或多个完整细胞、一种或多种细胞级分、或一种或多种人工膜结构。细胞级分的实例包括任何管腔细胞器,诸如细胞核、核糖体、线粒体、内质网、高尔基体、液泡、突触小泡以及溶酶体。人工膜结构的实例包括磷脂胶束、微米胶囊和纳米胶囊、以及支撑结构上的半液体膜。
一个或多个细胞总体上可以是具有膜和膜电位的任何类型的细胞。例如,这些细胞可以是细菌(革兰氏阳性或革兰氏阴性)、真核生物、原核生物、真菌、昆虫、鸟类、爬虫类、卵母细胞、蝇、斑马鱼、鱼、线虫、两栖动物、或哺乳动物细胞。这些方法还可以用在非细胞材料上,诸如人工膜、脂质体和磷脂双层。原代哺乳动物细胞的实例包括人类、小鼠、大鼠、狗、猫、熊、驼鹿、牛、马、猪、或中国仓鼠卵巢(“CHO”)细胞。细胞类型的其他实例包括免疫系统细胞(例如,B细胞、T细胞)、卵母细胞、红细胞、白细胞、神经元、CM、上皮细胞、神经胶质细胞、成纤维细胞、干细胞、癌细胞、分泌细胞、以及永生化细胞。
为了经由G-生物界面进行激活,细胞必须接触石墨烯相关的材料的表面或与该表面紧密接近地定位。为了实现此种定位,可以将细胞添加至G-生物界面中,或者可以将G-生物界面添加至细胞中。
在适当定位细胞之后,G-生物界面必须暴露于电磁刺激,该电磁刺激包括但不限于可见光谱、射频频谱、红外、微波、太赫兹频率、或其组合。例如,G-生物界面暴露于可见光谱(即,光)的电磁波可以通过基本上任何照射方法来执行,这些照射方法包括但不限于激光、汞灯、氙灯、卤素灯照射、或LED照射。
经由G-生物界面刺激细胞可以与其他刺激方式组合,这些其他刺激方式包括但不限于电刺激、磁刺激、化学刺激、生物刺激、或其组合。
G-生物界面可以用于研究引起细胞分化、迁移、增殖和激发-神经发生偶联以指导干细胞衍生的神经元的活性依赖性成熟和分化的过程。在其他实施例中,G-生物界面可以用于产生特定成熟度的干细胞衍生细胞。此类干细胞衍生细胞可以是患者特异性细胞。干细胞类型包括胚胎干细胞、成体干细胞和iPSC。细胞的实例包括但不限于神经元、CM、光感受器、成纤维细胞、内皮细胞、胰腺细胞、肌肉细胞、分泌细胞、脂肪细胞、间充质干细胞、以及骨形成干细胞。
G-生物界面也可以用于有益于神经再生研究,其通过依靠轴突向外生长的激活刺激的加速来促进神经损伤后的功能恢复;并且有益于神经假体开发,其经由与用于治疗日益依赖于电刺激技术的神经病症的神经元网络整合。
经由G-生物界面远程刺激细胞可以与用于监测细胞活性的光学方法组合。光输出信号可以使用明视场光学显微镜和/或荧光光学显微镜获取,并且是无标记实验或细胞荧光标记的结果。荧光染料和/或荧光蛋白可以用于对光激活的活细胞中的各种事件进行实时成像,这些事件诸如使用Ca2+敏感性荧光指示剂的细胞内钙的变化或使用电压敏感性荧光探针的膜电位的变化。可替代地,G-生物界面刺激的细胞的光学测定可以是终点测定,其中固定的细胞经由免疫组织化学方法来分析。光信号总体上可以使用任何合适的光测量仪器或光积累仪器监测。此种仪器的实例包括照相机、数码相机、CCD相机、CMOS相机、视频装置、CIT成像、安装在显微镜上的任何数码相机、光电倍增器、荧光计、光度计、分光光度计、以及甚至人眼。
经由G-生物界面远程刺激细胞可以与细胞活性的电学记录组合,这些电学记录包括但不限于膜片钳技术、平面电生理系统、微电极阵列、场晶体管、以及碳纳米管。
既然除了提供细胞的刺激之外,生物界面可以同时用于使用成像模态或电模态或其组合来记录细胞活性,那么G-生物界面可以用于与细胞双向通信。
经由G-生物界面远程刺激细胞可以与它们随后的遗传分析组合,该遗传分析包括但不限于PCR、RT-PCR、DNA测序、下一代测序、DNA微阵列、核型分析、荧光原位杂交、量热原位杂交、或其组合。
经由G-生物界面的细胞刺激可以使得能够在许多研究过程中监测细胞的功能活性,这些研究包括a)在神经元网络中突触可塑性的研究;b)在许多神经病症诸如帕金森氏病、阿尔茨海默病、孤独症、以及肌萎缩侧索硬化症中表现的感觉和运动受损中的机制的研究;c)心脏研究;d)胰腺病症的研究。
G-生物界面可以用于药理学分析细胞。在这种情况下,在具有未知遗传构成的细胞上测试基准化合物,同时通过电磁辐射G-生物界面来控制细胞膜电位,并且使用任何可用的检测方法监测细胞反应。
G-生物界面可以用于药物发现筛选应用,即新型化学实体的药理学表征。在这种情况下,将由G-生物界面控制的不同激活状态的良好表征的细胞暴露于新化学实体,并且使用任何可用的检测方法监测细胞反应。重要的是,G-生物界面可以通过在药物筛选过程中提供对细胞的膜电位的控制来简化有效用途依赖性和活性依赖性药物的开发,并且因此有利于表征中靶效应和脱靶效应并且有利于检测新化合物在各种激活状态的各种细胞类型中的潜在毒性。
G-生物界面可以用于治疗患有医学病状的动物。通过电磁辐射与受影响细胞和区域紧密相邻地定位的G-生物界面来触发的细胞膜电位的变化可以有助于克服在疾病进展过程中细胞活性降低或消除的后果。可以通过G-生物界面治疗的疾病的实例包括但不限于心律失常、心脏损害后的减损、神经变性/神经病症、各种眼科病症、以及内分泌病症。
实例
在此披露和要求保护的所有组合物和/或方法和/或过程根据本披露内容无需过度实验即可完成和执行。尽管已经以优选实施例的方式描述了本发明的组合物和方法,但是对本领域技术人员而言将显而易见的是,可以对在此描述的组合物和/或方法和/或过程以及在步骤或者在方法的步骤的顺序中进行变化,而不脱离本发明的概念和范围。更确切地,将显而易见的是,化学和生理学相关的某些试剂可以代替在此描述的试剂,同时将实现相同或相似的结果。对于本领域技术人员而言显而易见的所有此类类似的替换和修改被认为在本发明的范围和概念之内。
实例1:石墨烯相关的材料
在具有10cm×11cm尺寸的25μm厚的铜箔(阿法埃莎公司(Alpha Aesar),13382,99.8%)上合成石墨烯。在石墨烯生长之前,通过以下步骤清洁铜箔:在一个浅丙酮浴中浸泡、在丙酮中机械清洁、转移到一个填充有异丙醇(IPA)的类似浴中、在IPA中机械清洁、在一个压缩空气流中干燥、电解抛光、用DI水和IPA冲洗、以及在一个压缩空气流下吹干。在具有以下管尺寸的一个石英管式炉(MTI OTF-1200X-HVC-UL)中执行大气压CVD石墨烯合成:d=7.6cm,l=100cm。
在实验中,使用氧化石墨烯(例如,来自Graphenea Inc.)和还原的氧化石墨烯,该还原的氧化石墨烯通过化学还原(例如使用水合肼、硼氢化钠或L-抗坏血酸)或热还原氧化的石墨烯相关的材料来生产。在一些情况下,化学还原之后是热还原。
通过化学还原产生rGO的一个典型实验包括向100mL超声处理的GO水溶液(1mg/mL)中添加1mL水合肼,接着在95℃下孵育所得混合物1小时,并且随后过滤。
通过化学还原产生rGO的另一个典型实验包括在室温下向100mL超声处理的GO水溶液(1mg/mL)中添加100mg L-抗坏血酸,接着剧烈搅拌48小时,并且离心。
实例2:G生物界面的制造
在使用Triton X-100溶液清洁玻璃盖玻片(VWR)2小时后,将它们在乙醇中彻底洗涤并静置在UV光下干燥2小时。
为了开始将石墨烯转移到玻璃盖玻片上,首先用2.5%w/w聚(甲基丙烯酸甲酯)(PMMA)在甲苯中的溶液在4000rpm下旋涂具有CVD生长的石墨烯的膜的铜箔60s。在旋涂之后,使用氧等离子体清洁器(30s,30W,200微托氧压)蚀刻在该铜箔与PMMA相对的一侧上的暴露的石墨烯。接着,将PMMA/石墨烯涂覆的该铜箔漂浮在1M氯化铁(III)(FeCl3)浴中30分钟,以便蚀刻铜。然后将自由漂浮的PMMA支撑的石墨烯分三次转移至DI水浴中,并且然后通过从该DI水浴中“舀取”独立膜放置到盖玻片上。在室温下干燥2小时后,将盖玻片放置在丙酮浴中过夜以除去PMMA。接着,将盖玻片在IPA中冲洗并在压缩空气中干燥。
在一个典型的实验中,通过液滴沉积(每12mm盖玻片10μL)将通过化学还原GO产生的rGO放置在玻璃盖玻片上。接着,将rGO覆盖的盖玻片空气干燥30分钟,并且然后放置在UV细胞培养罩中灭菌过夜。可替代地,通过a)将GO液滴沉积在如上所述的玻璃盖玻片上,并且然后b)经由将它们放置在烘箱的层上(T=200℃)5分钟以在玻璃盖玻片上直接进行GO热还原来生产rGO涂覆的盖玻片。
为了制造一种rGO涂覆的96孔微量滴定板,将20mL 0.1mg/mL的通过使用L-抗坏血酸化学还原制备的rGO溶液沉积到一个标准96孔微板(赛默飞世尔科技(ThermoFisher Scientific))的每个孔中。随后,将rGO涂覆的板干燥并在UV细胞培养罩中灭菌过夜。
实例3:细胞培养步骤
通过四因子重编程序产生iPSC并使其分化为NPC。然后将NPC培养物放置在培养箱内用20μg/ml聚-L-鸟氨酸(西格玛公司(Sigma))涂覆过夜接着用5μg/ml层粘连蛋白(西格玛公司)涂覆至少2小时的塑料盘上,或者直接放置在石墨烯涂覆的玻璃盖玻片上,该玻璃盖玻片进一步用100μg/ml聚-L-鸟氨酸涂覆接着用10μg/ml层粘连蛋白涂覆。将NPC维持在补充有N2(生命技术公司(Life Technologies))、B27(生命技术公司)、Pen/Strep和20ng/ml成纤维细胞生长因子(FGF)(密理博(Millipore))的含有DMEM-F12+Glutamax(生命技术公司)的NPC基础培养基中。每2或3天更换培养基。一旦NSC达到融合,从培养基中取出FGF并维持5周,每周更换两次培养基。在3周分化后,使用细胞表面抗原标志对神经元进行FACS-纯化:使用1:1混合物Accutase/Accumax(创新性细胞技术(Innovative Cell Technologies))对分化的神经元进行分离,并且用CD184、CD44和CD24抗体(BD生物科学(BD Biosciences))进行染色。选择对CD184和CD44呈阴性染色并对CD24呈阳性染色的神经元,并将该神经元涂布在补充有0.5mM dbCAMP(西格玛公司)、20ng/mL BDNF和20ng/mL GDNF(派普泰克公司(Peprotech))的NPC基础培养基中的聚鸟氨酸/层粘连蛋白处理的石墨烯涂覆的盖玻片上。
根据制造商的说明书解冻iCell CM(细胞动力国际公司(Cellular Dynamics International))。将25μL细胞悬浮液(160,000个细胞/mL)添加到明胶涂覆的384孔板中。然后将这些细胞使用5%CO2在37℃下静置48小时。在48小时后,向总共100μL的每个孔中添加75μL化学成分确定的培养基(CDM),并且然后每隔一天更换一半体积。当培养10-14天后CM开始其自发收缩时,将CM用胰蛋白酶提取,并以每12mm盖玻片500,000个细胞的密度重新涂布。在实验前将CM在盖玻片上培养2-3周。
实例4:CM和G-生物界面的生物相容性
对于生物相容性的评估,比较在使用和未使用石墨烯相关的材料涂覆的情况下在玻璃盖玻片上培养的细胞的形态、细胞密度和膜完整性。明视场光学显微镜图像显示当在用石墨烯和rGO涂覆的玻璃盖玻片上培养时,CM显示正常形态(图2A)。为了获得额外的理解,进行扫描电子显微镜(SEM)实验。对于这些实验,将CM用0.1M磷酸盐缓冲液(pH 7.4)洗涤,在室温下用4%甲醛溶液固定2小时,并用相同缓冲液洗涤三次,每次5分钟。在用梯度系列的乙醇(50%乙醇-10分钟,70%乙醇-10分钟,80%乙醇-10分钟,95%乙醇-10分钟内更换2次,100%乙醇在15分钟内更换3次)脱水后,将所有样品在真空室中冷冻干燥,并用溅射的铱涂覆。在XL30ESEM-FEG(FEI)上以10mm工作距离同时使用10kV能量束来获取扫描电子显微镜图像。SEM图像显示CM与石墨烯涂覆的和rGO涂覆的玻璃衬底都成功地界面连接(图2B)。
为了评估细胞密度,使用明视场光学显微镜图像计算预定义面积中的细胞数目(图3A)。确定CM优选石墨烯和rGO涂覆的表面。图3B(左图)显示在rGO涂覆的玻璃盖玻片上的细胞密度显著高于在“裸”玻璃盖玻片上的细胞密度。
为了评估细胞活力,使用含有膜可渗透钙黄绿素-AM和膜不可渗透乙锭同二聚体-1(EthD-1)的活力/细胞毒性试剂盒(生物技术公司)。当用该试剂盒染色时,具有完整细胞膜和高水平酶活性的活细胞呈现绿色,这是由于非荧光的钙黄绿素-AM被酶促转化成绿色钙黄绿素并且排斥EthD-1。相反,EthD-1仅进入具有受损膜的死细胞,并在结合核酸时产生红色荧光信号。使用装备有标准过滤器(荧光素(对于钙黄绿素)、罗丹明(对于EthD-1)和DAPI(对于赫斯特))和一个QICLick CCD照相机(QImaging Inc.)的Olympus IX71荧光显微镜随机拍摄标记的细胞的图像。使用ImageJ图像分析软件分析数据。细胞死亡被计算为EthD-1阳性细胞数目除以EthD-1阳性和钙黄绿素阳性细胞数目之和的百分比。确定在涂覆衬底上相对于“裸”衬底上培养的细胞中的膜完整性没有统计学差异(图3B,右图)。
为了测试在G-生物界面上培养CM是否有益于它们的功能活性,采用明视场光学显微镜以使用无标记方法监测CM的自发收缩。为了检测CM在其收缩过程中发生的构象变化,在CM边缘之外选择感兴趣的区域(ROI),以确保ROI内部的光强度将会由于自发收缩而改变。通过计算每1秒的收缩数目来定量频率。发现当在G-生物界面上培养细胞时,CM的收缩频率更高。
实例5:G-生物界面和CM中的光触发效应
使用实例4中描述的无标记方法,在以下两种实验配置中研究G-生物界面的光照射对CM的自发收缩的影响:a)当将CM在rGO涂覆的玻璃盖玻片上培养2-3周时的“长期”(或慢性)连接,以及b)当在实验前将在对照(例如,未涂覆的)盖玻片上培养的CM在rGO薄片上直接沉积10分钟时的“短期”(或急性)界面连接。发现在慢性(图4A,B图)和急性(图4C)实验配置中光照射均引起CM的收缩频率增加。
使用电生理方法,监测在用石墨烯相关的材料涂覆的玻璃盖玻片的表面上培养的细胞的膜电位的光触发变化。在一个典型的实验中,将rGO涂覆的盖玻片置于填充有一种电生理细胞外溶液的实验腔室中,该电生理细胞外溶液由以下各项(以mM为单位)组成:NaCl,135;KCl,2.5;CaCl2,2;NaHCO3,1;Na2HPO4,0.34;KH2PO4,0.44;葡萄糖,20;HEPES,10;和甘氨酸,0.01(pH 7.4)。具有3-6MΩ最终尖端电阻的膜片吸量管填充有一种溶液,该溶液由以下各项(以mM为单位)组成:CsCl,120;氯化四乙铵,20;HEPES,10;EGTA,2.25;CaCl2,1;MgCl2,2(pH 7.4)。使用Digidata 1322界面、Axopatch200B放大器和pClamp软件(分子设备公司(Molecular Devices Corp.))获取所有记录。确定光照射不影响在“裸”盖玻片上培养的CM(图5A),但是确实触发在rGO涂覆的盖玻片上的CM中的膜去极化,导致动作电位列的发起(图5B)或动作电位生成频率的增加(图5C)。
一种全光学测定法将光触发的细胞激活(例如,通过G-生物界面)与监测细胞活性的光学方法(例如,使用荧光生物传感器)组合。在一个典型的实验中,将CM用5μM Fluo-4AM(一种钙敏感性荧光指示剂(赛默飞世尔科技))或2μM VF1.2(一种电压敏感性染料)在CO2培养箱中在装载缓冲液(132mM NaCl;4.2mM KCl;1.8mM CaCl2、5mM d-葡萄糖、10mM HEPES;调节至pH 7.4)中装载45分钟。为了执行全光学测定,使用在520nm处的高强度光的短脉冲以激活G-生物界面,并且使用在480nm处的低强度光连续照射以激发荧光染料。在装备有荧光素过滤器组(激发480/20nm,散发525/30nm)的直立光学荧光显微镜上进行成像实验。使用一个CCD照相机在30Hz下持续数秒进行获取图像,并且使用ImageJ软件进行分析。在实验中,检测到由于在CM中产生光触发动作电位而出现的细胞内钙浓度的变化(图6),并且证实结合用于光控制激活细胞的G-生物界面的全光学测定的可行性。
实例6:神经元和G-生物界面的生物相容性
使用明视场光学显微镜和SEM评估在用石墨烯相关的材料涂覆的玻璃盖玻片上培养的iPSC衍生神经元的形态(图7)。确定iPSC衍生神经元在rGO涂覆的玻璃盖玻片上培养6周后不改变它们的形态。
为了评估iPSC衍生的神经元和rGO涂覆的玻璃盖玻片的生物相容性,使用活力/毒性试剂盒(生物技术公司)进行活力实验。分析如实例4所述的结果,并且确定rGO涂覆的玻璃盖玻片上的细胞活力高于“裸”玻璃盖玻片上的细胞活力(图8)。
实例7:G-生物界面和神经元中的光触发效应
根据实例5中描述的实验计划进行关于iPSC衍生神经元的电生理学研究(图9A)。确定如在CM中光照射触发神经元中的膜去极化,引起动作电位的生成(图9B)。
为了执行神经元活性的全光学探测,通过用光照射它们的rGO涂覆的衬底来激活神经元,并使用Fluo-4(一种荧光钙敏感性指示剂)监测它们的光触发活性(图10A),如实例6所述的。成功地记录仅在rGO涂覆的衬底上培养的神经元中通过光照射触发电活动的过程中的细胞内钙的变化(图10B)。
实例8:统计分析
数据表示为平均值±s.e.m.当合适时,使用具有施图登特-纽曼-柯尔斯(Student-Newman-Keuls)(SNK)事后检验的单向ANOVA解释结果。用施图登特氏检验评定基因型/处理之间的成对比较。P<0.05处的差异被认为具有统计学显著性。
在以上详细说明中,参考了构成该详细说明的一部分的附图。除非上下文另外规定,否则在附图中,相似的符号典型地标识相似的组件。在详细说明、附图以及权利要求书中描述的示意性实施例并非意在具有限制性。在不脱离在此所提供的主题的精神或范围的情况下,可以使用其他实施例,并且可以进行其他改变。将容易理解的是,如总体上在此描述的和在附图中示出的,本披露的方面可以各种各样的不同配置来安排、替换、组合、分离和设计,所有这些在此均明确考虑在内。
本披露不限于本申请中描述的特定实施例,这些实施例旨在作为各个方面的说明。在不脱离其精神和范围的情况下,可以进行许多修改和变化,如将对于本领域技术人员而言显而易见的。根据以上说明,除了在此列举的那些之外,在本披露的范围内的功能等同方法和装置对于本领域技术人员而言将是显而易见的。此类修改和变化旨在属于所附权利要求的范围之内。本披露仅由所附权利要求的条款以及这些权利要求所赋予的等同物的全部范围来限制。应当理解的是,本披露不限于特定的方法、试剂、化合物、组合物或生物系统,它们当然可以变化。还应理解的是,在此使用的术语仅出于描述具体实施例的目的,而并不意图进行限制。
除非上下文另外明确规定,否则如本文件中所用,单数形式“一个/种(a)”、“一个/种(an)”以及“该(the)”包括复数指代物。除非另外定义,否则在此所用的所有技术性和科学性术语具有与本领域中技术人员通常所理解的相同意思。本披露中的任何内容都不应被解释为承认本披露中描述的实施例不会由于在先发明而早于这些披露内容。如本文件中所用,术语“包括”是指“包括但不限于”。
尽管以“包括”各种组分或步骤(解释为表示“包括但不限于”)的方式描述了各种组合物、方法和装置,但是这些组合物、方法和装置也可以“基本上由各种组分或步骤组成”或“由各种组分或步骤组成”,并且此类术语应当被解释为定义基本上封闭的成员组。
关于基本上任何复数和/或单数术语在此的使用,本领域技术人员可以在对上下文和/或应用适当时将复数转变成单数和/或将单数转变成复数。为了清晰起见,在此可以清晰地阐述各种单数/复数的转换。
本领域技术人员将理解的是,一般来说,在此使用且尤其在所附权利要求书(例如,所附权利要求书的主体)中使用的术语总体上旨在为“开放式”术语(例如术语“包括(including)”应该被解释为“包括但是不限于”,术语“具有”应该被解释为“至少具有”,术语“包括(includes)”应该被解释为“包括但是不限于”等等)。本领域的普通技术人员另外将理解的是,如果意指特定数目的一种所引入的权利要求陈述,那么将在该权利要求中明确陈述这种意图,并且在这类陈述不存在下,不呈现这种意图。例如,为了帮助理解,以下所附权利要求书可以含有介绍性短语“至少一个”和“一个或多个”的使用以引入权利要求陈述。然而,使用这类短语不应被视为暗示由不定冠词“一个(种)”引入一个权利要求陈述会将含有此类引入的权利要求陈述的任何具体权利要求限制为仅包含一个此类陈述的实施例,即使当同一权利要求包括介绍性短语“一个(种)或多个(种)”或“至少一个(种)”以及不定冠词诸如“一个(种)”时(例如,“一个(种)”应该解释为“至少一个(种)”或“一个(种)或多个(种)”)。这对用于引入权利要求陈述的定冠词的使用同样适用。另外,即使明确地陈述一个所引入的权利要求陈述的特定数目,本领域的技术人员将会认识到此陈述应当解释为意味着至少该陈述的数目(例如,在无其他修饰语的情况下仅陈叙“两个陈述”意味着至少两个陈述,或者两个或更多个陈述)。此外,在使用类似于“A、B和C中的至少一项等等”的惯例的情况下,总体上此种构造旨在处于本领域技术人员应当理解该惯例的意义上(例如,“一种具有A、B和C中的至少一项的系统”将包括但是不限于单独具有A、单独具有B、单独具有C、具有A和B一起、具有A和C一起、具有B和C一起、和/或具有A、B和C三者一起等等的系统)。在使用类似于“A、B或C中的至少一项等等”的惯例的情况中,总体上此种构造旨在处于本领域技术人员应当理解该惯例的意义上(例如,“一种具有A、B或C中的至少一项的系统”将包括但是不限于单独具有A、单独具有B、单独具有C、具有A和B一起、具有A和C一起、具有B和C一起和/或具有A、B和C三者一起等等的系统)。本领域技术人员将进一步理解的是,无论是在说明书、权利要求书或附图中,呈现两个或更多个替代性术语的几乎任何分隔性词语和/或短语都应当理解为考虑到包括这些术语中的一者、这些术语中的任一者或这两个术语的可能性。例如,短语“A或B”应理解为包括“A”或“B”或“A和B”的可能性。
另外,在以马库西(Markush)组的方式描述本披露的特征或方面的情况下,本领域技术人员将认识到,本披露也由此以马库西组的成员的任何单独成员或子组进行描述。
如本领域技术人员将理解的,出于任何和所有目的,诸如在提供书面说明方面,在此披露的所有范围也包括任何和所有可能的子范围及其子范围的组合。任何列出的范围可以容易地被认为是充分地描述该同一范围并且使得该范围分成至少相等的二分之一、三分之一、四分之一、五分之一、十分之一等。作为一个非限制性实例,在此讨论的每个范围可以容易地分解为下三分之一、中三分之一和上三分之一等。如本领域技术人员还将理解的是,诸如“多至”、“至少”等所有语言包括所陈述的数字,并且是指可以随后分成如上所述的子范围的范围。最后,如本领域技术人员将理解的,一个范围包括每个单独的成员。因此,例如,具有1-3个细胞的组是指具有1、2或3个细胞的组。类似地,例如,具有1-5个细胞的组是指具有1、2、3、4或5个细胞的组,等等。
可以将各种上文披露的和其他的特征和功能或其替代方案组合到许多其他不同的系统或应用中。本领域技术人员随后可以进行各种当前未预见的或未预期的替代、修改、变化或改进,它们各自也旨在由所披露的实施例包括在内。
- 还没有人留言评论。精彩留言会获得点赞!