癌干细胞群及其制备方法与流程
本发明涉及实质上去除了没有癌形成能的细胞且具有再现癌组织等级结构特征的癌干细胞群、以及该癌干细胞群的制备方法。本发明还涉及使用移植了该癌干细胞群的非人动物模型、或该癌干细胞群在体外条件下的培养体系的药物的靶分子探索方法、药物的评价方法、或药物的筛选方法。
背景技术:
以往,持有等级结构的癌被认为是处于各种分化阶段的癌细胞进行自我复制而形成大的肿瘤块。但近年来,已经逐渐明确由兼有自我复制能和多分化能的分化初期的有限的癌细胞形成癌。这被称为癌干细胞模型,而癌干细胞的存在,在血液癌、脑肿瘤、乳癌、大肠癌等各种癌中已得以报告。在癌干细胞模型中,人们提倡癌由分化不相同的、不均质的群构成,而唯有有限的细胞、即癌干细胞持有形成新癌的能力。另一方面,有时不持有等级结构且由单克隆的细胞群形成的CML或血液癌、或者上皮系的低分化癌等的癌形成细胞也被称为癌干细胞,然而由于它们虽具有自我复制能却不具有等级结构形成能(多分化能),因此脱离于上述的癌干细胞模型,产生关于癌干细胞定义的混乱。例如,在2008年,Quintana等人通过使用欠缺B细胞、T细胞以及NK细胞的高度免疫缺陷小鼠的实验,报告几乎所有的人黑色素瘤细胞具有肿瘤形成能(非专利文献1),然而这些细胞由于不具有多分化能而不分化,因此不应该包含在癌干细胞内,而应该仅被称为癌形成细胞。至今,就形成等级结构的癌干细胞的分离、浓缩而言,要么通过使用CD133或CD44等的癌干细胞标志物的流式细胞术进行,要么通过将癌细胞使用包含FGF或EGF等的干细胞培养基进行悬浮培养的方法来进行。由于流式细胞术法对操作中的细胞产生损坏,加上用于癌干细胞标志物的CD133或CD44不是癌干细胞特异性的表面标志物,因此作为高纯度制备未受损伤的癌干细胞的手法仍存在问题。事实上,已知在利用流式细胞术法由持有等级结构的癌采集到的癌干细胞群中,若通过有限稀释对于癌形成能进行评价,则癌干细胞频率仅为1/262左右,包含大量癌干细胞之外的细胞(非专利文献2)。另外,有报告称:由悬浮培养形成的球形体(细胞团)包含形成具有等级结构的癌的癌干细胞,然而构成球形体的细胞群为不均质的、癌干细胞频率为1/240左右且大量共存着癌干细胞之外的细胞(非专利文献3)。因此,由于癌干细胞的纯度较低,故使用这些细胞群来明确持有等级结构的癌干细胞的性质是困难的。另外,有人报告通过将人癌组织移植到免疫缺陷的动物中重复传代来浓缩癌干细胞的方法(非专利文献4),然而在胰腺癌中用此方法最浓缩的癌干细胞频率为1/180左右。另外,下述例子被报告:使用干细胞标志物的p75NTR,从向人子宫颈部上皮细胞导入人乳头瘤病毒癌基因而无限增殖化的细胞株中分离p75NTR阳性细胞,在包含TGFβ和TNFα的培养基中进行粘附培养(专利文献1),然而这些细胞也未形成等级结构,为不属于癌干细胞范畴的癌形成细胞。因此,至今为止,高纯度且大量地制备形成等级结构的癌干细胞的方法仍属未知,而对其开发的要求非常强烈。现有技术文献专利文献专利文献1:特开2008-182912;非专利文献非专利文献1:QuintanaE.等,Nature.2008年12月4日;456(7222):593-8;非专利文献2:O'BrienCA.等,Nature.2007年1月4日;445(7123):106-10;非专利文献3:VermeulenL.等,NatCellBiol.2010年5月;12(5):468-76;非专利文献4:IshizawaK.等,CellStemCell.2010年9月3日;7(3):279-82。
技术实现要素:
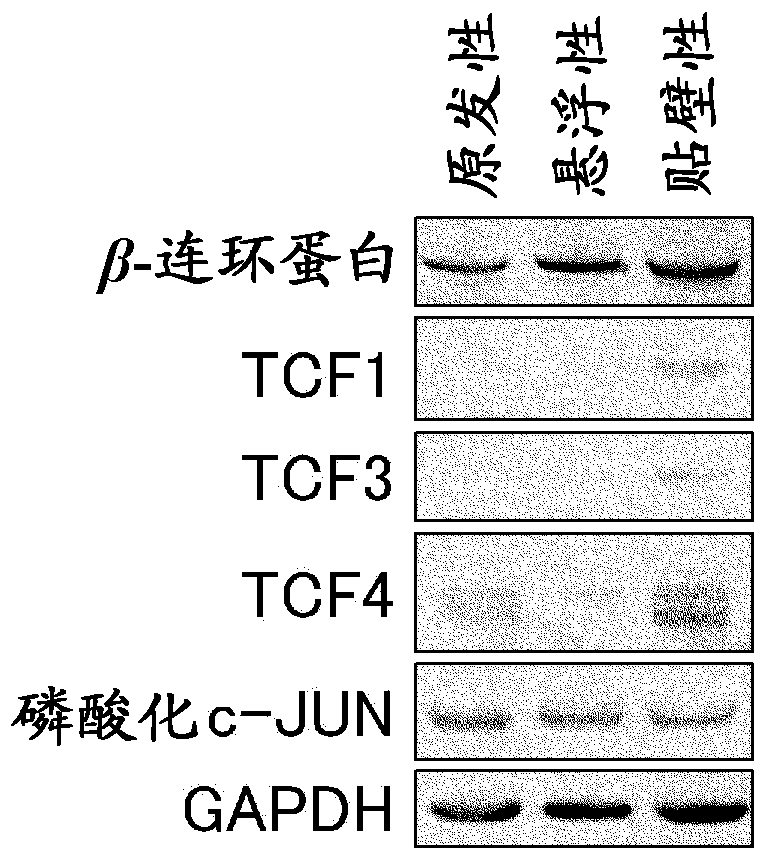
发明所要解决的课题本发明的课题在于提供癌干细胞群,所述癌干细胞群为实质上去除了没有癌形成能的细胞的癌干细胞群,具有再现癌组织等级结构的特征。另外,本发明的课题还在于提供制备实质上去除了没有癌形成能的细胞的癌干细胞群的方法,该方法包含贴壁培养包含癌干细胞的细胞群的步骤。并且,本发明的课题还在于提供使用移植了该癌干细胞群的非人动物模型、或该癌干细胞群在体外条件下的培养体系的药物的靶分子探索方法、药物的评价方法、或药物的筛选方法。解决课题的方法本发明人为了解决上述课题,进行了深入的研究。本发明人利用高度免疫缺陷小鼠确立癌细胞株,使用该确立细胞株,对持有等级结构的癌和不持有等级结构的癌进行比较、分析。并且,在属于癌干细胞模型的持有等级结构的癌中,由于不存在该癌干细胞的分离、浓缩、均质化、大量培养的方法,所以对分析或使用癌干细胞的药剂的筛选等产生障碍,因此本发明人试图解决该问题。至今为止,本发明人通过将人癌组织移植到不持有功能性T细胞、B细胞、自然杀伤细胞的NOD/SCID/γcnull小鼠(FujiiE.等,PatholInt.2008;58:559-567)(以下,该小鼠以及NSG小鼠(NOD-scid,IL-2Rgnull小鼠)在本申请中称为“NOG小鼠”)中,确立了多个人癌细胞株。由于这些株在NOG小鼠皮下重复进行传代也仍构建与原始癌组织具有相同形态的癌组织,因此认为能够在细胞群中保存人癌干细胞。因此,通过NOG小鼠可以进行传代的人癌干细胞是非常有用的研究工具。本发明人利用NOG小鼠使人癌组织反复生长,分离癌细胞后,比较了各种培养法。其结果,不通过一般采用的悬浮培养法,而通过使用不含血清的干细胞培养基的贴壁培养法,成功地得到了均质、且具有癌形成能的细胞和没有癌形成能的细胞实质上不共存的癌干细胞组合物,从而完成了本发明。对于由本方法得到的癌干细胞,通过使用不含血清的干细胞培养基进行传代的贴壁培养,能够稳定地维持,使其持续1个月以上也不产生表现型的变化。该细胞表达迄今报告的各种大肠癌干细胞标志物(CD133、CD44、EpCAM、CD166、CD24、CD26和CD29),并且以几乎为100%的频率显示癌形成能,再构建了与原本的原发性肿瘤具有相同的组织病理学特性(等级结构)的肿瘤。另外,该细胞具有在贴壁培养条件下显示高增殖性、且作为细胞表面标志物的Lgr5为阳性的特征。另外,高增殖性且Lgr5阳性的癌干细胞,由于从小鼠尾静脉注射时在肺或肝脏等脏器内形成了肿瘤块,因此显示出对于癌的转移起着重要作用。另一方面,通过将贴壁培养条件下显示高增殖性且作为细胞表面标志物的Lgr5为阳性的癌干细胞进行悬浮培养、或利用依立替康或5-FU等的抗癌药处理,能够分离出低增殖性且Lgr5为阴性的癌干细胞。该细胞也同样显示了高的癌形成能。并且,显示出:通过分离低增殖性且Lgr5为阴性的癌干细胞并再次在贴壁培养条件下培养,该癌干细胞会变化为高增殖性且Lgr5为阳性的癌干细胞。由此显示出:高增殖性且Lgr5阳性的癌干细胞和低增殖性且Lgr5阴性的癌干细胞能够相互变换,具有自我交替功能。更具体而言,本发明提供以下〔1〕~〔33〕。〔1〕癌干细胞群,其为实质上去除了没有癌形成能的细胞的癌干细胞群,具有再现癌组织等级结构的特征。〔2〕〔1〕所述的癌干细胞群,其特征在于,上述癌干细胞来自人肿瘤组织。〔3〕〔2〕所述的癌干细胞群,其特征在于,上述人肿瘤组织为来自上皮癌的肿瘤组织。〔4〕〔3〕所述的癌干细胞群,其特征在于,上述上皮癌为胰腺癌、前列腺癌、乳癌、皮肤癌、消化道癌、肺癌、肝细胞癌、子宫颈癌、子宫体癌、卵巢癌、输卵管癌、阴道癌、肝癌、胆管癌、膀胱癌、输尿管癌、甲状腺癌、肾上腺癌、肾癌、或其它腺组织的癌。〔5〕〔1〕~〔4〕中任一项所述的癌干细胞群,其特征在于,该癌干细胞群实质上为均质的。〔6〕〔1〕~〔5〕中任一项所述的癌干细胞群,其特征在于,在极限稀释分析中癌干细胞的频率为1/20以上。〔7〕〔1〕~〔6〕中任一项所述的癌干细胞群,其特征在于,该癌干细胞群包含1x104个以上的癌干细胞。〔8〕〔1〕~〔7〕中任一项所述的癌干细胞群,其特征在于,该癌干细胞群通过包括下述步骤的方法制备,所述步骤为贴壁培养包含癌干细胞的细胞群。〔9〕〔1〕~〔8〕中任一项所述的癌干细胞群,其特征在于,该癌干细胞群通过包括下述(1)~(3)步骤的方法制备:(1)将包含癌干细胞的细胞群移植到属于相同或不同种的非人动物中,制备癌细胞团的步骤;(2)细分所制备的癌细胞团的步骤;以及(3)使用干细胞培养基对通过(2)的步骤获得的细胞群进行贴壁培养的步骤。〔10〕〔1〕~〔9〕中任一项所述的癌干细胞群,其特征在于,上述非人动物为裸小鼠、SCID小鼠、NOD-SCID小鼠、NOG小鼠、或裸大鼠中的任一种。〔11〕制备实质上去除了没有癌形成能的细胞的癌干细胞群的方法,该方法包括:贴壁培养包含癌干细胞的细胞群的步骤。〔12〕〔11〕所述的方法,其特征在于,上述包含癌干细胞的细胞群为再现癌组织等级结构的细胞群。〔13〕〔12〕所述的方法,其特征在于,上述再现癌组织等级结构的细胞群为在非人动物中确立的癌细胞株、球形体、或选自癌干细胞标志物CD24、CD29、CD34、CD44、CD49f、CD56、CD90、CD117、CD133、CD135、CD166、CD184、CD271、CD326、Aldefluor、ABCG2、ABCG5、LGR5和Msi1的至少一个以上的标志物为阳性的细胞。〔14〕〔11〕~〔13〕中任一项所述的方法,其特征在于,在进行贴壁培养之前,使包含癌干细胞的细胞群增殖。〔15〕〔14〕所述的方法,其特征在于,通过球形体培养使包含癌干细胞的细胞群增殖。〔16〕〔14〕所述的方法,其特征在于,通过移植到非人动物中并进行传代而使细胞群增殖。〔17〕〔11〕~〔16〕中任一项所述的方法,其特征在于,上述癌干细胞来自人肿瘤组织。〔18〕〔17〕所述的方法,其特征在于,上述人肿瘤组织为来自上皮癌的肿瘤组织。〔19〕〔18〕所述的方法,其特征在于,上述上皮癌为胰腺癌、前列腺癌、乳癌、皮肤癌、消化道癌、肺癌、肝细胞癌、子宫颈癌、子宫体癌、卵巢癌、输卵管癌、阴道癌、肝癌、胆管癌、膀胱癌、输尿管癌、甲状腺癌、肾上腺癌、肾癌、其他腺组织的癌。〔20〕〔11〕~〔19〕中任一项所述的方法,其特征在于,上述非人动物为裸小鼠、SCID小鼠、NOD-SCID小鼠、NOG小鼠、或裸大鼠中的任一种。〔21〕药物的靶分子探索方法,其特征在于,在移植了〔1〕~〔10〕中任一项所述的癌干细胞群的非人动物模型中、或该癌干细胞群在体外条件下的培养体系中,以由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性为指标进行评价。〔22〕〔21〕所述的药物的靶分子探索方法,其特征在于,包括下述(1)~(4)所述的步骤:(1)通过将〔1〕~〔10〕中任一项所述的癌干细胞群移植到非人动物中,来制备非人动物模型的步骤;(2)采集组织片的步骤,所述组织片显示该癌干细胞群的癌进展过程中特征性所见的组织结构或显示其生物学特性;(3)对(2)中采集的组织片研究DNA、RNA、蛋白质、肽或代谢产物的表达的步骤;和(4)鉴定组织片中的依据由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性而改变的DNA、RNA、蛋白质、肽或代谢产物的步骤。〔23〕〔21〕所述的药物的靶分子探索方法,其特征在于,包括下述(1)~(3)所述的步骤:(1)将〔1〕~〔10〕中任一项所述的癌干细胞群在体外条件下培养,再现由癌干细胞开始的癌进展过程的特征结构、或癌干细胞的生物学特性的步骤;(2)研究再现了特征结构的培养细胞的DNA、RNA、蛋白质、肽或代谢产物的表达的步骤;和(3)鉴定培养细胞中依据由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性而改变的DNA、RNA、蛋白质、肽和代谢产物的步骤。〔24〕〔21〕~〔23〕中任一项所述的方法,其特征在于,上述药物为抗癌药。〔25〕〔21〕~〔24〕中任一项所述的方法,其特征在于,上述靶分子为癌细胞标志物。〔26〕药物的评价方法,其特征在于,在移植了〔1〕~〔10〕中任一项所述的癌干细胞群的非人动物模型中、或该癌干细胞群在体外条件下的培养体系中,以由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性为指标进行评价。〔27〕〔26〕所述的药物的评价方法,其特征在于,包括下述(1)~(5)所述的步骤:(1)通过将〔1〕~〔10〕中任一项所述的癌干细胞群移植到非人动物中,来制备非人动物模型的步骤;(2)将被测物质给予(1)的非人动物模型的步骤;(3)采集组织片的步骤,所述组织片显示由癌干细胞开始的癌进展过程中特征性所见的组织结构或显示其生物学特性;(4)观察组织片中的癌干细胞的经时变化、癌进展过程、或其生物学特性的步骤;和(5)鉴定由于被测物质而受抑制的由癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤。〔28〕〔26〕所述的药物的评价方法,其特征在于,包括下述(1)~(4)所述的步骤:(1)将〔1〕~〔10〕中任一项所述的癌干细胞群在体外条件下培养,再现由癌干细胞开始的癌进展过程的特征结构、或癌干细胞的生物学特性的步骤;(2)利用被测物质处理(1)的培养细胞的步骤;(3)观察由癌干细胞形成的等级结构的改变、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤;和(4)鉴定由于被测物质而受抑制的由癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤。〔29〕药物的筛选方法,其特征在于,在移植了〔1〕~〔10〕中任一项所述的癌干细胞群的非人动物模型中、或该癌干细胞群在体外条件下的培养体系中,以由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性为指标进行评价。〔30〕〔29〕所述的药物的筛选方法,其特征在于,包括下述(1)~(5)所述的步骤:(1)通过将〔1〕~〔10〕中任一项所述的癌干细胞群移植到非人动物中,来制备非人动物模型的步骤;(2)将被测物质给予(1)的非人动物模型的步骤;(3)采集组织片的步骤,所述组织片显示由癌干细胞开始的癌进展过程中特征性所见的组织结构或显示其生物学特性;(4)观察组织片中的癌干细胞的经时变化、癌进展过程、或其生物学特性的步骤;和(5)鉴定被测物质的步骤,所述被测物质抑制由特定癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性。〔31〕〔29〕所述的药物的筛选方法,其特征在于,包括下述(1)~(4)所述的步骤:(1)将〔1〕~〔10〕中任一项所述的癌干细胞群在体外条件下培养,再现由癌干细胞开始的癌进展过程的特征结构、或癌干细胞的生物学特性的步骤;(2)利用被测物质处理(1)的培养细胞的步骤;(3)观察由癌干细胞形成的等级结构的改变、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤;和(4)鉴定被测物质的步骤,所述被测物质抑制由特定癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性。〔32〕〔26〕~〔31〕中任一项所述的方法,其特征在于,上述药物为抗癌药。〔33〕〔21〕、〔23〕、〔26〕、〔28〕、〔29〕和〔31〕中任一项所述的方法,其特征在于,上述在体外条件下的培养体系为球形体培养。附图说明[图1]显示经HE染色的组织标本的照片。在移植到小鼠的大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325中,可见与人组织同样的形态学结构,显示出不受小鼠的影响。另一方面,在移植到NOG小鼠的大肠癌株PLR357中,可见形态学上的变化,显示出不适合于对小鼠的移植实验。[图2]显示通过EPICSALTRA、使用癌干细胞标志物对小鼠MHCI类阴性且7-AAD存活力染料(7-AADViabilityDye)阴性的细胞进行流式细胞术分析的结果的图。在由大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325形成的癌细胞团中,可见癌干细胞标志物阳性的细胞。在中分化型的大肠癌株PLR123、大肠癌株PLR59中,标志物阳性细胞和标志物阴性细胞共存,为异质性的细胞群。另一方面,在低分化型的大肠癌株PLR325中,为显示出所有的细胞为对于EpCAM、AC133、Aldefluor显示阳性、且所有的细胞为对于CD44显示阴性这样的均质性特征的细胞群。[图3]显示通过EPICSALTRA、对去除了小鼠细胞的细胞进行流式细胞术分析的结果的图。显示出在由大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325形成的癌细胞团中,去除小鼠细胞后,95%以上的细胞为小鼠MHCI类阴性。[图4]显示经HE染色的组织标本的照片。在中分化型的大肠癌株PLR123、大肠癌株PLR59中可见等级结构。另一方面,在低分化型的大肠癌株PLR325中未见等级结构。[图5]显示通过蛋白质印迹法检测的LGR5蛋白质的表达的图。在中分化型的大肠癌株PLR123、大肠癌株PLR59中检测到LGR5蛋白质,显示出存在正常肠道干细胞标志物阳性的细胞。另一方面,在低分化型的大肠癌株PLR325中未检测到LGR5蛋白质。[图6]显示通过EPICSALTRA、使用癌干细胞标志物对7-AAD存活力染料阴性的细胞进行流式细胞术分析的结果的图。市售的大肠癌株HCT116为显示几乎所有的细胞为干细胞标志物阳性这样的均质性特征的细胞群。[图7]显示经HE染色的组织标本的照片。在市售的大肠癌株HCT116中未见等级结构。[图8]显示通过蛋白质印迹法检测的LGR5蛋白质的表达的图。在市售的大肠癌株HCT116中未检测到LGR5蛋白质。[图9]显示通过原位杂交法检测的LGR5阳性细胞的照片。在市售的大肠癌株HCT116中未见LGR5阳性细胞。[图10]显示进行体外培养的中分化型的大肠癌株PLR123的形态的照片。仅在悬浮状态下,可见被称为球形体的细胞团的形成。[图11]显示通过EPICSALTRA、使用癌干细胞标志物对7-AAD存活力染料阴性的细胞进行流式细胞术分析的结果的图。在体外进行贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59中,显示出所有的细胞为癌干细胞标志物阳性且为均质的细胞群。[图12]显示通过蛋白质印迹法检测的LGR5蛋白质的表达的图。在用干细胞培养基进行体外贴壁培养的中分化型的大肠癌株中检测到LGR5蛋白质的增加。表明通过用干细胞培养基进行体外培养,正常肠道干细胞标志物阳性的细胞被浓缩。[图13]显示通过原位杂交法检测的LGR5阳性细胞的照片。可见用干细胞培养基进行体外贴壁培养的所有中分化型的大肠癌株PLR123对于LGR5探针呈阳性。显示通过用干细胞培养基进行体外培养,正常肠道干细胞标志物阳性的细胞被浓缩,这显示出所有的细胞为正常肠道干细胞标志物LGR5阳性的均质的细胞。[图14]显示经HE染色的组织标本的照片。在由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59形成的癌细胞团中,可见与人组织以及NOG确立癌细胞株同样的等级结构。另外,在由进行了1个月以上培养的体外贴壁培养的中分化型的大肠癌株PLR123形成的癌细胞团中,也可见与人组织以及NOG确立癌细胞株同样的等级结构。显示出体外进行贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59均为持有多分化能的癌干细胞。[图15]显示通过EPICSALTRA、使用癌干细胞标志物对小鼠MHCI类阴性且7-AAD存活力染料阴性的细胞进行流式细胞术分析的结果的图。在由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59形成的癌细胞团中,可见癌干细胞标志物阴性的细胞,显示出由癌干细胞产生了不持有癌形成能的分化细胞。[图16]显示经HE染色的组织标本的照片。在由进行体外贴壁培养的中分化型的大肠癌株PLR123形成的第二代癌细胞团中,可见与人组织以及原始大肠癌株同样的等级结构。[图17]显示在本发明的癌干细胞群和文献中的、100个以下细胞形成癌细胞团的频率。对于该癌干细胞群,在所有的移植中可见癌的形成和等级结构。[图18]显示在转染了Lgr4、Lgr5或Lgr6cDNA的DG44细胞中,通过免疫荧光显微镜观察确认到抗人Lgr5单克隆抗体(mAb)即2U2E-2和2T15E-2的特异性的结果的照片。固定非转染母细胞和转染子,用5μg/mL的抗体处理。在包含Lgr5cDNA的细胞中观察到强的荧光(右侧的绿色信号),然而在母细胞和包含Lgr4或Lgr6cDNA的细胞中未观察到。比例尺为5μm。[图19]显示在转染了Lgr4、Lgr5或Lgr6cDNA的DG44细胞中,通过流式细胞术确认到抗人Lgr5单克隆抗体(mAb)即2T15E-2的特异性的结果的图。将非转染母细胞和转染子与单克隆2T15E-2抗体共温育,通过FACS进行分析。2T15E-2抗体与包含Lgr5cDNA的细胞反应,然而与母细胞和包含Lgr4或Lgr6cDNA的细胞未反应。关于转染子的Lgr4、Lgr5和Lgr6的表达,通过蛋白质印迹分析确认。[图20]显示PLR123细胞的原发性细胞、悬浮癌干细胞和贴壁癌干细胞的β-连环蛋白、TCF1、TCF3、TCF4和磷酸化c-JUN蛋白质的蛋白质印迹分析结果的照片。与原发性细胞相比,在Lgr5阳性的贴壁癌干细胞中,所有蛋白质的表达被上调。作为蛋白质上样用的参照蛋白质的GAPDH也被可视化。[图21]显示源于来自PLR123的Lgr5阳性细胞1个和10个以及来自PLR123的Lgr5阴性细胞10个的异种移植片肿瘤的组织病理学的结果的照片。所有肿瘤均显示出等级结构,而其组织病理学特征与原本的肿瘤极其相似。比例尺为100μm。[图22]显示将来自PLR59和PLR123异种移植片的贴壁癌干细胞培养1个月,已经报告的癌干细胞标志物的流式细胞术分析的结果的图。甚至在体外培养1个月后,来自PLR59和PLR123的贴壁癌干细胞均对已经报告的所有癌干细胞标志物呈阳性。灰色显示利用所示的抗体染色细胞后的荧光强度或ALDH的活性,白色显示将利用对照同种型抗体染色细胞后的荧光强度或通过ALDH抑制剂处理ALDH活性的细胞。[图23]将来自PLR59和PLR123异种移植片的贴壁癌干细胞培养1个月后,用流式细胞术进行分析(图22),且对NOG小鼠进行注射。将图中所示的数量的贴壁癌干细胞皮下注射到NOG小鼠的侧腹部,研究了NOG小鼠的肿瘤形成活性。图显示从接种47天后判定了肿瘤形成的结果。甚至通过皮下注射10个贴壁癌干细胞,在所有注射部位产生了肿瘤,而该肿瘤的组织病理学形态与原本的肿瘤高度相似。[图24]显示PLR59细胞的原发性细胞、悬浮癌干细胞和贴壁癌干细胞的β-连环蛋白、TCF1、TCF3、TCF4和磷酸化c-JUN蛋白质的蛋白质印迹分析结果的照片。与原发性细胞相比,在Lgr5阳性的贴壁癌干细胞中所有蛋白质的表达被上调。作为蛋白质上样的参照的GAPDH也被可视化。[图25]显示在PLR123细胞中通过FH535(50μM)和小豆蔻明(50μM)抑制Lgr5阳性的贴壁癌干细胞的增殖的图。与FH535(灰色柱)和小豆蔻明(黑色柱)共同培养3天后的活细胞的数量以相对于仅DMSO的数量(白色柱)的百分比显示。结果为3次实验的平均数。各柱上部的条显示标准偏差。[图26]显示在PLR59细胞中通过FH535(50μM)和小豆蔻明(50μM)抑制Lgr5阳性的贴壁癌干细胞的增殖的图。与FH535(灰色柱)和小豆蔻明(黑色柱)共同培养3天后的活细胞的数量以相对于第0天的数(白色柱)的百分比显示。[图27]显示PLR123细胞在EGF和FGF的存在下或非存在下的细胞增殖的图。将贴壁癌干细胞在存在下或非存在下培养3天(黑色柱)。活细胞的数量以相对于第0天的数量的百分比显示(白色柱)。结果为3次实验的平均数。各柱上部的条显示标准偏差。[图28]显示PLR59细胞在EGF和FGF的存在下和非存在下的细胞增殖的图。将贴壁癌干细胞在存在下或非存在下培养3天(黑色柱)。为将活细胞的数量以相对于第0天的数量(白色柱)的百分比显示的图。[图29]显示在PLR123细胞中化学治疗剂对Lgr5阳性的贴壁癌干细胞和Lgr5阴性的悬浮癌干细胞的增殖的效果的图。通过5-FU(10μg/mL、灰色柱)或依立替康(10μg/mL、黑色柱)处理后的活细胞的数量作为未使用化学治疗剂培养的活细胞数量(白色柱)的百分比显示。结果为3次实验的平均数。各柱上部的条显示标准偏差。[图30]显示在PLR59细胞中5-FU(10μg/mL)和依立替康(10μg/mL)对Lgr5阳性的贴壁癌干细胞和Lgr5阴性的悬浮癌干细胞的增殖的效果的图。通过5-FU(灰色柱)或依立替康(黑色柱)处理后的活细胞的数量以相对于上述药物的非存在下培养的情况(白色柱)的百分比显示。[图31]显示在PLR123细胞的贴壁癌干细胞中,通过化学治疗剂处理细胞后的贴壁性癌干细胞的Lgr5表达的变化的图。显示流式细胞术的结果。上部显示无化学治疗剂(对照),中间显示5-FU处理细胞,下部显示依立替康处理细胞。灰色显示用所述的抗体染色细胞后的荧光强度或ALDH活性,白色显示利用对照同种型抗体染色细胞后的荧光强度或ALDH抑制剂下的ALDH活性。[图32]显示通过培养条件和化学治疗剂处置的大肠癌干细胞的表现型的相互变化的照片。研究了Lgr5阳性癌干细胞对5-FU和依立替康的敏感性。5-FU和依立替康均显著抑制了Lgr5阳性的癌干细胞的增殖。暴露于5-FU或依立替康3天后,出现了对于这些化学治疗剂具有抗性的细胞。该药物耐性细胞的形态高密度凝集。比例尺为25μm。[图33]显示将PLR59细胞的贴壁癌干细胞通过5-FU或依立替康处理后的癌干细胞标志物的流式细胞术分析的结果的图。上部显示5-FU处理细胞,下部显示依立替康处理细胞。灰色显示用所述的抗体染色细胞后的荧光强度或ALDH活性,白色显示利用对照同种型抗体染色细胞后的荧光强度或ALDH抑制剂下的ALDH活性。[图34]显示PLR123细胞的贴壁培养和悬浮培养的转移前(显示为1)和之后的细胞的Lgr5mRNA的水平的图。F→A显示从悬浮培养到贴壁培养的转移,A→F显示从贴壁培养到悬浮培养的转移。结果为3次实验的平均数。各柱上部的条显示标准偏差。[图35]显示癌干细胞的形态的相互变化的照片。当使Lgr5阴性的大肠癌干细胞解离,用平底培养板进行培养时,一部分细胞附着在板底,成为Lgr5阳性,显示出间充质细胞样形态(左侧)。另一方面,当将Lgr5阳性的贴壁大肠癌干细胞用超低附着培养板进行培养时,一部分细胞停止增殖,形成了球形体样结构。比例尺为10μm。[图36]显示在PLR123细胞中、Lgr5阴性的悬浮癌干细胞和Lgr5阳性的贴壁癌干细胞的E-钙粘蛋白和蜗牛蛋白(Snail)的蛋白质印迹分析结果的照片。悬浮癌干细胞表达了高水平的E-钙粘蛋白,而贴壁癌干细胞表达了高水平的蜗牛蛋白。将GADPH作为上样对照使用。[图37]显示在PLR123细胞中通过E-钙粘蛋白抗体、蜗牛蛋白抗体和β-连环蛋白抗体进行的Lgr5阴性的悬浮癌干细胞和Lgr5阳性的贴壁癌干细胞的免疫细胞化学的结果的照片。悬浮癌干细胞为在细胞表面高度表达E-钙粘蛋白和β-连环蛋白的上皮样细胞,而贴壁癌干细胞为蜗牛蛋白和β-连环蛋白定位于核内的间充质样细胞。比例尺为25μm。[图38]显示在PLR59细胞中Lgr5阴性的悬浮癌干细胞和Lgr5阳性的贴壁癌干细胞的E-钙粘蛋白和蜗牛蛋白的蛋白质印迹分析结果。悬浮癌干细胞表达了高水平的E-钙粘蛋白,而贴壁癌干细胞表达了高水平的蜗牛蛋白。将GADPH作为上样对照使用。[图39]显示抗Lgr5抗体和抗蜗牛蛋白抗体的异种移植组织(来自PLR123细胞)的免疫组织化学的结果的照片。在出芽性区的EMT样细胞中检测到核蜗牛蛋白和细胞质Lgr5同时表达(左侧图),而在管中未能检测到(右侧图)。箭头显示Lgr5阳性的出芽细胞。比例尺为10μm。[图40]显示多个器官的贴壁癌干细胞的肿瘤形成活性的图。将5×105个PLR123的贴壁癌干细胞注射到尾静脉中(n=5)。显示各种器官的给予后第40天的肿瘤形成的出现率。[图41]显示肺、肝脏、淋巴结和皮下组织的肿瘤的组织病理学实验结果的照片。在肺中,肿瘤细胞显示出未分化的肿瘤巢,而在肝脏和其他器官中,肿瘤细胞显示出伴随有多个分化阶段的管结构。比例尺为100μm。具体实施方式本发明涉及能够在用于人癌疾病的治疗或预防的药物开发中有效使用的癌干细胞群。具体而言,涉及实质上去除了没有癌形成能的细胞的癌干细胞群,所述癌干细胞群具有再现癌组织等级结构的特征。对本发明的癌干细胞群的由来不做特别限定,但优选来自人肿瘤组织。作为本发明的第一方面,提供实质上去除了没有癌形成能的细胞的癌干细胞群,所述群再现癌组织的等级结构。在本发明中,“癌”是指,一般以不受控的细胞增殖为特征的哺乳动物的生理状态,或相关的生理状态。在本发明中,对癌的种类不做特别限定,可以列举以下癌:作为癌瘤(上皮癌),可以举出胰腺癌、前列腺癌、乳癌、皮肤癌、消化道癌、肺癌、肝细胞癌、子宫颈癌、子宫体癌、卵巢癌、输卵管癌、阴道癌、肝癌、胆管癌、膀胱癌、输尿管癌、甲状腺癌、肾上腺癌、肾癌、或其他腺组织癌。作为肉瘤(非上皮癌),可以举出脂肪肉瘤、平滑肌肉瘤、横纹肌肉瘤、滑膜肉瘤、血管肉瘤、纤维肉瘤、恶性末梢神经肿瘤、胃肠道间质瘤、硬纤维瘤、尤因肉瘤、骨肉瘤、软骨肉瘤、白血病、淋巴瘤、骨髓瘤、其他实体器官肿瘤例如黑色素瘤或脑肿瘤(KumarV,AbbasAK,FausioN.RobbinsandCotranPathologicBasisofDisease.7thEd.UnitI:GeneralPathology,7:Neoplasia,Biologyoftumorgrowth:Benignandmalignantneoplasms.269-342,2005)。本发明的癌干细胞群可以是来源于上述的上皮癌由来的肿瘤组织的群。在本发明中,癌干细胞是指具有以下i)和/或ii)所述能力的细胞。i)保有自我复制能。自我复制能是指,分裂的2个子细胞的任何一个或两者的细胞能够产生细胞系谱上保持与母细胞同等的能力以及分化程度的细胞的能力。ii)能够分化为构成癌细胞团的多种癌细胞。由癌干细胞分化的多种癌细胞,与正常干细胞同样,形成细胞系谱上以癌干细胞作为顶点的等级结构。通过由癌干细胞阶段性地产生多种癌细胞,形成具有多样特征的癌细胞团。癌干细胞是指,持有癌形成能且与正常干细胞同样地持有多分化能和自我复制能的癌细胞。另外,有时选自癌干细胞标志物CD24、CD29、CD34、CD44、CD49f、CD56、CD90、CD117、CD133、CD135、CD166、CD184、CD271、CD326、Aldefluor、ABCG2、ABCG5、LGR5以及Msi1的至少1个以上标志物呈阳性,然而不必一定为阳性。优选选自CD326、CD133、CD44、ALDH的至少1个以上标志物呈阳性,更优选选自CD326、CD133、CD44、ALDH的至少2个以上标志物呈阳性,进一步优选选自CD326、CD133、CD44、ALDH的至少3个以上标志物呈阳性,最优选CD326、CD133、CD44、ALDH均呈阳性。另外,作为癌干细胞能够显示的生物活性的上皮间充质转化的能力也可以是癌干细胞所具有的性质之一。正常细胞和肿瘤细胞在体外和体内以多样分化的状态存在。这些分化状态,至少部分地通过由细胞所属的组织微环境产生的复杂信号的整合进行调节。细胞(例如癌细胞)可以通过多种基因干扰(geneticperturbation)例如经由特定因子(例如Twist、蜗牛蛋白、TGF-β或MMP类)的过表达或通过抑制E-钙粘蛋白等的粘着连接蛋白质,被诱导经历上皮间充质转化(EMT)。朝向EMT诱导的细胞,与使用的诱导方法无关,表达相似的表现型性状和蛋白质标志物(例如生物标志物),这就显示出EMT为主要的分化程序。本发明涉及朝向EMT诱导的细胞共有癌干细胞的多个特性的发现,所述多个特性包括:与癌干细胞关联的细胞表面标志物的表达、在悬浮培养中的增殖、以较少细胞数量在体内形成肿瘤、以及对特定的标准性的化学治疗药的耐性。因此,通过经历了亦被称为间充质分化转换或上皮间充质分化转换的上皮间充质转化的细胞所显示的分化状态,能够用于鉴定将癌干细胞作为特异性靶标的治疗。在本发明的非限定性的一个方案中,提供例如以生成被验细胞为目的等诱导上皮间充质转化的方法。癌干细胞形成以癌干细胞作为顶点的等级结构。通过由癌干细胞阶段性地产生出多种癌细胞,形成具有多样特征的癌细胞团。另一方面,癌形成细胞是指不持有多分化能,而持有癌形成能的癌细胞。在癌形成试验中能够评价癌形成能和自我复制能,而在病理学分析或使用分化标志物的分析中能够评价多分化能。为了证明是癌干细胞,不仅需要评价癌形成能,还需要评价自我复制能和多分化能。癌细胞团是指,细胞等与人肿瘤组织同样,不是分开着的,而是相互粘着形成的团块,且是由癌细胞、间质细胞或血球细胞等癌细胞之外的细胞、胶原或层粘连蛋白等的细胞外基质等构建的团块。等级结构是指,出现于正常组织的特征性的固有结构的一部分在以该组织作为发生源的肿瘤结构中以病理组织学方式被检测到,一般在高分化型的癌中该等级结构更高度地再现,例如为腺腔形成脏器的肿瘤(胃癌、大肠癌、胰腺癌、肝癌、胆管癌、乳癌、肺腺癌、前列腺癌等)的情况下,可见管腔形成或粘液细胞的出现等;为具有扁平上皮结构的肿瘤(肺、皮肤、阴道粘膜等的扁平上皮癌)的情况下,可见上皮的多层结构形成和角质化倾向等。另一方面,在低分化型的癌中被认为该等级结构的再现不充分且多为非典型性(KumarV,AbbasAK,FausioN.RobbinsandCotranPathologicBasisofDisease.7thEd.UnitI:GeneralPathology,7:Neoplasia,Biologyoftumorgrowth:Benignandmalignantneoplasms.272-281,2005)。该等级结构被认为是由于癌的各种生物反应的结果而得以再现的结构,因此认为再现该等级结构的非人动物模型的利用价值高。再现等级结构是指,移植来源的癌患者的癌组织所持有的特色性的固有结构,在移植到非人动物中时也同样地被观察到。具有癌形成能是指,移植到非人动物中的细胞或细胞群形成癌细胞团,优选形成具有等级结构的癌细胞团。没有癌形成能是指,移植到非人动物中的细胞或细胞群不能形成癌细胞团。实质上去除了没有癌形成能的细胞,这可通过将有限稀释的细胞群移植到免疫缺陷动物中来确认。在本发明中,“实质上去除了没有癌形成能的细胞”是指,当向免疫缺陷动物、优选NOG小鼠皮下移植每处10个细胞时所形成的癌细胞团的形成频率为60%以上,优选为70%以上、更优选为80%以上、进一步优选为90%以上、最优选为100%。另外,能够使用HuY&SmythGK.,JImmunolMethods.2009年8月15日;347(1-2):70-8或IshizawaK&RasheedZA.等,CellStemCell.2010年9月3日;7(3):279-82中记载的方法等。该方法中将1000个细胞、100个细胞、10个细胞移植到免疫缺陷动物中,将癌细胞团形成的频率使用极限稀释分析(HuY&SmythGK.,JImmunolMethods.2009年8月15日;347(1-2):70-8)进行分析。在本发明中,实质上去除了没有癌形成能的细胞的“均质的癌干细胞群”是指,在该分析方法中癌干细胞的频率为1/20以上、优选为1/10以上、更优选为1/5以上、进一步优选为1/3以上、进一步优选为1/2以上、最优选为1/1。极限稀释分析(ELDA)为根据干细胞测定的必要性、用于有限稀释分析(limitingdilutionanalysis(LDA))的软件应用。ELDA是为包括0%或100%应答在内的所有LDA的数据组提供有意义的置信区间的有限稀释分析软件,包括一次击中假说的有效性的测试、用于多个数据组间的频率显著差异的测试等。对于Hu等(JImmunolMethods.(2009)347(1-2),70-78)所提倡的根据ELDA的分析方法,除了适用上述的非专利文献所记载的方法之外,本领域技术人员还可以使用在http://bioinf.wehi.edu.au/software/elda/中提供的在线分析工具来实施。若使用本发明,则可以大量制备癌干细胞。通过增加进行贴壁培养的培养瓶数量,原理上能够得到所需数量的癌干细胞。例如使用T150培养瓶的情况下,若培养至汇合,则通常可以得到4×107个以上的细胞;若使用5个培养瓶进行培养,则能够制备2×108个以上的细胞。因此,本发明能够制备所需的细胞数量。本发明的癌干细胞群,优选实质上去除了没有癌形成能的细胞,且该群可以包含1x104个以上、更优选1x105个以上、进一步优选1x106个以上、进一步优选1x107个以上、进一步优选1x108个以上、最优选1x109个以上的癌干细胞。作为本发明的第二方面,提供本发明的细胞群的制备方法。本发明的细胞群能够通过例如对包含癌干细胞的细胞群进行贴壁培养来制备。作为包含癌干细胞的细胞群,可使用导入有SV40等癌病毒基因或者Ras等癌基因的细胞、由癌组织株化的细胞等。作为包含癌干细胞的细胞群,优选使用再现癌组织等级结构的细胞群,例如可使用采集的癌组织,但优选使用将癌移植到非人动物中进行传代而制备的确立癌细胞株,更优选使用将癌移植到免疫缺陷动物中进行传代而制备的确立癌细胞株,最优选使用将癌组织移植到NOG小鼠中进行传代而制备的NOG确立癌细胞株。并且,作为包含癌干细胞的细胞群,也可以为通过球形体培养所形成的球形体,或也可以为包含选自癌干细胞标志物CD24、CD29、CD34、CD44、CD49f、CD56、CD90、CD117、CD133、CD135、CD166、CD184、CD271、CD326、Aldefluor、ABCG2、ABCG5、LGR5以及Msi1的至少1个以上的标志物呈阳性的细胞的细胞群。对细胞群的由来不做特别限定,能够使用来自人、猴子、黑猩猩、狗、牛、猪、兔、大鼠、小鼠等的哺乳动物等的细胞群,但优选来自人的细胞群。NOG确立癌细胞株能够用本领域技术人员公知的方法制备,例如能够使用FujiiE.等,Patholint.2008;58:559-567中记载的方法等,通过将用外科手术摘出的人大肠癌、胃癌、肺癌、乳癌、胰腺癌等用剪刀物理性地切碎,皮下移植到NOG小鼠中进行传代来确立。对于NOG确立癌细胞株,即使经历传代也维持着原始人癌组织的特征。作为贴壁培养步骤,只要为贴壁培养即可,对使用的培养基不做特别限定,但优选使用无血清的干细胞培养基。贴壁培养是指将细胞接种于贴壁培养瓶、板、皿后,在贴壁的状态下对细胞进行培养、传代,去除了悬浮细胞的培养。对于增殖至汇合的细胞,使用Accutase剥下,在新的贴壁培养瓶、板、皿中进行传代,继续培养。本发明中可使用的培养液,只要为能够用于培养癌干细胞的培养液即可,对其不做特别限定,例如能够将加入了EGF、bFGF、hLIF、HGF、NGF、NSF-1、TGFβ、TNFα、肝素、BSA、胰岛素、转铁蛋白、腐胺、亚硒酸盐、孕酮、氢化可的松、D-(+)-葡萄糖、碳酸氢钠、HEPES、L-谷氨酰胺、N-乙酰半胱氨酸的以往公知的基础培养液或它们的混合物作为培养液使用。对EGF的浓度不做特别限定,但为0.1~100ng/mL、优选为0.5~50ng/mL、更优选为1~20ng/mL。对bFGF的浓度不做特别限定,但为0.1~100ng/mL、优选为0.5~50ng/mL、更优选为1~20ng/mL。对hLIF的浓度不做特别限定,但为0.1~100ng/mL、优选为0.5~50ng/mL、更优选为1~20ng/mL。对HGF的浓度不做特别限定,但为0.1~100ng/mL、优选为1~50ng/mL。对NGF的浓度不做特别限定,但为0.1~100ng/mL、优选为1~50ng/mL。对NSF-1的浓度不做特别限定,但为0.1~100ng/mL、优选为1~50ng/mL。对TGFβ的浓度不做特别限定,但为0.1~100ng/mL、优选为1~50ng/mL。对TNFα的浓度不做特别限定,但为0.1~100ng/mL、优选为1~50ng/mL。对肝素的浓度不做特别限定,但为10ng/mL~10μg/mL、优选为2~5μg/mL。对BSA的浓度不做特别限定,但为0.1~10mg/mL、优选为1~8mg/mL。对胰岛素的浓度不做特别限定,但为1~100μg/mL、优选为10~50μg/mL。对转铁蛋白的浓度不做特别限定,但为10~500μg/mL、优选为50~200μg/mL。对腐胺的浓度不做特别限定,但为1~50μg/mL、优选为10~20μg/mL。对亚硒酸盐的浓度不做特别限定,但为1~50nM、优选为20~40nM。对孕酮的浓度不做特别限定,但为1~50nM、优选为10~30nM。对氢化可的松的浓度不做特别限定,但为10ng/mL~10μg/mL、优选为100ng/mL~1μg/mL。对D-(+)-葡萄糖的浓度不做特别限定,但为1~20mg/mL、优选为5~10mg/mL。对碳酸氢钠的浓度不做特别限定,但为0.1~5mg/mL、优选为0.5~2mg/mL。对HEPES的浓度不做特别限定,但为0.1~50mM、优选为1~20mM。对L-谷氨酰胺的浓度不做特别限定,但为0.1~10mM、优选为1~5mM。对N-乙酰半胱氨酸的浓度不做特别限定,但为1~200μg/mL、优选为10~100μg/mL。作为公知的基础培养液,只要适于成为癌干细胞的来源的癌细胞的培养即可,不做特别限定,例如可以举出:DMEM/F12、DMEM、F10、F12、IMDM、EMEM、RPMI-1640、MEM、BME、Mocoy's5A、MCDB131等。其中,优选DMEM/F12。作为最优选的干细胞培养基,可以举出:向D-MEM/F12培养基中加入最终浓度为20ng/mL的EGF、10ng/mL的bFGF、4μg/mL的肝素、4mg/mL的BSA、25μg/mL的胰岛素、100μg/mL的转铁蛋白、16μg/mL的腐胺、30nM的亚硒酸盐、20nM的孕酮、2.9mg/mL的D-(+)-葡萄糖的培养基。优选在进行贴壁培养之前使包含癌干细胞的细胞群增殖。使细胞群增殖是指,例如,通过球形体培养或移植到非人动物中并进行传代使其增殖,但不特别限定于此。球形体培养是指,使用能够培养上述干细胞的培养基,将细胞接种于非贴壁培养瓶、板、皿后,在悬浮的状态下培养细胞,将在这样的悬浮状态下培养而形成的细胞团称为球形体。作为非人动物,就难以产生排斥反应这点而言,可使用免疫缺陷动物。作为免疫缺陷动物,适合使用欠缺功能性T细胞的非人动物、例如裸小鼠或裸大鼠,欠缺功能性T细胞和B细胞的非人动物、例如SCID小鼠或NOD-SCID小鼠,其中更适合使用具有优异的可移植性的欠缺T细胞、B细胞和NK细胞的小鼠(例如,SCID小鼠、RAG2KO或RAG1KO小鼠与IL-2Rgnull小鼠组合而得到的高度免疫缺陷小鼠:其包含NOD/SCID/γcnull小鼠、NOD-scid,IL-2Rgnull小鼠或BALB/c-Rag2null,IL-2Rgnull小鼠等)。非人动物的周龄,例如为无胸腺裸小鼠、SCID小鼠、NOD/SCID小鼠、NOG小鼠的情况下,优选使用4~100周龄者。NOG小鼠,例如可以通过WO2002/043477所述的方法来制备,也可以从(财)实验动物中央研究所或TheJacksonLaboratory(NSG小鼠)获取。移植的细胞为细胞团、组织片、分散为单个的细胞、分离后暂且进行培养的细胞、经历向其他动物移植的过程而再次由该动物分离出的细胞等,可以为任何一种细胞,但优选分散的细胞。另外,移植的细胞数量,可以为106以下的数量,但也可以移植其以上数量的细胞。皮下移植,因移植技术简便这一点,成为合适的移植部位,但对移植部位不做特别限定,优选根据使用的动物选择适宜的移植部位。需要说明的是,对NOG确立癌细胞株的移植操作没有特别限定,能够按照惯用的移植操作来进行。本方法的细胞群,能够通过例如将由患者采集的癌组织用无血清的干细胞培养基进行贴壁培养来制备。另外,为了使细胞群额外增殖,不考虑在进行贴壁培养之前经历了怎样的培养。例如,也能够对由患者采集的癌组织进行球形体培养,然后使用无血清的干细胞培养基进行贴壁培养来制备。另外,也能够将由患者采集的癌组织移植到非人动物中并传代后,使用无血清的干细胞培养基进行贴壁培养来制备。并且,从能够高效率地得到大量本发明的细胞群这一点考虑,最优选对于将由患者采集的癌组织移植到NOG小鼠中并进行传代而制备的NOG确立癌细胞株,使用无血清的干细胞培养基进行贴壁培养的制备方法。本发明的细胞群可用于药物的靶分子探索方法、药物的评价方法。作为药物的评价方法,可以举出药物的筛选方法或抗癌药的筛选等。作为靶分子探索方法,可以举出:使用基因芯片分析,鉴定在癌干细胞中高度表达的DNA或RNA等基因(例如,癌干细胞的标志物)的方法;使用蛋白质组学,鉴定在癌干细胞中高度表达的蛋白质、肽或代谢产物的方法等,但不被这些方法限定。作为靶分子探索的筛选方法,可以举出:由低分子文库、抗体文库、微小RNA文库、RNAi文库通过细胞生长抑制测定(cellgrowthinhibitionassay)筛选抑制癌干细胞增殖的物质的方法等。获得抑制的物质后,能够明确靶标。免疫癌干细胞获得抗体后,能够用ELISA筛选结合抗体、或用细胞生长抑制测定来筛选抑制增殖的抗体。获得结合抗体、功能性抗体后,能够通过鉴定抗原来明确靶分子。若使用本发明的癌干细胞群,也能够使用现有的药剂或开发中的药剂评价对癌干细胞的效果,发现新的药效。通过浓缩均质的癌干细胞,可以进行例如以下项目。1.高效鉴定在癌干细胞中特异性表达的核酸(DNA、RNA)、蛋白质等,阐明这些分子的功能。2.高效鉴定在癌干细胞中特异性表达的核酸(DNA、RNA)、蛋白质等,实施抑制该表达的药剂候选的探索、筛选。3.以被浓缩的各癌干细胞的生物功能分析结果(浸润性、分裂速度等)为指标,用于癌的预后诊断等。4.以被浓缩的各癌干细胞的生物功能分析结果(浸润性、分裂速度等)为指标,重新对癌分类,应用于每种分类的抗癌药的探索、筛选。5.研究被浓缩的癌干细胞大量产生占据大部分癌组织的分化细胞的过程,用于阻抑该过程的抗癌药(癌沉默基因)的探索、筛选。6.通过将癌干细胞的培养条件(氧分压、营养条件、抗癌药处置等)向恶劣的方向调节,检测癌干细胞中特征性的生物反应,研讨癌干细胞耐久性的成因。7.通过将癌干细胞的培养条件(氧分压、营养条件、抗癌药处置等)向恶劣的方向调节,检测在癌干细胞中特征性的生物反应,用于抑制癌干细胞耐久性的抗癌药的探索、筛选。药物的靶分子探索方法。本发明涉及药物的靶分子探索方法,该方法的特征在于:在移植了本发明癌干细胞群的非人动物模型中或本发明的癌干细胞群在体外条件下的培养体系中,以由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性为指标进行评价。在本方法中,使用移植了癌干细胞群的非人动物模型的情况下,通过以下(1)~(4)所述的步骤,能够进行药物的靶分子探索。(1)通过将癌干细胞群移植到非人动物中,来制备非人动物模型的步骤;(2)采集组织片的步骤,所述组织片显示该癌干细胞群的癌进展过程中特征性所见的组织结构或显示其生物学特性;(3)对(2)中采集的组织片研究DNA、RNA、蛋白质、肽或代谢产物的表达的步骤;和(4)鉴定组织片中的依据由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性而改变的DNA、RNA、蛋白质、肽或代谢产物的步骤。另外,在本方法中,使用癌干细胞群在体外条件下的培养体系的情况下,通过以下(1)~(3)所述的步骤,能够进行药物的靶分子探索。(1)将癌干细胞群在体外条件下培养,再现由癌干细胞开始的癌进展过程的特征结构、或癌干细胞的生物学特性的步骤;(2)研究再现了特征结构的培养细胞的DNA、RNA、以及蛋白质、肽或代谢产物的表达的步骤;和(3)鉴定培养细胞中依据由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性而改变的DNA、RNA、蛋白质、肽和代谢产物的步骤。在本发明中,对于在癌进展过程中特征性所见的组织或细胞株的结构观察,可在通过AMeX法等公知的标本制备方法来制备薄切组织标本后,通过实施HE染色以及免疫组织化学染色(IHC)来进行。在被验组织中,上述的人肿瘤组织特异性的等级结构、癌进展过程、或其生物学特性被确认的情况下,将该被验组织作为癌关联组织,确认DNA、RNA、蛋白质、肽以及代谢产物的表达。关于DNA、RNA、蛋白质、肽以及代谢产物的表达确认不做特别限定,能够按照惯用的表达确认方法来进行。作为RNA,可以举出:微小RNA、siRNA、tRNA、snRNA、mRNA、或非编码RNA等。例如,按照常规提取各基因的mRNA,将该mRNA作为模板,通过实施RNA杂交法或RT-PCR法,能够进行各基因的转录水平的测定。并且,也可以使用DNA阵列技术来测定各基因的表达水平。另外,按照常规回收包含由各基因编码的蛋白质的馏分,通过利用SDS-PAGE等的电泳法检测各蛋白质的表达,也能够进行基因的翻译水平的测定。另外,通过使用抗各蛋白质的抗体,实施蛋白质印迹法,检测各蛋白质的表达,也可以进行基因的翻译水平的测定。通过这些方法,能够进行抗癌药的靶分子的探索。作为上述药物的靶分子的非限定性的一种方案,可以适当举出:如实施例中列举的、作为本发明的癌干细胞特异性表达的分子的CD133、CD44、EpCAM、CD166、CD24、CD29或LGR5等。在本发明中,对上述药物不做特别限定,可以举出:抗炎药、免疫抑制剂、抗病毒剂、血管生成抑制剂、类固醇剂、酶抑制剂、抗生素、抗组胺剂、抗凝血剂、抗感染剂、镇痛剂、糖尿病治疗剂、关节炎治疗剂、抗哮喘剂、抗失眠症剂、止吐剂、偏头痛治疗剂、抗痉挛剂、抗抑郁剂、抗精神病剂、解热剂、帕金森病治疗剂、阿尔茨海默病治疗剂、交感神经作用剂、心律不齐治疗剂、降压剂、利尿剂、抗利尿剂、抗凝固剂、血管舒张剂、镇静剂等,优选抗癌药。另外,对上述药物不做特别限定,可以举出:蛋白质药剂、核酸药剂、低分子药剂、细胞性药剂等。另外,在本发明中,对靶分子不做特别限定,可以举出:膜受体、酶、离子通道、转录因子或核内受体等,优选癌细胞标志物。药物的评价方法本发明涉及药物的评价方法,该方法的特征在于:在移植了本发明癌干细胞群的非人动物模型中或该癌干细胞群在体外条件下的培养体系中,以由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性为指标进行评价。在本方法中,使用移植了本发明的癌干细胞群的非人动物模型的情况下,通过以下(1)~(5)所述的步骤,能够进行药物的评价。(1)通过将癌干细胞群移植到非人动物中,来制备非人动物模型的步骤;(2)将被测物质给予(1)的非人动物模型的步骤;(3)采集组织片的步骤,所述组织片显示由癌干细胞开始的癌进展过程中特征性所见的组织结构或显示其生物学特性;(4)观察组织片中的癌干细胞的经时变化、癌进展过程、或其生物学特性的步骤;和(5)鉴定由于被测物质而受抑制的由癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤。另外,在本方法中,使用癌干细胞群在体外条件下的培养体系的情况下,通过以下(1)~(3)所述的步骤,能够进行药物的评价。(1)将癌干细胞群在体外条件下培养,再现由癌干细胞开始的癌进展过程的特征结构、或癌干细胞的生物学特性的步骤;(2)用被测物质处理(1)的培养细胞的步骤;(3)观察由癌干细胞形成的等级结构的改变、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤;和(4)鉴定由于被测物质而受抑制的由癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性的步骤。药物的筛选方法本发明涉及药物的筛选方法,该方法的特征在于:在移植了本发明癌干细胞群的非人动物模型中或该癌干细胞群在体外条件下的培养体系中,以由癌干细胞形成的等级结构、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性为指标进行评价。在本方法中,使用移植了本发明的癌干细胞群的非人动物模型的情况下,通过以下(1)~(5)所述的步骤,能够进行药物的筛选。(1)通过将癌干细胞群移植到非人动物中,来制备非人动物模型的步骤;(2)将被测物质给予(1)的非人动物模型的步骤;(3)采集组织片的步骤,所述组织片显示由癌干细胞开始的癌进展过程中特征性所见的组织结构或显示其生物学特性;(4)观察组织片中的癌干细胞的经时变化、癌进展过程、或其生物学特性的步骤;和(5)鉴定被测物质的步骤,所述被测物质抑制由特定的癌干细胞形成的等级结构形成、由癌干细胞开始的癌进展过程、或癌干细胞的生物学特性。另外,在本方法中,使用癌干细胞群在体外条件下的培养体系的情况下,通过以下(1)~(4)所述的步骤,能够进行药物的筛选。(1)将癌干细胞群在体外条件下培养,再现各癌进展过程的特征结构、或其生物学特性的步骤;(2)利用被测物质处理(1)的培养细胞的步骤;(3)观察培养细胞中癌干细胞的等级结构的经时变化、癌进展过程、或其生物学特性的步骤;和(4)鉴定由于被测物质而受抑制的癌干细胞的等级结构形成、癌进展过程、或其生物学特性的步骤。通过上述筛选方法能够进行抗癌药的筛选。作为本发明方法的“被测物质”,不做特别限定,例如可以举出:天然化合物、有机化合物、无机化合物、蛋白质、抗体、肽、氨基酸等的单一化合物,以及化合物文库、基因文库的表达产物、细胞提取物、细胞培养上清、发酵微生物产物、海洋生物提取物、植物提取物、原核细胞提取物、真核单细胞提取物或者动物细胞提取物等。它们可以为纯化物,也可以为植物、动物或微生物等的提取物等这样的粗纯化物。另外对被测物质的制备方法也不做特别限定,可以为由天然物分离的物质,也可以为化学合成或生化学合成的物质,又可以为基因工程学制备的物质。上述被测试样能够按照需要进行适宜的标记来使用。作为标记,例如可以举出放射标记、荧光标记等。另外,除了上述被测试样之外,还包含将这些被测试样多种混合而得到的混合物。在本方法中,对于非人动物模型的被测物质的给予方法也不做特别限定。按照给予的被测物质的种类,能够适宜选择经口给予或皮下、静脉、局部、经皮或者经肠(直肠)等的非经口给予。在本方法中,对利用被测物质处理癌干细胞群的培养细胞的方法也不做特别限定。该处理能够通过向细胞的培养液或该细胞提取液中添加被测试样来进行。被测试样为蛋白质的情况下,例如,可以通过将包含编码该蛋白质的DNA的载体导入癌干细胞群、或也可以通过将该载体添加到癌干细胞群的细胞提取液中来进行。另外,例如,也可以利用使用酵母或动物细胞等的双杂交法。对于被测物质的评价,其后,能够通过对该模型动物摘出移植组织(移植了癌干细胞群的组织)以观察该移植组织的组织学特征,或在细胞培养体系下测定组织学特征来进行。具体来说,被测物质的评价能够如下进行:在非人动物模型或癌干细胞群在体外条件下的培养体系中,观察由移植组织或培养体系的癌干细胞形成的等级结构,确认是否有形成人癌细胞特有的等级结构,或者确认对人癌疾病的特征性癌进展过程的影响。需要说明的是,对于在癌进展过程中特征性所见的组织或细胞株的结构观察,能够在通过AMeX法等的公知的标本制备方法制备薄切组织标本后,通过实施HE染色以及免疫组织化学染色(IHC)来进行。上述被测物质的评价,更具体地说,能够如下进行:对于不给予被测物质的对照的非人动物模型或癌干细胞群,同样地观察移植组织或培养体系的癌干细胞的等级结构,确认是否有形成人癌细胞特有的等级结构,在给予被测物质的非人动物模型或癌干细胞群与上述对照动物中,对比癌干细胞的等级结构。该情况下,与对照动物的情况相比,在给予被测物质的移植组织或培养体系中未见人癌细胞特有的等级结构的情况下、或其比例降低的情况下,能够将那些被测物质作为具有人癌疾病的治疗或预防效果的有效物质来选择。另外,上述被测物质的评价,更具体地说,能够如下进行:对于不给予被测物质的对照的非人动物模型或癌干细胞群,同样地观察移植组织或培养体系的癌进展过程,确认是否可见人癌细胞特有的癌进展过程,在给予被测物质的非人动物模型或癌干细胞群与上述对照动物中,对比癌干细胞的癌进展过程。该情况下,与对照动物的情况相比,在给予被测物质的移植组织或培养体系中未见人癌细胞特有的癌进展过程的情况下,能够将那些被测物质作为具有人癌疾病的治疗或预防效果的有效物质来选择。并且,上述被测物质的评价,更具体地说,能够如下进行:对于不给予被测物质的对照的非人动物模型或癌干细胞群,同样地观察移植组织或培养体系的癌干细胞中的生物学特性,确认是否可见人癌细胞特有的该特性,在给予被测物质的非人动物模型或癌干细胞群与上述对照动物中,对比癌干细胞的该特性。该情况下,与对照动物的情况相比,在给予被测物质的移植组织或培养体系中未见人癌细胞特有的该特性的情况下,能够将那些被测物质作为具有人癌疾病的治疗或预防效果的有效物质来选择。需要说明的是,通过上述的本发明的筛选方法,对于被选拔的人癌疾病的预防有效物质或治疗有效物质,根据需要,通过进一步进行其他药效试验或安全性试验等,并通过进一步进行对人癌疾病患者的临床试验,能够筛选出更高效、且实用性高的预防有效物质或治疗有效物质。如此筛选的预防有效物质或治疗有效物质,进一步根据其结构分析结果,通过化学合成、生物化学合成(发酵)或基因学操作,也能够工业性地制备。此外,在本说明书中引用的所有现有技术文献,均作为参照结合到本说明书中。实施例以下,通过实施例对本发明进行详细的说明,然而本发明不受这些实施例的限定。[实施例1]使用人癌细胞株的癌干细胞和癌形成细胞的制备和评价(1)移植到小鼠中的大肠癌株的形态学评价大肠癌试样是在PharmaLogicalsResearch(新加坡)和ParkwayLaboratoryServices(新加坡)的伦理委员会的批准下,由征得同意的患者得到的。将肿瘤片用剪刀细细切碎,移植到NOG小鼠的侧腹部。人大肠癌异种移植片通过在由实验动物中央研究所(日本)提供的NOG小鼠中进行传代来维持。对于在本实验中使用的小鼠,按照PharmaLogicalsResearch的动物实验指南来处置。将用NOG小鼠或SCID小鼠确立的大肠癌细胞株皮下移植到NOG小鼠中,制备癌细胞团。癌细胞团在摘出后,以在4%多聚甲醛中、4℃、16~24小时的条件固定,利用AMeX法包埋,来制备薄切组织标本。对组织标本实施了HE染色。结果显示在图1中。在移植到NOG小鼠中的大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325中,可见与人组织同样的形态学的结构,显示出不受NOG小鼠的影响。另一方面,在移植到NOG小鼠中的大肠癌株PLR357中,可见形态学上的变化,显示出不适合于对NOG小鼠的移植实验。(2)由癌细胞团来制备细胞由NOG小鼠摘出癌细胞团,用剪刀物理性地切碎。接着用DPBS(Invitrogen,目录号14190144)悬浮数次,向包含胶原酶/分散酶(Roche,目录号10269638001)和DNA酶I(Roche,目录号11284932001)的酶液中转移组织,在37℃下搅拌3小时。并且,向反复进行移液而细分的细胞中加入Lysingbuffer(裂解缓冲液)(BD,目录号555899),去除小鼠红细胞。最后使其通过40μm细胞滤过器(BD,目录号352340),用DPBS悬浮数次,制备了细胞液。(3)癌干细胞标志物阳性细胞的检测将由癌细胞团制备的细胞利用FACS缓冲液(2%胎牛血清/DPBS)悬浮,加入大鼠抗小鼠MHCI类mAb(Abcam,目录号ab15680),在4℃下反应30分钟。将细胞利用FACS缓冲液清洗1次后,分别加入作为2级抗体的PE标记山羊抗大鼠IgG2aAb(BioLegend,目录号405406)或APC标记山羊抗大鼠IgG2aAb(BioLegend,目录号405407)、作为死细胞染色的7-AAD存活力染料(BeckmanCoulter,目录号A07704)、作为癌干细胞标志物的FITC标记小鼠抗人CD326(EpCAM)mAb(MiltenyiBiotec,目录号130-080-301)、PE标记小鼠抗人CD133/1(AC133)mAb(MiltenyiBiotec,目录号130-080-801)、或PE标记小鼠抗人CD44mAb(BDPharmingen,目录号550989),在4℃下反应30分钟。接着将细胞利用FACS缓冲液清洗一次后提供于流式细胞术分析。对于醛脱氢酶(ALDEHYDEDEHYDROGENASE:ALDH)活性,通过使用AldeFluor试剂盒(StemcellTechnologies,目录号01700),进行制造商推荐的操作来检测。在流式细胞术分析中使用EPICSALTRA(BeckmanCoulter),对小鼠MHCI类阴性且7-AAD存活力染料阴性的细胞进行癌干细胞标志物的分析。结果显示在图2中。在由大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325形成的癌细胞团中,可见癌干细胞标志物阳性的细胞。在中分化型的大肠癌株PLR123、大肠癌株PLR59中,共存着标志物阳性细胞和标志物阴性细胞,为异质性的细胞群。另一方面,在低分化型的大肠癌株PLR325中,为显示出所有细胞的EpCAM、AC133、ALDH活性呈阳性,并且所有细胞的CD44呈阴性这样的均质特征的细胞群。(4)从细胞液中去除小鼠细胞将由癌细胞团制备的细胞利用FACS缓冲液悬浮,加入大鼠抗小鼠MHCI类mAb,在4℃下反应15分钟。将细胞利用FACS缓冲液清洗1次后,加入作为2级抗体的PE标记山羊抗大鼠IgG2aAb,在4℃下反应15分钟。再次将细胞利用FACS缓冲液清洗1次后,通过使用EPICSALTRA的细胞分选或EasySep小鼠PE阳性选择试剂盒(StemcellTechnologies,目录号18554)进行制造商推荐的操作,来去除小鼠细胞。细胞的纯度使用EPICSALTRA进行分析。结果显示在图3中。显示出在由大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325形成的癌细胞团中,去除小鼠细胞后,95%以上的细胞为小鼠MHCI类阴性。(5)大肠癌株的癌形成试验从在上述(2)中制备的细胞液中去除小鼠细胞后,在显微镜下确认癌细胞为单细胞,对细胞数量进行计数。使用经Hank平衡盐溶液(Hank'sBalancedSaltSolution,Invitrogen,目录号24020-117)稀释为50%的Matrigel基底膜基质(MatrigelBasementMembraneMatrix,BD,目录号354234),制备了10000个细胞/mL、1000个细胞/mL、100个细胞/mL的细胞液。将各自的细胞液以100μL/处、即1000个细胞/处、100个细胞/处、10个细胞/处皮下移植到NOG小鼠中,对于形成的肿瘤数量进行评价。结果显示在表1中。在中分化型的大肠癌株PLR123、大肠癌株PLR59中,100个细胞/处以上的移植中可见癌的形成,在低分化型的大肠癌株PLR325中,10个细胞/处以上的移植中可见癌的形成。另外,将具有癌形成能的细胞的频率使用极限稀释分析进行分析。显示出在大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325中分别以1/161、1/195、1/14的频率包含具有癌形成能的细胞。[表1](6)大肠癌株中的等级结构形成的组织学评价由100个细胞、10个细胞形成的癌细胞团在摘出后,以在4%多聚甲醛、4℃、16~24小时的条件下固定,利用AMeX法包埋,来制备薄切组织标本。对组织标本实施了HE染色。结果显示在图4中。在中分化型的大肠癌株PLR123、大肠癌株PLR59中可见等级结构,显示出大肠癌株PLR123、大肠癌株PLR59为癌干细胞。另一方面,在低分化型的大肠癌株PLR325中,未见等级结构,显示出大肠癌株PLR325为癌形成细胞。(7)正常肠道干细胞标志物LGR5蛋白质的检测从在上述(2)中制备的细胞液中去除小鼠细胞后,使用RIPA缓冲液(Sigma,目录号R0278)制备大肠癌株PLR123、大肠癌株PLR59、大肠癌株PLR325的细胞裂解液,进行SDS-PAGE后,进行蛋白质印迹。为了检测LGR5蛋白质使用兔抗人GPR49mAb(Abcam,目录号ab75850)、为了阳性对照使用小鼠抗人GAPDHmAb(SantaCruz,目录号Sc-69778)。结果显示在图5中。在中分化型的大肠癌株PLR123、大肠癌株PLR59中检测到LGR5蛋白质,显示出存在着正常肠道干细胞标志物阳性的细胞。另一方面,在低分化型的大肠癌株PLR325中,未检测到LGR5蛋白质。[实施例2]市售的体外癌细胞株的特征分析(1)市售的体外癌细胞株的培养市售的体外癌细胞株的培养以一般的方法(例如,37℃、5%CO2存在下)为基本,使用ATCC(http://www.atcc.org/)推荐的培养基来进行。需要说明的是,所有培养基中的胎牛血清使用通过在56℃下进行30分钟以上保温处理而灭活的胎牛血清。(2)癌干细胞标志物阳性细胞的检测将体外培养的癌细胞利用Accutase(ICT,目录号AT104)由培养瓶剥下,利用FACS缓冲液悬浮,分别加入作为死细胞染色的7-AAD存活力染料(BeckmanCoulter,目录号A07704)、作为癌干细胞标志物的FITC标记小鼠抗人CD326(EpCAM)mAb、PE标记小鼠抗人CD133/1(AC133)mAb、或PE标记小鼠抗人CD44mAb,在4℃下反应30分钟。接着将细胞利用FACS缓冲液清洗一次后提供于流式细胞术分析。醛脱氢酶(ALDEHYDEDEHYDROGENASE:ALDH)活性通过使用AldeFluor试剂盒进行制造商推荐的操作来检测。在流式细胞术分析中使用EPICSALTRA(BeckmanCoulter),对7-AAD存活力染料阴性的细胞进行癌干细胞标志物的分析。结果显示在图6中。在HCT116中,为几乎所有的细胞显示干细胞标志物阳性这样的均质特征的细胞群。(3)市售的体外细胞株的癌形成试验将体外培养的癌细胞利用Accutase由培养瓶剥下,在显微镜下确认癌细胞为单细胞,对细胞数量进行计数。使用通过Hank平衡盐溶液稀释为50%的Matrigel基底膜基质,制备了10000个细胞/mL、1000个细胞/mL、100个细胞/mL的细胞液。将各自的细胞液以100μL/处、即1000个细胞/处、100个细胞/处、10个细胞/处皮下移植到NOG小鼠中,对于形成的肿瘤数量进行评价。结果显示在表2中。在HCT116中,10个细胞/处以上的移植中可见癌的形成。另外,将具有癌形成能的细胞的频率使用极限稀释分析进行分析。在HCT116中显示出以1/9的频率包含有具有癌形成能的细胞。[表2](4)市售的体外细胞株中的等级结构形成的组织学评价由10个细胞形成的癌细胞团在摘出后,以在4%多聚甲醛中、4℃、16~24小时的条件固定,利用AMeX法包埋,来制备薄切组织标本。对组织标本实施了HE染色。结果显示在图7中。在HCT116中未见等级结构,显示出HCT116为癌形成细胞。(5)正常肠道干细胞标志物LGR5蛋白质的检测使用RIPA缓冲液制备HCT116的细胞裂解液,进行SDS-PAGE后,进行蛋白质印迹。为了检测LGR5蛋白质使用兔抗人GPR49mAb,为了阳性对照使用小鼠抗人GAPDHmAb。结果显示在图8中。在HCT116中未检测到LGR5蛋白质。(6)正常肠道干细胞标志物LGR5阳性细胞的检测将HCT116以5000个细胞/孔接种于Lab-Tek小室玻片(Lab-TekChamberSlide,ThermoScientific,目录号177402)中并进行培养。约24小时后,用于原位杂交。原位杂交通过使用QuantiGeneViewRNA基于板的测定试剂盒(Panomics,目录号QVP0010)、QuantiGeneViewRNA基于板的信号放大试剂盒(Panomics,目录号QVP0200)、QuantaGeneViewRNAGPR49(LGR5)探针组(Panomics、目录号VA1-10587)进行制造商推荐的操作来分析。另外,在核染色中使用DAPI(Invitrogen,目录号D21490)。结果显示在图9中。在HCT116中未见对于LGR5探针阳性的细胞。[实施例3]癌干细胞的体外株化(1)癌干细胞的体外贴壁培养(以下也存在简称为贴壁培养的情况)细胞的培养以一般的方法(例如,37℃、5%CO2存在下)作为基本,使用以下干细胞培养基来进行。干细胞培养基如下制备:向DMEM/F12(Invitrogen,目录号11330057)培养基中分别加入最终浓度为1x的N-2补充物(Invitrogen,目录号17502014)、20ng/mL的重组人EGF(Invitrogen,目录号11330032)、10ng/mL的FibroblastGrowthFactor-basicHumanRecombinant(重组人b-FGF)(Sigma,Cat、No.F0291)、4μg/mL的肝素钠盐(Sigma,目录号H3149)、4mg/mL的AlbuMax富脂BSA(Invitrogen,目录号11010021)、20μg/mL的重组人胰岛素的锌溶液(Invitrogen,目录号12585014)、2.9mg/mL的D-(+)-葡萄糖溶液(45%)(Sigma,目录号G8769)、1x的抗生素-抗霉剂(Invitrogen,目录号15240062)来制备。对于包含癌干细胞的癌细胞,使用干细胞培养基在贴壁培养用的6孔板(BD,目录号353046)中培养。几天后,可见附着在板上的细胞和悬浮的细胞,除去悬浮细胞,仅培养贴壁细胞。将增殖至汇合的贴壁细胞使用Accutase剥下,使用新的贴壁培养用的6孔板、或贴壁培养用的T25培养瓶(BD,目录号353109)、T75培养瓶(BD,目录号356485)、T150培养瓶(BD,目录号355001)培养。用以下(2)所示的方法继续进行传代,直到所有贴壁细胞成为癌干细胞标志物阳性。将一部分细胞悬浮在作为细胞保存液的Bambanker(Wako,目录号302-14681)中,在-80℃以下保存。图10显示体外培养的中分化型的大肠癌株PLR123的形态。仅在悬浮状态下可见被称为球形体的细胞团的形成。(2)癌干细胞标志物阳性细胞的检测将用干细胞培养基进行体外贴壁培养的癌细胞利用Accutase由培养瓶剥下,利用FACS缓冲液悬浮,分别加入作为死细胞染色的7-AAD存活力染料、作为癌干细胞标志物的FITC标记小鼠抗人CD326(EpCAM)mAb、PE标记小鼠抗人CD133/1(AC133)mAb、或PE标记小鼠抗人CD44mAb,在4℃下反应30分钟。接着将细胞利用FACS缓冲液清洗一次后提供于流式细胞术分析。醛脱氢酶(ALDEHYDEDEHYDROGENASE:ALDH)活性通过使用AldeFluor试剂盒进行制造商推荐的操作来检测。在流式细胞术分析中使用EPICSALTRA,对7-AAD存活力染料阴性的细胞进行癌干细胞标志物的分析。结果显示在图11中。在体外进行贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59中,显示出所有的细胞为癌干细胞标志物阳性且均质的细胞群。(3)正常肠道干细胞标志物LGR5蛋白质的检测从细胞液中去除小鼠细胞后,使用RIPA缓冲液分别制备中分化型的大肠癌株PLR123、中分化型的大肠癌株PLR59、用干细胞培养基进行体外贴壁培养的大肠癌株PLR123、用干细胞培养基进行体外贴壁培养的大肠癌株PLR59的细胞裂解液,进行SDS-PAGE后,进行蛋白质印迹。为了检测LGR5蛋白质使用兔抗人GPR49mAb,为了阳性对照使用小鼠抗人GAPDHmAb。结果显示在图12中。在用干细胞培养基进行体外贴壁培养的大肠癌株中检测到LGR5蛋白质的增加。表明通过用干细胞培养基进行体外培养,正常肠道干细胞标志物阳性的细胞得以浓缩。(4)正常肠道干细胞标志物LGR5阳性细胞的检测将用干细胞培养基进行体外贴壁培养的中分化型的大肠癌株PLR123以50000个细胞/孔接种于Lab-Tek小室玻片中并进行培养。约24小时后,用于原位杂交。原位杂交通过使用QuantiGeneViewRNA基于板的测定试剂盒、QuantiGeneViewRNA基于板的信号放大试剂盒、QuantaGeneViewRNAGPR49(LGR5)探针组进行制造商推荐的操作来分析。另外,在核染色中使用DAPI。结果显示在图13中。可见用干细胞培养基进行体外贴壁培养的中分化型的大肠癌株PLR123均对于LGR5探针为阳性。通过用干细胞培养基进行体外培养,显示出正常肠道干细胞标志物阳性的细胞得以浓缩,这显示所有的细胞为正常肠道干细胞标志物LGR5阳性的均质细胞。(5)进行体外贴壁培养的细胞的癌形成试验将进行体外贴壁培养的癌细胞利用Accutase由培养瓶剥下,利用DPBS悬浮数次。使细胞液通过40μm细胞滤过器,在显微镜下确认为单细胞,对细胞数量进行计数。使用通过Hank平衡盐溶液稀释为50%的Matrigel基底膜基质,制备了10000个细胞/mL、1000个细胞/mL、100个细胞/mL的细胞液。将各自的细胞液以100μL/处、即1000个细胞/处、100个细胞/处、10个细胞/处皮下移植到NOG小鼠中,对于形成的肿瘤数量进行评价。结果显示在表3中。在体外进行贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59中,在所有移植中可见癌的形成。显示出体外进行贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59均为具有癌形成能的细胞。[表3](6)癌干细胞的体外株化的评价将进行体外贴壁培养的中分化型的大肠癌株PLR123进一步培养1个月以上,进行癌形成能力的比较。将进行体外贴壁培养的细胞利用Accutase由培养瓶剥下,利用DPBS悬浮数次。使细胞液通过40μm细胞滤过器,在显微镜下确认为单细胞,对细胞数量进行计数。使用通过Hank平衡盐溶液稀释为50%的Matrigel基底膜基质,制备了10000个细胞/mL、1000个细胞/mL、100个细胞/mL的细胞液。将各自的细胞液以100μL/处、即1000个细胞/处、100个细胞/处、10个细胞/处皮下移植到NOG小鼠中,对于形成的肿瘤数量进行评价。结果显示在表4中。培养1个月以上的中分化型的大肠癌株PLR123在所有移植中可见癌的形成。通过体外培养的癌形成能力维持在100%,显示出体外株化获得成功。[表4](7)由体外贴壁培养的10个癌细胞形成的癌细胞团的等级结构形成的组织学评价摘出由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59形成的癌细胞团后,以在4%多聚甲醛中、4℃、16~24小时的条件固定,利用AMeX法包埋,来制备薄切组织标本。对组织标本实施了HE染色。结果显示在图14中。在由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59形成的癌细胞团中,可见与人组织和确立癌细胞株同样的等级结构。另外,在由进行1个月以上培养的体外贴壁培养的中分化型的大肠癌株PLR123形成的癌细胞团中,也可见与人组织和NOG确立癌细胞株同样的等级结构。显示出在体外进行贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59均为具有多分化能的癌干细胞。(8)通过由体外贴壁培养的10个癌细胞形成的人癌细胞团制备的细胞中的癌干细胞标志物的分析将通过由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59形成的癌细胞团制备的细胞利用FACS缓冲液悬浮,加入大鼠抗小鼠MHCI类mAb,在4℃下反应30分钟。将细胞利用FACS缓冲液清洗1次后,分别加入作为2级抗体的PE标记山羊抗大鼠IgG2aAb或APC标记山羊抗大鼠IgG2aAb、作为死细胞染色的7-AAD存活力染料、作为癌干细胞标志物的FITC标记小鼠抗人CD326(EpCAM)mAb、PE标记小鼠抗人CD133/1(AC133)mAb、或PE标记小鼠抗人CD44mAb,在4℃下反应30分钟。接着将细胞利用FACS缓冲液清洗1次后提供于流式细胞术分析。醛脱氢酶(ALDEHYDEDEHYDROGENASE:ALDH)活性通过使用AldeFluor试剂盒进行制造商推荐的操作来检测。在流式细胞术分析中使用EPICSALTRA,对小鼠MHCI类阴性且7-AAD存活力染料阴性的细胞进行癌干细胞标志物的分析。结果显示在图15中。在由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123、大肠癌株PLR59形成的癌细胞团中,可见癌干细胞标志物阴性的细胞,显示出从癌干细胞标志物阳性细胞产生癌干细胞标志物阴性细胞。(9)通过由体外贴壁培养的10个癌细胞形成的人癌细胞团(第一代)制备的细胞的癌形成试验(第二代)从通过由10个细胞进行体外贴壁培养的中分化型的大肠癌株PLR123形成的癌细胞团(第一代)制备的细胞液中去除小鼠细胞后,在显微镜下确认人癌细胞为单细胞,对细胞数量进行计数。使用通过Hank平衡盐溶液稀释为50%的Matrigel基底膜基质,制备了10000个细胞/mL、1000个细胞/mL、100个细胞/mL的细胞液。将各自的细胞液以100μL/处、即1000个细胞/处、100个细胞/处、10个细胞/处皮下移植到NOG小鼠中,对于形成的肿瘤数量和形态进行评价。结果显示在表5中。由于在10处以上可见具有等级结构的癌的形成,所以显示出包含在癌细胞团中的细胞具有作为癌干细胞的自我复制能。另外,由于包含在癌细胞团中的癌干细胞频率为1/95,所以显示出由进行体外贴壁培养的癌干细胞癌产生不持有癌形成能的分化的细胞。[表5](10)由体外贴壁培养癌细胞形成的第二代癌细胞团的等级结构形成的组织学评价摘出由体外贴壁培养癌细胞形成的第二代癌细胞团,以在4%多聚甲醛中、4℃、16~24小时的条件固定,利用AMeX法包埋,制备了薄切组织标本。对组织标本实施了HE染色。结果显示在图16中。在由进行体外贴壁培养的中分化型的大肠癌株PLR123形成的第二代癌细胞团中,可见与人组织和NOG确立癌细胞株同样的等级结构。[参考实施例1]Lgr5蛋白质表达分析(1)表达全长人Lgr4、Lgr5和Lgr6的细胞的确立通过根据NM_018490(Lgr4)、NM_001017403(Lgr5)和NM_003667(Lgr6)的序列的PCR,克隆了全长人Lgr4、Lgr5和Lgr6cDNA。在克隆的基因的N末端付加或不付加HA标签,使其表达。使用基因脉冲器(GenePulser,BioRad),向中国仓鼠卵巢细胞株CHODG44(Invitrogen)中转染表达质粒。使用G418,选择了作为稳定细胞株的HA-Lgr4/DG、HA-Lgr5/DG和HA-Lgr6/DG。(2)可溶性Lgr5-Fc蛋白质的制备使可溶性的Lgr5(氨基酸1~555)蛋白质,作为与CHODG44的小鼠IgG2a的Fc部分的融合蛋白质进行表达。通过使用山羊抗小鼠IgG2a(Bethyllabotratories)和HRP大鼠抗小鼠IgG2amAb(Serotec)的夹心ELISA,筛选转染子。将最丰富地产生sLgr5-Fc的克隆命名为2D3。回收2D3培养上清,将Lgr5-Fc蛋白质通过A蛋白琼脂糖凝胶柱进行亲和纯化(Pharmacia)。Lgr5-Fc作为用于蛋白质免疫和ELISA筛选的抗原发挥作用。(3)利用Lgr5-Fc蛋白质免疫的抗Lgr5单克隆抗体的生成(WO2009063970)使用在费氏完全佐剂中乳化的50μg的Lgr5-Fc,对Balb/c小鼠(CharlesRiverJapan)进行了皮下免疫。2周后,使用费氏不完全佐剂中的同量,反复进行了长达2周、每周1次的注射。在细胞融合的3天前,向小鼠静脉注射了25μg的Lgr5Fc。通过现有方法(KremerL和MarquezG(2004)MethodsMol.Biol.,239,243–260),使来自免疫小鼠的脾淋巴细胞与P3-X63Ag8U1小鼠骨髓瘤细胞(ATCC)相融合。使用ELISA,针对与sLgr5-Fc具有反应性的抗体,筛选了杂交瘤培养上清。确立了Lgr5特异性的小鼠mAb2T15E-2和2U2E-2。(4)关于培养细胞和异种移植组织的免疫荧光染色为了免疫荧光细胞化学,将用4%多聚甲醛和甲醇固定的细胞与小鼠抗人E-钙粘蛋白抗体(Abcam)、兔抗人蜗牛蛋白抗体(Abcam)、或兔抗人β-连环蛋白抗体(Sigma)共同温育,然后使用分别用AlexaFluor488标记的山羊抗小鼠IgG抗体或山羊抗兔IgG抗体进行可视化。为了免疫荧光组织化学,将来自上述异种移植肿瘤的石蜡块的薄片与小鼠抗人Lgr5抗体(2U2E-2)或兔抗人蜗牛蛋白抗体(Abcam)共同温育。与一级抗体温育后,通过与聚合物-HRP(DAKO)结合的山羊抗小鼠抗体检测出Lgr5蛋白质,通过AlexaFluor488标记酪胺酰胺(tyramide)(Invitrogen)进行可视化。通过生物素化山羊抗兔抗体(VECTOR)检测蜗牛蛋白,通过AlexaFluor568标记链霉亲和素(Invitrogen)进行可视化。这些细胞和试样也利用DAPI(Invitrogen)进行染色。(5)流式细胞术分析利用标记抗体温育CSC,使用EPICSALTRA(BeckmanCoulter)和FACSCalibur(BectonDickinson)进行分析。使用的抗体为PE标记小鼠抗人CD133抗体(MiltenyiBiotec)、PE标记小鼠抗人CD44抗体(BDPharmingen)、FITC标记小鼠抗人CD326(EpCAM)抗体(MiltenyiBiotec)、PE标记小鼠抗人CD166抗体(R&DSystems)、PE标记小鼠抗人CD24抗体(BDPharmingen)、PE标记小鼠抗人CD26抗体(BDPharmingen)和PE标记小鼠抗人CD29抗体(BDPharmingen)。为了染色Lgr5,将CSC与小鼠抗人Lgr5抗体(2T15E-2)、接着与PR标记大鼠抗小鼠IgG抗体(Invitrogen)进行温育。醛脱氢酶的活性使用AldeFluor试剂盒(StemcellTechnologies)来测定。通过利用抗小鼠MHCI类抗体(Abcam)和PE或APC标记的山羊抗人IgG2a抗体(BioLegend)进行染色,来区别小鼠细胞和人CSC。死细胞也通过7-AAD存活力染料(BeckmanCoulter)去除。这些抗体对Lgr5具有高度特异性,对于双方对Lgr5都具有高同源性的Lgr4和Lgr6则没有交叉反应(图18、19)。通过使用这些抗体,本发明人证实了贴壁性的癌干细胞表达Lgr5。[参考实施例2]Lgr5阳性和Lgr5阴性的大肠CSC的肿瘤再构建能力若大肠癌的干细胞群的特征为Wnt信号转导,则在体内只有Lgr5阳性的贴壁细胞能够形成肿瘤。为了确认其真实性,本发明人研究了Lgr5阳性的贴壁细胞和Lgr5阴性的悬浮细胞的肿瘤形成能。结果证实,虽然肿瘤形成活性为Lgr5阳性的贴壁细胞强于Lgr5阴性的悬浮细胞,但Lgr5阳性细胞和Lgr5阴性细胞均保持着在NOG小鼠中的肿瘤形成能。通过皮下注射10个Lgr5阳性细胞,在所有注射部位(6处中的6处)产生了肿瘤,然而在Lgr5阴性细胞中,在6处注射部位中的2处(来自PLR123的细胞)或1处(来自PLR59的细胞)形成了肿瘤(表6)。[表6]需要说明的是,Lgr5阳性细胞甚至在每一接种部位只注射1个细胞的情况下,在12处注射部位中的2处(来自PLR123的细胞)或1处(来自PLR59的细胞)再构建了肿瘤(图20),来自Lgr5阳性细胞和Lgr5阴性细胞的肿瘤的组织病理学形态与原本的肿瘤大体上相同(图21)。并且细胞表面标志物的表达和Lgr5阳性CSC的肿瘤形成活性甚至在经历1个月的传代培养后也未发生变化(图22、23)。通过这些结果,证实了来自PLR59和PLR123的Lgr5阳性细胞和Lgr5阴性细胞为高纯度的大肠CSC,以及Lgr5阳性和Lgr5阴性细胞是指大肠癌的2种不同状态的CSC。[参考实施例3]TCF和β-连环蛋白的效果通过以下方法实施了蛋白质印迹分析。使用添加了CompleteMini蛋白酶抑制剂鸡尾酒(Roche)的RIPA缓冲液(Sigma)来提取蛋白质。将蛋白质利用NuPAGE凝胶(Invitrogen)进行分离,转录到PVDF膜上。用含有1%脱脂乳的PBS进行封闭后,将膜用兔抗人β连环蛋白抗体(Sigma)、兔抗人磷酸c-JUN抗体(Sigma)、兔抗人TCF1抗体(CellSignaling)、兔抗人TCF3抗体(CellSignaling)、兔抗人TCF4抗体(CellSignaling)、兔抗人Lgr5抗体(Abcam)、小鼠抗人E钙粘蛋白抗体(Abcam)、兔抗人蜗牛蛋白抗体(Abcam)和、小鼠抗人GAPDH抗体(SantaCruz)探测。使用BCIP/NBT基质(KPL)检测反应性的带。与Lgr5的表达一致,在Lgr5阳性细胞中β-连环蛋白、TCF1、TCF3和TCF4蛋白质的水平被上调,但在Lgr5阴性细胞中未见(图20和图24)。另一方面,就c-Jun的N末端区的磷酸化而言,与Lgr5阴性癌干细胞相比较,在Lgr5阳性癌干细胞中未检测到(图20和图24)。为了解决Wnt信号转导是否驱动大肠癌干细胞的增殖的疑问,本发明人研究了作为β-连环蛋白/TCF抑制剂的FH535和作为Wnt/β-连环蛋白抑制剂的小豆蔻明(诱发β-连环蛋白的分解)对大肠癌干细胞的增殖所赋予的效果。细胞增殖通过以下方法进行评价。将悬浮癌干细胞和贴壁癌干细胞,以分别每孔悬浮癌干细胞约100个和贴壁细胞1×104个接种于96孔板。在第0和第3天,根据制造商的方案,通过细胞计数试剂盒-8测定(CellCountingKit-8assay,Doujindo)测定了活细胞数量。将第0天的平均吸光度表示为100%。为了化学敏感性分析,将悬浮癌干细胞和贴壁癌干细胞以分别每孔悬浮癌干细胞约100个和贴壁细胞1×104个接种于96孔板,温育24小时后,添加10μg/mL的5-FU(Hospira)、10μg/mL的依立替康(Hospira)、50mM的TCF抑制剂FH535(Merck)和50mM的作为β连环蛋白抑制剂的小豆蔻明(Merck)。在药物存在下培养3天后,将细胞计数试剂盒-8加入细胞中。将暴露于DMSO或只有培养基的细胞的平均吸光度表示为100%。所有实验分别进行3次。结果,50μM的FH535显著降低了Lgr5阳性的大肠癌干细胞的增殖,然而对Lgr5阴性的大肠癌干细胞的增殖未造成影响(图25和图26)。另一方面,50μM的小豆蔻明在Lgr5阳性的大肠癌干细胞中使活细胞数量减少至70%,在Lgr5阴性的大肠癌干细胞中使其减少至约50%(图25和图26)。该结果表明:TCF介导Lgr5阳性细胞的增殖和β-连环蛋白参与大肠癌干细胞的生存。令人感兴趣的是,Lgr5阳性细胞即使没有EGF和FGF的供给也会增殖(图27和28),这显示出:大肠癌干细胞包含参与其增殖且用于活化Wnt信号转导的内因性/自我分泌机制。[参考实施例4]大肠癌干细胞的由Lgr5阳性状态到Lgr5阴性状态的交替能力因癌干细胞的特征之一为对于化学治疗剂的抗性,因此本发明人研究了大肠癌干细胞对于5-FU和依立替康的敏感性。如上述所示,Lgr5阳性细胞以加倍时间约2.5天增殖,而Lgr5阴性癌干细胞从增殖的观点看则属于静止状态。用5-FU(10μg/ml)和依立替康(10μg/ml)处理的情况下,无论哪个情况都显著抑制了Lgr5阳性的大肠癌干细胞的增殖,而对Lgr5阴性的大肠癌干细胞的增殖和生存未造成影响(图29和图30)。将Lgr5阳性的大肠癌干细胞暴露于5-FU(10μg/ml)或依立替康(10μg/ml)3天后,出现了对于这些化学治疗剂具有抗性的细胞。惊人的是,该药物抗性细胞为Lgr5阴性且其形态发生了变化(图31、图32和图33),这显示出:由Lgr5阳性状态变化为Lgr5阴性状态。本发明人为了确认Lgr5阴性的大肠癌干细胞是否变化为Lgr5阳性状态,将通过依立替康处理而制备的Lgr5阴性的大肠癌干细胞再次用无血清的干细胞培养液进行贴壁培养时,成为Lgr5阳性,显示间充质细胞样形态的同时(图34和图35),开始了细胞增殖。另一方面,当将Lgr5阳性的贴壁大肠癌干细胞用超低附着培养板培养时,本发明人观察到若干细胞停止增殖,形成球形体样结构,显示非常低水平的Lgr5mRNA(图34和图35)。需要说明的是,Lgr5的mRNA通过下述的定量的实时聚合酶链反应进行评价。即,将使用包括DNA酶处理的RNeasyMini试剂盒(RNeasyMiniKitincludingDNAasetreatment,Qiagen)分离的总RNA作为模板,使用第一链cDNA合成试剂盒(SABiosciences)合成cDNA。定量的实时PCR(QRT-PCR)分析,在Mx3005P实时PCR系统(Stratagene)中使用SYBRGreen/RoxqPCR(SABiosciences)来实施。诱导倍率的值使用2-ΔΔCt法算出。作为参照使用了GAPDH和ACTB。所有实验分别进行3次。作为用于定量的实时PCR分析的引物,将以下引物用于扩增反应性的转录产物。Lgr5:正向引物5'-AGTTTATCCTTCTGGTGGTAGTCC-3'(SEQIDNO:1)、反向引物5'-CAAGATGTAGAGAAGGGGATTGA-3'(SEQIDNO:2)、GAPDH:正向引物5'-CTCTGCTCCTCCTGTTCGAC-3'(SEQIDNO:3)、反向引物5'-ACGACCAAATCCGTTGACTC-3'(SEQIDNO:4)、ACTB:正向引物5'-AAGTCCCTTGCCATCCTAAAA-3'(SEQIDNO:5)、反向引物5'-ATGCTATCACCTCCCCTGTG-3'(SEQIDNO:6)通过上述结果,本发明人得出的结论是:大肠癌干细胞在Lgr5阳性状态和Lgr5阴性状态之间交替,而这样的变化不需要外因性要素和生态位环境。[参考实施例5]Lgr5阳性的大肠癌干细胞在体外和在体内的EMT表达核β-连环蛋白的间充质样细胞被认为是经受EMT的、迁移性癌干细胞和转移形成癌干细胞(BrabletzT,JungA,SpadernaS,HlubekF,KirchnerT(2005)Opinion:migratingcancerstemcells-anintegratedconceptofmalignanttumourprogression.NatRevCancer5:744-749.)。因Lgr5阳性的大肠癌干细胞的形态与间充质细胞相似,所以本发明人对Lgr5阳性的大肠癌干细胞是否相当于迁移性癌干细胞进行了试验。通过蛋白质印迹分析,明确了Lgr5阳性的大肠癌干细胞中低水平的细胞表面E-钙粘蛋白、高水平的蜗牛蛋白以及定位于核内的β-连环蛋白的表达(此为EMT的特征)(图36、图37和图38)。与此相对,Lgr5阴性的大肠癌干细胞不显示任何EMT的迹象,即,细胞表面E-钙粘蛋白高度表达、蜗牛蛋白低度表达,且未见β-连环蛋白的核内定位。并且,观察到:在异种移植肿瘤组织中,在出芽性区经受EMT的细胞中同时表达蜗牛蛋白和Lgr5(图39),这是支持Lgr5阳性的大肠癌干细胞相当于迁移性干细胞的看法的。并且,本发明人表明:Lgr5阳性的大肠癌干细胞在包含肺、肝脏、淋巴结和皮下在内的多个组织中形成肿瘤。令人感兴趣的是,由静脉注射肿瘤细胞开始直到至少40天后,在肝脏、淋巴结和皮下中持有上皮管结构的肿瘤得以再构成,但在肺中未能再构成(图40、41)。产业上的利用可能性通过本发明提供了均质、且实质上具有癌形成能的细胞和没有癌形成能的细胞不共存的、再现癌组织等级结构的癌干细胞组合物及其制备方法。通过使用该均质的细胞群来进行基因表达分析或蛋白质组学分析,期待可以鉴定在癌干细胞中特异性表达的靶标或鉴定被活化的信号转导体系。并且,使均质的癌干细胞的连续大量的制备成为可能,通过使用该癌干细胞的药物候选物质的高通量(highthroughput)分析,期待格外提高发现对于作为对癌患者来说最为深刻的结果的癌的复发或转移有效的药剂或诊断标志物的几率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1