抑制性的抗因子XII/XIIA单克隆抗体及其用途的制作方法
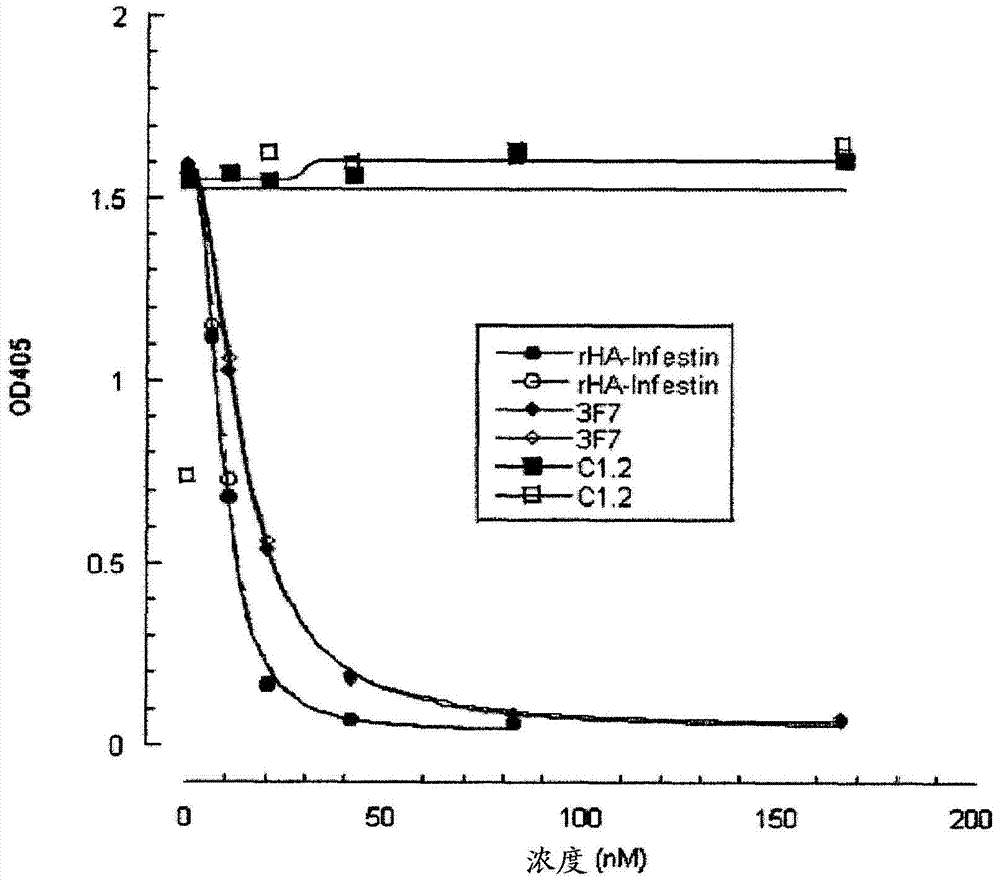
抑制性的抗因子XII/XIIA单克隆抗体及其用途本发明涉及抑制性抗因子XII/FXIIa抗体及其使用方法。因子XII(Hageman因子)是具有约80kDa分子量的血清糖蛋白。除了通过暴露于带负电荷的表面进行自体激活(autoactivation)外,因子XII还通过激肽释放酶经蛋白水解切割形成α-因子XIIa、随后所述α-因子XIIa通过例如胰蛋白酶进一步转化成β-因子XIIa(FXIIa-β)而被另外地激活。α-因子XIIa由约50kDa的N末端重链和约28kDa的C末端轻链组成,所述N末端重链包含接触结合结构域,所述C末端轻链包含催化中心。重链和轻链通过二硫键连接。FXIIa-β是约30kDa的FXII的活性形式,其由通过二硫键连接的完整轻链和2000Da的重链片段组成。血管壁损伤触发突然的血小板附着和聚集,随后是血浆凝固系统的活化和含血纤蛋白的血栓形成,其阻塞损伤的部位。这些事件对于限制创伤后失血是至关重要,但也可阻塞患病血管,从而导致极其重要的器官的缺血和梗塞。在瀑布模型(waterfallmodel)中,血液凝固通过一系列反应进行,所述反应包括通过在凝血酶的产生中达到顶点的限制性蛋白水解对酶原的活化,将血浆血纤蛋白原转化成血纤蛋白并且活化血小板。胶原或血纤蛋白附着性的血小板继而通过在它们外表面上暴露促凝血磷脂(procoagulantphospholipid)(主要地磷脂酰丝氨酸)(这增加了凝血蛋白酶复合物的装配和活化)和通过血小板受体与凝血因子之间的直接相互作用使凝血酶的产生提高数个数量级。存在由脉管系统的外源性(血管壁)或内源性(血液传播)组分触发的两个凝固趋同途径。"外源性"途径由血浆因子VII(FVII)与膜内在蛋白质组织因子(TF)(不存在于腔表面上但在血管的内皮下层中强劲表达的并且是易接近的或通过组织损伤释放的基本凝血辅因子)的复合物启动。在循环微囊泡中表达的TF还可能通过在活化血小板的表面上维持凝血酶产生来促成血栓蔓延。当因子XII(FXII,Hageman因子)与带负电荷的表面在反应(牵涉高分子量激肽原和血浆激肽释放酶)中接触时,"内源性"或接触活化途径被启动。FXll可被内下皮基质的大分子组成例如葡萄糖氨基聚糖和胶原、硫苷脂、核苷酸、多磷酸盐和其它可溶性多聚阴离子或非生理材料例如玻璃或聚合物所激活。最具效力的接触激活物之一是高岭土,并且该反应用作主要临床凝血测试,测量通过“内源性”途径的凝血能力的激活部分凝血酶原激酶时间(aPTT)的机制基础。在通过血小板蔓延的反应中,激活的FXII随后将FXI活化成FXla,随后FXla激活因子IX。FVllla(所述FVllla先前已被痕量FXa和/或凝血酶激活)与FlXa的复合物(tenase复合物)随后激活FX。尽管其在体外诱导血液凝固的高效力,但FXII-触发的内源性凝血途径的(病理-)生理意义受到这样的事实质疑:FXII以及高分子量激肽原和血浆激肽释放酶的遗传性缺乏与出血并发征无关。结合缺乏外来途径组分例如TF和FVll的人和小鼠遭受严重出血的观察结果,得出了当前的假说:体内出血的停止专有地需要外部级联(Mackman,N.2004.Roleoftissuefactorinhemostasis,thrombosis,andvasculardevelopment.Arterioscler.Thromb.Vasc.Biol.24,1015-1022)。在病理条件下,凝血级联可被不适当地活化,这随后导致在血管内形成止血塞。因此,血管可被阻塞并且向远端器官的血液提供受到限制。此过程被称为血栓形成,并且,如果血栓发生栓塞,则称为与高死亡率相关的血栓栓塞。此外,由于内源性凝血级联的活化,与血液接触的假体器官装置的使用受到严重限制。假体表面的适当涂覆可在一些情况下避免所述问题,但可在其它方面削弱其功能。这样的假体器官装置的实例是血液透析器、心肺旁路循环、心脏瓣膜、血管支架和留置导管。在其中使用这样的装置的情况下,施用抗凝剂例如肝素以防止血纤蛋白在表面上形成。然而,一些患者不耐受肝素,其可引起肝素诱导的血小板减少症(HIT),从而导致血小板聚集和威胁生命的血栓形成。此外,临床中使用的所有抗凝剂的固有不利方面是严重出血事件的风险增加。因此,强烈需要有新型抗凝剂,所述抗凝剂与这样的并发症无关并且可用于受累患者或用作防止血栓形成而出血风险不会增加的优良的预防/治疗概念。50多年来,已知凝血因子XII的缺乏与增加的自发或损伤相关出血并发症并不相关(RatnoffOD&ColopyJE1955.Afamilialhemorrhagictraitassociatedwithadeficiencyofaclot-promotingfractionofplasma.JClinInvest34:602-613)。事实上,虽然可容易地通过aPTT(阐明内源凝血途径的临床凝血测试)中测量的病理值来检测,但缺乏FXII的人即使在主要外科手术过程中也未遭受异常出血(ColmanRW.HemostasisandThrombosis.Basicprinciples&clinicalpractice(eds.ColmanRW,HirschJ,MaderVJ,ClowesAW,&GeorgeJ)103-122(LippincottWilliams&Wilkins,Philadelphia,2001))。相反地,已将FXII的缺乏与静脉血栓形成的风险增加相关(KuhliC等人2004.FactorXIIdeficiency:athrombophilicriskfactorforretinalveinocclusion.Am.J.Ophthalmol.137:459-464;HalbmayerWM等人1993.FactorXII(Hagemanfactor)deficiency:ariskfactorfordevelopmentofthromboembolism.IncidenceofFXlldeficiencyinpatientsafterrecurrentvenousorarterialthromboembolismandmyocardialinfarction.Wien.Med.Wochenschr.143:43-50)。支持该想法的研究和病例报告是指FXII缺乏的指标症例,Mr.JohnHageman,他死于肺栓塞。FXII缺乏与增加的血栓前风险相关的假说受到几个病例报告的最近再评价质疑,其最初的报告将FXII缺乏与血栓形成关联起来(GirolamiA等人2004.Theoccasionalvenousthrombosesseeninpatientswithsevere(homozygous)FXlldeficiencyareprobablyduetoassociatedriskfactors:Astudyofprevalencein21patientsandreviewoftheliterature.J.Thromb.Thrombolysis17:139-143)。在大多数情况下,作者鉴定了与因子FXll缺乏组合的伴随的先天性或获得性血栓前风险因子,其可独立于FXII而负责血栓形成事件。使用良好表征的患者的最大流行病学研究(KosterT等人1994.JohnHageman'sfactoranddeep-veinthrombusformation:LeidenthrombophiliaStudy.Br.J.Haematol.87:422-424)和FXII缺陷家族(ZeerlederS等人1999.ReevaluationoftheincidenceofthromboemboliccomplicationsincongenitalFactorXIIdeficiency-astudyon73subjectsfrom14Swissfamilies.Thromb.Haemost.82:1240-1246)显示FXll缺乏与任何促-或抗-血栓形成风险之间无相关性。令人惊讶地,并且与本领域技术人员通常相信的相反,已发现因子XII驱动的内源性凝血途径参与体内动脉血栓形成,但并不是正常组织特异性止血所必需的(RenneT等人2005.DefectivethrombusformationinmicelackingfactorXII.J.Exp.Med.202:271-281;KleinschnitzC等人2006.TargetingcoagulationFactorXIIprovidesprotectionfrompathologicalthrombusformationincerebralischemiawithoutinterferingwithhemostasis.J.Exp.Med.203,513-518;WO2006066878)。出乎意料地,这些结果将因子XII置于病理性血栓形成过程的中心位置。因此,能够干扰和阻断FXll激活或FXll活性的物质可能适合于阻断病原性动脉血栓形成及其临床后果。在W02006066878中推荐使用抗FXII/FXlla的抗体或FXII/FXlla的抑制剂。作为潜在的抑制剂,已建议使用抗凝血酶Ill(ATIll)、血管紧张素转化酶抑制剂、C1抑制剂、抑肽酶、α-I蛋白酶抑制剂、抗蛋白酶素([(S)-l-羧基-2-苯乙基]-氨甲酰基-L-Arg-L-Val-Arginal)、Z-Pro-Pro-醛-二甲基乙酸酯、DX88(DyaxInc.,300TechnologySquare,Cambridge,MA02139,USA;于:WilliamsA和BairdLG.2003.DX-88andHAE:adevelopmentalperspective.TransfusApheresisSci.29:255-258中引用的)、亮抑酶肽、脯氨酰寡肽酶的抑制剂例如Fmoc-Ala-Pyr-CN、玉米胰蛋白酶抑制剂、牛胰胰蛋白酶抑制剂的突变体、ecotin、黄鳍鲽抗凝剂蛋白、笋瓜胰蛋白酶抑制剂-/包括笋瓜同效抑制剂(isoinhibitor)和Hamadarin(如由lsawaH等人2002.AmosquitosalivaryproteininhibitsactivationoftheplasmacontactsystembybindingtofactorXIIandhighmolecularweightkininogen.J.Biol.Chem.277:27651-27658公开的)。作为治疗剂的FXII/FXlla理想抑制剂–虽然显示针对FXII/FXlla的高抑制活性-但未增加出血的风险,不具有免疫原性并且必须尽可能少地施用-理想地仅一次。小分子抑制剂如Z-Pro-Pro-醛-二甲基乙酸酯在施用后将仅具有极短的半衰期,从而需要多次注射,或必须被开发成口服可用的缓释形式,随后在长时间内恒定地提供。人血浆蛋白如C1抑制剂初看起来满足所有要求,具有相对高的针对FXII/FXlla的抑制活性,而不增加出血的风险,作为人蛋白质不具有免疫原性,并且还具有相当长的血浆半衰期。现已令人惊讶地发现,在血栓形成的体内模型中,作为人FXII/FXlla抑制剂的主要候选物的C1抑制剂不能成功地用于防止阻塞。另一个推荐的来自人血浆的FXII/FXlla抑制剂即ATIll抑制剂至少未满足第二个要求,因为出血风险将增加(WarrenBL等人2001.Caringforthecriticallyillpatient.High-doseantithrombinIllinseveresepsis:arandomizedcontrolledtrial.JAMA286:1869-1878)。在WO2008098720A1中推荐使用Kazal型丝氨酸蛋白酶抑制剂lnfestin或其结构域或者基于lnfestin同源物的修饰的Kazal型丝氨酸蛋白酶抑制剂作为FXII/FXIIa的抑制剂。开发了选自该亚组的融合至用于延长半衰期的人白蛋白的重组Infestin-4(rHA-Infestin-4),其显示针对FXII/FXlla的高抑制活性。此外,该物质显示抗血栓形成效能而不削弱(生理学的)止血,同时在融合至人白蛋白后显示有用的半衰期(Hagedorn等人2010.FactorXIIaInhibitorRecombinantHumanAlbuminInfestin-4AbolishesOcclusiveArterialThrombusFormationWithoutAffectingBleeding.Circulation.121:1510-1517)。然而,尽管在开发过程中免疫原性被降低,但在男性中仍然存在免疫原性反应的风险。此外,甚至更长的半衰期将具有额外的有益效应。因此,很明显仍然需要有用于治疗和/或预防血栓形成和类似障碍的改进的药剂。因此,本发明的一个目的是满足这样的需要。这样的改进的药剂的一种候选物是具有抑制活性的改进的抗FXII/FXIIa抗体。已公开了针对因子XII的抗体。Pixley等人(JBiolChem(1987)262,10140-10145)公开了针对人因子XII的单克隆抗体B7C9。该抗体阻断表面介导的促凝剂活性,但不阻断因子XIIa的酰胺裂解活性。Small等人(Blood(1985),65,202-210)公开了针对人因子XII的单克隆抗体,所述抗体阻止因子XII的激活,但不阻止激活的FXII(FXIIa)的凝血或酰胺裂解活性。Nuijens等人(J.Biol.Chem.(1989)264,12941-12949)公开了单克隆抗体F1和F3,其抑制凝血活性而不抑制FXII的酰胺裂解活性。WO8911865提供了针对FXII的轻链产生的单克隆抗体(B6F5、C6B7、D2E10)。这类抗体抑制凝血活性,但仅显示对FXIIa的酰胺裂解活性的部分抑制。WO9008835描述了优于FXII而选择性结合FXIIa-β的单克隆抗体的产生,以及特异性检测血液中的FXIIa-β的免疫测定的开发。根据WO9008835中的实施例7,很清楚该抗体不抑制FXIIa的酰胺裂解活性。WO9117258描述了利用抗FXII抗体OT-2对败血症治疗,所述抗体结合血浆中的天然FXII,并且抑制血浆中的接触系统的活化以及FXIIa的酰胺裂解活性。本发明的一个目的是开发改善的抗体,所述抗体虽然显示对于FXlla的高抑制活性-但不增加出血的风险,不具有免疫原性并且具有长半衰期。由于FXII具有多结构域结构,包括纤连蛋白类型和EGF样结构域(由Stavrou和Schmaier(2010)Thromb.Res.,125:210-215综述的),相信FXII除了其作为FXIIa的作用即在激活后用作酶外,还应当具有另外的重要生理功能。新的研究现已证明FXII促成细胞增殖和生长,从而导致血管生成(由Schmaier和LaRusch(2010)Thromb.Haemost.,104:915-918综述的)。因此,为了不干扰FXII的这些(和可能到目前为止还未知的其它功能)功能,优选抗FXII/FXIIa的治疗性抗体对于FXIIa例如对于FXIIa-β相比于对于FXII具有明确更高的亲和力。发明概述因此本发明的一个方面是抗因子XII/FXIIa单克隆抗体或其抗原结合片段,其对于人因子XIIa-β的结合亲和力为对人因子XII的结合亲合力的2倍以上,并且能够抑制人因子XIIa的酰胺裂解活性。本发明的另一个方面是抗因子XII/XIIa单克隆抗体或其抗原结合片段,当以FXIIa-α对抗体的摩尔比为1:0.2使用时,所述抗体或其片段抑制人因子XIIa-α超过50%。优选地,所述抗体或其抗原结合片段具有下列性质中的一个或多个:-结合鼠FXII/FXIIa;-所述抗体对包含SEQIDNO:2或其相关片段的多肽(其中(a)SEQIDNO:2的位置398上的天冬酰胺残基被赖氨酸置换;或(b)SEQIDNO:2的位置438上的异亮氨酸残基被丙氨酸置换)的结合水平比所述蛋白质对相应的包含SEQIDNO:2或其相关片段而不具有所述置换的多肽的结合水平低;-其包含与SEQIDNO:4的序列具有超过85%同一性的重链可变(vH)区;-其包含与SEQIDNO:5的序列具有超过85%同一性的轻链可变(vL)区;-其包含与SEQIDNO:6的序列具有至少80%同一性的重链CDR1,和/或与SEQIDNO:7具有至少60%同一性的重链CDR2,和/或与SEQIDNO:9的序列具有至少80%同一性的重链CDR3;-其包含与SEQIDNO:11具有至少50%同一性的轻链CDR1,和/或SEQIDNO:12的轻链CDR2,和/或具有序列A-X1-W-X2-X3-X4-X5-R-X6-X7的轻链CDR3,其中X1可以是A或S,X5可以是L或V,其它Xn可以是任意氨基酸(SEQIDNO:14)。-其以优于10-8M的KD结合人因子XIIa-β。-其与Infestin竞争,特别地与infestin-4竞争对人因子XIIa-β的结合。-其为人IgG或其变体,优选人IgG4或其变体。本发明的另一个方面是编码本发明的抗体或其抗原结合片段的核酸。本发明的另一个方面是包含有效地连接于适当启动子序列的编码本发明抗体或其抗原结合片段的核酸的载体。本发明的另一方面是包含本发明的载体的细胞系或酵母细胞。本发明的又一个方面是生产本发明抗体或其抗原结合片段的方法,包括在适合于表达抗体或其抗原结合片段的条件下培养本发明的细胞系或酵母细胞,和从培养上清液纯化所述抗体或其抗原结合片段。本发明的另一个方面是所述抗体或其抗原结合片段用于医学用途。本发明的其它方面是所述抗体或其抗原结合片段用于预防和/或治疗选自下述的病症:静脉、动脉或毛细血管血栓形成、心脏中的血栓形成、在将人或动物受试者的血液与人工表面接触过程中和/或之后的血栓形成、血栓栓塞(通过防止血栓的形成和/或稳定,从而阻止三维管腔内血栓生长,或通过预防和/或治疗管腔内血栓)、间质性肺病(interstitiallungdisease)、炎症、神经炎症性疾病、补体激活、纤维蛋白溶解(fibrinolysis)、与FXII/FXIIa-诱导的激肽形成或FXII/FXIIa-介导的补体活化相关的血管生成和疾病。本发明的另一个方面是所述抗体或其抗原结合片段用于治疗人或动物受试者中与选自下述的病症相关的腔内血栓:静脉、动脉或毛细血管血栓形成、心脏中的血栓形成、在将人或动物受试者的血液与人工表面接触过程中和/或之后的血栓形成、血栓栓塞;间质性肺病、炎症、神经炎性疾病、补体激活、纤维蛋白溶解、血管生成和与FXII/FXIIa-诱导的激肽形成或FXII/FXIIa-介导的补体活化相关的疾病。优选地,所述静脉或动脉血栓形成是中风、心肌梗塞、深静脉血栓形成、门静脉血栓形成、肾静脉血栓形成、颈静脉血栓形成、脑静脉窦血栓形成、Budd-Chiari综合征或Paget-Schroetter病。优选地,与FXII/FXIIa-诱导的激肽形成相关的疾病选自遗传性血管水肿、肺的细菌感染、锥虫属感染、低血压休克、胰腺炎、chagas病、关节痛风、关节炎、弥漫性血管内凝血(DIC)和败血症。优选地,所述间质性肺病是纤维增生和/或特发性肺纤维化。优选地,在对人或动物受试者进行医学操作期间和/或之后,所述人或动物受试者的血液与人工表面接触的过程中和/或之后发生血栓形成,并且在进行所述医学操作之前和/或期间和/或之后施用所述抗体或其抗原结合片段,并且进一步地(i)将人工表面暴露于受试者的至少80%血液体积并且人工表面为至少0.2m2或(ii)人工表面是用于在受试者的机体外收集血液的容器,或(iii)人工表面是用于血液的内部辅助泵动的支架、瓣膜、腔内导管或系统。本发明的又一方面是利用本发明的抗体或其抗原结合片段涂覆的医学装置,其中所述装置是心肺旁路机器(cardiopulmonarybypassmachine)、用于血液氧合的体外膜氧合作用系统、用于帮助血液泵动的装置、血液透析装置、用于血液体外过滤的装置、用于血液收集的容器、管腔内导管、支架、人造心脏瓣膜和/或用任一所述装置的配件,包括管道、套管、离心泵、瓣膜、端口和/或分流器(diverter)。本发明的另一个方面是所述抗体或其抗原结合片段用于在接受医学操作的患者中施用,其中所述医学操作包括与下述中至少一种的接触:(a)心脏,(b)至少一种选自如下血管的血管:主动脉、主动脉弓、颈动脉、冠状动脉、头肱动脉、脊椎基底动脉循环、颅内动脉、肾动脉、肝动脉、肠系膜动脉和/或心脏颅侧动脉系统的血管,(c)如果患者具有已知的中隔缺损,还可以是静脉血管;并且其中所述医学操作包括至少一个栓塞物在机体内至少一个所述血管中的释放,所述释放可导致至少一个靶器官的缺血,以及在该医学操作之前、期间和/或之后施用所述抗体或其抗原结合片段。本发明的另一个方面是所述抗体或其抗原结合片段用于预防或治疗与增加的血管通透性,特别是增加的视网膜血管通透性相关的病况,包括进行性视网膜病变、视网膜病变的威胁视力并发症、黄斑水肿、非增生性视网膜病、增生性视网膜病、视网膜水肿、糖尿病视网膜病变、高血压性视网膜病变和视网膜创伤。本发明的另一个方面是包含本发明的抗体或其抗原结合片段的药物组合物。附图概述图1:使用FXIIa酰胺裂解抑制剂infestin4进行的抗FXIIa噬菌体竞争性ELISA。竞争剂(rHA-Inf4)的浓度示于X轴。使用噬菌体滴定ELISA测定用于测定法中的噬菌体表达的Fab抗体或infestin4(pTacInf4)的固定浓度。图2:作为完全人IgG4的单克隆抗体3F7对人FXIIa的酰胺裂解活性的浓度依赖性抑制。抗人GCSF受体单克隆抗体C1.2(完全人IgG4)用作测定的阴性对照,并且rHA-Infestin用作测定的阳性对照。图3:用于亲和力成熟的3F7重链终止模板。CDR区域涂以灰色,每一个文库中随机化的氨基酸位置称为“x”。图4:用于亲和力成熟的3F7轻链终止模板。CDR区域涂以灰色,每一个文库中随机化的氨基酸位置称为“x”。图5:单克隆抗体3F7和OT-2对人FXIIa的酰胺裂解活性的浓度依赖性抑制。图6:A:小鼠、大鼠和人FXII的催化结构域比对,形成催化三分子(*)的残基和被引入的突变(!)的鉴定,以鉴定抗体3F7的潜在表位。B:显示3F7对各种突变体的结合的Western印迹。图7:在用MAb3F7处理后FeCl3-诱导的血栓形成的阻塞率(n=5-25/组)。图8:MAb3F7对aPTT的作用(n=5-25/组;平均值±SD)图9:MAb3F7对PT的作用(n=5-25/组;平均值±SD)图10:MAb3F7对FXIIa-活性的作用(n=5-25/组;平均值±SD)图11:MAb3F7对止血时间的作用。数据表示为平均值(+SD)。统计数据:p>0.05(Kruskal-Wallis检验)。N=10/组。图12:MAb3F7对总血液损失的作用。数据表示为平均值(+SD)。统计数据:p>0.05(Kruskal-Wallis检验)。N=10/组。图13:MAb3F7对止血时间的作用。水平线代表中值。统计数据:p>0.05(Kruskal-Wallis检验)。N=10/组。图14:MAb3F7对总的血液损失的作用。水平线代表中值。统计数据:p>0.05(Kruskal-Wallis检验)。N=10/组。图15:OT-2、MAb3F7和MAb3F7的亲和力成熟形式的aPTT比较。图16:不同抗体对人因子XIIa-α的抑制的比较。序列表SEQIDNO:1:人FXII序列SEQIDNO:2:小鼠FXII序列SEQIDNO:3:大鼠FXII序列SEQIDNO:4:3F7vH序列SEQIDNO:5:3F7vL序列SEQIDNO:6:3F7重链CDR1(HCDR1)SEQIDNO:7:3F7重链CDR2(HCDR2)SEQIDNO:8:具有变异的3F7重链CDR2SEQIDNO:9:3F7重链CDR3(HCDR3)SEQIDNO:10:具有变异的3F7重链CDR3SEQIDNO:11:3F7轻链CDR1(LCDR1)SEQIDNO:12:3F7轻链CDR2(LCDR2)SEQIDNO:13:3F7轻链CDR3(LCDR3)SEQIDNO:14:具有变异的3F7轻链CDR3SEQIDNO:15:3F7重链终止模板H1SEQIDNO:16:寡核苷酸诱变三聚体混合物3F7H1SEQIDNO:17:3F7重链终止模板H2SEQIDNO:18:寡核苷酸诱变三聚体混合物3F7H2SEQIDNO:19:3F7重链终止模板H3.1SEQIDNO:20:寡核苷酸诱变三聚体混合物3F7H3.1SEQIDNO:21:3F7重链终止模板H3.2SEQIDNO:22:寡核苷酸诱变三聚体混合物3F7H3.2SEQIDNO:23:3F7轻链终止模板L1SEQIDNO:24:寡核苷酸诱变三聚体混合物3F7L1SEQIDNO:25:3F7轻链终止模板L3.1SEQIDNO:26:寡核苷酸诱变三聚体混合物3F7L3.1SEQIDNO:27:3F7轻链终止模板L3.2SEQIDNO:28:寡核苷酸诱变三聚体混合物3F7L3.2SEQIDNO:29:VR119重链CDR2SEQIDNO:30:VR112重链CDR2SEQIDNO:31:VR115重链CDR2SEQIDNO:32:VR110重链CDR2SEQIDNO:33:VR107重链CDR2SEQIDNO:34:VR108重链CDR2SEQIDNO:35:VR103重链CDR2SEQIDNO:36:VR101重链CDR2SEQIDNO:37:VR109重链CDR2SEQIDNO:38:VR99重链CDR2SEQIDNO:39:VR149重链CDR3SEQIDNO:40:VR167重链CDR3SEQIDNO:41:VR148重链CDR3SEQIDNO:42:VR159重链CDR3SEQIDNO:43:VR160重链CDR3SEQIDNO:44:VR24轻链CDR1SEQIDNO:45:VR06轻链CDR1SEQIDNO:46:VR16轻链CDR1SEQIDNO:47:VR05轻链CDR1SEQIDNO:48:VR12轻链CDR1SEQIDNO:49:VR10轻链CDR1SEQIDNO:50:VR14轻链CDR1SEQIDNO:51:VR17轻链CDR1SEQIDNO:52:VR31轻链CDR3SEQIDNO:53:VR29轻链CDR3SEQIDNO:54:VR27轻链CDR3SEQIDNO:55:VR39轻链CDR3SEQIDNO:56:VR46轻链CDR3SEQIDNO:57:VR41轻链CDR3SEQIDNO:58:VR38轻链CDR3SEQIDNO:59:VR58轻链CDR3SEQIDNO:60:VR62轻链CDR3SEQIDNO:61:VR53轻链CDR3SEQIDNO:62:VR52轻链CDR3SEQIDNO:63:VR63轻链CDR3SEQIDNO:64:测序引物CH1RevSEQIDNO:65:测序引物pLacPCRfwSEQIDNO:66:测序引物wtGIIIstumprevSEQIDNO:67:测序引物KpaCLfwdSEQIDNO:68:测序引物LdaCLfwdSEQIDNO:69:测序引物PUCrevSEQIDNO:70:测序引物3254SEQIDNO:71:测序引物SeqCLλSEQIDNO:72:测序引物SeqCH1SEQIDNO:73:VR115的vH序列SEQIDNO:74:VR112的vH序列SEQIDNO:75:VR24的vL序列SEQIDNO:76:VR110的vH序列SEQIDNO:77:VR119的vH序列发明详述本发明的一个目的是开发改善的抗体,所述抗体显示对FXlla的高抑制活性-但不增加出血的风险,并且无免疫原性,具有长半衰期。因此,本发明的一个方面是抗因子XII/FXIIa单克隆抗体或其抗原结合片段,所述抗体或其抗原结合片段对人因子XIIa,优选对人因子XIIa-β的结合亲和力是对人因子XII的结合亲和力的2倍以上,并且能够完全抑制人因子XIIa的酰胺裂解活性的。本发明的另一个方面是抗体或其抗原结合片段,所述抗体或其抗原结合片段对人因子XIIa,优选对人因子XIIa-β的结合亲和力是对人因子XII的结合亲和力的2倍以上能够完全抑制人因子XIIa的酰氨水解活性,并且与表达为IgG4的包含SEQIDNO:4和75所述序列的抗体竞争对FXII/FXIIa的结合。优选地,所述抗体或其抗原结合片段对人因子XIIa,优选对人因子XIIa-β的结合亲和力是对人因子XII的结合亲和力的3倍以上,更优选4倍以上,更优选5倍以上,6倍以上,8倍以上,10倍以上,12倍以上,14倍以上,16倍以上,最优选18倍以上。优选地,所述抗体或其抗原结合片段在低于100nM,更优选低于50nM,更优选低于40nM或甚至低于30nM的浓度完全抑制FXIIa的酰胺裂解活性。优选地,所述抗体或其抗原结合片段在1pM至100nM之间的浓度,更优选5pM至50nM之间的浓度完全抑制。优选地,如实施例1(5)中所述进行FXIIa酰胺裂解活性的测定。本发明的另一个方面是抗因子XII/FXIIa单克隆抗体或其抗原结合片段,所述抗体或其抗原结合片段当以FXIIa-α对抗体的摩尔比1:0.2使用时,抑制因子XIIa-α,优选人因子XIIa-α超过40%,优选超过50%,更优选超过60%。或者,所述抗体或其抗原结合片段在FXIIa-α对抗体的摩尔比1:0.5上抑制因子XIIa-α,优选人因子XIIa-α超过80%,优选超过85%,更优选超过90%;最优选地,所述抗体或其抗原结合片段在1:0.5的摩尔比上实现对FXIIa-α的完全抑制。优选地,所述抗体或其抗原结合片段具有至少可与本文中公开的抗体3F7相当的对人FXIIa的亲和力。优选地,所述抗体或其抗原结合片段结合鼠FXII/FXIIa;更优选地,所述抗体对包含SEQIDNO:2或其相关片段的多肽(并且其中(a)SEQIDNO:2的位置398上的天冬酰胺残基被赖氨酸置换;或(b)SEQIDNO:2的位置438上的异亮氨残基被丙氨酸置换)的结合水平低于所述蛋白质对对应的包SEQIDNO:2或其相关片段而无所述置换的多肽的结合水平。SEQIDNO:2的多肽的相关片段包含催化中心;实例是轻链、FXIIa-β、FXIIa-α或完整FXII。优选地,所述抗体或其抗原结合片段包含重链可变(vH)区,所述重链可变区与SEQIDNO:4的序列具有超过85%的同一性,更优选与SEQIDNO:4的序列具有超过88%、90%、92%、93%、94%、95%、96%、97%,更优选98%或更优选99%的同一性。本发明的一些优选实施方案是包含具有SEQIDNO:4、73、74、76或77所述序列的重链可变区的抗体或其抗原结合片段。优选地,所述抗体或其抗原结合片段包含轻链可变(vL)区,所述轻链可变区与SEQIDNO:5的序列具有超过85%的同一性,更优选与SEQIDNO:5的序列具有超过88%、90%、92%、93%、94%、95%、96%、97%,更优选98%或更优选99%的同一性。本发明的一些优选实施方案是包含具有SEQIDNO:5或75所示序列的轻链可变区的抗体或其抗原结合片段。本发明的一些优选实施方案是具有上述vH区与上述vL区组合的抗体或其抗原结合片段。最优选的是具有下列vH/vL组合的抗体:(a)SEQIDNO:4的vH区域与SEQIDNO:5或SEQIDNO:75的vL区域组合;(b)SEQIDNO:4、73、74、76或77中任一个的vH区域与SEQIDNO:5的vL区域组合。优选地,所述抗体或其抗原结合片段包含与SEQIDNO:6的序列具有至少80%的同一性的重链CDR1(优选SEQIDNO:6的重链CDR1),和/或与SEQIDNO:7的序列具有至少60%的同一性的重链CDR2,和/或与SEQIDNO:9的序列具有至少80%的同一性的重链CDR3。更优选地,重链CDR2具有序列GIX1X2X3X4X5X6TVYADSVKG(参见SEQIDNO:8),其中X1为R、N或D,X2为P、V、I或M,X3为S、P或A,X4为G、L、V或T,X5可以是任意氨基酸,优选X5为G、Y、Q、K、R、N或M,并且X6为T、G或S,和/或重链CDR3具有序列ALPRSGYLX1X2X3X4YYYYALDV(参见SEQIDNO:10),其中X1为I、M或V,X2为S或K、X3为P、K、T或H以及X4为H、N、G或Q。优选地,所述抗体或其抗原结合片段包含与SEQIDNO:11具有至少50%的同一性的轻链CDR1,和/或SEQIDNO:12的轻链CDR2,和/或具有序列AX1WX2X3X4X5RX6X7(SEQIDNO:14中显示的)的轻链CDR3,其中X1为A或S,X5为L或V,X6为G、L或K,并且X2、X3、X4和X7可以是任意氨基酸,优选X2为D、Y、E、T、W、E或S、X3为A、N、I、L、V、P、Q或E,X4为S、D、P、E、Q或R,并且X7为V、A、D、T、M或G。本发明的优选实施方案是具有上述重链CDR与上述轻链CDR组合的抗体或其抗原结合片段。更优选地,所述抗体或其抗原结合片段包含表1中显示的重链CDR(HCDR)与轻链CDR(LCDR)的组合,其中HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3栏中的数字是各自的SEQIDNO:mAbHCDR1HCDR2HCDR3LCDR1LCDR2LCDR368101112143F7679111213VR1196299111213VR1126309111213VR1156319111213VR24679441213VR1106329111213VR1076339111213VR06679451213VR31679111252VR1086349111213VR1036359111213VR1016369111213VR16679461213VR29679111253VR05679471213VR12679481213VR27679111254VR10679491213VR1496739111213VR58679111259VR39679111255VR1676740111213VR62679111260VR1096379111213VR14679501213VR46679111256VR1486741111213VR1596742111213VR53679111261VR52679111262VR1606743111213VR17679511213VR63679111263VR41679111257VR996389111213VR38679111258优选地,本发明的抗体或其抗原结合片段以优于10-7M,更优选优于3x10-8M,更优选优于10-8M,更优选优于3x10-9M,最优选10-9M或甚至5x10-10M的KD结合人因子XIIa-β。优选地,本发明的抗体或其抗原结合片段与Infestin,优选与Infestin-4竞争对于人因子XIIa-β的结合。所述抗体或其抗原结合片段可以是任意同种型,包括IgG、IgM、IgE、IgD或IgA及其任何亚型。优选地,本发明的抗体或其抗原结合片段是人IgG或其变体,优选人IgG4或其变体。用于转换抗体类型的方法在本领域是公知的。分离编码vH或vL区的核酸分子,将其有效地连接编码相应地来自不同种类免疫球蛋白分子的恒定区的不同cH或cL的核酸序列。本公开内容包含本文中描述的包含抗体恒定区的蛋白质和/或抗体。这包括融合至Fc的抗体的抗原结合片段。可用于产生本公开内容的蛋白质的恒定区序列可获自许多不同来源。在一些实例中,所述蛋白质的恒定区或其部分来源于人抗体。恒定区或其部分可来源于任何抗体种类,包括IgM、IgG、IgD、IgA和IgE以及任何抗体同种型,包括IgG1、IgG2、IgG3和IgG4。在一个实例中,恒定区是人同种型IgG4或稳定化的IgG4恒定区。在一个实例中,恒定区的Fc区域具有减小的诱导效应子功能的能力,例如相较于天然或野生型人IgG1或IgG3Fc区而言。在一个实例中,效应子功能是抗体依赖性细胞介导的细胞毒性(ADCC)和/或抗体依赖性细胞介导的吞噬作用(ADCP)和/或补体依赖性细胞毒性(CDC)。用于评估包含Fc区的蛋白质的效应子功能水平的方法在本领域是公知的。在一个实例中,Fc区域是IgG4Fc区域(即,来自IgG4恒定区),例如人IgG4Fc区域。适当的IgG4Fc区域的序列对于本领域技术人员来说是很显然的和/或可在公共可获得的数据库中获得(例如,可获自美国国立生物技术信息中心)。在一个实例中,恒定区是稳定化的IgG4恒定区。术语“稳定化的IgG4恒定区”应理解为意指已被修饰而减少Fab臂交换或发生Fab臂交换或半抗体形成的倾向性或形成半抗原的倾向性的IgG4恒定区。“Fab臂交换"是指针对人IgG4的一种蛋白质修饰,其中将IgG4重链和所连接的轻链(半分子)与来自另一个IgG4分子重-轻链对交换。因此,IgG4分子可获得识别两个不同抗原的两个不同Fab臂(导致双特异性分子)。Fab臂交换在体内天然地发生,并且可通过纯化的血细胞或还原剂例如还原型谷胱甘肽来体外诱导。当IgG4抗体离解而以形成两个各自包含单个重链和单个轻链的分子时,“半抗体”形成。在一个实例中,稳定化的IgG4恒定区在根据Kabat系统(Kabat等人,SequencesofProteinsofImmunologicalInterestWashingtonDCUnitedStatesDepartmentofHealthandHumanServices,1987和/或1991)的铰链区的位置241上包含脯氨酸。该位置对应于根据EU编号系统(Kabat等人,SequencesofProteinsofImmunologicalInterestWashingtonDCUnitedStatesDepartmentofHealthandHumanServices,2001andEdelman等人,Proc.Natl.Acad.SciUSA,63,78-85,1969)的铰链区的位置228。在人IgG4中,该残基通常是丝氨酸。在用脯氨酸置换丝氨酸后,IgG4铰链区包含序列CPPC。这样,本领域技术人员将理解“铰链区”是连接Fc与Fab区的抗体重链恒定区的富含脯氨酸部分,其赋予抗体的两个Fab臂以可动性。铰链区包括参与重链间二硫键的半胱氨酸残基。其通常定义为根据Kabat编号系统的人IgG1中Glu226至Pro243的区段。可通过将形成重链间二硫(S-S)键的第一和最后一个半胱氨酸残基置于相同位置来将其它IgG同种型的铰链区与所述IgG序列进行对比(参见例如WO2010/080538)。稳定化的IgG4抗体的其它实例是其中人IgG4重链恒定区的位置409(根据EU编号系统)上的精氨酸被赖氨酸、苏氨酸、甲硫氨酸或亮氨酸置换的抗体(例如,如在WO2006/033386中描述的)。恒定区的Fc区域可额外地或可替代地在对应于405(根据EU编号系统)的位置上包含选自丙氨酸、缬氨酸、甘氨酸、异亮氨酸和亮氨酸的残基。任选地,铰链区在位置241上包含脯氨酸(即,CPPC序列)(如上文中描述的)。在另一个实例中,Fc区域是经修饰而具有减小的效应子功能的区域,即“非免疫刺激性Fc区域”。例如,Fc区域是在选自268、309、330和331中的一个或多个位置上包含置换的IgG1Fc区域。在另一个实例中,Fc区域是包含下列变化E233P、L234V、L235A和G236缺失中一个或多个和/或下列变化A327G、A330S和P331S中的一个或多个的IgG1Fc区域(Armour等人,EurJImmunol.29:2613-2624,1999;Shields等人,JBiolChem.276(9):6591-604,2001)。非免疫刺激性Fc区域的其它实例描述于例如Dall'Acqua等人,JImmunol.177:1129-1138,2006;和/或HezarehJVirol;75:12161-12168,2001)中。在另一个实例中,Fc区域是例如包含至少一个来自IgG4抗体的CH2结构域和至少一个来自IgG1抗体的CH3结构域的嵌合Fc区域,其中所述Fc区域在一个或多个选自240、262、264、266、297、299、307、309、323、399、409和427(EU编号)的氨基酸位置上包含置换(例如,如WO2010/085682中描述的)。示例性置换包括240F、262L、264T、266F、297Q、299A、299K、307P、309K、309M、309P、323F、399S和427F。本公开内容还涉及对抗体的进一步修饰。例如,所述抗体包含一个或多个增加蛋白质半衰期的氨基酸置换。例如,所述抗体包含含有增加Fc区域对于新生Fc区域(FcRn)的亲和力的一个或多个氨基酸置换的Fc区域。例如,所述Fc区域在更低的pH(例如约pH6.0)具有增加的对FcRn的亲和力,以促进Fc/FcRn在内体中的结合。在一个实例中,所述Fc区域在约pH6下对于FcRn的亲和力比其在约pH7.4下的亲和力更高,其在细胞再循环后促进Fc再释放(因此含Fc区域分子的再释放)进入血液。这些氨基酸置换可用于通过减少从血清的清除来延长蛋白质的半衰期。示例性氨基酸置换包括根据EU编号系统的T250Q和/或M428L或T252A、T254S和T266F或M252Y、S254T和T256E或H433K和N434F。额外的或可代替的氨基酸置换描述于例如US20070135620或US7083784中。更优选地,本发明的抗体是经工程化以在更低的pH(例如pH6)对人新生Fc受体FcRn具有增强的结合的人IgG1或人IgG4,其导致抗体在人血清中的半衰期增加。已描述了筛选最佳Fc变体以最优化FcRn结合的方法(例如Zalevsky等人(2010)NatureBiotech28,157-159)。本发明的其它优选抗体或其抗原结合片段包含哺乳动物免疫球蛋白恒定区,例如哺乳动物同种型例如IgG、IgM、IgE、IgD或IgA及其任何亚型的恒定区。优选地,所述抗体是哺乳动物IgG,包括小鼠IgG、猪IgG、牛IgG、马IgG、猫IgG、狗IgG和灵长类动物IgG或其变体。这些抗体可以是嵌合抗体,其中将本发明的人可变区与选定物种的免疫球蛋白的恒定区组合。或者,所述抗体或其抗原结合片段可通过将本文中描述的人CDR区移植进入来自选定物种的免疫球蛋白的构架残基来产生。优选地,本发明的抗体或其抗原结合片段以其成熟形式成存,即无信号肽;然而,包括信号肽的抗体或其抗原结合片段也包括在本发明中。所述抗原结合片段可以是维持其结合FXIIa的能力的本发明抗体的任意片段。优选的抗原结合片段是Fab片段、Fab’片段、F(ab’)2片段、Fv片段、单链抗体、单链Fv片段、二硫键稳定化的Fv蛋白质或单链Fv片段的二聚体。还包括在本发明中的抗体是嵌合抗体、人源化抗体、鼠源化抗体或双特异性抗体。用于产生这些片段和抗体的方法在本领域是公知的(参见例如,Harlow&Lane:Antibodies,ALaboratoryManual,ColdSpringHarborLaboratory,1988)。还包括在本发明中的是包含本发明抗体的抗原结合片段的融合蛋白或噬菌体颗粒。可将抗原结合片段与例如人血清白蛋白或其变体融合。本领域技术人员十分了解可用作抗原结合片段的融合伴侣的其它蛋白质。还可将抗体或其抗原结合片段融合至标签,例如六组氨酸标签。可给标签提供可切割的接头肽,以便当希望时可从抗体或其抗原结合片段除去该标签。本发明的另一个方面是编码本发明的抗体或其抗原结合片段的核酸。优选地,所述核酸还包含编码信号肽的区域,优选该核酸包含编码重链的信号肽的区域和编码轻链的信号肽的区域。编码由本发明提供的多肽的核酸分子可容易地由本领域技术人员使用所提供的氨基酸序列、可在公共数据库获得的遗传密码和序列来产生。此外,多种功能上等同的核酸可容易地产生,从而也包括在本发明中。可通过任何适当的方法,例如通过直接化学合成来制备核酸分子。用于制备DNA的方法在本领域是公知的。本发明的另一个方面是包含有效地连接至适当启动子序列或整合进入适当表达盒的编码本发明抗体或其抗原结合片段的核酸的载体,其可包含另外的调控元件例如增强子元件来升高表达水平。优选使用强启动子。为了在大肠杆菌(E.coli)中表达,可使用启动子例如T7、lac、trp或λ启动子,优选与核糖体结合位点和转录终止信号相结合。对于哺乳动物细胞,可使用SV40、CMV或免疫球蛋白启动子来提供高表达水平。优选地,所述载体是哺乳动物细胞表达载体,更优选选自Lonza’sGSSystemTM或SelexisGeneticElementsTM系统的载体。优选地,所述载体还包含可选择标记序列例如gpt、neo、amp或hyg基因,以及基因扩增系统例如谷氨酰胺合成酶或DHFR。另一种优选载体是酵母表达载体,例如针对巴斯德毕赤酵母最优化的表达载体。载体还可以是病毒载体。例如基于痘苗病毒、腺病毒或逆转录病毒的载体。载体还可以是用于在昆虫细胞中表达的杆状病毒。本发明的又一方面是包含本发明载体的细胞系或酵母细胞。优选地,所述细胞系是哺乳动物细胞系,例如CHO、HEK293、MDCK、COS、HeLa或骨髓瘤细胞系例如NS0。另一个实施方案是与杆状病毒一起使用的昆虫细胞系,例如SF9细胞、SF21细胞或HighFiveTM细胞。另一种细胞是酵母细胞,例如酵母属(Saccharomyces)例如酿酒酵母(S.cerevisiae)或巴斯德毕赤酵母。细菌宿主细胞例如大肠杆菌也是可能的。用于将DNA引入各自宿主细胞的方法在本领域是公知的。例如,当宿主细胞是哺乳动物细胞系时,可使用技术例如脂转染或电穿孔。本发明的另一个方面是生产本发明的抗体或其抗原结合片段的方法,包括在适当的条件下培养本发明的宿主细胞,例如细胞系或酵母细胞,以表达所述抗体或其抗原结合片段。随后可纯化抗体或其抗原结合片段。优选地,所述抗体或其抗原结合片段由宿主细胞分泌,随后可从培养上清液容易地纯化。用于纯化抗体的技术在本领域是公知的,包括技术例如硫酸铵沉淀、大小排阻层析、亲和层析、离子交换层析等。当在大肠杆菌中表达时,抗体或其抗原结合片段可能产生在包涵体中。分离包涵体和再折叠表达的蛋白质的方法在本领域是公知的。本发明的另一个方面是本发明抗体或其抗原结合片段用于医学用途。本发明的其它方面是抗体或其抗原结合片段用于在人或动物受试者中防止血栓的形成和/或稳定。三维管腔内血栓生长得以减少或甚至阻止。因此,本发明的该方面涉及抗体或其抗原结合片段用于通过预防和/或治疗血栓的形成和/或稳定,从而预防和/或治疗三维管腔内血栓生长,来治疗或预防选自下述的障碍:静脉、动脉或毛细血管血栓形成、心脏中的血栓形成、在将人或动物受试者的血液与人工表面接触的过程中和/或之后的血栓形成以及血栓栓塞。本发明的另一个方面是所述抗体或其抗原结合片段用于治疗人或动物受试者内与选自下述的障碍相关的管腔内血栓:静脉、动脉或毛细血管血栓形成、心脏中的血栓形成、在将人或动物受试者的血液与人工表面接触的过程中和/或之后的血栓形成或血栓栓塞。优选地,静脉或动脉血栓形成是中风、心脏梗塞、深静脉血栓形成、门静脉血栓形成、血栓栓塞,肾静脉血栓形成、颈静脉血栓形成、脑静脉窦血栓形成、Budd-Chiari综合征或Paget-Schroetter病。本发明的其它方面涉及所述抗体或其抗原结合片段用于预防和/或治疗如下疾病:炎症、神经炎性疾病、间质性肺病、补体激活、纤维蛋白溶解、血管生成和与FXII/FXIIa-诱导的激肽形成或FXII/FXIIa-介导的补体活化相关的疾病。优选地,与FXII/FXIIa-诱导的激肽形成相关的疾病选自遗传性血管水肿、肺的细菌感染、锥虫感染、低血压休克、胰腺炎、chagas病、关节石病、关节炎、弥漫性血管内凝血(DIC)和败血症。优选地,间质性肺病是纤维增生性和/或特发性肺纤维化。本发明的一个方面还包括通过给有此需要的受试者施用治疗有效量的所述抗体或其抗原结合片段治疗受试者的上述任何病况或疾病的方法。可以例如通过使用适当的动物模型(例如小鼠模型)验证所述抗体或其抗原结合片段在不同病况中的有益作用。通过利用抗体或其抗原结合片段治疗的动物与对照组的比较,可显示利用抗体进行相应疾病的治疗的有益作用。或者,可测试患者血浆样品的相关参数。例如,可通过使用小鼠模型,例如Han等人(2002)J.Clin.Invest.109:1057-1063中描述的小鼠模型来测试在遗传性血管水肿患者中治疗或预防疾病相关症状中的有益作用。还可预期使用患者血浆样品进行的体外测试;可比较处理的与未处理的患者血浆样品的缓激肽和/或高分子量激肽原水平。抗体应当减少缓激肽产生和/或防止高分子量激肽原水平的降低。优选地,血栓形成在对人或动物受试者进行医学操作的过程中和/或之后将人或动物受试者的血液与人工表面接触的过程中和/或之后发生,并且在进行所述医学操作之前和/或期间和/或之后施用所述抗体或其抗原结合片段,此外其中(i)人工表达被暴露于至少80%的受试者血液体积并且人工表面为至少0.2m2,或(ii)人工表面是用于在受试者的体外收集血液的容器,或(iii)人工表面是用于血液的内部辅助泵动的支架、瓣膜、腔内导管或系统。优选地,所述人或动物受试者的出血风险(i)未增加;和/或(ii)通过如下方面确定:a)通过根据Duke的耳或指尖出血时间,并且其中所述耳或指尖出血时间不长于10分钟,或b)根据Ivy的方法,并且其中出血时间不长于10分钟,或c)根据Marx的方法,并且其中出血时间不长于4分钟。所述医学操作可以是:i)需要心肺旁路术的任何方法,或ii)通过体外膜氧合作用的血液氧合,或iii)血液的内部辅助泵动,或iv)血液透析,或v)血液的体外过滤,或vi)将血液收集在任何容器中以待日后用于动物或人受试者,或vii)管腔内导管的使用,或viii)支架的使用,或ix)人工心脏瓣膜的使用。可在医学操作之前、之后和/或期间施用本发明的抗体或其抗原结合片段,所述医学操作需要心肺旁路术或包括将血液收集在任何容器中以待日后用于动物或人受试者。其还可通过涂覆在人工表面上来进行施用。当医学操作包括献血时,可将抗体或其抗原结合片段:i)在献血过程之前和/或期间给献血者施用,或ii)在收集容器中与血液混合,或iii)在将血液给人或动物受体施用之前、期间和/或之后给受血者施用。优选地,在医学操作之前和/或期间和/或之后除所述抗体或其抗原结合片段之外添加的肝素或其衍生物和/或水蛭素或其衍生物的量,相较于在未施用所述抗FXII/FXIIa抗体或其抗原结合片段时在进行所述医学操作之前和/或期间通常施用的肝素或其衍生物和/或水蛭素或其衍生物的量而言,有所减少或甚至完全省略。优选地,肝素或其衍生物的术后拮抗和/或水蛭素或其衍生物的术后拮抗后的血栓前风险被防止或降低;血栓前风险还可因鱼精蛋白的施用引起。本发明的另一方面是本发明的抗体或其抗原结合片段用于预防或治疗泵压头综合征(PumpHeadSyndrome)的。本发明的其它方面是利用本发明的抗体或其抗原结合片段涂覆的医疗装置,其中所述装置是心肺旁路机器、用于血液氧合的体外膜氧合作用系统、用于帮助血液泵动的装置、血液透析装置、用于血液体外过滤的装置、用于血液收集的容器、管腔内导管、支架、人造心脏瓣膜和/或用于所述装置之任一的配件,包括管线、套管、离心泵、瓣膜、端口和/或分流器。本发明的另一个方面是抗体或其抗原结合片段用于给接受医学操作的患者施用,其中所述医学操作包括与如下种类中的至少一种接触:(a)心脏,(b)至少一种选自如下的血管:主动脉、主动脉弓、颈动脉、冠状动脉、头肱动脉、脊椎基底动脉循环、颅内动脉、肾动脉、肝动脉、肠系膜动脉和/或心脏颅侧动脉系统的血管,(c)如果患者具有已知的中隔缺损,则还可以是静脉血管;并且其中所述医学操作包括至少一个栓塞物在身体的至少一个所述血管中的释放(所述释放可导致至少一个靶器官的缺血),以及在医学操作之前、期间和/或之后施用所述抗体或其抗原结合片段。栓塞物可由气泡、油、脂肪、胆固醇、凝固血液和/或碎片组成。靶器官可以是:(a)脑,并且其中所述患者患有、已患有如下疾病,或处于发生所述疾病的风险中:(i)无症状性脑缺血,或(ii)由非血栓可溶解性物质引起的中风;和/或(b)心脏、肾、肝;和/或胃肠道器官。优选地,所述医学操作包括与所述血管中至少一个或多个的内部接触或夹紧所述血管。优选地,所述医学操作是包括导管、支架、气囊、移植物和/或施用造影剂中任一项或多项的血管方法。优选地,所述医学操作是血管手术和/或诊断性的血管方法/更优选地,所述医学操作是冠状血管造影术、颈动脉支架术、经皮冠状动脉介入疗法、颈动脉内膜切除术、心血管手术或狭窄肾动脉的扩张。本发明的另一个方面是所述抗体或其抗原结合片段用于预防或治疗与增加的血管通透性(特别地增加的视网膜血管通透性)相关的病况,包括进行性视网膜病变、视网膜病变的威胁视力并发症、黄斑水肿、非增生性视网膜病、增生性视网膜病、视网膜水肿、糖尿病视网膜病变、高血压性视网膜病变和视网膜创伤。本发明的另一个方面是包含本发明的抗体或其抗原结合片段的药物组合物。可按照用于制备药物组合物的已知方法配制所述抗体或其抗原结合片段。例如,可将其与一种或多种药学上可接受的载体、稀释剂或赋形剂混合。例如,可使用无菌水或生理盐水。还可包含其它物质,例如pH缓冲液、粘性降低剂(viscosityreducingagent)或稳定剂。众多药学上可接受的赋形剂和载体在本领域是已知的。这样的药物载体和赋形剂以及适当的药物制剂已详细地描述于多种出版物中(参见,例如“PharmaceuticalFormulationDevelopmentofPeptidesandProteins”,Frokjaer等人,Taylor&Francis(2000)或“HandbookofPharmaceuticalExcipients”,第3版,Kibbe等人,PharmaceuticalPress(2000)A.Gennaro(2000)"《雷明顿:药学技术与实践》",第20版,Lippincott,Williams,&Wilkins;PharmaceuticalDosageFormsandDrugDeliverySystems(1999)H.C.Ansel等人,eds第7版,Lippincott,Williams,&Wilkins;和HandbookofPharmaceuticalExcipients(2000)A.H.Kibbe等人,eds.,第3版Amer.PharmaceuticalAssoc)。具体地,可以以冻干或稳定的可溶性形式配制包含本发明抗体的药物组合物。可通过多种本领域已知的方法冷冻干燥多肽。在使用之前,通过添加一种或多种药学上可接受的稀释剂(例如注射用无菌水或无菌生理盐水)重建冻干的制剂。本发明的药物组合物可按本领域公知的剂量和技术施用。施用的量和时间安排将由治疗医生或兽医确定以实现期望的目的。施用途径可以是通过将安全和治疗上有效的剂量递送至待治疗的受试者的血液的任何途径。可能的施用途径包括全身性、局部、经肠和胃肠外途径,例如静脉内、动脉内、皮下、真皮内、腹膜内、口服、跨粘膜、硬膜外或鞘内。优选途径是静脉内或皮下。施用的有效剂量和途径根据多种因素例如受试者的年龄和体重以及根据抗体或其抗原结合片段的性质和治疗范围来确定。剂量的确定通过已知方法来确定,无需过度实验。治疗有效剂量是在需要治疗的患者或受试者中产生积极治疗作用的本发明抗体或其抗原结合片段的剂量。治疗有效剂量在约0.01至50mg/kg,约0.01至30mg/kg、约0.1至30mg/kg、约0.1至10mg/kg、约0.1至5mg/kg、约1至5mg/kg、约0.1至2mg/kg或约0.1至1mg/kg的范围内。治疗可包括提供单个剂量或多个剂量。如果需要多个剂量,则可每日、每隔一日、每周、每两周、每月或每两月或按需施用它们。还可使用缓慢连续释放抗体或其抗原结合片段的储积物(depository)。治疗有效剂量可以是抑制受试者的FXIIa至少50%,优选至少60%、70%、80%、90%,更优选至少95%、99%或甚至100%的剂量。本发明的其它方面是亲和力成熟的抗体或上述抗体的抗原结合片段(或其抗原结合片段)。定义除非另有所指,否则按照常规用法使用所有术语。“抗体”在其最广意义上是包含特异性识别抗原上的表位的免疫球蛋白可变区的多肽。抗体通常由两个相同的重链和两个相同的轻链组成,所述重链和轻链的每一个在其N-末端上具有可变区(vH和vL区)。通常地,vH和vL区将组合而形成抗原结合部位。然而,还描述了其中仅存在一个可变区并且结合抗原的单结构域抗体。通常地,抗体包含通过二硫键连接的两个重链和两个轻链。抗体存在5个主要同种型(IgG、IgM、IgE、IgA、IgD),其中的一些以基本抗体结构的多聚体形式存在。同种型由重链的恒定区确定。存在两种类型的轻链,λ和κ。如本文中所用,术语“抗体”包括完整抗体以及保留抗原结合的其变体和部分。这包括抗体的片段,例如Fab片段、F(ab’)2片段、Fab’片段、单链Fv片段或二硫键稳定化的Fv片段。因此,本文中的术语“抗体或其抗原结合片段”仅是预防性的,术语“抗体”单独地已意欲涵盖抗体及其抗原结合片段。每一个重链和轻链均由可变区和恒定区组成。可变区包含构架残基和高变区(其也被称为互补决定区或CDR)。按照Kabat确定构架残基和CDR的界限;Kabat数据库可在线获得(KabatEA,WuTT,PerryHM,GottesmanKS,FoellerC(1991)Sequencesofproteinsofimmunologicalinterest,第5版.U.S.DepartmentofHealthandHumanservices,NIH,Bethesda,MD)。CDR区在对表位的结合中是非常重要的,从而确定了抗体的特异性。“单克隆抗体”是由单个克隆的B淋巴细胞,或由经工程化而表达单一抗体的细胞系所产生的抗体。“嵌合抗体”是具有来自一个物种的可变区移植至来自不同物种的恒定区上的抗体。“人源化”抗体是其中来自不同物种例如小鼠单克隆抗体的CDR区被移植进入人抗体的构架区的抗体。类似地,“鼠源化”抗体是其中来自不同物种例如人单克隆抗体的CDR区被移植进入小鼠抗体的构架区的抗体。人抗体是整个来源于人的抗体(即人构架区中的CDR和适合于给人施用的任何恒定区)。“种系”抗体是其中将变化引入构架残基的体细胞突变被回复至基因组中存在的原始序列的抗体。“抗原结合片段”是指保留特异性结合抗体所结合的所述抗原中表位的能力的抗体任何片段。这些片段包括但不限于Fab、F(ab’)2或单链Fv片段。“结合亲和力”是指抗体对其抗原的亲和力。其可利用多种技术例如基于表面等离子体共振的技术(BiaCore)来测定。“表位”是抗原决定簇,其由抗原上与抗体接触的残基或特定化学结构来确义。“序列同一性”涉及氨基酸序列的相似性。准备两个序列的最佳可能比对,通过相同残基的百分比测定序列同一性。有标准方法可用于序列的比对,例如Needleman和Wunsch(JMolBiol(1970)48,443)、Smith和Waterman(AdvApplMath(1981)2,482)、Pearson和Lipman(ProcNatlAcadSciUSA(1988)85,2444)等的算法。适当的软件是商购可得的,例如GCG软件包(Devereux等人(1984),NuclAcidsRes12,387),其中比对可利用缺省参数,使用例如GAP或BESTFIT或其后续者来产生。最初由Altschul等人(J.Mol.Biol.(1990)215,403)描述但经进一步改进而包括有缺口的比对(Blast2)的Blast算法(可从不同来源例如EBI、NCBI获得)也产生比对并计算两个序列之间的百分比同一性。“特异性结合”是指基本上仅结合一种抗原。“FXII/FXIIa”是指因子XII和激活的因子XII(FXIIa)之一或两者。因此,“FXII/FXIIa抑制剂”包括FXII和FXIIa之一或两者的抑制剂。此外,抗FXII/FXIIa抗体包括结合并且抑制FXII和FXIIa之一或两者的抗体。“Infestin”是一类来源于吸血昆虫骚扰锥蝽(Triatomainfestans)(已知引起美洲锥虫病的寄生虫枯氏锥虫(Trypanosomacruzi)的主要载体)的中肠的一类丝氨酸蛋白酶抑制剂(CamposITN等人32InsectBiochem.Mol.Bio.991-997,2002;CamposITN等人577FEBSLett.512-516,2004)。该昆虫使用这类抑制剂阻止摄入的血液凝固。Infestin基因编码4个结构域,形成的蛋白质可抑制凝血途径中的不同因子。具体地,结构域4编码作为FXIIa的强抑制剂的蛋白质(Infestin-4)。Infestin-4已被施用于小鼠中而无出血并发症(WO2008/098720)。已将Infestin-4与人血清白蛋白偶联(rHA-Infestin-4)。“FXIIa的酰胺裂解活性的完全抑制”意指对无任何抑制剂存在下的对照实验中观察到的活性抑制80%或更多,优选90%或更多,更优选95%或更多。“因子XIIa的活性”包括因子XIIa的所有形式例如FXIIa-α和FXIIa-β的活性。术语“治疗”或“医治”或“疗法”意欲在广义上进行解释;可包括受试者或患者的任何疾病相关症状或相关生物标志物的水平的改善。实施方案下列实施例举例说明本发明的某些实施方案,但无意将本发明限定于例举的这些实施方案。使用的技术基于本领域技术人员公知的标准实验室技术,并且描述于标准实验室手册中。目的为了从基于DYAXFab的噬菌体展示文库分离完全人抗体,所述抗体能够有效地抑制人FXIIa的酰胺裂解活性。材料rHA-Infestin-4(FXIIa酰胺裂解活性的抑制剂)由ThomasWeimer,HolgerLind和StefanSchmidbauer博士(CSLBehring)提供。人FXII、FXIIa和FXIIaβ购自EnzymeResearchLaboratories(由BanksiaScientific,Qld,Australia提供)。生色底物S-2303来自Chromogenix(由AbacusALS提供)。硫代-NHS-SS-生物素和TMB底物溶液来自Pierce。酶和M13-KO7辅助噬菌体来自NewEnglandBiolabs。Maxisorp免疫板来自Nunc。DynabeadsM-280链霉抗生物素蛋白来自InvitrogenCorp。Twintecskirted96孔PCR板来自Eppendorf。TaqDNA聚合酶来自Scientifix。ExoSAP-It由GEHealthcare提供。BigDyeTerminator测序试剂盒来自AppliedBiosystems。抗人FXII抗体(OT-2)来自Sanquin(Amsterdam,Netherlands)。实施例1.噬菌体展示选择1)噬菌体淘选法将基于人Fab的噬菌体展示文库(DyaxCorp.Cambridge,MA)用于针对生物素化FXIIaβ的筛选。在开始每一轮选择之前,用PBS中的4%牛奶500μL在室温(RT)预温育抗体文库1小时。用3μg的生物素化FXIIaβ于4℃涂覆100μL等分的M280链霉抗生物素蛋白珠粒过夜,随后使用KingFisher磁性颗粒处理器(ThermoFisherScientific)于PBS/0.05%Tween20(PBST)中洗涤3次,于PBS中洗涤一次。使用Dynal磁性颗粒分离器(MPS)(InvitrogenCorp.)收集珠粒,重悬浮于1mL的PBS中2%牛奶中,在RT下翻滚1hr。使用MPS收集封闭珠粒,通过在RT于1mL总体积中用固定化的FXIIaβ温育5.5x1012个集落形成单位(cfu)的噬菌体20分钟来进行第1轮。温育后,收集珠粒,使用Kingfisher利用PBST洗涤10次,随后于PBS中手工洗涤2次。最后,将珠粒重悬浮于500μLPBS中,命名为第1轮输出(总共约0.5x108cfu)。随后通过在以250rpm振荡的条件下,在37℃用一半(250μL)的珠粒感染6mlTG1培养物,进行30分钟来扩增第1轮输出噬菌体。取出1mL感染的培养物,将其于4℃贮存,将2.5x1010pfu的M13KO7辅助噬菌体添加至剩余的5mL培养物,随后在不振荡的条件下于37℃进行另外的温育。通过添加30mL的2xYT培养基(包含100μg/mL氨苄青霉素和50μg/mL卡那霉素)并且在30℃温育过夜来完成扩增。扩增后,通过以4000rpm离心30min来收获细菌沉淀,在添加1:5体积的NaCl-PEG溶液(20%PEG8000,2.5MNaCl)并且在冰上温育60min后从所得的培养基沉淀出噬菌体。将沉淀重悬浮于1mLPBS中,使用台式离心机以8000rpm离心10分钟来除去细菌碎片,如上所述再次沉淀噬菌体。将终噬菌体以1mL的总体积重悬浮于PBS中,对其进行滴定以用作下一轮选择的输入物。如对于第1轮所描述的进行第2和3轮。在第3轮后,通过ELISA进行中试规模的克隆选择和对FXIIaβ结合的初步分析。2)来自第3轮噬菌体展示选择的克隆的中试规模选择和ELISA分析第3轮输出克隆的初步筛选通过Fab-噬菌体ELISA来进行。挑拣集落,将其接种至120μL的包含2%葡萄糖和100μg/mL氨苄青霉素的2xYT中。在37℃,250rpm(InforsSupershaker)下振荡温育这些培养物过夜,将其称为“原始皿(masterplate)”。这些培养物用于在深孔板中接种100μL的2xYT/100μg/mL氨苄青霉素,将板于37℃,700rpm温育至OD600为约0.5。随后将100μL的辅助噬菌体添加至0.5x1010pfu的终浓度,在不振荡的条件下将板在37℃温育30min。将2xYT培养基(包含100μg/mL氨苄青霉素和100μg/mL卡那霉素)添加至拯救培养基以产生25μg/mL终浓度的卡那霉素,随后在振荡(650rpm)的条件下在30℃温育过夜。将所得的培养物以600g离心30分钟,将上清液用于噬菌体ELISA。对于Fab-噬菌体ELISA,在4℃用100μL/孔的1μg/mLPBS中的FXIIa涂覆Nunc免疫板过夜。还包括用单独的PBS涂覆的阴性对照孔。随后在37℃用200μL的5%脱脂奶粉/PBS封闭孔2小时,随后于PBST中洗涤3次。将50μL的1%脱脂奶粉/PBST和50μL的噬菌体培养上清液添加至每一个孔,在振荡的条件下在室温温育板2小时。随后用PBST手工洗涤板5次,将100μL于1%牛奶/PBST中以1/5000稀释的抗M13mAb添加至每一个孔,随后在振荡的条件下在RT温育30min。随后如上所述洗涤板,将100μL的TMB底物添加至每一个孔,随后在振荡的条件下在RT温育板10分钟。通过添加50μL的2M磷酸终止反应,在微量板读数器(WallacVictor)在450nm读取吸光度。12个克隆在单孔ELISA中显示阳性,在竞争性ELISA中进一步测试所述克隆。3)来自第3轮选择的克隆的分析:竞争性噬菌体ELISA在竞争性ELISA中进一步测试在单孔Fab-噬菌体ELISA中发现对FXIIa有反应性的12个克隆针对FXIIa的反应性。简而言之,首先使用滴定ELISA测定来自培养上清液(参见前述部分)的噬菌体滴度。对于滴定ELISA,在4℃利用100μL/孔的1μg/mLPBS中的FXIIa涂覆Nunc免疫板过夜。还包括利用单独PBS涂覆的阴性对照孔。随后在37℃用200μL的5%脱脂奶粉/PBS封闭孔进行2小时,于PBS/0.05%Tween20(PBST)中洗涤3次。将50μL的噬菌体上清液于1%脱脂奶粉/PBST中进行4倍连续稀释,将100μL的每一个稀释物添加至封闭的板。在于振荡的条件下在RT温育1.5hr后,在PBST中手工洗涤板5次,基本上如上述部分所述进行ELISA方案的剩余部分。使用KaleidaGraph软件,利用S形曲线拟合法对数据作图,记录EC50值。对于竞争性ELISA,如上所述涂覆和封闭Nunc96孔免疫板。将噬菌体浓度固定在从滴定ELISA测定的水平,并且连续稀释竞争蛋白质(rHA-Infestin-4)。简而言之,通过将100μL的2倍竞争剂(即对于期望的100nM浓度,使用200nM)置于初始孔中,在其余孔中添加75μL稀释缓冲液(1%脱脂奶粉/PBST),沿着板向下连续稀释25μL的竞争剂来制备竞争剂蛋白的4倍连续稀释物。将75μL的2x噬菌体原液(从滴定ELISA测定的稀释度)添加至每一个孔,将来自每一个孔的100μL转移至涂覆且封闭的板中,如上所述进行ELISA方案的余下部分。将以基因-III融合蛋白形式表达Infestin结构域4(Inf4)的噬菌体在竞争性ELISA中用作阳性对照。命名为3F7和3H4的噬菌体克隆显示具有与对照Inf4-噬菌体相等的EC50值的竞争,并且被选择用于进一步分析(图1)。竞争性ELISA的结果表明rHA-Infestin-4能够与3F7和3H4Fab-噬菌体竞争,并且最可能结合FXIIa上的相似区域。能够结合FXIIa的所有其它噬菌体克隆不被rHA-infestin-4(如由图1中的克隆3G5代表的)竞争,从而不太可能结合FXIIa的催化结构域内的相似区域。4)克隆3F7的分析:序列分析为了测定Fab克隆3F7和3H4的氨基酸序列,使5μL的“原始皿”培养物开始5mL的过夜培养,使用Qiagenminiprep试剂盒分离质粒。使用CH1Rev和pLacPCRfw引物对Fab盒DNA进行测序(表2)。在MelbourneUniversity病理系的DNA测序室进行测序反应和电泳。序列使用SeqMan(Lasergene)来进行分析,发现100%相同,从而从淘选获得了具有与infestin-4竞争对FXIIa的结合的能力的单一抗体(3F7)。表2:用于鉴定噬菌体克隆的测序引物表3:3F7的可变区和CDR的序列。根据KABAT编号系统(KabatEA,WuTT,PerryHM,GottesmanKS,FoellerC(1991)Sequencesofproteinsofimmunologicalinterest,第5版.U.S.DepartmentofHealthandHumanservices,NIH,Bethesda,MD)确定CDR。5)克隆3F7的分析:3F7mAb对FXIIa的抑制为了在体外测定中评价3F7mAb是否抑制FXIIa酰胺裂解活性。将3F7Fab-噬菌体重新格式化成全长人IgG4/λ抗体,使用实施例3中描述的方案进行纯化。简而言之,在Nunc免疫板中,将1μg的FXIIa在rHA-Infestin-4、3F7mAb或对照mAb(抗人GCSFR抗体C1.2)存在或不存在的情况下,在37℃于160μL的体积中温育5分钟。添加40μL的底物(4mMS-2302),将板在37℃进一步温育15min。通过添加40μL的20%醋酸终止反应,在板读数器中于405nm检测颜色变化。使用KaleidaGraph软件,利用S形曲线拟合将数据作图,记录EC50值。如图2中所示,发现3F7抗体有效地抑制FXIIa酰胺裂解活性。实施例2.3F7抗体的亲和力成熟3F7的亲和力成熟的目的是鉴定和表征能够以比亲代抗体更高的亲和力结合人FXIIa的3F7mAb变体。具有更高亲和力的变体有可能显示改善的对FXIIa酰胺裂解活性的抑制。用于产生Fab-噬菌体亲和力成熟文库的方法(参见下面的文库构建)依赖于对ssDNA模板退火的简并寡核苷酸,随后延伸所述寡核苷酸以产生用于转化的双链形式。文库的大小取决于转化效率和使用的引物的简并性。使用的引物(参见下面)覆盖19个氨基酸组合(无半胱氨酸)。设计同时靶向6个氨基酸残基的文库。对于6个残基使用三聚体寡核苷酸的理论多样性为196=4.7x107。1)亲和力成熟文库的设计对于每一个噬菌粒,通过用TAA终止密码子替代所有CDR(除CDR-L2外)中的18个密码子(6个氨基酸残基)来产生种系终止模板。构建体的线性设计如下:NcoI-VL-CL-连接子-VH-SalI。包括了侧翼的NcoI和SalI位点以克隆进入噬菌体展示pTac载体,从而包含用于噬菌体展示的剩余元件。命名为3F7H1、3F7H2、3F7H3.1和3F7H3.2(重链可变区)和3F7L1、3F7L3.1、3F7L3.2(轻链可变区)的终止模板形式由GeneArt产生并且分别示于图3和4中。2)文库构建使用由Sidhu等人(Phagedisplayforselectionofnovelbindingpeptides.MethodsinEnzymology,2000,第238卷,p.333-336)描述的方法,利用pTac-3F7Fab的“终止模板”形式构建文库。每一个终止模板用作用于Kunkel诱变法(Kunkel等人,Rapidandefficientsite-specificmutagenesiswithoutphenotypicselection.MethodsinEnzymology,1987,第154卷,p.367-382)的模板,诱变寡核苷酸(表4)被设计来同时修复终止密码子和在设计的位点引入突变。通过电穿孔将诱变反应物引入大肠杆菌SS320,通过添加M13-KO7辅助噬菌体起始噬菌体的产生。在于30℃过夜生长后,通过利用PEG/NaCl沉淀收获噬菌体。通过对从每一个文库随机挑拣的12个克隆测序来评价诱变效率,其在50至100%的范围内。每一个文库包含0.75-3.75x109个克隆。将引物3254(表2)用于对来自文库L1、L3.1和L3.2的克隆测序,将引物SeqCLλ(表2)用于对来自文库H1、H2、H3.1和H3.2的克隆测序。表4:用于亲和力成熟的3F7诱变三聚体寡核苷酸,其中每一个“Nnn”指示编码19种氨基酸(无半胱氨酸)之一的三联体(由EllaBiotech,Germany生产和提供的)。3)文库淘选通过5轮利用浓度递减的生物素化FXIIaβ的选择循环文库。对于每一轮,靶浓度减小至1/10,从第1轮的40nM减小至第5轮的4pM。利用生物素化FXIIaβ在溶液中进行淘选。在旋转的条件下,将噬菌体样品与于PBST的4%牛奶中稀释的抗原(或仅4%牛奶/PBST制备不具有靶的空白样品)一起在RT温育1hr。在水平振荡的情况下,在37℃于5%脱脂奶粉/PBS中封闭DynalM-280链霉抗生物素磁珠30min。使用MPS收集珠粒,添加噬菌体/抗原混合物,进行30分钟。随后将珠粒于PBST(KingFisherLongWash)中洗涤10次,随后于PBS中进行手工洗涤。最终将珠粒重悬浮于500μL50mMDTT中,在水平振荡的情况下于37℃温育30min。收集洗脱的噬菌体,将其添加至170μL的中和缓冲液(0.351gL-半胱氨酸+5mgBSA,用1MTrispH8制成5mL)。将330μL的洗脱噬菌体用作进行下轮的输入。每一轮选择的富集计算为针对靶选择的洗脱噬菌体对空白样品的比率。4)来自3F7亲和力成熟的克隆的分析在淘选完成时,从每一个富集的文库选择一些噬菌体克隆,使用上述引物进行测序(文库构建)。随后基于序列选择来自每一个文库的独特克隆,将其重新构造成全长人IgG4/λ抗体以进行结合分析。最初使用Biacore以未纯化的细胞培养上清液的形式筛选亲和力成熟的变体,以评价相较于亲代3F7的结合亲和力(如实施例4(1)中描述的)。表5列出了发现具有比3F7更高的对FXIIaβ的结合亲和力的抗体。具有最高亲和力的克隆来自重链CDR2区和轻链CDR1区。表5:基于单个FXIIaβ浓度的结合动力学的3F7和亲和力成熟变体的估计的结合亲和力。在BiacoreA100仪上将所有抗体作为细胞培养上清液中未纯化的IgG4分子进行测试。只显示具有比3F7更好的对FXIIa的亲和力的变体。关于文库位置参考图3和4。基于来自估计的结合亲和力筛选的结果,随后纯化最好的5个mab,对其进行详细的结合亲和力分析(如实施例4(2)中描述的)。如表6中显示的,这些克隆相较于亲代3F7显示结合亲和力有24至57倍的提高。表6:来自表5的纯化3F7和前5位亲和力成熟变体对FXIIaβ的结合亲和力的详细Biacore分析。所有抗体作为完全人IgG4分子进行测试。3F7变体ka(l/Ms)kd(l/s)KD(M)亲和力提高倍数3F71.2x1051.1x10-38.6x10-91VR1151.7x1052.5x10-51.5x10-1057VR1122.5x1054.3x10-5117x10-1051VR242.4x1056.4x10-52.6x10-1033VR1101.1x1053.9x10-53.5x10-1025VR1191.6x1055.9x10-53.6x10-1024实施例3.本发明噬菌体来源的抗体的IgG产生和纯化1)哺乳动物表达载体的构建使用标准分子生物学技术,如先前所描述的(Jostock等人2004.RapidgenerationoffunctionalhumanIgGantibodiesderivedfromFab-on-Phagedisplaylibraries.JImmunolMethods,289;65-80),通过将完整轻链(可变和恒定结构域)和来自选择的噬菌体来源Fab构建体的重链可变结构域克隆进入pRhG4载体来构建哺乳动物表达载体。2)细胞培养从GenechoiceInc.获得无血清悬浮液适应的293-T细胞。将细胞培养在补充有青霉素/链霉素/两性霉素B试剂(Invitrogen)的FreeStyleTMExpression培养基(Invitrogen)中。转染前,将细胞在具有8%CO2的大气的潮湿培养箱中于37℃维持。3)瞬时转染按照制造商的说明书,使用293fectin转染剂(Invitrogen),进行使用293-T细胞的哺乳动物表达载体的瞬时转染。将轻链和重链表达载体组合,利用293-T细胞进行共转染。以1x106个活细胞/ml的终浓度转染细胞(1000ml),将其在2/10WaveBioreactor系统2/10或20/50(WaveBiotech/GEHealthcare)上,在37℃和8%CO2的大气下在Cellbag2L(WaveBiotech/GEHealthcare)中温育5天。培养条件是以8°的角度每分钟35次摇动。转染后4小时添加F-68(Invitrogen)至0.1%v/v的终浓度。转染后24小时,利用TryptoneN1(Organotechnie,France)补充细胞培养物至0.5%v/v的终浓度。通过以2500rpm离心来收获细胞培养上清液,随后在纯化之前将其通过0.45μM滤器(Nalgene)。4)蛋白质表达的分析5天后,将20μl培养上清液在4-20%Tris-甘氨酸SDS聚丙烯酰胺凝胶上进行电泳,通过用考马斯蓝试剂染色来显现抗体。5)抗体纯化使用串联蛋白A亲和层析和脱盐柱层析来纯化单克隆抗体。按照制造商推荐的方法,使用AKTAexpress(GEHealthcare,UK)开发进行HitrapMabSelectsure(1ml,GEHealthcare,UK)和Desalting(HiPrep26/10,GEHealthcare,UK)树脂的层析。简而言之,在1XMT-PBS缓冲液中进行蛋白A亲和柱的平衡。将过滤的条件细胞培养基(500ml)以1ml/min加到柱子上,用1XMT-PBS(10ml)和10mMTris,0.5M精氨酸,150mMNaClpH7.2(80ml)依次洗涤。用0.1M醋酸钠pH3.0(8ml)洗脱结合的抗体,将其直接用于脱盐柱。通过与对照抗体标准比较来层析地测定抗体浓度。将蛋白质级分混合,在使用0.22um滤器进行无菌过滤之前,使用AmiconUltraCel50K离心设备(Millipore)进行浓缩。抗体的纯度利用SDS-PAGE进行分析,其中将还原样品缓冲液(Invitrogen,CA)中的2μg蛋白质加载至NovexNuPAGE4-12%Bis-Tris凝胶(Invitrogen,CA)上,按照制造商的说明书在具有NuPAGEMESSDS电泳缓冲液的XCellSureLockMini-Cell(Invitrogen,CA)中施加200V的恒压进行40分钟,然后使用考马斯染色显现。实施例4.抗体亲和力测定-Biacore分析1)来自未纯化抗体上清液的估计的结合亲和力使用胺偶联化学法将抗人(山羊抗人IgG(γ)小鼠吸附的,Invitrogen,CatNo.H10500)化学地固定在CM-5传感器表面上。在捕获之前,利用电泳缓冲液将培养上清液稀释60倍。捕获抗体180秒,代表了800个反应单位(RU)的平均捕获。随后以0和100nM注射FXIIaβ,进行180秒,离解180秒。在BiacoreA100仪上于37摄氏度进行所有测定,数据拟合1:1动力学模型。2)详细的结合亲和力分析使用胺偶联化学法将抗人(山羊抗-人IgG(γ)小鼠吸附的,Invitrogen,CatNo.H10500)或抗小鼠Fc特异性抗体(JacksonImmunoResearchLabsinc.CatNo.515-005-071)化学地固定在CM-5传感器表面上。随后将固定的抗体用于从溶液捕获抗FXII/FXIIamAb抗体。随后对不同浓度的捕获抗体注射人FXII或FXIIaβ以详细分析结合动力学。扣除来自参照流动池(其中mAb未被捕获,但其它方面同样地进行测试)的反应。随后从所得的传感图减去来自空白注射的反应。使用非线性回归将最终修正的反应拟合描述1:1动力学的模型,包括主动运输限制(masstransportlimitation)的术语。将Rmax值局部拟合,以反映捕获的mAb水平的轻微偏差。测定缔合速率(ka)、离解速率(kd)和平衡解离常数(KD)。关于详细的结合动力学,以一式两份,以0、15.1、31.25、62.5、125、250和500nM注射FXII,以0、1.25、2.5、5、10、20和40nM(10nM一式两份)注射FXIIaβ。对于3F7抗体,在每一个循环后,利用90秒的100mMH3PO4注射进行再生。对于mabOT-2,在每一个循环后,利用60秒的25mM甘氨酸,pH1.7注射、随后30秒的25mM甘氨酸,pH8.6注射进行再生。所有测定在25℃进行。实施例5.3F7与FXIIa酰胺裂解活性的其它抗体抑制剂的比较相关科学文献的综述表明,尽管已描述了许多可调节FXII活性的抗体,但大部分这类抗体是针对重链并且阻止FXII的初始接触活化,或是针对轻链并且表现仅部分抑制FXII酰胺裂解活性。本工作的目的是将3F7与被声称完全阻断FXIIa的酰胺裂解活的抗体OT-2(Dors等人,AnovelsensitiveassayforfunctionalFXIIbasedonthegenerationofkallikrein-C1-inhibitorcomplexesinFXIIdeficientplasmabyglass-boundFactorXII.ThrombosisandHaemostasis,1992,第67卷,p.644-648;Citarella等人,Structure/functionanalysisofhumanFactorXIIusingrecombinantdeletionmutants.EuropeanJournalofBiochemistry,1996,第238卷,p.240-249)进行比较。1)3F7和OT-2抗体对FXIIa酰胺裂解活性的抑制基本上如实施例1(5)中所述,在体外FXIIa酰胺裂解活性测定中比较3F7与OT-2抗体的活性。两种抗体都能够完全阻断FXIIa的酰胺裂解活性(图5)。2)3F7和OT-2mAb对FXII和活化的FXIIaβ的结合的Biacore分析虽然已显示3F7和OT-2都完全抑制FXIIa的酰胺裂解活性,但在该测定中3F7显示小的但可重现的约2倍的更高效力。为了确定3F7和OT-2是否享有FXIIa上的相似表位,我们最初利用这些抗体进行竞争性ELISA,并且显示它们能够有效地彼此竞争对FXIIa的结合(数据未显示)。为了进一步表征这些抗体对FXII的竞争性结合,我们利用针对未活化的FXII和具有催化活性的FXIIaβ的抗体进行Biacore实验。该实验的结果示于表7中,并且显示虽然OT-2显示对FXII或活化的FXIIaβ的结合亲和力相当,但3F7显示明显的对FXII活化形式(FXIIa)的结合的倾向性。这些结果显示虽然两种抗体似乎结合FXII的轻链上的相似区域,但它们似乎不共有相同的表位。3F7优先结合活化的FXII的能力可能赋予药物动力学和/或药效动力学的优势面。表7:纯化的IgG单克隆抗体3F7和OT-2对FXIIaβ的结合亲和力的详细Biacore分析。mAbFXIIKD(nM)FXIIaβKD(nM)3F7121±19(N=3)6.2±0.2(N=3)OT-20.69±0.25(N=3)0.76±0.077(N=3)实施例6:鉴定参与3F7结合的关键FXIIa残基在就其抑制来自许多物种的FXIIa活性的能力方面筛选了3F7后(数据未显示),我们确定3F7具有高度的抗小鼠和人FXIIa但非大鼠FXIIa的效力。使用该信息,我们通过产生重组鼠FXII(通过使用Western分析,其被3F7识别)和突变与大鼠氨基酸相异的不同残基来研究FXIIa轻链内的哪些关键残基参与3F7表位(参见图6)。如结果显示的,突变位置398或438消除了3F7的结合。1.野生型和突变型鼠因子XII(Mu-FXII)的构建和表达编码完整Mu-FXII蛋白的cDNA(GenBank登录号.NM_021489)获自GeneARTAG(Regensberg,Germany)。利用标准PCR技术将该cDNA用作模板来产生下列单独的残基变化:a)N376D、b)A385D、c)N398K、d)W420R、e)R427H、f)I438A、g)Q450R、h)delE451、i)S452G、j)K453R、T454K、k)G472S、l)N516S、m)T538A和n)A589D。除f)I438A外,这些残基变化对应于小鼠残基向其大鼠直系同源物的转换(GenBank登录号NM_001014006)(参见图6A)。在h)的情况下,这牵涉Glu451的缺失。产生一个另外的突变体(o),包含小鼠至大鼠的氨基酸变化E552D、T555V和A556T的多重突变体。在3'末端修饰所有构建体以编码C末端8xHis-标签,将所述构建体克隆进入哺乳动物表达载体pcDNA3.1(Invitrogen,Carlsbad,USA),通过DNA序列分析验证序列。将FreestyleTM293悬浮细胞(Invitrogen)于5mlFreestyleExpression培养基(Invitrogen)中生长至1.1x106个细胞/ml。用167μLOpti-MEMI培养基(Invitrogen)预温育7μL293Fectin(Invitrogen)转染剂5分钟,随后将其添加至5μg编码野生型或突变型Mu-FXII的质粒DNA,将混合物再温育20分钟。将DNA-293Fectin复合物添加至在37℃,8%CO2下于以250rpm振荡的培养箱中培养6天的细胞中。通过以2000rpm离心5分钟收获培养上清液,于4℃贮存以用于分析。2.Western印迹将包含重组野生型或突变型mu-FXII的上清液添加至等体积的2x非还原样品缓冲液,于80℃温育10分钟,随后加载至预铸的4-12%Bis-Tris凝胶(Invitrogen)上,在200V进行电泳1小时。随后将蛋白质电泳转移至硝酸纤维素滤膜上,于具有0.05%Tween-20的Tris-缓冲盐溶液(TTBS)中的5%脱脂奶粉中封闭1小时。随后用3F7mAb或抗HismAb3H3(两者以1mg/mL(于具有5%脱脂奶粉的TTBS中)的浓度)温育滤膜1小时,用TTBS充分洗涤,随后分别用抗人IgG-FITC或抗小鼠IgG-FITC(Millipore,USA;两者0.25mg/ml(于具有5%脱脂奶粉的TTBS中)的浓度)再温育1小时。在将膜于TTBS中进一步洗涤后,使用Typhoonvariablemode分析仪(GEHealthcare,USA)显现Ab-FITC结合的蛋白质。结果示于图6B中。当突变小鼠序列的残基398和438时,3F7的结合被消除,这表明这两个残基可能是mAb3F7的表位的部分。实施例7:通过利用单克隆抗体3F7的静脉内处理预防小鼠的FeCl3-诱导的动脉血栓形成先前的研究(例如WO2006066878中公开的)已显示FXIIa的抑制阻止小鼠中FeCl3-诱导的动脉血栓形成。本研究的目的是探究小鼠是否也通过利用针对凝血因子XIIa的特异性单克隆抗体(MAb3F7)的处理得以保护而免于动脉血栓形成。方法处理组如表8中显示的:表8:处理组1N.a.=不适用品系NMRI的小鼠(获自CharlesRiverLaboratories,雌性,6-8周龄,重量为25至39g)在深度麻醉的t=-15min接受表8中所列的处理溶液的单次静脉内注射。随后,定量各处理对血栓阻塞率的作用。通过将超声流量探测器置于暴露的颈动脉周围来测定基线血流。为了引发血栓形成,在t=0min将0.5mm2(0.5×1.0mm)利用10%氯化铁溶液饱和的滤纸贴片置于流量探测器下游的颈动脉上。3分钟后,除去滤纸,监测血流60分钟以测定血栓性阻塞的发生。在60分钟的观察期后,从研究动物获取血液样品(抗凝剂:10%柠檬酸盐)。随后,按照标准方法制备血浆,将其深度冷冻(-80℃±10℃)直至测定aPTT(活化的部分促凝血酶原激酶时间)、PT(促凝血酶时间)和FXIIa-活性。aPTT的测定:通过将50μL的研究血浆样品(参见上文)添加至50μLPathromtinSL(SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany),随后通过在37℃进行120秒的温育期来测定aPTT。随后,添加50μL的氯化钙溶液(25mM,SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)以起始反应。PT的测定:在于37℃温育15秒后,通过将50μL的研究血浆样品(参见上文)添加至100μL的活化试剂ThromborelS(SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)来测定PT。FXIIa-活性的测定:FXIIa活性通过使用基于aPTT的测定来进行测定,并且将其与利用标准人血浆和FXII-缺乏血浆(SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)的稀释物获得的参照曲线相比较。将50μL利用咪唑缓冲液(SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)以1:5预稀释的研究血浆样品(参见上文)添加至50μL的FXII缺乏血浆。在于37℃温育30秒后,添加50μLPathromtinSL(SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany),随后将溶液在37℃温育120秒。随后,添加50μL的氯化钙溶液(25mM,SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)以起始反应。按照由各自测定试剂的提供商建议的条件在BCT(BehringCoagulationTimer;SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)中进行所有3个分析(SiemensHealthCareDiagnosticsProductsGmbH,Marburg,Germany)。结果:30mg/kg、20mg/kg、10mg/kg和5mg/kgMAb3F7的静脉内注射导致小鼠的颈动脉免于FeCl3诱导的阻塞的完全保护(表9,图7)。在递减的剂量(即2.5-0.5mg/kg)上,阻塞率增加,然而阻塞时间以剂量依赖性方式减少(表9,图7)。相较于对照,PT未改变(表10,图9),然而aPTT在高剂量下延长约4倍(表10,图8)。FXIIa活性在10mg/kg和更高剂量上几乎完全被抑制,但在0.5mg/kg的剂量上仍然保留一半(表10,图10)。此外,aPTT减少,而FXIIa活性在MAb3F7的递减剂量下以剂量依赖性方式增加(表10,图8和10)。对照MAb未显示免于FeCl3诱导的颈动脉阻塞的保护作用,并且aPTT、PT和FXIIa活性值未被改变(表9、10,图7-10)。表9:阻塞率表10:PT、aPTT和FXIIa-活性(平均值±SD)讨论:本研究表明小鼠在利用MAb3F7以5mg/kg或更高剂量静脉内处理后受到完全保护而免于动脉血栓形成。在递减的剂量上,阻塞率增加,然而阻塞时间以剂量依赖性方式减少。相较于对照,PT未改变,而aPTT和FXIIa活性分别以剂量依赖性的方式延长和减少。总之,MAb3F7显示了惊人的效力特征和期望的剂量反应关系。实施例8:抗FXIIa单克隆抗体3F7对小鼠的半水生出血模型的止血的效果实施例7已显示MAb3F7在30-5mg/kg的剂量上完全阻止小鼠中FeCl3诱导的动脉血栓形成。除了该作用以外,FXIIa活性几乎被完全抑制,aPTT在这些保护性剂量上被延长高达4倍。为了阐明这样的作用是否会影响生理止血的问题,本研究的目的是在其最低完全保护剂量(即5mg/kg)以及5倍于该剂量的剂量(即25mg/kg)上对鼠尾尖出血模型的止血的作用方面研究MAb3F7。方法表11:处理组1N.a=不适用的雌性NMRI小鼠获自CharlesRiverLaboratories(Kisslegg)。它们为6至8周龄并且重量为25至32g。在半水生模型中测定止血。简而言之,通过定量止血的时间和血液损失来测定尾尖出血参数。通过测量用于浸没尾尖的盐溶液中存在的血红蛋白来计算总的血流损失体积。相应地考虑动物的血红蛋白。在深度麻醉(Narcoren)下利用解剖刀进行尾尖切割,除去约3mm的尾尖。在损伤后立即将尾尖浸没于盐溶液中,使用水浴将其保持在小鼠的生理体温。监测出血的观察期为30min。在观察期(尾切割)开始前5min.施用所有检测品。结果:不依赖于组,所有动物在观察期内显示止血(表12)。止血时间和总的血液损失在组间无差异(表12和13,图11至14;Kruskal-Wallis检验:p>0.05)。表12:在利用MAb3F7处理后30分钟内止血的频率和时间(N=10/组)表13:在用MAb3F7处理后总的血液损失(N=10/组)讨论:根据本研究的结果,可得出如下结论:通过使用鼠尾尖出血模型,MAb3F7的两个强有力地阻止小鼠的FeCl3诱导的动脉血栓形成的应用剂量(5和25mg/kg)对生理止血没有效果。实施例9:3F7和亲和力成熟形式的aPTT的比较在标准人血浆(SHP,DadeBehring)中测定激活部分促凝血酶原激酶时间(aPTT),其中将不同量的各自抑制剂添加至生理盐水至200μL的总体积。将50μL的该溶液添加至50μLPathromtinSL(DadeBehring),在37℃温育120秒。随后,添加50μL的氯化钙溶液(25mM)以起始反应。按照由制造商建议的条件在BCSXP(BehringCoagulationSystem)中进行该方法。比较OT-2、MAb3F7和MAb3F7的亲和力成熟形式的aPTT。结果示于图15中。MAb3F7的亲和力成熟形式的活性显著高于OT-2和原始MAb3F7。实施例10:不同抗体对因子因子XIIa-α的抑制的比较基本上如上文实施例1(5)中所述进行抑制测定。在该情况下,以对人因子XIIa-α的不同摩尔比(范围从1:0.1至1:10)比较3F7、亲和力成熟的3F7衍生物和OT-2。数据示于下面的表14中和图16中。3F7和亲和力成熟的衍生物显示比OT-2更好的抑制,从而OT-2需要比3F7及其衍生物更多的量来实现最大抑制。表14:
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1