一类稠杂环醛缩氨基硫脲荧光淬灭型汞离子探针的制作方法
本发明涉及一类稠杂环醛缩氨基硫脲汞离子荧光探针的制备及其对水环境中汞离子的检测。
背景技术:
汞离子是当今化学工业中起到非常重要作用的金属元素之一。汞离子毒性较强,在细菌的作用下可以转化为甲基汞,并不断在生物体内富集,对人类健康和环境的影响很大。过度接触汞及其衍生物会对脑、肾、中枢神经系统等造成极大伤害。因此,开发研究快速、方便有效的新型汞离子检测方法显得尤为重要。近年来,荧光探针因具有选择性高、灵敏度高、操作简单等优点越来越受到人们的关注。因此,开发汞离子荧光探针成为化学工作者们的工作重点之一。
稠杂环化合物中具有较大的共轭结构,且通过简单的结构修饰就可以调节发光波长,因此具有较好的光电特性。又因分子中含有S、O、N等杂原子,具有较多的反应位点,易与金属离子配位,使得稠杂环化合物在光电功能器件、染料和金属离子分析检测方面有广泛应用。
氨基硫脲中含配位能力很强的氮原子、硫原子,所以能和金属离子进行配位、反应或与阴离子形成氢键,从而实现对金属离子、阴离子的识别。基于此我们将稠杂环醛与氨基硫脲结合来发展新型的汞离子荧光探针。
本发明将含有噻吩基、呋喃基的苯并喹喔啉稠杂环醛的光学特性和氨基硫脲与金属离子的配位能力相结合,进而实现对汞离子快速及时检测。
技术实现要素:
技术问题:本发明的目的是针对上述技术分析,提供一种苯并喹喔啉类稠杂环醛缩氨基硫脲的制备方法及其在金属离子检测方面的应用。该探针制备方法简单、成本低,且能实现对汞离子快速专一的选择性识别。
技术方案:两种基于稠杂环醛缩氨基硫脲的汞离子荧光探针,化合物名称为(2E,2'E)-2,2'-(5,5'-(苊并[1,2-b]喹喔啉-8,11-二基)二(噻吩-5,2-二基))二甲醛双缩氨基硫脲(M1)和(2E,2'E)-2,2'-(5,5'-(苊并[1,2-b]喹喔啉-8,11-二基)二(呋喃-5,2-二基))二甲醛双缩氨基硫脲(M2),分子式分别为C30H20N8S4和C30H20N8O2S2,在波长为365nm的紫外灯照射下发橘红色荧光,这两个化合物的分子结构式为:
。
两种所述的基于稠杂环醛缩氨基硫脲的汞离子荧光探针M1、M2制备方法,具体步骤如下:
1. 4,7-二溴苯并噻二唑通过NaBH4还原制得3,6-二溴邻苯二胺(2);
2. 将3,6-二溴邻苯二胺与苊醌反应制得8,11-苊并[1,2-b]喹喔啉(3):
3. (5-甲酰基噻吩-2-基)硼酸/(5-甲酰基呋喃-2-基)硼酸和(3)发生Suzuki反应获得5,5'-(苊并[1,2-b]喹喔啉-8,11-二基)二噻吩-2-甲醛(4)和5,5'-(苊并[1,2-b]喹喔啉-8,11-二基)二呋喃-2-甲醛(5):
(4)和(5)与氨基硫脲缩合制得上述荧光探针M1、M2。
化合物M1、M2用于汞离子检测的具体步骤如下:
1. 配制1.0×10-5摩尔/升的含有1微升,50毫摩尔,pH=7.2 tris-HNO3缓冲溶液的M1和M2二甲基亚砜溶液3毫升,并记录其荧光光谱;
2. 向1所述的M1和M2溶液中加入汞离子水溶液,搅拌混合一分钟,立即用499 nm波长的光激发,测定其荧光光谱就可以对汞离子进行识别,且能够根据光谱的变化程度定量汞离子的浓度。
化合物M1和M2用于汞离子裸眼检测的具体步骤如下:
1. 在西林瓶中配制1.0×10-5摩尔/升的含有1微升,50毫摩尔,pH=7.2 tris-HNO3缓冲溶液M1和M2二甲基亚砜溶液3毫升;
2. 分别向其中加入2微升1×10-1摩尔/升金属离子水溶液,搅拌混合一分钟,在自然光下和手提式紫外灯365 nm灯光照射下对比其颜色变化。
该汞离子荧光探针的检测原理:利用M1和M2中的氨基硫脲部分与金属离子高配位能力,通过氨基硫脲与汞离子络合引发M1和M2荧光强度淬灭,从而实现对汞离子的检测。
技术优点:
1. 本发明的荧光探针M1和M2分子中共轭程度高,荧光颜色为橘红色,光学性质稳定;
2. 本发明的荧光探针M1和M2分子为对称结构,且为双官能团荧光探针;
3. 化合物M1和M2在溶液状态下颜色呈橘红色,加入汞离子后溶液颜色变成粉色且荧光淬灭,可以通过荧光和裸眼两种方式检测;
4. 本发明提供的这两种探针选择性高,不会受其他金属离子的干扰,尤其不会受银离子和铜离子的干扰,准确性高;
5. 本发明提供的探针操作简便、检测灵敏度高、检测速度快。
附图说明
图1. 实施例2中,M1分子在混合溶剂中对各种金属离子(水溶液)的选择性荧光发射光谱图。
图2. 实施例2中,M2分子在混合溶剂中对各种金属离子(水溶液)的选择性荧光发射光谱图。
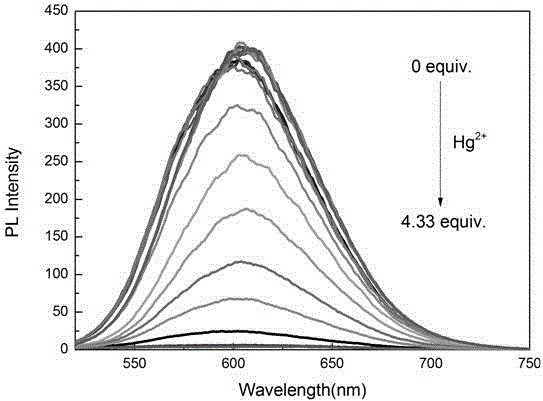
图3. 实施例3中,随着汞离子水溶液的加入,M1分子在混合溶剂中的荧光发射光谱滴定图。
图4. 实施例3中,随着汞离子水溶液的加入,M2分子在混合溶剂中的荧光发射光谱滴定图。
图5. 实施例4中,M1分子在混合溶剂中对各种金属离子(水溶液)抗干扰性荧光发射光谱图。
图6. 实施例4中,M2分子在混合溶剂中对各种金属离子(水溶液)抗干扰性荧光发射光谱图。
图7. 实施例5中,M1分子在混合溶剂中对各种重金属离子(水溶液)在自然光下和365 nm紫外灯照射下的裸眼识别图。
图8. 实施例5中,M2分子在混合溶剂中对各种重金属离子(水溶液)在自然光下和365 nm紫外灯照射下的裸眼识别图。
图9. 实施例6中,M1的核磁滴定谱图。
图10. 实施例6中,M2的核磁滴定谱图。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但本发明并不限以下实施例。
实施例1、化合物M1和M2的制备:
将50毫克(0.25毫摩尔)氨基硫脲溶于10毫升无水乙醇,再加入0.5毫摩尔的5,5'-(苊并[1,2-b]喹喔啉-8,11-二基)二噻吩-2-甲醛(4)/5,5'-(苊并[1,2-b]喹喔啉-8,11-二基)二呋喃-2-甲醛(5)和0.5毫升冰乙酸,回流7小时。反应完成后得红色固体,冷却,过滤,所得固体用无水乙醇、水、无水乙醇洗三次,干燥,产率分别为80%和81%。M1:m.p. >300 ℃; FT-IR(cm-1): 3418, 3261, 3154, 1584, 1535, 1292. 1H NMR (400 MHz, DMSO, ppm) δ 11.57 (s, 1H), 8.58 (d, J = 7.0 Hz, 1H), 8.44 – 8.30 (m, 4H), 8.13 (d, J = 4.1 Hz, 1H), 8.06 – 7.96 (m, 1H), 7.80 (s, 1H), 7.60 (d, J = 4.1 Hz, 1H). 13C NMR (100 MHz, DMSO-d6, ppm) δ 177.69, 152.15, 141.73, 140.40, 138.09, 136.85, 136.29, 131.31, 130.76, 130.54, 130.24, 129.85, 129.32, 128.20, 127.05, 123.31. HR-MS (TOF-MS): m/z = 621.0847 ([M+H]+), 419.2335 ([M+H-2C2H3N3S]+), calcd for (C30H20N8S4)+ = 621.0772。M2:FT-IR(cm-1): 3418, 3254, 3149, 1576, 1524, 1274. 1H NMR (400 MHz, DMSO, ppm) δ 11.60 (s, 1H), 8.50 (d, J = 7.0 Hz, 1H), 8.37 (s, 2H), 8.29 (d, J = 8.2 Hz, 1H), 8.15 (d, J = 3.6 Hz, 1H), 8.08 (s, 1H), 7.98 – 7.89 (m, 1H), 7.82 (s, 1H), 7.22 (d, J = 3.6 Hz, 1H). 13C NMR (100 MHz, DMSO, ppm) δ177.91, 152.49, 151.53, 149.15, 136.86, 136.10, 132.00, 130.87, 130.37, 129.79, 129.17, 126.82, 125.69, 122.73, 116.72, 116.25.HR-MS (TOF-MS): m/z = 589.1200, calcd for (C30H21N8O2S2)+= 589.1229 ([M+H]+)。
实施例2、M1和M2对金属离子的选择性实验:
取三毫升含有1微升tris-HNO3缓冲溶液(50毫摩尔、pH=7.2)、浓度为1×10-5摩尔/升M1或M2的二甲基亚砜溶液于比色皿中,分别加入17当量不同金属离子(Ag+, Al3+, Ba2+, Ca2+, Cd2+, Co2+, Cu2+, Fe3+, Hg2+, K+, Mg2+, Ni2+, Pb2+, Zn2+)的水溶液,并记录其荧光光谱;测试结果(如图1和图2所示)表明只有汞离子能够使M1和M2的荧光完全淬灭,其他金属离子,除了银使M1和M2得光谱有所增强外,均未使光谱发生改变。说明M1和M2能选择性的识别汞离子。
实施例3、滴定实验:
取三毫升含有1微升tris-HNO3缓冲溶液(50毫摩尔、pH=7.2)、浓度为1×10-5摩尔/升M1或M2的二甲基亚砜溶液于比色皿中,加入递增浓度的汞离子水溶液,直至荧光完全淬灭;测试数据(如图3和图4所示)表明随着汞离子的加入,M1和M2的荧光发射光谱中心约610纳米处的发射峰逐渐减弱,其最低检测限分别为~6.79×10-7摩尔/升和~5.81×10-7摩尔/升。
实施例4、不同金属离子的选择干扰性实验:
取三毫升含有1微升tris-HNO3缓冲溶液(50毫摩尔、pH=7.2)、浓度为1×10-5摩尔/升M1或M2的二甲基亚砜溶液于比色皿中,先分别向比色皿中分别滴加17当量的金属离子(除汞以外)水溶液,记录其波谱图,再分别向上述溶液中加入17当量汞离子水溶液,再次记录波谱图;测试数据(如图5和图6所示)表明当加入其他金属离子后再加入汞离子时发射光谱均发生淬灭,说明此荧光化学传感器有较高的选择性和抗干扰性。
实施例5、裸眼识别实验:
按实施例1中配制测试溶液并装入西林瓶中,在自然光下和手提式紫外灯365nm灯光照射下对比其颜色及荧光变化;测试数据(如图7和图8所示)表明只有当加入的金属离子是汞离子时溶液颜色才会变化,且发射光强度完全淬灭。
实施例6、检测机理验证实验:
配制1毫摩尔/升M1和M2的DMSO-d6溶液于核磁管中,分别测试不加汞离子、加一当量汞离子以及加两当量汞离子的核磁谱图;测试结果(如图9和10所示)表明加入汞离子后M1和M2中三个N-H质子峰分别不断向低场移动,这说明汞离子和M1、M2中氨基硫脲部分发生了络合作用。
- 还没有人留言评论。精彩留言会获得点赞!