一种增强脂肪干细胞增殖与移植后存活能力的方法与流程
本发明涉及再生医学与细胞治疗技术领域中的脂肪干细胞的培养,
技术实现要素:
是一种增强脂肪干细胞增殖与移植后存活能力的方法
背景技术:
脂肪干细胞(adipose derived stem cells,ADSC)是由中胚层发育而来的多能干细胞,是一种脂肪组织来源的间充质干细胞(Mesenchymal stem cells,MSCs),能够被诱导分化为多种细胞,包括同样中胚层来源的成骨细胞、脂肪细胞、软骨细胞。还可以跨胚层分化为内胚层来源的肝细胞、胰岛β样细胞,外胚层来源的神经细胞、心肌细胞、表皮细胞等。与其他间充质干细胞相比,脂肪干细胞来源丰富、取材简便、便于培养,是优秀的组织工程与细胞治疗的种子细胞(Park Andrew,et al.2010,Vivek D.Desai,et al.2014,Du Y,et al.2010)。
2001年,Zuc等最先从脂肪组织中分离出间充质干细胞(P.A.Zuk,et al.2001)。脂肪干细胞与其它来源的间充质干细胞具有相同的特征,包括形态学特征,免疫表型,细胞周期和多向分化能力及支持造血功能(Shuyun Liu,et al.2012,L.L.Lu,et al.2006,Jiang Peng,et al.2011)。脂肪干细胞通过分泌多种细胞因子和成血管介质以修复受损组织(Hsiao Sarah Tzu-Feng,et al.2012)。一系列的研究表明脂肪干细胞在皮肤修复、骨损伤、肝硬化、中枢神经系统疾病及自身免疫性疾病等的治疗和整形与皮肤美容中具有广泛的应用前景(Agnieszka Banas,et al.2009,J.L.Dragoo,et al.2007,Lu Feng,et al.2008,Park In Su,et al.2014,W.S.Kim,et al.2008,Won-Serk Kim,et al.2009,Hyun Jung Lee,et al.2012,H Mizuno 2009,Kristine M Safford and Henry E Rice2005,G.Taylor,.,et al.2000,Wang Y-L,et al.2013)。但是,临床应用中需要的干细胞数量巨大,且对干细胞移植后的融合率及细胞功能的保持要求颇高。动物实验表明间充质干细胞在移植环境中不容易成活,移植的细胞不能很好地融入宿主组织,或者在成功融合后一个月内消失(Tamama Kenichi,et al.2010,Mark F Pittenger and Bradley J Martin 2004,Freyman Toby,et al.2006),这可能是由局部贫血和微环境的缺失导致的细胞活力降低或者移植部位的局部炎症引起的(Song Heesang,et al.2010)。因此,如何建立稳定高效的扩增体系,保持干细胞的生理特性使其移植后修复功能的发挥得到保障是临床用干细胞培养中亟待解决的问题。
发明内容
为了解决现有技术存在的问题,本发明提供了一种提高增强脂肪干细胞增殖与移植后存活能力的方法。
本发明通过在培养基中添加适宜浓度的生长因子增加了细胞外基质的表达从而加快了脂肪干细胞的增殖并增强了其移植后的存活能力。
细胞外基质(ECM)是围绕细胞的复杂的蛋白网络,在建立干细胞微环境中发挥重要作用,其成分和机械性可以影响干细胞的形态和分化(Singh Purva and Jean E Schwarzbauer 2012)。ECM中的一大种类-纤连蛋白(FN)与其他ECM成分都具有结合位点,可以使细胞与ECM网络相连接,从而帮助MSC存活和扩增(Ma Schwartz and Rk Assoian 2001,A D Whetton and G J Graham 1999),另外,MSC的趋化性和归巢也都与细胞外基质有关。已有研究表明三种ECM蛋白成分:纤连蛋白(FN),玻连蛋白和胶原蛋白Ⅰ(COL-Ⅰ),可以激活MSC的有丝分裂(Marc M Thibault,et al.2007)。ECM还可以激活MSC向神经元的分化并使其更适于充当神经再生支架(D P Basile,et al.1999,J.H.Lee,et al.2011)。
转化生长因子(TGF-β1)在多种细胞中都可以通过smad信号通路激活ECM的合成,如肾细胞,血管平滑肌细胞和II型肺上皮细胞(H.A.Baarsma,et al.2011,Y C Lee and D E Rannels 1998,Cj O'Callaghan and B Williams 2000)。在MSC中,TGF-β1可以激活β-catenin介导的smad3依赖的核转运从而促进细胞增殖(Ng Felicia,et al.2008,Jian Hongyan,et al.2006)。已有研究证明TGF-β1还可以诱导血管平滑肌细胞样离子通道的表达和脂肪干细胞分化为血管平滑肌细胞(Park Won Sun,et al.2013)。
本发明在脂肪干细胞培养中加入特定浓度的TGF-β1,TGF-β1与TGF-βII型受体(TGF-βRII)结合后,再激活募集TGF-βI型受体(TGF-βRI)组合后形成二聚体形式的受体复合物。TGF-βRII磷酸化TGF-βRI的甘氨酸-丝氨酸富集区域(GS序列)并活化TGF-βRI的丝氨酸/苏氨酸活性。活化的TGF-βRI磷酸化受体相关smad2、smad3蛋白,然后smad2/smad3形成复合物并进一步结合smad4,形成的复合物转运入细胞核,Smad3和Smad4结合于称为SBE的DNA序列,而Smad2通过与Smad4的相互作用与DNA复合物反应,进而激活ECM合成基因的表达。
首先将TGF-β1溶解在含0.1%BSA的干细胞培养基中,配制浓度为100ng/ml。取传代2-5代的脂肪干细胞,以含有间充质干细胞培养因子(FGF、EGF、VEGF、PDGF,各2ng/ml),10%胎牛血清,100U/mL青链霉素的α-MEM培养基培养24-48小时至细胞80%汇合。传代后24h向培养基中添加TGF-β1。培养同批次脂肪干细胞不加TGF-β1作为对照组。培养24小时后,弃培养基,收获脂肪干细胞进行细胞增殖与ECM蛋白表达的检验。
本发明操作简单、方便实用,处理后的脂肪干细胞增殖加快,ECM蛋白表达增多,移植后存活率提高,并且细胞形态,免疫表型及多向分化能力不受影响。因此,本发明建立了稳定的增强脂肪干细胞增殖能力与治疗能力的培养技术体系,为脂肪干细胞的临床应用提供了更好的种子细胞来源。
附图说明
图1.不同剂量TGF-β1对脂肪干细胞增殖的影响
图2.脂肪干细胞的免疫表型
图3.TGF-β1对脂肪干细胞免疫表型的影响
图4.TGF-β1对脂肪干细胞成骨分化与成脂分化能力的影响
(A)向成骨细胞分化茜素红染色(B)碱性磷酸酶染色
(C)成脂诱导7天细胞形态(D)油红-O染色
图5.荧光实时定量PCR检测TGF-β1对脂肪干细胞ECM相关基因表达的影响
图6.细胞免疫荧光染色检测TGF-β1对脂肪干细胞ECM相关蛋白表达的影响
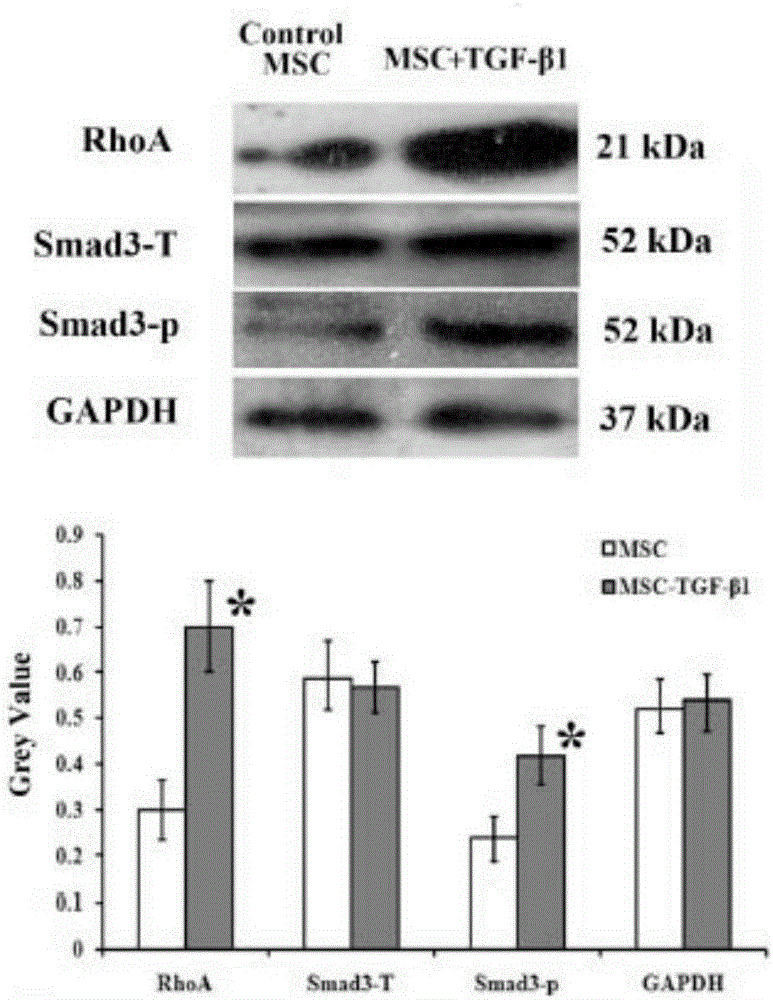
图7.Western-blot检测TGF-β1对脂肪干细胞ECM调控通路的激活
图8.TGF-β1调控脂肪干细胞增殖与存活相关信号通路示意图
图9.TGF-β1对脂肪干细胞移植入肺损伤小鼠中后存活时间的影响
具体实施方式
以下为本发明的具体实施方式,其实施方式为:
实施例1:脂肪干细胞的提取
1.固体脂肪
(1)将人脂肪组织用含双抗生理盐水反复冲洗脂肪2-3遍,再用无菌生理盐水冲洗3-4遍。
(2)将冲洗过的脂肪置于无菌的平皿中,观察是否存在腐坏变质、脂肪颜色是否存在异常等情况,并及时记录。
(3)用无菌剪刀将脂肪剪至2×2×2mm的小粒,将剪碎的脂肪小块生理盐水洗涤3遍,洗涤时用100微米滤网过滤,尽量洗涤并弃去红细胞组分;
(4)取剪碎的组织块以体积比1:5(1:3)的比例加入0.3%的Ⅰ型胶原酶/PBS消化液中,例如20mL脂肪加入100mL的消化液;
(5)将此管置于37℃恒温气浴旋转振荡箱中,以180rpm恒温振荡30min;
(6)将消化产物上端的油脂首先吸弃,然后将消化产物通过100微米滤网过滤到一个新的50mL离心管中,以1500rpm离心10min,弃上清;
(7)将细胞沉淀以PBS液重悬,以1500rpm离心10min再洗涤一次,弃上清;
(8)对细胞进行计数后,以3×106个细胞/mL的密度,加入脂肪间充质干细胞培养基并吹悬3-6次,置于通气盖培养瓶中,将培养瓶放入37℃5%CO2培养箱中;
(9)培养最初3-4d,保持培养瓶物理静止。第4天后观察细胞贴壁情况,吸掉培养液,用37℃,无菌PBS冲洗三遍,后加入培养基,以后按照细胞培养标准操作规程中的换液操作,2-3天换液一次。待细胞生长至80%汇合时,按脂肪间充质干细胞培养标准操作规程中传代程序进行细胞传代。
2.液体脂肪:
(1)取常规吸脂后静置的上层脂肪,加入等量含庆大霉素、两性霉素B生理盐水,混匀后离心800g,5分钟;
(2)离心结束后,将下层液体和沉淀的血细胞吸走弃掉,保留上层的脂肪组织;
(3)保留的脂肪组织中以体积比1:5的比例加入0.1%的Ⅰ型胶原酶/PBS消化液中,例如20mL脂肪加入100mL的消化液;
(4)以下步骤同固体脂肪提取方法。
实施例2:TGF-β1促进脂肪干细胞的增殖
取传代3代的脂肪干细胞传代,以6,000细胞/cm2的密度接种于24孔板,24h后加入不同浓度的TGF-β1,使其终浓度分别为0.1,0.5,1,5,10和20ng/mL,每组3个复孔,分别培养24h,48h与72h后收集细胞,使用CCK-8细胞毒性检测试剂盒对各实验组进行检测,结果表明0.1ng/ml是促进脂肪干细胞增殖的最适浓度。
实施例3:TGF-β1不影响脂肪干细胞的免疫表型
收集对照与TGF-β1处理的脂肪干细胞,分别使用抗人CD45,CD31,CD34,CD29,CD44,CD73,CD90和CD105的抗体进行标记,使用流式细胞仪检测分析,结果表明所获脂肪干细胞与其他来源的间充质干细胞一样,表达CD29,CD44,CD73,CD90和CD105;不表达CD31,CD34和CD45。且加入TGF-β1后,各分子表达量没有明显变化。
实施例4:TGF-β1不影响脂肪干细胞的成骨与成脂分化能力
成骨分化:取TGF-β1预处理的脂肪干细胞接种于24孔板,使用成骨分化培养基:L-DMEM含10%胎牛血清,0.1μM地塞米松,50mMβ-磷酸甘油和0.2mM维生素C。培养14天后使用4%多聚甲醛固定,分别使用碱性磷酸酶与茜素红染色。
成脂分化:分化培养基成分为高糖DMEM,含10%胎牛血清,0.25mM 3-异丁基-1-甲基黄嘌呤,0.1μM地塞米松,0.1mM吲哚美辛,6.25μg/ml胰岛素。培养7天后观察可见细胞铺展变大,14天后使用油红O染色,可见胞质内脂滴。
结果表明TGF-β1并不影响脂肪干细胞向成骨细胞与脂肪细胞分化的能力。
实施例5:TGF-β1增强ECM相关基因的表达
取传代3代的脂肪干细胞,传代接种于6孔板,24h后加入不同浓度的TGF-β1,使其终浓度分别为0.1,1,10ng/mL,培养24h后收集细胞提取总RNA,反转录后使用荧光实时定量PCR对ECM相关基因进行检测,GAPDH作为内参。结果表明0.1ng/mL浓度的TGF-β1促进了ECM相关基因Col-I,Col-IV,FN,integrin和tenascin-C的表达。
实施例6:TGF-β1增强ECM相关蛋白的表达
取传代3代的脂肪干细胞,以3×105/孔的密度接种于6孔板,24h后实验组细胞使用0.1ng/mL浓度的TGF-β1进行处理,24h后使用4%多聚甲醛固定,0.3%过氧化氢处理30分钟去除内源性过氧化物酶。使用相应抗体37℃孵育1h,DAB法显色并使用苏木精复染。
结果显示TGF-β1并未改变脂肪干细胞形态,并且增强了ECM蛋白Col-I和Col-IV特别是FN的表达,但是integrin的表达并未受到影响。
实施例7:TGF-β1激活了脂肪干细胞中的TGF-β-smad信号通路
取传代3代的脂肪干细胞,以3×105/孔的密度接种于6孔板,24h后实验组细胞使用0.1ng/mL浓度的TGF-β1进行处理,24h后收集细胞提取蛋白,使用Western blot的方法对ECM合成调控相关的TGF-β-smad信号通路的下游蛋白RhoA,smad3及其磷酸化水平进行检测。
结果显示TGF-β1激活了smad3但不影响其本身的表达,且增加了RhoA的表达,从而激活了其下游ECM蛋白合成相关基因的表达。
实施例8:TGF-β1增加了脂肪干细胞在动物体内的存活时间
急性肺损伤小鼠模型的建立:BALB/c小鼠购自山东大学实验动物中心,6-8周龄,雌性,体重20-25g,共36只。饲养于IVC屏障系统中,普通饲料喂养,自由饮水,12h/12h黑白交替。随机分为4组,分别命名为对照、ALI/PBS、ALI/MSC和ALI/MSC-T组。对除对照外剩余3组小鼠按照10mg/kg的体重比,腹腔注射脂多糖;对照组注射生理盐水。
1h后进行后续操作,对对照及ALI/PBS组小鼠尾静脉注射PBS 300μl,对ALI/MSC尾静脉注射含5×105个脂肪干细胞的PBS 300μl,对ALI/MSC-T组小鼠尾静脉注射含5×105个TGF-β1预处理脂肪干细胞的PBS 300μl。
在注射后第1,7,14天分别处死每组中的3只小鼠以检测脂肪干细胞的存活。在每10mg雌性小鼠肺组织中分别添加100,50,25,10,5,1和0×103个脂肪干细胞的DNA,通过对雄性性别决定基因Sry进行荧光实时定量PCR检测画出标准曲线。同时对各组小鼠肺组织中的Sry基因进行检测,与标准曲线比照后得出各组小鼠在各时间点肺中的脂肪干细胞存活数量。
结果表明,TGF-β1延长了脂肪干细胞移植后的存活时间。
- 还没有人留言评论。精彩留言会获得点赞!