一种利用氧化石墨烯‑金属离子配位固定化酶的方法与流程
本发明涉及一种利用氧化石墨烯-金属离子配位固定化酶的方法,属于酶固定化领域。
背景技术:
:在氧化还原酶催化过程中,辅酶的再生利用至关重要,甲酸脱氢酶(FormateDehydrogenase,FDH)在辅酶再生中的应用已成为研究热点之一。甲酸脱氢酶可用于构建辅酶高效再生系统,并已应用于工业生产。其优势在于产物为CO2易于从反应体系中逸出,使反应向正方向进行,且便于产物的分离和检测。底物甲酸钠或甲酸铵价格低廉,可降低成本。由于游离的甲酸脱氢酶稳定性差,采用固定化的方法可进行改善。固定化酶可回收、重复使用,稳定性好。固定化酶的性能取决于固定化酶所使用的载体材料的性质和固定化方法。酶的固定化材料包括无机、有机聚合物、凝胶以及生物材料等。酶的固定化方法主要有四种:包埋法、吸附法、共价法和交联法。氧化石墨烯(GrapheneOxide,GO)是石墨烯(Graphene)的一种重要的衍生物,具有良好的生物相容性,在生物医药、药物缓释、包装材料等领域有广阔的应用前景。GO具有和石墨烯相似的二维片层结构,不同的是GO在碳骨架的二维平面上以及边缘含有大量的含氧基团,包括环氧基、羧基和羟基,这些含氧基团的存在使得GO在水溶液中有了较好的分散性和稳定性。由于其带有负电荷,可基于静电结合力制备多层膜。因此,氧化石墨烯可作为一种良好的酶固定化载体。但目前利用氧化石墨烯作为酶固定化载体还存在一些负载量低、固定化率低、固定化酶的稳定性和重复使用性较差的缺陷。技术实现要素:本发明提供了一种利用氧化石墨烯-金属离子配位固定化酶的方法。利用氧化石墨烯-金属离子配位固定载体固定化酶,可以提高酶的温度稳定性与重复使用次数。带His-tag标签的酶均可采用此方法,不限于甲酸脱氢酶。
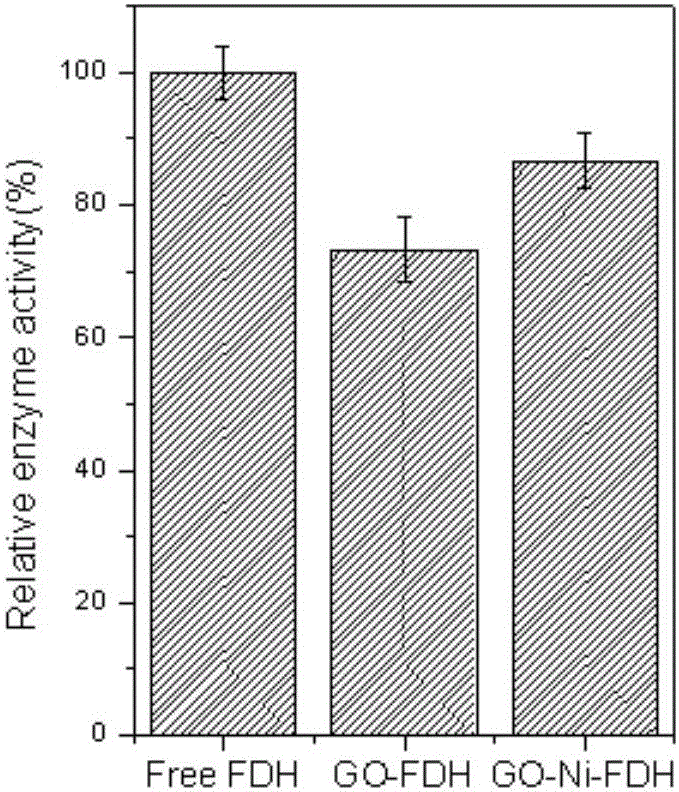
发明内容包括以下步骤:1)粗酶液制备:将可表达带His-tag标签的目标酶的重组表达菌株接种培养,培养一段时间后加入乳糖诱导剂IPTG;培养所得菌液,离心获取细胞,配制成细胞悬液;超声破碎并离心,收集上清液即为含有带His-tag标签的目标酶的粗酶液;以甲酸脱氢酶为例:构建可表达带His-tag标签的目标酶的重组表达菌株,甲酸脱氢酶(FDH)的基因原始序列来自Candidaboidinii(190-1284nucleotide,GenebankID:AF004096.1),如SEQIDNO.1所示;根据上述原始序列,采用PCR法构建5’端和3’端分别带有NdeI和Xhol酶切位点的甲酸脱氢酶基因,用NdeI和Xhol分别双酶切上述甲酸脱氢酶(FDH)基因和pET28a质粒,连接转化,得到pET28a-FDH质粒。将上述质粒转化至E.coliBL21(DE3),得到可表达带His-tag标签的甲酸脱氢酶的重组表达菌株E.coliBL21(DE3)/pET28a。将该可表达带His-tag标签的甲酸脱氢酶的重组表达菌株E.coliBL21(DE3)/pET28a接种到含有卡那霉素的LB培养基中培养,培养一段时间后加入乳糖诱导剂IPTG。所述的接种量为1~3%,所述的LB培养基的组成为:胰蛋白胨5.0~15.0g/L,酵母浸膏1.0~10.0g/L,NaCl0.0~15.0g/L,调节pH7.0~7.5,接种前添加卡那霉素使其终浓度为50~150μg/mL;所述培养条件为37℃,150~250rpm培养15~6h后加入诱导剂IPTG,使其终浓度为5~15mg/ml,继续在25~30℃,150~250rpm下培养2~6h。培养所得菌液,在冷冻离心机中离心(优选为4℃,8000rpm,15min)获得细胞,弃上清液,沉淀用Tris-HCl缓冲液(pH6.5~8.0)重悬,充分洗涤后离心,重复操作3次。用Tris-HCl缓冲液(pH6.5~8.0)配制成浓度为50~150g/L的细胞悬液。将制备的细胞悬液置于冰浴中,超声细胞破碎仪探头置于液面下1厘米,功率200W,超声2秒,间隔4秒,超声20~60次。然后4℃、12000rpm离心15min去除不溶性细胞碎片,上清即为含有带His-tag标签的甲酸脱氢酶的粗酶液。2)纯酶的制备:采用镍柱对步骤1)得到的粗酶液进行纯化并除盐;采用的纯化柱为能够特异性纯化带有His-tagged标签的蛋白质的HisTrapHP柱,其步骤包括平衡、上样、平衡、洗脱、柱子再生;收集洗脱的部分并利用超滤离心管进行除盐,除盐后获得的液体即为目标酶的纯酶溶液。3)向酶活测定体系加入金属离子溶液(包括Ni2+、Co2+、Zn2+、Mg2+、Sr2+、Ca2+、Fe2+、Fe3+、Cu2+、Mn2+、Cd2+、Ba2+等),使其终浓度为0.1~10mM。考察不同金属离子对目标酶酶活的影响,选择对游离目标酶酶活无明显抑制作用金属离子用于固定化。4)氧化石墨烯溶液的制备:用Bradford改良法等方法制备氧化石墨烯,将氧化石墨烯溶解在纯水中,超声分散后得到浓度为0.1~10mg/mL的分散均匀的氧化石墨烯悬浊液,离心之后取上清液即为氧化石墨烯溶液,该溶液在室温下可稳定保藏。5)氧化石墨烯-金属离子固定化载体的制备:在氧化石墨烯溶液中加入对游离目标酶酶活无明显抑制作用的金属离子溶液(包括Ni2+、Co2+、Zn2+、Mg2+、Sr2+、Ca2+、Fe2+、Fe3+、Cu2+、Mn2+、Mn2+、Cd2+、Ba2+等),使金属离子在溶液中配位平衡后的终浓度为0.1~10mM,在恒温振荡器(4~35℃)振荡1~5h,即得到氧化石墨烯-金属离子悬浊液。6)氧化石墨烯吸附固定化酶的方法:在氧化石墨烯溶液(0.1~10mg/mL)中加入甲酸脱氢酶溶液,使蛋白的终浓度为0.1~10mg/mL,在恒温振荡器中(4~35℃)振荡1~5h,离心除去上清液,用Tris-HCl缓冲溶液(pH7.5~11.5)进行重复洗涤3次后重悬起来,即得氧化石墨烯吸附固定化酶,作为对比。7)固定化酶的制备:在氧化石墨烯-金属离子悬浊液加入步骤2)得到的带His-tag标签的目标酶的酶溶液,并使目标酶的终浓度为0.1~10mg/mL,在恒温振荡器中(4~35℃)振荡1~5h,离心除去上清液,用Tris-HCl缓冲溶液(pH7.5~11.5)进行洗涤3次后重悬起来,即得氧化石墨烯-金属离子配位固定化酶体系。8)酶活力的检测方法:以甲酸脱氢酶为例,甲酸脱氢酶的活性测定反应体系包含10μL,1.62mMNAD+、180μL,0.1mol/L磷酸钾缓冲溶液(pH10.0)、10μL,162mM的甲酸钠溶液和20μL酶液,37℃下,340nm处,测定酶活。酶活力定义为在上述条件下,每分钟氧化消耗(或生成)1μmolNADH所需要的酶量为一个酶活力单位。本发明同时提供了利用上述氧化石墨烯-金属离子配位固定化酶的方法制备的固定化酶。本发明的有益效果如下:片层结构的氧化石墨烯是一种优良的固定化载体,表面带有环氧基、羰基、羧基等功能性基团,负载面积大。在固定化过程中,过渡态金属离子可以和氧化石墨烯表面的羧基配位,形成杂化载体,促进氧化石墨烯的均匀分散,进一步增大负载量;所使用的带His-tag标签的酶带有连续的4~10个组氨酸标签,能够通过亲和层析柱纯化,且相比酶表面其他分布松散的氨基酸残基,纯化标签的连续组氨酸残基,能与金属离子形成稳定的配位键,通过金属离子与酶组氨酸标签的配位相互作用力,实现酶在石墨烯上的高效、稳定的定向固定化。本发明工艺简单、制备条件温和、固定化率高。所得固定化酶的温度稳定性、pH稳定性和重复使用稳定性明显增强,同时具有较高的酶活性回收率。附图说明下面结合附图和实施例对本发明作进一步说明。图1为金属离子对游离甲酸脱氢酶的活性影响。图2为实施例1中GO-Ni-FDH与GO-FDH的酶活回收率。图3为实施例1中GO-Ni-FDH与GO-FDH的温度稳定性。图4为实施例1中GO-Ni-FDH重复使用稳定性。图5为实施例1中固定化酶的扫描电子显微镜表征。(A)氧化石墨烯(GO)SEM图;(B)固定化载体(GO-Ni)SEM图;(C)氧化石墨烯吸附固定化酶(GO-FDH)SEM图;(D)氧化石墨烯-金属配位固定化酶(GO-Ni-FDH)SEM图。图6为实施例2中GO-Zn-FDH的酶活回收率。图7为实施例2中GO-Zn-FDH温度稳定性。图8为实施例2中GO-Zn-FDH重复使用稳定性。图9为实施例3中GO-Mg-FDH的酶活回收率。图10为实施例3中GO-Mg-FDH温度稳定性。图11为实施例3中GO-Mg-FDH重复使用稳定性。图12为实施例4中GO-Co-FDH的酶活回收率。图13为实施例4中GO-Co-FDH温度稳定性。图14为实施例4中GO-Co-FDH重复使用稳定性。具体实施方式下面通过实施例具体说明本发明的内容:实施例11)粗酶液制备:构建可表达带His-tag标签的目标酶的重组表达菌株:甲酸脱氢酶(FDH)的基因原始序列来自Candidaboidinii(190-1284nucleotide,GenebankID:AF004096.1),如SEQIDNO.1所示;根据上述原始序列,设计引物(如表1所示)并采用PCR法构建5’端和3’端分别带有NdeI和Xhol酶切位点的甲酸脱氢酶基因,PCR合成过程由上海生工生物工程技术服务有限公司完成:表1用于FDH基因扩增的引物引物名称对应序列表中编号序列(5’-3’)FDH-P1SEQIDNO.2GGAATTCCATATGAAAATTGTCCTGGTCCTGTFDH-P2SEQIDNO.3CCGCTCGAGTTACTTTTTATCGTGTTTGCCATPCR扩增产物经1%琼脂糖凝胶电泳鉴定后,胶回收FDH基因片段,用NdeⅠ和XhoI酶切酶进行双酶切,回收酶切产物,与同样双酶切的pET-28a质粒(带有His-tag标签)进行连接,连接好的质粒转化到大肠杆菌BL21(DE3),得到pET28a-FDH质粒。将上述质粒转化至E.coliBL21(DE3),得到可表达带His-tag标签的甲酸脱氢酶的重组表达菌株E.coliBL21(DE3)/pET28a。重组大肠杆菌E.coliBL21(DE3)/pET28a的培养:以1%的接种量,将菌种接入200mLLB培养基中。LB培养基的组成为10.0g/L胰蛋白胨,5.0g/L酵母粉,10g/LNaCl,接种前添加卡那霉素使其终浓度为50~150μg/mL。培养条件为:起始pH7.0,装液量体积分数为10%,培养温度37℃,摇床转速200rpm,培养时间6小时。加入诱导剂IPTG,使其终浓度为10mg/ml,继续在30℃、200rpm条件下培养2小时。培养结束获得的发酵液,在冷冻离心机中离心(4℃,8000rpm,15min)获得细胞,弃上清液,沉淀用Tris-HCl缓冲液(pH7.5)重悬,充分洗涤后离心,重复操作3次,用Tris-HCl缓冲液(pH6.5~8.0)配制成浓度为50~150g/L的细胞悬液。利用超声细胞破碎仪对细胞悬液进行处理,超声细胞破碎仪探头置于液面下1cm,破碎条件为超声2秒,间隔4秒,超声40次,功率200W。然后4℃、12,000rpm离心15min去除不溶性细胞碎片,上清即为含有带His-tag标签的甲酸脱氢酶的粗酶液。2)甲酸脱氢酶纯酶制备:采用GE公司的HisTrap镍柱(HistrapTMHP,5mL)对步骤1)得到的粗酶液进行分离纯化,并用PALL公司的10K的超滤离心管进行超滤除盐。所述的纯化过程采用的纯化柱为能够特异性纯化带有His-tagged标签的蛋白质的HisTrapHP柱,其步骤包括平衡、上样、平衡、洗脱、柱子再生;收集洗脱的部分并利用超滤离心管进行除盐;除盐后获得的液体即为纯化的甲酸脱氢酶酶溶液。3)氧化石墨烯溶液的制备:用Bradford改良法等方法制备氧化石墨烯,将氧化石墨烯置于纯水中,超声分散(100W,120min)得到0.5mg/mL的氧化石墨烯悬浊液,离心之后取上清液即为氧化石墨烯溶液。4)甲酸脱氢酶酶活测定体系加入金属离子溶液(包括Ni2+、Co2+、Zn2+、Mg2+、Sr2+、Ca2+、Fe2+、Fe3+、Cu2+、Mn2+、Cd2+、Ba2+等),使其终浓度为0.5mM,考察不同金属离子对甲酸脱氢酶酶活的影响,发现Ni2+、Co2+、Zn2+、Mg2+、Sr2+、Ca2+、Fe2+、Ba2+对甲酸脱氢酶酶活有激活作用,Cd2+、Cu2+、Mn2+、Fe3+对甲酸脱氢酶酶活有一定的抑制作用。选择对游离甲酸脱氢酶酶活无明显抑制作用的金属离子用于固定化。结果如说明书附图1所示。5)氧化石墨烯-金属离子固定化载体的制备:在氧化石墨烯溶液加入NiSO4溶液,使其在溶液中配位平衡后的终浓度为0.6mM,在恒温震荡仪震荡(4℃,1h),即得到氧化石墨烯-金属离子悬浊液。6)氧化石墨烯吸附固定化酶的制备:在氧化石墨烯溶液中加入步骤2)得到的甲酸脱氢酶溶液并使其终浓度为1mg/mL,在恒温震荡仪震荡(4℃,1h),形成固定化颗粒,用纯水洗涤3次后用Tris-HCl缓冲溶液(0.05M,pH7.5)重悬起来,制备得到固定化酶GO-FDH,即得氧化石墨烯吸附固定化酶,作为对比;其酶活回收率可达到73.30%,如说明书附图2所示。7)氧化石墨烯-金属配位固定化酶的制备:在步骤5)得到的氧化石墨烯-金属离子悬浊液中加入步骤2)得到的甲酸脱氢酶溶液并使其终浓度为1mg/mL,在恒温震荡仪震荡(4℃,1h),形成固定化颗粒,用纯水洗涤3次后用Tris-HCl缓冲溶液(0.05M,pH7.5)重悬起来,制备得到固定化酶GO-Ni-FDH,酶活回收率可达到86.67%,如说明书附图2所示。8)固定化酶温度温度稳定性的测定:将游离酶与固定化酶在60℃水浴恒温3h,在这个过程中每隔30min测定一次酶活。相对于游离酶,固定化酶的温度稳定性明显提高,以固定化酶的初始酶活为100%,在60℃恒温水浴3h后得到固定化酶GO-Ni-FDH,其相对酶活为40.94%,而GO-FDH相对酶活为18.25%,如说明书附图3所示。氧化石墨烯-金属配位固定化酶与氧化石墨烯吸附固定化酶比较,酶活回收率高,稳定性好。9)固定化酶重复使用率的测定:用固定化甲酸脱氢酶催化甲酸钠的氧化反应,当转化率大于95%时结束反应,离心回收固定化酶,用Tris-HCl缓冲液(0.05M,pH10)洗涤,用于催化下一轮反应,以第一次反应测定的固定化酶酶活为100%,计算之后每次反应的相对酶活。重复反应8次后,GO-Ni-FDH相对酶活为63.81%,如说明书附图4所示。10)固定化酶的扫描电子显微镜(SEM)表征:运用SEM观察氧化石墨烯(GO)、固定化载体(GO-Ni)、氧化石墨烯吸附固定化酶(GO-FDH),氧化石墨烯-金属配位固定化酶(GO-Ni-FDH)的形貌特征,如说明书附图5所示。实施例21)~4)实验步骤如实施例1的步骤1)~4)。5)氧化石墨烯-金属离子固定化载体的制备:在氧化石墨烯溶液加入ZnCl2溶液,使其在溶液中配位平衡后的终浓度为10mM:在恒温震荡仪震荡(4℃,1h),即得到氧化石墨烯-金属离子悬浊液。6)氧化石墨烯-金属配位固定化酶的制备:在步骤5)得到的氧化石墨烯-金属离子悬浊液中加入步骤2)得到的甲酸脱氢酶溶液并使其终浓度为10mg/mL,在恒温震荡仪震荡(4℃,1h),形成固定化颗粒,用纯水洗涤三次后用Tris-HCl缓冲溶液(0.1M,pH10)重悬起来,得到固定化酶GO-Zn-FDH,酶活回收率可达到84.28%,如说明书附图6所示。7)固定化酶温度温度稳定性的测定:将游离酶与固定化酶在60℃水浴恒温3h,在这个过程中每隔30min测定一次酶活。相对于游离酶,固定化酶的温度稳定性明显提高,以固定化酶的初始酶活为100%,在60℃恒温水浴3h后固定化酶GO-Zn-FDH相对酶活为38.28%,如说明书附图7所示。8)固定化酶重复使用率的测定:用固定化甲酸脱氢酶催化甲酸钠氧化反应,当转化率大于85%时结束反应,离心回收固定化酶,用Tris-HCl缓冲溶液(0.05M,pH10)洗涤,用于催化下一轮反应,以第一次反应测定的酶活为100%,计算之后每次反应的相对酶活。重复反应8次后,GO-Zn-FDH相对酶活为60.47%,如说明书附图8所示。实施例31)~4)实验步骤如实施例1的步骤1)~4)。5)氧化石墨烯-金属离子固定化载体的制备:在氧化石墨烯溶液加入MgCl2溶液,使其在溶液中配位平衡后的的终浓度为0.1mM:在恒温震荡仪震荡(4℃,1h),即得到氧化石墨烯-金属离子悬浊液。6)氧化石墨烯-金属配位固定化酶的制备:在步骤5)得到的氧化石墨烯-金属离子悬浊液中加入步骤2)得到的甲酸脱氢酶溶液并使其终浓度为0.1mg/mL,在恒温震荡仪震荡(4℃,1h),形成固定化颗粒,用纯水洗涤三次后用Tris-HCl缓冲溶液(0.05M,pH11.5)重悬起来,得到固定化酶GO-Mg-FDH,酶活回收率可达到83.10%,如说明书附图9所示。7)固定化酶温度温度稳定性的测定:将游离酶与固定化酶在60℃水浴恒温3h,在这个过程中每隔30min测定一次酶活。相对于游离酶,固定化酶的温度稳定性明显提高,以固定化酶的初始酶活为100%,在60℃恒温水浴3h后GO-Mg-FDH相对酶活为36.30%,如说明书附图10所示。8)固定化酶重复使用率的测定:用固定化甲酸脱氢酶催化甲酸钠氧化反应,当转化率大于85%时结束反应,离心回收固定化酶,用Tris-HCl缓冲溶液(0.05M,pH10)洗涤,用于催化下一轮反应,以第一次反应测定的酶活为100%,计算之后每次反应的相对酶活。重复反应8次后,固定化酶GO-Mg-FDH相对酶活为58.25%,如说明书附图11所示。实施例41)~4)实验步骤如实施例1的步骤1)~4)。5)氧化石墨烯-金属离子固定化载体的制备:在氧化石墨烯溶液加入CoCl2溶液,使其在溶液中配位平衡后的的终浓度为5mM:在恒温震荡仪震荡(4℃,1h),即得到氧化石墨烯-金属离子悬浊液。6)氧化石墨烯-金属配位固定化酶的制备:在步骤5)得到的氧化石墨烯-金属离子悬浊液中加入步骤2)得到的甲酸脱氢酶溶液并使其终浓度为5mg/mL,在恒温震荡仪震荡(4℃,1h),形成固定化颗粒,用纯水洗涤三次后用Tris-HCl缓冲溶液(0.08M,pH9.0)重悬起来,得到固定化酶GO-Co-FDH,酶活回收率可达到80.43%,如说明书附图12所示。7)固定化酶温度温度稳定性的测定:将游离酶与固定化酶在60℃水浴恒温3h,在这个过程中每隔30min测定一次酶活。相对于游离酶,固定化酶的温度稳定性明显提高,以固定化酶的初始酶活为100%,在60℃恒温水浴3h后固定化酶GO-Co-FDH相对酶活为32.56%,如说明书附图13所示。8)固定化酶重复使用率的测定:用固定化甲酸脱氢酶催化氧化反应的进行,当转化率大于85%时结束反应,离心回收固定化酶,用Tris-HCl缓冲溶液(0.05M,pH7.5)洗涤,用于催化下一轮反应,以第一次反应测定的酶活为100%,计算之后每次反应的相对酶活。重复反应8次后,固定化酶GO-Co-FDH相对酶活为51.80%,如说明书附图14所示。以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1