一种结直肠癌循环肿瘤细胞的富集和分析方法与流程
本发明属于医学检测分析技术领域,具体涉及一种结直肠癌循环肿瘤细胞的富集和分析方法。
背景技术:
恶性肿瘤转移是导致肿瘤患者死亡的重要原因,越来越多的分子生物学和临床研究结果表明,肿瘤转移很可能在肿瘤发生的早期就已经出现。目前肿瘤的发现和诊断临床上仍依赖于影像学检查及传统肿瘤标志的监测,难以早期发现肿瘤的转移或复发,也难以及时反映疗效。
循环肿瘤细胞(circulating tumor cell,CTC)是脱落进入血液循环的肿瘤细胞,大量实验已经证实CTCs检测有助于肿瘤复发转移监控、判断患者预后、指导术后辅助治疗等。
外周血中循环肿瘤细胞(CTC)数量稀少,且具有异质性和易聚集成团等特点。目前众多的检测技术在灵敏性、特异性和可重复性等方面还存在诸多问题。
免疫磁性分离技术(immunomagnetic separation,IMS)是近年来国内外研究的一种新的免疫学技术,它能够从大量外周血中筛选出带有特异性标记的肿瘤细胞,其基本原理主要是基于细胞表面抗原能与连接有磁珠的特异性单抗相结合,形成细胞-抗原-抗体-磁珠免疫复合物,该复合物在外加磁场的作用下发生力学移动,将含有靶抗原的目的细胞与其他细胞分离,从而达到特异性分离细胞的目的。具体分为阳性富集方法和阴性富集方法。前者通过磁珠偶联上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)等标志物直接富集外周血中上皮来源的稀有细胞。后者通过磁珠偶联CD45等白细胞标志,去除外周血白细胞而间接富集稀有上皮细胞。
目前基于免疫磁性原理富集或同时检测CTCs的技术主要有CellSearch系统、免疫磁性细胞分选仪(magnetric cell sorting,MACS)、AdnaTest癌细胞检测系统和莱尔系统等。其中CellSearch检测系统已经被美国FDA批准用于检测 乳腺癌、结直肠癌和前列腺癌患者外周血的CTCs。该系统利用EpCAM抗体结合表达EpCAM的肿瘤细胞,然后用免疫磁珠来覆盖抗EpCAM抗体,最后在磁场的作用下对CTCs进行分离。将分离得到的细胞经固定后用4,6-二脒基-2-苯基吲哚(2-(4-amidinophenyl)-6-indole carbamidine dihydrochloride,DAPI)荧光染料标记细胞核,CD45荧光抗体和CK8、CK18、CK19或CKmix荧光抗体标记细胞,结果分析在四色荧光显微镜下进行。将DAPI+、CD45-、CK+和EpCAM+的细胞定义为CTCs。CellSearch系统的优点是细胞形态结构能够较好保存,即通过荧光显微镜看到荧光染色的结果,直接观察到肿瘤细胞的形态。
但CellSearch系统自身也有无法解决的缺陷:1.检测的灵敏度不够高。部分癌症转移期患者,由于其血液中CTC含量过低,或者其CTC本身发生变化而不能被CellSearch系统所捕获,因此该检测存在假阴性率较高的问题。2.无法对CTC深入分析。CellSearch系统只能对捕获并标志CTC的数量,而不能对CTC进行包括基因测序、蛋白表达、药物敏感性检测等更细致的分析。另外仪器及耗材的成本昂贵也限制了其进一步大规模应用于临床。
技术实现要素:
为了解决现有技术存在的上述问题,本发明提供了一种结直肠癌循环肿瘤细胞的富集和分析方法,通过免疫磁珠负向和正向的富集与qRT-PCR检测肿瘤标记基因表达相结合,建立一种高敏感性和特异性、且成本低廉的检测结癌症患者血液中循环肿瘤细胞的方法。
本发明所采用的技术方案为:
一种结直肠癌循环肿瘤细胞的富集和分析方法,其特征在于,所述富集和分析方法,是采集人体血液样本,并分离血液样本中的单个核细胞,将单个核细胞通过CD45磁珠负向富集、EpCAM磁珠正向富集两种方式先后两次富集后得到细胞悬浮液,裂解细胞后提取mRNA,通过RT-qPCR检测方法来检测结直肠癌循环肿瘤细胞的CK20和Survivin基因的表达水平,将两个基因的表达水平与已有的正常人和结直肠癌患者的CK20和Survivin基因的表达水平数据库对比后,分析得出结直肠癌患者中循环肿瘤细胞的有无以及肿瘤特异基因的表达丰度情况。
优选的,单个核细胞的收集是通过白细胞分离液或CPT管,去除血液中的红细胞、血小板,收集包括循环肿瘤细胞在内的单个核细胞;
CD45磁珠负向富集,是利用偶联CD45抗体的磁珠与血液中的白细胞结合,去除非循环肿瘤细胞,提高后续循环肿瘤细胞的分选特异性;
EpCAM磁珠正向富集:是利用偶联EpCAM抗体的磁珠与CD45磁珠负向负向筛选后剩余的细胞进一步特异性结合,收集得到循环肿瘤细胞。
本发明一种结直肠癌循环肿瘤细胞的富集和分析方法,包括以下具体步骤:
A、单个核细胞收集:采集人体血液样本,并分离血液样本中的单个核细胞;
B、CD45磁珠负向富集:在离心管中加入步骤A得到的单个核细胞和CD45磁珠,2-8℃条件下,旋转混匀,将上清液转移至新的离心管中;CD45磁珠为偶联有CD45抗体的磁珠,CD45抗体能够特异性吸附血液中的白细胞,去除大部分非肿瘤细胞;
C、EpCAM磁珠正向富集:在离心管中加入步骤B得到的上清液和EpCAM磁珠,2-8℃条件下,旋转后静置,并将上清液移除,得到磁珠悬浮液;EpCAM磁珠为偶联有EpCAM抗体的磁珠;因为肿瘤细胞表面上皮粘附因子(EpCAM抗原)表达高于普通血液细胞,所以通过偶联EpCAM抗体的磁珠,能够特异性吸附肿瘤细胞,进行后续检测;
D、mRNA提取:将步骤C得到的磁珠悬浮液漂洗后,加入裂解液将磁珠吸附的细胞裂解,释放核酸;取上清液加入Oligo dT磁珠与mRNA结合,将包含裂解细胞的样本管放置在磁体上,分离得到mRNA;
E、RT-qPCR检测:将步骤D得到的mRNA进行RT-qPCR检测,其中PCR扩增体系中使用的引物序列包括survivin上游引物、survivin下游引物、CK20上游引物、CK20下游引物、beta-actin上游引物和beta-actin下游引物;所述survivin上游引物的序列如SEQ ID NO:1所示,survivin下游引物的序列如SEQ ID NO:2所示,CK20上游引物的序列如SEQ ID NO:3所示,CK20下游引物的序列如SEQ ID NO:4所示,beta-actin上游引物的序列如SEQ ID NO:5所示,beta-actin下游引物的序列如SEQ ID NO:6所示。
经过两次磁珠分离,显著提高CTC的捕获效率,提高患者的CTC检出率。
本发明的发明人,通过对比正常人和结直肠癌患者的血液样本中基因表达的差异,筛选出一系列与结直肠癌相关的Marker基因,最终确定CTC中CK20和Survivin的表达水平与患者的预后和总生存期密切相关,
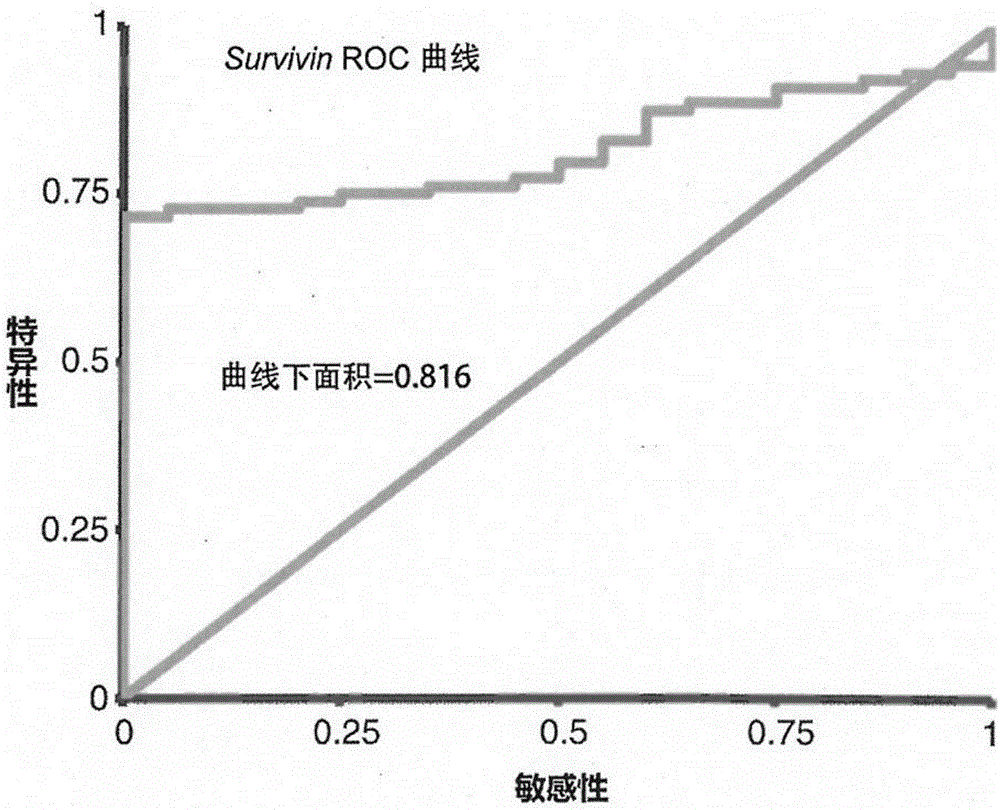
如图1-4所示,本申请的发明人选择20个正常人和88例结直肠癌患者的血液为样本进行了CTCs的富集以及CK20、Survivin基因表达水平检测,建立了判断结直肠癌的CK20、Survivin基因表达的基线。其中CK20的表达基线敏感性和特异性达到76%和85%;Survivin的表达基线敏感性和特异性达到72%和100%。以CK20和Survivin的表达水平基线对88例结直肠癌患者进行判断,真阳性率达到70%以上。
进一步地,如图5和图6所示,本申请的发明人对88例结直肠癌患者进行追踪研究,结果表明CK20和Survivin表达高于基线的患者,生存期是显著低于基因表达水平低于基线的患者。这也验证了通过检测患者CTCs中CK20和Survivin表达水平预测患者生存期的方法的可行性与准确性。
优选地,步骤A中,用EDTA抗凝管采集人体血液样本,加入磷酸缓冲液混合均匀;将稀释后的血液加到淋巴细胞分离液的上方;离心后,吸出白色层,重悬于磷酸缓冲液中,混匀;离心后移除上清液,并加入磷酸盐缓冲液重悬细胞,即得到单个核细胞。
进一步地,步骤A中,用EDTA抗凝管采集人体血液样本,加入磷酸缓冲液1∶1混合均匀;将稀释后的血液加到淋巴细胞分离液的上方,淋巴细胞分离液与稀释后血液的体积比为1∶1;室温2600rpm离心20分钟后,吸出白色层,重悬于5倍体积的磷酸缓冲液中,混匀;室温1500rpm离心5分钟,移除上清液,并加入磷酸盐缓冲液重悬细胞,即得到单个核细胞。.
步骤B包括准备CD45磁珠和负向富集两个步骤:
B1、准备磁珠:将CD45磁珠使用缓冲液洗涤、重悬后备用;此步骤的作用为清洗磁珠;
B2、负向富集:在离心管中加入步骤B1得到的磁珠和步骤A得到的单个核细胞,2-8℃条件下,旋转结合30-40min后;将上清液转移至新的离心管中。
步骤C包括准备准备EpCAM磁珠和正向富集两个步骤:
C1、准备磁珠:将EpCAM磁珠使用缓冲液洗涤、重悬后备用;此步骤的作用为清洗磁珠;
C2、正向富集:在离心管中加入步骤B得到的上清液和步骤C1上皮富集磁珠,2-8℃条件下,旋转结合20-40min;再将离心管放置磁体上3min,将上清液移除,得到磁珠悬浮液。
为了收集离心管盖子上遗留的上皮富集磁珠,以增加所述富集和分析方法结果的准确性,优选的技术方案是,步骤C2中,将离心管放置磁体上3min,将上清液移除后,从磁体上取下离心管,加入缓冲液将磁珠重悬,并清洗3次,得到磁珠悬浮液。
步骤D包括准备Oligo(dT)25磁珠、循环肿瘤细胞裂解和mRNA分离三个步骤:
D1、准备Oligo(dT)磁珠液:涡旋大于30s或倾斜旋转5min在离心管中重悬Oligo(dT)25磁珠,并加入等体积的Lysis/Binding Buffer,得到Oligo(dT)磁珠液;
D2、循环肿瘤细胞裂解:将步骤C得到的磁珠悬浮液漂洗后,使用Oligo(dT)磁珠液重悬所述磁珠悬浮液,使循环肿瘤细胞裂解;
D3、mRNA分离:将步骤D2得到的包含裂解细胞的样本管放置在磁体上3min,使mRNA充分与磁珠结合,然后移除上清液,然后用在冰上预冷的10mM Tris-HCl重悬,重悬完成后,在65-80℃孵育2min,即可分离得到mRNA。
步骤E中,所述反转录反应程序为:37℃保持60min;然后再93℃保持5min,再置于4℃下保存。
步骤E中,反转录反应体系为:总体积为20μL,10×Buffer RT 2.0μL,dNTPs 2.0μL,Oligo dT primer 2.0μL,Sensicript Reverse Transcriptase 1.0μL,40U/μL的RNase Inhibitor 0.25μL,mRNA-Tris-HCl重悬液12μL,余量为水。
步骤F中,使用的PCR扩增程序为:在95℃温度下预变性2min;然后进行40个循环,其中每个循环依次包括以下步骤:在95℃温度下保存5s,在60℃温度下保存30s;完成40个循环之后,即完成PCR扩增程序。
步骤F中,PCR反应体系为:总体积为20μL,2x QuantiNova SYBR Green PCR Master Mix 2.0μL,Rox 0.1μL,10μM的Forward Primer 1.4μL,10μM的Reverse Primer 1.4μL,cDNA 1.0μL,RNase-Free water 6.1μL,余量为水。
本发明的有益效果为:
1、本发明提供了一种结直肠癌循环肿瘤细胞的富集和分析方法,通过免疫磁珠负向和正向的富集与qRT-PCR检测肿瘤标记基因表达相结合,建立一种高敏感性和特异性、且成本低廉的检测结癌症患者血液中循环肿瘤细胞的方法。经过两次磁珠分离,显著提高CTC的捕获效率,提高患者的CTC检出率;其次,确定了CK20和Survivin基因的表达水平在评估肿瘤复发和转移风险、指导个体化治疗、快速判断化疗效果方面具有突出的临床效用。
2、通过所述结直肠癌循环肿瘤细胞的富集和分析方法可以有效的分离和鉴定结直肠癌患者外周血中的CTCs,其阳性检出率达到70%以上,并且具备成本较低,无需购置大型仪器,检测精确,后续扩展性强等特点。
3、利用所述结直肠癌循环肿瘤细胞的富集和分析方法也能够对血液样本进行CD45阴性和EpCAM阳性免疫富集CTCs,除了能够分离结直肠癌的CTCs,还能够分离前列腺癌、乳腺癌、胃癌等表达上皮细胞黏附因子的CTCs。
附图说明
图1是CK20基因的ROC曲线图;
图2是Survivin基因的ROC曲线图;
图3是CK20基因在健康人和结肠癌患者CTC中的表达曲线图;
图4是Survivin基因在健康人和结肠癌患者CTC中的表达曲线图;
图5是CK20基因预估存活率和CTC检测后时间的关联图;
图6是Survivin基因预估存活率和CTC检测后时间的关联图
图7是本发明的简易流程图。
具体实施方式
下面结合实施例,更具体地说明本发明的内容。应当理解,本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通和/或改变都将落入本发明保护范围。
在本发明中,若非特指,所有的份、百分比均为重量单位,所有的设备和原料等均可从市场购得或是本行业常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
实施例1
一种结直肠癌循环肿瘤细胞的富集和分析方法,包括以下步骤:
A、外周血单个核细胞收集
1.使用EDTA抗凝管采集病人血液样本约10mL。
2.使用移液枪,量取8mL血液样本到做有相同标记的的BD Vacutainer CPT管中。
3. 1700g室温离心25min。
4.离心之后,位于血浆层下的白色层为单核细胞和血小板,小心吸出约一半血浆,将剩余血浆与细胞层(约2mL)转移到无菌的15mL离心管中。
5.在上述离心管中加入RPMI 1640培养基,使总体积为10mL。拧紧离心管盖子,上下颠倒离心管5次使细胞混匀。
6. 300g离心15min,移除上清。
7.在上述离心管中加入1mL PBS,重悬细胞,置于冰上。
B、磁珠负向富集
1.准备磁珠:
(1)涡旋大于30s或倾斜旋转5min在小瓶中重悬磁珠,取适当体积的磁珠(250μL/样本)到新的离心管中;
(2)加入相同体积的Buffer1,重悬磁珠;
(3)离心管放置磁体1min,吸除上清;
(4)将离心管移出磁体,用与(2)相同体积的Buffer1重悬磁珠,备用。
2.准备离心管:
取50mL离心管,加入10mL Buffer 2,预包被处理5min;
3.阴性分离
(1)在预包被的管中加入250μL漂洗并重悬的磁珠;
(2)在上述管中加入1mL(第一部分步骤7,PBS重悬的细胞),轻柔 旋转混匀8℃孵育30min;
(3)从混合器上移除离心管,使用Buffer1稀释定容至50mL,轻柔混合;
(4)将上述离心管放置磁体5min;
(5)将上清转移到新的预包被离心管中,供下游分析;
注意:操作需要在冰上进行。
C、磁珠正向富集
试剂盒:Dynabeads Epithelial Enrich,公司:Invitrogen,货号:161.02
1.准备上皮富集磁珠(EpCAM):
(1)涡旋大于30s或倾斜旋转5min在小瓶中重悬磁珠,取适当体积的磁珠(25μL)到新的离心管中;
(2)加入相同体积的Buffer1,重悬磁珠;
(3)离心管放置磁体1min,吸除上清;
(4)将离心管移出磁体,用与(2)相同体积的Buffer1重悬磁珠,备用。
2.阳性分离
(1)在上述10mL细胞样本中加入约25μL被洗过的上皮富集磁珠,在混合器上8℃旋转20min;
(2)8℃条件下,将上述离心管放置磁体上5min,为了收集离心管盖子上遗留的磁珠,1min后轻轻地将磁体和离心管颠倒;
(3)用移液枪小心地将上清移除;
(4)在管中加入800μL预冷的Buffer1,将管从磁体上取下,小心重悬磁体细胞,将悬浮液转移到一个新的管中;
(5)将上述离心管放置磁体上3min,用移液枪小心地将上清移除;
(6)重复(4)和(5)四次;即一共清洗5次;
(7)将磁珠悬浮液转移到一个新管中,放在冰上,并立即进行后续实验。
D、从循环肿瘤细胞中分离mRNA
试剂盒:Dynabeads mRNA DIRECT Micro Kit,公司:Invitrogen,货号:61021
1.准备Oligo(dT)25磁珠
(1)涡旋大于30s或旋转混合5min,重悬混匀Dynabeads Oligo(dT)25;
(2)转移适当体积的Dynabeads Oligo(dT)25(以25μL/RNA分离样本计)到新的RNase-free管中;
(3)加入等体积Lysis/Binding Buffer(以25μL/RNA分离样本计);
(4)将该管放置在磁体上1min,移除上清;
(5)从磁体上取下管,用与步骤(2)相同体积的Lysis/Binding buffer(以25μL/RNA分离样本计),每个样本管分装25μL悬浮液。
2.肿瘤细胞裂解
(1)经过Dynabeads Epithelial Enrich试剂盒分离的肿瘤细胞,最后一次漂洗后,立即将磁珠-细胞混合样放在冰上,等待mRNA分离和PCR:
(2)在mRNA分离前,将样本管放置在磁体上3min,移除上清;
(3)使用100μL Lysis/Binding Buffer重悬磁珠-细胞混合体系;
(4)上下吹吸2次,注意不要起沫。
3.mRNA分离
(1)将包含裂解细胞的样本管放置在磁体上3min;
(2)将上清转移到包含有25μL预漂洗的Dynabeads Oligo(dT)25悬浮液(步骤第四部分-1-(5));
(3)吹吸数次混合均匀,注意不要起沫;
(4)将样本管固定在样本混合器或旋转仪上,室温下混合至少5min,保证mRNA充分与磁珠结合;
(5)将样本管放置在磁体上,移除上清。从磁体上取下样本管,加入100μL washing buffer A用枪头小心重悬磁珠-mRNA混合体系;
(6)将样本管放置在磁体上,移除上清;
(7)重复步骤5-6;
(8)用100μL washing buffer B重悬磁珠-mRNA混合体系;
(9)将悬浮液转移到一个新的管中;
(10)将上述新的样本管放置在磁体上,移除上清;
(11)用100μL washing buffer B重悬磁珠-mRNA混合体系;
(12)将样本管放置在磁体上,移除上清;
(13)从磁体上取下样本管,用13.5μL在冰上预冷的10mM Tris-HCl重悬;
(14)65℃孵育样本管2min,将管放置在磁体上立刻转移到一个新的离心管中,该体系可直接用于反转录或在-80℃保存。
E、将mRNA反转录成cDNA
试剂盒:QuantiNova SYBR Green PCR Kit,公司:Qiagen,货号:208054
所述反转录反应程序为:37℃保持60min;然后再93℃保持5min,再置于4℃下保存。
反转录反应体系为:总体积为20μL,10×Buffer RT 2.0μL,dNTPs 2.0μL,Oligo dT primer 2.0μL,Sensicript Reverse Transcriptase 1.0μL,40U/μL的RNase Inhibitor 0.25μL,mRNA-Tris-HCl重悬液12μL,余量为水。
F、RT-qPCR检测
PCR反应体系为:总体积为20μL,2x QuantiNova SYBR Green PCR Master Mix 2.0μL,Rox 0.1μL,10μM的Forward Primer 1.4μL,10μM的Reverse Primer 1.4μL,cDNA 1.0μL,RNase-Free water 6.1μL,余量为水。
使用的PCR扩增程序为:在95℃温度下预变性2min;然后进行40个循环,其中每个循环依次包括以下步骤:在95℃温度下保存5s,在60℃温度下保存30s;完成40个循环之后,即完成PCR扩增程序。
实施例2
一种结直肠癌循环肿瘤细胞的富集和分析方法,包括以下步骤:
A、外周血单个核细胞收集
1.使用EDTA抗凝管采集病人血液样本约10mL。
2.使用移液枪,量取8mL血液样本到做有相同标记的的BD Vacutainer CPT管中。
3. 1700g室温离心25min。
4.离心之后,位于血浆层下的白色层为单核细胞和血小板,小心吸出约一 半血浆,将剩余血浆与细胞层(约3mL)转移到无菌的15mL离心管中。
5.在上述离心管中加入RPMI 1640培养基,使总体积为10mL。拧紧离心管盖子,上下颠倒离心管5次使细胞混匀。
6. 300g离心15min,移除上清。
7.在上述离心管中加入1mL PBS,重悬细胞,置于冰上。
B、磁珠负向富集
1.准备磁珠:
(1)涡旋大于30s或倾斜旋转5min在小瓶中重悬磁珠,取适当体积的磁珠(250μL/样本)到新的离心管中;
(2)加入相同体积的Buffer1,重悬磁珠;
(3)离心管放置磁体1min,吸除上清;
(4)将离心管移出磁体,用与(2)相同体积的Buffer1重悬磁珠,备用。
2.准备离心管:
取50mL离心管,加入10mL Buffer 2,预包被处理5min;
3.阴性分离
(1)在预包被的管中加入250μL漂洗并重悬的磁珠;
(2)在上述管中加入1mL(第一部分步骤7,PBS重悬的细胞),轻柔旋转混匀2℃孵育40min;
(3)从混合器上移除离心管,使用Buffer1稀释定容至50mL,轻柔混合;
(4)将上述离心管放置磁体15min;
(5)将上清转移到新的预包被离心管中,供下游分析;
注意:操作需要在冰上进行。
C、磁珠正向富集
试剂盒:Dynabeads Epithelial Enrich,公司:Invitrogen,货号:161.02
1.准备上皮富集磁珠(EpCAM):
(1)涡旋大于30s或倾斜旋转5min在小瓶中重悬磁珠,取适当体积的磁珠(25μL)到新的离心管中;
(2)加入相同体积的Buffer1,重悬磁珠;
(3)离心管放置磁体1min,吸除上清;
(4)将离心管移出磁体,用与(2)相同体积的Buffer1重悬磁珠,备用。
2.阳性分离
(1)在上述10mL细胞样本中加入约25μL被洗过的上皮富集磁珠,在混合器上2℃旋转40min;
(2)2℃条件下,将上述离心管放置磁体上1min,为了收集离心管盖子上遗留的磁珠,1min后轻轻地将磁体和离心管颠倒;
(3)用移液枪小心地将上清移除;
(4)在管中加入800μL预冷的Buffer1,将管从磁体上取下,小心重悬磁体细胞,将悬浮液转移到一个新的管中;
(5)将上述离心管放置磁体上3min,用移液枪小心地将上清移除;
(6)重复(4)和(5)四次;即一共清洗5次;
(7)将磁珠悬浮液转移到一个新管中,放在冰上,并立即进行后续实验。
D、从循环肿瘤细胞中分离mRNA
试剂盒:Dynabeads mRNA DIRECT Micro Kit,公司:Invitrogen,货号:61021
1.准备Oligo(dT)25磁珠
(1)涡旋大于30s或旋转混合5min,重悬混匀Dynabeads Oligo(dT)25;
(2)转移适当体积的Dynabeads Oligo(dT)25(以25μL/RNA分离样本计)到新的RNase-free管中;
(3)加入等体积Lysis/Binding Buffer(以25μL/RNA分离样本计);
(4)将该管放置在磁体上1min,移除上清;
(5)从磁体上取下管,用与步骤(2)相同体积的Lysis/Binding buffer(以25μL/RNA分离样本计),每个样本管分装25μL悬浮液。
2.肿瘤细胞裂解
(1)经过Dynabeads Epithelial Enrich试剂盒分离的肿瘤细胞,最后一次漂洗后,立即将磁珠-细胞混合样放在冰上,等待mRNA分离和PCR;
(2)在mRNA分离前,将样本管放置在磁体上2min,移除上清;
(3)使用100μL Lysis/Binding Buffer重悬磁珠-细胞混合体系;
(4)上下吹吸3次,注意不要起沫。
3.mRNA分离
(1)将包含裂解细胞的样本管放置在磁体上3min;
(2)将上清转移到包含有25μL预漂洗的Dynabeads Oligo(dT)25悬浮液(步骤第四部分-1-(5));
(3)吹吸数次混合均匀,注意不要起沫;
(4)将样本管固定在样本混合器或旋转仪上,室温下混合至少5min,保证mRNA充分与磁珠结合;
(5)将样本管放置在磁体上,移除上清。从磁体上取下样本管,加入100μL washing buffer A用枪头小心重悬磁珠-mRNA混合体系;
(6)将样本管放置在磁体上,移除上清;
(7)重复步骤5-6;
(8)用100μL washing buffer B重悬磁珠-mRNA混合体系;
(9)将悬浮液转移到一个新的管中;
(10)将上述新的样本管放置在磁体上,移除上清;
(11)用100μL washing buffer B重悬磁珠-mRNA混合体系;
(12)将样本管放置在磁体上,移除上清;
(13)从磁体上取下样本管,用13.5μL在冰上预冷的10mM Tris-HCl重悬;
(14)80℃孵育样本管2min,将管放置在磁体上立刻转移到一个新的离心管中,该体系可直接用于反转录或在-80℃保存。
E、将mRNA反转录成cDNA
试剂盒:QuantiNova SYBR Green PCR Kit,公司:Qiagen,货号:208054
所述反转录反应程序为:37℃保持60min;然后再93℃保持5min,再置于4℃下保存。
反转录反应体系为:总体积为20μL,10×Buffer RT 2.0μL,dNTPs 2.0μL,Oligo dT primer 2.0μL,Sensicript Reverse Transcriptase 1.0μL,40U/μL的RNase Inhibitor 0.25μL,mRNA-Tris-HCl重悬液12μL,余量为水。
F、RT-qPCR检测
PCR反应体系为:总体积为20μL,2x QuantiNova SYBR Green PCR Master Mix 2.0μL,Rox 0.1μL,10μM的Forward Primer 1.4μL,10μM的Reverse Primer 1.4μL,cDNA 1.0μL,RNase-Free water 6.1μL,余量为水。
使用的PCR扩增程序为:在95℃温度下预变性2min;然后进行40个循环,其中每个循环依次包括以下步骤:在95℃温度下保存5s,在60℃温度下保存30s;完成40个循环之后,即完成PCR扩增程序。
实施例3
一种结直肠癌循环肿瘤细胞的富集和分析方法,包括以下步骤:
A、外周血单个核细胞收集
1.使用EDTA抗凝管采集病人血液样本约10mL。
2.使用移液枪,量取8mL血液样本到做有相同标记的的BD Vacutainer CPT管中。
3. 1700g室温离心25min。
4.离心之后,位于血浆层下的白色层为单核细胞和血小板,小心吸出约一半血浆,将剩余血浆与细胞层(约2mL)转移到无菌的15mL离心管中。
5.在上述离心管中加入RPMI 1640培养基,使总体积为10mL。拧紧离心管盖子,上下颠倒离心管5次使细胞混匀。
6. 300g离心15min,移除上清。
7.在上述离心管中加入1mL PBS,重悬细胞,置于冰上。
B、磁珠负向富集
1.准备磁珠:
(1)涡旋大于30s或倾斜旋转5min在小瓶中重悬磁珠,取适当体积的磁珠(250μL/样本)到新的离心管中;
(2)加入相同体积的Buffer1,重悬磁珠;
(3)离心管放置磁体1min,吸除上清;
(4)将离心管移出磁体,用与(2)相同体积的Buffer1重悬磁珠,备用。
2.准备离心管:
取50mL离心管,加入10mL Buffer 2,预包被处理5min;
3.阴性分离
(1)在预包被的管中加入250μL漂洗并重悬的磁珠;
(2)在上述管中加入1mL(第一部分步骤7,PBS重悬的细胞),轻柔旋转混匀5℃孵育40min;
(3)从混合器上移除离心管,使用Buffer1稀释定容至50mL,轻柔混合;
(4)将上述离心管放置磁体10min;
(5)将上清转移到新的预包被离心管中,供下游分析;
注意:操作需要在冰上进行。
C、磁珠正向富集
试剂盒:Dynabeads Epithelial Enrich,公司:Invitrogen,货号:161.02
1.准备上皮富集磁珠(EpCAM):
(1)涡旋大于30s或倾斜旋转5min在小瓶中重悬磁珠,取适当体积的磁珠(25μL)到新的离心管中;
(2)加入相同体积的Buffer1,重悬磁珠;
(3)离心管放置磁体1min,吸除上清;
(4)将离心管移出磁体,用与(2)相同体积的Buffer1重悬磁珠,备用。
2.阳性分离
(1)在上述10mL细胞样本中加入约25μL被洗过的上皮富集磁珠,在混合器上5℃旋转30min;
(2)5℃条件下,将上述离心管放置磁体上3min,为了收集离心管盖子上遗留的磁珠,1min后轻轻地将磁体和离心管颠倒;
(3)用移液枪小心地将上清移除;
(4)在管中加入800μL预冷的Buffer1,将管从磁体上取下,小心重悬磁体细胞,将悬浮液转移到一个新的管中;
(5)将上述离心管放置磁体上3min,用移液枪小心地将上清移除;
(6)重复(4)和(5)四次;即一共清洗5次;
(7)将磁珠悬浮液转移到一个新管中,放在冰上,并立即进行后续实验。
D、从循环肿瘤细胞中分离mRNA
试剂盒:Dynabeads mRNA DIRECT Micro Kit,公司:Invitrogen,货号:61021
1.准备Oligo(dT)25磁珠
(1)涡旋大于30s或旋转混合5min,重悬混匀Dynabeads Oligo(dT)25;
(2)转移适当体积的Dynabeads Oligo(dT)25(以25μL/RNA分离样本计)到新的RNase-free管中;
(3)加入等体积Lysis/Binding Buffer(以25μL/RNA分离样本计);
(4)将该管放置在磁体上1min,移除上清;
(5)从磁体上取下管,用与步骤(2)相同体积的Lysis/Binding buffer(以25μL/RNA分离样本计),每个样本管分装25μL悬浮液。
2.肿瘤细胞裂解
(1)经过Dynabeads Epithelial Enrich试剂盒分离的肿瘤细胞,最后一次漂洗后,立即将磁珠-细胞混合样放在冰上,等待mRNA分离和PCR;
(2)在mRNA分离前,将样本管放置在磁体上2min,移除上清;
(3)使用100μL Lysis/Binding Buffer重悬磁珠-细胞混合体系;
(4)上下吹吸3次,注意不要起沫。
3.mRNA分离
(1)将包含裂解细胞的样本管放置在磁体上3min;
(2)将上清转移到包含有25μL预漂洗的Dynabeads Oligo(dT)25悬浮液(步骤第四部分-1-(5));
(3)吹吸数次混合均匀,注意不要起沫;
(4)将样本管固定在样本混合器或旋转仪上,室温下混合至少5min,保证mRNA充分与磁珠结合;
(5)将样本管放置在磁体上,移除上清。从磁体上取下样本管,加入100μL washing buffer A用枪头小心重悬磁珠-mRNA混合体系;
(6)将样本管放置在磁体上,移除上清;
(7)重复步骤5-6;
(8)用100μL washing buffer B重悬磁珠-mRNA混合体系;
(9)将悬浮液转移到一个新的管中;
(10)将上述新的样本管放置在磁体上,移除上清;
(11)用100μL washing buffer B重悬磁珠-mRNA混合体系;
(12)将样本管放置在磁体上,移除上清;
(13)从磁体上取下样本管,用13.5μL在冰上预冷的10mM Tris-HCl重悬;
(14)72℃孵育样本管2min,将管放置在磁体上立刻转移到一个新的离心管中,该体系可直接用于反转录或在-80℃保存。
E、将mRNA反转录成cDNA
试剂盒:QuantiNova SYBR Green PCR Kit,公司:Qiagen,货号:208054
所述反转录反应程序为:37℃保持60min;然后再93℃保持5min,再置于4℃下保存。
反转录反应体系为:总体积为20μL,10×Buffer RT 2.0μL,dNTPs 2.0μL,Oligo dT primer 2.0μL,Sensicript Reverse Transcriptase 1.0μL,40U/μL的RNase Inhibitor 0.25μL,mRNA-Tris-HCl重悬液12μL,余量为水。
F、RT-qPCR检测
PCR反应体系为:总体积为20μL,2x QuantiNova SYBR Green PCR Master Mix 2.0μL,Rox 0.1μL,10μM的Forward Primer 1.4μL,10μM的Reverse Primer 1.4μL,cDNA 1.0μL,RNase-Free water 6.1μL,余量为水。
使用的PCR扩增程序为:在95℃温度下预变性2min;然后进行40个循环,其中每个循环依次包括以下步骤:在95℃温度下保存5s,在60℃温度下保存30s;完成40个循环之后,即完成PCR扩增程序。
最后所应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的 精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!