一种检测蛋白质巯基亚硝基化的荧光探针及其制备和应用的制作方法
本发明属生物检测领域,涉及一类检测蛋白质巯基亚硝基化(S-nitrosothiols,SNOs)的荧光探针及其制备方法和应用。
背景技术:
蛋白质巯基亚硝基化修饰(S-nitrosylation,S-亚硝基化修饰)是一类依赖于一氧化氮(NO)分子的可逆性蛋白质翻译后修饰。蛋白质结构中位于特定位点的半胱氨酸巯基与NO分子通过选择性氧化还原共价结合,最终半胱氨酸巯基被亚硝基化修饰。蛋白质中的半胱氨酸残基是调节酶活性、转录因子结合、蛋白质折叠和金属结合的关键因素,因此S-亚硝基化修饰对多种细胞功能的发挥和信号通路的调节,例如神经传导、细胞周期调控、细胞运输、转录翻译调控及自噬、凋亡等过程起着重要的调控作用。然而过度S-亚硝基化会触发蛋白质错误折叠、线粒体功能障碍、转录失调、突触损伤及神经元损伤等等细胞功能障碍,进一步引发多种疾病病理进程的发生和发展。近年来蛋白质S-亚硝基化修饰作为一个新兴的研究热点,越来越受到科学家的重视,发展能对生物体内S-亚硝基化修饰进行实时追踪检测的方法,可极大推动相关的生理病理学研究。
早期的S-亚硝基化修饰检测方法主要是利用化学发光法、比色法、电化学分析法测定样本释放的总NO量,但无法区分NO分解自血红素、代谢物还是S-亚硝基化蛋白质,也无法获取蛋白质S-亚硝基化的修饰位点和动态变化等任何信息。目前应用最广泛、体系发展最成熟的是生物素开关法(biotin switch),该法目前虽然接受度高,准确度好,但存在假阳性高、操作步骤繁琐、实验样本浪费率高、选择性和灵敏度有限、很难应用于活细胞成像及在体实时监测等缺点。小分子荧光探针成像由于透膜性好,灵敏度高,操作简单,可用于活体检测,近年来已成为检测完整生物样本的理想而不可缺少的辅助工具。
技术实现要素:
本发明的一个目的是提供一种检测蛋白质巯基亚硝基化的荧光探针,是一类新型的特异性在活细胞中检测蛋白质S-亚硝基化修饰的小分子荧光探针,具有式I所示的结构:
其中,R为氢、C1-C4烷基,或者不同长度的聚乙二醇链其中:R2为氢、甲基或乙基,n为1-4的自然数。
本发明的又一个目的是提供式I所示化合物的制备方法,通过以下步骤实现:以无水二氯甲烷为溶剂,在1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)及4-二甲氨基吡啶(DMAP)的存在条件下,N-R基取代的3-羟基邻苯二甲酰亚胺与2-二苯基磷基苯甲酸发生缩合反应,并在反应完全后经柱层析纯化,即得式I化合物。反应式如下:
其中,R为氢、C1-C4烷基,或者不同长度的聚乙二醇链其中:R2为氢、甲基或乙基,n为1-4的自然数。
本发明的再一个目的是提供式I所示的荧光探针在检测蛋白质S-亚硝基化修饰中的应用。本发明以活细胞中的应用为例,可通过以下步骤实现:细胞培养基中加入式I所示的荧光探针,使其终浓度为5μM,37℃下孵育30分钟,观察记录细胞荧光强度,本发明提供的荧光探针的特征在于它本身在生理环境中只有微弱的荧光,但可与SNO特异性快速反应,生成具有强荧光的产物,实现1至14倍荧光增强,从而实现蛋白质S-亚硝基化修饰的特异性检测和定量分析。
本发明利用亚硝基化硫醇(SNO)与三苯基磷类化合物间,类似于Staudinger ligation的还原偶联反应,设计可与蛋白质中S-亚硝基化位点特异性反应的荧光探针,这些荧光探针本身无荧光,与SNO反应后可生成具有强荧光的产物,因而可用于蛋白质S-亚硝基化修饰程度的灵敏检测。荧光探针法除适用于检测细胞样本、血浆、组织匀浆中S-亚硝基化修饰程度,还适用于活细胞甚至是动物组织中S-亚硝基化修饰的动态检测。
本发明涉及的荧光探针具有以下有益效果:(1)稳定性好,能够长期保存使用;(2)具有较大的吸收发射波长差(>100nm),能够有效避免激发光的干扰;(3)由于探针在生理环境中本身无荧光,只有在与SNO反应后才有荧光,即与巯基亚硝基化修饰的蛋白发生特异性的反应,生成具有强荧光的产物,因此,检测信噪比高,灵敏度好;(4)具有优秀的选择性,能在复杂生物样品中特异性地检测蛋白质S-亚硝基化;(5)具有良好的生物膜通透性,因而能用于活细胞中S-亚硝基化修饰的检测,从而实现对蛋白质巯基亚硝基化修饰的特异性检测。
附图说明
图1是荧光探针分子I-1与S-亚硝基化谷胱甘肽(GSNO)反应前后的荧光变化。
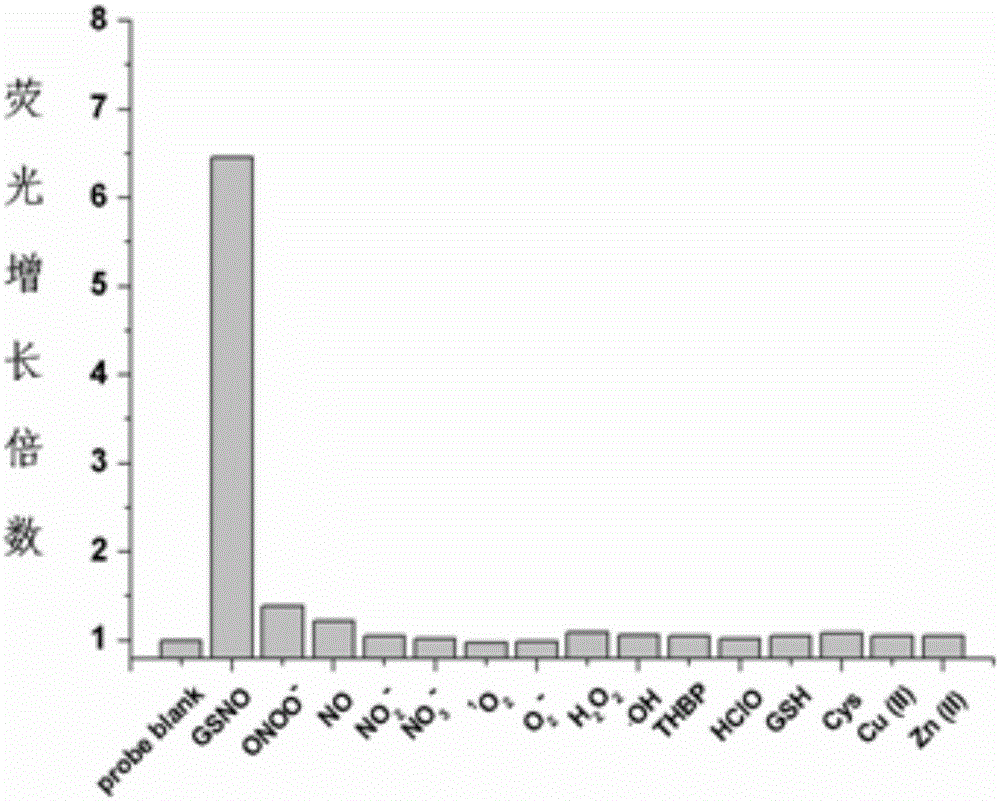
图2是荧光探针分子I-1对GSNO的选择性。
图3是荧光探针分子I-1对GSNO浓度依赖性荧光增强。
图4是荧光探针分子I-1检测活细胞中亚硝酰化蛋白。
图5是荧光探针分子I-1检测活细胞中过表达GAPDH蛋白的巯基亚硝酰化修饰。
具体实施方式
下面结合附图和实施例对本发明做进一步说明,以下的实施例不是限制本发明的范围。
实施例1:荧光探针分子I-1的制备
将2-二苯基磷基苯甲酸92mg(1eq),N-(2-(2-(2-乙氧基)乙氧基)乙氧基)乙基-3-羟基邻苯二甲酰亚胺(2eq),DMAP(0.2eq)放于25mL单口瓶,氮气保护,注入5毫升干燥二氯甲烷,反应15分钟,然后将EDC·HCl(1eq)溶于二氯甲烷,注入,室温搅拌过夜。后处理,加10毫升水,分别用10毫升二氯甲烷萃取三次,合并有机层,无水硫酸钠干燥,减压浓缩后以石油醚和二氯甲烷的混合溶剂洗脱进行硅胶柱层析,过柱色谱,得I-1。1H NMR(500MHz,CDCl3)δ8.42(dd,J=7.0,3.8Hz,1H),7.63–7.55(m,2H),7.45(t,J=7.0Hz,1H),7.41(t,J=7.0Hz,1H),7.31–7.14(m,11H),6.93(dd,J=7.0,3.8Hz,1H),3.74(t,J=5.9Hz,2H),3.60(t,J=5.9Hz,2H),3.56–3.48(m,6H),3.45–3.37(m,4H),1.10(t,J=7.0Hz,3H).
实施例2:荧光探针分子I-1与GSNO反应前后的荧光变化
将探针分子以少量DMSO溶解,分别加入PBS缓冲液或GSNO的PBS溶液,使探针分子的终浓度为5μM,GSNO终浓度为10μM。反应60min后使用荧光分光光计以405nm激发,记录溶液在最大发射波长(约505nm)下的荧光强度,进而确定探针分子与GSNO反应后荧光强度增强,如图1所示。
实施例3:荧光探针分子I-1对GSNO的选择性
将探针分子以少量DMSO溶解,再加入PBS缓冲液配置成溶液,分别加入PBS缓冲液溶解的待测样品,使探针分子的终浓度为5μM,而待测样品终浓度为10μM。反应60min后使用荧光分光光计以405nm激发,记录溶液在最大发射波长(约505nm)下的荧光强度,计算荧光增强倍数,进而确定探针分子对GSNO的选择性,如图2所示。
实施例4:荧光探针分子I-1对GSNO浓度依赖性荧光增强
将探针分子以少量DMSO溶解,再加入PBS缓冲液配置成溶液,分别加入不同浓度的GSNO溶液,使探针分子的终浓度为5μM,反应60min后使用荧光分光光计以405nm激发,记录溶液在最大发射波长(约405nm)下的荧光强度,计算荧光增强倍数,进而确定探针分子对GSNO浓度依赖性荧光增强,如图3所示。
实施例5:荧光探针分子H1检测活细胞中亚硝基化硫醇
将人脐静脉内皮细胞HUVEC接种于多聚赖氨酸包被过的玻片上,含10%胎牛血清的DMEM全培养液中培养24小时后,加入外源性NO供体GSNO(250μM)处理2h。随后换液,加入含有10μM荧光探针H1(10mM,1:1000)的培养液,置于细胞培养箱中37℃孵育1h。细胞玻片经过4%PFA固定7min后,PBS洗3次,加入50μg/ml RNAase 37℃处理30min排除RNA干扰,随后进行细胞核定位PI染色,封片。采用激光共聚焦荧光显微镜观察,拍照。其中分别采用405nm和543nm激光波长激发H1和PI。结果表明,荧光探针分子H1可有效检测到血管内皮细胞中的S-亚硝基化产物,如图4所示。NO清除剂PTIO(150μM)预孵24h处理可使S-亚硝基化探针的荧光亮度在一定程度上有所降低,在这个基础上再给GSNO处理则又能使荧光亮度稍有回升。
此外,我们在内皮细胞HUVEC内过表达GAPDH WT及其亚硝基化位点突变体GAPDH A155S,以提高特异性反应底物水平,考察荧光探针分子H1能否有效检测亚硝基化硫醇的积聚。细胞经Lipo3000转染试剂转染GAPDH WT和GAPDH A155S质粒48-72h后,如上述方法加GSNO处理、荧光探针分子孵育,并进行固定、细胞核PI染色、封片、共聚焦显微镜观察、拍照。结果如图5所示,相较于正常组和突变体组,GSNO处理后过表达GAPDH WT的细胞H1荧光强度明显增强,表明荧光探针分子H1能够有效监测细胞病理损伤过程中S-亚硝基化修饰程度的变化。
- 还没有人留言评论。精彩留言会获得点赞!