一种酶法制备三磷酸腺苷的方法与流程
本发明涉及生物技术领域,特别涉及一种酶法制备三磷酸腺苷的方法。
背景技术:
三磷酸腺苷(ATP)由一个腺苷(A)和三个磷酸基团组成,分子量为507,分子式C10H16N5O13P3。它是生物体内的能量转换器和贮存器,在人体能量代谢中起着重要的作用,作为代谢的中间体、辅酶参与生物体内糖类、蛋白质、核酸和脂肪等的代谢。在临床应用上,ATP作用广泛,对进行性肌肉萎缩、中风后遗症、心肌梗塞、心肌炎、冠状动脉硬化、肝炎等病症具有良好的治疗和辅助治疗作用。
ATP的合成主要有化学合成法、生物酶催化法、光合磷酸化和氧化磷酸化法以及微生物酶系发酵等方法。目前,工业生产ATP普遍采用的方法是以腺苷(A)或腺苷酸(AMP)为底物,利用酵母菌酶系,通过糖酵解途径,进行底物水平磷酸化合成ATP。此方法虽然生产效果良好,成本不高,但是经酵母细胞酶系催化合成ATP的反应过程复杂,参与催化反应的酶系众多,反应过程不易控制,产品批次间质量差异较大。同时,酵母质量常因供应的厂家不同、批次不同、甚至季节不同而有很大差异。且酵母酶系活力下降快,使用寿命短,一般是一次性使用,大量废弃酵母对大气、水源、土壤环境污染相对较大。另外,反应过程中添加大量酵母细胞酶液,引入了大量的蛋白、色素等杂质给ATP后期纯化带来很多困难。
相较而言,生物酶法催化生产ATP技术更加高效稳定、容易控制且节能环保。在原料成本方面,除底物和一定量镁盐等无机盐外,酵母发酵法需消耗大量酵母泥、葡萄糖及磷酸盐,而生物酶法则需要添加一定量的磷酸供体和相应的催化酶。因此,长期以来,磷酸供体和催化用酶的选择是酶法催化工艺无法规模化应用于生产的限制条件。根据文献报道,乙酸激酶、氨激酶、丙酮酸激酶、精氨酸激酶及肌酸激酶等酶均可用于制备ATP。但是,上述酶所利用的磷酸供体或者价值昂贵,如丙酮酸激酶、肌酸激酶所需磷酸供体磷酸烯醇式丙酮酸和磷酸肌酸,或者生成的副产物有一定的生物毒性和污染性,如乙酸激酶、氨激酶催化反应的产物分别为乙酸和氨气,因此都较难在工业生产中大量使用。
专利CN201610165471.7利用较简单的酶系,以固定化方式,使用成本低廉的多聚磷酸或其盐为磷酸供体制备ATP,获得高效稳定的效果。所用的“ATP生产酶”包括多聚磷酸激酶(EC 2.7.4.1,Ppk)、腺苷酸激酶(EC 2.7.4.3,Adk)和多聚磷酸-腺苷酸磷酸转移酶(EC 2.7.4.-,Pap,有文献报道该酶也属于Ppk酶中的一类,但IUBMB对该酶分类尚不十分明确)。其中,Ppk酶催化ADP与多聚磷酸或其盐反应生成ATP(Ppk酶有Ppk1和Ppk2两种不同形式,在一定条件下,两者均可催化ADP生成ATP),Adk酶催化2分子ADP生成1分子ATP和1分子AMP,Pap酶则催化AMP与多聚磷酸或其盐反应生成ADP。Ppk、Adk及Pap三种酶的合理组合均可合成ATP,所利用的底物为AMP。
但AMP作为生产原料价格偏高,本发明专利在原有“ATP生产酶”基础上添加腺苷激酶(EC 2.7.1.20,AK),该酶可催化腺苷生成AMP,组合上述其它ATP生产酶,可共同作用合成ATP,总反应方程式为:A+3PolyPn→ATP+3PolyPn-1。腺苷售价仅为AMP的30%左右,价格低廉,来源广泛,为工业生产节约了大量成本。且加入AK酶后,不影响其它ATP生产酶的活性,ATP的生成速率及最适反应条件也基本保持不变。整个反应过程中催化用酶可循环利用,成本低,节能环保。产物ATP易于纯化,适于开发用于工业化生产。
技术实现要素:
本发明提供了一种酶法制备三磷酸腺苷的方法,其克服了现有技术的上述缺陷。以腺苷为底物,通过添加“ATP生产酶”,即AK酶及Ppk、Adk和Pap酶的任意两种或三种组合催化生产ATP,大大降低现有酶法制备ATP的成本,使之进一步应用于规模化生产。
本发明所要解决的技术问题是通过以下技术方案来实现的:
一种酶法制备三磷酸腺苷的方法,包括以下步骤:
(1)制备ATP生产酶:
通过基因工程改造、发酵、纯化或直接提取等其它方式获得ATP生产酶。ATP生产酶可以游离酶的形式制成酶液或者干粉;也可进一步固定于固定化载体上,制得固定化ATP生产酶。
(2)反应液中ATP的制备:
在酶促反应体系中,按需求添加腺苷进行酶促反应。同时,按比例添加ATP生产酶,即AK酶及Ppk、Adk和Pap酶的任意两种或三种组合,并添加少量用以启动反应的ATP、ADP或AMP中的一种或几种组合,以及作为磷酸供体的多聚磷酸或其盐,进行ATP制备反应。反应体系中还包含镁离子和/或锰离子,钾离子、钠离子、铵离子中的一种或几种,Tris或磷酸根离子。本发明添加的底物、酶及各类盐可一次性加入反应体系,也可按照工业生产工艺流程分批次流加补入。
(3)分离产物和ATP生产酶:
固定化的ATP生产酶在反应罐中直接分离。上述分离可通过过滤方式分离,也可在反应柱中直接分离。或
游离的ATP生产酶通过滤器中超滤膜分离。其中,过滤器具有进料口、出料口和回流口,内设截留的超滤膜。经过滤器的截留液为回收的酶液,滤出液为分离出酶之后含产物ATP的反应液。
回收的固定化或游离的ATP生产酶可重复利用于步骤(2)。
(4)成品制备:步骤(3)中分离出酶的反应液通过离子交换层析、浓缩、结晶、干燥等步骤制备成品ATP。
优选地,上述技术方案中,步骤(1)所述的ATP生产酶为腺苷激酶(EC2.7.1.20,AK)以及多聚磷酸激酶(EC 2.7.4.1,Ppk,包括Ppk1酶和Ppk2酶)、腺苷酸激酶(EC 2.7.4.3,Adk)、多聚磷酸-腺苷酸磷酸转移酶(EC 2.7.4.-,Pap)中的任意两种或三种组合,即使用AK、Ppk和Adk组合,或AK、Adk和Pap组合,或AK、Ppk和Pap组合,或AK、Ppk、Adk和Pap的组合;其中,当选择四种酶组合时,AK、Ppk、Adk和Pap酶的添加比例优选为(0.1-10):(0.1-10):(0.1-10):1。
上述的AK、Ppk、Adk、Pap四种酶可以来源于任何生物、或者是经过人工改造具有同样催化功能的酶。Ppk可以是Ppk1酶和/或Ppk2酶。
优选地,上述技术方案中,步骤(1)所述固定化载体选自于高分子载体、无机载体、磁性高分子微球载体中的一种或多种。其中,高分子载体选自于纤维素、葡萄糖凝胶、琼脂糖、聚丙烯酰胺、多聚氨基酸、聚苯乙烯、聚丙烯酸、海藻酸钠、壳聚糖、淀粉、聚乙烯醇、明胶、卡拉胶、尼龙或合成高聚物等;无机载体选自于多孔玻璃、氧化硅、硅胶、活性炭或硅藻土等。
优选地,上述技术方案中,所述的固定化ATP生产酶通过下列方式固定于固定化载体:吸附、包埋、共价、结合、交联或其组合。其中,AK、Ppk、Adk、Pap四种酶可分别固定或按比例混合固定。
优选地,上述技术方案中,步骤(2)ATP生产反应条件如下:
反应温度为25-60℃,优选温度为30-50℃,最优选为45℃;
反应pH为5-9.5,优选pH为6-9,最优选为7.5。
酶促反应体系包括:底物腺苷;
还包括:ATP或ADP或AMP中的一种或几种,用以启动反应,腺苷与添加的ATP、ADP、AMP总量的摩尔浓度比例为(1-100):1;
还包括:多聚磷酸或其盐,镁离子、锰离子中的一种或两种,铵离子、钾离子、钠离子的一种或几种,Tris或磷酸根离子。
优选地,上述技术方案中,本发明添加的底物、酶及各类盐可一次性加入反应体系,也可按照工业生产工艺流程分批次补入。
优选地,上述技术方案中,本发明添加的腺苷浓度1-80g/L;多聚磷酸或其盐的摩尔浓度为反应添加的腺苷摩尔浓度的0.01-10倍;镁离子浓度为0.01-0.2M;锰离子浓度为0.01-0.15M;钾离子浓度为0.01-0.5M;钠离子浓度为0.01-0.5M;铵离子浓度为0.01-0.3M;Tris浓度为0.01-0.1M、磷酸盐浓度为0.01-0.1M。
优选地,上述技术方案中,多聚磷酸或其盐选自于多聚磷酸钠、多聚磷酸钾、多聚磷酸铵、六偏磷酸(钠)、四聚磷酸(钠)和三聚磷酸(钠)中的一种或多种;镁离子选自于氯化镁、硫酸镁、亚硫酸镁和硝酸镁中的一种或多种;锰离子选自于氯化锰和硫酸锰中的一种或多种;钾离子选自于氯化钾、硫酸钾、硝酸钾、氢氧化钾、亚硫酸钾、碳酸钾、碳酸氢钾、醋酸钾、磷酸氢二钾、磷酸二氢钾和柠檬酸钾中的一种或多种;钠离子选自于氯化钠、硫酸钠、硝酸钠、氢氧化钠、亚硫酸钠、碳酸钠、碳酸氢钠、醋酸钠、磷酸氢二钠、磷酸二氢钠和柠檬酸钠中的一种或多种;铵离子选自于氯化铵、硫酸铵、硝酸铵、氨水、碳酸铵、碳酸氢铵、磷酸氢二铵、磷酸二氢铵和醋酸铵中的一种或多种。
本发明方法步骤(3)中采用的超滤膜选自于醋酸纤维素膜、聚砜膜、聚丙烯腈膜、聚氯乙烯膜、聚偏氟乙烯膜、聚酰胺膜或陶瓷膜。
本发明上述技术方案,具有如下有益效果:
(1)采用新型ATP生产酶,酶高效稳定且价格低廉,ATP生产过程简单、容易控制;
(2)使用廉价的腺苷作为底物生产ATP,进一步降低了生物酶催化法制备ATP的成本;
(3)反应需添加的磷酸供体多聚磷酸或其盐价格低廉,污染小,且对反应用酶的影响较小;
(4)建立了ATP生产酶回收体系,适用于工业化大规模生产;
(5)酶法制备反应液中杂蛋白、色素等杂质含量少,易于后续ATP纯化工作。
附图说明
图1为本发明酶法制备三磷酸腺苷的方法所使用的AK酶的SDS-PAGE图。
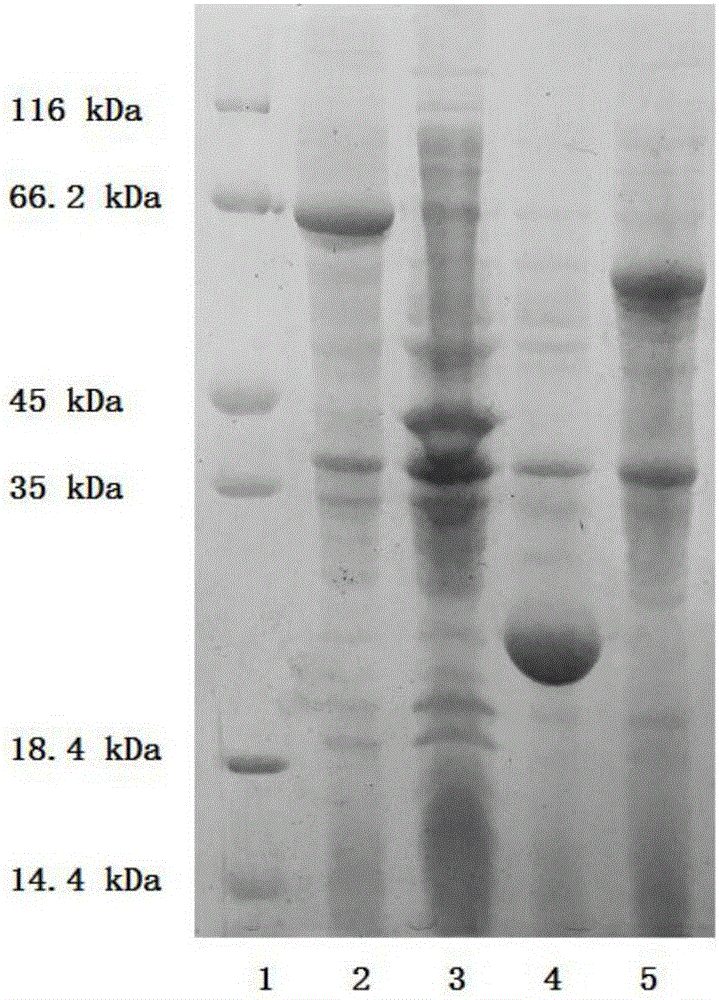
图2为本发明酶法制备三磷酸腺苷的方法所使用的Ppk、Adk、Pap酶的SDS-PAGE图。
图3为本发明酶法制备三磷酸腺苷的方法使用游离的ATP生产酶的反应工艺流程图。
图4为本发明酶法制备三磷酸腺苷的方法使用固定化ATP生产酶的反应工艺流程图。
图5为本发明酶法制备三磷酸腺苷的方法实施例2反应3小时HPLC图。
图6为本发明酶法制备三磷酸腺苷的方法实施例2反应6小时终止时HPLC图。
具体实施方式
下面对本发明的具体实施例进行详细描述,以便于进一步理解本发明。
实施例1 AK、Ppk、Adk和Pap酶的制备
本发明方法中的AK、Ppk(Ppk1和/或Ppk2)、Adk和Pap酶可以商购获得,或者是经过人工改造具有同样催化功能的酶。
AK、Ppk1、Ppk2、Adk和Pap酶的制备过程如下:
根据五种酶基因的序列,设计五对扩增引物。提取酿酒酵母(Saccharomyces cerevisiae)菌株基因组DNA,以其为模板,PCR扩增ado1(AK酶基因)片段,并将其连接至pET 22b载体(购于Novagene公司);提取大肠杆菌(Escherichia coli)K12菌株(购于天根生化科技有限公司)基因组DNA,以其为模板,PCR扩增ppk1和adk基因片段,并将其分别连接至pET 22b载体(购于Novagene公司);提取铜绿假单胞菌(Pseudomonas aeruginosa)菌株(CICC 10419)基因组DNA,以其为模板,PCR扩增ppk2基因片段,并将其连接至pET22b载体(购于Novagene公司);提取约氏不动杆菌(Acinetobacter johnsonii)菌株(CGMCC 1.8030)基因组DNA,以其为模板,PCR扩增pap基因片段,并将其连接至pET22b载体(购于Novagene公司)。5段连接序列经测序正确后,分别转入E.coli BL21(DE3)菌株(购于天根生化科技有限公司)。
将转化后的E.coli BL21(DE3)单克隆接入LB培养基,培养至对数期后,加入1mM异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导5小时,收集菌体,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)筛选高表达菌株。
将筛选出的高表达菌株在无菌条件下接入种子培养基,培养至对数生长期后接入含5L发酵培养基的发酵罐中,继续培养至对数生长期后接入含50L发酵培养基的发酵罐中,培养5小时后加入1mM IPTG诱导5小时,离心收集菌体约1kg。
其中LB培养基成分为:1%蛋白胨、0.5%酵母粉和1%氯化钠;种子培养基成分为:1%蛋白胨、0.5%酵母粉和1%氯化钠;发酵培养基成分为:1%蛋白胨、0.5%酵母粉、1%氯化钠、5%磷酸氢二钠、1%磷酸二氢钠、0.01%硫酸镁和1%甘油。
收获的菌体分别经超声或高压均质破碎后,离心收集上清。在上清中加入40-60%饱和硫酸铵,离心。收集的沉淀经Tris缓冲液(pH 8.0)溶解后,使用G25柱(购于通用电气医疗生物科学有限公司)脱盐,再经CM-或DEAE-Sepharose FF(购于通用电气医疗生物科学有限公司)层析可得到初步纯化的游离酶。
图1为所制备AK酶的SDS-PAGE图,如图所示:泳道1为蛋白标志物14.4-116kDa(购于北京中科瑞泰生物技术有限公司);泳道2为AK酶,约40kDa。
图2为所制备其它酶的SDS-PAGE图,如图所示:泳道1为蛋白标志物14.4-116kDa(购于北京中科瑞泰生物技术有限公司);泳道2为Ppk1酶,约60kDa;泳道3为Ppk2酶,约40kDa;泳道4为Adk酶,约25kDa;泳道5为Pap酶,约55kDa。
使用现有技术记载的公知的测定酶活性的方法,检测到1mg/ml AK、Ppk1、Ppk2、Adk和Pap酶液活性分别约为800U、100U、500U、1000U和800U,其中将1μM底物在1分钟内完全转化定义为1个活性单位(U)。
实施例2使用游离酶制备ATP
图3为本发明方法使用游离酶生产ATP工艺流程图。参见图3,使用游离酶制备ATP的操作步骤如下:
(1)在反应罐中合成ATP的反应:
在反应罐中,100L无菌水的反应体系为含有底物2.5kg腺苷,以及0.1kg ATP、0.5kg磷酸二氢钠、0.3kg氯化钠、0.3kg硫酸铵、1.0kg六水氯化镁和2.0kg六偏磷酸钠的溶液,配制时均匀搅拌防止出现沉淀。调节pH值至7.5,在反应体系中添加500U/LAK酶、800U/L Ppk2酶及800U/L Pap酶开始反应。反应期间控制pH值为7.5,温度为45℃。
图5、图6分别为反应3小时及6小时HPLC检测图。
反应6小时后,ATP生成量约为44g/L,腺苷转化率90%以上。HPLC检测条件为:Kromasil C18色谱柱(购于AKZO NOBEL公司)(150×4.6mm),检测波长210nm,检测温度30℃,检测流速1ml/min,流动相为含有5%甲醇及50mM磷酸盐的缓冲液,pH=3.0。
(2)在过滤器中分离ATP生产酶:
通过超滤方法,将步骤(1)中反应体系的反应液通过过滤器分离AK、Ppk2及Pap三种ATP生产酶,参见图3。过滤器内装膜包(购于Pall公司,截留分子量20kDa),滤出液为分离出酶之后的反应液,含有ATP、少量ADP、少量AMP及盐离子。
检测到回收的AK、Ppk2及Pap酶的活性较反应前减少5%-10%不等,添加相应新酶后再次用于步骤(1)反应。
(3)分离产物ATP:
步骤(2)的滤出液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达85%。
实施例3使用游离酶制备ATP
参见图3,使用游离酶制备ATP的操作步骤如下:
(1)在反应罐中合成ATP的反应:
在反应罐中,100L无菌水的反应体系为含有底物3.0kg腺苷,以及0.1kg AMP、0.5kg磷酸氢二钠、0.3kg氯化钾、0.25kg氯化铵、2.5kg七水硫酸镁和3.0kg四聚磷酸的溶液,配制时均匀搅拌防止出现沉淀。调节pH值至7.0,在反应体系中添加500U/LAK酶、500U/L Ppk2酶、300U/LAdk酶及500U/L Pap酶开始反应。反应期间控制pH值为7.0,温度为40℃。
反应8小时后,ATP生成量约为50g/L,腺苷转化率达85%。HPLC检测条件同实施例2步骤(1)。
(2)在过滤器中分离ATP生产酶:
通过超滤方法,将步骤(1)中反应体系的反应液通过过滤器分离AK、Ppk2、Adk及Pap四种ATP生产酶,参见图3。过滤器内装膜包(购于Pall公司,截留分子量8kDa),滤出液为分离出酶之后的反应液,含有ATP、少量ADP、少量AMP及盐离子。
检测到回收的AK、Ppk2、Adk及Pap酶的活性较反应前减少5%-10%不等,添加相应新酶后再次用于步骤(1)反应。
(3)分离产物ATP:
步骤(2)的滤出液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达80%。
实施例4使用固定化酶制备ATP
图4为本发明方法使用固定化酶生产ATP工艺流程图。参见图4,使用固定化酶制备ATP的操作步骤如下:
(1)ATP生产酶的固定:
催化用ATP生产酶AK、Ppk2和Adk酶一同以商业化的环氧基固定化载体LX1000EP固定。
将AK、Ppk2和Adk游离酶酶液按照活性比1:1:1配成混合酶液20L,酶液中各酶活性均为600U。在恒温搅拌罐中加入LX1000EP湿载体3kg与上述酶液混合,在20℃条件下,150rpm搅拌12小时。过滤收集载体,用0.02M磷酸钾缓冲液(pH 8.0)清洗2遍,即得固定化混合酶。AK、Ppk2和Adk酶固定化后,活性降低至原活性的50-60%。
(2)在反应柱中生成ATP:
配制反应液,每50L含有底物1.0kg腺苷,以及0.05kg ATP、0.2kg Tris、0.15kg氯化钠、0.15kg氯化铵、1.0kg七水硫酸镁和1.0kg四聚磷酸钠的溶液,配制时均匀搅拌防止出现沉淀。调节pH值至6.8,温度为35-40℃。
将上述步骤(1)中的混合固定酶3kg装入反应柱,排尽气泡后制得酶反应柱。使用恒流泵将反应液以15L/h流速由下而上缓慢泵入通过酶反应柱,反应期间控制温度为37℃。循环反应7小时后,收集反应液,检测ATP的生成量为35g/L,90%腺苷转化为ATP。
固定化酶循环反应20次以上或者-4℃储存时间一月以上,酶活性降低10-15%,需按比例补加或更换部分新酶。
(3)分离产物ATP:
步骤(2)的反应液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达82%。
实施例5使用固定化酶制备ATP
参见图4,使用固定化酶制备ATP的操作步骤如下:
(1)ATP生产酶的固定:
催化用ATP生产酶AK、Adk和Pap酶分别以商业化的含氨基合成高聚物载体LX1000HA固定。
将AK游离酶酶液配成酶液6L,酶活性为600U。在恒温搅拌罐中加入LX1000HA湿载体2kg与上述酶液混合,在20℃条件下,150rpm搅拌12小时。过滤收集载体,用0.02M磷酸钾缓冲液(pH 8.0)清洗2遍,即得固定化AK酶。将600UAdk酶、1200U Pap酶以同样方式分别固定于LX1000HA载体。AK、Adk和Pap酶固定化后,活性降低至原活性的30-50%。
(2)在反应柱中生成ATP:
配制反应液,每50L含有底物1.25kg腺苷,以及0.1kg ATP、0.1kg ADP、0.05kg AMP、0.2kg Tris、0.1kg氯化钠、0.1kg氯化铵、0.25kg一水氯化锰和1.0kg六偏磷酸钠的溶液,配制时均匀搅拌防止出现沉淀。调节pH值至6.5,温度为30-35℃。
将上述步骤(1)中的固定酶共6kg装入反应柱,排尽气泡后制得酶反应柱。使用恒流泵将反应液以20L/h流速由下而上缓慢泵入通过酶反应柱,反应期间控制温度为33℃。循环反应约6小时后,收集反应液,检测ATP的生成量为45g/L,80%以上腺苷转化为ATP。
固定化酶循环反应20次以上或者-4℃储存时间一月以上,酶活性降低约10-15%,需按比例补加或更换部分新酶。
(3)分离产物ATP:
步骤(2)的反应液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达78%。
实施例6
参见图3,使用游离酶制备ATP的操作步骤如下:
(1)在反应罐中合成ATP的反应:
在反应罐中,100L无菌水的反应体系为含有底物5.0kg腺苷,以及3.0kg ATP、3.0kg AMP、1.42kg磷酸氢二钠、3.73kg氯化钾、1.61kg氯化铵、5.0kg七水硫酸镁和6.0kg多聚磷酸铵(分子量>20000)的溶液,配制时均匀搅拌。调节pH值至6.0,在反应体系中添加1000U/L AK酶、1000U/L Ppk1酶及1000U/L Pap酶开始反应。反应期间控制pH值为6.0,温度为50℃。
反应3小时后,以0.6kg/小时的速度补入腺苷,补加5小时,使加入的总腺苷量达到80g/L。
反应12小时后,ATP生成量为120g/L。HPLC检测条件同实施例2步骤(1)。
(2)在过滤器中分离ATP生产酶:
通过超滤方法,将步骤(1)中反应体系的反应液通过过滤器分离AK、Ppk1及Pap三种ATP生产酶,参见图3。过滤器内装膜包(购于Pall公司,截留分子量20kDa),滤出液为分离出酶之后的反应液,含有ATP、少量ADP、少量AMP及盐离子。
检测到回收的AK、Ppk1及Pap酶的活性较反应前减少20%-30%不等,添加相应新酶后再次用于步骤(1)反应。
(3)分离产物ATP:
步骤(2)的滤出液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率40-50%。
实施例7
参见图3,使用游离酶制备ATP的操作步骤如下:
(1)在反应罐中合成ATP的反应:
在反应罐中,100L无菌水的反应体系为含有底物5.0kg腺苷,以及0.095kg ATP、1.42kg磷酸氢二钠、0.8kg氯化铵、1.0kg六水氯化镁、2.0kg多聚磷酸铵和2.0kg六偏磷酸钠的溶液,配制时均匀搅拌。调节pH值至9.0,在反应体系中添加1000U/L AK酶、1000U/L Ppk1酶、100U/L Ppk2酶及1000U/L Pap酶开始反应。反应期间控制pH值为9.0,温度为30℃。
反应9小时后,ATP生成量为70g/L。HPLC检测条件同实施例2步骤(1)。
(2)在过滤器中分离ATP生产酶:
通过超滤方法,将步骤(1)中反应体系的反应液通过过滤器分离AK、Ppk1、Ppk2及Pap四种ATP生产酶,参见图3。过滤器内装膜包(购于Pall公司,截留分子量20kDa),滤出液为分离出酶之后的反应液,含有ATP、ADP、AMP及盐离子。
检测到回收的AK、Ppk1、Ppk2及Pap酶的活性较反应前减少20%-30%不等,添加相应新酶后再次用于步骤(1)反应。
(3)分离产物ATP:
步骤(2)的滤出液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达62%。
实施例8
参见图3,使用游离酶制备ATP的操作步骤如下:
(1)在反应罐中合成ATP的反应:
在反应罐中,100L无菌水的反应体系为含有底物1.0kg腺苷,以及0.02kg ATP、0.12kg Tris、0.075kg氯化钾、0.054kg氯化铵、0.246kg七水硫酸镁和1.0kg四聚磷酸钠的溶液,配制时均匀搅拌。调节pH值至5.0,在反应体系中添加50U/L AK酶、500U/L Ppk2酶及300U/L Pap酶开始反应。反应期间控制pH值为5.0,温度为25℃。
反应15小时后,ATP生成量为10g/L。HPLC检测条件同实施例2步骤(1)。
(2)在过滤器中分离ATP生产酶:
通过超滤方法,将步骤(1)中反应体系的反应液通过过滤器分离AK、Ppk2及Pap三种ATP生产酶,参见图3。过滤器内装膜包(购于Pall公司,截留分子量20kDa),滤出液为分离出酶之后的反应液,含有ATP、ADP、AMP及盐离子。
检测到回收的AK、Ppk2及Pap酶的活性较反应前减少35%-40%不等,添加相应新酶后再次用于步骤(1)反应。
(3)分离产物ATP:
步骤(2)的滤出液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达40%。
实施例9
参见图3,使用游离酶制备ATP的操作步骤如下:
(1)在反应罐中合成ATP的反应:
在反应罐中,100L无菌水的反应体系为含有底物0.1kg腺苷,以及0.16kg ADP、0.12kg Tris、0.075kg氯化钾、0.058kg氯化钠、0.203kg六水氯化镁、0.144kg一水氯化锰和2.3kg六偏磷酸钠的溶液,配制时均匀搅拌。调节pH值至9.5,在反应体系中添加10U/L AK酶、20U/L Adk酶及100U/L Pap酶开始反应。反应期间控制pH值为9.5,温度为60℃。
反应9小时后,ATP生成量为1.8g/L。HPLC检测条件同实施例2步骤(1)。
(2)在过滤器中分离ATP生产酶:
通过超滤方法,将步骤(1)中反应体系的反应液通过过滤器分离AK、Adk及Pap三种ATP生产酶,参见图3。过滤器内装膜包(购于Pall公司,截留分子量8kDa),滤出液为分离出酶之后的反应液,含有ATP、ADP、AMP及盐离子。
检测到回收的AK、Adk及Pap酶的活性较反应前减少35%-40%不等,添加相应新酶后再次用于步骤(1)反应。
(3)分离产物ATP:
步骤(2)的滤出液通过离子交换层析、浓缩、结晶、干燥后制得成品ATP,纯度可达98%以上,总收率达45%。
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!
- 腺苷a1-和/或双a1/a2b-激动剂在制备治疗疾病的药物中的用途的制作方法
- 钠/钾三磷酸腺苷酶及src相关的材料和方法
- 钠/钾三磷酸腺苷酶及胆固醇相关的材料和方法
- 肌苷、三磷酸腺苷、维生素c复方制剂及其应用的制作方法
- 三磷酸腺苷多功能保健润眼液及其制备方法
- 一种多肽——二磷酸腺苷核糖二磷酸酶-38.5和编码这种多肽的多核苷酸的制作方法
- 焦磷酸测序检测hbv拉米夫定耐药突变位点的pcr与测序引物的制作方法
- 一种多肽——三磷酸腺苷合成酶-9.35和编码这种多肽的多核苷酸的制作方法
- 一种多肽——腺苷三磷酸合成酶-10.89和编码这种多肽的多核苷酸的制作方法
- 茶树液泡致电的质子泵三磷酸腺苷酶表达序列标签及其生物芯片的制作方法