裂解液、提取液、裂解和提取方法、试剂盒及应用、PCR体系与流程
本发明涉及基因工程
技术领域:
,特别涉及一种裂解液、鱼类组织DNA提取液、裂解方法、提取鱼类组织DNA的方法、鱼类组织DNA提取试剂盒及其应用、扩增鱼类组织DNA的PCR体系。
背景技术:
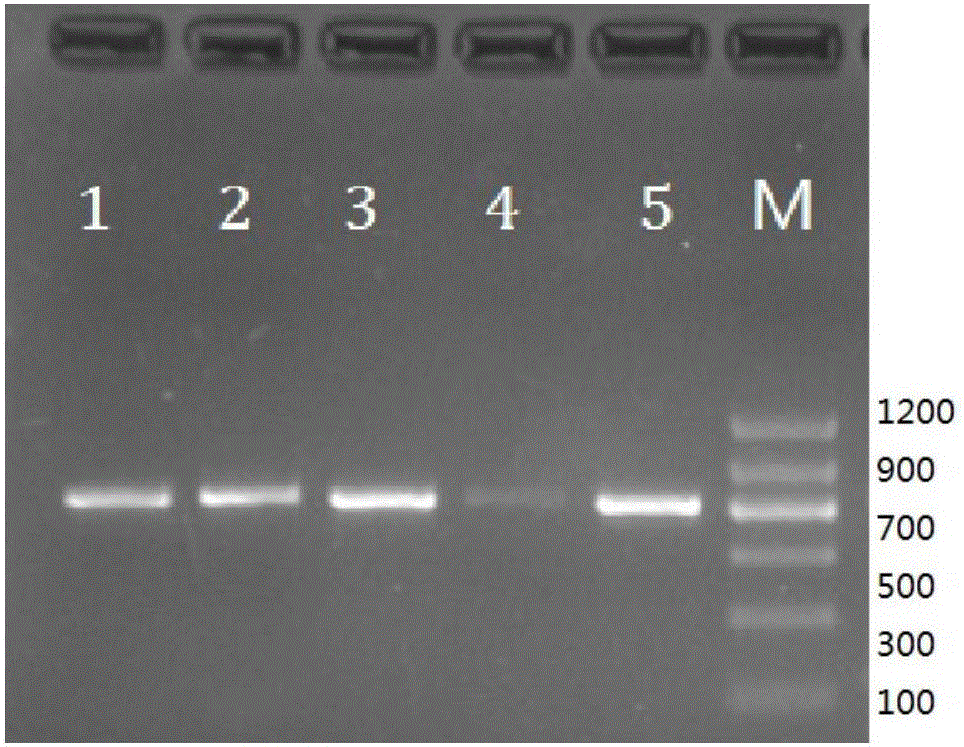
:动物组织DNA提取的主要方法有蛋白酶裂解后的酚-氯仿提取、异丙醇或异戊醇提取和SDS法,还有针对线粒体DNA提取的氯化铯沉淀法、chelex-100或吐温(Tween)法和尿素提取法等,目前应用较为广泛的是相对简单方便的商业化动物组织DNA提取试剂盒。通过这些方法获得的基因组DNA,一般能去除原来组织样本中的蛋白质和脂肪,还能通过醇类沉淀去除酚类等试剂,所得DNA纯度较高,能够满足大部分实验要求。获取动物组织DNA是PCR分析和其他分子生物学研究的基础,这些技术和分析方法被应用到诸多研究和检测领域,如对核DNA或线粒体DNA的遗传多样性分析、物种鉴定和目前DNA条形码技术分析等。但很多时候根据实验目的不同,对DNA纯度的要求也不同,在一些快速分析检测中更加注重DNA提取过程的快速、准确和灵敏性。鱼类组织具有易变质腐败,保存难度大于其他肉类的特点。因此,在提取鱼类组织DNA时,要求提取过程快速准确。然而,上述各种动物组织DNA提取方法由于操作过程复杂、步骤繁琐、耗时长,并且提取试剂复杂,往往不能满足鱼类组织DNA提取的需要,有时还会因试剂残留而影响后续PCR扩增过程,甚至微量样品处理后DNA总量不足难以进行PCR扩增,尤其难以满足于快速检测和鉴定领域。此外,个别提取方法,如酚-氯仿提取法,还具有毒性强,对研究者健康损害大的缺点。对于某一特定的鱼类肌肉组织,如鱼类肌肉还具有脂肪含量低,易于处理,细胞裂解后即可释放DNA,鳞片和鱼鳍类似于哺乳动物的指甲,含有大量的角蛋白,对其进行DNA提取时,不需过多的去除脂肪,而要去除大量的角蛋白。而现有动物组织DNA提取方法在于去除组织中的蛋白质和脂肪。很显然,现有的动物组织DNA的提取方法不利于鱼类研究。因此,亟需一种能够快速准确提取鱼类组织中DNA的方法,以利于后续在鱼类快速检测和鉴定中的研究。技术实现要素:针对鱼类组织的特点,本发明实施例公开了一种鱼类组织DNA提取液及提取方法,以达到快速提取鱼类组织中DNA的目的,从而加快鱼类快速检测和鉴定等研究。本发明提供了一种裂解液,其用于裂解鱼类组织而释放出DNA,包括:乙二胺四乙酸和/或乙二胺四乙酸钠盐、氯化钠、十二烷基硫酸钠、强碱以及水,其中相对于裂解液而言,乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为2~10mM,氯化钠的摩尔浓度为1~10mM,十二烷基硫酸钠的质量分数为0.1~10%,并且强碱的氢氧根离子的摩尔浓度为100~300mM。优选地,所述乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为3~8mM;所述氯化钠的摩尔浓度为3~7mM;所述十二烷基硫酸钠的质量分数为0.5~5%;所述强碱的氢氧根离子的摩尔浓度为150~250mM。更优选地,所述乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为5mM;所述氯化钠的摩尔浓度为5mM;所述十二烷基硫酸钠的质量分数为1%;所述强碱的氢氧根离子的摩尔浓度为200mM。优选地,所述强碱选自NaOH和/或KOH。本发明还提供了一种双组分型鱼类组织DNA提取液,包括作为第一组分的上述的裂解液和作为第二组分的中和液,所述中和液是包括:含有吐温-20的pH值为6.4~7.4的Tris-HCl缓冲液,其中所述中和液中的吐温-20的质量分数为0.02%~0.1%,所述中和液中的Tris的摩尔浓度为0.2~1mM。优选地,所述中和液是包括:含有吐温-20的pH值为6.8的Tris-HCl缓冲液,其中所述中和液中的吐温-20的质量分数为0.05%;所述中和液中的Tris的摩尔浓度为0.5mM。更优选地,所述中和液还包含以下物质中的至少一种:牛血清白蛋白,明胶,和二硫苏糖醇。更优选地,基于所述中和液的总体积,所述中和液还包含0.02~0.1mg/mL的牛血清蛋白、0.2~2mg/mL的明胶和0.02~1mg/mL的二硫苏糖醇中的至少一种。本发明还提供了一种裂解方法,其利用上述的裂解液而使鱼类组织释放出DNA,包括以下步骤:将鱼类组织与裂解液混合,在20~85℃的水浴中保持10~30min,之后离心处理,获得的上清液即为包含DNA的溶液。优选地,在50~65℃的水浴中保持10~20min。更优选地,在55℃的水浴中保持10min。优选地,所述混合的方式为振荡。更优选地,所述鱼类组织与所述裂解液的比例为10~25mg:200~400μL。更优选地,所述鱼类组织与所述裂解液的比例为25mg:400μL。本发明还提供了一种提取鱼类组织DNA的方法,包括以下步骤:将鱼类组织与上述的裂解液混合,在20~85℃的水浴中保持10~30min,再与上述的中和液混合,之后离心处理,获得的上清液即为含有DNA的溶液。优选地,在50~65℃的水浴中保持10~20min。更优选地,在55℃的水浴中保持10min。更优选地,所述裂解液和所述中和液的体积比为10:3~6。更优选地,所述鱼类组织与所述裂解液的比例为10~25mg:200~400μl。更优选地,所述鱼类组织、所述第一组分和所述第二组分的比例为25mg:400μL:120μL。优选地,所述混合的方式为振荡。优选地,所述鱼类组织选自:肌肉、内脏、鱼鳍、鳞片或骨骼。本发明还提供了一种鱼类组织DNA提取试剂盒,包括上述的裂解液和上述的中和液。优选地,还包含鱼类组织DNA提取操作说明书。本发明还提供了上述的试剂盒在提取鱼类组织DNA中的应用。本发明还提供了一种扩增鱼类组织DNA的PCR体系,该PCR体系包括由上述提取鱼类组织DNA的方法所得到的含有DNA的溶液,基于该PCR体系的总体积,所述含有DNA的溶液的体积分数为2%~15%。优选地,基于该PCR体系的总体积,所述含有DNA的溶液的体积分数为10%。本发明实施例提供的技术方案的有益效果是:与现有技术相比,可以在更短时间内提供鱼类组织PCR扩增所需的DNA模板,整个过程不会造成样本DNA的减少或丢失,并且操作简单方便,易于掌握。为鱼类基于DNA水平的分子生物学研究,如快速检测和鉴定研究,提供了更为快捷的处理方法。并且,本发明利用鱼类的多种组织作为提取DNA的原料,在一定程度上扩大了鱼类的分子生物学研究的材料来源。本发明基于最基本的水浴加热和离心设备,适于大多数检测和研究单位应用,且省时省力,是一种快捷方便的获得DNA分析的基础技术。此外,本发明提供的裂解液几乎无毒,不会对研究者的健康造成伤害。附图说明为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为以本发明实施例A1~A4、B1~B4和C1~C4制备的含有DNA的溶液为模板溶液获得的PCR产物的琼脂糖凝胶电泳图;图2为以本发明实施例C1~C4和酚-氯仿提取法制备的含有DNA的溶液为模板溶液获得的PCR产物的琼脂糖凝胶电泳图。具体实施方式为使本发明的技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。在本发明的第一方面,本发明实施例公开了一种裂解液,其用于裂解鱼类组织而释放出DNA,包括:乙二胺四乙酸(EDTA)和/或乙二胺四乙酸钠盐、氯化钠(NaCl)、十二烷基硫酸钠(SDS)、强碱以及水,其中相对于裂解液而言,乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为2~10mM,氯化钠的摩尔浓度为1~10mM,十二烷基硫酸钠的质量分数为0.1~10%,并且强碱的氢氧根离子(OH-)的摩尔浓度为100~300mM。本发明第一方面的原理为:强碱和SDS都可以使细胞破裂,蛋白质变性,染色体中的蛋白质与脱氧核糖核酸(DNA)分离,从而释放出DNA。除此之外,强碱性的裂解液,pH值范围12~13.5,尤其是pH值范围在12~12.6的裂解液可去除大量的角蛋白;在强碱性条件下,十二烷基硫酸钠可使蛋白质发生沉淀。在鱼类细胞破碎后,乙二胺四乙酸或乙二胺四乙酸钠盐可螯和鱼类组织或细胞中的镁离子和钙离子等金属离子,从而抑制脱氧核糖核酸酶对DNA的降解作用。氯化钠有利于提高DNA在裂解液中的溶解度,增加DNA稳定性,使易于DNA的保存。基于上述的裂解鱼类组织而释放出DNA的原理,利用本发明提供的裂解液,可以使鱼类组织中的DNA快速释放出来,并且DNA不被降解,迅速获得质量和纯度较高的含有DNA的溶液,为后续的分子生物学研究奠定基础。需要说明的是,本发明中所说的“鱼类”在生物分类学中定义为:鱼类是体被骨鳞、以鳃呼吸、用鳍作为运动器官和凭上下颌摄食的变温水生脊椎动物,属于脊索动物门中的脊椎动物亚门。还有,本发明中所说的鱼类组织可以为鱼类的肌肉、内脏、鱼鳍、鳞片和骨骼等组织。本发明实施例公开的裂解液适用于鱼类任何组织的裂解而释放DNA;优选地,鱼类的肌肉、内脏、鱼鳍、鳞片和骨骼;进一步优选地,肌肉、内脏、鱼鳍和鳞片;再进一步优选地,肌肉和内脏,其中内脏可以为肝脏;最优选地,肌肉。再有,本发明中所说的强碱是指碱溶于水能发生完全电离的,属于强碱。在本发明中,强碱优选为无机强碱,更优选为NaOH和/或KOH。乙二胺四乙酸钠盐可以为乙二胺四乙酸二钠。接下来以配制1L的含有EDTA的摩尔浓度为2mM,NaCl的摩尔浓度为1mM,SDS的质量分数为0.2%,NaOH的氢氧根离子的摩尔浓度为200mM的裂解液为例,说明本发明的裂解液的制备方法:分别精密称定0.548gEDTA、0.058gNaCl、2.017gSDS、7.999gNaOH分别溶解于双蒸水中,在将含有这四种溶质的溶液混合,用水定容至1L,即可。本领域技术人员可以理解的是,分子生物学研究中,配制试剂所用到的水通常为蒸馏水、双蒸水、去离子水和超纯水,其中以超纯水和去离子水为优。在没有特殊说明的情况下,本发明的实施例中所用到的水皆指蒸馏水,双蒸水去离子水。本发明实施例中的裂解液可以优选为:乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度优选为3~8mM;氯化钠的摩尔浓度为3~7mM;十二烷基硫酸钠的质量分数为0.5~5%;强碱的氢氧根离子的摩尔浓度为150~250mM。此浓度范围的裂解液不但能获得高浓度高质量的DNA,而且制备出的含有DNA的溶液中残留的试剂对后续PCR反应几乎没有影响。本发明实施例中的裂解液也可以更优选为:乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为5mM;氯化钠的摩尔浓度为5mM;十二烷基硫酸钠的质量分数为1%;强碱的氢氧根离子的摩尔浓度为200mM。此浓度的裂解液不但能获得更高浓度高质量的DNA,而且制备出的含有DNA的溶液中残留的试剂对后续PCR反应几乎没有影响。在本发明的第二方面,本发明实施例又公开了一种裂解方法,利用上述裂解液使鱼类组织裂解而释放出DNA,包括以下步骤:将鱼类组织与裂解液混合,在20~85℃的水浴中保持10~30min,之后离心处理,获得的上清液即为含有DNA的溶液。从上述裂解方法中可以看出,利用本发明第一方面公开的裂解液提取鱼类组织中的DNA,操作过程非常简单,而且时间短,可实现对鱼类组织DNA的快速提取。需要说明的是,在利用裂解液提取鱼类组织DNA之前,首先要对裂解液进行灭菌处理。而对试剂进行灭菌处理的方法为本领域常规技术手段,研究人员可以根据实验室的条件自行选择,因此,本发明在此不作赘述。此外,如果研究人员不是立刻对获得的上清液进行后续实验,可以将上清液分离出来,于-20℃保存备用。对于分离上清液的方法亦是本领域技术人员的惯用手段,本发明在此不作赘述。在裂解方法的实施例中,水浴条件优选为:在50~65℃的水浴中保持10~20min;更优选为:在55℃的水浴中保持10min。在裂解方法的实施例中,鱼类组织与裂解液的混合方式可以优选为:振荡。振荡方式可以为用小型振荡器来实现,也可以是人为振荡,以实现鱼类组织与裂解液快速充分接触,使鱼类组织及细胞快速破裂而释放DNA,从而实现快速提取DNA。此外,振荡时间可以为几十秒,如20秒、40秒,通常不用超过60秒。当然本领域技术人员可以根据实际经验自行把握,本发明在此不作具体限定。离心的条件也是本领域技术人员常用的手段,可以为10000g离心2~5min,也可以5000g以上离心5min以上,建议不用超过10min,本发明在此不作具体限定。此处所说的g是加速度产生的力约9.8N,10000g约为10000千克的离心力。在裂解方法的实施例中,优选地,鱼类组织与裂解液的比例为10~25mg:200~400μL;更优选地,鱼类组织与裂解液的比例为25mg:400μL。裂解液的加入量过少,上清液(含有DNA的溶液)中的杂质(主要为蛋白和脂肪)浓度就会相应增加,可能会导致后续研究中PCR反应受到抑制。裂解液过多,在造成试剂不必要的浪费的同时也会减少上清液(含有DNA的溶液)中的DNA含量,从而对后续研究产生不利影响。在本发明的第三方面,本发明实施例还公开了一种双组分型鱼类组织DNA提取液,包括作为第一组分的上述的裂解液和作为第二组分的中和液,中和液是包括:含有吐温-20的pH值为6.4~7.4的Tris-HCl缓冲液,其中中和液中的吐温-20(tween-20)的质量分数为0.02%~0.1%,中和液中的Tris的摩尔浓度为0.2~1mM。其中,对于裂解液的组成,请参考本发明第一方面记载的一种裂解液的相关内容,本发明在此不作赘述。根据本发明第一方面的叙述,本领域技术人员已经知道,上述的裂解液已经将鱼类组织中的DNA释放出来,并且根据本发明第二方面的叙述,本领域技术人员还可以知道,怎样制备含有DNA的溶液。在生物学研究过程中,制备DNA是一项基础工作,通常还需要对制备的DNA进行后续的研究工作,例如,对含有DNA溶液中的某一特定DNA进行体外扩增,即通常所说的聚合酶链式反应(PCR),裂解液中的各种物质很可能会影响PCR反应,主要是通过降低DNA聚合酶的活性来影响PCR反应。中和液中的Tris-HCl为DNA提供一个缓冲体系,在这个体系中DNA呈稳定状态,Tris-HCl与吐温-20相互作用可以起到保护DNA聚合酶的作用,为PCR反应提供有利的保障。在双组分型鱼类组织DNA提取液的实施例中,优选地,中和液是包括:含有吐温-20的pH值为6.8的Tris-HCl缓冲液,其中,中和液中的吐温-20的质量分数为0.05%;中和液中的Tris的摩尔浓度为0.5mM。在双组分型鱼类组织DNA提取液的实施例中,更优选地,中和液还包含牛血清白蛋白(BSA)、明胶和二硫苏糖醇(DTT)中的至少一种。牛血清白蛋白(BSA)、明胶和二硫苏糖醇(DTT)中的任意一种或组合,更有利于保护PCR体系中的DNA聚合酶活性,从而使PCR反应顺利进行。需要说明的是,明胶是没有固定的结构和相对分子量,由动物皮肤、骨、肌膜、肌魅等结缔组织中的胶原部分降解而成为白色或淡黄色、半透明、微带光泽的薄片或粉粒。本发明实施例中所用到的明胶不是食用或工业级别的明胶,而是适用于科学研究地杂质含量很低的高纯度明胶。在双组分型鱼类组织DNA提取液的实施例中,牛血清白蛋白(BSA)、明胶和二硫苏糖醇(DTT)进一步优选为:基于中和液的总体积,中和液还包含0.02~0.1mg/mL的牛血清蛋白、0.2~2mg/mL的明胶和0.02~1mg/mL的二硫苏糖醇中的至少一种。本领域技术人员可以理解的是,含有DNA的溶液中应尽量减少蛋白含量,而通过发明人的研究证实,向含有DNA的溶液中加入少量的BSA和/或明胶对PCR反应是有利的。在本发明的第四方面,本发明的实施例公开了一种利用上述双组分型鱼类组织DNA提取液提取鱼类组织DNA的方法,包括以下步骤:将鱼类组织与上述的裂解液混合,在20~85℃的水浴中保持10~30min,再与上述中和液混合,之后离心处理,获得的上清液即为含有DNA的溶液。其中,对于裂解液和中和液的组成,请参考本发明第三方面记载的一种双组分型鱼类组织DNA提取液中的相关内容,本发明在此不作赘述。对于鱼类组织与裂解液的比例,鱼类组织与裂解液的混合方式,鱼类组织与裂解液混合后的水浴条件,本领域技术人员可以参考本发明第二方面记载的一种裂解方法中的相关内容,本发明在此不作赘述。在提取鱼类组织DNA的方法的实施例中,优选地,裂解液和中和液的体积比为10:3~6。此参数不但能中和含有DNA的溶液的碱性,还能给予DNA聚合酶以有力的保护,使PCR反应顺利进行。在提取鱼类组织DNA的方法的实施例中,更为优选地,鱼类组织、第一组分和第二组分的比例为25mg:400μL:120μL。需要进一步说明的是,鱼类组织与裂解液的混合方式可以为振荡,中和液与水浴后的裂解液和鱼类组织的混合物的混合方式可以为振荡。对于振荡方式和振荡时间可以参考本发明第二方面记载的实施例中的相关内容,本发明在此不作赘述。对于离心条件可以参考本发明第二方面记载的实施例中的相关内容,本发明在此不作赘述。在本发明的第五方面,本发明的实施例公开了一种鱼类组织DNA提取试剂盒,包括上述的裂解液和上述的中和液。对于裂解液和中和液的组成,请参考本发明第三方面记载的一种双组分型鱼类组织DNA提取液中的相关内容,本发明在此不作赘述。在本发明的鱼类组织DNA提取试剂盒的实施例中,一种鱼类组织DNA提取试剂盒还包含鱼类组织DNA提取操作说明书。对于鱼类组织DNA提取操作说明书中记载的操作步骤,请参考本发明第四方面记载的一种利用上述双组分型鱼类组织DNA提取液提取鱼类组织DNA的方法,本发明在此不作赘述。举例来讲,鱼类组织DNA提取操作说明书可以为:将鱼类组织用去离子水洗净,取25mg鱼类组织,剪碎后,放入离心管中,加入400μL的裂解液,振荡20秒,之后在55℃的水浴中保持10min,再加入120μL中和液,振荡20秒,最后10000g离心2min,取上清液,即为含有DNA的溶液。在本发明的第六方面,本发明的实施例公开了上述鱼类组织DNA提取试剂盒在提取鱼类组织DNA中的应用。本发明第六方面记载的一种鱼类组织DNA提取试剂盒可以在基于鱼类DNA分子水平上的任何研究领域应用。例如,鱼类基因组的快速检测、鱼类品种的鉴定等。鱼类的研究人员可以根据研究地需要自行选择,本发明在此不一一列举。在本发明的第七方面,本发明的实施例公开了一种扩增鱼类组织DNA的PCR体系,该PCR体系包括由上述提取鱼类组织DNA的方法所得到的含有DNA的溶液,基于该PCR体系的总体积,含有DNA的溶液的体积分数为2%~15%。该PCR体系可以为:在扩增鱼类组织DNA的PCR体系的实施例中,优选地,含有DNA的溶液的体积分数为10%。需要说明的是,本发明所说的精密称定系指称取重量应准确至所称取重量的千分之一。mM表示为mmol/L。试剂、材料和仪器NaOH、Tris-HCL、EDTA、NaCL、SDS和Tween-20均为国产分析纯试剂;TaqDNA聚合酶产自于赛默飞世尔科技公司(ThermoFisherScientific);DNAMarker为上海生工生物技术有限公司产品。测试材料为小黄鱼(Larimichthyspolyactis)的肌肉、肝脏、身体中部脊椎骨、鳞片和鱼鳍。18SrRNA基因引物序列源自于参考文献:FajardoV,GonzalezI,MartinI,etal.Real-timePCRfordetectionandquantificationofreddeer(Cervuselaphus),fallowdeer(Damadama),androedeer(Capreoluscapreolus)inmeatmixtures.MeatSci,2008,79(2):289-298.COⅠ基因引物序列源自于参考文献:Ward,R.D.,T.S.Zemlak,B.H.Innes,P.R.Last,P.D.N.Hebert.DNAbarcodingAustralia'sfishspecies.PhilosophicalTransactionsoftheRoyalSocietyB:BiologicalSciences,2005,360:1847-1857.18SrRNA基因和引物序列和COⅠ基因引物序列都是由杭州擎科生物技术有限公司合成。紫外光分析仪Nanodrop2000,赛默飞世尔科技公司;PCR仪MJPTC200,美国基因仪器公司;凝胶成像系统,北京六一仪器厂。实施例A1~A4、实施例B1~B4和实施例C1~C4小黄鱼组织中的DNA的提取。其中所用到的小黄鱼组织分别为鳞片、骨骼、肌肉、肝脏。实施例A1~A4用灭菌的蒸馏水清洗小黄鱼组织,取25mg清洗后的小黄鱼组织,剪碎后放入1.5mL离心管中,加入400μL的裂解液,振荡20秒,在55℃的水浴中保持10min,再加入120μL中和液,振荡20秒,然后10000g离心2min,取上清液,即得含有DNA的溶液。实施例A1~A4和实施例B1~B4与实施例C1~C4的反应条件的区别仅在于裂解液和中和液中的各自试剂配比不同,见表1:表1裂解液和中和液中试剂的组成实施例A1~A4、实施例B1~B4和实施例C1~C4中的数字表示小黄鱼的不同组织,其中1、鳞片,2、骨骼,3、肌肉,4、肝脏。对实施例A1~A4、实施例B1~B4和实施例C1~C4制备的含有DNA的溶液进行DNA浓度测定,结果见表2:表2DNA浓度从表2中可以看出,对于同一组织,实施例B1~B4与实施例C1~C4中所用到的提取液制备的含有DNA的溶液中DNA浓度无明显差别,实施例A1~A4中所用到的提取液制备的含有DNA的溶液中DNA浓度明显低于前二者。以实施例A1~A4、实施例B1~B4和实施例C1~C4制备的含有DNA的溶液作为DNA模板溶液,扩增真核生物的18SrRNA基因,预期扩增产物为140bp,18SrRNA基因引物序列如下:上游引物:5'-TCTGCCCTATCAACTTTCGATGG-3'下游引物:5'-TAATTTGCGCGCCTGCTG-3'PCR体系总体积均为20μL,其含有试剂如下表3所示:表318SrRNA基因PCR体系中各试剂用量和终浓度PCR反应程序为:95℃变性5min;95℃变性30s,59℃退火30s,72℃延伸30s为一个循环,共计30个循环;然后72℃保持10min。反应结束后降温至4℃。PCR产物各6μL经2%琼脂糖凝胶电泳检测,核酸染料GelRed染色,凝胶成像系统分析,结果如图1所示(图1中的M表示DNAMarker)。由图1可知,产物大小与预期140bp一致,说明扩增得到了18SrRNA基因产物。电泳结果可以作为分子生物学分析的基本依据。从小黄鱼的不同组织提取的DNA进行PCR,电泳结果来看,骨骼、鳞片和鱼鳍的效果比肌肉和肝脏稍差。肌肉和肝脏组织中的DNA提取效果较好,二者无明显差异。也就是说,本发明提供的鱼类组织DNA提取液和提取方法能够实现对鱼类不同组织的DNA提取,对肌肉和肝脏的提取效果优于对骨骼、鳞片和鱼鳍的提取效果。结合表2和图1的结果来看,对于小黄鱼的同一组织,实施例B1~B4与实施例C1~C4中所用到的提取液制备的含有DNA的溶液中DNA浓度无明显差别,而在PCR反应条件相同的情况下,PCR产物的电泳结果却显示以实施例B1~B4制备的DNA溶液为DNA模板溶液进行PCR获得的PCR产物量明显少于实施例C1~C4,究其原因,可能是实施例B1~B4中所用到的提取液中各试剂含量高,抑制了PCR反应。实施例D~实施例S实施例D~实施例S与实施例C1~C4所用到的鱼类组织DNA提取液相同,区别在于小黄鱼组织种类,小黄鱼组织、裂解液与中和液的用量,以及水浴条件不同。实施例组织种类组织(mg)裂解液(μL)中和液(μL)水浴温度(℃)水浴时间(min)D肌肉254001205510E肌肉10200605020F肌肉252001007530H肝脏254001205510I肝脏10200605020G肝脏252001007530K骨骼254001205510L骨骼10200605020M骨骼252001007530N鱼鳍254001205510O鱼鳍10200605020P鱼鳍252001007530Q鳞片254001205510R鳞片10200605020S鳞片252001007530对实施例D~实施例S制备的含有DNA的溶液进行DNA浓度测定,发明人发现,处理肌肉和肝脏获得的含有DNA的溶液中的DNA浓度为50~200ng/μL,处理鱼鳍获得的含有DNA的溶液中的DNA的浓度为20~100ng/μL,处理鳞片获得的含有DNA的溶液中的DNA的浓度在8~40ng/μL。而且上述含有DNA的溶液中A260/A280的比值均在1.2~1.6之间,说明本发明的实施例获得的DNA纯度良好。对比例利用酚-氯仿提取法提取小黄鱼肌肉中的DNA。其中,酚-氯仿提取法参见《分子克隆实验指南》第三版,上册:463-485。将利用酚-氯仿提取法提取的小黄鱼肌肉中DNA与实施例C1~C4获得的DNA同时进行PCR实验,来验证本发明的鱼类组织DNA的提取方法。扩增小黄鱼DNA条形码的线粒体细胞色素C氧化酶Ⅰ(cytochromecoxidaseⅠ,COⅠ)基因,长度为658bp,其引物序列如下:COⅠ基因上游引物:5'-TCAACCAACCACAAAGACATTGGCAC-3'COⅠ基因下游引物:5'-TAGACTTCTGGGTGGCCAAAGAATCA-3'PCR体系总体积均为20μL,PCR体系含有试剂如下:2.0μL的Buffer缓冲液,上下游引物各2μL,1.6μL的dNTP混合物,1.6μL的MgCl2缓冲液,2.0μLDNA模板溶液,0.2μLTaqDNA聚合酶,最后加水补充至20μL。COⅠ基因PCR反应程序为:95℃变性5min;95℃变性30sec,55℃退火35sec,72℃延伸35sec为一个循环,共计30个循环;然后72℃保持10min。结束后降温至4℃。PCR产物各6μL经2%琼脂糖凝胶电泳检测,核酸染料GelRed染色,凝胶系统拍照,结果如图2所示(图2中的1、2、3和4分别表示以小黄鱼的肌肉、肝脏、鳞片和骨骼为样品获得的PCR产物,5表示利用酚-氯仿提取法处理小黄鱼的肌肉样品获得的PCR产物,M表示DNAMarker)。由图2可知,处理的肌肉、肝脏、鳞片和骨骼样品均得到预期大小658bp的特异性条带,肌肉、肝脏、鳞片中的DNA提取效果与利用酚-氯仿提取的DNA基本相同,骨骼的效果稍差。说明利用本发明的提取鱼类组织DNA的方法获得的DNA的质量和含量都不逊色于酚-氯仿提取法获得的DNA。不但如此,相对于酚-氯仿提取法,本发明的鱼类组织DNA提取方法操作简单,耗时短,提取液的毒性低。此外,利用本发明的鱼类组织DNA提取液和提取方法制备出的DNA模板溶液直接扩增长片段的基因也具有很好的效果。需要说明的是,加拿大科学家Hebert于2003年提出DNA条形码技术,在同年提出COⅠ基因作为条形码靶标。DNA条形码技术选用一段物种特异性序列作为物种识别的标志,COⅠ基因自提出作为靶标应用至今,在动植物及微生物鉴定和物种识别中发挥了重要作用,尤其在鱼类的鉴定中显示出无可比拟的优越性,是鱼类鉴定最具潜力的工具,而且国际上还有专门鱼类DNA条形码的数据库,为鱼类的快速鉴定提供了重要支撑。技术方案1一种裂解液,其用于裂解鱼类组织而释放出DNA,其特征在于,包括:乙二胺四乙酸和/或乙二胺四乙酸钠盐、氯化钠、十二烷基硫酸钠、强碱以及水,其中相对于裂解液而言,乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为2~10mM,氯化钠的摩尔浓度为1~10mM,十二烷基硫酸钠的质量分数为0.1~10%,并且强碱的氢氧根离子的摩尔浓度为100~300mM。技术方案2根据技术方案1所述的裂解液,其特征在于,所述乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为3~8mM;所述氯化钠的摩尔浓度为3~7mM;所述十二烷基硫酸钠的质量分数为0.5~5%;所述强碱的氢氧根离子的摩尔浓度为150~250mM。技术方案3根据技术方案1所述的裂解液,其特征在于,所述乙二胺四乙酸和/或乙二胺四乙酸钠盐的摩尔浓度为5mM;所述氯化钠的摩尔浓度为5mM;所述十二烷基硫酸钠的质量分数为1%;所述强碱的氢氧根离子的摩尔浓度为200mM。技术方案4根据技术方案1至3任一项所述的裂解液,其特征在于,所述强碱选自NaOH和/或KOH。技术方案5一种双组分型鱼类组织DNA提取液,其特征在于,包括作为第一组分的技术方案1~4任一项所述的裂解液和作为第二组分的中和液,所述中和液是包括:含有吐温-20的pH值为6.4~7.4的Tris-HCl缓冲液,其中所述中和液中的吐温-20的质量分数为0.02%~0.1%,所述中和液中的Tris的摩尔浓度为0.2~1mM。技术方案6根据技术方案5所述的DNA提取液,其特征在于,所述中和液是包括:含有吐温-20的pH值为6.8的Tris-HCl缓冲液,其中所述中和液中的吐温-20的质量分数为0.05%;所述中和液中的Tris的摩尔浓度为0.5mM。技术方案7根据技术方案5或6所述的DNA提取液,其特征在于,所述中和液还包含以下物质中的至少一种:牛血清白蛋白,明胶,和二硫苏糖醇。技术方案8根据技术方案7所述的DNA提取液,其特征在于,基于所述中和液的总体积,所述中和液还包含0.02~0.1mg/mL的牛血清蛋白、0.2~2mg/mL的明胶和0.02~1mg/mL的二硫苏糖醇中的至少一种。技术方案9一种裂解方法,其利用如技术方案1至4任一项所述的裂解液而使鱼类组织释放出DNA,其特征在于,包括以下步骤:将鱼类组织与裂解液混合,在20~85℃的水浴中保持10~30min,之后离心处理,获得的上清液即为包含DNA的溶液。技术方案10根据技术方案9所述的方法,其特征在于,在50~65℃的水浴中保持10~20min。技术方案11根据技术方案10所述的方法,其特征在于,在55℃的水浴中保持10min。技术方案12根据技术方案9所述的方法,其特征在于,所述混合的方式为振荡。技术方案13根据技术方案9所述的方法,其特征在于,所述鱼类组织与所述裂解液的比例为10~25mg:200~400μL。技术方案14根据技术方案13所述的方法,其特征在于,所述鱼类组织与所述裂解液的比例为25mg:400μL。技术方案15一种提取鱼类组织DNA的方法,其特征在于,包括以下步骤:将鱼类组织与技术方案5至8任一项所述的裂解液混合,在20~85℃的水浴中保持10~30min,再与技术方案5至8任一项所述的中和液混合,之后离心处理,获得的上清液即为含有DNA的溶液。技术方案16根据技术方案15所述的方法,其特征在于,在50~65℃的水浴中保持10~20min。技术方案17根据技术方案16所述的方法,其特征在于,在55℃的水浴中保持10min。技术方案18根据技术方案15至17任一项所述的方法,其特征在于,所述裂解液和所述中和液的体积比为10:3~6。技术方案19根据技术方案18所述的方法,所述鱼类组织与所述裂解液的比例为10~25mg:200~400μl。技术方案20根据技术方案19所述的方法,其特征在于,所述鱼类组织、所述第一组分和所述第二组分的比例为25mg:400μL:120μL。技术方案21根据技术方案15所述的方法,其特征在于,所述混合的方式为振荡。技术方案22根据技术方案15所述的方法,其特征在于,所述鱼类组织选自:肌肉、内脏、鱼鳍、鳞片或骨骼。技术方案23一种鱼类组织DNA提取试剂盒,其特征在于,包括技术方案1至4任一项所述的裂解液和技术方案5至8任一项所述的中和液。技术方案24根据技术方案23所述的鱼类组织DNA提取试剂盒,其特征在于,还包含鱼类组织DNA提取操作说明书。技术方案25技术方案23或24所述的试剂盒在提取鱼类组织DNA中的应用。技术方案26一种扩增鱼类组织DNA的PCR体系,其特征在于,该PCR体系包括由技术方案15至22任一项所述方法所得到的含有DNA的溶液,基于该PCR体系的总体积,所述含有DNA的溶液的体积分数为2%~15%。技术方案27根据技术方案26所述的PCR体系,其特征在于,基于该PCR体系的总体积,所述含有DNA的溶液的体积分数为10%。以上所述仅是为了便于本领域的技术人员理解本发明的技术方案,并不用以限制本发明。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1