一种茶提取液及其制备方法与流程
本发明涉及一种提取液及其制备方法,具体涉及一种茶提取液及其制备方法。
背景技术:
如今,茶已经成为世上广受欢迎的软饮料之一。随着人们生活水平的提高和生活节奏的加快,茶饮料以天然、健康和方便等特点而广受消费者的欢迎,发展非常迅速。茶饮料主要是以茶叶通过浓缩、浸泡、干燥工艺制成的速溶茶粉为原材料,再经加工、调配等工艺制成的饮料。随着茶饮料的市场不断扩大,速溶茶也迅速发展起来。
茶叶提取方式主要有浸出式、浇渗式、逆流式、煎煮法、浸渍法、渗溉法、回流法和水蒸气蒸馆法。此外,有许多研究表明茶叶提取的方式还有微波辅助提取、超声波辅助提取、超临界流体提取等。在以上这些茶叶提取方法出现前,一般使用热水直接进行浸提的传统方法来的制备茶叶提取液。但是这个方法浸提时间太长,导致了很多营养成分在高温处理下流失了,同时,许多风味物质在高温下十分容易挥发。这些缺点都极大地影响了茶汤的风味和品质。茶叶中的多酚、氨基酸、咖啡碱等有效成分在干茶中由于被纤维素、半纤维素和果胶为主体的细胞壁所包裹,难以释放。且茶叶中蛋白质则由于水溶性较差,主要存在于茶渣中,不能够被有效利用。如今现代生物技术逐步发展起来,外源生物酶开始应用到工艺生产中来,因此,现在外源生物酶在茶叶提取加工技术中逐步得到良好应用。现茶叶加工中应用较多的外源酶主要有单宁酶、多酚氧化酶、纤维素酶、果胶酶、蛋白酶等。酶法提取的原理是纤维素酶、果胶酶、半纤维素等外源酶用于破坏细胞的结构、破坏茶叶细胞壁,从而使茶叶中的有效成分的尽量大的得到扩散和浸出。多酚氧化酶能促进儿茶素类的氧化,主要是使速溶茶绿转红,使绿茶能转成具有红茶的特点,或者是应用在红茶方面。使用蛋白酶能够水解茶叶中的蛋白质,从而提高茶汤中的氨基酸含量。茶汤中游离氨基酸含量的增加,可增添茶汤的香气,同时也能增强茶汤鲜爽的口感。单宁酶水解茶叶中的酯型儿茶素,从而获得冷溶性好且苦涩味弱的茶产品。此外,酶技术在茶饮料中的应用可以实现茶汁的低温浸提,促进茶汁的澄清,从而改善茶汤感官品质。
姜绍通等[24]利用酶制剂研究了提取速溶绿茶的条件。其结果表明,当纤维素酶添加量为每克茶叶400U时,茶多酚含量增加12%,氨基酸的含量变化并不显著。同时复配使用蛋白酶后,茶汤氨基酸含量增多且茶汤滋味好。Jae HunKim等也进行过类似的研究。他们在经热水提取后的绿茶渣中加入纤维素酶后,发现其总茶多酚、总儿茶素、蛋白质含量、咖啡碱含量都有不同程度提高,对还原糖的测定也表明了纤维素酶的水解活性。
到目前为止,国外有过一些研究。例如,Chandini S K等的研究。其研究表明在提高可溶性固形物含量和茶汤品质方面,若单独使用单宁酶比果胶酶和单宁酶的复配使用会更加有优势。而且单宁酶水解酯型儿茶素的特点不仅有效地减少了茶乳酪的形成,还使茶汤的苦涩味减淡,口感较好。这是因为单宁酶有效地降低了非酯型儿茶素苦味阈值。此外,Min JerLu等做了此方面的研究。研究表明单宁酶处理后的绿茶茶汤抑制亚硝酸盐的效果比未处理组好。
目前虽然单宁酶、纤维素酶和蛋白酶在茶饮料中都有过研究应用的报道。但是,关于单宁酶的应用研究多集中于红茶饮料的除“冷后浑”及提高速溶茶的冷容性,在乌龙茶茶饮料中应用比较少。而且如今,对乌龙茶茶饮料的除“冷后浑”和除苦涩味的可行性尚未见报道。
技术实现要素:
本发明的目的在于克服现有技术的不足之处而提供一种具有高含量茶多酚、游离氨基酸和固形物的茶提取液及其制备方法。
为实现上述目的,本发明采取的技术方案为:一种茶提取液的制备方法,其包括以下步骤:
(1)水浴浸提:向茶叶中加入水,于70~95℃的温度下水浴浸提10~30分钟,得到水浸提物;
(2)酶解:冷却步骤(1)所得的水浸提物,再向水浸提物中加入酶,于30~50℃酶解1~6小时;其中所述酶由蛋白酶、纤维素酶和单宁酶组成,所述蛋白酶与茶叶的质量百分比大于0且小于或等于1.3%,纤维素酶与茶叶的质量百分比大于0且小于或等于1.7%,单宁酶与茶叶的质量百分比大于0且小于或等于1.7%;
(3)灭酶:将步骤(2)酶解所得产物进行灭酶处理,再过滤,得到茶提取液。
本发明采用的酶中,蛋白酶催化反应条件温和、作用高度专一、催化效率高、活性可调控和无毒;纤维素酶主要作用于茶叶细胞壁中的纤维素,对细胞壁起破坏作用,利于茶叶内含物的释放,在茶叶提取过程中,纤维素酶能提高可溶性糖和水浸出物的含量,促进茶多酚、氨基酸和咖啡碱的溶出,利于芳香性物质的释放,具有增效的效果;单宁酶可以水解苦涩味的酯型儿茶素,释放出没食子酸,解离后的没食子酸与咖啡碱作用,形成分子量较小的水溶物,此反应能有效地降低沉淀的形成,使茶汤保持澄清状态。
本发明制备茶提取液时,采用了由蛋白酶、纤维素酶和单宁酶组成的复合酶进行酶解,在各种的酶共同作用和相互影响下,本发明得到的茶提取液的品质有了很大改善,茶提取液中茶多酚、游离氨基酸和固形物的含量明显提高。
作为本发明所述茶提取液的制备方法的优选实施方式,所述蛋白酶与茶叶的质量百分比为1.1~1.3%,纤维素酶与茶叶的质量百分为1.5~1.7%,单宁酶与茶叶的质量百分比为1.5~1.7%。研究表明,采用所述用量的各种酶时,得到的茶提取液中茶多酚、游离氨基酸和固形物的含量更高。
作为本发明所述茶提取液的制备方法的更优选实施方式,所述蛋白酶与茶叶的质量百分比为1.1%,纤维素酶与茶叶的质量百分为1.5%,单宁酶与茶叶的质量百分比为1.5%。采用由所述特定含量的各种酶组成的复合酶时,不仅酶用量较少,且得到的茶提取液中茶多酚、游离氨基酸和固形物的含量最高。
作为本发明所述茶提取液的制备方法的优选实施方式,所述蛋白酶为ProteAX蛋白酶。
作为本发明所述茶提取液的制备方法的优选实施方式,所述步骤(2)中,酶解温度为40~50℃;更优选地,所述步骤(2)中,酶解温度为40℃。酶解的温度影响酶的活性,当温度高于50℃时,单宁酶的活性明显下降甚至丧失;综合考虑各种酶的活性以及不同温度下的酶解产物,发现40℃为最佳的酶解温度。
作为本发明所述茶提取液的制备方法的优选实施方式,所述步骤(2)中,先向水浸提物中加入单宁酶,酶解1小时,再加入蛋白酶和纤维素酶,继续酶解2小时。蛋白酶与纤维素酶的酶解时间为2小时且单宁酶的酶解时间为3小时时,茶提取液中茶多酚、游离氨基酸和固形物的含量最较高。
作为本发明所述茶提取液的制备方法的优选实施方式,所述步骤(1)之前还包括步骤(1a):将茶叶粉碎。将茶叶粉碎,有利于浸提过程中,茶叶中物质充分浸泡到水中。
作为本发明所述茶提取液的制备方法的优选实施方式,如下(a)~(d)中的至少一项:(a)所述茶叶为乌龙茶;(b)所述步骤(1)中,茶叶与水的质量比为1:10;(c)所述步骤(1)中,于80℃的温度下水浴浸提15分钟,得到水浸提物;(d)所述步骤(3)中,于100℃水浴中灭酶5分钟。
作为本发明所述茶提取液的制备方法的更优选实施方式,所述茶叶为凤凰单丛茶。凤凰单丛茶属于乌龙茶类,其茶香浓厚且口感醇厚。
本发明还提供了一种采用上述方法制得的茶提取液。本发明得到的茶提取液的品质有了很大改善,茶提取液中茶多酚、游离氨基酸和固形物的含量明显提高。
与现有技术相比,本发明的有益效果为:本发明制备茶提取液时,采用了由蛋白酶、纤维素酶和单宁酶组成的复合酶进行酶解,在各种的酶共同作用和相互影响下,本发明得到的茶提取液的品质有了很大改善,茶提取液中茶多酚、游离氨基酸和固形物的含量明显提高。并且,本发明选择了适宜的酶解温度和酶解时间,这些适宜的条件也有利于改善茶提取液的品质。
本发明制备茶提取液的方法可用于各种茶叶,尤其是选择乌龙茶中的凤凰单丛茶时,茶的品质更佳。
附图说明
图1为茶多酚浓度标准曲线图;
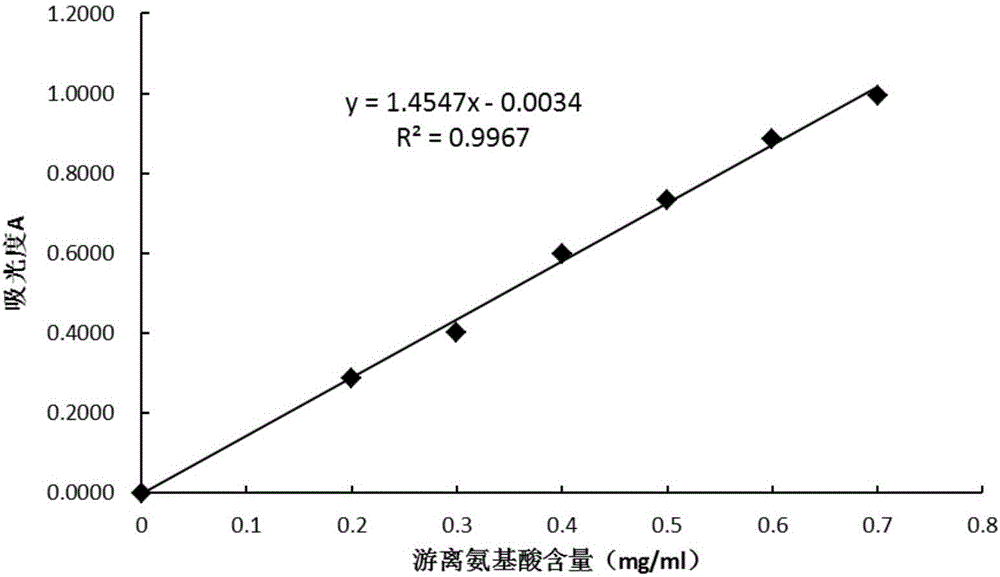
图2为游离氨基酸浓度标准曲线图;
图3为ProteAX蛋白酶加酶量对茶提取液中茶多酚、游离氨基酸、可溶性固形物含量的影响结果图;
图4为纤维素酶加酶量对茶提取液中茶多酚、游离氨基酸、可溶性固形物含量的影响结果图;
图5为单宁酶加酶量对茶提取液中茶多酚、游离氨基酸、可溶性固形物含量的影响结果图;
图6为不同酶酶解时间对茶提取液中茶多酚含量的影响结果图;
图7为不同酶酶解时间对茶提取液中游离氨基酸含量的影响结果图;
图8为不同酶酶解时间对茶提取液中可溶性固形物含量的影响结果图;
图9为不同酶酶解温度对茶提取液中茶多酚含量的影响结果图;
图10为不同酶酶解温度对茶提取液中游离氨基酸含量的影响结果图;
图11为不同酶酶解温度对茶提取液中可溶性固形物的影响结果图;
图12为不同酶处理对茶提取液中茶多酚含量的影响结果图;
图13为不同酶处理对茶提取液中游离氨基酸含量的影响结果图;
图14为不同酶处理对茶提取液中可溶性固形物含量的影响结果图;
图15为不同茶提取液样品的雷达图;
图16为不同茶提取液样品的判别函数分析图。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例和附图对本发明作进一步说明。
下述实施例中,ProtectAX蛋白酶、纤维素酶、单宁酶,均购自阿玛诺天野酶制剂商贸(上海)有限公司;磷酸二氢钠、磷酸氢二钠、水合茚三酮、酒石酸钾钠、硫酸亚铁、茶氨酸、茶多酚,均为市售分析纯;所用到的仪器为:精密电子天平(型号为JJ500,苏制),数显恒温水浴锅(型号为HH,厂家为金坛市金成国胜试验仪器厂),紫外分光光度计(型号为UV759,厂家为上海精科),电子鼻(型号为iNose,厂家为上海瑞玢国际贸易有限公司),阿贝折光仪(型号为WYT-2W,厂家为上海精科),电热恒温鼓风干燥箱(型号为SFG-02.300,厂家为黄石市恒丰医疗器械有限公司)。
实施例中,茶多酚、游离氨基酸和可溶性固形物的测定方法分别如下:
茶多酚的测定:参考GB/T 8313-2008茶中茶多酚检测方法:酒石酸亚铁比色法,具体方法为:(1)标准曲线的绘制:分别吸取浓度为0.4mg/mL、0.6mg/mL、0.8mg/mL、1.0mg/mL、1.2mg/mL、1.4mg/mL、1.6mg/mL、1.8mg/mL、2.0mg/mL的茶多酚标准溶液1.0mL于25mL具塞比色管中,加入水4mL和酒石酸亚铁溶液5mL,补加pH值为7.5的磷酸盐缓冲溶液至刻度线,混匀,用10mm比色皿,在波长540nm处,以试剂空白溶液作为参比,测定吸光度(A),绘制标准曲线;(2)样品的测定:准确吸取1mL样品茶汤于25mL具塞比色管中,加入水4mL和酒石酸亚铁溶液5mL,补加pH值为7.5的磷酸盐缓冲溶液至刻度线,混匀,用10mm比色皿,在波长540nm处,以试剂空白溶液作为参比,测定吸光度(A),从茶多酚浓度标准曲线中求得溶液中茶多酚的含量。其中,茶多酚浓度标准曲线如图1所示,该标准曲线的决定系数(R2)大于0.99,这说明其所得回归方程具有很高的拟合精度,即模型的模拟值和实测值具有高度的一致性。
游离氨基酸的测定:参考GB/T 8314-2013游离氨基酸的测定方法:茚三酮比色法,具体方法为:(1)茶氨酸标准工作液的制备:称取250mg茶氨酸(纯度不低于99%)溶于适量水中,转移定容至25mL,摇匀。该标准储备液、液1mL含有10mg的茶氨酸。移取0.0mL、1.5mL、2.0mL、2.5mL、3.0mL、3.5mL标准储备液,分别加水定容至50mL,摇匀,该系列标准工作液1mL分别含有0mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg茶氨酸;(2)标准曲线的绘制:分别吸取1mL茶氨酸系列标准液于一组25mL具塞比色管中,分别加入pH值为8.0的磷酸盐缓冲液0.5mL和2%茚三酮溶液0.5mL,在沸水浴中加热15min。冷却后加水定容至刻度线,放置10min后,混匀,用10nm比色皿,在波长570nm处,以试剂空白溶液作参比,测定吸光度(A),绘制标准曲线,如图2所示;(3)样品的测定:准确吸取0.5mL样品茶汤于25mL具塞比色管中,加入pH值为8.0的磷酸盐缓冲液0.5mL和2%茚三酮溶液0.5mL,在沸水浴中加热15min。冷却后加水定容至刻度线,放置10min后,混匀,用10nm比色皿,在波长570nm处,以试剂空白溶液作参比,测定吸光度(A)。从游离氨基酸标准曲线中求得溶液中游离氨基酸的含量。其中,游离氨基酸浓度标准曲线如图2所示,该标准曲线的决定系数(R2)大于0.99,这说明其所得回归方程具有很高的拟合精度。即模型的模拟值和实测值具有高度的一致性。
可溶性固形物的测定:滴数滴样品茶汤于阿贝折光仪的下棱镜上,迅速将上下两块棱镜闭合,调整反射镜,使光纤射入棱镜中,达到视野最亮。从目镜观察,旋动棱镜旋钮,使视野出现明暗两部分,再旋动色散补偿器,使视野中除了黑白两色外,无其他颜色。最后再旋动棱镜旋钮,使明暗分界线在十字交叉点。通过放大镜在读数镜筒里的刻度尺上进行读数,读取并记录百分浓度。测定完成后,用脱脂棉蘸水、乙醇擦净棱镜表面和镜身各个部分。
下述实施例中,所述酶的用量均以酶于茶叶的质量百分比来表示,实施例中CK表示空白对照组。
实施例1
本发明茶提取液及其制备方法的一种实施例,本实施例所述的茶提取液,其制备方法包括以下步骤:
(1)称取凤凰单丛茶,将其粉碎,得到粉碎的茶叶;
(2)水浴浸提:向步骤(1)所得粉碎的茶叶中加入水,茶叶与水的质量比为1:10,于80℃的温度下水浴浸提15分钟,得到水浸提物;
(3)酶解:冷却步骤(2)所得的水浸提物,再向水浸提物中加入单宁酶,酶解1小时,再加入ProteAX蛋白酶和纤维素酶,继续酶解2小时,酶解温度为40℃;其中,ProteAX蛋白酶与茶叶的质量百分比为1.1%,纤维素酶与茶叶的质量百分为1.5%,单宁酶与茶叶的质量百分比为1.5%;
(4)灭酶:将步骤(3)酶解所得产物于100℃水浴中灭酶5分钟,再过滤,得到茶提取液。
实施例2
本发明茶提取液及其制备方法的一种实施例,本实施例所述的茶提取液,其制备方法包括以下步骤:
(1)称取凤凰单丛茶,将其粉碎,得到粉碎的茶叶;
(2)水浴浸提:向步骤(1)所得粉碎的茶叶中加入水,茶叶与水的质量比为1:10,于95℃的温度下水浴浸提10分钟,得到水浸提物;
(3)酶解:冷却步骤(2)所得的水浸提物,再向水浸提物中加入单宁酶、ProteAX蛋白酶和纤维素酶,酶解1小时,酶解温度为50℃;其中,ProteAX蛋白酶与茶叶的质量百分比为1.3%,纤维素酶与茶叶的质量百分为1.7%,单宁酶与茶叶的质量百分比为1.7%;
(4)灭酶:将步骤(3)酶解所得产物于100℃水浴中灭酶5分钟,再过滤,得到茶提取液。
实施例3
本发明茶提取液及其制备方法的一种实施例,本实施例所述的茶提取液,其制备方法包括以下步骤:
(1)称取凤凰单丛茶,将其粉碎,得到粉碎的茶叶;
(2)水浴浸提:向步骤(1)所得粉碎的茶叶中加入水,茶叶与水的质量比为1:10,于70℃的温度下水浴浸提30分钟,得到水浸提物;
(3)酶解:冷却步骤(2)所得的水浸提物,再向水浸提物中加入单宁酶,酶解4小时,再加入ProteAX蛋白酶和纤维素酶,继续酶解2小时,酶解温度为30℃;其中,ProteAX蛋白酶与茶叶的质量百分比为1.2%,纤维素酶与茶叶的质量百分为1.6%,单宁酶与茶叶的质量百分比为1.6%;
(4)灭酶:将步骤(3)酶解所得产物于100℃水浴中灭酶5分钟,再过滤,得到茶提取液。
实施例4
本实施例考察了ProteAX蛋白酶、纤维素酶和单宁酶加酶量对酶解效果的影响,具体的考察方法如下:
ProteAX蛋白酶加酶量的考察方法:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,分别加入ProteAX蛋白加酶量按照样品茶叶质量的0.0%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%计算,放于设置为40℃的恒温水浴锅中进行酶解1h后,把样品置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。
纤维素酶加酶量的考察方法:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,分别加入纤维素加酶量按照样品茶叶质量的0.0%、1.0%、1.3%、1.4%、1.5%、1.6%、1.7%计算,放于设置为40℃的恒温水浴锅中进行酶解1h后,把样品置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。
单宁酶加酶量的考察方法:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,分别加入单宁酶加酶量按照样品茶叶质量的0.0%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%计算,放于设置为40℃的恒温水浴锅中进行酶解1h后,把样品置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。
ProteAX蛋白酶加酶量对茶提取液中茶多酚、游离氨基酸、可溶性固形物含量的影响如图3所示,纤维素酶加酶量对茶提取液中茶多酚、游离氨基酸、可溶性固形物含量的影响如图4所示,单宁酶加酶量对茶提取液中茶多酚、游离氨基酸、可溶性固形物含量的影响如图5所示。
在茶叶中添加蛋白酶可促进茶叶中蛋白质的水解,从而提高茶提取液中氨基酸的含量,可增添茶提取液的香味。由图3可知,加入ProteAX蛋白酶处理所得的茶提取液中的茶多酚含量、游离氨基酸含量、可溶性固形物含量明显比空白对照组(即并没有进行加酶处理的样品)的含量要高(p<0.05)。在加酶量为0.8%后,随着加酶量的增加,茶提取液中的茶多酚含量变化平缓,通过数据分析,此段茶多酚含量变化并没有较大差异(p>0.05)。可能因为加入的酶为蛋白酶,对茶叶中茶多酚的释放作用不太强烈。而蛋白酶的主要作用是分解茶中的蛋白质产生氨基酸。随着蛋白酶加酶量的增加,茶提取液中的游离氨基酸呈上升趋势,通过数据分析,当加酶量为1.1%时,与加酶量小于1.1%所处理的样品存在显著性差异(p<0.05),而与加酶量大于1.1%所处理的样品差异开始减小,游离氨基酸含量基本保持平稳。可能由于底物的量一定,加酶量在1.1%已能够把底物反应完,以致增大加酶量对游离氨基酸释放的作用不大。由图3可以看出,加入ProteAX蛋白酶处理的茶提取液中的可溶性固形物含量比空白对照组高,但变化基本趋于平稳。得知加酶量的增加对可溶性固形物含量的变化影响并不大。根据以上结果以及考虑成本问题得,选择ProteAX蛋白酶的加酶量1.1%为宜。
纤维素酶主要是对茶叶细胞壁中的纤维素起作用,破坏细胞壁,有利于释放茶叶中的内含物,以促进茶多酚、游离氨基酸等的溶出。由图4可知,加入纤维素酶处理所得的茶提取液中的茶多酚含量、游离氨基酸含量及可溶性固形物含量比空白对照组(即并没有进行加酶处理的样品)的含量要高。在纤维素加酶量为1.5%前,随着加酶量的增大,茶提取液中的茶多酚含量显著上升;而在加酶量为1.5%时,茶多酚的含量达到最高值,;随着加酶量的继续增加,茶多酚含量不再增加。这可能由于纤维素酶在加酶量为1.5%时,能较充分地酶解细胞壁,释放出茶多酚。在游离氨基酸含量变化曲线中,加酶处理的样品与空白对照组都有显著性差异(p<0.05)。证实加入纤维素酶对茶叶中游离氨基酸的释放是有一定作用,但游离氨基酸含量变化基本保持平稳,不同的加酶量处理所得的样品结果差异不大。而纤维素酶也是蛋白质的一种,当加酶量过多时,蛋白质易与茶多酚、咖啡碱、氨基酸相结合成茶乳酪[29],这可能是加酶量大于1.5%后茶多酚含量及游离氨基酸含量略有下降的原因。在可溶性固形物含量变化曲线中,加入纤维素酶处理的茶提取液中的可溶性固形物含量比空白对照组高,但变化基本平稳。得知酶用量的增加对可溶性固形物含量的变化影响并不大。根据以上结果以及考虑成本问题得,选择纤维素酶的加酶量1.5%为宜。
单宁酶在茶饮料中应用广泛,主要作用是能水解酯型儿茶素从而释放出没食子酸,水解出的没食子酸能与咖啡碱作用使之降低沉淀的形成。由图5可知,加入单宁酶处理所得的茶提取液中的茶多酚含量、游离氨基酸含量以及可溶性固形物含量都比空白对照组(即并没有进行加酶处理的样品)的含量要高。在茶多酚含量变化曲线中可知,在单宁酶加酶量为1.5%前,随着纤维素酶用量的增大,茶提取液中的茶多酚含量显著上升;而在加酶量为1.5%时,茶多酚的含量达到最高值,;随着酶用量的继续增加,茶多酚含量不再增加且趋于平缓。在游离氨基酸含量变化曲线中,加酶处理的样品与空白对照组都有显著性差异(p<0.05)。证实加入单宁酶对茶叶中游离氨基酸的释放是有一定作用,但在加酶量大于1.3%后,游离氨基酸含量变化基本保持平稳,不同的加酶量处理所得的样品结果差异不大,可能单宁酶加入量为1.3%时已足以把底物反应完。在可溶性固形物含量变化曲线中看出,加入单宁酶处理的茶提取液中的可溶性固形物含量比空白对照组高,随着加酶量的增加,可溶性固形物含量随之缓慢增大,而在酶用量为1.5%之后,可溶性固形物含量变化趋于稳定,得出单宁酶对茶叶中可溶性糖含量的溶出作用明显。根据以上结果以及考虑成本问题得,选择单宁酶的加酶量1.5%为宜。
实施例5
本实施例考察了酶解时间对酶解效果的影响,考察的具体方法如下:
酶解时间对ProteAX蛋白酶酶解效果的影响:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,分别加入1.1%的ProteAX蛋白酶,放于设置为40℃的恒温水浴锅中进行酶解,酶解时间分别为1h、2h、2.5h、3h、4h、5h、6h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。准备7个锥形瓶除了不加入酶外,其他处理相同,进行空白对照组,待测。
酶解时间对纤维素酶酶解效果的影响:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,分别加入1.5%的纤维素酶,放于设置为40℃的恒温水浴锅中进行酶解,酶解时间分别为1h、2h、2.5h、3h、4h、5h、6h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。准备7个锥形瓶除了不加入酶外,其他处理相同,进行空白对照组,待测。
酶解时间对单宁酶酶解效果的影响:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,分别加入1.5%的单宁酶,放于设置为40℃的恒温水浴锅中进行酶解,酶解时间分别为1h、2h、2.5h、3h、4h、5h、6h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。准备7个锥形瓶除了不加入酶外,其他处理相同,进行空白对照组,待测。
不同酶酶解时间对茶提取液中茶多酚含量的影响如图6所示,不同酶酶解时间对茶提取液中游离氨基酸含量的影响如图7所示,不同酶酶解时间对茶提取液中可溶性固形物含量的影响如图8所示。
由图6可知,在不同的酶解时间里,经过酶处理的茶提取液中茶多酚含量均比空白对照组(即并没有进行酶处理的样品)中茶多酚含量高。且从图中可看出,经过单宁酶酶解的茶提取液中茶多酚含量最高,这说明,相对其他两种酶,使用单宁酶对茶叶中茶多酚含量的释放作用更为明显,可能由于单宁酶水解茶叶中的酯型儿茶素生成的没食子酸与咖啡碱作用,阻止了咖啡碱与茶多酚等物质结合,使茶多酚能有效释放。由经ProteAX蛋白酶酶解和经纤维素酶酶解样品的两条茶多酚含量变化曲线可知,在酶解时间为2h时,两种酶酶解的样品当中的茶多酚含量均达到峰值,随后开始平缓下降。根据数据分析,经ProteAX蛋白酶与经纤维素酶处理2h的样品茶多酚含量相对于酶解时间小于2h的样品和空白对照组均在显著性差异(p<0.05)。而在酶解时间大于2h时,经过两种不同酶处理的样品中,茶多酚的含量均缓慢下降,这可能由于在2h后,酶解时间过长,茶提取液中的蛋白质与茶多酚、咖啡碱、氨基酸形成复合物,使之其中的茶多酚含量略有下降。由经单宁酶酶解样品的茶多酚含量变化曲线可知,酶解条件为3h时,样品中茶多酚的含量达到最大值,随后开始变化趋势平缓,且与空白对照组(即并没有进行酶处理的样品)含量相比有明显差异。而酶解时间为5h时,样品中茶多酚含量突然下降,这可能由于实验操作造成的误差形成。根据数据分析,经单宁酶处理3h的样品茶多酚含量相对于酶解时间小于3h的样品和空白对照组均在显著性差异(p<0.05),且与处理条件为4h的样品差异较小。
由图7可知,经过酶处理的茶提取液中游离氨基酸含量均比空白对照组(即并没有进行酶处理的样品)中的游离氨基酸含量高。且从图中可看出,经过ProteAX蛋白酶酶解的茶提取液中游离氨基酸含量最高,这说明,相对其他两种酶,ProteAX蛋白酶对茶叶中游离氨基酸含量的释放作用更为明显,可能是由于酶催化的专一性,蛋白酶的催化作用促使茶叶中的蛋白质水解成氨基酸,比纤维素酶和单宁酶的作用更大。由经ProteAX蛋白酶酶解样品的游离氨基酸含量变化曲线可知,经ProteAX蛋白酶酶解条件为2h时游离氨基酸含量达到最高值,随后变化略有下降;而在酶解条件为3h时,游离氨基酸含量突然下降,这可能是由于实验操作造成的误差;而空白对照组中的游离氨基酸含量先缓慢上升,在2h后趋于平缓,变化不明显。根据数据分析,经蛋白酶处理2h的样品茶多酚含量、游离氨基酸含量相对于处理条件小于2h的样品和空白对照组均在显著性差异(p<0.05)。由经纤维素酶酶解的样品游离氨基酸含量变化曲线可知,经纤维素酶酶解的样品中,游离氨基酸含量比空白对照组的含量高,证实纤维素酶对茶叶中的游离氨基酸的释放还是有一定作用的。而根据数据分析,经纤维素酶处理2h的样品茶多酚含量、游离氨基酸含量相对于其他条件处理的样品和空白对照组均在显著性差异(p<0.05)。而经单宁酶酶解的样品中游离氨基酸含量变化趋势不明显,可能是由于单宁酶催化的专一性,未能较好地把茶中的蛋白质水解成氨基酸,但与空白对照组相比,游离氨基酸含量增大,证实单宁酶对茶叶中游离氨基酸的释放还是有一定作用的。
由图8可知,空白对照组(即并没有进行酶处理的样品)中可溶性固形物含量变化不明显,基本趋于平缓状态,而经过三种不同的酶酶解后的样品中可溶性固形物含量均比空白对照组高,可见三种酶对茶叶中可溶性固形物含量的释放均有作用。从图中看出,经过单宁酶酶解的样品可溶性固形物含量最高,可见单宁酶对茶叶中可溶性物质含量的影响最大,这可能与单宁酶水解酯型儿茶素后释放的没食子酸与咖啡碱作用,生成分子量较小的水溶物有一定关系。但在酶解2h后样品的可溶性固形物含量变化差异不大;在酶解5h时样品可溶性固形物含量突然下降,可能是由于实验操作误差引起的。从数值上看,经ProteAX蛋白酶与经纤维素酶酶解的样品中可溶性固形物含量均在酶解2h时达到最大值,而酶解时间大于2h后,可溶性固形物含量变化幅度不大。根据以上结果以及考虑成本问题得,选择ProteAX蛋白酶与纤维素酶的酶解时间2h、单宁酶的酶解时间3h宜。
实施例6
本实施例考察了酶解温度对酶解效果的影响,考察的具体方法如下:
酶解温度对ProteAX蛋白酶酶解效果的影响:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至所要进行酶解的温度,分别加入1.1%的ProteAX蛋白酶,放于设置恒温水浴锅中进行酶解,酶解温度分别为30℃、35℃、40℃、45℃、50℃、60℃、70℃,酶解2h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。准备7个锥形瓶除了不加入酶外,其他处理相同,进行空白对照组,待测。
酶解温度对纤维素酶酶解效果的影响:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至所要进行酶解的温度,分别加入1.5%的纤维素酶,放于设置恒温水浴锅中进行酶解,酶解温度分别为30℃、35℃、40℃、45℃、50℃、60℃、70℃,酶解2h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。准备7个锥形瓶除了不加入酶外,其他处理相同,进行空白对照组,待测。
酶解温度对单宁酶酶解效果的影响:在7个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至所要进行酶解的温度,分别加入1.5%的单宁酶,放于设置恒温水浴锅中进行酶解,酶解温度分别为30℃、35℃、40℃、45℃、50℃、60℃、70℃,酶解3h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,待测。准备7个锥形瓶除了不加入酶外,其他处理相同,进行空白对照组,待测。
不同酶酶解温度对茶提取液中茶多酚含量的影响如图9所示,不同酶酶解温度对茶提取液中游离氨基酸含量的影响如图10所示,不同酶酶解温度对茶提取液中可溶性固形物的影响如图11所示。
由图9可知,在不同的酶解温度里,经过酶处理的茶提取液中茶多酚含量均比空白对照组(即并没有进行酶处理的样品)中茶多酚含量高。在30℃到40℃条件中,空白对照组样品中的茶多酚含量缓慢上升,随后茶多酚含量变化趋势平缓。且从图中可看出,经过单宁酶酶解的茶提取液中茶多酚含量最高,这说明,相对其他两种酶,使用单宁酶对茶叶中茶多酚含量的释放作用更为明显。由经单宁酶酶解的样品茶多酚含量变化曲线可知,在低于40℃条件下,样品中的茶多酚含量缓慢上升,而在40℃条件下,茶多酚含量达到峰值;随后,在高于40℃条件下,经单宁酶酶解的样品茶多酚含量开始下降,而在高于50℃条件下,明显下降;且在高于60℃条件下,经过酶处理样品中的茶多酚含量非常接近于空白对照组。说明在高于50℃条件下,单宁酶活性明显下降甚至丧失酶活性。根据数据分析,在40℃经蛋白酶处理的样品茶多酚含量相对于其他条件下处理的样品和空白对照组均在显著性差异(p<0.05)。由经纤维素酶酶解的样品茶多酚含量变化曲线可知,在低于40℃条件下,茶多酚含量上升;在40℃下酶解,当中的茶多酚含量达到峰值;而在高于40℃条件下,经纤维素酶处理的样品茶多酚含量开始下降且含量开始接近空白对照,而空白对照组却变化平缓;在60℃条件下的样品,茶多酚含量骤然上升,可能是由于实验操作引起的误差。由此推断,纤维素酶反应最适温度在40℃左右。由经ProteAX蛋白酶酶解的样品茶多酚含量变化曲线可知,在40℃条件下酶解,当中的茶多酚含量达到峰值。而在高于40℃条件下,经ProteAX蛋白酶酶解的样品茶多酚含量明显下降;在高于50℃条件下酶解的样品,茶多酚含量接近于空白对照组。根据数据分析,在40℃条件下,样品中茶多酚含量相对于其他温度条件下处理的样品和空白对照组均在显著性差异(p<0.05)。
由图10可知,在不同温度条件下,经过酶处理的茶提取液中游离氨基酸含量均比空白对照组(即并没有进行酶处理的样品)中的游离氨基酸含量高。且从图中可看出,经过ProteAX蛋白酶酶解的茶提取液中游离氨基酸含量最高,这说明,相对其他两种酶,ProteAX蛋白酶对茶叶中游离氨基酸含量的释放作用更为明显。由经ProteAX蛋白酶酶解的样品游离氨基酸含量变化曲线可知,在40℃条件下酶解经蛋白酶处理的样品游离氨基酸含量达到最高值,随后变化略有下降,与空白对照组存在的差异也逐渐减小。这是由于反应温度过高,高于ProteAX蛋白酶的最适温度,使酶变性而减弱甚至丧失其催化活性,从而导致酶解反应速率下降或者停止;当反应温度低于其最适温度时,温度会抑制酶的活性,酶解反应速率会变慢。根据数据分析,在40℃条件下酶解样品中的游离氨基酸含量相对于其他条件下处理的样品和空白对照组均在显著性差异(p<0.05)。由经单宁酶酶解的样品游离氨基酸含量变化曲线可知,在低于50℃条件下游离氨基酸含量缓慢上升;在高于50℃条件经酶解处理的样品游离氨基酸含量开始下降,与空白对照组存在的差异也逐渐减小。说明在高于50℃条件下,单宁酶活性明显下降甚至丧失酶活性。由经纤维素酶酶解的样品游离氨基酸含量变化曲线可知,在40℃条件下样品中游离氨基酸含量达到最高值,随后含量略有下降。根据数据分析,在40℃经纤维素酶处理的样品茶多酚含量、游离氨基酸含量相对于其他条件下处理的样品和空白对照组均在显著性差异(p<0.05)。
由图11可知,空白对照组(即并没有进行酶处理的样品)中可溶性固形物含量变化不明显,基本趋于平缓状态,而经过三种不同的酶酶解后的样品中可溶性固形物含量均比空白对照组高。由经单宁酶酶解的样品可溶性固形物含量变化曲线可知,而经单宁酶酶解的样品中可溶性固形物含量与空白组相比存在明显差异,且在40℃—50℃条件下,可溶性固形物含量变化平缓,而高于在50℃条件下可溶性固形物含量开始明显下降。可推断出,在高于50℃条件下,单宁酶活性明显下降甚至丧失酶活性。由经ProteAX蛋白酶酶解和经纤维素酶酶解样品的两条可溶性固形物含量变化曲线可知,在40℃条件下两种酶酶解的样品中可溶性固形物含量均达到最大值,随后含量略有下降且变化幅度不大。根据以上结果以及考虑成本问题得,选择ProteAX蛋白酶、纤维素酶与单宁酶的酶解温度均以40℃为宜。
实施例7
本实施例考察了复合酶解对凤凰单丛茶提取液主要品质的影响,同时与ProteAX蛋白酶、纤维素酶和单宁酶加酶量对凤凰单丛茶提取液主要品质的影响进行了对比。
复合酶酶解对凤凰单丛茶提取液主要品质的影响的考察方法:在1个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,加入1.5%的单宁酶后,放于设置40℃恒温水浴锅中进行酶解1h后,在加入1.1%的蛋白酶及1.5%纤维素酶后,继续酶解2h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,测定茶汤滤液中的茶多酚、游离氨基酸和可溶性固形物的含量。
ProteAX蛋白酶酶解对凤凰单丛茶提取液主要品质的影响的考察方法:在1个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,加入1.1%的蛋白酶酶解2h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,测定茶汤滤液中的茶多酚、游离氨基酸和可溶性固形物的含量。
纤维素酶酶解对凤凰单丛茶提取液主要品质的影响的考察方法与ProteAX蛋白酶酶解对凤凰单丛茶提取液主要品质的影响的考察方法的不同之处仅在于:酶解时,采用的酶为1.5%的纤维素酶。
单宁酶酶解对凤凰单丛茶提取液主要品质的影响的考察方法与ProteAX蛋白酶酶解对凤凰单丛茶提取液主要品质的影响的考察方法的不同之处仅在于:酶解时,采用1.5%的单宁酶酶解3小时。
不同酶处理对茶提取液中茶多酚含量的影响如图12所示,不同酶处理对茶提取液中游离氨基酸含量的影响如图13所示,不同酶处理对茶提取液中可溶性固形物含量的影响如图14所示。
由图12、图13和图14可见,经过复合酶处理的茶提取液与空白对照组(即并没有进行酶处理的样品)及其他单酶在最优条件下处理的样品中茶多酚含量、游离氨基酸含量及可溶性固形物含量均明显增大。且根据数据分析,,经过复合酶处理的样品相对于各个单酶在最优条件处理的样品及空白对照组样品中的各个成分均有明显的差异(p<0.05)。由此得出,此复合酶组合处理优于单酶处理。
实施例8
本实施例考察了复合酶解凤凰单丛茶提取液的感官评价。考察的方法为:在1个100mL锥形瓶中分别加入5g已粉碎的样品茶叶,加入50mL蒸馏水后,于温度为80℃水浴锅中浸提水浴15min,冷却使之降至40℃,加入1.5%的单宁酶后,放于设置40℃恒温水浴锅中进行酶解1h后,在加入1.1%的蛋白酶及1.5%纤维素酶后,继续酶解2h,酶解完成后置于沸水浴中5min灭酶处理,冷却到室温,过滤取茶汤滤液,得到茶提取液。把所得茶提取液按照与蒸馏水比例为1:250、1:500以及1:1000的比例加入到水中,选定若干人组成感官评价鉴定小组,按照表1分别对其香气、色泽、茶味进行评分,评分结果为5者之和,总分为10分。评分标准见表1,茶稀释液感官评价结果见表2。
表1茶稀释液评分标准
表2茶稀释液感官评价
由表2可知,把茶提取液在稀释250倍后,加酶处理的样品优于空白对照样品,且经复合酶处理的样品具有较浓郁的茶香味和明显的茶涩味。使用复合酶对茶进行酶解处理所得的提取液在稀释500倍之后,依然存在较浓郁的茶香味,且较有茶涩味,经复合酶处理所得样品优于单酶处理或不加酶处理的样品。把茶提取液稀释1000倍之后,基本上不存在茶涩味。
实施例9
本实施例采用电子鼻对3中茶提取液(复合酶酶解的茶提取液、空白对照组茶提取液、ProteAX蛋白酶酶解的茶提取液)进行区分辨别,通过判别函数分析法来评价复合酶酶解的效果,以验证感官评价的准确性。
复合酶酶解的茶提取液、空白对照组茶提取液、ProteAX蛋白酶酶解的茶提取液均同实施例7。不同茶提取液样品的雷达图见图15,不同茶提取液样品的判别函数分析图见图16。
由图15可知,3个不同茶提取液样品的气味差异主要集中在S2、S5、S11传感器上。从图中可得知,空白对照组与经ProteAX蛋白酶酶解的样品在气味上差异较小,而复合酶酶解的样品与其他两个样品在气味上差异较大。由图16可知,2个不同插图去也样品分布在图中不同区域内,相互之间没有重叠,且DI值(DI值反映整体区分效果)为96.6%,说明经过复合酶酶解处理的样品与空白对照组、ProteAX蛋白酶酶解的样品在气味上差异上较大。综合感官评价的结果与电子鼻的结果,看出两个结果是一致的,证明感官评价是有一定的可靠性与准确性。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!