中华绒螯蟹HSP90基因克隆及其应用的制作方法
本发明涉及中华绒螯蟹一种热激蛋白90(HSP90)基因cDNA全长序列的扩增及原核表达等。
背景技术:
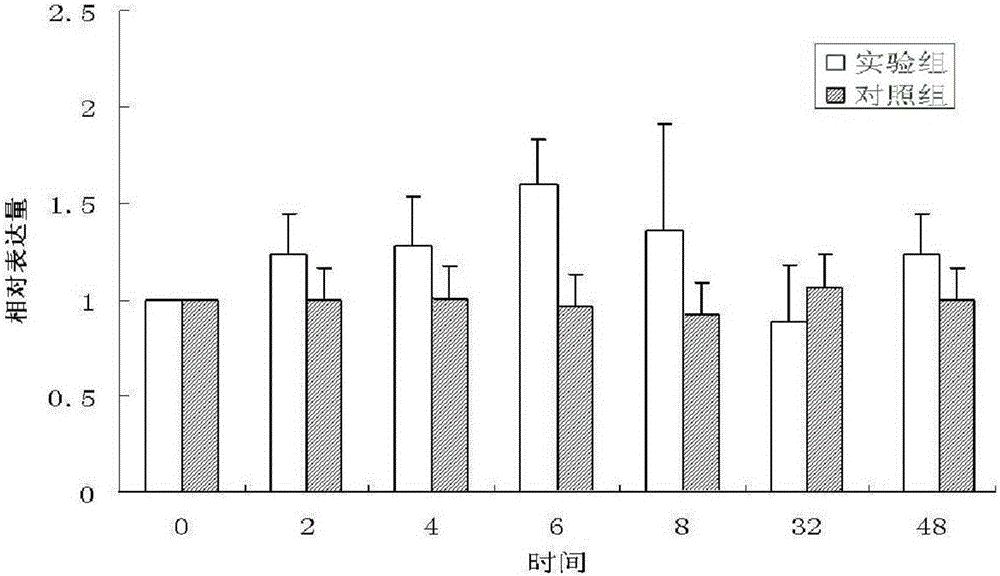
:中华绒螯蟹(Eriocheirsinensis),又名河蟹、毛蟹、大闸蟹,在我国广泛分布于辽河、黄河、长江、瓯江和闽江等江河流域,是我国最主要的经济蟹类之一,也是我国蟹类中产量最多的淡水蟹。其生长快、肉质细嫩、味道鲜美,是我国重要的经济水产养殖品种,该蟹的养殖已成为我国水产养殖的支柱产业。但随着我国工业化进程的加快,中华绒螯蟹的养殖水体中重金属离子、有害病原菌超标问题越来越突出,导致该蟹病害等问题也越来越严重,已成为制约中华绒螯蟹养殖业可持续健康发展的主要问题。热激蛋白(HeatShockProtein,HSP)是一种在应对高温和低温、重金属离子超标、病原微生物感染等应激条件下细胞产生的对自身起保护作用的蛋白质。根据其分子量的大小可分为不同的蛋白家族,其中热激蛋白90(HSP90)是与信号传导途径中的苏氨酸蛋白激酶、络氨酸蛋白激酶和丝氨酸、类固醇激素受体等分子结合,调节它们之间的生物活性,防止蛋白质的聚集和热变性的一类基因家族。HSP90对细胞的凋亡、免疫作用及其肿瘤的发生发展有十分重要的影响;同时,HSP90在抵抗病原的入侵、调节机体免疫力以及机体衰老过程中也发挥着重要作用。鉴于HSP90的众多重要功能及其与机体多种损伤、感染等的关系不断被阐明,近年来,对水生动物HSP90基因序列、蛋白功能等研究引起了广泛关注,其中包括多种水生甲壳类动物HSP90基因的研究。有研究表明,甲壳动物的该基因在受到环境或者病原胁迫时发生热休克反应而被诱导表达,参与相关免疫应激反应。HSP90包含不同的家族成员,宋林生研究员和李鹏博士分别公布了中华绒螯蟹cDNA全长为2506bp和2517bp的HSP90α基因,经比对,这两个基因相似性98%,是同一个基因。并且李鹏博士还对该基因的结构、特征和不同发育阶段的表达水平进行了分析。黄安明在拟穴青蟹中发现了HSP90家族的β亚型基因:HSP90β(GenBank号:JX987068),发现该基因全长3023bp,包含2373bp的开放阅读框,经菌刺激后表达分析证明,该HSP90参与机体抗菌及病毒免疫应激反应,在先天免疫系统中发挥重要作用。技术实现要素:本发明旨在从中华绒螯蟹中扩增得到HSP90基因,更为具体地说,是HSP90β基因,并期望通过该基因在制备中华绒螯蟹免疫学药品、分子标记辅助育种等的应用,为中华绒螯蟹抗逆新品种选育提供理论及数据支持。本发明首先提供一种中华绒螯蟹HSP90基因克隆,具有SEQIDNO.1所示的碱基序列。本发明利用PCR扩增、5′RACE和3′RACE技术,对中华绒螯蟹HSP90基因进行了研究,首次从中华绒螯蟹中扩增到上述具有SEQIDNO.1所示的碱基序列的HSP90基因的cDNA全长序列,该基因cDNA全长3142bp,5′UTR为64bp,3′UTR为711bp,有一个2367bp开放阅读框,编码788个氨基酸。其编码蛋白具有SEQIDNO.2所示的氨基酸序列。制备上述本发明的中华绒螯蟹HSP90基因克隆的方法包括以中华绒螯蟹的cDNA为模板,SEQIDNO.3/SEQIDNO.4为引物进行PCR扩增的步骤。进一步地,该克隆方法包括如下步骤:①从中华绒螯蟹的肝胰脏提取cDNA模板;②构建PCR扩增体系:cDNA模板1μL,2.5mmol/L的dNTPMixture4μL,10μmol/L的上下游引物各1μL,10×Buffer2.5μL,5U/μL的LATaq酶0.25μL,加灭菌超纯水至总体积25μL;③SEQIDNO.3/SEQIDNO.4为引物PCR扩增:94℃预变性5min;94℃30s,58℃30s,72℃1min,35个循环;最后72℃延伸10min,SEQIDNO.3:CCTGGGACTGGACTCTGGTA;SEQIDNO.4:CCTTTGGTTGGTGGGTCG;④3′RACE和5′RACE扩增。具体的实施方式中,所述的3′RACE和5′RACE扩增分别使用碱基序列为SEQIDNO.5/6、SEQIDNO.7/8的引物对。SEQIDNO.5:TGAGACGAAGGATTTGGTGC;SEQIDNO.6:TGTGTATGCGTTCGCTGGT;SEQIDNO.7:GCTGCTTGTCAGAGTTGTGTTTGGA;SEQIDNO.8:CATTTGTGCTACATTGAGTCCGTCC。另一方面,本发明提供一种重组中华绒螯蟹HSP90基因的质粒,该质粒是将上述本发明的中华绒螯蟹HSP90基因克隆片段连接至表达载体pET-15b中所构建的重组表达质粒。再一方面,本发明的目的在于构建一种表达中华绒螯蟹HSP90的基因工程菌,所述基因工程菌是以上述重组中华绒螯蟹HSP90基因的质粒转化大肠杆菌BL21(DE3)宿主细胞所获得的重组基因工程菌。即将SEQIDNO.1的碱基序列所对应的基因片段连接至表达载体PET-15b中,构建重组表达质粒。并将所得的质粒转化大肠杆菌BL21(DE3)宿主细胞获得重组基因工程菌。再一方面,本发明提供所述中华绒螯蟹HSP90基因克隆的应用,所述应用包括但不限于其在制备中华绒螯蟹免疫学药品中的应用,以及其在中华绒螯蟹抗逆新品种选育中的应用。本发明还可以根据序列表SEQIDNO.1的序列设计PCR和RT-PCR引物,对中华绒螯蟹不同规格和不同地理群体的HSP90基因的部分序列进行扩增和序列测定,比较不同个体在HSP90基因序列上的差异,同时比较不同规格和地理群体的HSP90基因mRNA表达的差异,以此指导中华绒螯蟹的遗传选育。本发明利用PCR扩增技术、cDNA5′和3′快速扩增技术(RACE)从中华绒螯蟹中克隆得到了HSP90基因,可用于HSP90基因的重组表达和基因转移,并为中华绒螯蟹增强抗逆境能力、基因辅助选育及进一步开发为药物产品奠定基础。所述的中华绒螯蟹HSP90基因的序列可在中华绒螯蟹遗传选育中应用;也可在细菌、酵母和昆虫细胞系的表达;例如:克隆到pQE系列、pET等系列表达载体中,再将构建成的重组表达载体转化大肠杆菌和酵母,筛选阳性克隆并以IPTG诱导重组蛋白的表达。利用亲和层析对表达产物进行多级纯化,获得体外重组表达的中华绒螯蟹HSP90。所表达的重组蛋白产品可作为药物、饲料添加剂使用。本发明所公开的中华绒螯蟹HSP90基因(SEQIDNO.1)及其相关产品和技术在医药产品制备、中华绒螯蟹免疫学研究、遗传选育和改良等方面有广阔的应用前景。附图说明本发明附图8幅,分别是:图1是中华绒螯蟹HSP90基因表达分布,图中:1.眼柄、2.肌肉、3.心、4.血细胞、5.肠、6.鳃、7.胃、8.肝胰脏、9.Y器官。图2是金黄色葡萄球菌刺激后不同时间段HSP90基因表达量变化,其中:横坐标是相对表达量,纵坐标是时间(小时)。图3是鳗弧菌刺激后不同时间段HSP90基因表达量变化,其中:横坐标是相对表达量,纵坐标是时间(小时)。图4是融合蛋白诱导结果的SDS-PAGE照片,其中,M:ProteinMarker;1:诱导前总蛋白;2:20℃上清;3:20℃沉淀;4:37℃上清;5:37℃沉淀。图5是蛋白镍琼脂糖亲和层析纯化SDS-PAGE分析图,其中,M:ProteinMarker;1:上样;2:流出;3:20mMImidazole洗脱组分;4-6:50mMImidazole洗脱组分;7-:9500mMImidazole洗脱组分。图6是蛋白最终纯化SDS-PAGE分析图,其中,M:ProteinMarker;1:目的蛋白。图7是蛋白SDS-PAGE分析图,其中,M:Prestainedproteinmarker;1:目的蛋白。图8是蛋白浓度测定结果。具体实施方式下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。实施例1中华绒螯蟹HSP90基因的全长cDNA序列扩增本发明中,实施例所用中华绒螯蟹采自辽宁省盘锦双台子河口。1.中华绒螯蟹总RNA的提取取自盘锦野生中华绒螯蟹(体重70克左右),暂养于养殖室,用解剖剪活体解剖中华绒螯蟹的肝胰脏于液氮中研磨,使用TIANGEN动物组织总RNA提取试剂盒进行总RNA的提取,核酸蛋白测定仪(NanoPhotometer)与1.0%琼脂糖凝胶电泳检测其质量及完整性。2.cDNA的合成取中华绒螯蟹肝胰脏组织提取的总RNA为模板,使用PrimescriptRTReagentKit(TaKaRa公司)试剂盒进行反转,将得到的cDNA存于-20℃冰箱中保存备用。3.中华绒螯蟹HSP90基因cDNA全长序列的扩增参照拟穴青蟹(ScyllaParamamosain)HSP90基因完整cDNA全序列(GenBank号:JX987068),结合中华绒螯蟹转录组文库序列(GenBank号:KA666262)和EST文库序列(GenBank号:FL571565),设计特异性引物(表1),以上述中华绒螯蟹肝胰脏的cDNA为模板,SEQIDNO.3/SEQIDNO.4为引物进行HSP90基因cDNA的扩增。PCR扩增体系为25μL,cDNA模板1μL,dNTPMixture(2.5mmol/L)4μL,上下游引物(10μmol/L)各1μL,10×Buffer2.5μL,LATaq酶(5U/μL)0.25μL,加灭菌超纯水至总体积25μL。PCR反应条件:94℃预变性5min;94℃30s,58℃30s,72℃1min,35个循环;最后72℃延伸10min。1.0%琼脂糖凝胶电泳检测,后送上海生物工程有限公司进行测序。表1中华绒螯蟹HSP90基因克隆所用的引物根据已经获得的HSP90基因片段设计3′RACEouterPrimerSEQIDNO.5/innerPrimerSEQIDNO.6和5′RACEouterPrimerSEQIDNO.7/innerPrimerSEQIDNO.8特异性引物(表1),按照3′-FullRACECoreSetwithPrimeScriptTMRTase(TaKaRa)和5′-FullRACEKitwithTAP(TaKaRa)说明书的反应体系和反应条件进行HSP90基因3′和5′端序列的扩增。产物送上海生工生物工程有限公司测序。通过上述试验方法,获得一种中华绒螯蟹HSP90基因克隆,具有以下序列(SEQIDNO.1),序列特征:长度:3142碱基对;类型:核酸;链型:双链;拓扑结构:线形;来源:中华绒螯蟹(Eriocheirsinensis);其氨基酸序列(SEQIDNO.2)的序列特征如下:长度:788个氨基酸;类型:氨基酸;链型:单链;拓扑结构:线形;来源:中华绒螯蟹(Eriocheirsinensis)。开放阅读框共编码788个氨基酸。按照标准密码子翻译后的蛋白质推测分子式为C3998H6324N1060O1286S22,分子量计算值为90.52kD,理论等电点为4.80。4.中华绒螯蟹HSP90基因片段的同源性分析将获得的长度3142bp序列在NCBI数据库中进行BLASTn和BLASTx分析,根据相似性分析结果寻找出与HSP90基因同源的序列,HSP90氨基酸序列同源性比对结果如下表2:证明中华绒螯蟹与青蟹等其他7种节肢动物的HSP90β亚型基因具有较高的相似性,也具有较高的同源性,可推测本基因为中华绒螯蟹HSP90β亚型基因。表2.同源性比对结果种名登录号E值同源性/%拟穴青蟹ScyllaParamamosainAGC54636.1090飞蝗LocustamigratoriaACS75351.1075湿木白蚁ZootermopsisnevadensisKDR24512.1073隆头蛛StegodyphusmimosarumKFM57735.1070黑腹果蝇DrosophilamelanogasterNP_651601.1072体虱PediculushumanuscorporisXP_002428463.1070斜纹夜蛾SpodopteralituraADK55517.2063实施例2.中华绒螯蟹HSP90基因的应激表达试验及体外重组表达(一)HSP90基因在不同组织及不同菌刺激的表达1.实验材料及病原菌取自盘锦野生中华绒螯蟹(体重70克左右),暂养于养殖室养殖水槽中一周,水温19℃,pH为8.0~8.2,每天换水,投喂新鲜文蛤及菲律宾蛤仔肉。用以攻毒试验的金黄色葡萄球菌(Staphylococcusaureus)和鳗弧菌(Vibrioanguillarum)由本实验室保存,使用前37℃液体LB过夜培养,3000×g离心20min,去上清,用TBS(10mMTris-HCL和150mMNaCL;Ph7.5)洗涤一次,用TBS将细菌稀释至每毫升108CFU/mL备用。2.免疫刺激及样品采集选择暂养的健康中华绒螯蟹(每槽18只)分为4组,设3个平行,实验组分为金黄色葡萄球菌和鳗弧菌刺激组,分别从中华绒螯蟹的第二步足基部注射50ul金黄色葡萄球菌悬液(5×107CFU)和鳗弧菌悬液(5×107CFU),另外注射相同体积PBS的中华绒螯蟹作为菌刺激对照组。于刺激后0h、2h、4h、6h、8h、32h、48h时随机挑选3只中华绒螯蟹,从步足基部的腹窦处按一定比例抽取血淋巴(抗凝剂与血淋巴比例为1/1-1/2),抗凝剂使用之前需冰上预冷。抽取血淋巴加入在冰上预冷处理过的离心管中,低温(4℃)800×g离心10min,收集血细胞。另外,取健康三只中华绒螯蟹的血细胞、心、Y器官、眼柄、肝、肌肉、肠、鳃、胃等9个组织用于组织表达分析。将新鲜组织器官放液氮中暂时冷冻,待解剖结束将样品保存于-80℃冰箱备用。3.总RNA提取与cDNA合成取上述中华绒螯蟹的各组织于液氮中研磨,使用TIANGEN动物组织总RNA提取试剂盒进行总RNA的提取,核酸蛋白测定仪(NanoPhotometer)与1.0%琼脂糖凝胶电泳检测其质量及完整性。使用PrimescriptRTReagentKit(TaKaRa公司)试剂盒进行反转,将得到的cDNA存于-20℃冰箱中保存备用。4.表达分析所用序列及条件参照获得的中华绒螯蟹HSP90基因全长cDNA序列,利用PrimerPremier5.0和FPCR软件设计一对定量PCR的特异性引物SEQIDNO.9/SEQIDNO.10(表3),用于HSP90基因的荧光定量分析,并应用内参引物SEQIDNO.11/SEQIDNO.12(表3)量化分析HSP90在中华绒螯蟹不同组织和不同菌刺激的表达差异。定量PCR反应条件:95℃30s;95℃10s,56℃30s,72℃30s,40个循环。样本和内参分别设置3个平行。实验使用STRATAGENEMx3005pReal-TimePCR荧光定量PCR仪,采用2-ΔΔCt法进行数据分析,用EXCEL软件进行显著性分析(P﹤0.05)。表3中华绒螯蟹HSP90基因表达所用的引物5.表达分析结果HSP90在中华绒螯蟹各个组织的表达情况如图1所示,在9个组织中都能检测到HSP90基因的表达,其中眼柄相对表达量最低,而肝胰脏相对表达量最高,血细胞的相对表达量也较高。将中华绒螯蟹在受到金黄色葡萄球菌刺激后0小时鳃内HSP90基因相对于β-actin基因的表达量作为基准值1,随着刺激时间的延长观察相对表达量变化情况,结果如图2。发现表达量开始逐渐增大,刺激6个小时时HSP90基因相对表达量达到最大,以后相对表达量开始下降,到32个小时时相对表达量趋于稳定。将中华绒螯蟹在受到鳗弧菌刺激后0小时鳃内HSP90基因相对于β-actin基因的表达量作为基准值1,随着刺激时间的延长观察相对表达量变化情况,结果如图3。发现表达量开始逐渐增大,刺激8个小时时HSP90基因相对表达量达到最大,接近基准值的2倍,以后相对表达量开始下降,到48个小时时相对表达量趋于稳定。说明中华绒螯蟹在受到菌刺激后8个小时机体通过调节使HSP90基因的表达量增加到最大值,但是由于持续的菌刺激,HSP90基因表达量在达到最大值以后开始逐渐减少,直到正常水平,符合正态分布规律,同时也证实了中华绒螯蟹HSP90基因与免疫反应紧密相连。(二)构建克隆载体PMD-Es-HSP901.引物:根据序列表SEQIDNO.1中中华绒螯蟹HSP90对应cDNA序列设定引物,引入两个不同的限制性内切酶突变位点,设计带有NdeI限制性酶切位点的正向引物SEQIDNO.13和带有XhoI限制性内切酶位点的反向引物SEQIDNO.14,用来扩增Es-HSP90的ORF区。正向引物[SEQIDNO.13]:TGGTGCCGCGCGGCAGCCATATGGAAGATGAGCC;反向引物[SEQIDNO.14]:CTTTGTTAGCAGCCGGATCCTCGAG。2.将扩增产物切胶回收,后与PMD-19T载体连接(PMD-19Tsimplevector,LigationMix:TaKaRa公司),连接体系:pMDl9-T载体:1μl;DNA4μl;SolutionI5μl;16摄氏度过夜。3.配SOB培养基100ml,其中50ml不加抗生素备用,50ml铺成2个平板,铺平板之前按100uL:100mL比例加氨苄抗生素。SOB培养基:液体培养基是3.05gSOB:100ml纯水,固体培养基是在此基础上再加入1.5g琼脂粉,煮沸灭菌。4.将连接好的克隆载体PMD-Es-HSP90转入感受态细胞DH5α。冰浴30min,42℃热激1分50秒,冰浴2-3min,加1000ul不含抗生素的液体培养基,37℃培养45min。5.涂平板在无菌操作台中吸出200-300ul培养液,均匀涂布在之前准备好的平板上,待培养液深入平板以后,37摄氏度倒置过夜培养。6.挑菌每个1.5ml离心管中加入1000ul含有氨苄抗生素的液体培养基,用灭菌枪头轻蘸一下菌落插入带有培养基的离心管中,轻轻搅动后移出枪头。37℃下200转摇菌6个小时左右,期间摇2-3个小时做一份PCR检测是否有片段插入。7.选结果较好的一管,取出200ul菌液加200ul甘油-80℃冻存,同一管其余的用来测序,保留测序结果为阳性的菌液。(三)构建表达载体PET-Es-HSP90、诱导表达融合蛋白1.取10ul保存的阳性菌液,加入1000ul含有氨苄抗生素的液体培养基(每个做五管),37摄氏度摇菌过夜(摇目的菌和相应的载体菌)。2.用质粒小提试剂盒(TaKaRa公司)提目的菌和载体菌的质粒。提出来以后检测产物浓度X/ul,用于计算酶切反应体系。目的片段和PET-15b载体经过内切酶NdeI和XhoI酶切反应后,切胶回收目的片段,纯化后与表达用质粒载体PET-15b连接。连接体系(10ul):(保证目的DNA0.3pmol:载体0.03pmol)T4连接酶1ul,T4连接酶Buffer1.6ul,16℃过夜。将构建成的表达载体,转化到克隆感受态大肠杆菌DE3上。4.转化:培养经测序正确的克隆菌株,取1ul重组的pET15b质粒转化BL21(DE3)菌株,42℃热击90s,冰上静置2min后涂平板(100μg/mL氨苄青霉素),37℃培养过夜。5.小试培养选择最佳的诱导条件1)挑取表达菌株BL21(DE3)的单菌落于试管中(4mLLB培养基,100μg/mL氨苄青霉素)37℃,220rpm过夜培养。2)将培养的菌液按1:100比例分别接种于4mLLB培养基中,添加100μg/mL氨苄青霉素,37℃,220rpm培养。3)当OD值达到0.6左右时,添加终浓度为0.5mM的IPTG,220rpm,分别20℃诱导过夜;37℃诱导4h,未加IPTG诱导剂的作为阴性对照。4)4000rpm离心10min收集菌体,弃上清,菌体用500μLPBS(PH7.4)缓冲液悬浮,超声破碎6min,超0.5s停1.5s,分别离心收集上清和沉淀,沉淀用500μL包涵体溶解液(8MUrea,50mMTris-HCl,150mMNaCl,PH8.0)溶解,分别取40μL样品和10μL5×proteinloadingbuffer混匀,沸水浴10min。5)SDS-PAGE检测,准备12%的SDS-PAGE,Tris-Gly电泳缓冲液(Tris30g,甘氨酸144.0g,SDS10g,定容至1L),上样量10μL,浓缩胶80V20min,分离胶120V60min,凝胶电泳结束考染20min,脱色。6.大量诱导:将培养的菌液按1:100比例接种于4L的LB液体培养基中,添加100μg/mL氨苄青霉素,37℃,220rpm培养,当OD值达到0.6左右时,添加终浓度为0.5mMIPTG,20℃,220rpm,诱导过夜,离心收集细胞菌体。(四)蛋白的纯化1.超声破碎菌体:将收集的细菌菌体用破碎Buffer(20mMPB,300mMNaCl,0.1%TritonX-100,10%甘油,pH8.0)溶解,冰浴中超声破碎菌体,功率400W,20min(超声2S,暂停6S为一个循环)。超声完毕,12000rpm,4℃,离心20min,上清做下一步纯化。2.镍琼脂糖亲和层析1)取5mLNi-NTA,用10倍柱床体积的Bindingbuffer清洗平衡柱子,流速5mL/min。2)上柱,流速为2mL/min,收集穿透液。3)10倍柱床体积的Bindingbuffer清洗柱子,流速10mL/min。4)Washbuffer洗杂,流速5mL/min,收集洗脱液。5)Elutionbuffer洗脱,流速2mL/min,收集洗脱液。注:Bindingbuffer(20mMPB,300mMNaCl,0.1%TritonX-100,10%甘油,pH8.0)Washbuffer(20mMPB,300mMNaCl,0.1%TritonX-100,10%甘油,20/50mMImidazole,pH8.0)Elutionbuffer(20mMPB,300mMNaCl,0.1%TritonX-100,10%甘油,500mMImidazole,pH8.0)6)收集样品SDS-PAGE检测后,将纯度最高的组分透析至1×PBS,pH7.4的透析buffer中,4℃过夜,0.45μm滤膜过滤后分装,-80℃保存。(五)纯化蛋白的检测1.SDS-PAGE检测准备12%的SDS-PAGE,Tris-Gly电泳缓冲液,上样量10μL,浓缩胶80V20min,分离胶120V60min,凝胶电泳结束后进行考马斯亮蓝染色20min,脱色。2.Westernblot检测1)制胶:制备聚丙烯酰胺凝胶:浓缩胶5%,分离胶12%。2)制样:上样量:2ug。3)电泳:浓缩胶80V,30min;分离胶120V,60min。4)转膜:湿转,250mA90min。5)封闭:5%的脱脂奶粉,37℃缓慢振荡2h。6)孵育一抗:一抗为兔抗his标签,抗体公司:SangonBiotech,编号:D110002,1:500稀释,37℃缓慢振荡60min。7)孵育二抗:二抗为羊抗兔,抗体公司:SangonBiotech,编号:D110058,1:8000稀释,37℃缓慢振荡60min。8)显色:TMB显色。(六)纯化实验结果1.融合蛋白诱导结果通过小试样品进行SDS-PAGE分析,结果如图4所示。由SDS-PAGE图可以看出,目的蛋白成功表达。2.蛋白镍琼脂糖亲和层析纯化SDS-PAGE分析结果如图5所示,从图中可以看出:经不同浓度咪唑洗脱后,洗脱液中含有目的蛋白,其中500mM咪唑洗脱蛋白纯度最好。3.蛋白最终纯化SDS-PAGE分析融合蛋白经过纯化,SDS-PAGE电泳分析在相应位置出现明显条带,如附图6所示,表明融合蛋白成功得到了纯化。4.蛋白WesternBlot分析按照Westernblot实验步骤用TMB显色试剂盒显色,WesternBlot分析在相应位置出现明显条带,如附图7所示。5.蛋白浓度测定用SK3071非干扰型蛋白浓度测定试剂盒测定蛋白,测定融合蛋白浓度为2.03mg/ml,BSA浓度为2mg/ml,测定蛋白体积为20μl,结果如附图8及下表:测试1测试2平均值BSA(μg)0.6280.6450.6365500.6920.6920.692400.8190.8020.8105240.8690.8760.8725160.9230.9250.92480.9780.9760.97700.6980.6920.695HSP90(七)蛋白活性检测采用上海彩佑实业有限公司的螃蟹热休克蛋白-90试剂盒检测HSP90的活性,具体如下:1.标准品的稀释:按照下列表在小试管中进行稀释。240U/L5号标准品150μl的原倍标准品加入150μl标准品稀释液120U/L4号标准品150μl的5号标准品加入150μl标准品稀释液60U/L3号标准品150μl的4号标准品加入150μl标准品稀释液30U/L2号标准品150μl的3号标准品加入150μl标准品稀释液15U/L1号标准品150μl的2号标准品加入150μl标准品稀释液2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。3.温育:用封板膜封板后置37℃温育30分钟。4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。6.加酶:每孔加入酶标试剂50μl,空白孔除外。7.温育:操作同3。8.洗涤:操作同5。9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色10分钟。10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。11.测定:以空白孔调零,450nm波长依序测量各孔的吸光度OD值(测定应在加终止液后15分钟以内进行)。12.结果:经计算,测得活性为:93.5U/L。(八)蛋白结果蛋白纯化和透析后,在该浓度下,中华绒螯蟹HSP90活性达到93.5U/L。即本发明得到的HSP90在体外大肠杆菌中有表达活性。此结果证明,本发明利用PCR技术、cDNA5′和3′快速扩增技术(RACE)从中华绒螯蟹中扩增得到了热激蛋白90基因,可用于热激蛋白90的重组表达和基因转移,可开发为作免疫佐剂,能显著提高疫苗的免疫保护率,促进中华绒螯蟹养殖业健康发展;并为中华绒螯蟹抗逆新品种、基因辅助选育及进一步开发为药物产品奠定基础。该产品在药物、饲料添加剂等领域具有广泛的应用前景。以上所述,仅是本发明的实施例而已,并非对本发明做任何形式上的限制,凡是对本发明做非实质性修改,均仍属于本发明范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1