检测Ⅰ群禽腺病毒的通用PCR引物、方法及检测试剂盒与流程
本发明涉及生物技术领域,具体涉及一种采用多聚合酶链式反应(PCR)技术对Ⅰ群禽腺病毒进行快速检测的通用PCR引物、通用PCR方法及检测试剂盒。
背景技术:
禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科(Adenoviridae)、禽腺病毒属(Aviadenovirus),病毒粒子无囊膜,直径约70-90nm,呈十二面体对称,由衣壳、纤突、核酸芯髓及相关蛋白构成。基因组为单分子、线状、双链DNA,大小不一,在26kb-45kb之间。根据群特异性抗原的不同,禽腺病毒可分为3群:I群、Ⅱ群和Ⅲ群。其中I群禽腺病毒包括从鸡、火鸡、鹅及其它禽类分离获得的腺病毒,其包含12个血清型(1-11,8a,8b)和5个基因型(A-E),各血清型之间有一定交叉保护。病毒可经粪便、气管和鼻腔粘膜水平传播,也可发生垂直传播,主要为种鸡产蛋期感染后1~2周内经蛋传播。鸡群感染后表现为包涵体肝炎和心包积液的临床症状,引起死亡率在10%-80%之间,近年来国内报道此病毒感染有增多的趋势。目前国内市场上没有商品化的疫苗,增加了FAdV-I的预防和控制的难度。
FAdV-I的诊断方法主要包括病毒的分离与鉴定,琼脂扩散试验,酶联免疫吸附试验等。病毒的分离与鉴定结果准确可信,但是检测周期长,操作繁琐,不利于疾病的快速诊断。
生物技术的飞速发展极大地推动了生命科学各个领域的发展,疾病的诊断、病原的检测已从细胞水平进入分子水平。禽腺病毒分子结构与基因序列分析的日益深入为其特异性诊断技术研究奠定了基础。根据不同基因型毒株存在的分子结构差异,相继建立了特异、快速的分子诊断技术,包括核酸探针技术、限制性核酸内切酶分析和基因片段的体外扩增技术等。这些技术不仅应用于FAdV的检测、鉴定和特性研究,还可以追踪病毒的来源及流行情况。
聚合酶链式反应(PCR)是一种体外扩增特异性基因片段的技术,在疾病的检测方面有着广阔的应用前景,现已被广泛应用。PCR能够选择性地将病毒基因组的一个特异性短片段放大10万倍以上,极大地增强了检测的敏感性。PCR方法的建立极大地提高了疾病的诊断速度,对病毒的流行病学调查具有重要的应用价值。大量研究结果证明,利用特异性引物对FAdV-I进行PCR扩增不失为一种快速、准确的检测方法。
公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
本发明的目的在于提供一种检测Ⅰ群禽腺病毒的通用PCR引物,以及使用了该引物的PCR扩增反应体系、PCR检测方法和检测试剂盒,该PCR扩增反应体系、PCR检测方法和检测试剂盒操作简便,通用性好,特异性强,灵敏度高,成本低,可以同时进行大批量样本分析。
为了实现本发明目的,本发明提供了一对检测Ⅰ群禽腺病毒的PCR引物,包括上游引物5’-TGYTCGTTGTGGATSGTGAA-3’(如序列表SEQ ID No.1所示)和下游引物5’-CTTYGTKKTGGGNTGGTCG-3’(如序列表SEQ ID No.2所示),其中:上游引物中和下游引物中的Y、S、K和N均为简并引物,Y=C/T,S=G/C,K=G/T,N=A/T/C/G。
本发明还提供了一种包含上游引物5’-TGYTCGTTGTGGATSGTGAA-3’和下游引物5’-CTTYGTKKTGGGNTGGTCG-3’的检测试剂盒。
本发明还提供了一种检测Ⅰ群禽腺病毒的PCR扩增的反应体系,包括以下组分:
其中:上游引物为5’-TGYTCGTTGTGGATSGTGAA-3’,下游引物为5’-CTTYGTKKTGGGNTGGTCG-3’。20μM的上下游引物是指引物自身的浓度,而非其在PCR扩增的反应体系中的终浓度。
在上述反应体系另外一种可能的实现方式中,所述反应体系进行PCR扩增的反应程序为:94℃预变性5min;32个循环,每个循环为94℃45s,55℃45s,72℃35s;循环结束后72℃延伸10min。
在上述反应体系另外一种可能的实现方式中,所述样本取自待测菌悬液或禽类临床病料,如:鸡、火鸡、鹅或其他禽类的临床病料。
在上述反应体系另外一种可能的实现方式中,当样本取自禽类临床病料时,样本总DNA提取前还包括样本预处理的步骤,所述样本预处理的方式为:取脏器组织样本,将样本在灭菌生理盐水中研磨均匀并混悬,离心取上清。
本发明还提供了一种检测Ⅰ群禽腺病毒的PCR方法,包括如下步骤:
1)样本总DNA的提取;
2)利用上游引物5’-TGYTCGTTGTGGATSGTGAA-3’和下游引物5’-CTTYGTKKTGGGNTGGTCG-3’,对步骤1)所得的DNA进行PCR扩增;
3)分析步骤2)所得PCR产物,如果扩增产物包含565bp的片段,则样本为Ⅰ群禽腺病毒检测阳性,否则为检测阴性。即:需要对PCR产物进行琼脂糖凝胶电泳分析,根据电泳结果确定样本中能否扩增出目的条带,目的条带即为565bp的片段。
本发明以NCBI数据库中FAdV-D分离株HBQ12(GenBank登录号为KM096545)基因组序列作为参考,参照GenBank登录的检测不同基因型FAdV-I DNA polymerase基因的保守区序列设计和筛选特异性检测引物。通过新型引物,扩增FAdV-I的DNA polymerase基因中的保守区序列长度约565bp的核苷酸序列,上游引物对应于DNA polymerase基因的7631bp-7650bp之间,下游引物对应于DNA polymerase基因的8177bp-8194bp之间。整体思路为:提取样本总DNA,利用本申请引物进行聚合酶链式反应(PCR),采用下列反应程序:预变性94℃5min;32个循环(94℃45s,55℃45s,72℃35s),最后经过72℃10min延伸,对PCR产物进行琼脂糖凝胶电泳分析,利用紫外凝胶成像仪检测目的条带,如果扩增出目的条带则证明为FAdV-I检测阳性,否则为阴性。
与现有技术相比,本发明具有如下有益效果:
1)扩增的目的片段位于FAdV-I的DNA polymerase基因的高度保守区,且核苷酸序列为565bp,敏感性好、操作方便、对不同基因型的FAdV-I均有较好检出,即通用性好;
2)将FAdV-I病毒样本DNA进行10倍系列稀释后,发现进行10000倍稀释后利用本方法仍能检测到FAdV-I特异性条带,表明使用本申请引物的PCR扩增反应体系、PCR检测方法和检测试剂盒具有较高的灵敏度;
3)使用本申请引物的PCR扩增反应体系、PCR检测方法和检测试剂盒对其它常见禽病病原,如禽流感病毒、新城疫病毒、传染性支气管炎病毒、传染性法氏囊病毒、禽呼肠孤病毒和禽传染性喉气管炎病毒的检测结果皆为阴性,没有交叉反应,表明使用本申请引物的PCR扩增反应体系、PCR检测方法和检测试剂盒亦具有良好的特异性;
4)使用本申请引物的PCR扩增反应体系、PCR检测方法和检测试剂盒适用于养禽生产中进行FAdV-I的检测,具有高特异性、高灵敏度、高效率、低成本的特点,可在4h内对临床病料进行快速鉴别诊断,克服了传统检测方法通过绒毛尿囊膜途径接种于10-11日龄SPF鸡胚,观察鸡胚绒毛尿囊膜是否增厚、出现痘斑,以及琼脂扩散试验、包涵体观察耗时较长等缺点。由于国内疑似FAdV感染的病例有增多的趋势且该病目前尚没有商业化的疫苗,而国内对于FAdV的了解和研究相对较少,而该方法适合大批量临床样本的分析与检测,对FAdV-I的早期快速诊断,为进一步开展全国范围内病毒的分子流行病学调查研究提供可靠技术手段。
附图说明
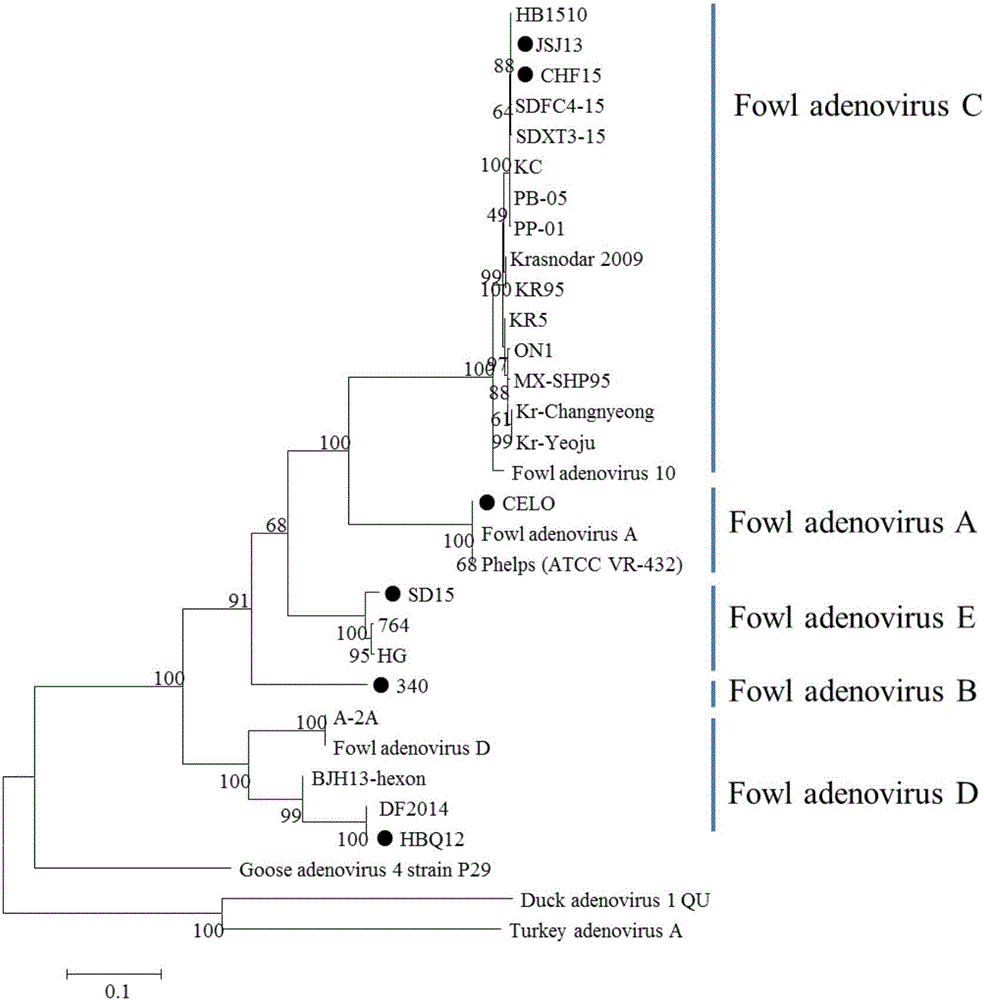
图1是根据FAdV-I hexon基因所绘制的遗传进化树,图中●标示出了不同基因型的FAdV-I代表性毒株,用于本方法的通用性检测。
图2是对不同基因型FAdV-I进行检测的电泳结果。点样顺序为M:DNA Maker II;P:阳性对照;N:阴性对照;1:JSJ13株(FAdV-C);2:CHF13株(FAdV-C);3:CELO(FAdV-A);4:HBQ12株(FAdV-D);5:340(FAdV-B);6:SD株(FAdV-E)。
图3是该引物对FAdV-I的灵敏度检测电泳结果。点样顺序为M:DNA maker II;P:阳性对照;N:阴性对照;1:DNA稀释10倍;2:DNA稀释102倍;3:DNA稀释103倍;4:DNA稀释104倍;5:DNA稀释105倍。
图4是对其它常见禽病病原进行检测的电泳结果。其中M:DNA Maker II;P:阳性对照;N:阴性对照;1:H5亚型禽流感病毒;2:H7亚型禽流感病毒;3:H9亚型禽流感病毒;4:新城疫病毒(NDV);5:传染性支气管炎病毒(IBV);6:传染性法氏囊病毒(IBDV);7:禽呼肠孤病毒(REOV);8:禽传染性喉气管炎病毒(ILTV)。
具体实施方式
下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
下列实施例中常规的实验方法,参见Sambrook等编写的分子克隆。仪器的使用参照仪器操作说明。本申请中实施例中所使用的各个毒株和菌株均由中国农业大学畜禽疫病诊断中心保藏和提供。
实施例1禽类临床病料样本的预处理
1、实验试剂和主要仪器
主要试剂:灭菌生理盐水
主要仪器:LEGEND MICRO 17R低温台式离心机,为Thermo公司产品;VS-1涡旋振荡器购自鼎昊源科技有限公司;TL-2010S组织研磨震荡器购自鼎昊源科技有限公司。
2、实验步骤
组织样本处理:取100mg脏器组织样本加入0.5ml灭菌生理盐水并用研磨器进行研磨混悬,组织悬液3000rpm离心30min后取上清用于检测。
实施例2样本总DNA的提取
1、实验试剂和主要仪器
主要试剂:用DNA Vzol提取试剂,为威格拉斯生物技术(北京)有限公司产品,购自威格拉斯生物技术(北京)有限公司;无水乙醇和75%乙醇购自北京华美智博科技有限公司;Rnase-free的离心管与枪头北京购自华夏远洋科技有限公司。
主要仪器:LEGEND MICRO 17R低温台式离心机,为Thermo公司产品;1300SEVIES A2生物安全柜,为Thermo公司产品。
2、实验步骤
(1)取实施例1预处理所得禽类临床病料样本悬液250μl,加入800μl DNA Vzol,颠倒混匀,裂解产物应呈澄清的透明粘稠液体。
(2)加入无水乙醇量为400μl,轻轻颠倒混匀5-8次,室温放置2-3min。可见DNA在液体中行程团块状沉淀,室温5000g离心5min,以收取DNA,弃去剩余液体。
(3)加入1ml 75%乙醇至离心管中,颠倒数次以重悬DNA,室温2000g离心3-5min,吸除洗涤液。再重复洗涤一次。
(4)仔细吸去剩余乙醇,不要完全晾干DNA,加入100μl水或TE缓冲液,使DNA沉淀溶解。可用吸头缓缓吹打助溶或放置4℃过夜待其自溶,存放于4℃或-20℃。
实施例3目的片段的PCR扩增
1、实验试剂和主要仪器
主要试剂:DNA溶液;2×Taq PCR master mix,购自中科瑞泰(北京)生物科技有限公司;dd H2O;特异性引物(上游引物5’-TGYTCGTTGTGGATSGTGAA-3’;下游引物5’-CTTYGTKKTGGGNTGGTCG-3’);Marker II DNA Ladder购自中科瑞泰(北京)生物科技有限公司。
主要仪器:Veriti 96-Well Thermal Cycler PCR扩增仪为Applied Biosystems公司产品,购自北京诚茂兴业科技发展有限公司;MINI-Smart小型台式离心机为HERO公司产品;DYY-8C电泳仪购自北京市六一仪器厂;α凝胶成像仪购自鼎昊源科技有限公司。
2、实验步骤
在0.2ml离心管中加入下列成分:
轻轻混匀后,进行如下反应:94℃预变性5min;94℃45s,55℃45s,72℃35s,进行32个循环;循环结束72℃延伸10min。
PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe。取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30min,电泳结束后将凝胶块置于凝胶成像仪上观察并拍照,根据电泳结果确定样本中能否扩增出目的条带,如果扩增出目的条带则证明为FAdV-I检测阳性,否则为检测阴性。
利用上述方法分别对不同基因型FAdV-I(A-E)进行检测,结果均有较好的检出,如图2所示,表明本方法具有良好的通用性。
实施例4敏感性检测
1、实验试剂和主要仪器
主要试剂:DNA溶液;2×Taq PCR master mix,购自中科瑞泰(北京)生物科技有限公司;dd H2O;特异性引物(上游引物5’-TGYTCGTTGTGGATSGTGAA-3’;下游引物5’-CTTYGTKKTGGGNTGGTCG-3’);Marker II DNA Ladder购自中科瑞泰(北京)生物科技有限公司。
主要仪器:Veriti 96-Well Thermal Cycler PCR扩增仪为Applied Biosystems公司产品,购自北京诚茂兴业科技发展有限公司;MINI-Smart小型台式离心机为HERO公司产品;DYY-8C电泳仪购自北京市六一仪器厂;α凝胶成像仪购自鼎昊源科技有限公司。
2、实验步骤
将DNA溶液进行10倍系列稀释,稀释度为10、102、103、104和105倍,分别以稀释后的模板按如下体系进行PCR反应。
在0.2ml离心管中加入下列成分:
轻轻混匀后,进行如下反应:94℃预变性5min;94℃45s,55℃45s,72℃35s,进行32个循环;循环结束72℃延伸10min。
PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe。取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30min,电泳结束后将凝胶块置于凝胶成像仪上观察并拍照,根据电泳结果确定样本中能否扩增出目的条带,如果扩增出目的条带则证明为FAdV-I检测阳性,否则为检测阴性。
利用上述方法分别对FAdV-I进行检测,结果显示对FAdV-I DNA稀释104倍后,仍能检测到病毒DNA,如图3所示,表明本方法具有良好的敏感性。
实施例5特异性检测
1、实验试剂和主要仪器
主要试剂:DNA溶液;2×Taq PCR master mix,购自中科瑞泰(北京)生物科技有限公司;特异性引物(上游引物5’-TGYTCGTTGTGGATSGTGAA-3’;下游引物5’-CTTYGTKKTGGGNTGGTCG-3’);Marker II DNA Ladder购自中科瑞泰(北京)生物科技有限公司。
主要仪器:Veriti 96-Well Thermal Cycler PCR扩增仪为Applied Biosystems公司产品,购自北京诚茂兴业科技发展有限公司;MINI-Smart小型台式离心机为HERO公司产品;DYY-8C电泳仪购自北京市六一仪器厂;α凝胶成像仪购自鼎昊源科技有限公司。
2、实验步骤
在0.2ml离心管中加入下列成分:
轻轻混匀后,进行如下反应:94℃预变性5min;94℃45s,55℃45s,72℃35s,进行32个循环;循环结束72℃延伸10min。
PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe。取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30min,电泳结束后将凝胶块置于凝胶成像仪上观察并拍照,根据电泳结果确定样本中能否扩增出目的条带,如果扩增出目的条带则证明为FAdV-I检测阳性,否则为检测阴性。
利用上述方法对其它常见的禽病病原,如禽流感病毒、新城疫病毒、传染性支气管炎病毒、传染性法氏囊病毒、禽呼肠孤病毒和禽传染性喉气管炎病毒进行检测,其结果如图4所示,结果皆为阴性,表明本方法具有良好的特异性。
实施例5对临床样本的检测
表1 PCR检测方法对临床病料检测的应用
由表1可以看出,本申请建立用于检测Ⅰ群禽腺病毒的PCR方法与病毒分离结果或测序结果均符合,准确性高,同时对来自不同采样时间和地点的病料样本均适用。
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!