一种用于三维肝细胞球培养的细胞交联剂材料的制作方法
本发明涉及一种肝细胞交联剂材料,该材料用于体外三维肝细胞的培养,属于组织工程领域。
技术背景
目前,全球的原发性肝癌死亡率在恶性肿瘤中居第三位,我国肝癌的发病率和死亡率均占全球的半数以上(L.A.Torre,F.Bray,R.L.Siegel,J.Ferlay,J.Lortet-Tieulent,A.Jemal,Global cancer statistics,2012,CA.Cancer J.Clin.65(2015)87–108.doi:10.3322/caac.21262.)。近年来随着手术技术的进步和规范的放化疗方案的推广,肝癌的临床治疗水平有了很大提高,但肝癌的5年生存率并未得到有效改善。究其原因,除了肝癌高侵袭性和易复发的恶性特征外,临床药物治疗的局限性也是制约肝癌治疗效果的重要因素。导致上述现象的主要原因是现有药物筛选系统中常用的体外肿瘤细胞模型难以模拟体内肿瘤组织的生长方式和行为特点,因此导致临床试验结果与前期体外实验结果相去较远。临床前体外肿瘤细胞模型通常建立在传统2D细胞培养基础上,这种培养方法难以模拟体内肿瘤立体生长模式,不易形成促肿瘤生长的局部微环境,因此也无法如实反映体内肿瘤的生物学行为和对药物的反应性。
文献证实,在癌症研究中三维细胞培养(three-dimensional cell culture,3D)方法可以弥补二维细胞培养无法模拟细胞体内生存环境的缺陷,并可实现肿瘤干细胞的体外分离和扩增(Fitzgerald K A,Malhotra M,Curtin C M,et al.Life in 3D is never flat:3D models to optimise drug delivery[J].Journal of controlled release:official journal of the Controlled Release Society,2015,215,39-54)。与二维的单层细胞培养相比,三维培养的细胞的形态和功能更加类似于生物体内的组织和器官。因此,三维细胞培养作为体外细胞模型能够更好的模拟体内真实的细胞外生理环境,在药物研发过程中可以有效提高药物研发的成功率,降低新药研发的成本(Elliott,Nelita T.;Yuan,Fan.A review of three-dimensional in vitro tissue models for drug discovery and transport studies[J].Journal of pharmaceutical sciences,2011,100(1):59-74)。同时,由于三维培养细胞的近似于生物体内细胞生理功能的特点,有望被用于混合人工器官的构建(Mironov V,Kasyanov V,Drake C,Markwald RR,organ printing:From bioprinter to organ biofabrication line[J].Current opinion in Biotechnology,2011,22(5):667-673)。
传统的三维细胞培养方法有:细胞支架培养,微流体法和水凝胶法(Jun Yanga M G,HirohikoIsec,Chong-SuChod,Toshihiro Akaikea,c,.Galactosylated alginate as a scaffold for hepatocytes entrapment[J].Biomaterials,2002,23(471-479;Xu Z,Gao Y,Hao Y,et al.Application ofa microfluidic chip-based 3D co-culture to test drug sensitivity for individualized treatment oflung cancer[J].Biomaterials,2013,34(16):4109-4117;Wang Y,Wang J.Mixed hydrogel bead-based tumor spheroid formation and anticancer drug testing[J].The Analyst,2014,139(10):2449-2458)。细胞支架培养法虽然能够培养出具有三维结构的细胞在细胞活性、生理行为等方面较2D细胞培养表现出显著的改善,但是无法精确的控制细胞培养过程中的各个变量;微流体法进行三维细胞培养,虽然可以实现高通量的培养以及多组织的共培养,但是微流体培养法需要较为精细的实验装置,导致成本较高,一直限制了微流体法进行三维细胞培养的广泛应用;水凝胶培养法在材料的制备上,步骤繁杂,实验灵活性差。以上三种传统的三维细胞培养方法存在批次的差异,缺乏可重复性,无法满足实验中对科学、可重复性实验结果获取的要求,并且细胞球制备周期较长,影响着三维细胞模型在实验中的广泛应用。为加快三维细胞培养环境的构建,细胞交联剂法作为一种新的三维细胞培养方法具有实验操作简单易行等优点,有望成为简便有效的三维肝细胞培养方法。前人报道的树枝状细胞交联剂具有促进细胞聚集的能力,但是该方法需要对细胞膜进行化学修饰,这会对细胞产生损伤,同时,树枝状大分子的合成复杂,使该方法(Deqiang Zhao,Siew-Min Ong,Zhilian Yue,Dendrimer hydrazides as multivalent transient inter-cellular linkers[J].Biomaterials,2008,29,3693-3702)具有使用的局限性;另外也有研究者们通过将与细胞膜具有相互作用的功能性配体(如油基、RGD、特异性配体等)修饰在线性PEG链两端用于桥连细胞(Michiko Ito,Tetsushi Taguchi;Enhanced insulin secretion of physically crosslinked pancreaticβ-cells by using a poly(ethylene glycol)derivative with oleyl groups[J].ActaBiomaterialia,2009,5,2945-2952;Zhi Rao,Makoto Sasaki,Tetsushi Taguchi;Development of amphiphilic,enzymatically-degradable PEG-peptide conjugate as cell crosslinker for spheroid formation[J].Colloids and Surfaces B:Biointerfaces,2013,101,223-227)。但该体系存在以下缺点:线性PEG链双端必须完全功能化,反应条件控制困难;交联剂与细胞单位点作用,结合能力较差;两端的功能基团作用在同一个细胞几率较大,从而降低了细胞的桥连率。
技术实现要素:
发明目的:解决现有三维细胞培养技术中交联剂结构控制严格,合成条件苛刻,交联剂与细胞结合能力弱,细胞交联率低等问题。设计一种基于简便有效的三维肝细胞模型的构建方法,既可以高效的构建三维细胞培养环境,也可以进行大批量的三维细胞模型的制备;提供一种用于三维肝细胞培养的细胞交联剂材料。利用细胞交联剂进行三维细胞培养是一种理想的三维细胞培养的方法,通过细胞交联剂拉近细胞间的距离,从而使得细胞的聚集形成三维的细胞培养环境。
本设计将具有良好肝细胞相容性的甘草次酸衍生物修饰到海藻酸钠侧基,使得每条交联剂链上存在多个配体,从而使得交联剂与细胞间形成多点相互作用,有效解决了单位点交联剂桥连率低、细胞结合力不足的问题。此外,该方法对功能基团的修饰量也不需要进行严格的控制,还可通过调整配体种类、修饰量等调整细胞球的功能。因此本文首先制备了甘草次酸修饰的海藻酸钠,并以其为细胞交联剂并通过简单的共混方法获得了具有良好生理功能的肝细胞球。
本发明技术方案
一种用于三维肝细胞球培养的细胞交联剂材料,所述的细胞交联剂材料是以多糖海藻酸钠(ALG)或磺化壳聚糖(SCTS)为载体,将亲水改性后的甘草次酸(GA-N(CH3)2)修饰到海藻酸钠(ALG)或磺化壳聚糖(SCTS)上制备而成,表达式分别为为ALG-GA-N(CH3)2或SCTS-GA-N(CH3)2,其结构分别为:
具体是:将能够与肝细胞膜相互作用的配体甘草次酸(GA)进行亲水性改性,即通过在羟基上引入叔胺基团作为水溶性基团对GA进行亲水改性,通过酯化反应在甘草次酸的羟基上重新引入羧基,以便于向海藻酸钠(ALG)和磺化壳聚糖(SCTS)上修饰,最后利用乙二胺为连接臂通过羧基的酰胺化反应将亲水改性后的甘草次酸(GA-N(CH3)2)修饰到海藻酸钠糖链上,制备了甘草次酸衍生物修饰的海藻酸钠,为ALG-GA-N(CH3)2,取代度DS=2%-12%;
壳聚糖(Chitosan)和海藻酸钠(Sodium alginate)都是天然聚多糖。壳聚糖链上氨基基团的存在,在特定条件下,壳聚糖能发生烷基化、酰基化、羧甲基化、磺化、硝化、卤化、氧化、还原、缩合和络合等反应,可以生成各种具有不同性能的壳聚糖衍生物。因此本发明通过改性甘草次酸的羧基和磺化壳聚糖上的胺基进行酰胺化反应直接将改性甘草次酸修饰到磺化壳聚糖的糖链上,制备了甘草次酸衍生物修饰的磺化壳聚糖SCTS-GA-N(CH3)2,取代度为DS=2%-10%,同样可以实现三维肝细胞的构建。
本发明所述细胞交联剂材料ALG-GA-N(CH3)2的制备方法的具体步骤见实施例1;SCTS-GA-N(CH3)2的制备方法的具体步骤见实施例2。
本发明的优点和积极效果:
本发明和已有技术相比具有以下特点:本发明以胺基改性甘草次酸(GA-N(CH3)2)作为肝细胞亲和配体,不仅保留了其肝靶向能力而且显著提高了其亲水性,有利于细胞交联剂的实际应用;将GA-N(CH3)2引入到海藻酸钠主链,通过与肝细胞简单共混即可以有效的促进细胞的聚集,加快三维肝细胞球的制备;该细胞交联剂无需精确控制GA-N(CH3)2的取代度以及交联剂的分子量,与现有细胞交联剂相比在实际应用中具有更大的优势。本发明可能作为一种用于三维细胞培养的细胞交联剂,在组织工程领域有很好的应用前景。
相对于已有的细胞交联剂,这种将可与肝细胞膜相互作用的配体修饰到高分子链侧基上的交联剂为细胞提供结合位点,并且不需要对功能性配体的数量进行严格的限制,并且由于一条高分子链上可以修饰多个配体,有效增强了交联剂与细胞的相互作用。并且通过细胞摄取实验证明改性后的GA对肝细胞具有较好的选择性;由MTT测试结果可以知道本发明所制备的肝细胞交联剂材料具有较好的生物相容性;活/死细胞染色实验可以证明细胞球内部细胞的活性。因此简单将HepG2细胞与ALG-GA-N(CH3)2悬浮共培养,可以有效促进细胞的聚集,加快三维肝细胞球的构建。
附图说明
图1是GA的亲水改性合成图。
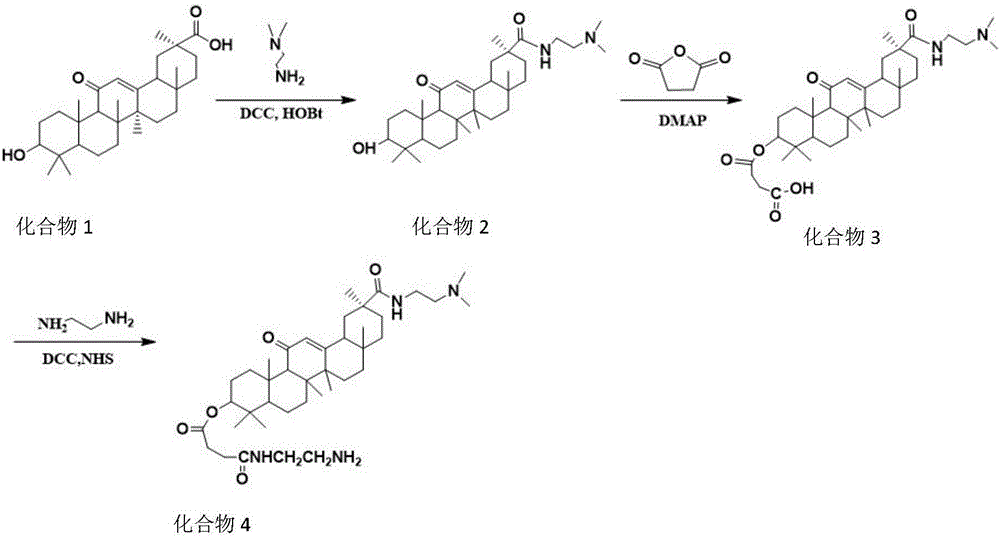
图2是合成细胞交联剂的合成图。
图3是壳聚糖硫酸酯的合成示意图。
图4是SCTS-GA-N(CH3)2DE合成示意图。
图5是HepG2细胞与Hela细胞的流式结果对比图。
图6是ALG-GA-N(CH3)2的MTT测试结果图。
图7是细胞共培养24h后细胞形态图,A,B,C,D为ALG-GA-N(CH3)2样品,E,F为ALG对照组。
图8是培养细胞的AO/EB染色结果图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
本说明书中公开的任一特征,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。即,除非特别叙述,每个特征只是一系列等效或类似的特征中的一个例子而已。
实施例1、肝细胞交联剂ALG-GA-N(CH3)2的制备
步骤1、GA亲水改性:
GA-N(CH3)2的合成
将5.3g DCC和3.4g HOBt溶于二氯甲烷中,室温下搅拌30min。向溶液中加入10g GA(化合物1),搅拌20min。之后加入2.3mLN,N-二甲基乙二胺,室温条件搅拌12h。反应液利用旋蒸仪除去溶剂后使用色谱柱(体积比:CH2Cl2:MeOH:NH3H2O=15:1:1)提纯,之后将产物溶解于乙酸乙酯中,0℃下静置2h,过滤,滤液蒸干、真空干燥后得到白色粉末状产物即化合物2(10.6g,92%)。
步骤2、肝细胞交联剂ALG-GA-N(CH3)2(DS=12%)的制备:
第1、scu-GA-N(CH3)2的合成
将3.2g化合物GA-N(CH3)2(化合物2)溶于30mL吡啶中,依次加入4.7g丁二酸酐,7.7g DMAP,90℃下加热12h,得黑色粘稠液体,先加入一定量的二氯甲烷稀释,然后利用稀盐酸洗涤,将得到的二氯甲烷溶液浓缩后使用色谱柱洗脱,首先使用CH2Cl2:MeOH:NH3H2O=15:1:1的洗脱液除去DMAP与未反应的化合物2,之后使用CH2Cl2:MeOH:NH3H2O=15:5:1洗脱得到棕色产物即化合物3(2.4g,65%)。
第2、N-GA-N(CH3)2的合成
将2.7g化合物scu-GA-N(CH3)2(化合物3)溶于20mL的二氯甲烷中,控制温度在-10℃条件下,向溶液中加入1.05g DCC反应30min,加入0.57g NHS投料摩尔比为M化合物3:MDCC:MNHS=1:1.2:1.2,室温搅拌12h;过滤除去DCU,将滤液滴加到30mL,含有70%乙二胺的二氯甲烷溶液中,室温搅拌12h,反应体系用稀盐酸溶液洗涤一次,浓缩后使用色谱柱提纯CH2Cl2:MeOH:NH3H2O=15:1:1,得到白色粉末状产物即N-GA-N(CH3)2(化合物4)(1.0g,40%)。
第3、ALG-GA-N(CH3)2的合成
将30mL浓度为0.6M的HCl加入到30mL乙醇中,再将2.0gALG-Na加入到混合溶液中,在4℃搅拌过夜;抽滤得到ALG-H,依次用乙醇,丙酮洗涤,在40℃真空干燥过夜;将干燥后的海藻酸分散在100mL蒸馏水中,在搅拌条件下逐滴滴加四丁基铵碱(TBAOH)到聚合物完全溶解,调节pH为7.0-10.0,透析,冻干得到白色的ALG-TBA;将1.0gALG-TBA溶于DMF中,冰浴条件下加入0.3g 2-氯-1-甲基吡啶(CMPI),在N2环境下搅拌反应1h,撤去冰浴,加入0.8g化合物4并滴加适量的三乙胺,常温反应24h。加入30.0mL,2.5mol/L的NaCl溶液;将所得液体在乙醇中沉淀,过滤,洗涤,重新溶于蒸馏水中,转入透析袋(截留分子量Mw=3500)中透析两天,冻干,得白色海绵状固体即取代度为12%的ALG-GA-N(CH3)2。
步骤3、肝细胞交联剂ALG-GA-N(CH3)2(DS=8%)的制备:
方法同步骤2,其中ALG-TBA投料为:1.0g,2.2mmol;N-GA-N(CH3)2投料为:0.5g,0.731mmol。
步骤4、肝细胞交联剂ALG-GA-N(CH3)2(DS=4%)的制备:
方法同步骤2,其中ALG-TBA投料为:1.0g,2.2mmol;N-GA-N(CH3)2投料为:0.3g,0.439mmol。
步骤5、肝细胞交联剂ALG-GA-N(CH3)2(DS=2%)的制备:
方法同步骤2,其中ALG-TBA投料为:1.0g,2.2mmol;N-GA-N(CH3)2投料为:0.15g,0.220mmol。
实施例2、肝细胞交联剂SCTS-GA-N(CH3)2的制备:
1、SCTS的合成
壳聚糖硫酸酯的合成示意图如附图3所示,在500mL的三口瓶中加入45mL的HSO3Cl,在冰浴条件下,将90mL浓度为98%的浓硫酸缓慢的滴加到三口瓶中,搅拌15min。提高搅拌速度,将将3g壳聚糖固体缓慢的加入到反应体系中,大约10min后,待体系稳定后,撤去冰水浴;室温反应2h后,停止反应;将反应液缓慢滴加到1000mL的冰乙醚中(-26℃下令藏3h)中沉淀。然后,将沉淀减压抽滤,先用乙醚洗涤一次,再用丙酮多次洗涤,收集固体并用适量的蒸馏水溶解,用1M NaOH调节pH至中性;之后将样品溶液转入透析袋(Mw=12-14KD)中,对蒸馏水透析3天后,将透析液冻干得到淡黄色的固体即为合成的壳聚糖硫酸酯,产率为94%。
2、SCTS-GA-N(CH3)2的制备
SCTS-GA-N(CH3)2的制备反应式如附图4所示,称取225mg SCTS,溶解在5mL水中,然后称取256mg scu-GA-N(CH3)2,92mg EDC和55.2mg NHS溶解在45mL的DMF中,再将溶解好的溶液加入到SCTS的水溶液中,投料比为:MSuc-GA:MEDC:MNHS=1:1.2:1.2。控制温度在35℃条件下搅拌24h,反应结束,用丙酮进行沉淀,过滤,冻干,得到产物即SCTS-GA-N(CH3)2。
实施例3、细胞摄取实验:
(1)取对数生长期的HepG2细胞,用胰酶消化1min后,加入1mL的DMEM细胞培养基中和胰酶,吹打细胞使其从培养皿中剥离下来,转入离心管中,离心后弃去培养基,重新移取新的DMEM培养基1mL,吹打使细胞分散均匀,计数,并按每孔2×105个细胞的密度接种到12孔细胞培养盘中,用1mL移液枪将细胞吹打均匀,在37℃,5%CO2培养箱中培养24h。
(2)用移液枪移走培养基,用PBS缓冲溶液洗涤一次。然后,加入按照1:1体积比混合的纳米粒子溶液1mL。将其放置在37℃的细胞培养相中培养4h。
(3)用移液枪移走培养基,用PBS缓冲溶液洗涤三次,每次5min,1mL/盘,最后全部移除。加入200μL的胰酶消化,再加入200μL的DMEM培养基中和,用移液枪吹打细胞使其剥离。
(4)用移液枪将细胞混合液转移到1.5mL离心管中,再用200μL的DMEM培养基冲洗孔板,也转移到1.5mL的离心管中。
(5)调整转速为800r/min,离心5min。弃掉上清液,重新加入900μL的PBS缓冲溶液,并用移液枪吹打细胞使其充分分散开。
(6)利用流式细胞仪进行检测,以PBS与DMEM为等体积混合的培养基为空白对照组;以Hela细胞为平行对照组。
结果见附图5,由图可知HepG2细胞经与纳米粒子共培养后整体向右荧光强度高的方向平移,说明HepG2细胞整体对纳米粒子都有摄取且摄取较为平均;由此也体现了HepG2细胞对纳米粒子的摄取是由两者之间的相互作用介导的。而Hela细胞经过共培养后,部分细胞群与空白对照组的峰重叠,说明其中的细胞对纳米粒子的摄取量为零;同时,也有部分细胞的群的荧光强度峰向右平移,说明细胞对纳米粒子有摄取;但是,细胞摄取的荧光强度却不是单峰,说明了细胞对纳米粒子摄取的不均匀性。所以,改性后的GA对肝细胞具有较好的选择性。
实施例3、MTT实验:
HepG2细胞的接种密度为0.8×104cells/孔,DMEM培养基400μL,细胞于37℃,5%CO2培养箱中孵育24h,然后,分别将配置好的样品的DMEM溶液浓度依次为1mg/L,2mg/L,4mg/L加入到培养盘中,在细胞培养箱中培养12h,弃去上层培养基,用PBS洗去死细胞,加入含有0.5mg/mL的MTT的DMEM培养基400μL继续孵育,4h后弃去上层溶液,加入150μL的DMSO充分溶解甲臢沉淀,然后取出80μL加到96孔板中,使用酶标仪在540nm处测定各孔的吸光度,即OD值。每种材料平行3孔,实验重复2次。数据以mean+SD表示,作t检测,P<0.05认为有显著性差异。见附图6,由实验结果可知,制备的材料有良好的细胞相容性。
实施例4、肝细胞球交联剂细胞成球实验:
本发明中细胞实验均为HepG2细胞,HepG2细胞来源于人肝癌组织,广泛用于肝组织工程的体外研究中。使用的培养基为90%的DMEM培养液加10%的胎牛血清,再加1%的双抗,在细胞培养箱中培养(37℃,5%CO2)。将制备的不同取代度的交联剂以不同浓度溶解在DMEM细胞培养基中,然后将细胞栽种到六孔PS细胞培养盘中,40万cell/孔,2mL培养基每孔,培养24h后观察细胞形态。见附图7。不同取代度及浓度样品形成细胞球情况如表一所示,其中,在取代度为4%时,成球大小均一,细胞形态良好,此时形成细胞球效果最好。
表一、不同取代度及浓度样品形成细胞球情况
注:–表示不能形成细胞球;√表示可以形成细胞球
实施例5、AO/EB染色实验:
配置浓度均为50μg/mL的AO/EB混合溶液,弃去细胞培养基,加入已配置好的AO/EB染色液,细胞培养箱中孵化15min(37℃,5%CO2),利用倒置荧光显微镜观察细胞存活情况。见附图8,由图可知细胞球内的细胞有良好的细胞活性。
- 还没有人留言评论。精彩留言会获得点赞!