生产β‑胡萝卜素的重组微生物及构建方法与应用与流程
本发明属于生物技术领域,涉及MEP途径限速步骤发现、解除及其在萜烯类化合物生产中的应用,尤其涉及生产β-胡萝卜素的重组微生物及构建方法与应用。
背景技术:
萜类化合物(terpenoids)是自然界中存在的一类由异戊二烯为结构单元组成的化合物。许多萜类化合物具有很好的药理活性,是中药和天然植物药的主要有效成分。有些萜类化合物已经开发出临床广泛应用的有效药物。
β-胡萝卜素和番茄红素是两种典型的萜类化合物。β-胡萝卜素是具有抗氧化、解毒、抗癌、预防心血管疾病,防治白内障和保护肝脏等作用。此外,β-胡萝卜素有维生素A源之称,是一种重要的人体生理功能活性物质,可以治疗由于缺乏维生素A引起的上体细胞质角质化,干眼病、夜盲症等(Lee et al.,2002;Das et al.,2007)。世界上已有52个国家地区批准使用。
由于萜类化合物具有广泛的应用前景,市场需求巨大,因此高效生产萜类化合物的方法一直以来是研究热点。目前萜类化合物的生产方法主要有三种:化学合成法、植物提取法和微生物发酵法。化学合成法工艺流程复杂、能耗高、污染大;另一方面,萜类化合物在植物中的含量通常很低,植物提取法对野生植物资源造成严重破坏;相比之下,微生物发酵法不受原料的限制、生产过程绿色清洁,具有很大的优势。由于大肠杆菌(Escherichia coli)基因组序列已完全公布,遗传背景和代谢途径都非常清楚、具有培养基要求简单和生长迅速等优点,很多研究都选取大肠杆菌作为出发菌种进行改造生产萜类化合物。图1为引入萜烯类合成基因后大肠杆菌生成萜烯类化合物的合成途径。
异戊烯焦磷酸(IPP)和二甲基丙烯基焦磷酸(Dimethylallyl pyrophosphate,DMAPP)是所有萜类化合物的前体化合物,目前已知有两种合成途径(Lee et al.,2002)。一种是甲羟戊酸途径(Mevalonic Acid Pathway,MVA途径),主要存在于真菌和植物的胞液或内质网上。另一种是MEP途径,主要存在于细菌、绿藻和植物质体中。该途径的起始物是3-磷酸甘油醛和丙酮酸,经一系列酶催化形成大约5:1的IPP和DMAPP混合物。IPP在异戊酰焦磷酸异构酶(Isopentenyl diphosphate isomerase,Idi)的催化下异构成二甲基丙烯基焦磷酸DMAPP。IPP与DMAPP是萜类化合物的基本C5单位,可以在此基础上合成各种萜类化合物。
大肠杆菌具有MEP途径,可以合成萜类化合物的前体物质IPP与DMAPP,将萜类化合物的合成基因引入大肠杆菌,大肠杆菌即可生产萜类化合物。但由于大肠杆菌合成IPP和DMAPP的能力很差,所以萜类化合物的产量通常很低。提高大肠杆菌中MEP途径的代谢流、提高合成IPP与DMAPP的能力,成为提高大肠杆菌合成萜烯类化合物产量的关键。多个研究小组在寻找MEP途径中限速步骤、提高MEP途径中关键基因的表达强度中,做了大量工作(Yoon et al.,2007;Ajikumar et al.,2010;Alper etal.,2005a;Alper et al.,2005b;Choi et al.,2010;Jin and Stephanopoulos,2007;Yuan et al.,2006)。研究表明提高MEP途径中1-脱氧-木酮糖-5-磷酸合成酶基因(dxs)、4-二磷酸胞苷-2-C-甲基-D赤藓糖醇合成酶基因(ispD)和4-二磷酸胞苷-2-C-甲基-D赤藓糖醇激酶基因(ispF)、2-C-甲基-D-赤藓醇-2,4-环焦磷酸合成酶基因(ispE)、异戊酰焦磷酸异构酶基因(idi)的表达强度能提高重组大肠杆菌生产β-胡萝卜素的能力。但提高MEP途径中1-脱氧-木酮糖-5-磷酸还原异构酶基因(dxr)、(E)-4-羟基-3-甲基-2-丁烯基-焦磷酸合成酶基因(ispG)、(E)-4-羟基-3-甲基-2-丁烯基-焦磷酸还原酶基因(ispH)的表达强度反而降低了重组大肠杆菌生产β-胡萝卜素的能力(Yuan et al.,2006)。
为了鉴定MEP途经的限速步骤,Yuan等利用同源重组的方法,用T5启动子在染色体上分别替换了MEP途径的各基因的启动子,发现调控dxs、idi、ispB、ispDF基因后,β-胡萝卜素产量分别提高了100%、40%、20%和40%。用T5启动子对这4个基因进行组合调控后,β-胡萝卜素产量提高了6.3倍,达到6mg/g干重细胞(Yuan et al.,2006)。Suh用强启动子T5调控MEP途经的关键基因dxs、idi和ispDF后,β-胡萝卜素产量比对照提高了4.5倍(Suh et al.,2012)。除了已经鉴定的MEP途径中的限速步骤外,可能MEP途径中还有其他蛋白因为高表达时可溶性低,而没有发现限速(Zhou et al.,2012)。Zhao 2013研究发现,在前体物质供给不足时,下游β-胡萝卜素合成基因很难完成高强度启动子调控实验,而当前体物质供应充足时,很容易实现高强度启动子调控下游基因,因此认为,菌株条件改变,大肠杆菌产β-胡萝卜素的限速步骤会跟着改变(Zhao et al.,2013)。
技术实现要素:
本发明的一个目的是提供一种重组菌。
本发明提供的重组菌,为提高产β-胡萝卜素大肠杆菌中(E)-4-羟基-3-甲基-2-丁烯基-焦磷酸合成酶基因ispG和(E)-4-羟基-3-甲基-2-丁烯基-焦磷酸还原酶基因ispH的表达和/或活性,得到重组菌。
上述重组菌中,所述提高产β-胡萝卜素大肠杆菌中ispG和ispH基因的表达和/或活性为通过同时调控产β-胡萝卜素大肠杆菌中ispG基因和ispH基因的启动子实现的。
上述重组菌中,所述同时调控产β-胡萝卜素大肠杆菌中ispG基因和ispH基因的启动子为如下1)-9)中任一种:
1)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列23所示的调控元件mRSL-4::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列32所示的mRSL-14::ispH;
2)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列21所示的mRSL调控元件mRSL-1::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列29所示的mRSL-3::ispH;
3)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列21所示的mRSL调控元件mRSL-1::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列30所示的mRSL-4::ispH;
4)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列21所示的mRSL调控元件mRSL-1::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列32所示的mRSL-14::ispH;
5)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列23所示的mRSL调控元件mRSL-4::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列29所示的mRSL-3::ispH;
6)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列23所示的mRSL调控元件mRSL-4::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列30所示的mRSL-4::ispH;
7)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列25所示的mRSL调控元件mRSL-11::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列29所示的mRSL-3::ispH;
8)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列25所示的mRSL调控元件mRSL-11::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列30所示的mRSL-4::ispH;
9)将所述产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列25所示的mRSL调控元件mRSL-11::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列32所示的mRSL-14::ispH。
上述插入位置均为插入被调控基因前面,且紧邻被调控基因的起始密码子。
上述重组菌中,所述插入是采用基因组定点编辑或同源重组的方式进行;
或所述基因组定点编辑具体为ZFN编辑、TALEN编辑或CRISPR/Cas9编辑;
或所述同源重组具体为λ-red同源重组或sacB基因介导筛选的同源重组或整合质粒介导的同源重组。
上述重组菌中,所述产β-胡萝卜素大肠杆菌为将β-胡萝卜素合成基因簇和trc调控元件导入大肠杆菌中,再将β-胡萝卜素合成基因簇的trc调控元件替换为人工调控元件M1-93;再将1-脱氧-木酮糖-5-磷酸合成酶基因dxs的原始调控元件替换为人工调控元件M1-37;再将异戊酰焦磷酸异构酶基因idi的原始调控元件替换为人工调控元件M1-46;再将α-酮戊二酸脱氢酶基因sucAB、丁二酸脱氢酶基因sdhABCD和转醛醇酶基因talB的原始调控元件均替换为人工调控元件M1-46得到的菌,具体为CAR005。
上述重组菌的保藏号为CGMCC No.12884。
CAR015于2016年8月19日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101)保藏号为CGMCC No.12884,分类命名为大肠埃希氏菌(Escherichia coli)。
本发明另一个目的是提供一种构建上述重组菌的方法,为如下1)-9)中任一种:
1)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列23所示的调控元件mRSL-4::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列32所示的mRSL-14::ispH;
2)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列21所示的mRSL调控元件mRSL-1::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列29所示的mRSL-3::ispH;
3)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列21所示的mRSL调控元件mRSL-1::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列30所示的mRSL-4::ispH;
4)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列21所示的mRSL调控元件mRSL-1::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列32所示的mRSL-14::ispH;
5)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列23所示的mRSL调控元件mRSL-4::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列29所示的mRSL-3::ispH;
6)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列23所示的mRSL调控元件mRSL-4::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列30所示的mRSL-4::ispH;
7)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列25所示的mRSL调控元件mRSL-11::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列29所示的mRSL-3::ispH;
8)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列25所示的mRSL调控元件mRSL-11::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列30所示的mRSL-4::ispH;
9)所示的方法包括如下步骤:将产β-胡萝卜素大肠杆菌中的ispG基因前插入启动ispG基因表达的序列25所示的mRSL调控元件mRSL-11::ispG,且将所述产β-胡萝卜素大肠杆菌中的ispH基因前插入启动ispH基因表达的序列32所示的mRSL-14::ispH。
上述方法中,
所述插入是采用基因组定点编辑或同源重组的方式进行;
或所述基因组定点编辑具体为ZFN编辑、TALEN编辑或CRISPR/Cas9编辑;
或所述同源重组具体为λ-red同源重组或sacB基因介导筛选的同源重组或整合质粒介导的同源重组;
或所述产β-胡萝卜素大肠杆菌为CAR005。
上述的重组菌在生产β-胡萝卜素中的应用也是本发明保护的范围。
本发明第三个目的是提供一种生产β-胡萝卜素的方法,包括如下步骤:发酵上述的重组菌,得到β-胡萝卜素。
本发明的实验证明,在具有一定β-胡萝卜素合成能力的重组大肠杆菌中,MEP途径中间体HMBPP胞内积累,可以引起细胞毒性;协调表达ispG和ispH基因,可以有效提高重组大肠杆菌的萜烯类化合物合成能力。。
附图说明
图1为引入萜烯类合成基因后大肠杆菌生成萜烯类化合物的合成途径。
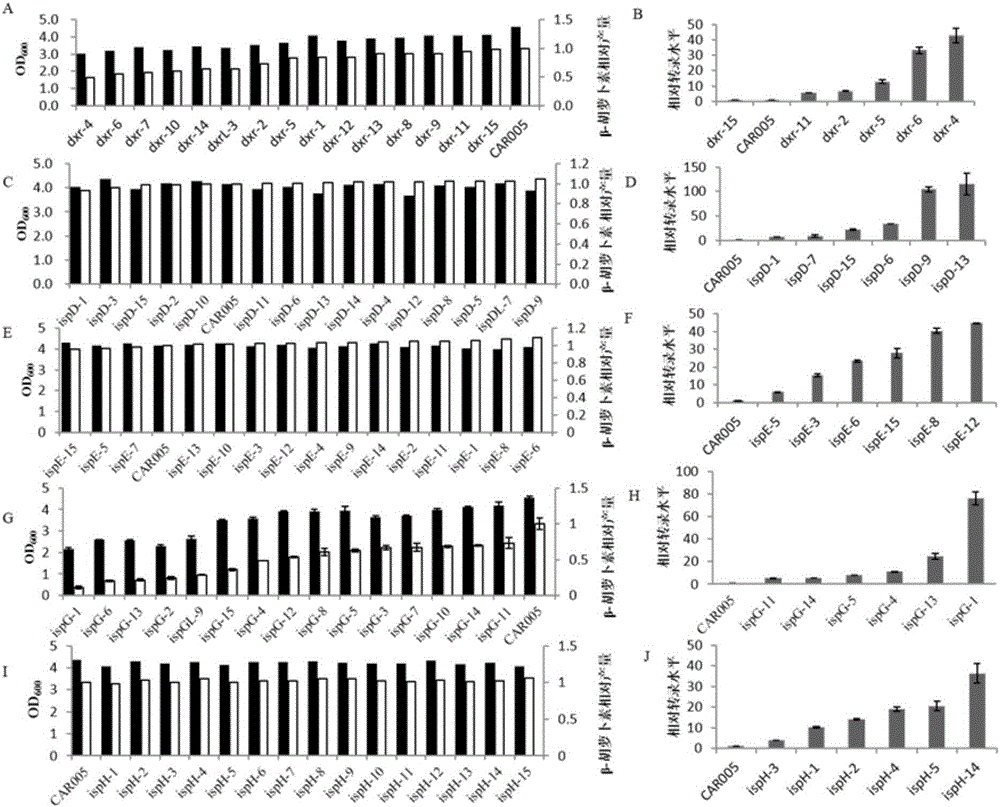
图2为建库调控及测定细胞量、β-胡萝卜素相对产量及相应基因的转录水平;
A为dxr建库后所选菌株的细胞量和β-胡萝卜素相对产量;B为dxr建库后所选菌株dxr相对表达量;C为ispD建库后所选菌株的细胞量和β-胡萝卜素相对产量;D为ispD建库后所选菌株ispD相对表达量;E为ispE建库后所选菌株的细胞量和β-胡萝卜素相对产量;F为ispE建库后所选菌株ispE相对表达量。G为ispG建库后所选菌株的细胞量和β-胡萝卜素相对产量;H为ispG建库后所选菌株ispG相对表达量;I为ispH建库后所选菌株的细胞量和β-胡萝卜素相对产量;J为ispH建库后所选菌株ispH相对表达量。
图3为ispG和ispH基因组合调控菌株细胞生长和β-胡萝卜素产量变化;
A为OD600;B为β-胡萝卜素相对产量。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
大肠杆菌ATCC 8739在文献“Gunsalus IC,Hand DB.(1941).The use of bacteria in the chemical determination of total vitamin C.J Biol Chem.141:853-858.”中公开过,公众可从天津工业生物技术研究所获得;
重组菌株M1-93在文献“Lu,J.,J.Tang,et al.(2012).Combinatorial modulation of galP and glkgene expression for improved alternative glucose utilization.ApplMicrobiolBiotechnol93(6):2455-2462.”中公开过,公众可从天津工业生物技术研究所获得。
M1-93人工调控元件序列见序列1。
番茄红素购自Sigma,产品目录号为L9879。
2-C-Methyl-D-erythritol 4-phosphate(MEP)购自Echelon Biosciences,产品目录号为I-M051。
1-Hydroxy-2-methyl-2-buten-4-yl 4-diphosphate(HMBPP)购自Echelon Biosciences,产品目录号为I-M055。
1-Deoxy-D-xylulose 5-phosphate(DXP)购自Echelon Biosciences,产品目录号为I-M050。
4-Diphosphocytidyl-2-C-methyl-D-erythritol(CDP-ME)购自Echelon Biosciences,产品目录号为I-M052。
2-C-Methyl-D-erythritol 2,4-cyclophosphate(MEcPP)购自Echelon Biosciences,产品目录号为I-M054。
Isopentenyl pyrophosphate triammonium salt solution(IPP)购自Sigma,产品目录号为I0503-1VL。
pXZ-CS质粒在文献“Tan Z,Zhu X,Chen J,Li Q,Zhang X(2013)Activating phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase in combination for improving succinate production.Appl Environ Microbiol 79(16):4838-4844.”中公开过,公众可从天津工业生物技术研究所获得。
pKD46质粒在文献“Datsenko,wanner.One-step inactivation of chromosomal genes in Escherichia coli K-12using PCR products.Proc Natl Acad Sci USA.2000.97(12):6640-6645;”中公开过,公众可从天津工业生物技术研究所获得。
重组菌CAR005为将β-胡萝卜素合成基因簇和trc调控元件导入大肠杆菌中,再将β-胡萝卜素合成基因簇的trc调控元件替换为人工调控元件M1-93;再将1-脱氧-木酮糖-5-磷酸合成酶基因dxs的原始调控元件替换为人工调控元件M1-37;再将异戊酰焦磷酸异构酶基因idi的原始调控元件替换为人工调控元件M1-46;再将α-酮戊二酸脱氢酶基因sucAB、丁二酸脱氢酶基因sdhABCD和转醛醇酶基因talB的原始调控元件均替换为人工调控元件M1-46得到的菌,具体构建方法在公开号为CN 103087972A、发明名称为“生产萜类化合物的重组微生物及构建方法”的发明专利中公开过,公众可从天津工业生物技术研究所获得。
带有pKD46的大肠杆菌CAR005为将质粒pKD46导入大肠杆菌CAR005中得到的菌。
无盐LB的制备方法如下:
50%的蔗糖溶液:称取500g蔗糖,少量超纯水溶解后,定溶至1L,115℃,灭菌20min。
10%的无盐蔗糖LB培养基:称取5g酵母膏,10g蛋白胨于800ml水中,115℃,灭菌20min。灭菌后加200ml的50%的蔗糖溶液。
6%的无盐蔗糖LB培养基:称取5g酵母膏,10g蛋白胨,15g琼脂粉,溶于880ml水中,115℃,灭菌20min。灭菌后加120ml的50%的蔗糖溶液。
实施例中氯霉素、氨苄霉素、卡那霉素的浓度均分别为34μg/L、50μg/L、50μg/L。
表1本发明中所用的引物
表2为本发明中构建菌株
实施例1、摸索MEP途径dxr、ispD、ispE、ispG和ispH基因表达强度与β-胡萝卜素产量的关系
为了研究CAR005(Zhao J,Li Q,Sun T,et al.Engineering central metabolic modules of Escherichia coli for improving beta-carotene production.Metabolic engineering 2013;17:42-50.CAR001和CAR005都出自这篇文章)中MEP途径各基因表达强度与β-胡萝卜素产量的关系,建立mRS文库调控dxr、ispD、ispE、ispG和ispH基因,随机选15个菌株,测定β-胡萝卜素的产量,根据β-胡萝卜素的产量,再选几株代表性菌株用实时定量PCR方法,测定基因表达量,研究表达量与β-胡萝卜素的产量的关系。
一、构建mRS文库调控CAR005中dxr、ispD、ispE、ispG和ispH基因
本实施案例PCR扩增出mRS(mRNA稳定区)文库片段,插在几个待调控基因的起始密码子前,保留原始调控元件。原核生物中-10区同-35区之间称为mRNA稳定区,该区核苷酸种类和数目的变动会影响基因转录活性的高低,在这个区域建立文库,可以得到不同活性的启动子。该文库序列见序列2。
(一)、调控CAR005中dxr基因
以dxr基因为例,用两步同源重组法构建dxr基因的mRS文库,具体方法如下:
以pXZ-CS质粒为模板,dxr-cat-up和dxr-cat–down为引物,PCR得到3000bp左右的DNA片段I;DpnI处理后,将DNA片段I电转至带有pKD46的大肠杆菌CAR005中。取200μl转化的菌液涂在含有氯霉素和氨苄的LB平板上,30℃过夜培养后,分别在含有氯霉素氨苄的LB平板和含有卡那霉素的LB平板上筛选,得到在卡那霉素LB平板上不长,氯霉素氨苄LB平板上长的克隆,使用引物cat-up和dxr-320-down进菌落PCR验证,得到约800bp大小片段的菌株为正确菌株,重组正确菌株为dxr基因前带有cat-sacB的大肠杆菌CAR005,该菌可用于第二步同源重组。
以M1-93的基因组DNA(序列1)为模板,扩增引物为dxr-up-P/dxr-mRSL-down,PCR扩增得到200bp左右的DNA片段II;上游引物dxr-up-P包括待调控dxr基因原始启动子外的50bp碱基和M1-93的人工调控元件的5’末端起20bp同源片段;下游引物dxr-mRSL-down包括待调控dxs基因的起始密码子后的40bp碱基(基因的+1到+40区)、RBS区在内的mRS区的兼并引物片段(5’-ATTTCACACAGGAAACAGCT(N18)-3’)和M1-93的人工调控元件的3’末端起20bp同源片段。这对引物可以扩增出一组mRS区为兼并序列的人工调控元件,用这组元件进行第二步同源重组,即将这组片段电转化至步骤(一)得到的含pKD46的菌株中。将转化菌液转入50ml无盐LB+10%surcose培养基中,37℃、250rpm震荡培养24h后,在无盐LB+6%surcose平板上划线,41℃过夜培养,去除pKD46质粒。分别在含有氯霉素的LB平板和不含抗生素的LB平板上筛选,得到在含氯霉素的LB平板上不长的克隆,进行PCR验证,使用引物P-up/dxr-320-down进行验证。随机选15株验证正确的重组大肠杆菌,命名为dxr-1、dxr-2、dxr-3……dxr-15,即将用于启动dxr基因的表达的表2所示的各个基因对应的mRSL-1元件至mRSL-15元件分别插入大肠杆菌中CAR005基因组中的dxr基因前。
上述案例中所用引物见表1,构建菌株见表2。
(二)调控CAR005中ispD、ispE、ispG和ispH基因
采用(一)中的方法,将(一)中的各个引物替换为各个基因所需引物。
结果得到如下重组菌:
ispD-1、ispD-2、ispD-3……ispD-15分别为将大肠杆菌中CAR005基因组中的ispD基因前分别插入用于启动ispD基因的表达的表2所示的mRSL-1::ispD-mRSL-15::ispD,。
ispE-1、ispE-2、ispE-3……ispE-15分别为将大肠杆菌中CAR005基因组中的ispE基因前分别插入用于启动ispE基因的表达的表2所示的mRSL-1::ispE-mRSL-15::ispE。
ispG-1、ispG-2、ispG-3……ispG-15分别为将大肠杆菌中CAR005基因组中的ispG基因前分别插入用于启动ispG基因的表达的表2所示的mRSL-1::ispG-mRSL-15::ispG。
ispH-1、ispH-2、ispH-3……ispH-15分别为将大肠杆菌中CAR005基因组中的ispG基因前分别插入用于启动ispH基因的表达的表2所示的mRSL-1::ispH-mRSL-15::ispH。
上述(一)和(二)得到的所有菌构成文库菌株。
二、文库菌株β-胡萝卜素的产量
将上述一得到的各个文库菌株分别挑单菌落于4ml的LB培养基的试管中,30℃,250rpm过夜培养;然后按照1%(体积百分含量)的接种量,即100μl菌液,将试管中的菌液转接到含10ml培养液的100ml三角瓶中,30℃,250rpm培养;培养24h后。取500μL菌液于13000rpm离心3min弃上清液,用灭菌水清洗菌体,加1ml丙酮重悬菌体,在55℃黑暗条件下萃取15min,13000rpm离心10min收集上清液。以CAR005为对照。
采用紫外分光光度计453nm下测定上清液中β-胡萝卜素吸收值。
β-胡萝卜素的相对产量=上清液中β-胡萝卜素吸收值乘以/上清液细胞浊度(OD600nm)
dxr-1、dxr-2、dxr-3……dxr-15β-胡萝卜素的相对产量的结果见图2A,图2A表明,CAR005的dxr基因经mRS文库调控后,随机所选15株菌的β-胡萝卜素产量为CAR005的0.5到0.99倍,细胞量为CAR005的0.66到0.9倍。选β-胡萝卜素产量较低的菌株dxr-4(调控元件mRSL-4::dxr序列见序列3)和dxr-6(调控元件mRSL-6::dxr序列见序列4)、β-胡萝卜素产量中等的菌株dxr-2(调控元件mRSL-2::dxr序列见序列5)和dxr-5(调控元件mRSL-5::dxr序列见序列6)、及β-胡萝卜素产量较高的菌株dxr-11(调控元件mRSL-11::dxr序列见序列7)和dxr-15(调控元件mRSL-15::dxr序列见序列8)用实时定量PCR方法测定dxr基因的表达量。
ispD-1至ispD-15β-胡萝卜素的相对产量的结果见图2C所示,表明,CAR005的ispD基因经mRS文库调控后,随机所选15株菌的β-胡萝卜素产量为CAR005的0.99到1.05倍。选β-胡萝卜素产量较低的菌株ispD-1(调控元件mRSL-1::ispD序列见序列9)和ispD-15(调控元件mRSL-15::ispD序列见序列10)、β-胡萝卜素产量中等的菌株ispD-6(调控元件mRSL-6::ispD序列见序列11)和ispD-13(调控元件mRSL-13::ispD序列见序列12)、及β-胡萝卜素产量较高的菌株ispD-7(调控元件mRSL-7::ispD序列见序列13)和ispD-9(调控元件mRSL-9::ispD序列见序列14)用实时定量PCR方法测定ispD基因的表达量。
ispE-1至ispE-15β-胡萝卜素的相对产量的结果如图2E所示,表明,CAR005的ispE基因经mRS文库调控后,随机所选15株菌的β-胡萝卜素产量为CAR005的0.97到1.09倍。选β-胡萝卜素产量较低的菌株ispE-5(调控元件mRSL-5::ispE序列见序列15)和ispE-15(调控元件mRSL-15::ispE序列见序列16)、β-胡萝卜素产量中等的菌株ispE-3(调控元件mRSL-3::ispE序列见序列17)和ispE-12(调控元件mRSL-12::ispE序列见序列18)、及β-胡萝卜素产量较高的菌株ispE-6(调控元件mRSL-6::ispE序列见序列19)和ispE-8(调控元件mRSL-8::ispE序列见序列20)用实时定量PCR方法测定ispE基因的表达量。
ispG-1至ispG-15β-胡萝卜素的相对产量的结果如图2G所示,表明,CAR005的ispG基因经mRS文库调控后,随机所选15株菌的β-胡萝卜素产量为CAR005的0.11到0.79倍,细胞量为CAR005的0.47到0.91倍。选β-胡萝卜素产量较低的菌株ispG-1(调控元件mRSL-1::ispG序列见序列21)和ispG-13(调控元件mRSL-13::ispG序列见序列22),β-胡萝卜素产量较低的菌株ispG-4(调控元件mRSL-4::ispG序列见序列23)和ispG-5(调控元件mRSL-5::ispG序列见序列24),及β-胡萝卜素产量较低的菌株ispG-11(调控元件mRSL-11::ispG序列见序列25)和ispG-14(调控元件mRSL-14::ispG序列见序列26),用实时定量PCR方法测定ispG基因的表达量。
ispH-1至ispH-15β-胡萝卜素的相对产量的结果如图2I表明,CAR005的ispH基因经mRS文库调控后,随机所选15株菌的β-胡萝卜素产量为CAR005的0.98到1.06倍。随机选ispH-1(调控元件mRSL-1::ispH序列见序列27)、ispH-2(调控元件mRSL-2::ispH序列见序列28)、ispH-3(调控元件mRSL-3::ispH序列见序列29)、ispH-4(调控元件mRSL-4::ispH序列见序列30)、ispH-5(调控元件mRSL-5::ispH序列见序列31)和ispH-14(调控元件mRSL-14::ispH序列见序列32)用实时定量PCR方法测定ispH基因的表达量。
上述各菌为将各自基因的启动子替换为括号里面的调控元件。
三、β-胡萝卜素产量与相应基因表达量关系
提取菌株dxr-4、dxr-6、dxr-2、dxr-5、dxr-11和dxr-15总RNA,反转录得到cDNA的第一链;以第一链cDNA为模板,dxr-610-f/dxr-802-r为引物,用iQSYBR Green RT-PCR试剂盒(Bio-Rad Laboratories,Hercules,CA)在实时定量PCR仪(Bio-Rad CFX Connect Real Time System)进行PCR,同时,以CAR005中dxr的cDNA量为对照,测定所选菌株中dxr的表达量。为了保证样品一致性,以16S RNA为内参基因,用于扩增的引物为16S-797-f/16S-963-r,所用引物序列见表1。
实时定量PCR扩增程序:
1)95℃10min,1cycle
2)95℃15s-60℃30s-72℃30s,40cycles
3)60℃-95℃,0.2℃/s
ABI Prism 7000SDS软件(Applied Biosystems)进行数据分析。
将CAR005的cDNA按照一定浓度稀释,测定dxr和16S基因的相对表达量,绘制标准曲线,根据标准曲线计算各个样品中dxr和16S基因的相对表达量,然后计算每个样品做三个重复。
dxr样品=dxr相对量/16S相对量
dxr相对表达强度=dxr样品/dxrCAR005
采用同样方法分别测定文库选定菌株相应基因的相对表达量,所用引物见表1。
结果如图2所示。
图2B表明,CAR005的dxr基因mRS文库所选6株菌中dxr表达量为CAR005中dxr表达量的的0.68到42.86倍。β-胡萝卜素产量最低的菌株dxr-4中dxr表达量最高,表达量是CAR005中dxr表达量的42.86倍;而β-胡萝卜素产量最高的dxr-15中dxr基因的表达量最低,为CAR005中dxr表达量的0.68倍。Dxr表达量与相应菌株β-胡萝卜素产量呈反比,即菌株中dxr表达量越高,其β-胡萝卜素产量越低。
图2D表明,CAR005的ispD基因mRS文库所选6株菌中ispD表达量为CAR005中ispD表达量的的7到116倍。ispD基因mRS文库所选株菌β-胡萝卜素产量和细胞量与出发菌株CAR005相比变化不大,而ispD表达水平有明显差异,因此,认为ispD表达量和β-胡萝卜素产量没有明显相关性。
图2F表明,CAR005的ispE基因mRS文库所选6株菌中ispE表达量为CAR005中ispE表达量的的6到44.5倍。ispE基因mRS文库所选株菌β-胡萝卜素产量和细胞量与出发菌株CAR005相比变化不大,而ispE表达水平有明显差异,因此,认为ispE表达量和β-胡萝卜素产量没有明显相关性。
图2H表明,CAR005的ispG基因mRS文库所选9株菌中ispG表达量为CAR005中ispG表达量的的5.09到75.83倍。β-胡萝卜素产量最低的菌株ispG-1中ispG表达量最高,表达量是CAR005中ispG表达量的75.83倍;而β-胡萝卜素产量最高的ispG-11中ispG基因的表达量最低,为CAR005中ispG表达量的5.09倍。ispG表达量与相应菌株β-胡萝卜素产量呈反比,即菌株中ispG表达量越高,其β-胡萝卜素产量越低。
图2J表明,CAR005的ispH基因mRS文库所选6株菌中ispH表达量为CAR005中ispH表达量的的4到36.4倍。ispH基因mRS文库所选株菌β-胡萝卜素产量和细胞量与出发菌株CAR005相比变化不大,而ispH表达水平有明显差异,因此,认为ispH表达量和β-胡萝卜素产量没有明显相关性。
实施例2、ispG和ispH组合调控得到的重组菌
分别将ispG库调控中ispG-1、ispG-4和ispG-11的ispG的人工调控元件,与ispH库中ispH-3、ispH-4和ispH-14的ispH的人工调控元件在CAR005中组合调控。
一、重组大肠杆菌G1H3、G1H4、G1H14、G4H3、G4H4、G4H14、G11H3、G11H4和G11H14的构建
重组大肠杆菌G1H3为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-1::ispG(序列21),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-3::ispH(序列29);
重组大肠杆菌G1H4为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-1::ispG(序列21),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-4::ispH(序列30);
重组大肠杆菌G1H14为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-1::ispG(序列21),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-14::ispH(序列32)。
重组大肠杆菌G4H3为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-4::ispG(序列23),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-3::ispH(序列29)。
重组大肠杆菌G4H4为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-4::ispG(序列23),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-4::ispH(序列30)。
重组大肠杆菌G4H14为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-4::ispG(序列23),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-14::ispH(序列32)。
重组大肠杆菌G11H3为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-11::ispG(序列25),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-3::ispH(序列29)。
重组大肠杆菌G11H4为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-11::ispG(序列25),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-4::ispH(序列30)。
重组大肠杆菌G11H14为将出发菌CAR005基因组中的ispG基因前插入启动ispG基因表达的mRSL调控元件mRSL-11::ispG(序列25),且将出发菌CAR005基因组中的ispH基因前插入启动ispH基因表达的mRSL-14::ispH(序列32)。
上述重组大肠杆菌均用两步同源重组的方法,插入人工调控元件,以G1H3、G1H4、G1H14构建方法为例,具体如下:
(一)以pXZ-CS质粒为模板,ispH-cat-up和ispH-cat-down为引物,PCR得到3000bp左右的DNA片段I;DpnI处理后,将DNA片段I电转至带有pKD46的大肠杆菌ispG-1中。取200μl转化的菌液涂在含有氯霉素和氨苄的LB平板上,30℃过夜培养后,分别在含有氯霉素氨苄的LB平板和含有卡那霉素的LB平板上筛选,得到在卡那霉素LB平板上不长,氯霉素氨苄LB平板上长的克隆,使用引物cat-up和ispH-395-down进菌落PCR验证,结果重组菌正确,该重组菌为ispH基因前带有cat-sacB的大肠杆菌ispG-1,该菌可用于第二步同源重组。
(二)分别以ispH-3、ispH-4和ispH-14的基因组DNA为模板,扩增引物为ispH-440-up/ispH-395-down,PCR扩增得到940bp左右的DNA片段II;这个片段包括相应调控元件及上下游400bp左右的同源臂,将这条片段电转至步骤(一)得到的含pKD46的菌株中。将转化菌液转入50ml无盐LB+10%surcose培养基中,37℃、250rpm震荡培养24h后,在无盐LB+6%surcose平板上划线,41℃过夜培养,去除pKD46质粒。分别在含有氯霉素的LB平板和不含抗生素的LB平板上筛选,得到在含氯霉素的LB平板上不长的克隆,进行PCR验证,使用引物P-up/ispH-395-down进行验证。筛选验证正确,送去测序,测序正确的菌株命名为G1H3、G1H4、G1H14。所述案例中所用引物见表1,构建菌株见表2.
(三)采用上述(一)、(二)所述方法,用ispH-3、ispH-4和ispH-14的ispH的人工调控元件分别调控ispG-4和ispG-11中ispH基因,得到重组大肠杆菌G4H3、G4H4、G4H14、G11H3、G11H4和G11H14。所用引物见表1,所构建菌株见表2。
二、重组大肠杆菌G1H3、G1H4、G1H14、G4H3、G4H4、G4H14、G11H3、G11H4和G11H14的β-胡萝卜素测定
将重组大肠杆菌G1H3、G1H4、G1H14、G4H3、G4H4、G4H14、G11H3、G11H4和G11H14按照实施例1的方法进行发酵培养,测定β-胡萝卜素产量,同时以CAR005为对照,计算β-胡萝卜素相对产量。结果如图3所示。
结果表明,G1H3、G1H4、G1H14中B-胡萝卜素产量分别为CAR005的0.16、0.47、0.55倍,即在ispG表达量高时(G1H3、G1H4、G1H14中ispG表达量是CAR005的75.8倍),β-胡萝卜素的产量随着ispH基因表达量提高而提高;G4H3、G4H4、G4H14中B-胡萝卜素产量分别为CAR005的0.57、1.70、1.76倍(G4H3、G4H4、G4H14中ispG表达量是CAR005的10.84倍),G11H3、G11H4和G11H14中B-胡萝卜素产量分别为CAR005的0.93、1.66、1.72倍(G11H3、G11H4和G11H14中ispG表达量是CAR005的5.09倍);在ispG表达量低时,β-胡萝卜素产量随着ispH的表达量增加而增加,当ispH表达量增加到一定程度,则β-胡萝卜素产量不再增加。并且各菌株的细胞生长和β-胡萝卜素产量趋势相同。
将β-胡萝卜素产量最高菌株G4H14命名为CAR015。摇瓶中培养24小时,用HPLC方法测定β-胡萝卜素产量,β-胡萝卜素产量达64.83mg/L,单位细胞产量达41.63mg/g。
取制备的β-胡萝卜素萃取液用0.45μm的微孔滤膜(Millpor公司)过滤,使用HPLC(Agilent Technologies高效液相色谱仪1260Infinity)测β-胡萝卜素含量。测定方法同标准品测定。
标准品β-胡萝卜素购自美国Sigma公司(Cat.No.C4582),到货之后马上进行标准曲线的测定。过滤时所用滤膜为0.45μm的微孔滤膜(Millpor公司);丙酮、甲醇、二氯甲烷、石油醚、乙腈为色谱纯试剂,由Merk公司提供。
准确称取β-胡萝卜素的标准品5mg加入1ml二氯甲烷溶解,丙酮定容至10ml,得到500μg/ml的标准品溶液。使用时用丙酮进行倍比稀释(2×、4×、8×、16×、32×),过滤至HPLC进样瓶中,进行HPLC检测。采用Symmetry C18柱(4.6×250mm,5μm);柱温:30℃;流动相:甲醇:乙腈:二氯甲烷=21:21:8;进样量:20μl;进样时间:20min;DAD灯检测;检测波长为450nm,通过标品峰面积与β-胡萝卜素浓度之间的关系,得到β-胡萝卜素的标准曲线。
CAR015于2016年8月19日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101)保藏号为CGMCC No.12884,分类命名为大肠埃希氏菌(Escherichia coli)。
实施例3、重组大肠杆菌发酵得到MEP途径代谢中间体及其应用
推测MEP途径中HMBPP积累,导致ispG-1生长变慢、β-胡萝卜素产量降低,因此测定代表性菌株重组大肠杆菌ATCC 8739、CAR005、ispG-1、ispG-4、G1H14和G4H14(CAR015)中MEP途径代谢中间体积累情况。本实施案例研究MEP途径代谢中间体积累对β-胡萝卜素产量的影响。
一、MEP途径中间体的获得及测定
配制提取液,提取液为甲醇和水(体积比为4:1)。
将上述重组大肠杆菌挑单菌落于4ml的LB培养基的试管中,30℃,250rpm过夜培养;然后按照1%(体积百分含量)的接种量,即100μl菌液,将试管中的菌液转接到含10ml培养液的100ml三角瓶中,30℃,250rpm培养;培养5h后,取10ml培养物离心收集细胞,然后用2ml提取液重悬细胞;将重悬物置于-20℃冰箱中20分钟进行萃取,放置过程中,不时摇动,使萃取充分。萃取结束后离心,将上清液取出放置一个新的离心管中,重复上述萃取过程,然后合并两次萃取液,得到含有MEP途径中间体的溶液。
用带有6500Q-TRAP的质谱仪的安捷伦1290HPLC测定含有MEP途径中间体的溶液中代谢中间体,上样量为15μl。包含溶剂A和溶剂B(体积比为85:15)的流动相在15℃、0.8ml/min流速下,经氨基柱(50×4.6mm,particle size 5μm;Phenomenex)分离MEP代谢中间体。溶液A为含20mM的乙酸铵和20mM的氨水的5%的乙腈水溶液;溶液B为乙腈。以电喷雾电离、正离子检测,优化MEP途径中间体条件,不同物质的离子对见表3。各中间体浓度换算为每OD每升培养基体积含量。
表3MEP途径中间体质谱测定是最优离子对
分别测定了ATCC 8739、CAR005(ATCC 8739是构建CAR005的出发菌株)、ispG-1、G1H14、ispG-4和G4H14菌的MEP途径中间体,结果见表4。在原始菌株大肠杆菌ATCC8739和CAR005中,中间体HMBPP的量分别为0.059和0.07μmol/OD600/L(每升是培养体积的每升),ispG的转录水平增加到原始水平的10.8倍和75.8倍时,胞内HMBPP浓度分别为0.203和0.413μmol/OD600/L,分别是出发菌株CAR005的2.9和5.9倍。在ispG的转录水平增加到原始水平的10.8倍和75.8倍基础上,将ispH的转录水平增加36倍,HMBPP积累分别从0.413降低到0.257μmol/OD600/L,从0.203降低到0.062μmol/OD600/L。而其他中间体的积累量与细胞生长及β-胡萝卜素产量没有明显的相关性(表4)。
表4代表性重组大肠杆菌菌株中胞内代谢中间体浓度(μmol/OD600/L broth)
- 还没有人留言评论。精彩留言会获得点赞!