一种用于多种药物及细胞同时筛选的多功能微流控芯片的制作方法
本发明涉及微流控芯片技术领域,尤其涉及一种用于多种药物及细胞同时筛选的多功能微流控芯片。
背景技术:
药物筛选(drug screening)是从天然或合成的化合物中筛选出高效的新药或先导化合物,对其进行生物活性和药理作用检测,并根据检测结果评价某一物质的药用前景,是新药研究的最初过程和关键步骤。但是传统的药物筛选过程复杂,效率低下,且成本昂贵,不能适应大规模样品的同时筛选,因此需要开发效率更高的药物筛选方法。近年来,随着细胞生物学技术的迅速发展,基于细胞水平的高通量、高内涵筛选为新药筛选提供了新的信息和机会,细胞水平药物筛选具有微量化、超高通量化、均质检测的优点,并可进行多指标、多靶点及多通道检测。而微流控芯片凭借其样品及试剂消耗少、分析速度快、效率高、操作模式灵活多变、集成化优势明显等特点,为细胞水平高通量及高内涵药物筛选提供了一个优秀的实验技术平台。微流控芯片细胞水平筛选方法的出现,给药物发现领域带来了新的生机,使得药物发现进入到了一个更深的层次。
目前,将微流控芯片技术应用于药物筛选领域的报道已有不少,例如Wu 等在文献(Wu J,Wheeldon I,Guo Y,et al.A sandwiched microarray platform for benchtop cell-based high throughputscreening[J].Biomaterials, 2011,32(3): 841-848.)中设计了一种具有“三明治”夹层结构的、细胞水平的阵列式高通量筛选芯片,通过荧光检测药物与乳腺癌细胞(MCF-7)的相互作用,筛选出潜在的抗肿瘤药物,实验采用9-羟基喜树碱进行实验,证明其有效可行,该方法为药物活性成分的筛选提供了一种快速、低成本的途径。但就目前的技术发展来说,一种芯片实现多种功能的筛选依然是药物高通量筛选的瓶颈,成为一大难题而长期无法突破。因此,如何简易高效地进行高通量药物筛选及药物对细胞特异性的筛选仍是亟待解决的问题。
技术实现要素:
本发明针对上述问题,弥补现有技术的不足,提供一种用于多种药物及细胞同时筛选的多功能微流控芯片。其可实现多种细胞的同时筛选实验,还可实现多种药物的同时筛选实验。
为实现本发明的上述目的,本发明提供一种用于多种药物及细胞同时筛选的多功能微流控芯片,由上层的PDMS微阀控制通道层,中层的PDMS流体通道层和下层起支撑和细胞贴附作用的玻璃基底层构成;其特征在于,所述PDMS微阀控制通道层包括第一微阀组和第二微阀组,所述PDMS流体通道层包括阵列式细胞培养区;所述PDMS微阀控制通道层与PDMS流体通道层经热键合后再与玻璃基底层等离子键合形成一体。
所述阵列式细胞培养区由若干个培养单元和多级分支流体进样通道构成,所述培养单元包括细胞培养单元、S形弯曲通道、细胞腔室进样口、S形混合器和废液口;所述细胞培养单元的一端通过S形弯曲通道与细胞腔室进样口相连通,细胞培养单元的另一端通过S形混合器与废液口相连通;所述细胞培养单元由两列细胞培养腔室并联构成,每列细胞培养腔室由若干个细胞培养腔相互串联组成一列;在S形弯曲通道与细胞培养单元的连接处由微通道逐级互相连接,最终连接成一个多级分支流体进样通道,该多级分支流体进样通道的末端作为培养通道进样口。
所述第一微阀组为联动微阀,包含若干个用于控制与细胞培养单元相连通的多级分支流体进样通道的通断的联动微阀控制处,该联动微阀控制处由联动微阀阀通道逐级互相连接,最终连接为一个微阀输注孔,该联动微阀控制处的数量与所述细胞培养单元的数量相同;所述第二微阀组为若干个用于控制细胞腔室进样口与S形弯曲通道的通断的独立微阀;该独立微阀的数量与所述细胞培养单元的数量相同;所述第一微阀组与第二微阀组的结构均是由PDMS微阀控制通道层与PDMS流体通道层的PDMS薄膜构成密闭的空腔,并分别与压力施加装置相连。
作为本发明的一种优选方案,所述压力施加装置为注射器、微量注射泵或气动微阀微泵控制装置。
作为本发明的另一种优选方案,所述独立微阀位于PDMS微阀控制通道层、细胞腔室进样口与S形弯曲通道的连接处所对应的纵向相对应的位置且不与该连接处相连通。
作为本发明的另一种优选方案,所述联动微阀控制处位于PDMS微阀控制通道层、组成多级分支流体进样通道的微通道的纵向相对应的位置,联动微阀控制处与所述微通道不连通。
作为本发明的另一种优选方案,所述PDMS微阀控制通道层与PDMS流体通道层的预聚物与固化剂的比例不同,经加热固化形成一整体后,再与玻璃基底层通过不可逆键合形成完整的芯片。
作为本发明的另一种优选方案,所述S形混合器采用S形弯曲通道,宽度为90-210μm。
作为本发明的另一种优选方案,所述第一微阀组与第二微阀组均为气动控制微阀组,第一微阀组的联动微阀控制处截面为圆形或椭圆形,尺寸为(800-1200)×(800-1200) μm,第二微阀组包括独立微阀阀通道和独立微阀控制处,联动微阀阀通道和独立微阀阀通道宽度相同,均为100-300μm。
作为本发明的另一种优选方案,所述S形弯曲通道宽度为100-200μm。
作为本发明的另一种优选方案,所述第一微阀组的高度为60-150μm,第一微阀组的联动微阀控制处的两两间距为3000-3440μm,所述第二微阀组的高度为60-150μm,第二微阀组的独立微阀之间的间距3880-4220μm。
作为本发明的另一种优选方案,所述细胞培养腔截面为圆形或椭圆形,其尺寸为(800-1200)×(800-1200)μm,细胞培养腔的高度为60-150μm,所述废液口、细胞腔室进样口及培养通道进样口的截面相同,均为圆形或椭圆形,尺寸为(900-1100)×(900-1100)μm。
与现有技术相比本发明有益效果。
本发明具有操作灵活简单、易于集成、实验成功率高、结果稳定、制作成本低及多功能等特点,可实现芯片里一种特定浓度药物对多种细胞的活性筛选,多种药物同时作用于一种细胞的活性筛选,上游外接圣诞树模型还可实现不同浓度的药物对不同种类细胞的筛选,双列细胞培养腔室的应用,不仅增大了样本量,同时降低了细胞染菌的可能性,从而提高了实验成功率和结果的准确性,具有微型化、高通量、低成本、低消耗、试验数据准确可靠的特点。具有较高的潜在生物学研究价值与经济价值。避免了传统96孔板的繁琐操作,可以为基于微流控芯片的实验提供较好的技术支撑,有望为以后高通量药物筛选奠定一定的前期实验基础,并且为新药开发与利用提供一个崭新的平台。
附图说明
下面结合附图和具体实施方式对本发明做进一步说明。本发明保护范围不仅局限于以下内容的表述。
图1是本发明的多功能微流控芯片总体结构示意图。
图2是本发明的多功能微流控芯片第一微阀组示意图。
图3是本发明的多功能微流控芯片第二微阀组示意图。
图4是本发明上层PDMS微阀控制通道层及中层的PDMS流体通道层键合后示意图。
图5是LIVE/DEAD 染色后荧光显微镜下培养24h SMMC-7721等4种细胞的形态图。
图6为顺铂对SMMC-7721等4种细胞Hoechst33342、PI双染色后荧光显微镜下的SMMC-7721等4种细胞凋亡坏死形态图。
图7为不同种类抗肿瘤西药作用下Hoechst33342、PI双染色后荧光显微镜下的肝肿瘤细胞SMMC-7721凋亡坏死形态图。
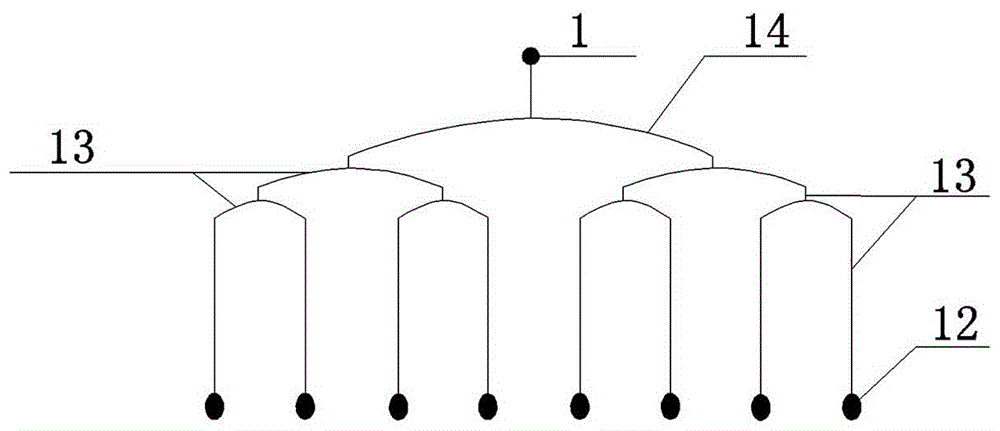
图中,1为微阀输注孔、2为细胞腔室进样口、3为独立微阀、4为S形弯曲通道、5为细胞培养腔、6为细胞培养腔室、7为细胞培养单元、8为S形混合器、9为废液口、10为培养通道进样口、11为多级分支流体进样通道、12为联动微阀控制处、13为联动微阀阀通道、14为第一微阀组、15为第二微阀组、16为独立微阀控制处、17为独立微阀阀通道。
具体实施方式
如图1- 4所示,本发明由上层的PDMS微阀控制通道层,中层的PDMS流体通道层和下层起支撑和细胞贴附作用的玻璃基底层构成;所述PDMS微阀控制通道层包括第一微阀组14和第二微阀组15,所述PDMS流体通道层包括阵列式细胞培养区;所述PDMS微阀控制通道层与PDMS流体通道层经热键合后再与玻璃基底层等离子键合形成一体。
所述阵列式细胞培养区由若干个培养单元和多级分支流体进样通道11构成,所述培养单元包括细胞培养单元7、S形弯曲通道4、细胞腔室进样口2、S形混合器8和废液口9;所述细胞培养单元7的一端通过S形弯曲通道4与细胞腔室进样口2相连通,细胞培养单元7的另一端通过S形混合器8与废液口9相连通;所述细胞培养单元7由两列细胞培养腔室6并联构成,每列细胞培养腔室6由若干个细胞培养腔5相互串联组成一列;在S形弯曲通道4与细胞培养单元7的连接处由微通道逐级互相连接,最终连接成一个多级分支流体进样通道11,该多级分支流体进样通道11的末端作为培养通道进样口10。
所述第一微阀组14为联动微阀,包含若干个联动微阀控制处12,该联动微阀控制处12用于控制与细胞培养单元7相连通的多级分支流体进样通道11的通断,该联动微阀控制处12由联动微阀阀通道13逐级互相连接,最终连接为一个微阀输注孔1,该联动微阀控制处12的数量与所述细胞培养单元7的数量相同。
所述第二微阀组15为若干个独立微阀3,该独立微阀3用于控制细胞腔室进样口2与S形弯曲通道4之间的通断;该独立微阀3的数量与所述细胞培养单元7的数量相同。
所述第一微阀组14与第二微阀组15的结构均是由PDMS微阀控制通道层与PDMS流体通道层的PDMS薄膜构成密闭的空腔,并分别与压力施加装置相连。
本发明所述压力施加装置为注射器、微量注射泵或气动微阀微泵控制装置。也可以是常规微流控气动微阀,包括装有高压空气、高压氮气的高压气瓶,压力调节器等。使用时,将注射器连接到微量注射泵上,注射器内部吸入空气后经注射泵注入芯片内。
本发明所述独立微阀3用于控制细胞腔室进样口2与S形弯曲通道4的通断,其位于PDMS微阀控制通道层、细胞腔室进样口2与S形弯曲通道4的连接处所对应的纵向相对应的位置且不与该连接处相连通。
本发明所述联动微阀控制处12位于PDMS微阀控制通道层、组成多级分支流体进样通道11的微通道的纵向相对应的位置,且该微通道是与细胞培养单元7相连的多级分支流体进样通道11,联动微阀控制处12与所述微通道不连通。
本发明所述PDMS微阀控制通道层与PDMS流体通道层的预聚物与固化剂的比例不同,经加热固化形成一整体后,再与玻璃基底层通过不可逆键合形成完整的芯片。
本发明所述S形混合器8采用S形弯曲通道4,宽度为90-210μm。
本发明所述第一微阀组14与第二微阀组15均为气动控制微阀组,第一微阀组14的联动微阀控制处12的截面为圆形或椭圆形,尺寸为(800-1200)×(800-1200)μm,第二微阀组15包括独立微阀3阀通道和独立微阀3控制处,联动微阀阀通道13和独立微阀阀通道17宽度相同,均为100-300μm。
本发明所述S形弯曲通道4宽度为100-200μm。
本发明所述第一微阀组14的高度为60-150μm,第一微阀组14的联动微阀控制处12的两两间距为3000-3440μm,所述第二微阀组15的高度为60-150μm,第二微阀组15的独立微阀3之间的间距3880-4220μm。
本发明所述细胞培养腔5截面为圆形或椭圆形,其尺寸为(800-1200)×(800-1200)μm,细胞培养腔5的高度为60-150μm,所述废液口9、细胞腔室进样口2及培养通道进样口10的截面相同,均为圆形或椭圆形,尺寸为(900-1100)×(900-1100)μm。
所述第一微阀组14可实现联动控制,第二微阀组15可实现独立控制,微阀可保持良好的关闭状态,无漏液现象,且回弹效果好可实现对流体的操控,用于药物-细胞的筛选。
所述双列细胞培养腔室6的应用,不仅增大样本量,同时降低了细胞染菌的可能性,从而提高了实验成功率和结果的准确性。
本实施例提供三种用于多种药物-细胞同时筛选的多功能微流控芯片的具体应用方法,具体如下。
应用方法一包含以下步骤。
步骤1 外接实验室自制的气动微泵微阀控制装置,关闭第一微阀组14,打开第二微阀组15,使用精密注射泵,以0.2μL/min的速度,将调整好密度的SMMC-7721等多种肿瘤细胞分别由细胞腔室进样口2注入,放置培养箱中培养约4h。
步骤2 约4h细胞贴壁后,关闭第二微阀组15,打开第一微阀组14,使用精密注射泵,以0.2μL/min的速度,由下方多级分支培养通道的培养通道进样口10注入RPMI-1640培养液,实时动态培养24h。
步骤3 培养24h后,用培养液配置成24.04μg/mL的顺铂待测溶液,经精密注射泵,以0.2μL/min的速度,由下方多级分支流体进样通道11的培养通道进样口10注入,放置培养箱中进行药物对细胞的刺激。
步骤4 药物刺激完毕,由下方多级分支流体进样通道11的培养通道进样口10注入PBS缓冲液,对细胞进行清洗。
步骤5在所述下方多级分支流体进样通道11的培养通道进样口10注入LIVE/DEAD 染液,使用精密注射泵施加驱动力,以0.2μL/min对细胞进行染色。
步骤6 倒置荧光显微镜下,进行细胞凋亡坏死检测,分析特定浓度药物对不同种类细胞的活性筛选。
应用方法二包含以下步骤。
步骤1 外接实验室自制的气动微泵微阀控制装置,打开第一微阀组14,关闭第二微阀组15,使用精密注射泵,以0.2μL/min的速度,将调整好密度的SMMC-7721肿瘤细胞由下方多级分支流体进样通道11的培养通道进样口10注入,放置培养箱中培养约4h。
步骤2 约4h细胞贴壁后,使用精密注射泵,以0.2μL/min的速度,将含10%胎牛血清的RPMI-1640培养液由多级分支流体进样通道11的培养通道进样口10注入,放置培养箱中实时培养24h。
步骤3 培养24h后,关闭第一微阀组14,打开第二微阀组15,使用精密注射泵,以0.2μL/min的速度,将配置好的多种不同种类的药液分别由细胞腔室进样口2注入,放置培养箱中进行药物对细胞的刺激。
步骤4 药物刺激完毕,由下方多级分支流体进样通道的培养通道进样口10注入PBS缓冲液,对细胞进行清洗。
步骤5在所述下方多级分支流体进样通道的培养通道进样口10注入LIVE/DEAD 染液,使用精密注射泵施加驱动力,以0.2μL/min对细胞进行染色。
步骤6 倒置荧光显微镜下,进行细胞凋亡坏死检测,分析不同种类药物对特定细胞的活性筛选。
应用方法三包含以下步骤。
步骤1 外接实验室自制的气动微泵微阀控制装置,关闭第一微阀组14,打开第二微阀组15,使用精密注射泵,以0.2μL/min的速度,将调整好密度的SMMC-7721等多种肿瘤细胞分别由细胞腔室进样口2注入,放置培养箱中培养约4h。
步骤2 约4h细胞贴壁后,打开第一微阀组14,关闭第二微阀组15,使用精密注射泵,以0.2μL/min的速度,由下方多级分支培养通道的培养通道进样口10注入RPMI-1640培养液,实时动态培养24h。
步骤3 培养24h后,关闭第一微阀组14,打开第二微阀组15,通过聚四氟乙烯管,上游外接经典“圣诞树”浓度梯度生成结构,由注射泵以0.2μL/min注入,自动生成八种不同的浓度梯度,放置培养箱中进行药物对细胞的刺激。
步骤4 药物刺激完毕,打开第一微阀组14,关闭第二微阀组15,使用精密注射泵,以0.2μl/min的速度,由下方多级分支流体通道11的培养通道进样口10注入PBS缓冲液,对细胞进行清洗。
步骤5在所述下方培养通道进样口10注入LIVE/DEAD 染液,使用精密注射泵施加驱动力,以0.2μL/min对细胞进行染色。
步骤6 倒置荧光显微镜下,进行细胞凋亡坏死检测,分析不同浓度梯度药物对不同种类细胞的活性筛选。
为进一步验证本发明的实用性,提供以下案例。
实施例一。
1、材料与仪器。
SU-8 2075负性光刻胶;Sylgard184型聚二甲基硅氧烷(PDMS);固化剂(美国Dow Corning公司);JKG-2A 型光刻机(上海学泽光学机械有限公司);HPDC-32G-2型等离子清洗机(美国Harrick Plasma公司);匀胶机(SC-1B型,北京创世威纳科技有限公司);真空干燥箱(上海一恒科学仪器有限公司);精密注射泵(LSP04-1A,保定兰格公司);Nikon ECLIPSE TI倒置荧光显微镜(日本Nikon公司)。
2、芯片里细胞培养。
(1)芯片预处理:制作好的芯片先用无菌三级水润洗三遍,之后注入75%乙醇,清洗三遍,然后用无菌水洗三遍,烘干,紫外光照射30min杀菌,之后通入0.1mg•L-1的多聚L-赖氨酸(PLL),于37℃下孵育1h,对芯片的细胞培养腔5室进行包被处理,提高细胞的贴壁率,最后用无菌水将剩余PLL 冲掉,烘干备用。
(2)芯片细胞培养及活力检测:将对数生长期的人肝肿瘤SMMC-7721细胞、正常人肝细胞L-02、正常大鼠肾细胞NRK、肺癌细胞A549用含10%灭活胎牛血清的RPMI-1640培养液配制成密度为5×105个/cm 2的悬液,外接实验室自制的气动微泵微阀控制装置,关闭第一微阀组14,打开第二微阀组15,将调整好密度的SMMC-7721等4种细胞分别由细胞腔室进样口2注入,之后将芯片放入细胞培养箱中静置,约3-3.5h 细胞贴壁后,打开第一微阀组14,关闭第二微阀组15,使用精密注射泵以0.2μL•min-1的流速从下方多级分支流体进样通道11的培养通道进样口10注入RPMI-1640培养液,实时动态培养24h后,在所述下方多级分支流体进样通道11的培养通道进样口10注入LIVE/DEAD 染液,使用精密注射泵施加驱动力,以0.2μL/min对细胞进行避光染色30min,然后继续用PBS清洗细胞3次,使用倒置荧光显微镜进行拍照,并结合图像分析软件IPP 检测细胞的存活率。如图5所示,结果显示芯片中培养的细胞活力良好,细胞存活率能达到95%以上。
3、芯片里细胞凋亡坏死研究。
将肝肿瘤SMMC-7721细胞、正常人肝细胞L-02、正常大鼠肾细胞NRK、肺癌细胞A549 四种细胞密度调整为5×105个/cm 2,关闭第一微阀组14,打开第二微阀组15,将调整好密度的SMMC-7721等4种细胞分别由细胞腔室进样口2注入经过消毒处理的芯片中,待细胞贴壁且进入对数生长期时,打开第一微阀组14,关闭第二微阀组15,使用精密注射泵以0.2μL•min-1的流速从下方多级分支流体进样通道11的培养通道进样口10注入含顺铂(8μg/mL)的培养液,实时刺激24h,之后使用精密注射泵以0.2μL•min-1的流速从下方多级分支流体进样通道11的培养通道进样口10注入PBS缓冲液,对细胞清洗3 遍后,向芯片中通入凋亡坏死试剂盒中现配的Hoechst 33342 和PI 染液(V/V=1:1)对细胞进行双染,4℃避光孵育12min,然后用PBS 清洗剩余的染料,最后使用Nikon eclipse Ti倒置荧光显微镜对芯片进行拍照处理,并结合IPP 软件计算出待测药物对肝肿瘤SMMC-7721细胞、正常人肝细胞L-02、正常大鼠肾细胞NRK、肺癌细胞A549 四种细胞的凋亡坏死率。
因需要对每种细胞的凋亡坏死率进行相对定量分析,所以以四种细胞对应四种空白对照为例,进行Hoechst 33342 和碘化丙啶(PI)双染凋亡坏死分析,后续如果定性分析,可直接进行八种细胞的分析,这里选取每种细胞的一个细胞培养腔5,作为整个双染结果的代表,结果如图6、表1所示。
表1顺铂对SMMC-7721等4种细胞凋亡坏死率的影响(%)(±s)。
实施例二。
1、材料与仪器。
SU-8 2075负性光刻胶;Sylgard184型聚二甲基硅氧烷(PDMS);固化剂(美国Dow Corning公司);JKG-2A 型光刻机(上海学泽光学机械有限公司);HPDC-32G-2型等离子清洗机(美国Harrick Plasma公司);匀胶机(SC-1B型,北京创世威纳科技有限公司);真空干燥箱(上海一恒科学仪器有限公司);精密注射泵(LSP04-1A,保定兰格公司);Nikon ECLIPSE TI倒置荧光显微镜(日本Nikon公司)。
2、芯片里细胞培养。
(1)芯片预处理:制作好的芯片先用无菌三级水润洗三遍,之后注入75%乙醇,清洗三遍,然后用无菌水洗三遍,烘干,紫外光照射30min杀菌,之后通入0.1mg•L-1的多聚L-赖氨酸(PLL),于37℃下孵育1h,对芯片的细胞培养腔5室进行包被处理,提高细胞的贴壁率,最后用无菌水将剩余PLL 冲掉,烘干备用。
(2)芯片细胞培养及活力检测:将对数生长期的人肝肿瘤SMMC-7721细胞用含10% 灭活胎牛血清的RPMI-1640 培养液配制成密度为5×105个/cm 2的悬液,打开第一微阀组14,关闭第二微阀组15,利用精密注射泵将细胞通过下方多级分支培养通道的培养通道进样口10注入,之后将芯片放入细胞培养箱中静置,约3-3.5h 细胞贴壁后,使用精密注射泵以0.2μL•min-1的流速通入培养液,进行灌流培养24h,之后,用精密注射泵从细胞注入口11 处通入磷酸盐缓冲液(PBS),对细胞进行清洗后,将配制好的LIVE/DEAD 染液混匀后通入芯片,避光染色30min,然后继续用PBS清洗细胞3 次,使用倒置荧光显微镜进行拍照,并结合图像分析软件IPP 检测细胞的存活率,如图5所示,结果显示芯片中培养的细胞活力良好,细胞存活率能达到95% 以上。
3、芯片里细胞凋亡坏死研究。
将肝肿瘤细胞SMMC-7721 密度调整为5×105个/cm 2,打开第一微阀组14,关闭第二微阀组15,利用精密注射泵由下方多级分支流体进样通道11的培养通道进样口10注入经过消毒处理的芯片中,待细胞贴壁且进入对数生长期时,关闭第一微阀组14,打开第二微阀组15。这里选用常见的五种广谱抗癌西药进行试验(他们均通过抗代谢物而起作用,干扰DNA或RNA 的合成),之后将用RPMI-1640培养液配制好的五种待测药液分别由第一到第五系列细胞培养腔5室的细胞腔室进样口2以0.2μL•min-1的速度实时灌注刺激,第六系列注入空白培养液,作为对照组,五种待测药液的种类和浓度分别为顺铂(8μg/mL)、吉西他滨(8μg/mL)、奥沙利铂(8μg/mL)、阿霉素(5μg/mL)、5-Fu(10μg/mL)。当药物作用SMMC-7721 细胞24h 后,吸取一定量的PBS 缓慢匀速的注入到第一到第六系列细胞培养腔5室,对细胞清洗3 遍后,向芯片中通入凋亡坏死试剂盒中现配的Hoechst 33342 和PI 染液(V/V=1:1)对细胞进行双染,4℃避光孵育12min,然后用PBS 清洗剩余的染料,最后使用Nikon eclipse Ti倒置荧光显微镜对芯片进行拍照处理,并结合IPP 软件计算出待测药物对SMMC-7721 细胞的凋亡坏死率。
选取每种常见抗肿瘤西药的1 个细胞培养腔5,作为整个双染结果的代表,Hoechst 33342 和碘化丙啶(PI)双染结果如图7、表2所示。
表2 常见五种抗肿瘤西药对肝肿瘤细胞SMMC-7721凋亡坏死率的影响(%)(±s)。
可以理解的是,以上关于本发明的具体描述,仅用于说明本发明而并非受限于本发明实施例所描述的技术方案,本领域的普通技术人员应当理解,仍然可以对本发明进行修改或等同替换,以达到相同的技术效果;只要满足使用需要,都在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!