一种利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的方法与流程
本发明涉及发酵工程领域,具体涉及一种以亚硫酸铵法制浆废液作为补料物实施补料发酵生产纤维素酶的方法。
背景技术:
纤维素酶是酶制剂中的一个重要品种,广泛应用于印染、饲料、酿造等行业,特别在纤维素乙醇的生产过程中发挥关键作用。当前市场对纤维素酶需求量逐年迅速增加,诺维信、杰能科等国际大型酶制剂生产企业也将研发重点放在提高纤维素酶的效率和生产技术上,可以预测未来纤维素酶的市场前景非常广阔。
液体深层发酵是当前工业上生产纤维素酶的主要方式。通常情况下,液体培养基中基质浓度和纤维素酶产量呈正相关,但纤维素、麸皮等基质的吸水性较强,在含量过高时会影响溶氧和水活度等条件,从而影响到纤维素酶的生产,所以培养基中的基质浓度一般都低于10%。研究表明,补料的发酵方式可以有效地提高纤维素酶的产量。饶庆隆在发酵过程中每24h补加2g/L的纸浆,滤纸酶活提高了80%(南京林业大学学报:自然科学版,饶庆隆,2008,32(3):57-60)。Lijuan Ma则通过物料守恒策略补加微晶纤维素使里氏木霉(T.reesei)的滤纸酶活提高了82.13%,达到19.07IU/mL(Journal of Biotechnology,Lijuan Ma,2013,166(4):192-197)。从已经报道的工作看,纤维素酶发酵生产时补料物均为纯纤维素或富含纤维素的材料,这些物质多难溶于水,价格较高且吸水性非常强,只能采用少量多次补加的补料策略,未能实现连续流加补料发酵的生产工艺,操作复杂并存在一定染菌的风险。
我国许多造纸企业是利用麦草、稻草等农业废弃秸秆作为原料采用亚硫酸铵法进行制浆,在蒸煮过程中产生的棕黑色废液(以下简称制浆废液)大多直接排放,造成了环境污染,而这种制浆废液中含有一定量的半纤维素、葡聚糖和铵盐,因为半纤维素、葡聚糖等能够诱导分泌纤维素酶,铵盐可为微生物生长提供氮源,因此其有望作为纤维素酶发酵过程中的补料物,但检索发现,目前为止工业上还没有流加制浆废液补料发酵生产纤维素酶的实例。
技术实现要素:
针对现有技术中纤维素类材料作为补料物时成本高、难连续流加的缺陷,本发明要解决的问题是提供一种以亚硫酸铵法制浆废液作为补料物实施补料发酵生产纤维素酶的方法。该方法培养基成本低、所产纤维素酶活力高,同时解决了制浆废液造成的环境污染问题。
本发明所述利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的方法,是将高产纤维素酶的丝状真菌做为生产菌株,按体积百分比2~15%的接种量将种子液接入发酵培养基,以温度为25~35℃,搅拌转速为150~400r/min,通风比为0.4~1.2vvm的条件进行发酵培养,pH和溶解氧由发酵罐控制单元测定并控制,在发酵过程中以恒定流加速率或者阶段性改变流加速率向发酵罐中补加造纸厂亚硫酸铵法制浆时产生的废液诱导产酶和补充养分,其中在发酵过程中设定间隔一定时间取样,测定酶活力、还原糖浓度并依据在发酵过程中取样测定的还原糖浓度来调整废液的流加速度,培养120~180h后当滤纸酶活不再增加或呈现下降趋势时发酵结束放罐,即获得含纤维素酶的发酵液;
其特征在于:
所述高产纤维素酶的丝状真菌是以草酸青霉(Penicillium.oxalicum)RE-10或者里氏木霉(Trichoderma reesie)SN1为代表的纤维素酶生产菌株;
所述发酵培养基的组成是以废弃纤维素木糖渣和廉价天然原料麸皮、豆饼粉为主要组成成分,其配方为:木糖渣18~22g/L,微晶纤维素5~7g/L,麸皮45~50g/L,豆饼粉8~12g/L,硫酸铵2~4g/L,硝酸钠2~3g/L,尿素0.5~1g/L,磷酸二氢钾2~4g/L,硫酸镁0.4~0.6g/L,加蒸馏水定容到1L;
所述造纸厂亚硫酸铵法制浆时产生的废液是指造纸厂采用亚硫酸铵法进行制浆时,在从植物纤维原料分离出纤维的蒸煮过程中产生的棕黑色液体,其组分中至少含有80~120g/L的半纤维素、30~50g/L葡聚糖和20~40g/L的单糖;
所述以恒定流加速率向发酵罐中补加造纸厂亚硫酸铵法制浆时产生的棕黑色废液的流加速率是0.1~5mL/L/h,流加的起始时间为发酵前期0~120h;
所述阶段性改变流加速率向发酵罐中补加造纸厂亚硫酸铵法制浆时产生的棕黑色废液的方法是:接种之后,在前10h以0.1mL/L/h速率流加废液,随后每10h将流加的速率提高一倍,在50h后黑液所述废液的流加速率达到3.2mL/L/h,维持3.2mL/L/h的流加速率不变,持续流加废液补料至100h;
所述依据在发酵过程中取样测定的还原糖浓度来调整废液的流加速度中,当测得测定的还原糖浓度应控制在低于10mg/L以下时,维持原废液的流加速率;当测得的还原糖浓度在10mg/L以上时,减慢原废液的流加速率,使再次取样测定的还原糖浓度在10mg/L以内。
上述利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的方法中:所述高产纤维素酶的丝状真菌优选是草酸青霉(P.oxalicum)Re-10或者里氏木霉(T.reesei)SN1。
上述利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的方法中:所述以恒定流加速率向发酵罐中补加造纸厂亚硫酸铵法制浆时产生的废液的流加速率优选是1mL/L/h。
上述利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的方法中,利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的条件优选是:种子液接入发酵培养基接种之后,发酵温度控制在30℃,通风比0~12h控制在0.5,12~24h后控制在0.75,24~36h后控制在1,搅拌转速优选控制在300r/min。
本发明公开的利用亚硫酸铵法制浆废液补料发酵生产纤维素酶的方法,利用制浆废液中含有的半纤维素、葡聚糖诱导微生物分泌纤维素酶,能够进行连续性的补料操作。通过优化补料工艺,得到了较高的纤维素酶活力及得率,降低了生产成本,并且解决了制浆废液造成环境污染的难题,有望在工业生产中得到广泛应用。
附图说明
图1:亚硫酸铵法制浆废液中各种单糖及多糖的浓度。
图2:利用草酸青霉以0.5mL/L/h恒速流加制浆废液进行补料发酵生产纤维素酶过程中产酶、溶氧及pH的变化曲线。
图3:利用草酸青霉以1mL/L/h恒速流加制浆废液进行补料发酵生产纤维素酶过程中产酶、溶氧及pH的变化曲线。
图4:利用草酸青霉变速流加制浆废液补料发酵生产纤维素酶过程中产酶、溶氧及pH的变化曲线。
图5:利用里氏木霉分批发酵生产纤维素酶过程中产酶、溶氧及pH的变化曲线。
图6:利用里氏木霉以溶氧反馈控制流加制浆废液补料发酵生产纤维素酶过程中产酶、溶氧及pH的变化曲线。
具体实施方式
下面结合实施例对本发明保护内容作进一步阐述。实施例中所描述的内容仅用于说明本发明,而不应当也不会限制本发明权利要求所述的保护范围。
实施例1:利用草酸青霉以0.5mL/L/h速率恒速流加制浆废液进行补料发酵生产纤维素酶
采用的生产菌株草酸青霉(Penicillium oxalicum)可以为经过诱变选育或基因改造过的高产菌株。如P.oxalicum A10为经过多轮诱变筛选后又经亚铵废液驯化过的高产菌株P.oxalicum Re-10,该菌株是以野生菌株P.oxalicum 114-2为出发菌株,依次进行用gpdA启动子过表达clrB、敲除bgl2、敲除creA三步基因操作得到的基因重组菌株。这些菌株均适用于流加制浆废液补料发酵生产纤维素酶。
制浆废液选择山东泉林纸业有限责任公司在采用亚硫酸铵法进行蒸煮制浆过程中产生的棕黑色废液,采用高效液相色谱对制浆废液中含有的各种单糖及多糖的浓度进行了分析,结果见图1。制浆废液中所含葡萄糖为6.483±0.349g/L,木糖为14.483±1.577g/L,阿拉伯糖为3.190±0.248g/L,葡聚糖为35.009±1.759g/L,木聚糖为76.468±4.249g/L,阿拉伯木聚糖为16.843±1.611g/L。
将甘油冻存管保存的P.oxalicum Re-10孢子悬液接种于麸皮斜面培养基,在30℃条件下培养4~5天。随后用无菌生理盐水洗下孢子,按106个孢子/mL的比例接种种子培养基,在30℃条件下培养36~48h,做为用于接种发酵罐的种子。所述种子培养基的组成为:葡萄糖10g/L,硫酸铵2g/L,磷酸二氢钾3g/L,硫酸镁0.5g/L,蛋白胨10g/L,木糖渣10g/L,麸皮10g/L。
在发酵罐中进行补料发酵,发酵罐容积为7.5L,初始装液量为4.5L,发酵培养基的组成为:木糖渣20g/L,微晶纤维素6g/L,麸皮46.5g/L,豆饼粉10g/L,硫酸铵2g/L,硝酸钠2.8g/L,尿素1g/L,磷酸二氢钾3g/L,硫酸镁0.5g/L,121℃灭菌30min。按10%接种量接入0.5L培养好的种子,发酵温度控制在30℃,通风比0~12h控制在0.5,12~24h后控制在0.75,24~36h后控制在1,搅拌转速控制在300r/min。在接种之后,以0.5mL/L/h速率流加制浆废液,补料时间持续100h。
每隔12h对发酵罐取样,测定发酵液的滤纸酶活、内切纤维素酶活、外切纤维素酶活、β-葡萄糖苷酶活以及蛋白浓度、还原糖浓度等指标。
测定滤纸酶活(FPA)和内切纤维素酶活力(EG)的底物分别为Whatman 1号滤纸和羧甲基纤维素钠(CMC-Na),在50±0.1℃,pH 4.8条件下每分钟水解产生出相当于1μmol葡萄糖的还原糖量定义为1个酶活力单位(IU)。测定外切纤维素酶(ρNPCase)和β-葡萄糖苷酶(ρNPGase)的底物分别为4-nitrophenyl-β-D-cellobioside(ρNPC)和4-nitrophenyl-β-D-glucopyranoside(ρNPG),在50±0.1℃,pH 4.8条件下反应30min,用150μL浓度为10%的Na2CO3终止反应,每分钟水解产生1μmol对硝基酚所需的酶量定义为1个酶活力单位(IU)。蛋白浓度的测定采用Bradford试剂法,还原糖的测定采用DNS法。
发酵过程中酶活及蛋白浓度、还原糖等指标的变化见图2。
结果显示:在发酵144h时,FPA达到最高为14.58IU/mL,EG、ρNPCase、ρNPGase分别为37.68IU/mL、1.66IU/mL、2.45IU/mL;蛋白浓度为7.05mg/mL,每mg蛋白具有FPA为2.07IU。
实施例2:利用草酸青霉以1mL/L/h速率恒速流加制浆废液进行补料发酵生产纤维素酶
使用高产纤维素酶的草酸青霉(Penicillium oxalicum)做为生产菌株,进行补料发酵生产纤维素酶。制浆废液选用山东泉林纸业有限责任公司在采用亚硫酸铵法进行蒸煮制浆过程中产生的黑色废液。
种子培养条件同实例1。在发酵罐中进行补料发酵,发酵罐容积为7.5L,初始装液量为4.5L。按10%接种量接入0.5L培养好的种子,发酵温度控制在30℃,通风比0~12h控制在0.5,12~24h后控制在0.75,24~36h后控制在1,搅拌转速控制在300r/min。在接种之后,以1mL/L/h速率流加制浆废液,补料时间持续100h。
每隔12h对发酵罐取样,测定发酵液的滤纸酶活、内切纤维素酶活、外切纤维素酶活、β-葡萄糖苷酶活以及蛋白浓度、还原糖浓度等指标。
测定滤纸酶活(FPA)和内切纤维素酶活力(EG)的底物分别为Whatman 1号滤纸和羧甲基纤维素钠(CMC-Na),在50±0.1℃,pH 4.8条件下每分钟水解产生出相当于1μmol葡萄糖的还原糖量定义为1个酶活力单位(IU)。测定外切纤维素酶(ρNPCase)和β-葡萄糖苷酶(ρNPGase)的底物分别为4-nitrophenyl-β-D-cellobioside(ρNPC)和4-nitrophenyl-β-D-glucopyranoside(ρNPG),在50℃±0.1,pH 4.8条件下反应30min,用150μL浓度为10%的Na2CO3终止反应,每分钟水解产生1μmol对硝基酚所需的酶量定义为1个酶活力单位(IU)。蛋白浓度的测定采用Bradford试剂法,还原糖的测定采用DNS法。
发酵过程中酶活及蛋白浓度、还原糖等指标的变化见图3。
结果显示:在发酵144h时,FPA达到最高为16.12IU/mL,EG、ρNPCase、ρNPGase分别为38.37IU/mL、1.57IU/mL、2.25IU/mL;蛋白浓度为7.59mg/mL,每mg蛋白具有FPA为2.12IU。
实施例3:利用草酸青霉变速流加制浆废液进行补料发酵生产纤维素酶
使用高产纤维素酶的草酸青霉(Penicillium oxalicum)做为生产菌株,进行补料发酵生产纤维素酶。制浆废液选用山东泉林纸业有限责任公司在采用亚硫酸铵法进行蒸煮制浆过程中产生的黑色废液。
种子培养条件同实例1。在发酵罐中进行补料发酵,发酵罐容积为7.5L,初始装液量为4.5L。按10%接种量接入0.5L培养好的种子,发酵温度控制在30℃,通风比0~12h控制在0.5,12~24h后控制在0.75,24~36h后控制在1,搅拌转速控制在300r/min。在接种之后,在前10h以0.1mL/L/h速率流加制浆废液,随后每10h将流加的速率提高一倍,在50h后制浆废液的流加速率达到3.2mL/L/h,维持3.2mL/L/h的流加速率不变,持续补料至100h。每隔12h对发酵罐取样,测定发酵液的滤纸酶活、内切纤维素酶活、外切纤维素酶活、β-葡萄糖苷酶活以及蛋白浓度、还原糖浓度等指标。
测定滤纸酶活(FPA)和内切纤维素酶活力(EG)的底物分别为Whatman 1号滤纸和羧甲基纤维素钠(CMC-Na),在50±0.1℃,pH 4.8条件下每分钟水解产生出相当于1μmol葡萄糖的还原糖量定义为1个酶活力单位(IU)。测定外切纤维素酶(ρNPCase)和β-葡萄糖苷酶(ρNPGase)的底物分别为4-nitrophenyl-β-D-cellobioside(ρNPC)和4-nitrophenyl-β-D-glucopyranoside(ρNPG),在50±0.1℃,pH 4.8条件下反应30min,用150μL浓度为10%的Na2CO3终止反应,每分钟水解产生1μmol对硝基酚所需的酶量定义为1个酶活力单位(IU)。蛋白浓度的测定采用Bradford试剂法,还原糖的测定采用DNS法。
发酵过程中酶活及蛋白浓度、还原糖等指标的变化见图4。
结果显示:在发酵144h时,FPA达到最高为17.66IU/mL,EG、ρNPCase、ρNPGase分别为40.39IU/mL、1.77IU/mL、2.31IU/mL;蛋白浓度为7.50mg/mL,每mg蛋白具有FPA为2.35IU。
实施例4:利用里氏木霉以溶氧反馈控制流加制浆废液补料发酵生产纤维素酶
使用一株高产纤维素酶的里氏木霉(T reesei)SN1做为生产菌株,进行补料发酵生产纤维素酶。制浆废液选用山东泉林纸业有限责任公司在采用亚硫酸铵法进行蒸煮制浆过程中产生的黑色废液。
将甘油冻存管保存的T reesei SN1孢子悬液接种于麦芽汁斜面培养基,在30℃条件下培养6~7天。随后用无菌生理盐水洗下孢子,按106个孢子/mL的比例接种种子培养基,在30℃条件下培养36~48h,做为用于接种发酵罐的种子。所述种子培养基的组成为:葡萄糖25g/L,玉米浆干粉10g/L,磷酸二氢钾25g/L,硫酸铵7.5g/L,,硫酸镁1.5g/L,氯化钙0.75g/L。
在发酵罐中进行补料发酵,发酵罐容积为7.5L,初始装液量为4.5L,发酵培养基的组成为:玉米浆干粉10g/L,葡萄糖10g/L,微晶纤维素15g/L,硫酸铵4g/L,氯化钙1.6g/L,柠檬酸0.25g/L,硫酸锌0.04g/L,硫酸锰0.025g/L,硫酸亚铁0.175g/L,硫酸钾1.5g/L,121℃灭菌30min。按10%接种量接入0.5L培养好的种子,发酵温度控制在30℃,通风比0~12h控制在0.5,12~24h后控制在0.75,24~36h后控制在1,搅拌转速控制在300r/min。在接种之后,以溶氧为指标控制制浆废液的流加速度。当溶氧高于8%时,以2mL/L/h的速度向发酵罐中流加制浆废液,当溶氧低于8%时,停止流加。
每隔24h对发酵罐取样,测定发酵液的滤纸酶活、内切纤维素酶活、外切纤维素酶活、β-葡萄糖苷酶活以及蛋白浓度、还原糖浓度等指标。
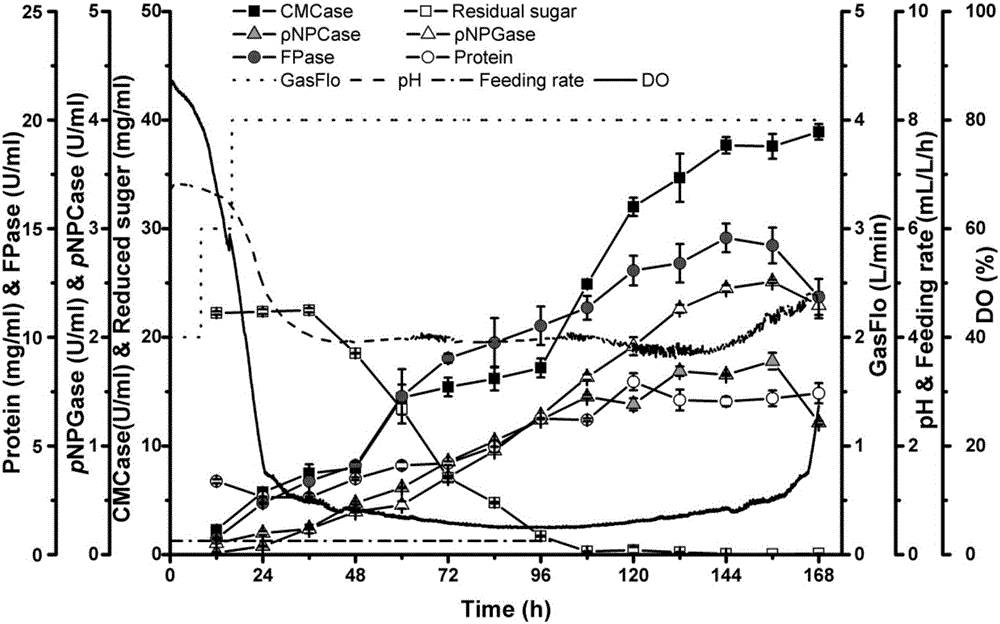
分批发酵过程中酶活及蛋白浓度、还原糖等指标的变化见图5。以溶氧反馈控制流加制浆废液补料发酵过程中酶活及蛋白浓度、还原糖等指标的变化见图6。
结果显示:在发酵144h时,FPA达到最高为3.69IU/mL,较分批发酵提高45%,EG、ρNPCase、ρNPGase分别为25.57IU/mL、0.53IU/mL、0.97IU/mL,分别较分批发酵提高21%、73%、39%;蛋白浓度为4.56mg/mL,每mg蛋白具有FPA为0.81IU。
- 还没有人留言评论。精彩留言会获得点赞!