膜微粒的制备及其在预防和治疗电离辐射导致的造血系统损伤和促进红系细胞分化中的应用的制作方法
本发明属于电离辐射导致的造血系统损伤的预防及治疗领域。更具体而言,本发明涉及制备膜微粒的方法以及膜颗粒在预防或治疗电离辐射导致的造血系统损伤以及促进红系细胞分化中的应用。
背景技术:
电离辐射是由直接或间接电离粒子使受作用物质发生电离现象的辐射。
电离辐射对机体的损伤可分为急性放射损伤和慢性放射损伤。机体大部分或全身短时间内暴露于相对高剂量辐射(对于人体高于1Gy)可引起机体的急性损伤。急性损伤平时见于核事故和放射治疗病人,通常称作放射病(radiation sickness)或急性放射综合征(acute radiation syndrome,ARS)。相对快速增殖的细胞及相应组织和器官易感辐射损伤。包括皮肤、造血系统、胃肠道系统、血管系统、生殖系统等在内的几乎所有器官、系统均易发生病理改变,其中以神经系统、造血系统和消化系统的改变最为明显。而较长时间内分散接受一定剂量的照射,可引起慢性放射性损伤,如皮肤损伤、造血障碍、白细胞减少、生育力受损等。另外,辐射还可以致癌和引起胎儿的死亡和畸形。
临床上用于预防或减轻辐射损伤的方法包括采用辐射防护剂、辐射缓解剂或辐射后治疗刺激组织再生[Bentzen,S.M.Preventing or reducing late side effects of radiation therapy:radiobiology meets molecular pathology.Nat.Rev.Cancer 2006,6,702-713.Coleman,C.N.;Stone,H.B.;Moulder,J.E.;Pellmar,T.C.Medicine.Modulation of radiation injury.Science 2004,304,693-694.Whitnall,M.H.;Pellmar,T.C.In:New directions in development of pharmacological countermeasures for the acute radiation syndrome;Research Signpost:Trivandrum,India,2007.Chao,N.J.Accidental or intentional exposure to ionizing radiation:biodosimetry and treatment options.Exp.Hematol.2007,35,24-27.Waselenko,J.K.;MacVittie,T.J.;Blakely,W.F.;Pesik,N.;Wiley,A.L.;Dickerson,W.E.;Tsu,H.;Confer,D.L.;Coleman,C.N.;Seed,T.;Lowry,P.;Armitage,J.O.;Dainiak,N.Medical management of the acute radiation syndrome:recommendations of the Strategic National Stockpile Radiation Working Group.Ann.Intern.Med.2004,140,1037-1051.]。然而,迄今仍无批准用于治疗ARS的药物。挽救造血衰竭是电离辐射损伤的关键治疗策略之一,包括采用造血生长因子或造血干细胞移植[Saha S,Bhanja P,Kabarriti R,Liu L,Alfieri AA,Guha C.Bone Marrow Stromal Cell Transplantation Mitigates Radiation-Induced Gastrointestinal Syndrome in Mice.PLoS One 2011;6:e24072.],但后者受制于合适供者的可获取性。
在再生疗法和免疫治疗的大背景下,间充质干细胞(mesenchymal stem/stromal cell,MSC)的治疗潜力及安全性被广为研究。已经有大量报道采用MSC用于各种临床试验及研究[Lalu,M.M.,McIntyre,L.,Pugliese,C.,et al.(2012).Safety of cell therapy with mesenchymal stromal cells(SafeCell):a systematic review and meta-analysis of clinical trials.PloS One,7,e47559.]。总的来看,MSC可通过其旁分泌机制发挥有益的治疗作用,其核心机制在于包含生物活性成分的膜微粒或微泡(microvesicle(MV),也称为外泌体(exosome)或微颗粒(microparticle))。
MV包括来自于胞内内涵体(endosome)的外泌体(exosome)以及来自于细胞质膜的脱落囊泡,前者大小一般为40~100nm,后者大小一般为100nm~1um。MV可通过表面受体相互作用以及转移传递蛋白、mRNA和miRNA等参与细胞间通讯和调节靶细胞活动,包括血管生成[Lee,J.K.,Park,S.R.,Jung,B.K.,et al.(2013).Exosomes derived from mesenchymal stem cells suppress angiogenesis by downregulating VEGF expression in breast cancer cells.PloS One,8,e84256.]、细胞增殖[Looze,C.,Yui,D.,Leung,L.,et al.(2009).Proteomic profiling of human plasma exosomes identifies PPARgamma as an exosomeassociated protein.Biochemical and Biophysical Research Communications,378,433–438.]和免疫调节[Robbins,P.D.,&Morelli,A.E.(2014).Regulation of immune responses by extracellular vesicles.Nature Reviews Immunology,14,195–208.]等。已有报道表明,MV可应用于急性肾损伤、心肌梗死、肝纤维化、肺动脉高压、后肢缺血、肿瘤生长抑制等[Akyurekli C,Le Y,Richardson RB,Fergusson D,Tay J,Allan DS.A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles.Stem Cell Rev.2015,11(1):150-60.]。但迄今未有MV用于预防及治疗电离辐射损伤的报道。
此外,现有膜微粒制备技术如超速离心技术(UC)、密度梯度离心技术(DGC)、高效液相色谱技术(HPLC)等均需要精密昂贵仪器设备,并且工艺步骤繁琐,有效处理体积极小,效率低下。因此,在本领域中,存在对于快速高效制备膜微粒的方法的需求。
技术实现要素:
本发明人出人意料地发现,间充质干细胞(MSC)、尤其是脐带间充质干细胞(umbilical cord mesenchymal stromal cells,UCMSCs)来源的MV可有效预防或治疗电离辐射所致造血系统损伤。因此,本发明旨在提供一种制备膜微粒的新方法,并采用该方法所制备的膜微粒用于电离辐射导致的造血系统损伤的预防与治疗。
miR-486是miRNA基因家族的成员。本发明人还发现,用转基因技术在造血细胞过表达miR-486后收集膜微粒,其miR-486的表达与对照细胞收集膜微粒相比明显升高。用过表达miR-486膜微粒处理造血细胞后可以促进造血红系分化能力。因此,本发明还旨在提供一种诱导红系分化的新方法。
为了实现上述发明目的,本发明涉及如下技术方案。
在第一个方面,本发明涉及一种制备膜微粒的方法,所述方法包括用聚乙二醇即PEG处理细胞培养物的上清。
在一个实施方案中,本发明的方法包括以下步骤:
a)收集细胞培养物上清;
b)将所述培养物上清离心;
c)收集并用聚乙二醇即PEG处理步骤b)中经离心的上清;
d)离心步骤c)所获得的上清,并弃去经离心的上清,保留沉淀;
e)用无血清培养基重悬沉淀,获得膜微粒。
在优选的实施方式中,所述细胞为间充质干细胞或成纤维细胞或造血细胞。
在优选的实施方案中,在步骤a)之前进一步包括诱导细胞凋亡以释放膜微粒的步骤。在进一步优选的实施方案中,该诱导步骤包括在低氧低营养条件下培养细胞例如间充质干细胞或成纤维细胞或造血细胞。
在优选的实施方案中,在步骤b)和d)中各自独立地采用转速小于或等于10,000rpm的低速离心机进行离心。
在优选的实施方案中,步骤b)和d)中各自独立地以2,000rpm至10,000rpm、2,500rpm至8,000rpm、2,600rpm至7,000rpm、2,700rpm至6,000rpm、2,800rpm至5,000rpm、2,900rpm至4,000rpm、或3,000rpm至3,500rpm的速度离心。
在优选的实施方案中,步骤b)中在约4℃离心5-15分钟,例如10分钟。在优选的实施方案中,在步骤d)中在约4℃离心25-35分钟,例如30分钟。
在优选的实施方案中,PEG的分子量范围为2000-8000。在进一步优选的实施方案中,PEG选自由下列组成的组:PEG8000、PEG7000、PEG6000、PEG5000、PEG4000、PEG3000和PEG2000。
在优选的实施方案中,在步骤c)中,以2:1至6:1的PEG/血清体积比加入PEG。在进一步优选的实施方案中,PEG/血清体积比为6:1、5:1、4:1、3:1或2:1。
在优选的实施方案中,所述间充质干细胞为脐带、脐带血、骨髓、胎盘组织、脂肪组织或牙髓间充质干细胞、或其组合。优选地,所述细胞培养物为脐带间充质干细胞。
在优选的实施方案中,无血清培养基为α-MEM无血清培养基。
在第二个方面,本发明涉及膜微粒在制备用于预防或治疗电离辐射导致的造血系统损伤的药物中的用途。
在优选的实施方案中,所述膜微粒获自间充质干细胞或成纤维细胞。在进一步优选的实施方案中,所述膜微粒获自脐带、脐带血、骨髓、胎盘组织、脂肪组织或牙髓间充质干细胞。在最优选的实施方案中,所述膜微粒获自脐带间充质干细胞。
在优选的实施方案中,所述膜微粒是经PEG处理的膜微粒。
在优选的实施方案中,所述膜微粒是通过本文所述的方法制备的。
在优选的实施方案中,所述膜微粒与另外的治疗剂联合应用。在进一步优选的实施方案中,另外的治疗剂选自包括激素、生长因子、细胞因子(包括但不限于粒细胞集落刺激因子(Granulocyte Colony Stimulating Factor,G-CSF)、巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、血小板生成素(thrombopoietin,TPO)、干细胞因子(stem cell fator,SCF)、白介素(interleukin、IL)、甲状旁腺素(parathyroid hormone,PTH)等);非细胞因子药物,包括但不限于5-雄烯二醇(5-Androstenediol,5ADE)、褪黑素(Melatonin)、染料木素(Genistein)、化合物CBLB502等;辐射防护剂(Radioprotector),包括但不限于阿米福汀(Amifostine);以及抗氧化剂,包括但不限于维生素E(Vitamin E)等。
在第三个方面,本发明涉及一种预防或治疗受试者中电离辐射导致的造血系统损伤的方法,所述方法包括向所述受试者施用预防或治疗有效量的本发明的膜微粒,优选经PEG处理的膜微粒。
在优选的实施方案中,所述造血系统损伤包括但不限于骨髓造血干细胞(HSC)耗竭;外周血白细胞、红细胞、血小板和/或血红蛋白水平低下;以及造血组织(例如肝脏、脾脏等)损伤等。
在优选的实施方案中,所述受试者为人。
在优选的实施方案中,采用治疗或预防有效量的膜微粒,例如但不限于,对于人而言,约0.75-20mg/kg体重,或者对于小鼠而言,0.75ug~10ug/g体重。
在优选的实施方案中,所述膜微粒与另外的治疗剂联合应用。
在第四个方面,本发明涉及膜微粒,其用于预防或治疗电离辐射导致的造血系统损伤。
在第五个方面,本发明涉及膜微粒在诱导造血细胞红系分化中的用途。在一个实施方案中,本发明涉及膜微粒在诱导造血细胞红系分化中的非治疗用途。在一个实施方案中,本发明涉及膜微粒在制备诱导造血细胞红系分化的药物中的用途。
在优选的实施方案中,膜微粒是经PEG处理的。在一个优选的实施方案中,膜微粒是通过本发明的方法制备获得的。
在优选的实施方案中,膜微粒获自造血细胞。在一个实施方案中,膜微粒获自TF-1细胞。
附图说明
图1显示电离辐射前后外周血白细胞(WBC)水平(N=9,*p<0.05)。
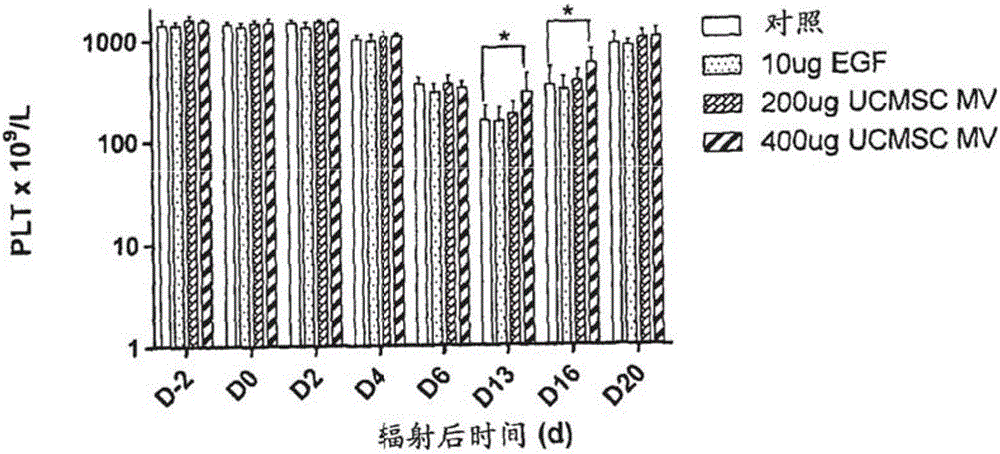
图2显示电离辐射前后外周血血小板(PLT)水平(N=9,*p<0.05)。
图3显示电离辐射前后外周血红细胞(RBC)水平(N=9)。
图4显示电离辐射前后外周血血红蛋白(HGB)水平(N=9)。
图5显示过表达miR-486膜微粒处理TF-1后miR-486的表达。
图6显示过表达miR-486膜微粒处理TF-1后的红系分化能力。
具体实施方式
在本文中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。
在一个方面,本发明涉及一种制备膜微粒的方法,所述方法包括用聚乙二醇即PEG处理细胞培养物的上清。
本发明人令人惊讶地发现,在提取膜微粒的过程中,采用PEG处理细胞培养物上清可简化膜微粒的制备工艺,从而无需精密昂贵的仪器设备例如超速离心机、高效液相色谱仪等。可用于本发明的PEG可以是分子量范围为2000-8000的PEG。优选地,PEG选自由下列组成的组:PEG8000、PEG7000、PEG6000、PEG5000、PEG4000、PEG3000和PEG2000。在优选的实施方案中,可以以2:1至6:1的PEG/血清(v/v)加入PEG。在进一步优选的实施方案中,PEG/血清体积比为约6:1、约5:1、约4:1、约3:1或约2:1。
在一个实施方案中,本发明的方法包括以下步骤:a)收集细胞培养物上清;b)将所述培养物上清离心;c)收集并用聚乙二醇即PEG处理步骤b)中经离心的上清;d)离心步骤c)所获得的上清,并弃去经离心的上清,保留沉淀;和e)用无血清培养基重悬沉淀,获得膜微粒。在一个优选的实施方案中,所述细胞为间充质干细胞或成纤维细胞或造血细胞。
在优选的实施方案中,在步骤a)之前进一步包括诱导细胞凋亡以释放膜微粒的步骤。在进一步优选的实施方案中,该诱导步骤包括在低氧低营养条件下培养细胞例如所述间充质干细胞或成纤维细胞或造血细胞。本领域技术人员能够容易选择可用于诱导细胞例如间充质干细胞或成纤维细胞或造血细胞凋亡的条件。例如,诱导步骤包括在细胞培养至约80%融合时,改变培养条件为无血清、低氧(94%N2、5%CO2和1%O2)培养72h。
取决于细胞类型和上清液体积,本领域技术人员能够选择合适的离心速度。例如,在优选的实施方案中,在步骤b)和d)中各自独立地采用转速小于或等于10,000rpm的低速离心机进行离心。例如,步骤b)和d)中各自独立地以2,000rpm至10,000rpm、2,500rpm至8,000rpm、2,600rpm至7,000rpm、2,700rpm至6,000rpm、2,800rpm至5,000rpm、2,900rpm至4,000rpm、或3,000rpm至3,500rpm的速度离心。
取决于细胞类型和上清液体积,本领域技术人员能够选择合适的离心操作温度和时间。例如,在优选的实施方案中,步骤b)中在约4℃离心5-15分钟,例如10分钟。在优选的实施方案中,在步骤d)中在约4℃离心25-35分钟,例如30分钟。
可用于步骤c)的PEG可以是分子量范围为2000-8000的PEG。优选地,PEG选自由下列组成的组:PEG8000、PEG7000、PEG6000、PEG5000、PEG4000、PEG3000和PEG2000。在优选的实施方案中,在步骤c)中,以2:1至6:1的PEG/血清体积比加入PEG。在进一步优选的实施方案中,PEG/血清体积比为6:1、5:1、4:1、3:1或2:1。
在优选的实施方案中,可用于本发明的间充质干细胞为脐带、脐带血、骨髓、胎盘组织、脂肪组织或牙髓间充质干细胞、或其组合。优选地,所述细胞培养物为脐带间充质干细胞。
在优选的实施方案中,可用于本发明的造血细胞为TF-1细胞、Mo7e细胞等。
在优选的实施方案中,步骤e)中无血清培养基可以为α-MEM无血清培养基。
本发明的方法所获得的膜微粒可采用本领域已知的方法进行鉴定,例如电镜观察,流式细胞术检测、动态光散射测定等。
在另一个方面,本发明涉及膜微粒在制备用于预防或治疗电离辐射导致的造血系统损伤的药物中的用途。造血系统损伤包括但不限于骨髓造血干细胞(HSC)耗竭;外周血白细胞、红细胞、血小板和/或血红蛋白水平低下;以及造血组织(例如肝脏、脾脏等)损伤等。
在优选的实施方案中,可用于本发明的膜微粒可以是获自间充质干细胞或成纤维细胞的膜微粒。优选地,膜微粒可获自脐带、脐带血、骨髓、胎盘组织、脂肪组织或牙髓间充质干细胞。最优选地,膜微粒获自脐带间充质干细胞。在优选的实施方案中,膜微粒可以是经PEG处理的膜微粒。可用于本发明的PEG可以是分子量范围为2000-8000的PEG。优选地,PEG选自由下列组成的组:PEG8000、PEG7000、PEG6000、PEG5000、PEG4000、PEG3000和PEG2000。在优选的实施方案中,可以以2:1至6:1的PEG/血清(v/v)加入PEG。在进一步优选的实施方案中,PEG/血清体积比为约6:1、约5:1、约4:1、约3:1或约2:1。在优选的实施方案中,膜微粒是通过本文所述的方法制备的。
本领域技术人员能够根据实际应用的情况确定本发明的膜微粒的治疗或预防有效量,例如根据膜微粒的来源、待治疗对象的年龄、体重、和疾病严重程度等因素,这在本领域技术人员的能力范围之内。例如但不限于,对于人而言,治疗或预防有效量可以为约0.75-20mg/kg体重;对于小鼠而言,治疗或预防有效量可以为0.75ug~10ug/g体重。
在优选的实施方案中,膜微粒还可以与另外的治疗剂联合应用。例如,另外的治疗剂选自包括激素、生长因子、细胞因子(包括但不限于粒细胞集落刺激因子(Granulocyte Colony Stimulating Factor,G-CSF)、巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、血小板生成素(thrombopoietin,TPO)、干细胞因子(stem cell fator,SCF)、白介素(interleukin、IL)、甲状旁腺素(parathyroid hormone,PTH)等);非细胞因子药物,包括但不限于5-雄烯二醇(5-Androstenediol,5ADE)、褪黑素(Melatonin)、染料木素(Genistein)、化合物CBLB502等;辐射防护剂(Radioprotector),包括但不限于阿米福汀(Amifostine);以及抗氧化剂,包括但不限于维生素E(Vitamin E)等。
在另一个方面,本发明涉及一种预防或治疗受试者例如人中电离辐射导致的造血系统损伤的方法,所述方法包括向所述受试者施用预防或治疗有效量的本发明的膜微粒,优选经PEG处理的膜微粒。在优选的实施方案中,所述造血系统损伤包括但不限于骨髓造血干细胞(HSC)耗竭;外周血白细胞、红细胞、血小板和/或血红蛋白水平低下;以及造血组织(例如肝脏、脾脏等)损伤等。可用于该治疗或预防方法的膜微粒可以为上文描述的膜微粒。
本领域技术人员能够根据实际应用的情况确定本发明的膜微粒的治疗或预防有效量,例如根据膜微粒的来源、待治疗对象的年龄、体重、和疾病严重程度等因素,这在本领域技术人员的能力范围之内。例如但不限于,对于人而言,治疗或预防有效量可以为约0.75-20mg/kg体重;对于小鼠而言,治疗或预防有效量可以为0.75ug~10ug/g体重。
在优选的实施方案中,所述膜微粒与可以与上文描述的另外的治疗剂联合应用。
本发明的膜微粒可以通过任何合适的方式来施用。示例性的施用方式包括但不限于,静脉内,动脉内,腹膜内,肺内,囊内,肌内,气管内,皮下,眼内,鞘内,透皮或局部施用。在某些优选的实施方案中,通过静脉注射来施用所述膜微粒。在某些优选的实施方案中,所述膜微粒被施用一次。在某些优选的实施方案中,所述膜微粒被施用多次。在某些优选的实施方案中,所述膜微粒以选自下述的频率施用:每天三次,每天两次,每天一次,每两天一次,每3天一次,或每周一次。
在另一个方面,本发明涉及膜微粒,其用于预防或治疗电离辐射导致的造血系统损伤。所述膜微粒可以是本文描述的膜微粒,例如经PEG处理的膜微粒,或者通过本发明的制备方法获得的膜微粒。
在又一个方面,本发明涉及膜微粒在诱导造血细胞红系分化中的用途。在一个实施方案中,本发明涉及膜微粒在诱导造血细胞红系分化中的非治疗用途。在一个实施方案中,本发明涉及膜微粒在制备诱导造血细胞红系分化的药物中的用途。在优选的实施方案中,膜微粒是经PEG处理的。在一个优选的实施方案中,膜微粒是通过本发明的方法制备获得的。在优选的实施方案中,膜微粒可获自造血细胞。在一个实施方案中,膜微粒获自TF-1细胞。
本领域技术人员能够根据实际应用的情况确定本发明的膜微粒的促进分化有效量,例如根据膜微粒的来源、待治疗对象的年龄、体重、和疾病严重程度等因素,这在本领域技术人员的能力范围之内。例如但不限于,对于人而言,促进分化有效量可以为约0.75-20mg/kg体重;对于小鼠而言,促进分化有效量可以为0.75ug~10ug/g体重。
近年来,miRNA已被证明通过调控重要造血相关基因的表达参与血细胞生成调控,是造血生成的重要调节因素之一。大量文献显示miRNA与造血细胞红系分化相关,包括早期红系细胞的成熟和增殖,例如miR-15a、miR-16-1、miR-126、miR-144、miR-451以及miR-210[Bianchi N,Zuccato C,Gambari R,et al.Involvement of mi RNA in erythroid differentiation[J].Epigenomics,2012,4(1):51-65.]。miR-221和miR-222下调能够促进造血干/祖细胞向红系分化[Felli N,Fontana L,Pelosi E,et al.Micro RNAs 221and 222inhibit normal erythropoiesis and erythroleukemic cell growth via kit receptor down2modulation[J].Proc Natl Acad Sci USA,2005,102(50):18081218086.]。miRNA介导基因的表达,调控细胞增殖、分化和凋亡过程,在调节红细胞生成的不同阶段发挥作用。因此,不受限于理论,我们推测膜微粒可能通过miRNA调控红系分化,参与了造血损伤的修复。
现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
实施例
实施例中未指明其来源的试剂、试剂盒或仪器均为市场上商购可得的常规产品。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。
实施例1:膜微粒的提取和鉴定
按照表1所描述的细胞、PEG和条件,采用下述方法提取膜微粒并进行鉴定。收集脐带间充质干细胞、成纤维细胞或TF-1细胞培养上清,采用低速离心机以3000rpm、4℃离心10分钟,收集上清。按表1所示的比例分别加入PEG6000或PEG3000,混匀,4℃静置12小时。然后,采用低速离心机以3000rpm、4℃离心30分钟,弃上清。用适量α-MEM无血清培养基重悬沉淀,检测蛋白质浓度,于-80℃保存。
表1
任选地,在细胞培养至约80%融合时,改变培养条件为无血清、低氧(94%N2、5%CO2和1%O2)培养72h,以诱导细胞凋亡,释放膜微粒。
通过miRNA和蛋白质定量检测,发现通过本申请的方法获得的膜微粒与现有膜微粒制备技术如超速离心技术(UC)、密度梯度离心技术(DGC)、高效液相色谱技术(HPLC)所获得的膜微粒含量相当,并且不需要精密昂贵的仪器设备,工艺步骤简单,有效处理体积极小,效率高。
实施例2:膜微粒治疗辐射损伤c57BL小鼠
将36只8周龄、约20克的雌性c57BL小鼠随机分为对照组(注射αMEM)、EGF组(注射10ug EGF/只小鼠)、低剂量膜微粒组(每只注射200μg实施例1实验1获得的通过PEG6000纯化获得的膜微粒,以下称为200ug UCMSC MV组)、高剂量膜微粒组(每只注射400ug实施例1实验1获得的通过PEG6000纯化获得的膜微粒,以下称为400ug UCMSC MV组)。每组9只,分别称体重,眼眶采血并检测外周血中白细胞(WBC)、血小板(PLT)、红细胞(RBC)及血红蛋白(HGB)的水平。表2为实验动物分组及各组注射剂量。
表2实验动物注射剂量(/只,在200uLαMEM中)
48小时后(即D0),采用7Gy、102.36cGy/分钟辐射这四组小鼠6分钟50秒。辐射完毕后1小时对小鼠进行眼眶采血并检测外周血中白细胞(WBC)、血小板(PLT)、红细胞(RBC)及血红蛋白(HGB)水平。
小鼠眼眶采血后对各组分别进行腹腔注射200ug/只αMEM、10ug/只EGF、200ug/只UCMSC MV和400ug/只UCMSC MV。之后连续6天、即合计连续7天(D0~D6)每天按表2对各组分别进行腹腔注射。
自辐射完毕开始,分别在第0天(D0)、第2天(D2)、第4天(D4)、第6天(D6)、第13天(D13)、第16天(D16)和第20天(D20)进行眼眶采血并检测外周血中白细胞(WBC)、血小板(PLT)、红细胞(RBC)及血红蛋白(HGB)水平。
血常规主要检测指标为外周血白细胞(WBC)、血小板(PLT)、红细胞(RBC)及血红蛋白(HGB)水平。检测结果显示,与对照组、EGF组、低剂量膜微粒组(200ug UCMSC MV组)相比,高剂量膜微粒组(400ug UCMSC MV组)可明显治疗或恢复小鼠造血功能。结果见图1、2、3和4。
实施例3:过表达miR-486的膜微粒诱导TF-1细胞红系分化
过表达miR-486的TF-1膜微粒及其对照病毒TF-1膜微粒的获得
用5MOI过表达miR-486的慢病毒或者对照病毒感染TF-1细胞,48小时后收集细胞培养上清。通过实施例1的方法提取膜微粒。
采用常规方法提取所获得的过表达miR-486的TF-1膜微粒的RNA,并检测膜微粒中miR-486的表达。结果显示,过表达miR-486的TF-1膜微粒中miR-486表达明显升高(图5)。
TF-1细胞的处理
采用800ng的过表达miR-486的TF-1膜微粒及其对照病毒TF-1膜微粒处理TF-1细胞8天。
采用常规方法提取经膜微粒处理的TF-1的RNA,并检测其miR-486的表达。结果显示用过表达miR-486的TF-1膜微粒处理TF-1细胞8天后可以显著促进TF-1细胞中miR-486的表达。
经膜微粒处理的TF-1细胞的红系分化
将上述经膜微粒处理的TF-1细胞用PBS洗涤2遍后,与CD235a抗体避光温育。然后,采用流式细胞仪检测细胞表面CD235a的表达。结果显示,过表达miR-486的TF-1膜微粒处理TF-1细胞显著促进TF-1细胞CD235a的表达,从而证明了其具有促进TF-1细胞红系分化的能力(图6)。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和修改,这些改进和修改也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!