一种诱导绿藻持续放氢的光控基因开关系统及其应用的制作方法
本发明属于基因工程领域,涉及利用间断蓝光诱导调控绿藻连续光合放氢的基因开关系统及其在绿藻制氢转基因生物反应器中的应用。
背景技术:
氢气作为世界上最清洁的能源,是唯一能真正做到“零排放”的可再生能源。目前氢能的制备主要有三个来源:一是以煤炭、石油、天然气等碳氢化合物为原料制氢;二是利用电解水制备氢能;三是利用生物来制备氢能。由于煤炭、石油、天然气等资源逐渐枯竭,而电解水制氢需要消耗大量能源,因此生物制氢技术成为最具发展前景的制氢途径[Tumer J A.Sustainable hydrogen production.Science,2004,305:972-974.]。生物制氢研究始于十九世纪,最早在细菌和蓝藻中发现生物产氢的现象[Stephenson M,Stickland L H.Hydrogenase:a bacterial enzyme activating molecular hydrogen.Biochemistry Journal,1931,25:205-214.]。在1939年,Gafforn及其合作者首次发现栅藻利用其可逆氢酶能在光照条件下通过光合作用分解水产生的电子和氢离子合成氢气[Gaffron H.Reduction of carbon dioxide with molecular hydrogen in green algae.Nature,1939,143:204-205]。随后在许多绿藻(如莱茵衣藻、小球藻等)均发现光合放氢现象。由于这些绿藻能通过光合作用从自然界最丰富的资源(光和水)中获得氢能,而且绿藻中氢酶的活性高达蓝藻和光合细菌氢酶活性的100倍以上,绿藻产氢效率可以达到利用化石燃料等传统制氢技术的四倍以上,国际能源组织(IEA)在1998年的评估报告中,将绿藻光合制氢称为最具有应用前景的生物制氢技术[Carolyn CE.Annual Report of IEA,1998:15-31.]。
尽管绿藻光合制氢具有非常远大的应用前景,以美国能源部ASP项目(Aquatic Species Program)为代表的众多国际科研计划对藻类产氢进行了大量研究,但最后发现:绿藻光合放氢的机制主要是由绿藻氢酶介导,而绿藻氢酶活性受到光合放氧的抑制,只有将绿藻细胞氧气含量降低或者将产氧与产氢两个过程从空间或时间隔离,才能达到使绿藻细胞持续进行光合产氢的目标。这严重制约了绿藻光合制氢产业的发展前景。如何让绿藻细胞能够持续光合放氢?这是长期以来一直制约绿藻光合制氢技术发展的理论瓶颈问题。
美国国家可再生能源实验室(NREL)和加州大学伯克利分校的Melis小组于2000年在缺硫条件下培养莱茵衣藻时,发现光合放氧速率发生可逆下降现象,但线粒体的呼吸耗氧却不受影响,使封闭的莱茵衣藻生物反应器中的藻细胞处于厌氧环境,解除了衣藻光合放氧对氢酶的抑制作用,从而使持续放氢时间达到70小时以上,莱茵衣藻的放氢效率大大提高【Melis A,Zhang L,Forestier M et al.Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green algal Chlamydomonas reinhardtii.Plant Physiol.2000(22):127-135.】。进一步研究表明:当莱茵衣藻在缺硫条件下培养时,其藻细胞光合系统II(PSII)的活性受到抑制,进一步诱导呼吸耗氧,从而解除氧对绿藻氢酶的抑制,实现绿藻持续放氢过程。基于绿藻能在缺硫环境下持续放氢的理论,目前国际上设计出的绿藻光合制氢生物反应器均是使用两步交替法制氢,即在有硫培养基中生长,在去硫培养基中放氢,这样交替更换培养基来达到持续产氢的目的。然而,由于藻与培养基分离困难,将藻固定化后其生长和放氢能力又会大大下降,所以这种制氢途径没有产业化应用前景。
能否在不改变培养基的条件下让绿藻持续产氢?本专利发明人通过热激诱导人工microRNA调控PSII蛋白OEE2基因表达的途径,获得了能持续产氢的藻株[Hui Li,Li Zhang,Longfei Shu,Xiaoshan Zhuang,Yanmei Liu,Jun Chen,Zhangli Hu*.Sustainable photosynthetic H2-production mediated by artificial miRNA silencing of OEE2gene in green alga Chlamydomonas reinhardtii,International Journal of Hydrogen Energy 40(2015):5609-5616.]。但热激对藻细胞有损害作用,严重制约了绿藻的产氢效率。
技术实现要素:
本发明是针对绿藻持续放氢的理论问题,发明一种利用间断蓝光诱导调控绿藻连续光合放氢的基因开关系统,并利用该系统构建能够连续光合制氢的绿藻转基因生物反应器。
本发明的目的在于:(1)发明一种蓝光诱导绿藻持续放氢的光控基因开关系统,并将该系统应用于绿藻连续光合制氢转基因生物反应器的构建。本发明提供了光控基因开关各组件的基因序列与结构、各组件转入转基因藻的方法、绿藻光控基因开关系统的工作途径与具体应用。具体包括以下内容:
(1)一种诱导绿藻持续放氢的光控基因开关系统,该系统的元件包括光受体隐花色素CRY2基因及其相互作用蛋白CIB1基因、GAL4转录因子的DNA结合结构域和具有转录激活活性单纯疱疹病毒的激活域VP16、UAS转录激活序列、特异性靶向PSII复合体基因的miRNAs,其中CRY2与BD、CIB1与VP16及核定位序列NLS、UAS与miRNAs基因序列分别融合,并通过遗传转化整合到绿藻基因组。
(2)转基因绿藻持续放氢的光控基因开关系统的工作途径:正常光照下,藻细胞表达的CRY2-BD融合蛋白通过BD结构域与转基因藻核基因组DNA的UAS序列结合(CRY2-BD-UAS-miRNAs),而表达的CIB1-VP16融合蛋白则游离于核质中。由于绿藻氢酶受光合放氧抑制,正常情况绿藻只能持续几十秒放氢时间;当蓝光照射时,CRY2与CIB1发生相互作用,使游离于核质中的CIB1-VP16也结合在UAS上(CIB1-VP16-CRY2-BD-UAS-miRNAs),从而使具有转录激活活性单纯疱疹病毒的激活域VP16与UAS启动子序列发生相互作用,诱导其下游的miRNAs过表达,靶向抑制PSII核心蛋白基因表达,使绿藻PSII活性下调,藻细胞氧分压下降而使藻细胞放氢;持续一段时间后,为了保证藻细胞的生长和[H+]与电子的供应,停止蓝光照射,藻细胞miRNAs表达停止,使绿藻PSII恢复活性,藻细胞恢复正常生理活动。通过连续间断蓝光诱导,始终控制藻细胞内氧分压而保持氢酶活性,从而达到藻细胞能够连续放氢。
(3)本发明的诱导绿藻持续放氢的光控基因开关系统中miRNA的序列,可以是1个或多个,从而达到控制PSII复合体1个或多个靶向蛋白活性的目的。所述miRNAs包括靶向目标基因的人工miRNA或内源miRNA。
(4)一种诱导绿藻持续放氢的光控基因开关系统,诱导调控的方式包括蓝光与红光、白光与红光、蓝光与黑暗等交替照射或通过自动设置的连续间断蓝光照射途径,其蓝光、红光、白光照射及黑暗时间可根据藻细胞放氢特性及放氢效率进行设置。
(5)一种诱导绿藻持续放氢的光控基因开关系统,其绿藻为以莱茵衣藻(Chlamydomonas reinhardtii)为代表的真核绿藻,该系统可以在生物制氢技术开发与装置研制中的应用。
本发明专利的有益效果包括:
(1)目前使用“两步法”绿藻连续光合制氢技术,需要间断更换藻细胞的正常培养基和缺硫培养基。由于藻液分离困难,严重制约该技术发展。本专利在不更换培养基的前提下,只需要间断蓝光照射,就可以达到绿藻连续放氢的目标。操作方便,适宜规模化绿藻光合制氢。
(2)本发明专利使用miRNA调控途径,可以同时对影响绿藻光合制氢的多个基因进行同时调控,调控效率高;同时由于miRNA对蓝光诱导反应时间短,可逆反应时间只需几分钟,可以实现绿藻细胞连续高效光合放氢。
(3)蓝光诱导连续光合放氢解决了热激或强光等诱导因素本身对绿藻细胞的伤害,延长了藻细胞光合放氢的周期,具有明显的优势。
附图说明
图1为莱茵衣藻持续放氢光控基因开关系统的表达载体结构示意图;ble和Hyg分别代表博来霉素zeocin和潮霉素Hygromycin的抗性筛选标记基因。
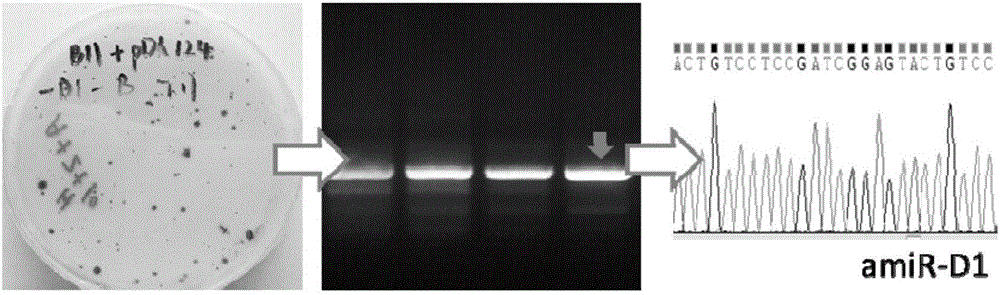
图2为具有持续放氢光控基因开关系统的转基因藻株的筛选示意图;用amiRNA前体引物进行PCR验证,条带大小正确的切胶后测序验证。
图3为amiRNA-D1影响产氢的效率分析示意图;纵坐标为产氢效率,单位为微升氢气每毫克叶绿素。双星号表示两藻株产氢效率有极显著差异。
图4为转基因藻株产氢效率分析示意图;利用气象色谱法检测藻液的产氢量。上一组为表达了靶向D1蛋白编码基因的人工miRNA的转化子,下一组为对照组的CC-849。转化子amiR-D1和对照组CC-849都做了三个独立的重复。纵坐标为蓝光处理时间。虚线为产氢量平均值曲线。
具体实施方式
下面结合附图和具体的实施例对本发明的技术方案做进一步介绍:
实施例1基于人工mcroRNA调控莱茵衣藻D1蛋白的持续放氢光控基因开关系统的主要元件
设计靶向莱茵衣藻PSII复合体的核心蛋白D1的人工mcroRNA,通过蓝光诱导调控这些人工mcroRNA的表达,调节D1蛋白的生物学活性,进而调控光解水反应进程,控制藻细胞内氧分压在较低的水平,从而使莱茵衣藻氢酶维持较高的活性而持续光合放氢。
该系统的主要组件包括:GAL4DNA binding domain(GAL4 BD),VP16,upstream activating sequence(UAS),CRY2,CIB1,5’PsaD,3’PsaD和amiRNA。amiRNA是指靶向D1蛋白设计的人工mcroRNA序列,将该序列替换掉高丰度表达的天然miRNA1162前体中的成熟RNA序列,可获得用于构建载体及转化的人工miRNA前体序列。GAL4 DNA binding domain是酵母转录激活蛋白GAL4的DNA结合域,VP16是具有转录激活活性单纯疱疹病毒的激活域,UAS是能与GAL4 DNA binding domain结合的上游激活DNA序列,CRY2是拟南芥的蓝光受体蛋白隐花色素(cryptochrome),CIB1是拟南芥的蓝光受体互作蛋白。5’PsaD是PsaD基因编码区之前的5’序列,是用于组成型启动GAL4DNA binding domain-CIB1和VP16-CRY2两个融合蛋白表达的启动子序列。3’PsaD是PsaD对应的3’区序列,对于外源序列的组成型高表达有重要作用。
GAL4 DNA binding domain序列是以酵母单杂交所使用的质粒pGBKT7的DNA为模板,使用高保真酶经由PCR扩增获得。VP16序列和UAS序列是通过基因全序列合成获得。CIB1和CRY2序列是以拟南芥的基因组DNA为模板,使用高保真酶经由PCR扩增获得。5’PsaD和3’PsaD序列是以莱茵衣藻的基因组DNA为模板,使用高保真酶经由PCR扩增获得。人工miRNA前体序列是通过基因全序列合成获得。
实施例2构建莱茵衣藻持续放氢光控基因开关系统的表达载体利用pBluescript SK载体的基础上,将莱茵衣藻持续放氢光控基因开关系统的主要元件组装到两个表达载体pBD-CIB1-Ble和pVP16-CRY2-UAS-amiRNA-Hyg。具体构建示意图如图1所示。
实施例3遗传转化及蓝光诱导持续光合产氢转基因藻的筛选
本实施例所选用的转基因受体为莱茵衣藻CC-849(购自美国Duke大学衣藻遗传中心,Durham,NC27708USA)。该藻株为细胞壁缺陷型品系。
本次转化选用了“珠磨法”。将莱茵衣藻在连续光照和TAP培养液中培养至对数期,细胞数约为1~2×106细胞/ml。5000转/分钟室温离心5分钟,收集藻细胞;用无菌的新鲜TAP培养液重悬藻细胞沉淀,调整细胞浓度至2×108细胞/ml;吸取300μl藻细胞悬浮液到1.5ml离心管里(内含无菌的0.3mm直径玻璃珠),分别加入1μg酶切成线状的载体DNA;把衣藻细胞/玻璃珠/外源DNA混合物在振荡器上以最高速振荡25秒;把混合液转移到含有10ml新鲜TAP培养基的离心管中,在100转/分钟摇床弱光下22℃培养20小时;3000转/分钟室温离心5分钟,收集细胞,弃上清;用500μl新鲜TAP培养液轻柔重悬细胞,加入3.5ml,40℃,0.5%琼脂的TAP培养基,混匀后均匀铺在含有10μg/ml的抗性固体平板上。置于22℃光照培养箱里倒置培养,直至长出绿色的单克隆。
首先,通过“珠磨法”将pBD-CIB1-Ble载体转入莱茵衣藻CC-849,通过zeocin抗性筛选得到绿色克隆后,通过转化子基因组DNA的PCR鉴定和PCR产物的测序得到真正的阳性克隆。以转化子基因组DNA为模板的PCR分别扩增了GAL4BD和CIB1的全长序列,并对产物条带进行了测序比对。
然后,在pBD-CIB1-Ble阳性藻株中再次通过“珠磨法”转入pVP16-CRY2-UAS-amiRNA-Hyg载体,通过Hygromycin B抗性筛选得到绿色克隆,再次通过转化子基因组DNA的PCR鉴定和PCR产物的测序得到同时含有BD-CIB1和VP16-CRY2-UAS-miRNA的阳性克隆。以转化子基因组DNA为模板的PCR分别扩增了VP16,CRY2和miRNA前体的全长序列,并对产物条带进行了测序比对。该zeocin和Hygromycin B双抗性藻株即为具有持续放氢光控基因开关系统的转基因藻株。
实施例4具有持续放氢光控基因开关系统的转基因藻株产氢效率
利用气象色谱法(GC)测定转基因藻产氢效率。首先将CC-849和转基因藻株都置于持续的白光下培养,由于全光谱的白光含有蓝光,因此对于转基因藻具有持续诱导的效果。在蓝光持续诱导amiRNA-D1表达的情况下,转化子的产氢效率有极显著的增高,结果见图3,这表明amiRNA-D1起到了调控产氢的作用。
为了验证光诱导的效率,将转基因藻置于缺乏蓝光的光照条件下生长(红光LED植物培养灯,峰值波长:660纳米,半宽度:17.9纳米,主波长:642.4纳米,色纯度:0.989),生长到对数生长期时,利用蓝光(波长约为450nm)诱导相关miRNA的表达,引起产氢量的增加。首先蓝光诱导4小时和8小时,测定产氢量后在红光恢复培养16小时,然后再蓝光重复诱导4小时,8小时和12小时,再次测定产氢量。实验结果表明,转化子蓝光诱导后产氢增加,经红光恢复培养后,再次蓝光诱导,产氢量再次上升。该结果证明本光控系统在绿藻体系中对产氢的诱导是有效的,并且可以反复诱导,以达到持续产氢的目的。
序列表
<110> 深圳大学
<120> 一种诱导绿藻持续放氢的光控基因开关系统
<160> 7
<210> 1
<211> 261
<212> DNA
<213> 人工序列
<220>
<221> CDS
<222> (1)...(261)
<223>
<400> 1
>VP16 AD
ATGGGCCCTA AAAAGAAGCG TAAAGTCGCC CCCCCGACCG ATGTCAGCCT GGGGGACGAG CTCCACTTAG ACGGCGAGGA CGTGGCGATG GCGCATGCCG ACGCGCTAGA CGATTTCGAT CTGGACATGT TGGGGGACGG GGATTCCCCG GGTCCGGGAT TTACCCCCCA CGACTCCGCC CCCTACGGCG CTCTGGATAT GGCCGACTTC GAGTTTGAGC AGATGTTTAC CGATGCCCTT GGAATTGACG AGTACGGTGG G
<210> 2
<211> 672
<212> DNA
<213> 人工序列
<400> 2
>GAL4 BD
AAGCTTGAAG CAAGCCTCCT GAAAGATGAA GCTACTGTCT TCTATCGAAC AAGCATGCGA TATTTGCCGA CTTAAAAAGC TCAAGTGCTC CAAAGAAAAA CCGAAGTGCG CCAAGTGTCT GAAGAACAAC TGGGAGTGTC GCTACTCTCC CAAAACCAAA AGGTCTCCGC TGACTAGGGC ACATCTGACA GAAGTGGAAT CAAGGCTAGA AAGACTGGAA CAGCTATTTC TACTGATTTT TCCTCGAGAA GACCTTGACA TGATTTTGAA AATGGATTCT TTACAGGATA TAAAAGCATT GTTAACAGGA TTATTTGTAC AAGATAATGT GAATAAAGAT GCCGTCACAG ATAGATTGGC TTCAGTGGAG ACTGATATGC CTCTAACATT GAGACAGCAT AGAATAAGTG CGACATCATC ATCGGAAGAG AGTAGTAACA AAGGTCAAAG ACAGTTGACT GTATCGCCGG AATTTGTAAT ACGACTCACT ATAGGGCGAG CCGCCATCAT GGAGGAGCAG AAGCTGATCT CAGAGGAGGA CCTGCATATG GCCATGGAGG CCGAATTCCC GGGGATCCGT CGACCTGCAG CGGCCGCATA ACTAGCATAA CCCCTTGGGG CCTCTAAACG GGTCTTGAGG GGTTTTTTGC GCGCTTGCAG CCAAGCTAAT TC
<210> 3
<211> 1839
<212> DNA
<213> 拟南芥种(Arabidopsis thaliana)
<400> 3
>CRY2(AT1G04400)
ATGAAGATGG ACAAAAAGAC TATAGTTTGG TTTAGAAGAG ACCTAAGGAT TGAGGATAAT CCTGCATTAG CAGCAGCTGC TCACGAAGGA TCTGTTTTTC CTGTCTTCAT TTGGTGTCCT GAAGAAGAAG GACAGTTTTA TCCTGGAAGA GCTTCAAGAT GGTGGATGAA ACAATCACTT GCTCACTTAT CTCAATCCTT GAAGGCTCTT GGATCTGACC TCACTTTAAT CAAAACCCAC AACACGATTT CAGCGATCTT GGATTGTATC CGCGTTACCG GTGCTACAAA AGTCGTCTTT AACCACCTCT ATGATCCTGT TTCGTTAGTT CGGGACCATA CCGTAAAGGA GAAGCTGGTG GAACGTGGGA TCTCTGTGCA AAGCTACAAT GGAGATCTAT TGTATGAACC GTGGGAGATA TACTGCGAAA AGGGCAAACC TTTTACGAGT TTCAATTCTT ACTGGAAGAA ATGCTTAGAT ATGTCGATTG AATCCGTTAT GCTTCCTCCT CCTTGGCGGT TGATGCCAAT AACTGCAGCG GCTGAAGCGA TTTGGGCGTG TTCGATTGAA GAACTAGGGC TGGAGAATGA GGCCGAGAAA CCGAGCAATG CGTTGTTAAC TAGAGCTTGG TCTCCAGGAT GGAGCAATGC TGATAAGTTA CTAAATGAGT TCATCGAGAA GCAGTTGATA GATTATGCAA AGAACAGCAA GAAAGTTGTT GGGAATTCTA CTTCACTACT TTCTCCGTAT CTCCATTTCG GGGAAATAAG CGTCAGACAC GTTTTCCAGT GTGCCCGGAT GAAACAAATT ATATGGGCAA GAGATAAGAA CAGTGAAGGA GAAGAAAGTG CAGATCTTTT TCTTAGGGGA ATCGGTTTAA GAGAGTATTC TCGGTATATA TGTTTCAACT TCCCGTTTAC TCACGAGCAA TCGTTGTTGA GTCATCTTCG GTTTTTCCCT TGGGATGCTG ATGTTGATAA GTTCAAGGCC TGGAGACAAG GCAGGACCGG TTATCCGTTG GTGGATGCCG GAATGAGAGA GCTTTGGGCT ACCGGATGGA TGCATAACAG AATAAGAGTG ATTGTTTCAA GCTTTGCTGT GAAGTTTCTT CTCCTTCCAT GGAAATGGGG AATGAAGTAT TTCTGGGATA CACTTTTGGA TGCTGATTTG GAATGTGACA TCCTTGGCTG GCAGTATATC TCTGGGAGTA TCCCCGATGG CCACGAGCTT GATCGCTTGG ACAATCCCGC GTTACAAGGC GCCAAATATG ACCCAGAAGG TGAGTACATA AGGCAATGGC TTCCCGAGCT TGCGAGATTG CCAACTGAAT GGATCCATCA TCCATGGGAC GCTCCTTTAA CCGTACTCAA AGCTTCTGGT GTGGAACTCG GAACAAACTA TGCGAAACCC ATTGTAGACA TCGACACAGC TCGTGAGCTA CTAGCTAAAG CTATTTCAAG AACCCGTGAA GCACAGATCA TGATCGGAGC AGCACCTGAT GAGATTGTAG CAGATAGCTT CGAGGCCTTA GGGGCTAATA CCATTAAAGA ACCTGGTCTT TGCCCATCTG TGTCTTCTAA TGACCAACAA GTACCTTCGG CTGTTCGTTA CAACGGGTCA AAGAGAGTGA AACCTGAGGA AGAAGAAGAG AGAGACATGA AGAAATCTAG GGGATTCGAT GAAAGGGAGT TGTTTTCGAC TGCTGAATCT TCTTCTTCTT CGAGTGTGTT TTTCGTTTCG CAGTCTTGCT CGTTGGCATC AGAAGGGAAG AATCTGGAAG GTATTCAAGA TTCATCTGAT CAGATTACTA CAAGTTTGGG AAAAAATGGT TGCAAATGA
<210> 4
<211> 1008
<212> DNA
<213> 拟南芥种(Arabidopsis thaliana)
<400> 4
>CIB1(AT4G34530)
ATGAATGGAG CTATAGGAGG TGACCTTTTG CTCAATTTTC CTGACATGTC GGTCCTAGAG CGCCAAAGGG CTCACCTCAA GTACCTCAAT CCCACCTTTG ATTCTCCTCT CGCCGGCTTC TTTGCCGATT CTTCAATGAT TACCGGCGGC GAGATGGACA GCTATCTTTC GACTGCCGGT TTGAATCTTC CGATGATGTA CGGTGAGACG ACGGTGGAAG GTGATTCAAG ACTCTCAATT TCGCCGGAAA CGACGCTTGG GACTGGAAAT TTCAAGAAAC GGAAGTTTGA TACAGAGACT AAGGATTGTA ATGAGAAGAA GAAGAAGATG ACGATGAACA GAGATGACCT AGTAGAAGAA GGAGAAGAAG AGAAGTCGAA AATAACAGAG CAAAACAATG GGAGCACAAA AAGCATCAAG AAGATGAAAC ACAAAGCCAA GAAAGAAGAG AACAATTTCT CTAATGATTC ATCTAAAGTG ACGAAGGAAT TGGAGAAAAC GGATTATATT CATGTTCGTG CACGACGAGG CCAAGCCACT GATAGTCACA GCATAGCAGA ACGAGTTAGA AGAGAAAAGA TCAGTGAGAG AATGAAGTTT CTACAAGATT TGGTTCCTGG ATGCGACAAG ATCACAGGCA AAGCAGGGAT GCTTGATGAA ATCATTAACT ATGTTCAGTC TCTTCAGAGA CAAATCGAGT TCTTATCGAT GAAACTAGCA ATTGTGAATC CAAGGCCGGA TTTTGATATG GATGACATTT TTGCCAAAGA GGTTGCCTCA ACTCCAATGA CTGTGGTGCC ATCTCCTGAA ATGGTTCTTT CCGGTTATTC TCATGAGATG GTTCACTCTG GTTATTCTAG TGAGATGGTT AACTCCGGTT ACCTTCATGT CAATCCAATG CAGCAAGTGA ATACCAGTTC TGATCCATTG TCATGCTTCA ACAATGGCGA AGCTCCTTCG ATGTGGGACT CTCATGTGCA GAATCTCTAT GGCAATTTAG GAGTTTGA
<210> 5
<211> 141
<212> DNA
<213> 人工序列
<400> 5
> Pre-amiRNA-D1
GCGGGGCCCT GACACCACTG CGGCCGCACC ACTAATCGGT ATTTGACGCC GCGCCTGGAC CCGAGGGAGG ACCCCTCGGG ACCCGGTACG TCGTCAAATA CCGATTACCG GCCTGGTCGC GGTGGGGTCA GGTCCTTCCG C
- 还没有人留言评论。精彩留言会获得点赞!
- 囊括气压传感模块和电磁阀驱动模块的光催化解水制氢装置、光触媒催化剂应用系统的制造方法
- 囊括气压传感模块的光催化应用装置、光触媒催化剂应用机械的制造方法
- 具有电磁阀驱动模块的光触媒催化解水系统、光催化环保装置的制造方法
- 包含电磁阀驱动模块的光催化应用设备、光触媒催化剂应用设备的制造方法与工艺
- 含有电磁阀驱动模块和电机控制模块的光催化解水制氢装置、光触媒催化剂应用机械的制造方法
- 应用于储能领域的含有电机控制模块的光触媒催化解水系统、光触媒催化剂应用模块的制造方法与工艺
- 一种灰色Bi2O2CO3光催化剂及其制备方法与制造工艺
- 一种乙酸自热重整制氢的固溶体催化剂及制备方法与制造工艺
- 一种重整氢氢解催化剂,其制备方法及应用与制造工艺
- 一种基于余热利用的制氢反应装置的制造方法