一种顺铂荧光配合物及其应用的制作方法
本发明属于生物化学领域,涉及一种顺铂荧光配合物,还涉及该顺铂荧光配合物在制备核苷酸和蛋白质探针中的应用。
背景技术:
荧光素是具有共轭双键体系化学结构的化合物,当受到特定波长光照射时,被激发成为激发态,从激发态恢复到基态过程中可发出荧光。荧光素的这一特性,被广泛运用于生物学和医学领域的检测中。荧光素在生物学和医学领域中的运用始于上世纪80年代末,目前,在生物学和医学领域,荧光素主要用于标记核苷酸和蛋白质。具体分述如下:
核苷酸(DNA,RNA)的荧光素标记技术,主要包括:(1)酶促生物素标记核酸法:主要是以生物素化的脱氧核苷三磷酸(Bio-11-dUTP,Bio–7–dATP、Bio-11-dCTP等)经DNA聚合酶作用掺入DNA。Bio-dUTP代替dTTP,Bio-dATP代替dATP,Bio-dCTP代替dCTP。(2)末端标记法:主要分为5’-磷酸的化学标记法和3’-OH的酶促标记法。5’-磷酸的化学标记法是在寡核苷酸上的5’-磷酸上接一个乙二胺,然后用琥珀酰亚胺生物素,将生物素基团连接在磷酸酰胺基上。3’-OH的酶促标记法是用末端转移法将Bio-11–dUTP加于其3’-OH端(脱去一个焦磷酸)。(3)酶标DNA法:使用辣根过氧化酶(HRP)或碱性磷酸酶(AP)作为标记试剂。通过对苯醌(PBQ)与聚乙烯亚胺(PEI)连接成(HRP-PBQ-PEI+),此试剂在戊二醛的作用下与变性的DNA结合,使HRP与DNA连接在一起,组成HRP标记的DNA探针。(4)酶标寡核苷酸法:包括核苷酸5’末端标记HRP法和内部标记AP法。核苷酸5’末端标记HRP法是在HRP中产生一个-HS反应基团,在寡核苷酸合成终了加在5’端,带一个C6的-HS基,与活化的HRP反应生成5’-HRP寡核苷酸。内部标记AP法是在全成寡核苷酸过程中将一个5’带连接臂及CF3基团的尿苷3’亚磷酰亚胺合成在寡核苷酸链中,合成后此活化的寡核苷酸与AP反应即得到AP标记的寡核苷酸。(5)DNA半抗原标记法:其原理与Bio-11-dTUP相同,只是用毛地黄甙代替生物素形成Dig–11-dUTP,酶促掺入DNA分子。用抗毛地黄甙抗体检测标记在DNA上的半抗原分子(地高辛)。
此外,常用的核苷酸链荧光标记技术主要包括缺口平移法和随机引物标记法两种。
其中,所述缺口平移法是指:在DNA合成酶的作用下,随机在双链DNA分子的一条链上随机切开若干个缺口,在3’—OH端逐个加入新的核苷酸,同时切除5’端游离的核苷酸,导致了新链合成缺口的平移,新链核苷酸的合成是以另一互补链为模板,按碱基互补的原则合成;在新链合成中用上述方法标记dNTP(dATP,dGTP,dCTP,dUTP),标记荧光的核苷酸就被掺入到新链中,达到核苷酸链标记目的。
其中,所述随机引物标记法是指:在Klenow酶催化下,通过随机引物结合目标核苷酸序列,以模板链为参照合成互补链的方法。在此过程中,用荧光素、生物素、半抗原(地高辛)等标记过的脱氧核苷三磷酸dNTP(dATP,dGTP,dCTP,dUTP)掺入到核苷酸新链中,从而使靶核苷酸链(DNA链)得以高效标记。
此外,蛋白质的标记主要是通过荧光素衍生化反应来实现的。其主要原理是,蛋白质结构中的一些功能性氨基酸基团与荧光素以共价键相连接,从而使目的蛋白质被标记。通常在以蛋白质氨基端作为衍生化位点,其上的氢原子在碱性条件下被荧光基团取代,且反应条件相对温和,因此,是目前常用的蛋白质标记方法。
目前,以上标记方法已被广泛应用于核酸和蛋白质标记的研究和医学诊断中,有些已作为临床诊断和评估的指标。例如:应用荧光原位杂交探针,原位杂交探针,抗体和蛋白质标记技术检测各种疾病中相关指标的改变。目前常用的荧光素一般为FITC,罗丹明等。但是,现有技术中的标记方法仍然存在标记效率不高、标记时间长和荧光强度不稳定等缺陷。
因此,如何设计并合成出一种新的配合物,使得其既能与荧光素相连接,又能与脱氧核糖核酸(DNA)、核糖核酸(RNA)、蛋白质牢固连接,以期用该配合物作为生物探针的连接主体,应用于目标DNA、RNA和蛋白质的检测。
技术实现要素:
针对上述现有技术中存在的缺陷与不足,发明人合成了一种新的以金属铂为骨架的配位化合物,并发明了以之为介导的核苷酸或蛋白质的标记新方法;该方法实现以金属铂为骨架的配位化合物为介导,牢固连接荧光素和靶分子(核苷酸或蛋白质),从而达到荧光标记的目的。
具体地,本发明第一方面提供了一种顺铂荧光配合物,具有如下结构式:
其中,n=3,4,5,6,7,8,9;
其中,Marker为标记基团,至少包括荧光素。
优选地,上述顺铂荧光配合物中,所述标记基团还包括:生物素和/或半抗原。其中,半抗原例如为地高辛。
值得说明的是,本发明所提供的顺铂荧光配合物中,金属Pt原子分别与3个氮原子和1个氯原子配位,当其与核苷酸或蛋白质相结合时,氯原子会被脱去而与核苷酸或蛋白质上的结合位点形成共价键。具体地,所述顺铂荧光配合物可以连接生物素,并连接地高辛等半抗原化合物,也可以直接连接荧光素(如罗丹明,FITC,DEAC,Cy5,Cy3),同时,可牢固地连接鸟嘌呤(Guanine)氮原子N7位点,产生共价键牢固结合,达到标记核酸链(DNA链,RNA链)的目的。基于上述特点,本发明所述的顺铂荧光配合物能用于对荧光原位杂交(Fluorescence in situ hybridization,FISH),原位杂交(in situ Hybridization,ISH),比较基因组杂交(comparative genomic hybridization,CGH)以及基因芯片中的核苷酸链进行荧光或者染料标记。而在所述顺铂荧光配合物与蛋白质结合时,具体的结合位点为:例如,所述顺铂荧光配合物与甲硫氨酸(Methionine),半胱氨酸(Cysteine)侧链上的硫原子形成共价键,和组氨酸(Histidine)分子上的氮原子形成稳定的化学结构。
优选地,上述顺铂荧光配合物中,所述标记基团选自以下A~I中的任一种:
本发明的第二方面,还提供了一种本发明第一方面所述顺铂荧光配合物在制备核苷酸和蛋白质探针中的应用。
本发明的第三方面,还提供了一种本发明第一方面所述顺铂荧光配合物在制备试剂盒中的应用,其中,所述试剂盒用于疾病的早期诊断、治疗随诊、预后或复发诊断。
本发明所提供的顺铂荧光配合物,既能与荧光素相连接,又能与脱氧核糖核酸(DNA)、核糖核酸(RNA)、蛋白质牢固连接,从而能够作为生物探针的连接主体,十分适用于目标DNA、RNA和蛋白质的检测。相较于现有技术中的标记方法,本发明所提供的顺铂荧光配合物用于核苷酸和蛋白质标记具有如下优点:(1)标记速度快:经多次实验表明,完成对DNA标记的平均时间不超过45分钟,完成对RNA标记的平均时间不超过20分钟,完成对蛋白质(抗体)标记的平均时间不超过30分钟;(2)操作步骤简单,避免使用传统的酶标记技术,操作条件不苛刻,使用方便;(3)对石蜡标本,福尔马林包埋组织的标记效果显著;(4)不受标记分子大小的限制,理论上对于Micro RNA(约20bp)至大片段核酸探针(>20kb)都能进行有效标记;不受标记混合体系的pH值的影响;可以广泛用于核苷酸、蛋白质(抗体)、核酸和蛋白质微阵列(Micro Arrays),比较基因组杂交等细分领域。
综上所述,所述顺铂荧光配合物在用于标记核苷酸或蛋白质时,显著提高了标记效率,缩短了标记时间并增加了荧光强度稳定性,取得了优异的标记效果;因此,本发明所提供的顺铂荧光配合物在核苷酸和蛋白质探针的制备、生物医药研发、疾病的诊断等领域具有良好的应用前景。
附图说明
图1显示了本发明所述的顺铂荧光配合物的结构式,并示出了其标记基团与用于连接核算或蛋白质的部位;
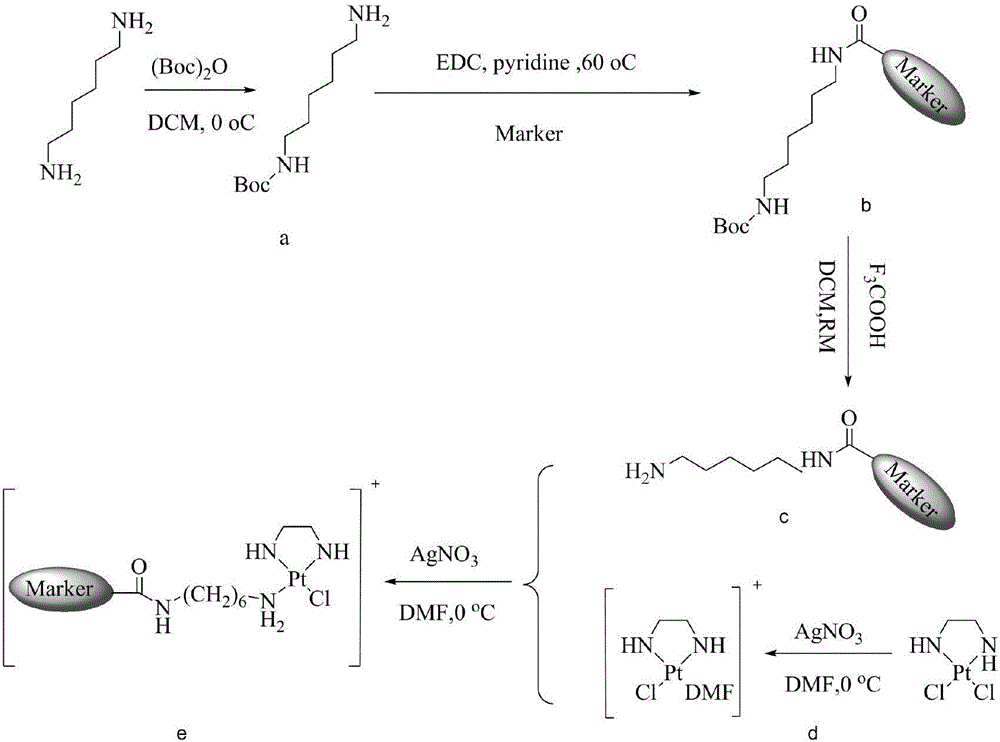
图2为n=6时本发明所述的顺铂荧光配合物的合成路线图;
图3为n=3,标记基团分别为E,C,G,I时,所述顺铂荧光配合物的浓度(X轴)与荧光强度(Y轴)的关系曲线图;
图4为n=6,标记基团分别为E,C,G,I时,所述顺铂荧光配合物的浓度(X轴)与荧光强度(Y轴)的关系曲线图;
图5为n=9,标记基团分别为E,C,G,I时,所述顺铂荧光配合物的浓度(X轴)与荧光强度(Y轴)的关系曲线图;
图6为所述顺铂荧光配合物结合生物素(n=6)、亲和素以及Cy5标记的荧光抗体进行标记后,所形成的生物素-亲和素-荧光抗体复合物的浓度(X轴)与荧光强度(Y轴)的关系曲线图;
图7为实施例4中所实施的铂-荧光素标记方法用于标记的荧光原位杂交探针在精子染色体中的荧光检测图;其中(1000倍油镜下),蓝色代表DAPI复染的精子核部分,红色代表精子Y染色体,绿色信号代表X染色体(原图为彩色,此处为灰度图);
图8为实施例5中所标记的精子的荧光检测图,其中(1000倍油镜下),绿色代表荧光染料FITC发出的荧光,荧光信号明亮,该荧光集中在精子尾部,精子头部较少染色(原图为彩色,此处为灰度图);
图9为实施例6对照组中的顺铂荧光配合物标记抗体标记膀胱癌T24细胞凋亡的显微图,其中,棕褐色表示凋亡细胞,蓝色表示正常细胞,因此可见凋亡细胞极少(原图为彩色,此处为灰度图);
图10为实施例6实验组中的顺铂荧光配合物标记抗体标记膀胱癌T24细胞凋亡的显微图,其中,棕褐色表示凋亡细胞,蓝色表示正常细胞,因此可见大量的凋亡细胞(原图为彩色,此处为灰度图)。
具体实施方式
下面结合具体实施方式对本发明作进一步阐述,但本发明并不限于以下实施方式。
实施例1
n=6时本发明所述的顺铂荧光配合物的合成
如图2所示的合成路线,具体步骤如下:
(1)以1,6-二氨基己烷作为起始反应物;首先将(Boc)2O(12.3g,0.056m ol)溶解在100mL二氯甲烷中,然后缓慢滴加溶有1,6-二氨基己烷(33g,0.28mol)的150mL二氯甲烷溶液,0℃下反应4小时,然后室温下反应20小时;反应完全后,用4×100mL饱和食盐水洗涤反应液,分液,有机相用无水硫酸钠干燥,减压蒸去溶剂,得到14.3g无色油状液体,即N-Boc-1,6-二氨基己烷(N-Boc-1,6-diaminohexane,中间体a),无需纯化,直接进行下一步反应。
(2)将[Pt(en)Cl2](500mg,1.53mmol)溶解在50ml DMF中,然后加入AgNO3(248mg,1.46mmol,0.95equiv),避光室温搅拌16小时,过滤除去AgCl,将化合物a(315mg,<0.8equiv)溶解在25mL正己烷中,加入到上述滤液中,40℃下反应过夜,减压除去溶剂,柱色谱分离纯化,得到白色粉末,即中间体b([Pt(II)(N-tert-Butoxycarbonyl-1,6-hexanediamine)(en)Cl](NO3))(650mg收率74%),1H NMR(D2O):δ=3.11(2H),2.71(4H),2.63(2H),1.69(2H),1.52(2H),1.46(9H),1.39(4H)ppm;195Pt-NMR:δ=-2625ppm。
(3)将化合物b(28mg,0.05mmol)溶解在2mL三氟乙酸中,50℃下过夜反应,然后用5M NaOH溶液调节到中性,过滤,干燥得到中间体c,将中间体c溶解在一定量的DMF中,加入1.2equiv EDC和三乙胺,室温下反应12小时,反应结束后柱色谱分离得到最终产物。
实施例2
本实验将铂与罗丹明,DEAC,gloxalic acid,FITC,TRITC,Alexa fluor 594等荧光素进行标记,并对荧光强度进行测定。结果提示顺铂为介导的配合物能与以上荧光素很好地结合,发射荧光。(本实验使用的顺铂荧光配合物的n=3,6,9)。将marker-Pt配位化合物溶解在0.1M三羟甲基氨基甲烷的缓冲溶液中,pH=7.1,室温下对荧光强度进行测定。有机顺铂荧光化合物(碳链长度分别是n=3,n=6,n=9)的荧光强度和配合物浓度之间的关系如图3~5所示。
我们还采用有机顺顺铂荧光配合物结合生物素,并且使用亲和素、标记Cy5的荧光抗体进行标记,形成生物素-亲和素-荧光抗体复合物,荧光信号得到显著放大。其结果见图6。
实施例3
采用本发明所述的顺铂荧光配合物制备核酸和蛋白质探针的实验
一、核苷酸标记方法
将100ug的纯化的靶核苷酸克隆与2ug纯化后的铂-生物素-荧光素(FITC,Cy5)标记物(本实验采用顺铂荧光配合物中的n=6)混合,80℃反应约40min(反应时间根据靶分子类型可做适当调整,RNA反应时间可以缩短至20min左右),吸出标记样本的混合物,经过上述醋酸纤维素液相分离柱,得到纯化的荧光素化的核苷酸序列。
二、蛋白质分子探针标记方法
将100ug的蛋白质(本实验所用为抗体IgG)与1ug纯化后的铂-生物素-荧光素(FITC,Cy5)标记物(本实验采用顺铂荧光配合物中的n=6)混合,37℃反应约20min后,吸出标记样本的混合物,经过液相分离柱,得到纯化的荧光素化的抗体(蛋白质)。
结构式如下:
其中,复合物中的Marker可以被异硫氰酸荧光素(fluorescein isothiocyanate,FITC),罗丹明(Rohdamine),四甲基异氰酸罗达明(tetrametrylrhodarnine isothiocyante,TRITC),Cy5,Cy3标记,该复合物也可以与半抗原类物质(如地高辛Digoxin)以及其他细胞染料等化合。
最终产物的分离和纯化:使用醋酸纤维素液相色谱分离柱,在均相条件下合成了醋酸纤维素,将其涂渍在修饰硅胶表面,制备涂渍型高效液相色谱固定相。将合成后的产物装入色谱柱,控制压力为40Mpa左右,高效液相色谱正相色谱条件下,对产物进行高效分离。
三、采用本发明所述的顺铂荧光配合物制备的标记探针实验结果
(1)评价标记手段:通过检测探针的荧光信号值(F),确定含有荧光基团的单核苷酸量(s),并以此计算出该种核苷酸的总量(n),最终可获得探针DNA的量(w)。以总的探针DNA的质量(w)、或以总的探针DNA的质量(w)除以模板mRNA或DNA的质量(r)的比值e来表示荧光标记效率,可表示为:w=4×324.5×n=1298×(mk+1)×s;e=(w/r)×100%=(1298×(mk+1)×s/r)×100%。(2)标记效率结果:将已被克隆纯化的人类乳腺癌Her-2基因,运用本发明标记技术(有机顺铂标记)标记法进行标记效率进行实验比较,实验组顺铂荧光配合物按照碳链长度分为n=3,n=6,n=9三组,每组共重复进行5次标记实验。实验结果用SPSS14.0软件进行统计分析。当碳链长度n=3时,顺铂荧光配合物标记效率达到(2.563±0.461)%;当碳链长度n=6时,顺铂荧光配合物标记效率达到(2.865±0.229)%;当碳链长度n=9时,顺铂荧光配合物标记效率达到(2.665±0.327)%,结果表明:顺铂荧光配合物(n=3,6,9)三组之间标记效率无显著差异(p>0.05)。
(3)标记时间结果:运用顺铂荧光配合物标记法对人类乳腺癌Her-2克隆基因进行标记,其中实验组顺铂荧光配合物按照碳链长度分为n=3,n=6,n=9三组。每组共重复进行5次标记实验。统计标记所需时间差异,结果用SPSS14.0软件进行分析。当碳链长度n=3时,顺铂荧光配合物标记方法所用的平均标记时间为(40±3.42)分钟;当碳链长度n=6时,顺铂荧光配合物标记方法所用的平均标记时间为(32.2±5.69)分钟;当碳链长度n=9时,顺铂荧光配合物标记方法所用的平均标记时间为(42.8±6.21)分钟。顺铂荧光配合物标记方法三组之间(碳链n=3,6,9时),三者差异有显著性(p<0.05),当碳链长度n=6时,标记时间更短。
(4)标记靶分子长度比较结果:采取X染色体着丝粒寡核苷酸重复序列和P53基因克隆进行铂-荧光素方法标记(采用碳链长度n=3,n=6,n=9三组进行实验)。X染色体探针序列长度42bp(5’GACGATGGAGTTAACTCAGGGAGCT GAACATTCGTTATGATG3’),P53基因长度约为20kb,按照(n=3,n=6,n=9)分3组对X着丝粒序列和P53基因分别标记,每组重复实验10次,并用FI TC标记的铂复合物进行标记反应,反应时间40min,温度82℃。反应完成后将混合物经过醋酸纤维素液相色谱柱,40Mpa高压分离过柱纯化。将纯化后的标记产物在紫外分光光度计检测下,控制检测波长480nm左右,统计吸光度,并按照上述评价标记手段进行标记长度结果统计。实验结果使用SPSS14.0软件分析。本发明方法对小片段的X染色体DNA探针标记率:当n=3时,标记效率达到(2.660±0.501)%;n=6时,标记效率达到(2.792±0.483)%;n=9时,标记效率达到(2.611±0.495)%。标记人类P53基因(>20kb)的标记效率:当n=3时,标记效率达到(2.632±0.596)%;当n=6时,标记效率达到(2.807±0.310)%,当n=9时,标记效率达到(2.718±0.441)%。n=3,6,9时,X着丝粒片段组相对P53组其标记效率均无统计学差异(p>0.05)。由此可见,该标记技术能高效标记核酸片段,并且不受片段长度影响。
实施例4
采用本发明所述顺铂荧光配合物介导标记的寡核苷酸荧光原位杂交探针检测人类精子染色体的试验(荧光原位杂交技术(FISH))
针对X,Y染色体着丝粒区域的高度串联重复片段(Satellite III,Alpha S atellite),设计DNA寡核苷酸探针序列,具体序列如下:
X染色体着丝粒序列
5’GACGATGGAGTTAACTCAGGGAGCTGAACATTCGTTATGATG3’
5’ATTTCTTTGGAATCGGGAGTCAATATTTCCACAG3’
Y染色体着丝粒序列
5’TCCATTGGAGTCAATTCTACGCTTTCGACACCCA3’
5’CCAGTCGAATCCATTCTGCAGAGTACATACC3’
5’CTGCATACAATTTCATGCCTCCATTCGTTCCCA3’
用合适的合成方法合成上述DNA序列(X,Y染色体),取合成产物(约2OD值),加100ul去离子水后与纯化的荧光素标记物混合,其中含Y染色体D NA序列用铂-罗丹明(红色)标记物1ug;含X染色体DNA序列用铂-FITC(绿色)标记物1ug(本实验采用所述顺铂荧光配合物中碳链长度n=6)。将混合物80℃反应40min,取出,进液相分离柱纯化待用。
将精子细胞常规固定,经过二硫苏糖醇(DTT),二碘水杨酸锂(LIS)处理后,于75℃下变性5min,取出经70%-80%-90%乙醇脱水,将标记的DNA探针经92℃变性10min后,20℃处理30min,取出,滴加于精子玻片杂交区域,封片,37℃杂交过夜。取出玻片,经过0.4×SSC/0.3%Nonidet-P40溶液清洗,梯度脱水,晾干,DAPI复染,荧光显微镜(Olympus BX51)观察。
结果显示:荧光信号明显,特异性高,无弥散信号,其中红色代表精子Y染色体着丝粒区域,绿色代表X染色体着丝粒区域,以铂为介导的复合物标记方法能够有效对DNA进行标记,且被标记的荧光探针同样具有较满意的荧光强度(见图7)。
实施例5
采用本发明所述的顺铂荧光配合物为介导的荧光素标记抗体,检测人类精子一种谷氨酸受体,N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)进行抗原抗体特异反应的试验(蛋白质抗体荧光标记)
自Sigma公司采购抗NMDA抗体,以及二抗。将100ug的二抗IgG与1u g纯化后的铂-生物素-FITC标记物混合(本实验采用所述顺铂荧光配合物中的n=6),37℃反应约20min后,吸出标记样本的混合物,40Mpa经过液相分离柱,得到纯化的荧光素化的抗体备用。
人类精子样品从21-43岁男子节欲3天后手淫获得。精子于37℃液化30分钟,检测到正常精子,在含4%多聚甲醛的磷酸盐缓冲液中固定30分钟,涂于明胶包被的载玻片上,干燥、固定。人类精子涂片用0.01M PBS洗涤,然后用含10%山羊或兔血清及0.1%Triton X-100的PBS缓冲液封闭以降低非特异性免疫染色。用初级抗体或作为阴性对照的正常非免疫血清4℃过夜,孵化后,涂片用PBS漂洗3次,并与已经标记好的相应的二抗(铂-FITC)结合,室温下孵化2小时,然后用PBS漂洗,最后涂片在荧光显微镜下检测并拍照。
结果显示:实验发现在精子尾部可清楚地观察到NR2B特异性的绿色荧光(FITC)但精子头部无免疫活性(见图8),说明NR2B受体主要存在于精子的尾部,从而证明铂介导的荧光标记技术同样能有效对蛋白质抗体进行标记。
实施例6
采用本发明所述顺铂荧光配合物为介导的荧光素标记抗体标记膀胱癌T24细胞凋亡的试验
取膀胱癌T24细胞,加入木黄酮40mg/L。分别于12、24、36、48h收获膀胱癌T24细胞,用TUNEL法检测凋亡细胞,观察木黄酮对T24细胞的影响,加药48h后收获细胞,离心、弃上清液。具体按试剂盒说明书进行操作,加入0.01mol/L PBS混匀,将细胞悬液滴于经二甲蓝处理的载玻片上,放置20min,载玻片放入4%多聚甲醛中过夜,PBS及双蒸水洗片3次,加标记缓冲液,室温下放置15min,加混合液及标记缓冲液;37℃于湿盒中标记60min,其中标记物为本发明的新化合物与地高辛-Pt-dUTP复合物(本实验采用所述顺铂荧光配合物中的n=6),常规封片,于光学显微镜下观察细胞并拍照,细胞染成棕褐色为凋亡细胞,蓝色为正常细胞。图9显示对照组活细胞呈蓝色,凋亡细胞极少;图10显示,实验组见大量染成棕色的凋亡细胞,该铂-复合物介导的标记手法同样可以用于组织化学染色,且能很好显色。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!