一种布鲁氏菌诊断标识作用的基因表达产物BLSJ‑2及其制备方法与流程
背景技术:
布鲁氏菌病(Brucellosis简称为布病)是由布鲁氏菌(Brucella)引起的人畜共患传染病。人感染布病主要来于患病动物及其产品。我国与人类布病有关的传染源主要是患病羊、牛,但以羊种布鲁氏菌危害最为严重(朱良全et al.微生物学通报,2015(01):171~177;吴清民.兽医导刊,2011(09):46~47)。
血清学方法是当前诊断动物布病的主要方法,而疫苗接种是预防动物布病的重要手段。布病已有的血清学诊断主要基于检测抗布鲁氏菌脂多糖抗体,由于我国现有动物布病疫苗株(S2、A19和M5)与野毒感染株均属于光滑型菌株,均诱导机体产生抗脂多糖抗体,因而无法通过现有血清学方法区分疫苗免疫和自然感染(毛开荣,等.动物布鲁氏菌病诊断技术.中国农业出版社,2014.)。
不过,强弱毒布鲁氏菌感染宿主后的血清学抗体应答出现明显差异,为从血清学上筛选区分自然感染与疫苗免疫的鉴别诊断抗原提供了一些背景和线索。如已有研究表明,强毒感染布鲁氏菌后,7天可检测到抗体,15天抗体水平达到最高,其凝集抗体滴度达到1:3000,随后开始下降,60天后抗体水平已经低于7天时的抗体水平,而240天后抗体为阴性(Gao XL.et al Turkish Journal of Veterinary and Animal Sciences,2015,39:271~278)。而布鲁氏菌疫苗S2免疫绵羊后,2周后开始检测到抗体,第30天抗体水平达到最高,其滴度为1:120,随后开始下降,至180天后抗体为阴性。上述显示的免疫与自然感染血清之间的差异信息为鉴别诊断点的筛选开辟了新思路。
据报道,膜蛋白占据病原微生物总蛋白质的大约30%~40%,不仅是治疗药物和疫苗开发的主要靶点所在,而且含有保护性抗原成分,因而成为布鲁氏菌诊断抗原和药物治疗靶点研究的重点对象(胡剑飞,等.疾病监测,2010(05):380~389;吴朔,等.免疫学杂志,2008(04):385~388)。由于免疫蛋白组学方法可显示蛋白血清学反应差异信息,并可运用生物信息学技术作为高通量筛选的技术平台,从膜蛋白中获取大量可能的鉴别诊断抗原信息,从而破解疫苗免疫与自然感染的难题。
技术实现要素:
本发明的目的是针对现有血清学方法无法区分布鲁氏菌疫苗免疫抗体和自然感染抗体难题,提供具有鉴别诊断价值的布鲁氏菌基因表达产物,运用免疫学方法,从而实现疫苗免疫抗体及自然感染抗体的鉴别诊断。
本发明技术方案
1.一种布鲁氏菌诊断标识作用基因的表达产物BLSJ-2,其特征在于:该产物是由布鲁氏菌S2株基因编号(GI)为490823642的基因,表达为“糖苷水解酶家族43(glycoside hydrolase family 43)”;该基因长度:1068bp;其表达产物的蛋白分子量约37.5kDa,其基因序列为基因序列1。
2.本发明所述的一种布鲁氏菌诊断标识作用基因的表达产物BLSJ-2的制备方法,其特征在于该方法包括以下步骤:
(1)基因筛选:从布鲁氏菌S2株基因组中,通过免疫蛋白组学方法,筛选鉴定出上述权利1的基因;
(2)基因表达:通过设计的引物(序列2和序列3),经过常规PCR克隆扩增,将其置于pGEX6p-1载体中诱导表达;
(3)表达产物纯化:通过谷胱甘肽S转移酶(GST)亲和层析柱与谷胱甘肽梯度洗脱法纯化表达产物,获得所需抗原,被命名为BLSJ-2。
3.本发明所述的一种布鲁氏菌诊断标识作用基因的表达产物BLSJ-2的应用,其特征在于将该基因PCR克隆扩增,其表达产物作为抗原。该抗原可作为区分动物布鲁氏菌疫苗免疫和自然感染血清检测抗原。
本发明的详细描述
1.鉴别诊断标识基因的筛选
(1)采用免疫蛋白组学技术,选择我国应用最广泛的布鲁氏菌疫苗株S2和我国布病影响严重的羊血清为研究对象,从S2株膜蛋白中筛选出鉴别诊断抗原基因信息。
(2)各用30份布病阴性健康羊(Nm)、30份S2免疫羊(Sm),以及30份临床布病感染羊阳性混合血清(Zm),分别与S2株膜蛋白二维电泳胶(2DE)进行免疫印迹(Western-blot),寻找S2膜蛋白与不同状态(感染/免疫/阴性)绵羊血清反应差异点,共寻找到113个差异蛋白点。选择免疫反应差异较大的30个蛋白点进行基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱鉴定及生物信息学分析,共鉴定出14个蛋白。
(3)将3种混合血清(感染/免疫/阴性)分别与S2膜蛋白进行免疫共沉淀(IP),并对IP结合物进行高通量质谱鉴定(Q-Exactive质谱仪)及生物学信息分析,获得182个候选蛋白点。对2种方法鉴定出的所有蛋白进行功能分析,共挑选出8个体外鉴别诊断的候选靶点。
(4)构建8个候选靶蛋白原核表达质粒,将表达蛋白分别与3种混合血清进行免疫印迹(Western-blot)和酶联免疫吸附测定(ELISA),筛选到一个具有鉴别诊断效果的基因(糖苷水解酶家族43,glycoside hydrolase family 43)鉴别诊断效果明显。
2.基因产物的表达
(1)培养繁殖布鲁氏菌S2株,提取其基因组。
(2)以序列2和序列3分别为上下游引物,按常规PCR方法进行基因扩增,
上游引物EcoRI:GAATTC为5’-aaGAATTCat gggtttcagc cgcaaac-3’27(序列2);
下游引物XhoI:CTCGAG为5’-atCTCGAGtc attttacggt ttccgcaag-3’29(序列3)。
(3)基因扩增条带,经在1%琼脂糖凝胶电泳中检测片段与预期的大小一致,并将获得的重组质粒送公司测序与美国国家生物技术信息中心(NCBI)上公布的基因序列进行比对,符合率为100%。
(4)筛选到的阳性重组质粒转化到商品化的E.coLi BL21(DE3)感受态细胞后,用1mM异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达,然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),其重组蛋白分子量大小分别与理论大小基本一致。
3.表达产物的纯化
(1)诱导表达的蛋白,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定为包涵体。
(2)将该包涵体经梯度脲素(4.5M、3.5M、2.5M、2M、1.5M、1M、0.5M、0M)的透析复性缓冲液于4℃,按常规方法进行梯度透析复性。
(3)运用谷胱甘肽S转移酶(GST)融合蛋白纯化柱按其说明书方法进行纯化。
4.表达产物作为诊断抗原的应用
将目的蛋白(糖苷水解酶家族43,glycoside hydrolase family 43)用谷胱甘肽S转移酶(GST)亲和层析柱纯化后获得的产物命名为BLSJ-2,作为酶联免疫吸附测定法(ELISA)包被抗原,对30份感染血清及656份免疫羊场血清样品进行检测,其建立的酶联免疫吸附测定法(ELISA)对感染样本检出率为87%。
附图说明
图1 S2膜蛋白双相电泳及与不同免疫状态绵羊血清的免疫印迹(Western-blot)结果图中:图A为S2膜蛋白双相电泳结果,图B-D依次为膜蛋白分别与布病阴性健康绵羊混合血清(Nm)、S2免疫绵羊混合血清(Sm)、自然感染绵羊混合血清(Zm)的免疫印迹(Western-blot)结果。图E为图B-D所有点叠加分析结果。
图2 S2膜蛋白免疫共沉淀结果1为阴性血清(Nm)的IP混合物;2为S2免疫血清的IP混合物(Sm);3为自然感染血清(Zm)的IP混合物。
图3 猪布鲁氏菌S2株抗原基因PCR扩增结果图中注:泳道M:Marker。泳道1-8为编号1-8的基因。
图4 8种重组蛋白诱导表达图谱图中:M,蛋白质分子量标准(Protein molecular weight marker);1-8,为1-8#候选蛋白;U,未诱导菌体蛋白;W,诱导全菌蛋白;S,上清;P,沉淀
图5 6种重组候选蛋白分别与三种血清的免疫印迹(Western-blot)
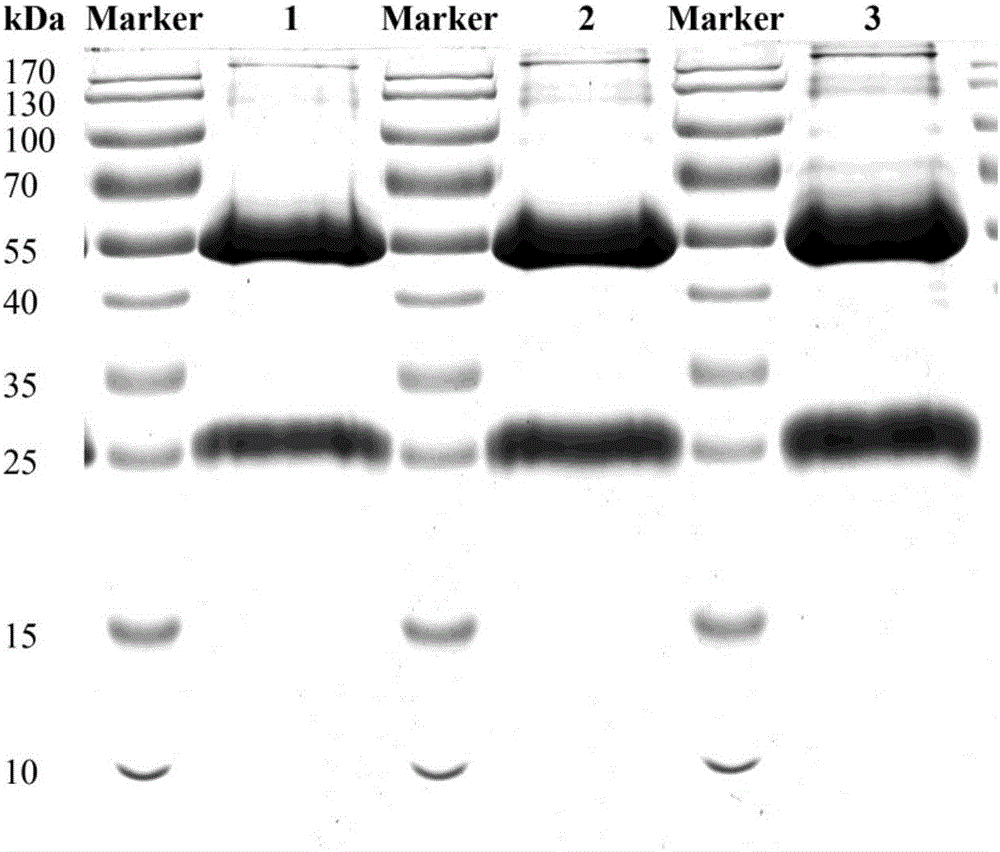
图6 3#重组纯化蛋白BLSJ-2(糖苷水解酶家族43,glycoside hydrolase family 43)的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)结果图中:M:蛋白质分子量标准;3,3#候选蛋白;P,沉淀;Pu,纯化的蛋白。
本发明涉及生物材料资源信息
本发明中涉及的微生物资源是猪种布鲁氏菌弱毒株S2株(CVCC70502株),由中国兽医药品监察所鉴定、保管和供应(请见请见中国兽医药品监察所、中国兽医微生物菌种保藏管理中心编著,中国兽医菌种目录(第二版),中国农业科学技术出版社,2002年,p145)。
本发明的积极效果
本发明涉及一种布鲁氏菌诊断标识作用的基因表达产物BLSJ-2及其制备方法。目的是针对现有血清学方法无法区分布鲁氏菌疫苗免疫抗体和自然感染抗体难题,提供具有鉴别诊断价值的布鲁氏菌基因表达产物,运用免疫学方法,从而实现疫苗免疫抗体及自然感染抗体的鉴别诊断。
实施例
以下实施例为更好的说明本发明,不对本发明构成限制。
实施例1
——鉴别诊断抗原蛋白点的筛选研究
采用免疫蛋白组学方法从S2株膜蛋白中筛选鉴别诊断抗原。各用30份布病阴性健康羊、30份S2免疫羊,以及30份临床布病感染羊阳性混合血清,分别与S2株膜蛋白二维电泳胶(2D)进行免疫印迹(Western-blot),寻找S2膜蛋白与不同布病状态(感染/免疫/阴性)绵羊血清反应差异,共寻找到113个差异蛋白点。选择免疫反应差异较大的30个蛋白点进行基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱鉴定及生物信息学分析,共鉴定出14个蛋白,这些蛋白承担13类分子功能、参与组成6类细胞组分和13类生物学过程。将3种混合血清(感染/免疫/阴性)分别与S2膜蛋白进行免疫沉淀(IP),并对结合物进行高通量质谱(Q-Exactive)鉴定,获得182个候选蛋白点,这些蛋白行使129类分子功能、参与组成91类细胞组分和137类生物学过程。对2种方法鉴定出的所有蛋白进行功能分析,共挑选出8个体外鉴别诊断的候选靶点(编号1#-8#)。
构建8个候选靶蛋白原核表达质粒,除1#(转运蛋白/transporter)与5#(细胞分裂蛋白FtsH/cell division protein FtsH)外,6个蛋白成功表达。将表达蛋白分别与3种混合血清进行免疫印迹(Western-blot)和酶联免疫吸附测定(ELISA)检测,筛选出3#(糖苷水解酶家族43,glycoside hydrolase family 43)鉴别诊断效果明显。
1.布鲁氏菌S2株菌液制备、膜蛋白提取及定量
布鲁氏菌S2株种子液制备参考《中华人民共和国兽用生物制品规程》((农业部兽用生物制品规程委员会.中华人民共和国兽用生物制品规程(二〇〇〇版).北京:化学工业出版社,2000,本发明以下简称《规程》)方法进行,膜蛋白提取参照曲勍等推荐方法进行(曲勍,等.吉林大学学报(医学版),2009(05):805~811)。膜蛋白浓度定量,按照考马斯亮蓝(Bradford)蛋白定量(Thermo Pierce货号:23236蛋白定量试剂盒)方法进行。
2.S2株膜蛋白双相电泳和免疫印迹(western-blot)结果
2个不同批次实验之间的凝胶蛋白点匹配率达80%以上。在预实验中首先采用固定化pH 3~10梯度的胶条进行一向分离,发现蛋白都主要集中位于pH 4~7。因此,选用了固定化pH 4~7梯度的胶条进行一向分离,用12.5%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)进行双向电泳(图1A),用不同血清孵育的免疫印迹(Western-blot)(图1B-1D)。电泳图扫描成图之后通过PDquest8.0软件,将不同血清孵育的免疫印迹(Western-blot)曝光的图比对,以确定免疫反应蛋白的差异。根据图1E结果,结合PDquest 8.0软件分析结果,总共能分辨出262个蛋白差异点。选取30个灰度值差异明显的蛋白点,经胶内酶切及质谱鉴定。
3.双相电泳(2DE)及基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱分析鉴定数据列表
该30个点中所反应的灰度值列表(表1)如下。Nm为膜蛋白与正常绵羊血清免疫反应的灰度值,Sm为膜蛋白与免疫绵羊血清反应的灰度值,Zm为膜蛋白与自然感染绵羊血清的灰度值。比值为免疫与自然感染之间灰度值的比值。
表1 30个蛋白点与3种不同血清反应的灰度值差异信息列表
/:无数据.
4.基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱鉴定结果
结果显示,共鉴定到29个点,其中有9个点(其中涉及转录调控活性3个,DNA复制3个,胞质大核糖体亚基1个,没有功能的2个),因C.I.值低于90而不可信。20个点处于可信区,其按生物信息学本体分可分为3类,分子功能(Molecular Function)7个点,细胞组分(Cellular Component)3个点,生物学过程(Biological Process)12个点。其中有2个点涉及的氧化还原酶活力的功能既可归为分子功能又可归为生物学过程分类中。
5.免疫共沉淀结果
根据蛋白A/G磁珠(protein A/G beads)能与IgG抗体FC段进行非特异性共价结合的特性,将3种不同混合血清抗体分别结合到蛋白A/G磁珠(protein A/G beads)中,然后再将上述混合物与S2膜蛋白结合,根据抗原抗体反应原理,3种不同血清分别与膜蛋白结合形成混合物,其电泳图见图2。
6.免疫沉淀获得质谱点信息及经生物信息学功能分析获得的可能诊断靶点信息
通过天然抗体与非变性抗原进行免疫学反应,其捕捉的点较多,共284个点。比较所鉴定的蛋白点在不同血清免疫沉淀(IP)混合物中的丰度,其中54个蛋白点与阴性血清(Nm)存在非特异性反应。在剩余230个与阴性血清不存在非特异性反应的蛋白点中,有50个蛋白点仅与S2免疫血清(Sm)反应;有63个蛋白点仅与自然感染血清(Zm)反应;与免疫及自然感染血清均有反应的蛋白点117个,其中S2血清和自然感染血清IP混合物中的丰度之比(Sm/Zm)>1.5的蛋白点有12个,Sm/Zm<0.67的蛋白点有57个。可见共鉴定到可能的鉴别诊断抗原蛋白182个。
通过Uniprot基因本体(Gene Ontology)数据库的检索,免疫沉淀/高通量质谱(IP/QE)鉴定的182个可能的鉴别诊断抗原蛋白,按其生物信息学的基因本体(Gene Ontology)分可分为3类。可见,182个蛋白行使129类不同的分子功能(Molecular Function),参与组成91类细胞组分(Cellular Component),参与137种不同生物学过程(Biological Process)。经功能及定位信息分析获得的可能诊断靶点信息列表见表2。
表2经过免疫沉淀/高通量质谱(IP/QE)分析的可能诊断靶点信息列表
*,通过与猪布鲁氏菌S2进行序列比对获得。
筛选出8个蛋白,其功能可能与布鲁氏菌的免疫原性、毒力、布鲁氏菌与宿主相互作用、细胞外膜蛋白转运有关(见表2)。由此选择这8个蛋白,作为可能的鉴别诊断靶点进行进一步验证。
根据二维电泳/免疫印迹/基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱和免疫沉淀/高通量质谱分别获得的可能的鉴别诊断抗原蛋白,初步确定8个蛋白点有望成为体外诊断的靶点,其中二维电泳/免疫印迹/基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱途径获得1个点,为转运蛋白;免疫沉淀/高通量质谱途径获8个点,分别为转运蛋白、膜蛋白(肽聚糖相关脂蛋白)、HlyD家族分泌蛋白(HlyD family secretion protein)、膜蛋白(26kDa周质腔免疫蛋白)、细胞分裂蛋白FtsH、细胞膜生物合成蛋白OmpA、假想蛋白(脂蛋白)、凝集素。其中免疫沉淀/高通量质谱所获得的两个点与二维电泳/免疫印迹/基质辅助激光解吸电离-飞行时间(MALDI-TOF)质谱所获得的一个点重复,即转运蛋白。
实施例2
——鉴别诊断抗原蛋白点基因信息的确定
将2种方法获得的候选蛋白点,与美国国家生物技术信息中心(NCBI)网站公布的S2基因组信息中表达蛋白进行比对,获得各候选蛋白点对应基因信息见表3(含基因名称信息、基因编号、基因长度、蛋白分子量等),随后分别设计引物运用PCR进行基因克隆,获得原核表达产物(表3、图3、图4),分别与布鲁氏菌免疫血清和布鲁氏菌自然感染血清用免疫印迹(Western-blot)及间接酶联免疫吸附测定(ELISA)验证其鉴别诊断价值(图5、表4)。
1. 8个候选的鉴别诊断抗原(表3),分别编号#1-#8,后文表述中均以蛋白编号代替详细蛋白名称。
表3 8个候选基因靶点的详细信息及上下游引物
2.PCR扩增和原核表达
以S2基因组DNA为模板,获得扩增的8个基因的PCR产物。图3电泳结果表明8个基因均出现特异性扩增条带,目的片段与预期的大小一致,获得的重组质粒送公司测序后与美国国家生物技术信息中心(NCBI上提供的各自基因序列进行比对,符合率为100%,其插入的方向均正确,可以用于进一步的)诱导表达。
筛选到的阳性重组质粒转化到E.coLi BL21(DE3)感受态细胞后,用1mM IPTG诱导表达,所收集的菌体经超声破碎后,分别取上清和沉淀进行SDS-PAGE,结果发现1#和5#候选蛋白不表达,其余6个重组蛋白都均以包涵体形式表达。各重组蛋白分子量大小分别与理论大小基本一致(图4)。
3.重组蛋白与三种血清的免疫印迹(Western-blot)
将除了1#和5#之外的6种重组蛋白,将离心分离的含有6种重组蛋白的沉淀(P)分别与布病阴性混合血清(Nm)、S2免疫混合血清(Sm)和自然感染混合血清(Zm)进行Western-blot(图5),发现其中3#候选蛋白与免疫血清和自然感染血清的反应强度存在较强差异。
4.重组蛋白与三种血清的酶联免疫吸附测定(ELISA)反应
除了采用免疫印迹(Western-blot)检测候选蛋白与三种血清的免疫反应性之外,还采用酶联免疫吸附测定(ELISA)方法进一步进行验证。
表4不同包被的抗原蛋白血清样品检测结果
从表4看出,将除了1#和5#之外的6种蛋白,即离心分离的含有6种重组蛋白的沉淀(P)用6M尿素溶解悬浮,用pH9.6碳酸盐缓冲液稀释至1μg/mL,进行间接酶联免疫吸附测定方法检测发现3#在S2免疫与布病阴性血清反应OD450nm基本一致,而与自然感染血清差异明显,表明3#蛋白具有具有鉴别诊断效果。因此筛选出具有区分免疫与自然感染血清起到鉴别诊断基因标识信息见表5。
表5筛选出的鉴别诊断标识基因的详细信息表
实施例3
——3#(糖苷水解酶家族43,glycoside hydrolase family 43)鉴别诊断效果验证
1.利用谷胱甘肽S转移酶(GST)亲和层析柱与谷胱甘肽梯度洗脱法纯化重组蛋白8#,得到纯度90%以上的纯化目的蛋白(图6)。
2.纯化的3#重组蛋白布病抗体酶联免疫吸附测定(ELISA)检测结果
将纯化的3#重组蛋白以常规条件:任选3种单份阴性/免疫/感染血清及1份阴性/免疫/感染血清混合血清,分别用pH9.6的碳酸盐缓冲液将纯化的重组蛋白抗原稀释至100ng/mL,4℃包被过夜,10%脱脂奶作为封闭液封闭2h,将血清用PBS作1∶50稀释,用磷酸盐缓冲液(PBS)对酶标二抗进行1∶5000稀释,其他步骤同常规程序,然后进行OD450nm检测。检测结果见表6
表6 3#重组蛋白对不同血清的酶联免疫吸附测定结果
从表6看出,3#重组蛋白(即为BLSJ-2)在免疫与感染之间的反应确实有明显的差异。而且阴性及S2免疫血清之间的反应值较低,自然感染反应的值较高。
实施例4
——间接酶联免疫吸附测定方法的建立及临床血清样本检测
1.反应条件的优化
(1)包被液、包被抗原浓度及血清稀释度优化结果
将3#重组纯化蛋白为抗原,将其包被液设置为中性的PBS,碱性碳酸盐缓冲液,酸性的柠檬酸缓冲液。抗原浓度设置为20ng/mL,100ng/mL,500ng/mL等3个稀释度,血清浓度设置为1∶50,1∶100和1∶200。通过棋盘试验进行筛选,以背景值最低,而且感染/免疫比值最大,确定为最适浓度。纯化的3#重组蛋白抗原其抗原包被液、抗原包被浓度及血清稀释度条件优化结果见表7。
表7 3#抗原蛋白包被液、抗原浓度以及抗体稀释度筛选结果
从表7看出,3#蛋白适合包被液为碳酸盐缓冲液;最适抗原包被浓度均为100ng/mL,血清稀释度均为为1∶50。
(2)封闭液及酶标二抗稀释度优化结果
根据上述结果,进一步对封闭液及酶标二抗浓度进行优化,分别设置牛血清白蛋白(BSA)、脱脂奶及鱼明胶作为封闭液,将酶标二抗分别作1∶10000及1∶20000稀释,通过棋盘试验进行筛选,以背景值最低,而且感染/免疫比值最大,确定为最适浓度。其具体结果见表8。
表8不同封闭液、酶标二抗浓度筛选结果
从表8看出,3#蛋白(BLSJ-2)最适封闭液为10%脱脂奶,其最适酶标二抗浓度分别为1∶10000。
(3)反应时间及显色时间的优化分别见表9和表10。
将反应时间设置为0.5h和1h进行比较,另将显色15min,20min和30min进行比较,选择Zm/Sm较大值,作为最适参数。
表9反应时间优化
表10显色时间优化
从表9和表10看出,3#重组蛋白酶联免疫吸附测定反应0.5h与反应1h基本一致,另0.5h反应其Zm/Sm略高;3#重组蛋白显色30min,其效果好于15min及20min。
(4)鉴别诊断抗原间接酶联免疫吸附测定方法检测免疫血清的临界值(Cut-off)
运用3#重组蛋白作为抗原建立的间接酶联免疫吸附测定方法,分别检测30份S2免疫血清,计算其平均值及方差。
表11 3#重组抗原建立的间接酶联免疫吸附测定方法
2.在临床羊场血清中的应用
运用已建立的间接酶联免疫吸附测定方法对30份用于免疫蛋白组学已知临床感染单份样本检测及来自免疫的4个羊场656份样本进行检测。结果见表12。
表12临床检测血清样本
注:分母为检测样品数量;分子为判断阳性样品数量。对于鉴别诊断纯化抗原判为阳性,即为临床感染样品;对于抗脂多糖的间接酶联免疫吸附测定方法判为阳性,即为免疫或自然感染血清。
从表12看出,3#重组蛋白检出已知感染的30份血清的检出率达到86.7%。
序列表
<110> 中国兽医药品监察所
<120> 一种布鲁氏菌诊断标识作用的基因表达产物BLSJ-2及其制备方法
<130>
<160> 17
<170> Patentin version 3.5
<210> 1
<211> 1068
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:布鲁氏菌S2株(GI)490823642的基因
<400> 1
atgggtttca gccgcaaaca atggatcgtt gcaggcgcaa ttgtcgttct cgctgcgggc 60
ggctattatg ccttgcaggc gatgaatggc agcgggctgc cggacgggat tgccagcggc 120
aatggccgcg tcgaggcggt tgaaatcgat atttccacga aaagccccgg ccgcatccgt 180
gaaatttttg caaatgaagg cagtttcgtc aaagcgggcg atgttctggc ccgcatggac 240
acggaccagc ttgaaagcca gtaccggcag gcgaaggcac aattgcgccg ggcggaaatc 300
ggtatcgata cggcacaaag ccttgtgacg cagcggcagg cagaacatgc ggcggccgaa 360
gcgaccgttg cccagcggga agcccagctt gatgcagcac agcgccgtct ggcccgttcc 420
cggcaattgt cggaatcgcg gactgtctcg cagcaggttc tggatgacga tcgcgcaacc 480
gcgcaaggcg cggaagccgc cgtcggtgcg gccaaggcgc agcttgcagc aacggacgcg 540
gccataggtg ccgccaaggc gcaggttgtg gatgcgcaag cctctgtcga agctgccaag 600
gccgctattg ccgccattga ggcggatttg agggacgcaa ccttgaccgc gcccaagccg 660
ggccgtgtgc aatatcgtgt ggcacagccc ggcgaagtgc tttcagcagg cgggcgcgtg 720
cttaatctgg tggacctcag cgatgtttcc atgaccttct tcctgcccac ggcgcaggcg 780
gggcgcgtgg caatcggagc cgatgcccgc atcgttctcg atgctgcgcc gcaatatgtc 840
atcccggcca aggtcagctt cgtggccgat gtcgcccagt tcacgccgaa aacggtcgag 900
agcgaggaag agcgccagaa gctgatgttc cgcgtcaagg caaagattcc gcagatcctt 960
ttacagaaat atattcagca ggtgaaaacc ggcttgcccg gcgttgccta tgtcaagctt 1020
gcccctgatg ccggatggcc gaagaacctt gcggaaaccg taaaatga 1068
<210> 2
<211> 27
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增(GI)490823642基因的上游引物EcoRI GAATTC
<400> 2
aaGAATTCat gggtttcagc cgcaaac 27(序列2)
<210> 3
<211> 29
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增(GI)490823642基因的下游引物XhoI: CTCGAG
<400> 3
atCTCGAGtc attttacggt ttccgcaag 29(序列3)
<210> 4
<211> 30
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489056667基因的上游BamHI:GGATCC
<400> 4
ggGGATCCat gaggtacacg gtgttcaaag 30(序列4)
<210> 5
<211> 29
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489056667基因的下游引物XhoI:CTCGAG
<400> 5
aaaCTCGAGt cagcggccat caggcgtac 29(序列5)
<210> 6
<211> 30
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489056820基因的上游引物EcoRI: GAATTC
<400> 6
ttGAATTCat gcgccgtatc cagtcgattg 30(序列6)
<210> 7
<211> 28
<212> DNA
<213>人工序列
<223> 对人工序列的描述:扩增489056820基因的下游引物XhoI: CTCGAG
<400> 7
tttCTCGAGt taccgtccgg ccccgttg 28(序列7)
<210> 8
<211> 34
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489054409基因的上游引物EcoRI: GAATTC
<400> 8
aatGAATTCa tgaacactcg tgctagcaat tttc 34(序列8)
<210> 9
<211> 34
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489054409基因的下游引物XhoI: CTCGAG
<400> 9
cctCTCGAGt tacttgattt caaaaacgac attg 34(序列9)
<210> 10
<211> 30
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增490822055基因的上游引物SalI: GTCGAC
<400> 10
gggGTCGACa tgaatccgaa ctatcgcaac 30(序列10)
<210> 11
<211> 30
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增490822055基因的下游引物NotI:GCGGCCGC
<400> 11
tttGCGGCCG Cttattgcgg ctgcggtttc 30(序列11)
<210> 12
<211> 30
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:引物扩增490824872基因的上游引物EcoRI: GAATTC
<400> 12
ggGAATTCat gctgaagaaa accggtattg 30(序列12)
<210> 13
<211> 26
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增490824872基因的下游引物下游XhoI: CTCGAG
<400> 13
tttCTCGAGt caggctccgc gtagcg 26(序列13)
<210> 14
<211> 28
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489053693基因的上游引物EcoRI: GAATTC
<400> 14
gaaGAATTCa tgcggaaaat ggcgcttg 28(序列14)
<210> 15
<211> 32
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489053693基因的下游引物XhoI: CTCGAG
<400> 15
tttCTCGAGc tatcggcggc agcgtgctcg ag 32(序列15)
<210> 16
<211> 31
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489055761基因的上游引物EcoRI: GAATTC
<400> 16
ccGAATTCat gaacagcttc aggaaaactt g 31(序列16)
<210> 17
<211> 30
<212> DNA
<213> 人工序列
<223> 对人工序列的描述:扩增489055761基因的下游引物XhoI: CTCGAG
<400> 17
ccgCTCGAGt ttaacgagaa taaggcgaac 30(序列17)
- 还没有人留言评论。精彩留言会获得点赞!