布鲁氏菌的检测方法、试剂盒及其应用与流程
本发明涉及一种细菌的检测方法、试剂盒及其应用,具体讲,涉及一种布鲁氏菌的检测方法、试剂盒及其应用。
背景技术:
布鲁氏菌病(Brucellosis)简称布病,又称地热中海弛张热、马耳他热或波浪热,俗称“懒汉病”,是由细胞内寄生的布鲁氏菌属(Brucella)细菌引起的一种人兽共患传染—变态反应性疾病,布病广泛分布于世界各地。
目前已知有60多种家畜、家禽、野生动物是布鲁氏菌的宿主。与人类有关的传染源主要是羊、牛及猪,其次是犬。病畜的分泌物、排泄物、流产物及乳类含有大量病菌,在动物间传播,造成带菌或发病。人通过接触布病感染的动物、食用布鲁氏菌污染的奶制品以及实验室接触等传播方式引起布菌感染。
布鲁氏菌为小球杆状菌,革兰氏染色阴性,无鞭毛,不形成芽孢,一般无荚膜,毒力菌株可有微薄的荚膜。本菌侵入人体后,随淋巴液到达淋巴结,被吞噬细胞吞噬。如布菌未被吞噬细胞杀灭,则细菌在胞内生长繁殖,形成局部原发病灶。此阶段有人称为淋巴源性迁徙阶段,相当于潜伏期,潜伏期为7-60天,平均两周,少数患者可达数月或1年以上。细菌在吞噬细胞内大量繁殖导致吞噬细胞破裂,随之大量细菌进入淋巴液和血循环形成菌血症。在血液里细菌又被血流中的吞噬细胞吞噬,并随血流带至全身,在肝、脾、淋巴结、骨髓等处的单核—吞噬细胞系统内繁殖,形成多发性病灶,造成临床上不仅有菌血症、败血症,而且还有毒血症的表现。经一定时期后,感染灶的细菌生长繁殖再次入血,导致疾病复发。组织病理损伤广泛。临床表现也就多样化。如此反复成为慢性感染,慢性期多侵及脊柱和大关节,表现为长期发热(包括低热)、多汗、关节痛兼或肝、脾、淋巴结和睾丸肿大等可疑症状及体征。
布鲁氏菌常规检测方法主要有血培养方法和虎红平板凝集试验(RBPT)、血清凝集试验(SAT)、补体结合试验(CFT)、酶联免疫吸附试验(ELISA)等免疫学方法。血培养中分离到布鲁氏菌仍然是布鲁氏菌病诊断的“金标准”,但布鲁氏菌分离培养的敏感性低、耗时、费力,而且具有较大的生物安全性危害。免疫学方法目前已经用于布鲁氏菌病的监测和流行病学调查研究中,但由于在感染早期,机体还未产生相关抗体或产生的抗体还未达到检测的限度,易得到假阴性结果;而布鲁氏菌与某些细菌间又存在交叉反应,易得到假阳性结果,影响了检测的特异性。
随着分子生物学技术的发展,PCR方法已被用于布鲁氏菌病的辅助诊断和病原体的检测鉴别中。但普通PCR却存在着操作步骤繁琐,容易造成污染,难以准确定量检测等不足。因此,在布鲁氏菌感染早期或对药品生物制品中布鲁氏菌检测时,急需建立一种快速、特异、灵敏且高通量检测布鲁氏菌的方法。
荧光定量PCR技术是一种集PCR技术、荧光信号检测和数据分析于一体的核酸定量检测技术。荧光定量PCR使用了特异性的探针,能够对靶序列进行特异性的识别,具有引物探针双重控制,且综合了荧光标记技术、激光检测技术、数码显像技术,在扩增指数期进行定量,具有很高的特异性、灵敏性,准确性及假阳性率低等特点。
本产品采用实时荧光定量PCR技术,用于定量检测人体血清样本中的布鲁氏菌DNA。以布鲁氏菌保守基因序列为检测目的片段,该检测不得作为患者病情单独的评价指标,必须结合临床表现和其他实验室检测指标对患者病情进行评价,还可通过对患者布鲁氏菌DNA基线水平和变化情况的监测,用于评估抗细菌治疗的应答和治疗效果监测。本试剂不用作布鲁氏菌的血源筛查。
目前,国内外临床应用上还没有采用荧光定量PCR方法检测布鲁氏菌。使用本发明中所提到布鲁氏菌核酸测定试剂盒(PCR-荧光探针法),由于使用离心柱法,可以有效进行核酸提取,在本试剂盒中,我们使用的定量标准品和阳性质控品为灭活菌株或灭活的阳性样本,可以与待测样本同时进行提取与扩增,从而可以全程监控标本提取扩增。
技术实现要素:
本申请解决的主要问题是提供一种布鲁氏菌的检测方法及试剂盒,以解决无法实现的技术问题。
为了解决上述技术问题,本发明公开了布鲁氏菌的检测方法,包括如下步骤:
待测样本获取:
采用离心柱法从血清标本中获取布鲁氏菌DNA,获得待测样本;
PCR扩增反应:
将提取的布鲁氏菌DNA加到PCR反应混合液中,进行PCR扩增;
所述PCR反应混合液,包括:PCR反应液、布鲁氏菌引物探针混合液,
所述布鲁氏菌引物探针混合液,包括,上游引物Bcsp-F,下游引物Bcsp-R,Taqman荧光探针Bcsp-FP,纯化水;
所述上游引物Bcsp-F包含如SEQ ID NO:1所示的碱基序列;
所述下游引物Bcsp-R包含如SEQ ID NO:2所示的碱基序列;
所述Taqman荧光探针Bcsp-FP包含如SEQ ID NO:3所示的碱基序列,所述Taqman荧光探针BKV-FP5’端有荧光报告基团,3’端有荧光淬灭基团;
结果检测:
采用荧光定量PCR仪检测反应结果,荧光信号收集时设定为Taqman荧光探针BKV-FP 5’端荧光基团对应的荧光素,在60℃收集荧光信号;对结果分析。
进一步地,所述PCR扩增反应的条件为:37℃2min;95℃3min;94℃15s,60℃35s,10个循环;94℃15s,60℃35s荧光,35个循环;25℃1min。
进一步地,,所述BKV引物探针混合液,还包括:内标上游引物,内标下游引物,内标探针。
进一步地,所述PCR扩增反应,还包括:平行设置Brucella阴性质控品、Brucella临界阳性质控品、Brucella阳性质控品和Brucella定量标准品I~IV反应组,所述Brucella阴性控品为阴性血清,所述Brucella临界阳性质控品、Brucella阳性质控品的待测模板为灭活菌株或灭活阳性标本,所述Brucella定量标准品I~IV的待测模板为灭活菌株或灭活阳性标本。
进一步地,,所述的Taqman荧光探针BKV-FP的荧光报告基团6-羧基荧光素、六氯-6-甲基荧光素、VIC荧光染料、四氯-6-羧基荧光素、羧基-X-罗丹明、6-羧基四甲基罗丹明、磺酰罗丹明、6-羧基-4’,5-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯、花菁3、花菁5或花菁5.5中的至少一种;所述荧光淬灭基团选自6-羧基四甲基罗丹明、4-(4-二甲基氨基苯偶氮基)苯甲酸、黑洞淬灭剂1、黑洞淬灭剂2或黑洞淬灭剂3中的至少一种。
进一步地,,所述PCR反应液,包括UDG酶防污染体系,所述UDG酶防污染体系,包括:UDG酶及dUTP。
本申请还提供检测布鲁氏菌的试剂盒,其特征在于,包括权利要求1所述的上游引物Bcsp-F,下游引物Bcsp-R,Taqman荧光探针Bcsp-FP,纯化水;
所述上游引物Bcsp-F包含如SEQ ID NO:1所示的碱基序列;
所述下游引物Bcsp-R包含如SEQ ID NO:2所示的碱基序列;
所述Taqman荧光探针Bcsp-FP包含如SEQ ID NO:3所示的碱基序列。
进一步地,该试剂盒还包括:内标上游引物、内标下游引物、内标探针、Brucella阴性质控品、Brucella阳性质控品、Brucella临界阳性质控品和Brucella定量标准品I~IV,所述Brucella阴性质控品为阴性血清,所述Brucella临界阳性质控品、Brucella阳性质控品为灭活菌株或灭活标本,所述Brucella定量标准品I~IV为灭活菌株或灭活阳性标本,所述Brucella定量标准品I~IV,包括Brucella定量标准品I、Brucella定量标准品II、Brucella定量标准品III、Brucella定量标准品IV。
进一步地,所述试剂盒包括:布鲁氏菌引物探针混合液、PCR反应液、Brucella定量标准品、Brucella阳性质控品、Brucella临界阳性质控品、Brucella阴性质控品、Brucella内标质控品,各组分含量为:
本申请提供的检测布鲁氏菌的试剂盒用于布鲁氏菌的检测。
与现有技术相比,本发明所述的布鲁氏菌的检测方法、试剂盒,达到了如下效果:
1.本发明中所涉及的试剂盒中设置临界阳性质控品、阳性质控品、定量标准品均为灭活菌株或灭活标本,参与核酸提取及扩增,全面真实反映核酸提取和扩增。
2.本发明使用尿苷酶(UDG)防污染体系,经加热可以选择性地降解U-DNA,以防止先前PCR扩增产物的污染。
3.本发明采用内标质控体系,用于监测反应体系可能存在的抑制因素。内标模板与靶基因无同源性,内标探针选择的是与靶基因探针没有冲突的另一检测通道。
4.本发明的检测方法、试剂盒敏感性高,最低检出可达到1000copies/mL;同时,本发明的检测方法的特异性很好,不和其他的细菌发生交叉反应,例如大肠杆菌、肠炎沙门菌、乙型肝炎病毒、人类疱疹病毒4型、人巨细胞病毒等。
5.本发明的检测方法反应快速,一般1.5到2小时即可得到PCR反应结果,并且成本低、无假阳性,适合于大规模临床开展。从而实现对布鲁氏菌的快速、有效且准确的定量检测,因而能保证及时的病例诊治及治疗效果监测。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明实施例2所述布鲁氏菌定性检测结果图;
图2是本发明实施例3所述布鲁氏菌定量检测标准品检测结果图;
图3是本发明实施例3所述布鲁氏菌定量检测标准品和待测样品检测结果图。
具体实施方式
如在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可理解,硬件制造商可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名称的差异来作为区分组件的方式,而是以组件在功能上的差异来作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。说明书后续描述为实施本申请的较佳实施方式,然所述描述乃以说明本申请的一般原则为目的,并非用以限定本申请的范围。本申请的保护范围当视所附权利要求所界定者为准。
以下结合附图对本申请作进一步详细说明,但不作为对本申请的限定。下文为了叙述方便,下文中所称的“左”“右”“上”“下”等与附图本身左、右、上、下等方向一致。
实施例1
本实施例提供待测样本获取的方法,待测样本核酸提取可以采用商品化的离心柱提取法、商品化的磁珠提取法或商品化的煮沸裂解法。
本发明提供采用离心柱法从血清标本中获取布鲁氏菌DNA,获得待测样本的方法。具体方法如下:
1)使用前向缓冲液GD中加入17mL无水乙醇,向漂洗液PW中加入60mL无水乙醇,摇匀。
2)取待测血清样本1ml,13,000rpm离心10min,尽量吸净上清。
3)向菌体沉淀中加入200μl缓冲液GA,振荡至菌体彻底悬浮。
4)向管中加入20μl Proteinase K、5μl Brucella内标质控品溶液,混匀。
5)加入220μl缓冲液GB,振荡15sec,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠。
6)加220μl无水乙醇,充分振荡混匀15sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
7)将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中。
8)向吸附柱CB3中加入500μl缓冲液GD(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中。
9)向吸附柱CB3中加入600μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,吸附柱CB3放入收集管中。
10)重复操作步骤⑨。
11)将吸附柱CB3放回收集管中,12,000rpm(~13,400×g)离心2min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
12)将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50μl洗脱缓冲液TE,室温放置2-5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中,即为提取到核酸DNA。
实施例2
布鲁氏菌的定性检测
本实施例2提供一种布鲁氏菌的定性检测方法:
1、布鲁氏菌的PCR扩增反应
1)布鲁氏菌DNA的PCR扩增反应所用试剂及成分
(1)布鲁氏菌引物探针混合液:
布鲁氏菌引物探针混合液具体组成成分为上游引物Bcsp-F(50μM)0.6μL,下游引物Bcsp-R(50μM)0.6μL,Taqman荧光探针Bcsp-FP(20μM)0.5μL,纯化水3.3μL。
优选布鲁氏菌引物探针混合液的组分为:上游引物Bcsp-F(50μM)0.6μL,下游引物Bcsp-R(50μM)0.6μL,Taqman荧光探针Bcsp-FP(20μM)0.5μL,内标上游引物(20μM)0.5μL,内标下游引物(20μM)0.5μL,内标探针(10μM)0.375μL,纯化水1.925μL。
所述上游引物Bcsp-F包含如SEQ ID NO:1所示的碱基序列;
所述下游引物Bcsp-R包含如SEQ ID NO:2所示的碱基序列;
所述Taqman荧光探针Bcsp-FP包含如SEQ ID NO:3所示的碱基序列,所述Taqman荧光探针Bcsp-FP 5’端有荧光报告基团,3’端有荧光淬灭基团。
所述的Taqman荧光探针的荧光报告基团选自6-羧基荧光素(6-carboxyfluorescein,6-FAM)、六氯-6-甲基荧光素、VIC荧光染料、四氯-6-羧基荧光素、羧基-X-罗丹明、6-羧基四甲基罗丹明、磺酰罗丹明、6-羧基-4’,5-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯、花菁3、花菁5或花菁5.5中的至少一种;所述荧光淬灭基团选自6-羧基四甲基罗丹明、4-(4-二甲基氨基苯偶氮基)苯甲酸、黑洞淬灭剂1(Black Hole Quencher 1,BHQ1)、黑洞淬灭剂2或黑洞淬灭剂3中的至少一种;
优选的,当荧光淬灭基团选自4-(4-二甲基氨基苯偶氮基)苯甲酸时,荧光报告基团选自6-羧基荧光素、四氯-6-羧基荧光素、6-羧基-4’,5’-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯、六氯-6-甲基荧光素、花菁3中的至少一种;当荧光淬灭基团选自6-羧基四甲基罗丹明时,荧光报告基团选自6-羧基荧光素、四氯-6-羧基荧光素、6-羧基-4’,5’-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯或六氯-6-甲基荧光素中的至少一种;
当荧光淬灭基团选自黑洞淬灭剂1时,荧光报告基团选自6-羧基荧光素、四氯-6-羧基荧光素、6-羧基-4’,5’-二氯-2’,7’-二甲氧基荧光素琥珀酰亚胺酯、六氯-6-甲基荧光素或花菁3中的至少一种;
当荧光淬灭基团选自黑洞淬灭剂2时,荧光报告基团选自6-羧基四甲基罗丹明、花菁3、羧基-X-罗丹明或磺酰罗丹明中的至少一种;
当荧光淬灭基团选自黑洞淬灭剂3时,荧光报告基团选自花菁5或花菁5.5中的一种。
最优选地,所述荧光报告基团为6-FAM;所述荧光淬灭基团为BHQ1。
(2)PCR反应液:
PCR反应液组成为:10×reaction buffer 5μL,10mM dNTP Mix 4μL,Taq DNA Polymerase 1.2μL,UDG酶0.2μL,10mM dUTP 1μL,纯化水13.6μL。
2)布鲁氏菌DNA(待测样本)PCR反应
(1)按以下比例进行PCR反应混合液配制与加样:PCR反应液25μL,布鲁氏菌引物探针混合液5μL加到PCR管中,振荡混匀,将提取好的待测样本20μL加到上述PCR管中,进行PCR扩增。
(2)PCR反应的反应条件设置为:37℃2min;95℃3min;94℃15s,60℃35s,10个循环;94℃15s,60℃35s荧光(荧光收集),35个循环;25℃1min。
2、PCR反应结果判读(布鲁氏菌的定性检测结果分析)
本实施例2采用最优方案,即布鲁氏菌引物探针混合液含内标,所述Taqman荧光探针Bcsp-FP的荧光报告基团为6-FAM;荧光淬灭基团为BHQ1。
本实施例2采用ABI7500荧光定量PCR仪,荧光信号收集时设定为对应荧光素,本实施例设定为FAM、VIC荧光素,荧光信号收集设在60℃。
布鲁氏菌引物探针混合液有无内标,不影响待检样品通道曲线的响应,即布鲁氏菌检出为阳性时,待检样品对应通道会出现S型曲线;布鲁氏菌检出为阴性时,待检样品对应通道不出现S型曲线。
本实施2采用布鲁氏菌引物探针混合液含内标,所述Taqman荧光探针Bcsp-FP的荧光报告基团为6-FAM;荧光淬灭基团为BHQ1的方案,因此检测结果会包含内标通道曲线:
如果内标通道出现S型曲线,同时FAM通道检测无S型曲线,判定为BKV阴性;如果内标通道出现S型曲线,同时FAM通道检测有S型曲线,判定为BKV阳性。利用上述方法对12例布鲁氏菌血清样本、5例健康人血清样本,2例大肠杆菌血清样本、2例肠炎沙门菌血清样本、2例乙型肝炎病毒血清样本、2例人类疱疹病毒4型血清样本、2例人巨细胞病毒血清样本,标本来源XXX医院共计27份样本进行检测,结果如图1所示:
其中,12例布鲁氏菌血清样本检测均为阳性,内标通道出现S型曲线,同时FAM通道检测有S型曲线;健康人血清样本,大肠杆菌血清样本、肠炎沙门菌血清样本、乙型肝炎病毒血清样本、人类疱疹病毒4型血清样本、人巨细胞病毒血清样本,检测均为阴性,内标通道出现S型曲线,同时FAM通道检测无S型曲线。
本实施例2采用内标质控体系,内标参与样本提取与扩增,用于监测反应体系可能存在的抑制因素。内标模板与靶基因无同源性,内标探针选择的是与靶基因探针没有冲突的另一检测通道。
实施例3
本实施例2提供一种布鲁氏菌的定量检测方法:
1、布鲁氏菌DNA(待测样本)的PCR扩增反应
1)布鲁氏菌DNA的PCR扩增反应所用试剂及成分
(1)布鲁氏菌引物探针混合液:
布鲁氏菌引物探针混合液的组分为:上游引物Bcsp-F(50μM)0.6μL,下游引物Bcsp-R(50μM)0.6μL,Taqman荧光探针Bcsp-FP(20μM)0.5μL,内标上游引物(20μM)0.5μL,内标下游引物(20μM)0.5μL,内标探针(10μM)0.375μL,纯化水1.925μL。
所述上游引物Bcsp-F包含如SEQ ID NO:1所示的碱基序列;
所述下游引物Bcsp-R包含如SEQ ID NO:2所示的碱基序列;
所述Taqman荧光探针Bcsp-FP包含如SEQ ID NO:3所示的碱基序列,所述Taqman荧光探针Bcsp-FP 5’端有荧光报告基团,3’端有荧光淬灭基团。所述荧光报告基团为6-FAM;所述荧光淬灭基团为BHQ1。
(2)BKV PCR反应液:
PCR反应液组成为:10×reaction buffer 5μL,10mM dNTP Mix 4μL,Taq DNA Polymerase 1.2μL,UDG酶0.2μL,10mM dUTP 1μL,纯化水13.6μL。
(3)Brucella内标质控品:
Brucella内标质控品为体外构建的重组质粒。
(4)Brucella阴性质控品:
Brucella阴性质控品为阴性血清。
(5)Brucella临界阳性质控品:
Brucella临界阳性质控品为灭活菌株稀释液或灭活的阳性样本,浓度为1×104copies/mL。
(6)Brucella阳性质控品:
Brucella阳性质控品为灭活菌株稀释液或灭活的阳性样本,浓度为2.5×106copies/mL。
(7)定量标准品:
定量标准品均为灭活菌株稀释液或灭活的阳性样本,浓度分别为:Brucella定量标准品Ⅰ(2.5×108copies/mL)、Brucella定量标准品Ⅱ(2.5×107copies/mL)、Brucella定量标准品Ⅲ(2.5×106copies/mL)、Brucella定量标准品Ⅳ(2.5×105copies/mL)。
2)PCR反应
(1)按以下比例进行PCR反应混合液配制与加样:PCR反应液25μL×(n+7:四个定量标准品和一个阴性质控品、一个临界阳性质控品、一个阳性质控品),每管加布鲁氏菌引物探针混合液5μL;振荡混匀,每份30μL分至PCR管中,将提取好的待测样本(该待测样本为定性检测为阳性的样本)及质控品20μL加到上述PCR管中,进行PCR扩增。
(2)设置PCR扩增反应条件:37℃2min;95℃3min;94℃15s,60℃35s,10个循环;94℃15s,60℃35s荧光(荧光收集),35个循环;25℃1min。
2、PCR反应结果判读(BK病毒的定量检测结果分析)
采用ABI7500荧光定量PCR仪,荧光信号收集时设定为FAM荧光素,荧光信号收集设在60℃
结果判断:
(1)如果靶基因FAM通道没有出现S型扩增曲线,判为Brucella DNA检测阴性。
(2)如果靶基因FAM通道出现S型扩增曲线,判为Brucella DNA检测阳性,检测结果有如下解释:
1)测定值在0~1000copies/mL的样本报告为“低于试剂盒检出下限(1000copies/mL)”,即“<1000copies/mL”。应结合其它临床诊断指标进行判断。
2)测定值在1000~5×108copies/mL之间的样本,直接报告所测定的数值;
3)测定值大于5×108copies/mL的样本,可报告为>5×108copies/mL;若需精确定量,可根据结果将样本稀释至5×108copies/mL以下复测,并根据以下公式计算样本浓度,结果注明为可报告数值。
可报告数值(最终样本浓度)=稀释后浓度×稀释倍数
稀释倍数=(样本量+稀释液量)/样本量
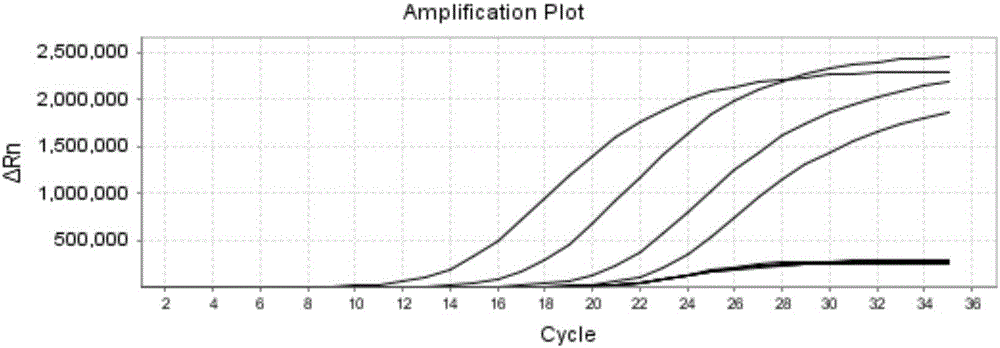
利用Brucella定量标准品检测所生成的标准曲线计算待测样本的浓度(copies/mL)。检测反应时,经换算,Brucella定量标准品Ⅰ(5×107copies/mL)、Brucella定量标准品Ⅱ(5×106copies/mL)、Brucella定量标准品Ⅲ(5×105copies/mL)、Brucella定量标准品Ⅳ(5×104copies/mL)与样品同时检测,如图2为定量标准品扩增曲线,图3为标准品与待测样本扩增曲线。根据定量标准品浓度与检测结果CT值,系统自动生成一条标准曲线。根据待测样品的检测CT值,可计算出样品中靶基因的浓度。
利用上述方法对6例布鲁氏菌血清样本进行定量检测,通过计算机生成的标准曲线。计算图3中6个待测样本(如图3所示,除4个标准品曲线外的6个曲线为待测样本曲线)从左至右浓度分别为,计算6个阳性样本的浓度分别为:1.2×107copies/mL、8.0×105copies/mL、7.1×104copies/mL、7.8×103copies/mL、1.3×103copies/mL、8.1×102copies/mL。
结果验证:将检测阳性的扩增产物进行基因测序,测序结果经BLAST比对后证实为布鲁氏菌基因序列。
实施例4
本实施例4提供一种检测BK病毒的试剂盒。
检测BK病毒的试剂盒,包括:上游引物:Bcsp-F,下游引物:Bcsp-R,Taqman荧光探针Bcsp-FP,纯化水;
所述上游引物Bcsp-F包含如SEQ ID NO:1所示的碱基序列;
所述下游引物Bcsp-R包含如SEQ ID NO:2所示的碱基序列;
所述Taqman荧光探针Bcsp-FP包含如SEQ ID NO:3所示的碱基序列。
优选的,该试剂盒还包括:内标上游引物、内标下游引物、内标探针。内标质控体系参与提取与扩增。用于监测反应体系可能存在的抑制因素。内标模板与靶基因无同源性,内标探针选择的是与靶基因探针没有冲突的另一检测通道。
优选的,该试剂盒,还包括:Brucella阴性质控品、Brucella阳性质控品、Brucella临界阳性质控品和Brucella定量标准品I~IV,所述Brucella阴性质控品为阴性血清,所述Brucella临界阳性质控品、Brucella阳性质控品为灭活菌株或灭活标本,所述Brucella定量标准品I~IV为灭活菌株或灭活阳性标本,所述Brucella定量标准品I~IV,包括Brucella定量标准品I、Brucella定量标准品II、Brucella定量标准品III、Brucella定量标准品IV。
优选的,Brucella定量标准品I~IV、Brucella临界阳性质控品、Brucella阳性质控品的构建方法包括以下步骤:
(1)提取灭活菌株核酸或灭活阳性标本核酸,分光光度计进行定值。
(2)使用灭菌后的生理盐水将所定量高浓度菌株进行稀释,稀释成4个梯度2.5×105~2.5×108copies/mL,分别作为试剂盒的Brucella定量标准品I、Brucella定量标准品II、Brucella定量标准品III、Brucella定量标准品IV,另外,稀释浓度为2.5×106copies/mL和1×104copies/mL分别作为试剂盒的Brucella阳性质控品和Brucella临界阳性质控品。
优选的,该试剂盒,包括:布鲁氏菌引物探针混合液、PCR反应液、Brucella定量标准品、Brucella阳性质控品、Brucella临界阳性质控品、Brucella阴性质控品、Brucella内标质控品。
优选的,各组分组成及制造方法为:
(1)布鲁氏菌引物探针混合液:
布鲁氏菌引物探针混合液具体组成成分为:Bcsp-F(50μM)0.6μL,Bcsp-R(50μM)0.6μL,Bcsp-FP(20μM)0.5μL,内标上游引物(20μM)0.5μL,内标下游引物(20μM)0.5μL,内标探针(10μM)0.375μL,纯化水1.925μL。分装量为120μL×1管/24份。
(2)PCR反应液:
PCR反应液组成为:10×reaction buffer5μL,10mM dNTP Mix 4μL,Taq DNA Polymerase1.2μL,UDG酶0.2μL,10mM dUTP1μL,纯化水13.6μL。分装量为600μL×1管/24份。
(3)Brucella内标质控品:
Brucella内标质控品为体外构建的重组质粒,分装量为120μL×1管/24份。
(4)Brucella阴性质控品:
Brucella阴性质控品为阴性血清,分装量为600μL×1管/24份。
(5)Brucella临界阳性质控品:
Brucella临界阳性质控品为灭活菌株稀释液或灭活的阳性样本,浓度为1×104copies/mL,分装量为600μL×1管/24份。
(6)Brucella阳性质控品:
Brucella阳性质控品为灭活菌株稀释液或灭活的阳性样本,浓度为2.5×106copies/mL,分装量为600μL×1管/24份。
(7)定量标准品:
定量标准品均为灭活菌株稀释液或灭活的阳性样本,浓度分别为:Brucella定量标准品Ⅰ(2.5×108copies/mL)、Brucella定量标准品Ⅱ(2.5×107copies/mL)、Brucella定量标准品Ⅲ(2.5×106copies/mL)、Brucella定量标准品Ⅳ(2.5×105copies/mL),分装量为600μL×1管/24份。
优选的,该试剂盒组成为,布鲁氏菌引物探针混合液、PCR反应液、Brucella定量标准品、Brucella阳性质控品、Brucella临界阳性质控品、Brucella阴性质控品、Brucella内标质控品,各组分含量为:
上述检测布鲁氏菌的试剂盒,应用于布鲁氏菌的检测。该检测可以为定性检测和/或定量检测。
与现有技术相比,本发明所述的布鲁氏菌的检测方法、试剂盒,达到了如下效果:
1.本发明中所涉及的试剂盒中设置临界阳性质控品、阳性质控品、定量标准品均为灭活菌株或灭活标本,参与核酸提取及扩增,全面真实反映核酸提取和扩增。
2.本发明使用尿苷酶(UDG)防污染体系,经加热可以选择性地降解U-DNA,以防止先前PCR扩增产物的污染。
3.本发明采用内标质控体系,用于监测反应体系可能存在的抑制因素。内标模板与靶基因无同源性,内标探针选择的是与靶基因探针没有冲突的另一检测通道。
4.本发明的检测方法敏感性高,最低检出可达到1000copies/mL;同时,本发明的检测方法的特异性很好,不和其他的细菌发生交叉反应,例如大肠杆菌、肠炎沙门菌、乙型肝炎病毒、人类疱疹病毒4型、人巨细胞病毒等。
5.本发明的检测方法反应快速,一般1.5到2小时即可得到PCR反应结果,并且成本低、无假阳性,适合于大规模临床开展。从而实现对布鲁氏菌的快速、有效且准确的定量检测,因而能保证及时的病例诊治及治疗效果监测。
由于方法部分已经对本申请实施例进行了详细描述,这里对实施例中涉及的系统与方法对应部分的展开描述省略,不再赘述。对于系统中具体内容的描述可参考方法实施例的内容,这里不再具体限定。
上述说明示出并描述了本申请的若干优选实施例,但如前所述,应当理解本申请并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述申请构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本申请的精神和范围,则都应在本申请所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!