多孔毛细管膜用于测定滚环扩增产物的量的应用的制作方法
本申请要求2015年4月30日提交的英国专利申请系列号1507376.0的权益,在本文中并入所述申请用于全部目的。
背景
使用母体血液样品或非侵入地从孕妇获得的另一种样品,非侵入产前检验提供了胎儿状况或健康的信息。早期检测胎儿状况或健康允许定向干预和医学治疗。
滚环扩增(RCA)可用于分析母体血液中的无细胞DNA。但是,在统计稳健性情况下对RCA产物定量可能有挑战性。在实践层面,尽管RCA反应中产物的绝对数目可能足够高以提供统计稳健性,但反应中特异性RCA扩增子摩尔浓度的可能相当低,这限制了可以用来定量这些扩增子的方法类型。例如,理论上可以通过以下方式检测到样品中的RCA产物:将RCA产物标记,将样品沉积到载玻片表面上,以及计数载波片上标记产物的数目。但是,单纯在载玻片上放置含有标记的RCA产物的溶液、允许标记的RCA产物扩散到表面上并且随后计数已经附着至载玻片的标记的RCA产物的数目耗费几小时,并且并不是全部标记的RCA产物均抵达载波片并被计数。
本文描述了过滤到固相支持物上以对标记的RCA产物定量的应用。如下文将更详细地描述,该方法可以促进含有RCA产物的样品的分析。
概述
提供一种分析样品的方法。在某些实施方案中,该方法可以包括:(a)使用多孔毛细管膜过滤含有滚环扩增(RCA)产物的液体样品,从而在膜上产生RCA产物的阵列;其中样品含有至少第一RCA产物群体和第二RCA产物群体,其中将标记的RCA产物的第一和第二群体可区分地标记;以及(b)测定膜的区域中第一标记的RCA产物群体的量和第二标记的RCA产物群体的量。在一些实施方案中,测定步骤可以包括计数该区域内第一和第二标记的RCA产物的数目。在其他实施方案中,测定步骤可以包括检测来自该区域的集合信号。采用任一种方式,该方法可以提供样品中第一和第二RCA产物群体的数目的估计量。
取决于该方法如何实施,多孔毛细管膜的使用可以使得定量样品中基本上全部的RCA产物(不仅仅是碰巧扩散到载玻片表面的那些)成为可能,并且这转而增加测定的精度、灵敏度和重现性。另外,与一些备选方法相比,多孔毛细管膜的使用允许在数分钟内而非数小时完成测定,如上文所示,所述备选方法可能依赖于将样品抽吸到载玻片上并且随后将载波片温育延长的时间段,以希望RCA产物将会扩散并粘附于载波片表面。与此一致,本申请的实验部分报告,如与载玻片上16小时温育相比,本发明方法的实施可以导致在90秒(这等于在膜顶部放置样品并且随后抽吸样品穿过膜所耗费的时间)后计数至少2.5倍的RCA产物。此外,膜的使用可以通过使得潜在背景源(例如,尚未与RCA产物杂交的荧光寡核苷酸分子等)穿过膜,减少背景(尤其如果在已经施加RCA产物后洗涤膜的情况下)。
因为如上文提到,膜起到在膜表面上浓缩RCA产物的作用,所以该方法特别用于分析RCA产物的浓度范围相对广泛(例如,50μl至200μl或更大体积内10个至1千万个RCA产物)的样品,所述RCA产物在许多情况下可能具有相对低的浓度。换句话说,在不使用膜的情况下并代之使用替代性方案,50μl样品将扩散遍及玻璃显微镜载玻片表面并且即使可以引起全部RCA产物与载片结合,RCA产物将在载片上相互空间分离,从而单个视野将仅含有数目不足的RCA产物,从而使得通过显微术或其他手段以任何合理准确度定量这些RCA产物费时和低效。取决于如何实施该方法,膜可以起到以下作用:浓缩及支撑RCA产物的作用,与此同时,提供可以借以洗涤RCA产物以降低背景的手段。此外,膜可以充当显微术载片,尤其如果它是透明的或可以通过添加润湿剂令其透明的情况下。
总之,认为本发明方法提供了一种测定样品中RCA产物的量的快速、高精确、灵敏和可重现方式–所述RCA产物是本身已经按如此意义无偏倚产生,从而每种靶分子由仅一种RCA产物代表(与其中将每个靶分子扩增到未知数目的副本和不同靶分子按不同量扩增的PCR相反)的产物。从而,本发明方法应当证明对快速、精确和准确测量样品中DNA分子丰度不可或缺的应用而言是非常宝贵的。尤其,本发明方法应当证明对非侵入性产前检验是有价值的,其中快速、精确和准确测量母体血流的无细胞级分中相对低浓度的DNA分子的丰度至关重要。
这些及其他潜在特征和优点可以基于以下描述变得显见。
附图简述
技术人员将会理解,下文描述附图仅用于说明目的。附图不意在以任何方式限制本发明教导内容的范围。
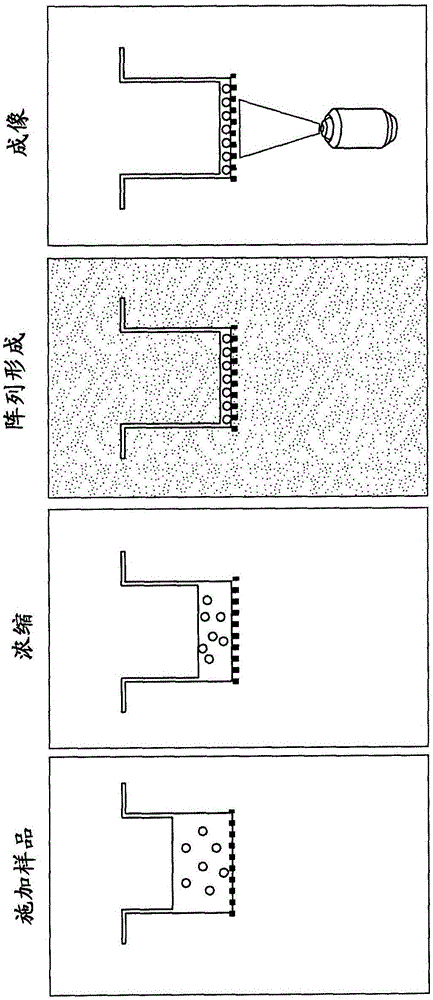
图1示意性地显示本发明方法的一些步骤。
图2示意性地显示本发明方法的一些原理。
图3是在y-轴上描述每图像的计数值和在x-轴中描述样品、温育时间和玻璃或氧化铝平板类型的图。
图4是显示实施例2中描述的实验的一些结果的直方图。
图5是两个通道的计数之间的比率相对于细胞系混合物组成的曲线。
发明详述
在描述多种实施方案之前,应当理解本公开的教导内容不限于所述的具体实施方案,并且本身当然可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,因为本发明教导内容的范围将仅由所附的权利要求限制。
本文所用的章节标题仅出于组织目的并且不得以任何方式解释为限制所描述的主题。尽管结合多种实施方案描述了本发明教导内容,本发明的教导内容不意图限于这类实施方案。相反,本发明教导内容涵盖各种备选物、修饰和等同物,如本领域技术人员将领会。
除非另外定义,本文中所用的全部技术术语和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同意义。尽管与本文所述的那些方法和材料相似或等同的任意方法和材料也可以用于本发明教导内容的实施或检验,然而现在描述一些示例性方法和材料。
对任何出版物的引用是因其在申请日前的披露并且不应当解释为承认因在先发明而不认为本发明权利要求早于这种出版物。此外,所提供的公开日可能不同于需要独立核实的实际公开日。
如本领域技术人员阅读本公开时将显而易见,本文所描述和展示的各个变型的每一者都具有可以容易地与其他几种实施方案的任一者的特征分离或与之组合的独立组分和特征,而不脱离本发明教导内容的范围或精神。任何所述的方法可以按列举的事件顺序或按逻辑上可能的任何其他顺序实施。
本文提到的全部专利和出版物,包括这些专利和出版物内公开的所有序列在内,均明确地通过引用的方式并入。
在更详细地描述示例性实施方案之前,阐述以下含义以显示说明书中所用术语的含义和范围。
必须指出,除非上下文另外明确指出,否则如本文中和所附权利要求中所用,单数形式“一个(a)”、“一种(an)”和“该(an)”包括复数称谓。例如,术语“引物”指一种或多种引物,即,单一引物和多重引物。进一步指出,可以起草这些权利要求以排除任何任选的要素。因而,这种声明意在充当与描述权利要求要素相联系地使用这类排他性术语如“单独”、“仅”等或使用“否定式”限制的先行基础。
如本文所用,术语“过滤”包括通过滤器移除含有分析物(例如,滚环扩增产物)的液体,从而一些分析物被滤器留下的动作。在过滤时,至少一些液体从滤器的一侧转移到另一侧。
如本文所用,术语“滚环扩增”或“RCA”包括使用链置换聚合酶产生环状核酸模板线性连环化副本的等温扩增。RCA是分子生物学领域中熟知的并且在多种出版物中描述,包括但不限于Lizardi等人(Nat.Genet.1998 19:225-232)、Schweitzer等人(Proc.Natl.Acad.Sci.2000 97:10113-10119)、Wiltshire等人(Clin.Chem.2000 46:1990-1993)和Schweitzer等人(Curr.Opin.Biotech 2001 12:21-27),所述文献通过引用的方式并入本文。
如本文所用,术语“滚环扩增产物”包括滚环扩增反应的连环化体产物。如本文所用,术语“荧光标记的滚环扩增产物”指已经例如通过荧光标记的寡核苷酸与滚环扩增产物杂交或其他手段(例如,通过扩增期间荧光核苷酸掺入产物中)被荧光标记的滚环扩增产物。
如本文所用,术语“多孔毛细管膜”包括具有相对致密堆积的独立毛细管的膜,所述毛细管贯通膜的厚度,即,从膜的一侧到另一侧,从而允许液体从膜的一侧至另一侧穿过,而不允许粒子穿过。多孔毛细管膜的例子包括但不限于例如阳极氧化铝膜(参见下文)、纳米通道玻璃膜、径迹蚀刻膜和聚四氟乙烯。纳米通道玻璃膜由玻璃制成并具有高密度的直径15微米至15纳米的均匀通道(参见,例如,Tonucci等人,Advances in Nanophotonics II,AIP Conference Proceedings,2007 959:59-71;Pearson等人,Science 1995 270:68-70和Tonucci等人,Science 1992 258:783-785,以及美国专利5,306,661;5,332,681;5,976,444;6,087,274;6,376,096;6,483,640;和6,599,616,所述文献通过引用的方式并入)。径迹蚀刻膜由含有直径处于0.01μm至30μm范围内的孔的透明聚合物(例如,聚碳酸酯、聚对苯二甲酸乙二醇酯或聚酰胺等)制成,所述孔已经通过带电荷粒子轰击法(或照射)和化学蚀刻的组合产生。其他目的多孔膜包括但不限于非晶态氟聚合物如NAFIONTM、TEFLON AFTM、FEFLON FEIPTM和CYTOPTM(DuPont Fluoroproducts,Fayetteville,NC)。如将认识到,多孔毛细管膜可以具有不同于从中产生膜的材料的表面(例如,涂敷表面或化学改性表面)。例如,多孔毛细管膜的表面可以具有改变的电荷特征或改变的疏水特征或亲水特征。在一些实施方案中,表面可以用提供正电荷的氨基硅烷、聚赖氨酸或另一种化合物涂覆,所述正电荷辅助保留RCA产物至表面上。备选地或额外地,表面可以在其中沉积有金属(例如,钛、金)薄层,所述薄层可以与调节滤器表面特性的其他试剂连接。
如本文所用,术语“阳极氧化铝膜”包括当Al在某些酸性介质中阳极化时产生的规律、自组织的纳米膜状结构。可以通过沉积电压、酸的类型和其他参数控制膜中孔的内径、膜中相邻孔的中心之间的距离和膜中相邻孔的边缘之间的距离。当潮湿时,阳极氧化铝膜实际上是透明的。多种出版物中详细综述了阳极氧化铝膜、其特性和如何制作这类膜,所述出版物包括但不限于:Li等人(Chem.Mater 1998 10:2470-2480)、Santos等人(Trends on Analytical Chemistry 2013 44:25-38)、Ingham等人(Biotechnology Advances 30 2012 1089-1099)和Poinern等人.(Materials 2011 4:487-526),所述文献通过引用的方式并入本文用于那些教导内容。阳极氧化铝膜以商品名称ANOPORETM从例如SPI Supplies(West Chester,PA)和从他供应商如Sykera Technolgoies Inc(Longmont,CO)和Signma-Aldrich(St.Louis,MO)可商业获得并且可以随支撑环一起买到。
如本文所用,在膜的区域或图像区域的上下文中,术语“区域”包括连续或不连续区域。例如,如果方法涉及测定该区域内标记的RCA产物的量,例如,计数该区域内标记的RCA产物的数目,将RCA产物定量的区域可以是单一连续性空间或多个不连续空间。
如本文所用,术语“成像”包括借以检测到来自对象表面的光学信号并且与位置关联的数据(即,“像素”)存储的过程。对象的数字图像可以从该数据重建。可以使用单幅图像或一幅或多幅图像,对膜的某个区域成像。
如本文所用,术语“各个标记的RCA产物”包括标记的各个RCA分子。
如本文所用,术语“测定…的量”包括计数独立分辨的RCA产物的方法以及包括从多个RCA产物测量集合信号的方法。在涉及测量集合信号的强度的方法中,不要求分辨各个RCA产物。RCA产物的量可以使用任何合适的单位表述。在一些情况下,RCA产物的量可以表述为已经计数的独立分辨的RCA产物的数目。
如本文所用,术语“计数”包括测定更大集合中各个对象的数目。在实施方案中,“计数”需要检测多个对象中来自各个对象的独立信号(并非来自多个对象的集体信号)并且随后通过计数各个信号测定多个对象中存在多少个对象。在本发明方法的情况下,可以通过测定信号阵列中各个信号的数目,进行“计数”。
如本文所用,术语“透明的”包括对象在正在使用的波长上光学透明的状态。对于荧光显微术,“透明”意指对象将会对荧光团的激发光谱和发射光谱之一或二者是透明的。如下文将更详细地描述,某些膜仅在已经润湿时才是透明的。即便这些膜的干燥形式可能不透明,仍将这类膜视为透明膜。
如本文所用,谈及RCA产物阵列时,术语“阵列”包括在平坦表面上的单个RCA产物的集合,其中RCA产物在表面的平面上相互空间分离(到这样的程度,依据泊松分布,该阵列是真实随机的)。“随机”阵列包括其中要素(例如,RCA产物)在基材表面上按未预定的位置分布的阵列。在一些情况下,RCA产物在随机阵列上的分布可以由泊松统计学描述,从而,例如,随机阵列的RCA产物之间距离的分布可以使用泊松分布逼近。也就是说,RCA产物可以在膜上随机分布,即,在非预定的位置分布。
这些术语和其他术语的其他含义可以在本说明书通篇范围内出现。
在更详细地描述本发明的方法之前,认识到可以使用任何类型的捕获支持物实施本发明的方法,所述捕获支持物可以充当RCA产物的滤器。这类捕获支持物应当在分析中所用的波长具有低背景信号并具有足以允许液体和捕获RCA产物快速流体通流的孔径。合适的捕获支持物可以由多孔有机或无机物质制成,所述物质包括固体如多孔金属、陶瓷、均相薄膜(例如,聚合物)和异相固体(聚合物混合物、混合玻璃)。多孔陶瓷膜可以由无机物质(如氧化铝、二氧化钛、氧化锆、重结晶碳化硅)制成。参见,例如,Pamgene(The Netherlands)出售的PamChip;Wu等人,Nucleic Acids Res.2004 32:e123和Anthony等人,Biotechniques。(2003)34:1082-6,1088-9。示例性多孔聚合物膜可以由醋酸纤维素、硝酸纤维素、纤维素酯(CA、CN、和CE)、聚砜(PS)、聚醚砜(PES)、聚丙烯腈(PAN)、聚酰胺、聚酰胺、聚乙烯和聚丙烯(PE和PP)、聚四氟乙烯(PTFE)、聚偏氟乙烯(PVDF)和聚氯乙烯(PVC)制成。从而,在一些实施方案中,该方法可以包括:(a)使用充当RCA产物的滤器的捕获支持物过滤含有滚环扩增(RCA)产物的液体样品,从而在支持物上产生RCA产物的阵列;其中样品含有至少第一RCA产物群体和第二RCA产物群体,其中将标记的RCA产物的第一和第二群体可区分地标记;以及(b)测定膜的区域中第一标记的RCA产物群体的量和第二标记的RCA产物群体的量。
以下描述内容显示其中使用多孔毛细管膜的实施。多孔毛细管膜是可能使用的捕获支持物的例子。以下描述通过例子显示本发明方法。
如上总结,提供一种分析样品的方法。在某些实施方案中,该方法可以包括:(a)经多孔毛细管膜过滤含有滚环扩增(RCA)产物的液体样品,从而在所述膜上产生RCA产物的阵列;(b)在步骤(a)之前或之后将RCA产物荧光标记;以及(c)测定膜的区域中各个标记的RCA产物的量,从而提供样品中标记的RCA产物数目的估计量。该方法可以按多种方式进行,其中一个实施在图1中示意性显示。参考图1,该方法的某些实施方案涉及:经多孔毛细管膜6(例如,阳极氧化铝膜)过滤含有荧光标记的滚环扩增(RCA)产物4的液体样品2。过滤步骤浓缩了粒子并且产生在膜6上的RCA产物阵列8。在所示的实施方案中,下一个步骤涉及在粒子位于膜上的同时检测粒子。在一些实施方案中,这个步骤可以产生阵列8的图像10。如将显而易见,可以用任何合适的荧光检测器,例如,荧光显微镜、扫描仪、使用高分辨CMOS或CCD检测器或使用PMT等进行检测。最后,例如,通过计数独立分辨的RCA产物或通过测量集合信号等,测定膜的区域中标记的RCA产物的量。这种测定提供了样品2中标记的RCA产物12的数目的估计量。在某些实施方案中并且取决于方法如何进行,滤器可以被润湿,例如,用润湿膜并使其透明的润湿剂(例如,浸镜用油或甘油)润湿。在这些实施方案中,可以在过滤RCA产物后和测定RCA产物的量之前使用润湿剂,使多孔毛细管膜透明。在一些实施方案中,RCA产物可以在过滤步骤后标记。另外,在一些情况下,不必要生成并存储阵列的图像。在这些实施方案中,阵列的分析可以在成像期间或在成像后立即进行。在其中分析包括计数的一些实施方案中,所用的荧光检测器应当足以分辨膜上的不同RCA产物。在一些实施方案中,荧光检测器可以具有小于10μm(例如,小于5μm或小于1μm)的分辨率。在涉及测量集合信号的实施方案中,荧光检测器不需要具有这种分辨率。
在任何实施方案中,毛细管膜的孔应当具有足够的大小,从而防止RCA产物穿过这些孔。例如,在实施方案中,毛细管膜的孔直径可以不超过RCA产物的中位直径的50%,而在一些实施方案中,它可以不超过RCA产物的中位直径的20%,并且在一些实施方案中不超过RCA产物的中位直径的10%。从而,在使用多孔毛细管膜过滤样品中,RCA产物应当留在膜的顶部上并且不应当完全进入或穿过孔。
在某些实施方案中,多孔毛细管膜不包含与RCA产物特异性杂交或结合的系留的捕获剂(例如,系留的寡核苷酸,抗体或链霉亲和素等)。在这些实施方案中,RCA产物不借助特异性(例如,序列特异性)相互作用与多孔毛细管膜结合。在这类实施方案中,多孔毛细管膜不包含多个不同的系留的序列特异性捕获剂(例如,寡核苷酸),所述序列特异性捕获剂在空间可寻址位置以微阵列形式系留至膜上,如US 2006022813中所述。
在某些实施方案中,除产生光信号之外,在RCA产物经膜过滤后无需生物化学反应(例如,导致共价键破裂或形成的反应)在膜上发生。
如显而易见,滚环扩增(RCA)产物在经膜过滤之前不被变性(例如,不暴露于至少90℃的温度至少2分钟)。
图2显示方法的示例性实施方案的一些原理。在第一步骤中,将含有荧光标记的RCA产物的样品置于容器(例如,含有膜(例如,作为底面)的孔)中。通过施加牵引样品的液相通过膜的压力,浓缩样品。RCA产物以阵列形式按例如至少10、至少50、至少100、至少500、至少1,000、至少5,000或至少10,000/mm2的密度留在膜的表面上。如果膜不是已经透明的,则在添加润湿剂后膜变得透明并且RCA产物可以检出,例如,成像。也可以使用固定剂,使RCA产物固定就位,从而膜可以运输和/或储存,从而如果获得阳性结果,它们可以再读取。在一些实施方案中,润湿剂,除使得膜透明之外,还充当固定剂。可以从膜的任一侧分析阵列,例如,透过膜(如图2中所示)。如显而易见,如果从“上方”(即,从与RCA产物相同的一侧)读取膜,则膜不需要是透明的。在一些实施方案中,可以将膜在运输和分析前干燥。分析的区域可以含有至少10个,例如、至少100、至少1,000、至少5,000、至少10,000、至少20,000、至少50,000、至少100,000或至少200,000个或更多个RCA产物。
如果需要,RCA产物可以在它们与膜结合的同时被标记,并且在某些实施方案中,在标记的RCA产物阵列已经产生后和在分析之前,可以将膜洗涤,例如,用水或含有盐的含水缓冲液洗涤。这个洗涤步骤可以减少背景,因为潜在背景源(例如,不与RCA产物杂交的标记的核苷酸或标记的寡核苷酸)可以借助滤器洗去并且在分析滤器之时不与滤器结合。如果需要,其他试剂,例如,抗褪色剂或增强荧光的试剂等,可以在分析之前添加至膜,以减少背景或增加信号等。同样,如果需要,标记的RCA产物可以在分析之前与膜表面(共价或非共价)结合。连接生物分子至表面的化学是熟知的,并且在某些情况下,可以使用修饰的核苷酸或具有与膜表面特异性反应的基团的引物产生RCA产物,从而确保仅RCA产物变得与表面附着。
在某些实施方案中,可以通过以下方式进行过滤步骤:(i)在多孔膜上放置样品;和(ii)施加使样品移动穿过膜的力。施加至样品的力可以是主动力(例如,离心力,负压或正压)或被动力(例如,借助毛细管作用(例如,使用吸墨纸)或蒸发)。
如上文所示,可以通过沉积电压、酸的类型和其他参数控制膜中孔的内径、膜中相邻孔的中心之间的距离和膜中相邻孔的边缘之间的距离(总体上参见,Poinern,上文)。在一些实施方案中,膜中孔的内径可以处于5nm至500nm范围内,例如,4nm至250nm、4nm至50nm、50nm至100nm、100nm至200nm或200nm至500nm范围内。独立地,膜中相邻孔的中心之间的平均距离可以处于50nm至1000nm范围内,例如,50nm至420nm、50nm至100nm、100nm至250nm、250nm至500nm或500nm至1000nm范围内。膜中相邻孔的边缘之间的平均距离可以处于10nm至500nm、10nm至50nm、50nm至200nm或200nm至500nm范围内。可以理解,本文中提供的孔间直径值和平均距离值是示例性的,并且这类值可以基于实施方案变动。
在一些实施方案中,孔直径和相邻孔的中心之间的距离可以优化,以提供通过所用检测系统单独可分辨的标记的RCA产物。具体而言,在某些情况下,膜中的孔可以具有相对大的直径(例如,处于100nm至500nm范围内的直径)并且膜中相邻孔的中心之间的平均距离可以相对地大(例如,处于200nm至1000nm,例如,200nm至420nm范围内),从而牵引每个标记的RCA产物到孔的入口孔(有效“堵住”该孔)并且相邻标记的RCA产物之间的距离是通过荧光显微术可分辨的。如果使用超高分辨率荧光显微术(Huang等人,Annu.Rev.Biochem.2009 78:993–1016),这些最佳距离可以缩减。
所用的膜可以具有任何合适的厚度,例如,处于20μm至500μm或50μm至200μm范围内,根据需要,如上文所示,可以含有一种或多种支撑结构(例如,支撑环)以维持膜在使用期间的完整性。
如上文所示,本发明方法可以用于这样的方案中,所述方案要求精确定量样品、尤其具有可变RCA产物浓度(例如,可以处于相对低浓度的10个至1千万个,例如,50μl至200μl或更大体积中的5,000个至1百万个RCA产物)的样品中RCA产物的数目,并且为测定差异所要求的统计分辨率仅可以通过计数至少1,000、至少5,000、至少10,000、至少50,000、至少100,000或至少200,000个或更多个RCA产物达到。如下文将更详细地描述,该方法在拷贝数分析中和非侵入性产前检验应用中具有特殊应用。
在一些实施方案中,样品可以含有多个RCA产物群体(例如,2个、3个或4个或更多个RCA产物群体,如第一标记的RCA产物群体和第二RCA产物群体),其中不同的RCA产物群体可区分地标记,其意指每个RCA产物群体标记物的各自成员可以独立地检出并计数,甚至当各群体混合时也是如此。可用主题方法中的合适的可区分荧光标记物对包括Cy-3和Cy-5(Amersham Inc.,Piscataway,NJ)、Quasar 570和Quasar 670(Biosearch Technology,Novato CA)、Alexafluor555和Alexafluor647(Molecular Probes,Eugene,OR)、BODIPY V-1002和BODIPY V1005(Molecular Probes,Eugene,OR)、POPO-3和TOTO-3(Molecular Probes,Eugene,OR)以及POPRO3和TOPRO3(Molecular Probes,Eugene,OR)。其他合适的可区分可检测标记物可以在Kricka等人(Ann ClinBiochem.39:114-29,2002)中找到。例如,RCA产物可以用ATTO、ALEXA、CY或二聚体菁染料如YOYO、TOTO等的任何组合标记。也可以包括其他标记物。例如2014年11月26日提交的PCT/US2014/06771和2014年11月26日提交的PCT/US2014/067719中描述了用于产生可区分标记的RCA产物群体的示例性方法,所述文献通过引用的方式就这些教导内容并入本文。在一些情况下,RCA产物群体可以通过用多重标记物标记它来可区分地标记,从而增加多路复用的可能性。例如,在一些情况下,群体的RCA产物可以各自用两种可区分染料(例如,Cy3和Cy5)标记。当读取时,这类双标记的RCA产物将与单一染料(例如,Cy3或Cy5)标记的RCA产物可区分。
在一些实施方案中,第一RCA产物群体可以代表标记的RCA产物的“测试”群体并且第二RCA产物群体可以代表第一RCA产物的数目可以与之比较的RCA产物“参比”群体。例如,在一些实施方案中,第一RCA产物群体可以对应于第一染色体区域(例如,第一染色体如染色体21)并且第二RCA产物群体可以对应于第二染色体区域(例如,第二染色体如染色体13或18或第一染色体不同的区域),并且第一RCA产物群体和第二RCA产物群体的数目可以计数并且比较以测定是否存在该区域的拷贝数差异(提示存在测试区域的重复或缺失)。在一些实施方案中,样品含有至少第一RCA产物群体和第二RCA产物群体,其中将第一和第二标记的RCA产物群体在标记步骤中可区分地标记。在这些实施方案中,这些方法包括测定膜的区域中第一标记的RCA产物的量(例如,计数其数目)和测定膜的区域(相同区域或不同区域)中第二标记的RCA产物的量(例如,计数其数目),从而提供样品中第一和第二RCA产物群体的量的估计量。这个实施方案还可以涉及将样品中第一RCA产物的数目与样品中第二RCA产物的数目比较。
在所述方法的这些实施方案中的某些实施方案内,方法可以包括对第一和第二标记的RCA产物群体成像以产生一幅或多幅图像(例如,一幅图像或分别是第一图像和第二图像),并且,任选地,(i)测定所述一幅或多幅图像中标记的RCA产物的量,从而提供样品中第一和第二标记的RCA产物群体量的估计量。可以使用已知的方法(例如,使用适宜的滤器等)分别检测第一和第二标记的RCA产物群体。对RCA产物的检测可以依次进行(在这种实施方案,例如,可以产生每种标记物的分开的图像并且可以依次分析来自每个群体的RCA产物)。对RCA产物的检测还可以基本上同时进行(在这种实施方案,例如,可以产生显示两个RCA产物群体的单幅图像并且可以在基本上相同的时间(即,基本上同时)分析来自每个群体的RCA产物)。所述方法的这些实施方案还可以包括将样品中第一标记的RCA产物的量与样品中第二标记的RCA产物的量比较。方法的这个步骤可以涉及计数第一群体中至少1,000个(例如,至少5,000、至少10,000、至少20,000、至少50,000、至少100,000、至少500,000个直至1百万个或更多个)标记的RCA产物并且计数膜的区域中至少1,000个(例如、至少5,000、至少10,000、至少20,000或至少50,000、至少100,000、至少500,000个直至1百万个或更多个)标记的RCA产物,从而确保可以按统计严格性提到拷贝数的差异。
在实施方案中,所述方法还可以包括检测样品中第一RCA产物的量与样品中第二RCA产物的量之间的差异,其中差异具有至少0.95、至少0.98或至少0.99的P-值。在一些实施方案中,该方法可以用来检测至少1%差异、至少2%差异、至少3%差异或至少5%差异,P-值大于0.95、0.98或0.99。例如,在涉及来自孕妇的母体样品的实施方案中,可以在这个计算中包括样品的胎儿部分。
如上文所示,在一些情况下,使用这种方法正在分析的样品可以是从血液(例如,从孕妇血液)获得的无细胞DNA的样品。在这些实施方案中,该方法可以用来检测正在发育的胎儿中的染色体异常(如上文所述)或用来例如计算样品中胎儿DNA的分数。可以使用该方法检测到的拷贝数异常包括但不限于21三体、13三体、18三体、16三体、XXY、XYY、XXX、X单体、21单体、22单体、16单体和15单体。下表中列出可以使用本发明方法检测到的其他拷贝数异常。
例如2014年11月26日提交的PCT/US2014/06771和2014年11月26日提交的PCT/US2014/067719中描述了用于产生并标记RCA产物的示例性方法,所述文献通过引用的方式就这些方法的公开内容并入。
组合物
还提供一种组合物。在一些实施方案中,该组合物可以包含:a)多孔毛细管膜,例如,多孔阳极氧化铝膜;和b)在膜表面上荧光标记的RCA产物的阵列。该阵列可以包含至少1,000个标记的RCA产物(例如、至少5,000、至少10,000、至少20,000、至少50,000、至少100,000、至少500,000或至少1百万个标记的RCA产物)并且标记的RCA产物可以按随机方式以例如至少10、至少50、至少100、至少500、至少1,000、至少5,000,或至少10,000/mm2的密度横贯膜表面分布。如上文所述,该组合物可以包含:多孔毛细管膜;和在膜表面上荧光标记的RCA产物的至少两个群体,其中将荧光标记的RCA产物不同群体可区分地标记。可以在本公开的方法部分中找到这种组合物的其他细节和变型。
试剂盒
本公开还提供用于实施如上文所述的主题方法的试剂盒。在一些实施方案中,试剂盒可以至少含有:以序列特异性方式环化选定片段并且随后进行环化产物滚环扩增的试剂。例如,一种或多种限制性酶、连接酶和一种或多种可以充当使产物环化的夹板的寡核苷酸、用于借助RCA扩增环化产物的链置换聚合酶、一种或多种用于标记RCA产物的标记寡核苷酸和如上文所述的多孔毛细管膜(例如,多孔阳极氧化铝膜)。试剂盒的各种组分可以存在于分开的容器中或某些相容的组分可以根据需要预先合并至单个容器中。可以在本公开的方法部分中找到这种试剂盒的组分的其他细节和变型。
除上文提到的组分之外,主题试剂盒还可以包括使用试剂盒的组分以实施主题方法的说明书,即,样品分析说明书。实施主题方法说明书通常记录在合适的记录介质上。例如,说明书可以印刷在基材(如纸或塑料等)上。从而,这些说明书可以在试剂盒中作为包装插页存在、在试剂盒的容器的标签中或其组件中存在(即,与包装物或分包装物结合)等。在其他实施方案中,说明书作为电子储存数据文件存在,所述电子储存数据文件存在于合适的计算机可读取存储介质上,例如,CD-ROM、磁盘盒等。在另外的其他实施方案中,实际说明书不存在于试剂盒中,但是提供从远程来源(例如,通过互联网)获得说明书的手段。这个实施方案的例子是包含其中可以浏览和/或从中可以下载说明书的网址的试剂盒。与说明书一样,这种用于获得说明书的手段记录在合适的基材上。
实施方案
下文描述本发明的方法的示例性实施。
在一些实施方案中,该方法可以包括:(a)使用多孔阳极氧化铝膜过滤含有荧光标记的滚环扩增(RCA)产物的液体样品,从而在该膜上产生RCA产物的阵列;以及(b)测定膜的区域中标记的RCA产物的量,从而提供样品中标记的RCA产物量的估计量。在一些实施方案中,测定步骤可以包括计数该区域内第一和第二标记的RCA产物的数目。在其他实施方案中,测定步骤可以包括检测来自该区域的集合信号。
在实施方案中,可以通过以下方式进行方法的步骤(a):(i)在多孔阳极氧化铝膜上放置样品;和(ii)施加使样品移动穿过膜的力。在这些实施方案中,力可以是主动力(离心力、负压或正压)或被动力(其可以毛细管作用或蒸发施加)。在一些实施方案中,该方法可以包括在步骤(a)和(b)之间洗涤多孔阳极氧化铝膜。在一些实施方案中,测定步骤可以包括计数图像区域中至少1,000个标记的RCA产物。
在实施方案中,膜中孔的内径可以处于5nm至500nm范围内,并且独立地,膜中相邻孔的中心之间的平均距离可以处于50nm至1000nm范围内。在实施方案中,膜中相邻孔的边缘之间的平均距离可以处于10nm至500nm范围内。在一些实施方案中,样品可以含有至少第一和第二标记的RCA产物群体,其中将第一和第二标记的RCA产物群体可区分地标记。在这些实施方案中,该方法还可以包括对第一和第二标记的RCA产物群体成像,以产生一幅或多幅图像(例如,分别产生第一图像和第二图像)。这些方法还可以包括(i)计数第一图像的区域中标记的RCA产物的数目和(ii)分别地计数第二图像的某区域(例如,相同区域)中标记的RCA产物的数目,从而提供样品中第一和第二标记的RCA产物群体的数目的估计量。这个实施方案还可以包括将样品中第一标记的RCA产物的量与样品中第二标记的RCA产物的量比较。
还提供是一种组合物,所述组合物包含:a)多孔毛细管膜;和b)在膜表面上的荧光标记的滚环扩增(RCA)产物的阵列。在这些实施方案的一些实施方案中,多孔毛细管膜可以是多孔阳极氧化铝膜。在一些实施方案中,该阵列可以包含至少1,000个RCA产物。在一些实施方案中,组合物可以包含荧光标记的RCA产物的多重阵列,其中多重阵列处在膜的表面上并且可区分地标记。可以在前文描述中找到对这些要素的每一者以及可以在组合物存在的任选要素的描述。
还提供是一种试剂盒,所述试剂盒包含:a)多孔毛细管膜;和b)用于环化DNA并进行滚环扩增(RCA)的试剂;和c)用于标记RCA产物的试剂。可以在前文描述中找到对这些要素的每一者以及可以在试剂盒存在的任选要素的描述。
实施方案1,一种分析样品的方法,包括:(a)经多孔透明毛细管膜过滤含有滚环扩增(RCA)产物的液体样品,从而在该膜上浓缩RCA产物并产生RCA产物的阵列;(b)在步骤(a)之前或之后将RCA产物荧光标记;以及(c)计数膜的区域中各个标记的RCA产物的数目,从而提供样品中标记的RCA产物数目的估计量。
实施方案2.实施方案的方法1,其中多孔透明毛细管膜是多孔阳极氧化铝膜。
实施方案3.实施方案1或2的方法,其中通过在步骤(a)之前或之后将荧光标记的寡核苷酸与RCA产物杂交,进行步骤(b)。
实施方案4.前述任何实施方案的方法,其中方法包括对膜的区域成像以产生一幅或多幅图像并计数一幅或多幅图像中各个标记的RCA产物的数目。
实施方案5.前述任何实施方案的方法,其中可以通过以下方式进行方法的步骤(a):(i)在多孔透明毛细管膜上放置样品;和(ii)施加使样品移动穿过膜的力。
实施方案6.实施方案5的方法,其中力是主动力或被动力。
实施方案7.实施方案6的方法,其中主动力是离心力、负压或正压。
实施方案8.实施方案6的方法,其中通过毛细管作用或蒸发施加被动力。
实施方案9.前述任何实施方案的方法,还包括在步骤(a)和(b)之间洗涤多孔透明毛细管膜。
实施方案10:前述任何实施方案的方法,其中计数步骤包括计数膜的区域中至少1,000标记的RCA产物。
实施方案11:前述任何实施方案的方法,其中膜中孔的内径处于2nm至500nm范围内。
实施方案12:前述任何实施方案的方法,其中膜中相邻孔的中心之间的平均距离处于50nm至1000nm范围内。
实施方案13:前述任何实施方案的方法,其中膜中相邻孔的边缘之间的平均距离处于10nm至500nm范围内。
实施方案14:前述任何实施方案的方法,其中样品含有至少第一RCA产物群体和第二RCA产物群体,其中在步骤b)中可区分地标记第一和第二标记的RCA产物群体。
实施方案15:实施方案的方法11,其中该方法包括计数膜的区域中第一标记的RCA产物的数目和计数膜的区域中第二标记的RCA产物的数目,从而提供样品中第一和第二RCA产物群体的数目的估计量。
实施方案16:实施方案的方法15,还包括将样品中第一RCA产物的数目与样品中第二RCA产物的数目比较。
实施例
提供以下实施例从而为本领域普通技术人员提供如何制造和使用本发明的完整公开和描述,并且不意图限制本发明人视为其发明的范围,它们也不意图表明下文的实验是所进行的全部或仅有实验。
实施例1
AAO滤器的应用
简介
许多分子诊断学应用中的第一步骤在是将患者的生物材料如DNA转化成有效的生物标记物。将DNA提取,经常纯化并进一步转化成可以被测量或定量的替代分子,如滚环产物(RCP)。往往通过特异性连接荧光染料辅助对这些替代分子的检测。不同染料可以与不同的替代标记物连接,这使得甚至在复杂混合物中进行多重检测成为可能。沉积到平坦表面(如玻璃板或载片)使得通过显微术或扫描计数标记的分子成为可能。
当样品在溶液中的浓度低时,出现特殊挑战,并且难以沉积足够数目的分子以便准确计数。已经证明用试剂如聚L-赖氨酸(PLL)、氨基硅烷或类似物涂覆载玻片是一种改善主要由DNA组成的替代标记物沉积的有效手段(参见,例如,2014年11月26日提交的PCT/US2014/06771和2014年11月26日提交的PCT/US2014/067719)。这在某种程度改善了沉积效率,然而许多分子仍留在溶液中并且并未纳入后续分析中。致力于增加荧光标记的生物标记物向平坦表面沉积的产率,实施以下过滤方法。
材料和方法
装置:将氧化铝膜与自行产生或购自Ibidi(部件编号81201)的孔-平板超级结构结合。
氨基硅烷涂覆的平板(96孔玻璃底平板SuperAmine,部件编号M96M)购自ArrayIt Corporation。
使用前述方法产生两种分开的滚环扩增产物(PCT/US2014/06771)。通过含有5’Atto 550标记物的互补性检测寡核苷酸杂交标记一个RCA反应,另一个RCA反应以相似方式用5’Atto 647N标记。将RCA反应按50:50混合物以50fM浓度混合。
对于玻璃板,100μl反应物等分入平板的3个孔中并允许在室温温育16小时。将另一个系列的3孔温育90秒。在温育后,将各孔用2x SSC淋洗2次并且使其干燥。
对于膜,100μl样品添加至膜为底部的平板,并随后将平板置于吸墨纸(VWR部件编号28298-022)上。样品在大约90秒内穿过氧化铝膜。从吸墨纸取出膜底平板,并且将2滴延长抗褪色试剂(Life Technologies)添加至每个孔以使得它们透明。
在具有20倍物镜的Olympus X81显微镜和Hamamatsu Orca 4.0lt照相机上按两种格式进行成像。通过叠加9x 9图像以覆盖每个孔的整个底,进行成像。使用自有专用软件分析图像并计数RCA产物。
结果
图3中总结了结果。当温育16小时时,在玻璃板上沉积对Atto 550标记的RCA产物产生每幅图像平均2,000至4,000个计数。对于Atto 647N,每幅图像的平均计数在2,000至3,000个计数之间。在玻璃板上温育90秒对两个通道均产生每幅图像500至2,500个计数之间的平均计数。相反,在氧化铝平板上温育/沉积对Atto 550标记的RCP产生每幅图像6,000至10,000个计数的平均数,以及对647N标记的RCA产物产生每幅图像6,000至9,000个计数之间的平均数。
数据表明,对于相同的90秒时间区间,在氧化铝膜上沉积导致比玻璃板上沉积高大致4倍的计数。如果玻璃板的温育时间增加至16小时,则结果是玻璃板上正在检测的RCA产物增加,然而仍比氧化铝上在90秒所观察少2.5倍。
实施例2
多重检测方法
材料和方法
装置:具有20nm孔的氧化铝膜与4titude Ltd,UK定制生产的96孔-平板超级结构结合。
在这个多重实验中,使用来自2个细胞系的DNA的混合物作为遗传起始材料。细胞系DNA含有2拷贝的染色体21(正常遗传组成)或细胞系含有3拷贝的染色体(21三体)。从这些细胞系提取的DNA按以下比例混合:100:0、95:5、90:10、0:100。将每种DNA混合物首先使用限制性酶消化,杂交并连接至探针组,并且随后通过如先前所描述的RCA酶促扩增(参见WO 2015083001和WO 2015083002)。将两种染色体特异性检测寡核苷酸(Atto 550用于染色体18,Atto 647用于染色体21)添加至每份样品并允许杂交,因此荧光标记每份样品中的染色体特异性RCA产物。
在标记后,100μl样品添加至膜为底部的平板,并随后将平板置于真空岐管上(Supleco部件编号66879-U)。样品在大约90秒内穿过氧化铝膜。将膜底平板用400μl 0.5X SSC洗涤2次,随后使其干燥。随后施加300微升润湿剂/固定剂至每个孔,以使它们透明并将RCA产物固定至膜上。
在具有20倍物镜的Olympus X81显微镜和Hamamatsu Orca 4.0lt照相机上进行成像。通过叠加10x 10图像以覆盖每个孔的整个底,进行成像。使用自有专用软件分析图像并计数RCA产物。
结果
图4中总结了结果。实验中纳入的全部91份样品的每图像平均计数范围从每图像3000个至略微高于5000个计数。直方图清晰地显示在0:100比率混合物中550通道和647通道之间与计数成比例的差异(最后22次复制),然而单从该图中更难以察觉0、5%和10%样品中的比例差异。图5是两个通道的计数之间的比率对细胞系混合物组成的曲线。在这张图中,清晰展示这个趋势,例示了遵循输入细胞系DNA样品的比例的计数相对比率偏移。
数据表明,对于相同的90秒时间区间,在氧化铝膜上沉积导致比玻璃板上沉积高大致4倍的计数。如果我们增加玻璃板的温育时间增加至16小时,则结果是玻璃板上正在检测的RCA产物增加,然而仍比氧化铝上在90秒所观察的少2.5倍。
- 还没有人留言评论。精彩留言会获得点赞!