治疗方法的选择方法以及表明该选择方法的生物标志与流程
本发明涉及生物标志和使用该生物标志的疗法的选择方法,上述生物标志表明针对大肠癌选择folfox疗法和folfiri疗法中的哪一种对患者是有利的。
背景技术:
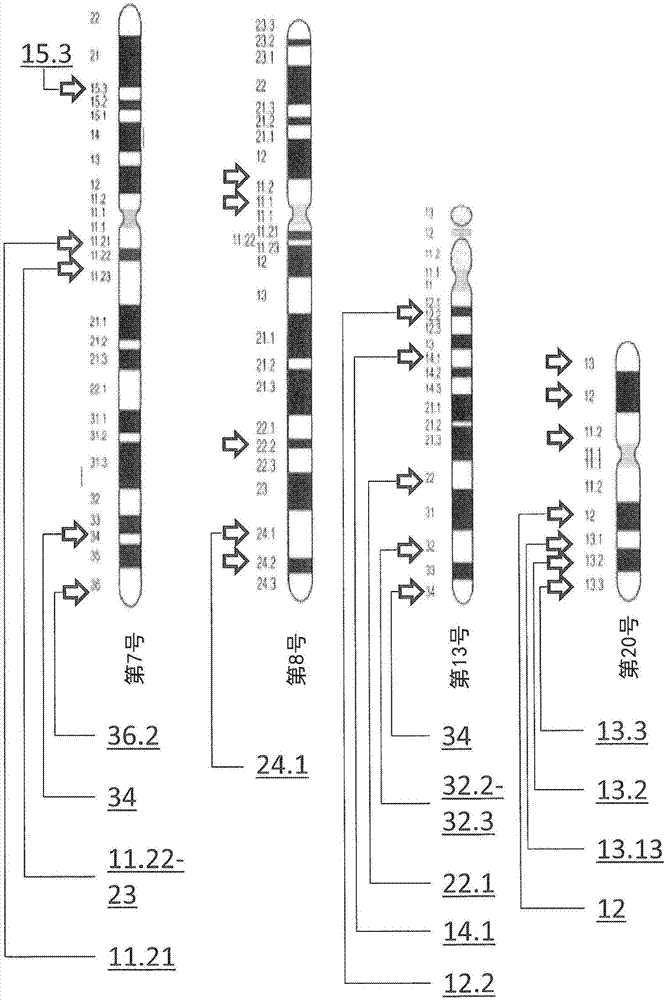
:在大肠癌研究会的大肠癌治疗指南中,大肠癌用五个阶段(分期)表示进展程度。随着分期的发展,癌的进展程度发展。该分期的判断通过向大肠壁的浸润度、有无向淋巴结的转移、有无向其他脏器的转移进行判断。第iv期是最严重恶化的大肠癌,是确认到向其他脏器的转移的阶段。在这样的分期中,难以进行外科切除,主要实施全身化学疗法。作为针对该浸润和转移性结肠直肠癌的治疗,在一线用药中广泛推荐folfox疗法+贝伐单抗(bevacizumab)、或folfiri疗法+贝伐单抗。其中,贝伐单抗(bev)是作为针对vegf-a(vascularendothelialgrowthfactora:血管内皮生长因子a)的人源化单克隆抗体而开发的、抑制vegf-vegfr结合的药物。肿瘤血管的血管内皮细胞通过暴露于药物而阻断vegfr(vascularendothelialgrowthfactorreceptor:血管内皮细胞生长因子受体)信号传导,结果是肿瘤血管受到强大的血管新生抑制作用。已确立bev对无法切除和复发结肠直肠癌的有用性,且出现在临床上已经过多年。bev的药理作用机理在开发新药时是明确的,从早期的临床开发阶段就投入精力进行对包括bev在内的血管新生抑制药的生物标志的研究。但是,目前尚未特定在临床实践上具有有用的重现性、简便、测定值在设施间没有差别、非浸润性的生物标志。同样地,对于folfox(5-氟尿嘧啶(5-fu)/左亚叶酸钙(i-lv)+奥沙利铂(l-ohp))疗法及folfiri(5-氟尿嘧啶(5-fu)/左亚叶酸钙(i-lv)+伊立替康(cpt-11))疗法这两种治疗方案的效果预测因子,目前尚未确定已证明在临床实践上有用的生物标志。将dna的拷贝数作为能用于选择对发病的患者的最佳药物治疗方法的标志,已知专利文献1(日本专利特开2011-135838号公报)。其能以高精度和概率预测导致明显视力下降的年龄相关性黄斑变性症的发病和进展,提供能适合用于年龄相关性黄斑变性症的早期预防、或选择针对已发病的患者的最佳的药物治疗方法的用于判定年龄相关性黄斑变性症感受性的标志。作为针对大肠癌使用dna拷贝数作为标志的例子,有专利文献2(日本专利特开2010-162029号公报)。这里,提供一种将两种非常不同类型的阵列组合,以高分辨率迅速且正确地检测出能成为癌和三体综合征等各种各样的遗传缺陷的标志的基因拷贝数的变化的方法。在该方法中,作为成为对象的疾病,可例举乳腺癌、肺癌、大肠癌、睾丸癌、子宫内膜癌或膀胱癌。此外,在专利文献3(日本专利特表2008-524986号公报)中,公开了将基因拷贝数的变化用在乳腺癌、卵巢癌、胃癌、大肠癌、食道癌、间质癌、膀胱癌或非小细胞肺癌的诊断、预后、预测、预防和治疗的方法,更具体而言,想要通过基因拷贝数的变化来进行针对包含taxol(商标)或taxotere(商标)等紫杉烷或其他基于紫杉烷的衍生物的各种治疗计划的肿瘤性病变的响应预测。现有技术文献专利文献专利文献1:日本专利特开2011-135838号公报专利文献2:日本专利特开2010-162029号公报专利文献3:日本专利特表2008-524986号公报技术实现要素:本发明所要解决的技术问题如专利文献3中所公开,关于在针对癌的治疗方法的响应预测中采用基因拷贝数的增加的方面,已被公开了。但是,没有具体地公开用于判断选择针对大肠癌的folfox疗法和folfiri疗法的哪一种对各患者是有利的标志。通常认为这些疗法不存在交叉耐药性,当一种药物疗法没有效果时,可进行另一种的药物疗法。但是,在一种药物疗法没有效果后再进行另一种的药物疗法,需要更大的对副作用的忍受性,从该方面及治疗成本的方面考虑,对患者而言,会成为大的负担。大肠癌的患者数仅在日本国内就超过10万人,今后对于folfox疗法和folfiri疗法确定抗肿瘤药的效果预测因子,进行治疗对象的分层,从医疗经济方面来看是有益的。此外,不仅在医疗经济方面,对于患者而言,还可带来以下有益性:避免因投给无效的药物而引起的有害事件的出现及由无效药物造成的无用的治疗期间等。因此,预测folfox疗法和folfiri疗法中的哪一种方法对该患者有利的必要性较高。解决技术问题所采用的技术方案本发明是鉴于上述技术问题而想到的,提供一种根据人染色体上的特定区域的拷贝数有无增加,表明进行folfox疗法或folfiri疗法对该患者是有利的生物标志和治疗方法的选择方法。更具体而言,本发明的生物标志是在针对大肠癌进行folfox疗法或folfiri疗法时,表明对患者而言哪一种疗法是有利的生物标志,其特征是,上述生物标志是人染色体上的7p15.3、7q34、8q24.1、8q24.2、8q24.1-q24.2、9q34.3、13q12.2、13q14.11、13q22.1、13q32.2-q32.3、13q34、20q12、20q13.13、20q13.2、20q13.3中的至少1个区域的拷贝数有无增加。此外,本发明是在针对大肠癌进行folfox疗法或folfiri疗法时,表明哪一种疗法对患者是有利的生物标志,其特征是,上述生物标志是人染色体上的7q34、8q24.1、8q24.2、8q24.1-q24.2、9q34.3、13q12.2、13q14.11中的任一个区域的拷贝数有无增加。此外,本发明的治疗方法的选择方法是针对大肠癌选择folfox疗法或folfiri疗法中的任一种疗法的选择方法,其特征是,包括:测定上述大肠癌的肿瘤组织试样的人染色体上的特定区域的拷贝数有无增加的工序,及根据上述拷贝数有无增加来选择上述folfox疗法或folfiri疗法的工序,上述人染色体上的特定区域是7p15.3、7q34、8q24.1、8q24.2、8q24.1-q24.2、9q34.3、13q12.2、13q14.11、13q22.1、13q32.2-q32.3、13q34、20q12、20q13.13、20q13.2、20q13.3中的至少1个区域。此外,本发明的治疗方法的选择方法的特征是,上述人染色体上的特定区域是7q34、8q24.1、8q24.2、8q24.1-q24.2、13q12.2、13q14.11中的至少1个区域,选择上述folfox疗法或folfiri疗法的工序是在上述特定区域的拷贝数增加的情况下选择folfiri疗法。此外,本发明的治疗方法的选择方法的特征是,上述人染色体上的特定区域是9q34.3区域,选择上述folfox疗法或folfiri疗法的工序是在上述特定区域的拷贝数无增加的情况下选择folfiri疗法。此外,本发明的治疗方法的选择方法的特征是,上述人染色体上的特定区域是7p15.3和8q24.1,选择上述folfox疗法或folfiri疗法的工序是在上述7q15.3中确认到拷贝数的增加,且在上述8q24.1中未确认到拷贝数的增加的情况下,选择folfox疗法。发明效果根据本发明的生物标志及治疗方法的选择方法,对于作为统计的效果大致相等的folfox疗法及folfiri疗法,可选择对各患者而言哪一种疗法是否是有利的。因此,对于患者而言,可起到在接受一种疗法后,没有必要再做另一种疗法的效果。附图的简要说明图1是显示利用安捷伦科技公司(アジレント社)的genomicworkbench6.5lite软件的染色体全部区域和在该区域中编码的基因的列出的例子的图。图2是显示在第7号、第8号、第13号、第20号染色体中具有扩增区域的部分的图。图3是显示基于第7号染色体长臂34(7q34)的区域中的拷贝数有无增加的生存率曲线的图图4是显示对于第7号染色体长臂中具有的共4个扩增区域,基于拷贝数有无增加的生存率曲线的图。图5是显示对于第13号染色体长臂中具有的共5个扩增区域,基于拷贝数有无增加的生存率曲线的图。图6是显示对于第20号染色体长臂中具有的共4个扩增区域,基于拷贝数有无增加的生存率曲线的图。图7是显示对于第7号、第13号、第20号中具有的扩增区域的ets的结果的图。图8是对于在os、ets双方确认到显著差异的7q34的区域,划分为(1)folfox疗法+贝伐单抗的folfox组75例、(2)folfiri疗法+贝伐单抗的folfiri组79例,(logrank:对数秩)检验各自有扩增的病例、无扩增的病例之间的os,共计4组进行了比较的结果(卡普兰-迈耶曲线)。图9是显示第13号染色体中的结果(kaplan–meyer曲线)的图。图10是显示第13号染色体中的结果(kaplan–meyer曲线)的图。图11是显示第20号染色体中的结果(kaplan–meyer曲线)的图。图12是显示第20号染色体中的结果(kaplan–meyer曲线)的图。图13是显示第7号染色体区域中的全部患者(154名)的拷贝数有增加(cng)、无增加之间的os、pfs中的差异以及有cng(+)、无cng(-)的两组中的folfox组、folfiri组之间的os、pfs中的差异(p值)的图。图14是显示第8号染色体区域中的全部患者(154名)的拷贝数有增加(cng)、无增加之间的os、pfs中的差异以及有cng(+)、无cng(-)的两组中的folfox组、folfiri组之间的os、pfs中的差异(p值)的图。图15是显示第13号、第20号染色体区域中的全部患者(154名)的拷贝数有增加(cng)、无增加之间的os、pfs中的差异以及有cng(+)、无cng(-)的两组中的folfox组、folfiri组之间的os、pfs中的差异(p值)的图。图16是显示7p15.3的区域中的pfs的卡普兰-迈耶曲线的图。图17是显示8q24.1的区域中的os的卡普兰-迈耶曲线的图。图18是显示8q24.1的区域中的pfs的卡普兰-迈耶曲线的图。图19是显示基于7p15.3和8q24.1的区域中的cng的状况进行分组后的pfs和os的卡普兰-迈耶曲线的图。图20是显示基于7p15.3和8q24.1的区域中的cng的状况进行分组后的pfs和os的卡普兰-迈耶曲线的图。图21是显示第7号、第8号、第13号、第20号以外的染色体扩增区域中的全部患者(154名)、folfox组(75名)、folfiri组(79名)的拷贝数有增加、无增加之间的os、pfs中的差异(p值)的图。图22是显示9q34.3区域的folfox组、folfiri组中的拷贝数有增加、无增加之间以及有cng(+)、无cng(-)的两组中的folfox组、folfiri组之间的卡普兰-迈耶曲线的图。具体实施方式以下,对本发明的生物标志和治疗方法的选择方法,示出附图和实施例进行说明。另外,以下的说明是对本发明的一种实施方式和一个实施例进行例示,本发明并不限定于以下的说明。以下的说明可在不脱离本发明的思想的范围内进行改变。在第iv期中使用的化学疗法中,使用folfox疗法和folfiri疗法。folfox疗法是指联用氟尿嘧啶(5-氟尿嘧啶(5-fu))、亚叶酸(左亚叶酸钙(i-lv))和奥沙利铂(oxaliplatin(l-ohp))这三种药物的治疗方法。在folfox疗法中还可以包括联用贝伐单抗(bevacizumab(bev))。folfiri疗法是指联用氟尿嘧啶(5-氟尿嘧啶(5-fu))、亚叶酸(左亚叶酸钙(i-lv))和伊立替康盐酸盐(irinotecan(cpt-11))(以下简称为“伊立替康”)这三种药物的治疗方法。在folfiri疗法中还可以包括联用贝伐单抗(bevacizumab(bev))。因此,folfox疗法和folfiri疗法的不同点是奥沙利铂和伊立替康的不同。但是,以往未能预测对于各个患者适合采用哪一种疗法。如以下的实施例所示,本发明中,在各患者的肿瘤组织试样中的染色体中,通过考察人染色体上的特定区域的拷贝数有无增加,能够判断选择哪一种疗法是有利的。这里,“有利的”是指能以高概率期待治疗后的生存期变长。此外,这里,人染色体上的特定区域的拷贝数有无增加可以通过后述的cgh法、pcr法、rt-pcr法等方法进行测定。实施例(实施例1)以下的实施例涉及使用的对象症例是符合无法切除和复发结肠/直肠癌初次化学疗法例,自2008年9月到2012年12月为止登记在西日本癌研究机构(westjapanoncologygroup)的“针对无法切除和复发结肠/直肠癌初次化学疗法例的5-氟尿嘧啶(5-fu)/左亚叶酸钙(i-lv)+奥沙利铂(l-ohp)+贝伐单抗(bev)联用疗法与5fu/i-li+伊立替康(cpt-11)+bev联用疗法的随机化比较第iii期试验(wjog4407g)”中,且获得wjog4407gtr同意的患者的数据。作为试样,使用由治疗前获得的肿瘤组织试样制作的病理玻片(ffpe玻片)。肿瘤组织试样是手术试样或者内视镜下的活组织,玻片是经过石蜡包埋、使用5微米的切片的薄切,固定在载玻片上而制作的玻片。因此,手术时采集试样或利用内视镜采集活组织可以称为采集肿瘤组织试样的工序。另外,也可以使用在临床试验登记以前采集的试样。肿瘤组织中的人染色体上的特定区域的拷贝数变化通过使用比较基因组杂交(comparativegenomichybridization(cgh))法进行了测定。cgh法是将全部染色体作为对象,在短时间内检测出基因组dna的过剩、缺失、扩增等拷贝数异常的方法。因为能检测出染色体拷贝数的变化,所以作为在现有的染色体分析法中难以详细解析的固体肿瘤的基因组异常分析法,现在被广泛利用。虽然能确定以染色体级别的物理尺寸发生的拷贝数的减少(loss)、增加(gain)、扩增(amplification),但是根据本技术不能检测出无伴随拷贝数的变化的染色体平衡易位。例如,如易位那样的染色体本身的数量不发生变化的情况等。由于预想最新鉴定的扩增区域所包含的癌相关基因随基因扩增其表达量也增加,所以以探索成为新癌治疗靶的基因为目的,频繁地进行cgh分析。在本研究中,使用自石蜡切片提取的基因组dna,通过使其与市售的来源于正常组织的dna竞争来进行分析。cgh分析的步骤如下所述。首先,进行从ffpe试样提取dna。进行了全部154个试样的dna的提取。接着,对从癌部提取的dna进行荧光标记和杂交的准备。具体而言,癌部dna用花菁5(cy5)进行荧光标记,参比dna(来源于正常组织的dna)用花菁3(cy3)进行荧光标记。如下进行杂交。将处理完成的110ul样品(cy5标记化癌部dna+cy3标记化参比dna)中的100ul涂覆在与安捷伦科技公司的cgh微阵列4x44k对应的垫片载玻片上。接着,以与4x44k微阵列载玻片中的探针的涂覆面接触的方式,使两玻片重叠后,固定于腔中。在旋转式炉中,在65℃下进行了40小时的杂交反应。实际的分析通过以下步骤来进行。首先,在两块重叠的垫片玻片和阵列玻片之间插入镊子,将其剥开。将阵列玻片插入盛满了安捷伦科技公司的cgh清洗用缓冲液1的玻璃容器中的玻片架中。然后在室温下放置了5分钟。接着,将阵列与玻片架一起转移到盛满了安捷伦科技公司的cgh清洗用清洗缓冲液2的其他玻璃容器中。然后在37℃下放置了1分钟。接着,将阵列取出,固定在玻片支架上。接着,固定在安捷伦科技公司的带有除臭氧滤器的扫描器上,进行了扫描。在pc(电脑)上安装安捷伦科技公司的扫描器控制软件,读取阵列的图像。接着,使用安捷伦科技公司的featureextraction软件,从之前读取的图像中,对于在阵列上结合了各个探针的点(约44000处)获得cy3、cy5的荧光强度。计算出cy5/cy3的log2比值,估算了各点(第〇号染色体的〇基因座)中的人染色体上的特定区域的拷贝数有无增加。将人染色体上的特定区域的拷贝数有无增加称为畸变(aberration)。使用安捷伦科技公司的genomicworkbench6.5lite软件对在第几号染色体的哪一区域存在畸变进行了分析。图1(a)(图示了各染色体的全部区域)和图1(b)(列出了各染色体上的区域中所编码的基因的表)是例示了该软件弹出的内容的图。基于该数据,可知道各症例的全部染色体中的畸变。对于图1的表(图1(b)),输出了样品名、染色体编号、基因座、扩增或缺失、该基因座中所包含的基因名等信息。本实施例中,在全部154个试样的所有试样中,记录了确认畸变的染色体及其基因座。本研究特别是仅对cy5/cy3的log2比>0.25,即与正常相比确认到扩增20.25=1.19倍以上的基因座进行了探索。这样与正常组织比较来算出拷贝数的增减,可以称为测定大肠癌的肿瘤组织试样的人染色体上的特定区域的拷贝数有无增减的工序。另外,像扩增为1.19倍这样,而没有达到整数倍,这是因为假定了正常细胞的混入或肿瘤细胞的不均匀性等收集dna的肿瘤组织中的细胞的异质性(heterogeneity)。此外,对于大部分的人基因,也可以使用能简便地进行所有组织中的基因拷贝数的测定的生命技术公司(ライフテクノロジーズ社)的“taqman(注册商标)拷贝数测定(copynumberassay)”。对于从成为此次(1)folfox疗法+贝伐单抗、(2)folfiri疗法+贝伐单抗两者联用疗法的对象的154名大肠癌患者的治疗前的手术试样、或者活组织标本(内视镜下活组织)的石蜡包埋切片提取的癌部基因组dna,使用安捷伦科技公司的试剂盒“安捷伦寡核苷酸cgh微阵列试剂盒(agilentoligocghmicroarraykit)”进行了cgh分析。另外,各患者的观察期为1600天。将人染色体上的特定区域的拷贝数增加的截断值设定为log2比>0.25,对扩增为原来的约1.2倍以上,即2.4拷贝数以上的区域进行了探索。于是,在第7号、第8号、第13号、第20号染色体中具有扩增的症例集中。在表1中示出30症例以上显示扩增的区域。[表1]染色体编号(chr)基因座(locus)例数pfs(p值)os(p值)7q11.21370.510.00277q11.22-23440.260.00297q34350.370.00697q36.2340.740.00688p11.1350.710.468p11.23310.780.698q22.2520.160.638q24.2630.260.3613q12.2740.360.009713q14.11640.260.019713q22.1670.350.028913q32.2-q32.3660.250.012713q34640.330.024620p13430.640.001120p12.1-p11.23440.770.001520p11.2520.810.002720q12970.670.005620q13.131010.560.009120q13.21050.790.009620q13.3840.570.0183表1中,“chr”表示染色体编号,“locus”表示基因座。对于这些各区域,在拷贝数有增加的症例(患者)、拷贝数无增加的症例(患者)这两组之间进行了pfs(progression-freesurvival:无进展生存期)和os(overallsurvival:总生存期)的对数秩检验。其结果是,在任何区域中都没有确认到pfs存在显著差异。但是,在除第8号染色体以外的所有区域中,都确认到os存在显著差异(p<0.05)。这样的os具有显著差异的人染色体上的特定区域暗示可能包含预后制约因子。在图1中,在os具有显著差异的人染色体上的特定区域标以下划线。图2是显示在第7号、第8号、第13号、第20号染色体中的扩增区域的图。箭头的部分表示显示了扩增的区域,实际上扩增区域具有以该部分为中心的一定程度的宽度。另外,第7号、第13号、第20号的长臂的区域编号用引出线表示。其中,在图3中显示第7号染色体长臂34(7q34)的区域中的结果(生存率曲线)。图3(a)是pfs的结果,图3(b)是os的结果。在图3(a)和图3(b)中,横轴都是观察期(天:刻度从0天到1600天),纵轴都是生存率(无单位:刻度从0到1)。此外,方形标记是在这些区域中有扩增(扩增+),菱形标记是在这些区域中无扩增(扩增-)。在该区域中有扩增的患者(扩增+)与无扩增的患者(扩增-)相比,在os上显示更显著的预后良好。图4是显示了第7号染色体长臂中具有的共4个的扩增区域的图。图4(a)显示了7q11.21的情况,图4(b)显示了7q11.22-23的情况,图4(c)显示了7q34的情况,图4(d)显示了7q36.2的情况。任一个图的横轴都是观察期(天:刻度从0天到1600天),纵轴都是生存率(无单位:刻度从0到1)。此外,方形标记是在这些区域中有扩增(扩增+),菱形标记是在这些区域中无扩增(扩增-)。在任一个中,有扩增的患者与无扩增的患者相比,在os上都是更显著地呈现预后良好。此外,这些区域因为都位于同一染色体的相同臂(长臂)中,且归到有扩增、无扩增中的任一组的患者的组合彼此接近,因此呈现出近似的曲线。图5中显示第13号染色体的os的结果(生存率曲线),图6中显示第20号染色体的os的结果(生存率曲线)。图5(a)显示13q12.2的扩增区域,图5(b)显示13q14.11的扩增区域,图5(c)显示13q22.1的扩增区域,图5(d)显示13q32.2-q32.3的扩增区域,图5(e)显示13q34的扩增区域。此外,图6(a)显示20q12的扩增区域,图6(b)显示20q13.13的扩增区域,图6(c)显示20q13.2的扩增区域,图6(d)显示20q13.3的扩增区域。任一个图的横轴都是观察期(天:刻度从0天到1600天),纵轴都是生存率(无单位:刻度从0到1)。此外,方形标记是在这些区域中有扩增(扩增+),菱形标记是在这些区域中无扩增(扩增-)。这些染色体中的扩增区域也均是有扩增的患者预后良好,而且在相同的染色体臂上,即第13号长臂、第20号长臂中,也显示出类似的生存率曲线。接着,研究了ets(earlytumorshrinkage=早期肿瘤退缩情况)的影响。对于自登记时起经过8周时的肿瘤的大小,即与原来大小相比的百分比,以各染色体区域检验(t-test)了有扩增的症例、无扩增的症例这两组间的平均值的差异。结果示于表2。在表2中,对est的检验结果小于5%的人染色体上的特定区域标记了下划线。此外,对os存在显著差异的也标记了下划线。ets的结果示于图7中。[表2]染色体编号(chr)基因座(locus)例数os(p值)ets7q11.21370.00270.12597q11.22-23440.00290.13907q34350.00690.00447q36.2340.00680.161013q12.2740.00970.0003213q14.11640.01970.0001913q22.1670.02890.0002213q32.2-q32.3660.01270.0006713q34640.02460.0022620p13430.00110.104620p12.1-p11.23440.0015.0.108420p11.2520.00270.073620q12970.00560.002720q13.131010.00910.009820q13.21050.00960.005220q13.3840.01830.0028图7显示第7号(图7(a))、第13号(图7(b))、第20号(图7(c))的各染色体中的ets的结果。在各横轴方向上显示各染色体有无扩增(amplification的±)以及针对ets的p值。纵轴显示与肿瘤登记时相比的大小的比例(%)。另外,p值小于5%的,在p值的下面标有下划线。如图7(a)所示,在第7号染色体长臂中,在1处(q34)中ets有显著差异。此外,如图7(b)所示,在第13号长臂中,在5处(q12.2、q14.11、q22.1、q32.2-q32.3、q34)中ets均有显著差异,如图7(c)所示,在第20号位于长臂的4处(q12、q13.13、q13.2、q13.3)中ets有显著差异(在短臂的3处没有显著差异)。即,在全部的10处区域中ets有显著差异。这里,重要的是在人染色体上的特定区域的拷贝数有扩增的症例中,可观察到肿瘤的显著退缩。可以说这是在有扩增的症例中,与os的预后良好的结果(图3~图6的结果)相矛盾的结果。因此,认为不仅是os,在ets中也确认到显著差异的这些共10处的染色体区域可能包含多药联用化学疗法(1)folfox疗法+贝伐单抗或(2)folfiri疗法+贝伐单抗的效果预测因子。即,在第7号、第13号、第20号的上述10处中,只要在至少1处的染色体区域中确认到拷贝数的增加,就知道进行folfox疗法或folfiri疗法对患者产生有利的作用。换言之,可将人染色体上的特定区域的拷贝数的增加作为显示进行folfox疗法或folfiri疗法是有利的标志来利用。此外,此时拷贝数的增加是指,只要扩增为正常组织的至少2.4拷贝以上即足够。以下,示出关于在该(1)和(2)这两种联用疗法之间有无治疗效果显示差异的区域的结果。图8~图12是对于在os、ets双方确认到显著差异的10个区域(7q34、13q12.2、13q14.11、13q22.1、13q32.2-q32.3、13q34、20q12、20q13.13、20q13.2、20q13.3),划分为(1)folfox疗法+贝伐单抗的folfox组75例、(2)folfiri疗法+贝伐单抗的folfiri组79例,(对数秩)检验各自有扩增的症例、无扩增的症例之间的os,共计4组进行了比较的结果(kaplan–meyer曲线)。在图8~图12中,对p值小于5%(0.05)的数值标记下划线。在图8中,横轴是观察期(天:刻度从0天到1600天),纵轴是生存率(无单位,从0到1)。“x+”是在folfox疗法+贝伐单抗中人染色体上的特定区域的拷贝数有扩增,“x-”是在folfox疗法+贝伐单抗中没有扩增。“r+”是在folfiri疗法+贝伐单抗中有扩增,“r-”是在folfiri疗法+贝伐单抗中无扩增。以下的图9~图12也同样。参照图8,可知在第7号染色体q34中,与folfox组(x+和x-)相比,folfiri组(r+和r-)的有扩增、无扩增的症例间的效果差异较大。在folfiri疗法的情况下,p值为0.0128,在r+とr-之间显示显著的差异(p=0.0128)。因此,在该区域中,虽然对奥沙利铂没有影响,但有可能包含提高伊立替康的感受性的基因。在该区域(7q34),在确认拷贝数的扩增的症例(35例)中共同的(7q34中所含的扩增了的)基因是hipk2、tbxas1、parp12、jhdm1d、loc100134229、slc37a3、rab19、mkrn1(参照下述的表3)。根据7q34的有无扩增,可以选择folfox疗法和folfiri疗法中的任一种,但是也可以通过测定7q34中所含的上述基因的拷贝数来选择folfox疗法和folfiri疗法中的任一种。图9和图10中显示第13号染色体中的结果。如图9和图10所示,第13号染色体也同样地,folfiri组的有无扩增的差异较大。而且,在有扩增的情况下,可观察到folfiri组比folfox组的感受性更高的倾向(p=0.2左右)。因此,在该区域中,虽然对奥沙利铂没有影响,但也有可能包含提高伊立替康的感受性的基因。特别是在13q12.2、13q14.11、13q22.1的3个区域中,显著地显示了伊立替康和奥沙利铂的差异。在13q12.2区域中,在确认拷贝数的扩增的症例(74例)中共同的(13q12.2中所含的扩增了的)基因是21个基因:usp12、rpl21、rpl21p28、snord102、snora27、rasl11a、gtf3a、mtif3、lnx2、polr1d、gsx1、pdx1、atp5ep2、cdx2、prhoxnb、flt3、loc100288730、pan3、flt1、pomp、slc46a3(参照下述的表3)。此外,在13q14.11区域中,在确认拷贝数的扩增的症例(64例)中共同的(13q14.11中所含的扩增了的)基因是27个基因:loc646982、foxo1、mir320d1、mrps31、slc25a15、sugt1l1、mir621、elf1、wbp4、kbtbd6、kbtbd7、mtrf1、naa16、or7e37p、c13orf15、kiaa0564、dgkh、akap11、tnfsf11、c13orf30、epsti1、dnajc15、enox1、ccdc122、c13orf31、loc121838、serp2(参照下述的表3)。在13q22.1区域中,在确认拷贝数的扩增的症例(67例)中共同的(13q22.1中所含的扩增了的)基因是2个基因:pifb1、klf5(参照下述的表3)。根据13q12.2、13q14.11、13q22.1的拷贝数有无扩增,可以选择folfox疗法和folfiri疗法中的任一种,但是也可以通过测定这3个区域中所含的上述基因的拷贝数来选择folfox疗法和folfiri疗法中的任一种。图11和图12中显示第20号染色体中的结果。如图11和图12所示,在第20号染色体中也有相似的倾向,但是在folfox组也出现在有扩增、无扩增之间效果不同的倾向(x+对x-;p=0.06-0.2),在该4个区域中,包含对奥沙利铂、伊立替康中的任一个的感受性特异地产生影响的基因的可能性较低。根据以上所述,作为将两种联用疗法的效果区别的生物标志,可列举7q34、13q12.2、13q14.11、13q22.1这4个区域,表3中示出的这4个区域的扩增区域内所含的基因也有可能成为生物标志的候选。[表3]只要使用大肠癌细胞株,进行表3示出的这些候选基因的大量表达、或者基于sirna的敲减,测定伊立替康和奥沙利铂的感受性的变化,就能期待发现效果预测因子(基因),通过表3示出的基因的拷贝数(表达量)的测定,能预测在各个大肠癌的患者中,哪一种疗法作为贝伐单抗的联用药是有利的。此外,即使不确定效果预测因子(基因),只要在7q34、13q12.2、13q14.11、13q22.1的4处中的至少1个区域中有拷贝数的扩增,就能预料进行folfiri疗法对于该患者而言是治疗效果提高的疗法。特别是在13q12.2、13q14.11、13q22.1的3个区域中,显著地显示了伊立替康和奥沙利铂的差异。因此,通过调查这3个区域的至少1个区域的拷贝数的增加,能以高准确度预测进行folfiri疗法对该患者是有利的。此外,folfox疗法和folfiri疗法的不同点是奥沙利铂和伊立替康的不同,因此,7q34、13q12.2、13q14.11、13q22.1的4处中的任一区域的拷贝数的扩增也可作为预测伊立替康的治疗效果的标志来使用。这里,拷贝数的增加是指,只要扩增为正常组织的至少2.4拷贝以上即足够。(实施例2)接着,示出对实施例1中获得wjog4407grt同意的患者的观察期到70个月为止进行总结的结果。因为与实施例1的情况相比,观察期更长,所以得到了准确度更高的结果。与实施例1同样地,将人染色体上的特定区域的拷贝数扩增的截断值设定为log2比>0.25,对扩增为原来的约1.2倍以上,即2.4拷贝数以上的区域进行了探索。于是,在第7号、第8号长臂、第13号、第20号染色体中具有扩增的症例集中。在第7号、第8号、第13号、第20号染色体中的扩增区域如图2所示。在图13(第7号)、图14(第8号)、图15(第13号、第20号)中显示制成表的以染色体带划分的这些各染色体区域中的全部患者(154名)、folfox疗法组(75名)、folfiri疗法组(79名)的拷贝数有增加(cng:copynumbergain)、拷贝数无增加之间的os、pfs中的差异(p值)以及有cng(+)、无cng(-)的两组中的folfox疗法组、folfiri疗法组之间的os、pfs中的差异(p值)。对于这些各区域,若在全部患者(154名)中的人染色体上的特定区域的拷贝数有扩增的症例(患者)、无扩增的症例(患者)的两组之间进行pfs(无进展生存期)和os(总生存期)的对数秩检验,则在任一区域中都没有确认到pfs存在显著差异。但是,在第7q号、第13q号、第20号染色体的多个区域中确认到了os存在显著差异(参照图13、14、15的“总计(154)”栏的“os”)。即,p值小于0.05(p<0.05)。这样的os具有显著差异的基因扩增区域暗示可能包含预后制约因子。若参照图13,则在第7号染色体短臂7p的大部分区域中的cng(-)组中,观察到pfs存在准显著差异(日文:準有意な差)(p<0.1)。其中,将p值最小的7p15.3的区域中的pfs的卡普兰-迈耶曲线示于图16中。图16(a)与folfox疗法相关,是关于有增加(cng(+))、无增加(cng(-))的图。图16(b)与folfiri疗法相关,是关于有增加(cng(+))、无增加(cng(-))的图。图16(c)与有增加(cng(+)相关,是关于folfox疗法和folfiri疗法的图。此外,图16(d)与无增加(cng(-))相关,是关于folfox疗法和folfiri疗法的图。关于全部的图,横轴是观察期(记为“时间(月)”),纵轴是关于pfs的生存概率(记为“pfs概率”)。另外,各图横轴记载了从0到70(个月)的刻度,纵轴记载了从0到1的刻度。若参照图16,则在图16(d)中可观察到p值为0.059的准显著差异。即,在该区域中基因没有扩增的患者中,可以说folfiri疗法显示出比folfox疗法高的治疗效果。接着,参照图14。在从第8号染色体长臂24.1到24.2(8q24.1-q24.2),可观察到cng(+)组中的pfs存在显著差异(p=0.037)或准显著差异(p=0.053)。在图17中显示8q24.1中的os的卡普兰-迈耶曲线,在图18中显示pfs。在各图中,横轴是观察期(记为“时间(月)”),纵轴是生存概率(记为“os或pfs概率”),与图16的情况相同。此外,在各图中,(a)与folfox疗法相关,是关于有增加(cng(+))、无增加(cng(-))的图;(b)与folfiri疗法相关,是关于有增加(cng(+))、无增加(cng(-))的图;(c)与有增加(cng(+)相关,是关于folfox疗法和folfiri疗法的图;此外,(d)与无增加(cng(-))相关,是关于folfox疗法和folfiri疗法的图,也与图16相同。另外,各图横轴记载了从0到70(个月)的刻度,纵轴记载了从0到1的刻度。参照图17(a)、图17(b),在folfox疗法组中,cng(-)中os显著变长;在folfiri疗法组中,cng(+)中os显著变长(各自的p值都小于0.05)。此外,在cng(+)组(参照图17(c))中,folfiri疗法组与folfox疗法组相比,预后更加良好(p=0.004)。参照图18。反映图17的结果,在pfs中,在cng(+)组(参照图18(c))中,folfiri疗法组与folfox疗法组相比,治疗效果也是显著地较高(p=0.037)。在图19、图20中显示根据7p15.3和8q24.1中的cng的状况分组的4组中的pfs和os的卡普兰-迈耶曲线。图19(a)、图19(b)是7p15.3和8q24.1的cng均有增加(cng(+))的情况。图19(a)是关于pfs的曲线,图19(b)是关于os的曲线。图19(c)、图19(d)是7p15.3的cng有增加(cng(+)),8q24.1的cng无增加(cng(-))的情况。图19(c)是关于pfs的曲线,图19(d)是关于os的曲线。图20(a)、图20(b)是7p15.3的cng无增加(cng(-)),8q24.1的cng有增加(cng(+))的情况。图20(a)是关于pfs的曲线,图20(b)是关于os的曲线。图20(c)、图20(d)是7p15.3和8q24.1的cng均无增加(cng(-))的情况。图20(c)是关于pfs的曲线,图20(d)是关于os的曲线。此外,在各图中,横轴是观察期(记为“时间(月)”),纵轴是生存概率(记为“os或pfs概率”)。另外,各图横轴记载了从0到70(个月)的刻度,纵轴记载了从0到1的刻度。在7p15.3中的cng(-)、8q24.1中的cng(+)的情况下(即cng(-、+):参照图20(a)、(b)),显示了在folfiri疗法组中治疗效果有较大的优势。在cng(+、+)(图19(a)、(b))和cng(+、-)(图19(c)、(d))的情况下,根据os的卡普兰-迈耶曲线(图19(b)和(d)),分别暗示了folfiri疗法、folfox疗法的有利性。即,图19(a)、(b)中,如果在7p15.3和8q24.1的各区域中均确认到基因拷贝数的增加,则暗示folfiri疗法是有利的。此外,图19(c)、(d)中,如果在7p15.3中基因有增加,在8q24.1中基因无增加,则暗示folfox疗法是有利的。接着,再参照图14。在从8q24.1到8q24.2区域确认cng有增加的症例中,nsmmce2、trbi、fam84b、pou5f1b、loc727677、myc、pvt1是最频繁地共同显示cng有增加(确认到拷贝数增加)的基因组。根据以上所述,暗示了在该区域内可能包含提高folfiri疗法的效果的因子。如果发现了提高folfiri(伊立替康)疗法的感受性的基因a,则对于各个浸润和转移性结肠直肠癌的患者,通过预测基因a的拷贝数,如果确认到增加,就能积极地选择folfiri疗法和贝伐单抗的联用治疗。此外,参照图13,在包含7p15.3的7p全部区域中,有可能包含提高folfox疗法的效果的因子。在图21中显示第7号、第8号、第13号、第20号以外的染色体扩增区域中的全部患者(154名)、folfox组(75名)、folfiri组(79名)的拷贝数有增加、无增加之间的os、pfs中的差异(p值)。其中,在图22中显示在pfs中确认到特别低的值(0.11)的9q34.3区域的folfox疗法组、folfiri疗法组中的拷贝数有增加、无增加之间以及有cng(+)、无cng(-)这两组中的folfox疗法组、folfiri疗法组之间的卡普兰-迈耶曲线。图22(a)与folfox疗法相关,是关于有增加(cng(+))、无增加(cng(-))的图。图22(b)与folfiri疗法相关,是关于有增加(cng(+))、无增加(cng(-))的图。图22(c)与有增加(cng(+)相关,是关于folfox疗法和folfiri疗法的图。此外,图22(d)与无增加(cng(-))相关,是关于folfox疗法和folfiri疗法的图。关于全部的图,横轴是观察期(记为“时间(月)”),纵轴是关于pfs的生存概率(记为“pfs概率”)。另外,各图横轴记载了从0到70(个月)的刻度,纵轴记载了从0到1的刻度。若参照图22(d),则在全部154症例中,在该区域内拷贝数无增加的137例中,folfiri疗法的治疗效果是显著良好。在9q34.3区域内确认cng有增加的患者中,最频繁地共同显示cng有增加的基因组是notch1、egfl7、mir126、agpat2、fam69b、snhg7。它们之中,有可能包含提高folfox疗法的治疗效果、或降低folfiri疗法的治疗效果的因子。如果发现了这样的因子b,则对于各个浸润和转移性结肠直肠癌的患者,通过测定基因b的拷贝数,对于未发现有基因b的拷贝数的增加的患者,可以优先选择folfiri(伊立替康)疗法作为贝伐单抗的联用疗法。当然,即使没有确定这样的基因b,如果9q34.3区域的cng没有增加,则可以优先选择folfiri(伊立替康疗法)作为贝伐单抗的联用疗法。根据以上所述,作为将两种联用疗法的效果区别的生物标志候选,可例举在8q24.1-q24.2、9q34.3这两处的扩增区域内所含的基因,通过考察8q24.1-q24.2、9q34.3这两处的扩增区域的拷贝数有无增加,可以进行联用治疗的选择。更具体而言,在8q24.1-q24.2的扩增区域内基因有扩增的情况下,选择folfiri疗法作为贝伐单抗的联用疗法即可。另外,8q24.1-q24.2的增加区域包括仅在8q24.1区域内或仅在8q24.2区域内基因的拷贝数有增加的情况。此外,在9q34.3扩增区域内基因无扩增的情况下,选择folfiri疗法作为贝伐单抗的联用疗法即可。产业上利用的可能性本发明的生物标志适合在判断选择folfox疗法和folfiri疗法中的哪一种作为大肠癌的治疗方法时使用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1