邻苯二甲酰亚胺类吲哚胺‑2,3‑双加氧酶1抑制剂及其用途的制作方法
本发明涉及药物化学领域,具体涉及一种具有邻苯二甲酰亚胺结构的IDO1抑制剂及制备方法。
背景技术:
吲哚胺-2,3-双加氧酶(Indoleamine 2,3-dioxygenase,IDO)是细胞内的一种含有亚铁血红素的代谢酶,它是介导色氨酸代谢的关键限速酶,是犬尿氨酸途径的重要组成部分。IDO自2003年被发现以来,其作为药物研发的重要靶点被学术界和制药界广泛研究。
色氨酸降解的第一步是将色氨酸氧化为N-甲酰基-L-犬尿氨酸,它是由IDO和色氨酸-2,3-双加氧酶(tryptophan 2,3-dioxygenase,TDO)这两种亚铁血红素依赖型双加氧酶其中的一种介导产生的。在这两种双加氧酶中,IDO被认为是调节该氧化反应发生的检查点,其存在与作用的发挥是人体产生免疫抑制力的主要原因。IDO进一步分为IDO1和IDO2。正常情况下IDO1在体内呈低水平表达,当干扰素(IFN-α,、IFN-β和IFN-γ)、白介素(IL-1和IL-2)、肿瘤坏死因子(TNF)等多种细胞因子诱导IDO1水平升高时,色氨酸将被大量代谢,从而抑制人体对寄生性、病毒性、细菌性、真菌性等病原体的免疫应答,人体将处于病态的免疫抑制状态。
在大多数肿瘤细胞中IDO1的高表达降低了细胞微环境中色氨酸的浓度,使得色氨酸依赖的T细胞合成停滞于G1期,T细胞增殖受到抑制,从而抑制了人体的免疫系统对肿瘤组织的杀伤作用。同时,具有细胞毒性的色氨酸代谢产物可以对T细胞产生直接的溶解作用。因此,IDO1在肿瘤免疫豁免和肿瘤的发生发展中起着重要作用。
在一些慢性疾病如获得性免疫缺陷综合证(AIDS)、多种类型抑郁症、阿尔兹海默症等中,IDO1也被认为是促进病情发展的原因之一。高水平的干扰素诱导IDO1高表达。在干扰素的持续活化下,IDO1降低了游离血清色氨酸的利用度,从而降低了5-羟色胺的产生。加之具有神经活性的犬尿氨酸代谢物的蓄积,多种神经病学病症和心理障碍的产生一触即发。
由于IDO1已被证明与多种疾病发病机制密切相关,因此IDO1抑制剂可用于治疗IDO1介导的色氨酸代谢途径的病理学特征的疾病,这些疾病包括且不仅限于恶性肿瘤、自身免疫性疾病、阿尔兹海默症和精神分裂症。IDO1抑制剂作为药物具有广阔的开发前景,然而迄今为止未有合适的IDO1抑制剂作为药物上市,因此寻找新型高效的IDO1抑制剂具有重要的理论意义和应用价值。
技术实现要素:
本发明公开了一种含有邻苯二甲酰亚胺类结构的化合物,结构式如下:
X代表氢、卤素或甲基;
R代表-NH2、
n代表0~3;
m代表0或1。
其中X优选代表甲基。
R优选代表
本发明优选的部分化合物如下:
本发明还公开了化合物(I)的制备方法,包括:
其中X、R的定义同前。
式II所示化合物与NaNO2发生反应生成式III所示化合物,反应温度优选0~5℃,反应时间优选12~24h,反应溶剂为浓盐酸和醋酸组成的混合溶剂。反应中加入NaCl。
式III所示化合物与含有R基团的胺反应生成式IV所示化合物,反应温度优选25~30℃,反应时间优选1~3h,反应溶剂为乙酸乙酯、二氯甲烷等。反应中还加入无机碱或有机碱,如碳酸钠、碳酸氢钠、三乙胺等。
式IV所示化合物回流变构成式V所示化合物,反应温度优选80~100℃,反应时间优选12~20h,反应溶剂为水、乙醇等。反应中还加入无机碱,如氢氧化钠、氢氧化钾等。
式I所示通式可由式V所示化合物与X取代的邻苯二甲酸酐回流生成,反应温度优选110~120℃,反应时间优选12~20h,反应溶剂为乙酸、浓盐酸、三氟乙酸等。
通式I化合物可以采用常见的分离方法进行纯化,如重结晶、柱层析等。
本发明也包括通式I化合物药学上可接受的盐等。
本发明所述的化合物可以添加药学上可接受的载体制成常见的药用制剂,如片剂、胶囊、粉剂、糖浆、液剂、悬浮剂、针剂,可以加入香料、甜味剂、液体或固体填料或稀释剂等常用药用辅料。
本发明所述的化合物在临床上的给药方式可以采用口服、注射等方式。
一般地,本发明的化合物用于治疗时,人用剂量范围为1mg~1000mg/天。也可根据剂型的不同和疾病严重程度,使用剂量超出该范围。
以下是本发明部分化合物的药理学试验及结果:
(1)IDO1抑制活性的测定实验
在大肠杆菌中表达具有N-末端His标签的人吲哚胺2,3-双加氧酶(IDO),提取并纯化IDO1。IDO1催化色氨酸吲哚环的吡咯环的氧化断裂得到N’-甲酰基犬尿氨酸。在96孔板上将50mM磷酸钾缓冲液(pH 6.5),40mM维生素C,400μg/mL过氧化氢酶,20μM亚甲蓝和IDO1酶混合。向上述混合液内加入底物L-色氨酸和待测样品。反应在37℃下进行60min,加入30%(w/v)三氯乙酸使反应终止。96孔板在65℃下加热15min,使之完成从甲酰犬尿氨酸到犬尿氨酸的转化,然后6000rpm旋转10min。每孔取出100μL上清液转移到新的96孔板内,加入2%(w/v)对-(二甲基氨基)苯甲醛的乙酸溶液100μL,犬尿氨酸与之反应产生黄颜色可使用酶标仪在480nm观测,所得结果利用IC50(nM)计算软件计算。利用上述方法,对化合物的IDO1抑制活性进行测定,其IC50(nM)如下,并用目前处于I期临床试验的IDO抑制剂NLG-919作为对照。结果见表1.
表1本发明部分化合物对IDO1的抑制活性IC50(nM)
由表1可见,本发明部分化合物对IDO1有良好的抑制活性。
(2)基于Hela细胞的IDO1抑制活性的测定实验
在37℃,将细胞保存在提供5%CO2的控湿培养箱中。如下进行测定:按5000/孔的密度,将Hela细胞接种在96孔培养板中,并培养过夜。第二天,将IFN-γ(终浓度50ng/mL)和化合物的系列稀释液(总体积200μL培养基)加给细胞。温育48h后,将140μL上清液/孔移至新的96孔板中。将10μL6.1N三氯乙酸混入各孔,在50℃温育30min使产生的N-甲酰基犬尿氨酸水解为犬尿氨酸。然后以6000rpm将反应混合物离心10min以去除沉淀物。将100μL上清液/孔移至另一96孔板中,与乙酸中的100μL2%(w/v)对二甲氨基苯甲醛混合,在480nm测量犬尿氨酸产生的黄色。用L-犬尿氨酸作标准。用100μL培养基制备标准液(240、120、60、30、15、7.5、3.75、1.87μM),并将它们与等体积的2%(w/v)对二甲氨基苯甲醛混合。测定各个浓度下的抑制百分率,使用非线性回归分析数据,得到IC50(μM)值,并用目前处于I期临床试验的IDO抑制剂NLG-919作为对照。结果见表2.
表2本发明部分化合物基于Hela细胞的IDO1抑制活性IC50(μM)
由表2可见,本发明部分化合物对IDO1有良好的抑制活性。
(3)IDO1抑制剂的抗肿瘤活性的体内实验
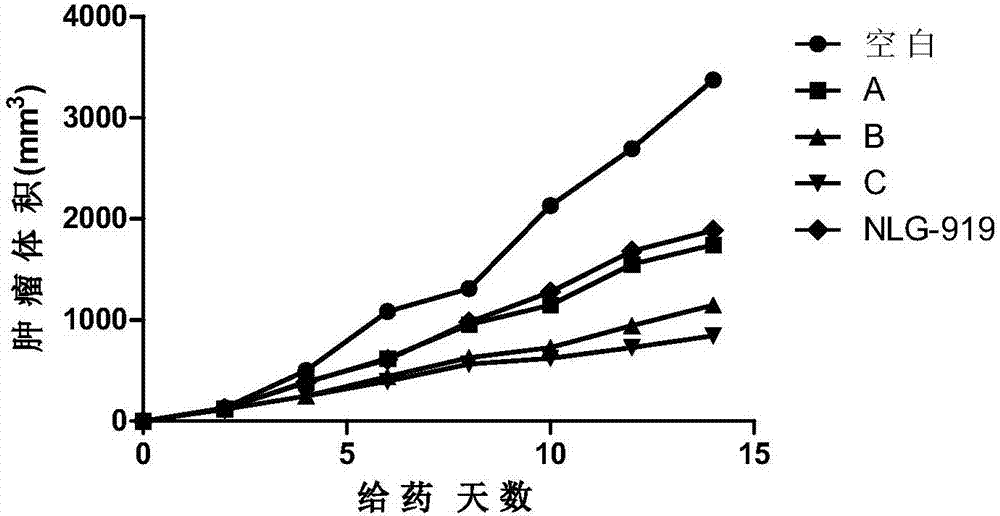
收集生长旺盛期鼠黑色素瘤细胞B16F10,在无菌条件下制备成细胞悬液,接种于C57BL6小鼠腋下。C57BL6小鼠移植瘤用游标卡尺测量移植瘤直径,待肿瘤生长至一定大小后将动物分组,每组5只。使用测量瘤径的方法,动态观察被试物抗肿瘤的效应。空白对照给予等剂量0.5%CMC(羧甲基纤维素钠),灌胃给药;化合物组进行腹腔注射,隔天一次,持续15天。从给药当天开始测量肿瘤长径(a)和短径(b),每隔一天测量一次,肿瘤体积=ab2/2。15天后处死荷瘤C57BL6小鼠,并分离瘤块称重。所得数据进行统计学处理,计算抑瘤率,并用目前处于I期临床试验的IDO抑制剂NLG-919作为对照。结果见表3、图1和图2.
表3本发明代表性化合物CPUL-I021的B16F10移植瘤的生长抑制率
由图1、图2和表3可见,本发明化合物对恶性肿瘤的生长具有良好的抑制活性。
(4)IDO1抑制剂在大鼠中的药代动力学实验
选取SD大鼠10只,雄性,体重180~200g,灌胃或静脉给予化合物CPUL-I021,见表4:
表4化合物CPUL-I021在大鼠中的给药情况
灌胃给药以1%MC配制为悬浮液,静脉注射以DMSO:30%PEG400(5:95)配制。试验前禁食12h,自由饮水。给药后2h统一进食。给药后按照以下时间点采血:灌胃给药组采血时间点为给药后0.25,0.5,1.0,2.0,4.0,6.0,8.0和24h;静脉给药组采血时间点为给药后0.25,0.5,1.0,2.0,4.0,6.0,8.0和24h。在上述时间点经大鼠眼球后静脉丛取静脉血0.3mL,置于EDTA-2K试管中,11000rpm离心5min,分离血浆,置于-20℃冰箱中冷冻。采用LC/MS/MS法测定大鼠血浆中化合物CPUL-I021的浓度。采用非房室模型计算给药后的药代动力学参数。达峰浓度Cmax和达峰时间Tmax为实测值;药时曲线下面积AUC0-t值采用梯形法计算;AUC0-∞=AUC0-t+Ct/ke,Ct为最后一个可测得时间点的血药浓度,ke为消除速率常数;消除半衰期t1/2=0.693/ke;平均滞留时间MRT=AUMC/AUC。清除率CL=D/AUC0-∞;稳态分布容积Vss=CL×MRT;绝对生物利用度F=(AUC灌胃×D静脉)/(AUC静脉×D灌胃)×100%。结果见表5和表6.
表5大鼠灌胃给药10mg/kg CPUL-I021后的药动学参数
表6大鼠静脉给药1mg/kg CPUL-I021后的药动学参数
附图说明
图1是处死荷瘤C57BL6小鼠后分离瘤块称重
图2是肿瘤体积与给药天数关系
具体实施方式
实施例1
4-氨基-3-(N’-羟基脒基)-1,2,5-噁二唑(II)的制备
将亚硝酸钠(20.7g,300mmol)和40mL水加入到500mL反应瓶中,搅拌溶解,室温下缓慢滴加丙二腈(9.9g,150mmol)的盐酸(2N)溶液,室温搅拌过夜,冷却至0℃,滴加盐酸羟胺(23g,340mmol)的水溶液,搅拌30min,20℃以下用10N氢氧化钠调节pH至10,升至35℃反应2h,再加热回流2h。冷却至室温,反应液用20mL乙酸乙酯萃取,减压蒸除溶剂得白色固体,将水层放置过夜,析出固体,抽滤,水洗,滤饼与减压蒸馏得白色固体合并干燥得白色粉末状固体(14.9g,69.5%)。1H NMR(300MHz,DMSO-d6)δ:10.46(s,1H,-OH),6.24(s,2H,-NH2),6.02(s,2H,-NH2)ppm.HRMS m/z[M+H]+calculated for C3H5N5O2:143.0516,found:143.0518。
4-氨基-3-氯代甲肟基-1,2,5-噁二唑(III)的制备
将II(4.18g,29.2mmol),58.4mL水,29.7mL醋酸和14.6mL的6N盐酸加入到250mL反应瓶中,升至45℃搅拌溶解,加入氯化钠固体(5.12g,87.5mmol),搅拌溶解,冷却至0℃,析出白色固体,缓慢滴加亚硝酸钠(2.00g,29mmol)的水溶液,0℃以下搅拌3h,升至室温,抽滤,滤饼水洗,甲苯重结晶得白色粉末状固体(2.52g,53.2%)。1H NMR(300MHz,DMSO-d6)δ:13.39(s,1H,-OH),6.29(s,2H,-NH2)ppm.HRMS m/z[M+H]+calculated for C3H3ClN4O2:161.9872,found:161.9872。
实施例2
化合物CPUL-I001的制备
4-氨基-3-(N-甲基-N’-羟基脒基)-1,2,5-噁二唑(IV-1)的制备
将III(1.0g,6.2mmol)和40mL乙醇加入到100mL反应瓶中,搅拌,室温下依次缓慢滴加40%的甲胺乙醇溶液(0.48g,6.2mmol)和三乙胺(1.25g,12.4mmol),室温搅拌3h,减压蒸除溶剂,加入乙酸乙酯搅拌,抽滤,滤液用水与饱和氯化钠水溶液各洗涤1次,无水硫酸钠干燥有机层,减压蒸除溶剂得黄色油状物(0.68g,70.1%)。HRMS m/z[M+H]+calculated for C4H7N5O2:157.0602,found:157.0600。
4-甲胺基-3-(N’-羟基脒基)-1,2,5-噁二唑(V-1)的制备
将IV-1(0.68g,4.3mmol)和9mL水加入到50mL反应瓶中,搅拌下缓慢滴加氢氧化钾(0.73g,13mmol)的3mL水溶液,加热回流14h,经TLC检测反应完毕后,冷却至室温,用乙酸乙酯萃取(5×4mL),合并有机相,无水硫酸钠干燥,减压蒸除溶剂得淡黄色油状物(0.46g,67.5%)。HRMS m/z[M+H]+calculated for C4H7N5O2:157.0608,found:157.0600。
2-[(4-甲胺基-1,2,5-噁二唑-3-基)甲肟基]异吲哚-1,3-二酮(CPUL-I001)的制备
将V-1(0.46g,3mmol),20mL醋酸和邻苯二甲酸酐(0.88g,6mmol)加入到100mL反应瓶中,回流搅拌约8h,经TLC检测反应完毕后,冷却至室温,减压蒸除溶剂,柱层析纯化得淡黄色固体(0.25g,29%)。m.p.203-204℃,1H NMR(300MHz,DMSO-d6)δ:12.61(s,1H,-OH),7.87-7.95(m,2H,-ArH),7.64-7.67(m,2H,-ArH),5.41(m,1H,-NH-),2.33(d,J=4.5Hz,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C12H9N5O4:287.0650,found:287.0655。
实施例3
化合物CPUL-I002的制备
用乙胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I002(0.28g,15%)。m.p.199-200℃,1H NMR(300MHz,DMSO-d6)δ:13.01(s,1H,-OH),7.91-8.02(m,2H,-ArH),7.73-7.77(m,2H,-ArH),6.21(m,1H,-NH-),2.43(m,2H,-CH2-),2.29(t,J=4.7Hz,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C12H9N5O4:301.0806,found:301.0811。
实施例4
化合物CPUL-I003的制备
用环丙胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I003(0.28g,14.5%)。m.p.169-171℃,1H NMR(300MHz,DMSO-d6)δ:13.71(s,1H,-OH),7.81-8.03(m,4H,-ArH),6.63(bs,1H,-NH-),2.67-2.74(m,1H,-CH-),0.67-0.78(m,4H,-CH2-CH2-)ppm.HRMS m/z[M+H]+calculated for C14H11N5O4:313.0884,found:313.0867。
实施例5
化合物CPUL-I004的制备
用正丙胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I004(0.31g,16%)。m.p.197-198℃,1H NMR(300MHz,DMSO-d6)δ:13.61(s,1H,-OH),7.97-8.05(m,2H,-ArH),7.84-7.87(m,2H,-ArH),6.41(bs,1H,-NH-),3.28(q,J=6.5Hz,2H,-CH2-),1.63-1.70(m,2H,-CH2-),0.92(t,J=7.3Hz,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C14H13N5O4:315.0873,found:315.0869。
实施例6
化合物CPUL-I005的制备
用叔丁胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I005(0.32g,15.5%)。m.p.136-138℃,1H NMR(300MHz,DMSO-d6)δ:13.67(s,1H,-OH),7.85-7.97(m,4H,-ArH),5.80(s,1H,-NH-),1.40(s,9H,-C(CH3)3)ppm.HRMS m/z[M+H]+calculated for C15H15N5O4:329.1197,found:329.1196。
实施例7
化合物CPUL-I006的制备
用环己胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I006(0.32g,14.5%)。m.p.202-203℃,1H NMR(300MHz,(CD3)2CO-d6)δ:8.14-8.17(m,1H,-ArH),7.98-8.01(m,1H,-ArH),7.88-7.90(m,2H,-ArH),5.71(d,J=6.9Hz,1H,-NH-),3.55(bs,1H,-CH-),2.11-2.17(m,2H,-CH2-),1.77-1.80(m,2H,-CH2-),1.31-1.68(m,6H,-CH2-CH2-CH2-)ppm.HRMS m/z[M+H]+calculated for C17H17N5O4:355.1353,found:355.1353。
实施例8
化合物CPUL-I007的制备
用4-氧氮环己烷(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I007(0.28g,13%)。m.p.190-192℃,1H NMR(300MHz,DMSO-d6)δ:13.72(s,1H,-OH),7.81-8.06(m,4H,-ArH),3.64-3.74(m,4H,-CH2-O-CH2-),3.31(t,J=4.2Hz,4H,-CH2-N-CH2-)ppm.HRMS m/z[M+H]+calculated for C15H13N5O5:343.0989,found:343.0992。
实施例9
化合物CPUL-I008的制备
用苯胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I008(0.32g,15%)。m.p.182-184℃,1H NMR(300MHz,DMSO-d6)δ:8.69(s,1H,-NH-),7.98-8.06(m,2H,-ArH),7.84-7.89(m,2H,-ArH),7.66(d,J=7.9Hz,2H,-ArH),7.41(t,J=7.6Hz,2H,-ArH),7.08(t,J=7.3Hz,1H,-ArH)ppm.1H RMS m/z[M+H]+calculated for C17H11N5O4:349.0884,found:349.0916。
实施例10
化合物CPUL-I009的制备
用苄胺(6.2mmol)代替甲胺外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I009(0.35g,15.5%)。m.p.195-197℃,1H NMR(300MHz,DMSO-d6)δ:7.97-8.06(m,2H,-ArH),7.82-7.89(m,2H,-ArH),7.24-7.43(m,5H,-ArH),7.10(t,J=6.2Hz,1H,-NH-),4.53(d,J=6.1Hz,2H,-CH2-)ppm.HRMS m/z[M+H]+calculated for C18H13N5O4:363.1040,found:363.1045。
实施例11
化合物CPUL-I010的制备
用丙胺(6.2mmol)代替甲胺、4-氯苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I010(0.31g,14.5%)。m.p.120-122℃,1H NMR(300MHz,DMSO-d6)δ:14.00(s,1H,-OH),7.90-8.09(m,3H,-ArH),6.42(bs,1H,-NH-),3.26(bs,2H,-CH2-),1.63-1.67(m,2H,-CH2-),0.91(bs,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C14H12ClN5O4:349.0651,found:349.0686。
实施例12
化合物CPUL-I011的制备
用环己胺(6.2mmol)代替甲胺、4-氯苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I011(0.41g,17%)。m.p.200-202℃,1H NMR(300MHz,DMSO-d6)δ:14.00(s,1H,-OH),8.03-8.06(m,2H,-ArH),7.93-7.96(m,1H,-ArH),5.96(d,J=7.6Hz,1H,-NH-),3.31-3.43(m,1H,-CH-),2.00-2.04(m,2H,-CH2-),1.71-1.75(m,2H,-CH2-),1.31-1.63(m,6H,-CH2-CH2-CH2-)ppm.HRMS m/z[M+H]+calculated for C17H16ClN5O4:389.0964,found:389.0978。
实施例13
化合物CPUL-I012的制备
用4-氧氮环己烷(6.2mmol)代替甲胺、4-氯苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I012(0.39g,16.5%)。m.p.176-178℃,1H NMR(300MHz,DMSO-d6)δ:13.90(s,1H,-OH),7.93-8.08(m,3H,-ArH),3.73(bs,4H,-CH2-O-CH2-),3.31(bs,4H,-CH2-N-CH2-)ppm.HRMS m/z[M+H]+calculated for C15H12ClN5O5:377.0600,found:377.0600。
实施例14
化合物CPUL-I013的制备
用苯胺(6.2mmol)代替甲胺、4-氯苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I013(0.34g,14.5%)。m.p.207-209℃,1H NMR(300MHz,DMSO-d6)δ:8.77(s,1H,-NH-),8.06(s,1H,-ArH),7.95(d,J=7.5Hz,1H,-ArH),7.88(d,J=6.8Hz,1H,-ArH),7.67(d,J=7.8Hz,2H,-ArH),7.39(t,J=7.6Hz,2H,-ArH),7.06(t,J=7.1Hz,1H,-ArH)ppm.HRMS m/z[M+H]+calculated for C17H10ClN5O4:383.0494,found:383.0512。
实施例15
化合物CPUL-I014的制备
用丙胺(6.2mmol)代替甲胺、4-溴苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I014(0.38g,15.5%)。m.p.130-132℃,1H NMR(300MHz,DMSO-d6)δ:14.00(s,1H,-OH),7.93-8.21(m,3H,-ArH),6.43(t,J=5.3Hz,1H,-NH-),3.24-3.31(m,2H,-CH2-),1.63-1.70(m,2H,-CH2-),0.92(t,J=7.4Hz,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C14H12BrN5O4:393.0145,found:393.0148。
实施例16
化合物CPUL-I015的制备
用环己胺(6.2mmol)代替甲胺、4-溴苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I015(0.46g,17%)。m.p.188-190℃,1H NMR(300MHz,CDCl3)δ:7.77-8.23(m,3H,-ArH),5.30(bs,1H,-NH-),3.58(bs,1H,-CH-),2.15-2.21(m,2H,-CH2-),1.70-1.78(m,2H,-CH2-),1.25-1.66(m,6H,-CH2-CH2-CH2-)ppm.HRMS m/z[M+H]+calculated for C17H16BrN5O4:433.0458,found:433.0462。
实施例17
化合物CPUL-I016的制备
用4-氧氮环己烷(6.2mmol)代替甲胺、4-溴苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I016(0.39g,15%)。m.p.189-191℃,1H NMR(300MHz,DMSO-d6)δ:13.95(s,1H,-OH),7.91-8.21(m,3H,-ArH),3.73(t,J=4.2Hz,4H,-CH2-O-CH2-),3.31(t,J=4.1Hz,4H,-CH2-N-CH2-)ppm.HRMS m/z[M+H]+calculated for C15H12BrN5O5:421.0095,found:421.0098。
实施例18
化合物CPUL-I017的制备
用苯胺(6.2mmol)代替甲胺、4-溴苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I017(0.40g,15%)。m.p.237-239℃,1H NMR(300MHz,DMSO-d6)δ:8.69(s,1H,-NH-),7.95-8.06(m,3H,-ArH),7.68(d,J=7.9Hz,2H,-ArH),7.40(t,J=7.8Hz,2H,-ArH),7.07(t,J=7.3Hz,1H,-ArH)ppm.HRMS m/z[M+H]+calculated for C17H10BrN5O4:426.9989,found:427.0004。
实施例19
化合物CPUL-I018的制备
用丙胺(6.2mmol)代替甲胺、4-甲基苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I018(0.29g,14%)。m.p.123-125℃,1H NMR(300MHz,CDCl3)δ:7.68-8.08(m,2H,-ArH),7.57(d,J=7.8Hz,1H,-ArH),5.46(bs,1H,-NH-),3.40-3.43(m,2H,-CH2-),2.54(s,3H,-CH3),1.74-1.81(m,2H,-CH2-),1.03(t,J=7.4Hz,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C15H15N5O4:329.1197,found:329.1205。
实施例20
化合物CPUL-I019的制备
用环己胺(6.2mmol)代替甲胺、4-甲基苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I019(0.33g,14.5%)。m.p.201-203℃,1H NMR(300MHz,CDCl3),δ:7.89-8.05(m,1H,-ArH),7.66-7.81(m,1H,-ArH),7.55(d,J=7.9Hz,1H,-ArH),5.36(d,J=5.6Hz,1H,-NH-),3.57(bs,1H,-CH-),2.53(s,3H,-CH3),2.15-2.18(m,2H,-CH2-),1.69-1.77(m,2H,-CH2-),1.24-1.65(m,6H,-CH2-CH2-CH2-)ppm.HRMS m/z[M+H]+calculated for C18H19N5O4:369.1510,found:369.1507。
实施例21
化合物CPUL-I020的制备
用4-氧氮环己烷(6.2mmol)代替甲胺、4-甲基苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I020(0.33g,15.5%)。m.p.176-178℃,1H NMR(300MHz,DMSO-d6)δ:13.58(s,1H,-OH),7.74-7.96(m,3H,-ArH),3.73(t,J=4.8Hz,4H,-CH2-O-CH2-),3.31(t,J=4.4Hz,4H,-CH2-N-CH2-),2.49(s,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C16H15N5O5:357.1146,found:357.1150。
实施例22
化合物CPUL-I021的制备
用苯胺(6.2mmol)代替甲胺、4-甲基苯酐代替邻苯二甲酸酐外,以与化合物CPUL-I001相同的方法合成化合物CPUL-I021(0.36g,16%)。m.p.206-208℃,1H NMR(300MHz,(CD3)2CO-d6)δ:12.58(s,1H,-OH),8.38(s,1H,-NH-),8.03(dd,J=8.0Hz,5.4Hz,1H,-ArH),7.88(d,J=8.4Hz,1H,-ArH),7.71-7.75(m,3H,-ArH),7.44(t,J=8.1Hz,2H,-ArH),7.11(t,J=7.3Hz,1H,-ArH),2.57(s,3H,-CH3)ppm.HRMS m/z[M+H]+calculated for C18H13N5O4:363.1040,found:363.1041。
- 还没有人留言评论。精彩留言会获得点赞!