一种氨基酸多吡啶铜配合物及其制备方法和应用与流程
本发明涉及到一种氨基酸多吡啶铜配合物的制备方法及其应用前景,该配合物对所选肿瘤细胞株具有良好的抗癌活性,且对蛋白酶体活性具有一定的抑制作用,因此可作为一种潜在应用价值的靶向蛋白酶体的抗肿瘤或抗癌药物。
背景技术:
癌症是一大类恶性肿瘤的统称,是当前危及人类生命的最主要疾病之一。上世纪60年代末,顺铂以其优异抗肿瘤作用,带动了科学界对金属配合物的药理机能的进一步深入研究。随之众多新的高效、低毒、具有抗癌性能的金属配合物被不断合成出来,并逐步投入临床应用。其中,顺铂,卡铂等铂类抗肿瘤药物以优异的抗癌性能成为抗癌药物的主力军。然而由于作用靶点为DNA,缺乏对肿瘤细胞的选择性,导致极大的胃肠道和血液毒副作用,加之顺铂不能口服和严重的耐药性,限制了其临床广泛应用。故医药化学家试图开发靶点不用于铂类或者多靶点的其他金属基化合物以提高对肿瘤细胞的选择性,以克服铂类药物的缺陷,扩大临床抗肿瘤谱。钌的配合物毒性低,同时易被肿瘤组织吸收,被视为最具有前景的抗癌药物之一。近年来一些钌的化合物陆续进入临床试验。铜是人体所需的重要必需元素,作为生物体内一些结构和催化中心的辅助因子参与体内多个生物反应过程。近年来发现金属配合物尤其是铜配合物对肿瘤细胞中蛋白酶体有强抑制作用且能诱导细胞凋亡,而对正常细胞毒性很小,这为开发金属配合物作为靶向药物提供了依据。
多吡啶类配体具有较强的σ给电子能力及π受电子能力,本身具有很强的抗肿瘤活性,能够与多种金属形成稳定的配合物,可以中和金属离子的正电荷,提高配合物的亲脂性,还能够插入DNA或与蛋白发生氧化还原反应,且其配合物易于被细胞摄入,在DNA结构探针、DNA分子光开关、DNA示踪试剂、DNA断裂试剂以及抗癌药物等方面有极大的应用前景;氨基酸作为载体,可以增加化合物水溶性,减低毒性,由于癌变细胞对氨基酸的需求量比正常细胞大得多,因而借助氨基酸分子的引入,就可能将抗癌基团运载到癌细胞内,从而提高到达靶标的有效剂量,增大杀伤癌细胞的选择性。
基于以上研究背景,本发明将氨基酸结构引入多吡啶铜配合物中,一方面利用氨基酸的水溶性,通过构建不同的分子骨架来调控脂水分配系数,提高多吡啶铜配合物的水溶性,以改变配合物进入细胞内的活性;另一方面,借助肿瘤细胞对氨基酸的亲和性,增加配合物的靶向性。本发明设计合成氨基酸多吡啶铜配合物,对其进行结构表征,测定了其对肿瘤细胞生长增殖的抑制作用和对蛋白酶体活性的抑制作用,以期获得新型金属基靶向抗肿瘤药物。
技术实现要素:
本发明的目的在于提供一种氨基酸多吡啶铜配合物及其制备方法和应用。本发明是新型金属配合物型抗癌药物。目标化合物对MCF-7、SMMC-7721、K562、A549和SGC-7901细胞具有良好的抗癌活性,且对蛋白酶体活性有一定抑制作用,本发明制备方法简单,可靠。
本发明提供的氨基酸多吡啶铜配合物的化学式分别为[Cu(OH-PIP)(Phe)Cl]·3H2O 1、[Cu(OH-PIP)(Gly)(H2O)]NO3·2H2O 2、[Cu(OH-PIP)(Ala)(Cl)]3、[Cu(OH-PIP)(Met)](PF6)·2H2O 4、[Cu(OH-PIP)(Gln)(H2O)](Cl)·3H2O 5,其中OH-PIP为4-(1-氢-咪唑[4,5-f][1,10]菲咯啉-2-基)苯酚,Phe为苯丙氨酸,Gly为甘氨酸,Met为蛋氨酸,Ala为丙氨酸,Gln为谷氨酰胺,PF6为六氟磷酸根。
铜配合物1晶体属于正交晶系,空间群为P21212,晶胞参数为α=90°,β=90°,γ=90°,Z=2,单胞体积
铜配合物2晶体属于三斜晶系,空间群为P-1,晶胞参数为α=74.112(9)°,β=70.602(8)°,γ=72.277(9)°,Z=2,单胞体积
铜配合物3晶体属于三斜晶系,空间群为P-1,晶胞参数为α=82.402(6)°,β=75.485(6)°,γ=69.805(5)°,Z=2,单胞体积铜配合物4晶体属于单斜晶系,空间群为C2/c,晶胞参数为α=90.00°,β=104.930(3)°,γ=90.00°,Z=8,单胞体积
铜配合物5晶体属于单斜晶系,空间群为P21/c,晶胞参数为α=90.00(6)°,β=95.958(7)(6)°,γ=90.00(5)°,Z=4,单胞体积
本发明提供的铜配合物1-5的制备方法包括如下步骤:将等摩尔的氨基酸和碱溶于等体积的水和醇混合溶液中,常温搅拌下加入等摩尔的金属铜盐,回流搅拌2-5小时,再加等摩尔的六氟磷酸盐,室温搅拌1-4小时,过滤,滤液室温缓慢挥发,2-6周后,析出适合X-射线分析的绿色晶体,收集检测。
所述的碱包括三乙胺,氢氧化锂,氢氧化钠,氢氧化钾。
所述的醇包括甲醇,乙醇,丙醇,异丙醇,丁醇。
所述的盐包括氯化铜,氯化亚铜,碳酸铜,硝酸铜,高氯酸铜。
所述的六氟磷酸盐包括六氟磷酸锂,六氟磷酸钠,六氟磷酸钾,六氟磷酸铵。
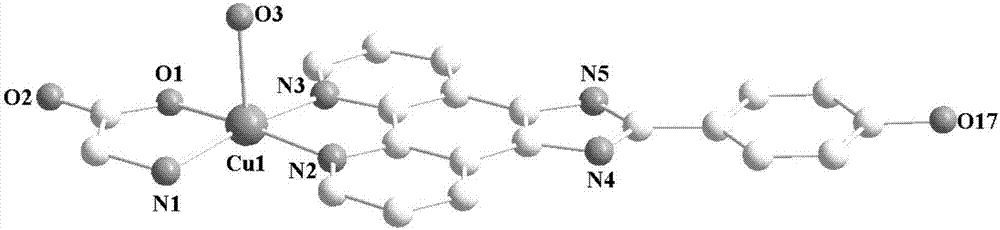
所述铜配合物1的结构为:基本单元由一个[Cu(OH-PIP)(Phe)Cl]和三个游离的水分子组成。一个Cu原子与一个OH-PIP配体的2个N原子,苯丙氨酸配体的一个O和N原子,以及一个Cl原子形成的五配位构型。根据Addison-Reedijk几何学计算,Cu离子的配位构型为四方锥(τ=0.10)。其赤道平面由OH-PIP的两个N原子和苯丙氨酸的N和O原子构成,Cl离子占据轴向位置,单元结构图见图1。
所述铜配合物2的结构为:基本单元由一个[Cu(OH-PIP)(Gly)(H2O)]+阳离子,一个硝酸根阴离子和两个游离的水分子组成。一个Cu原子与一个OH-PIP配体的2个N原子,甘氨酸配体的一个O和N原子,以及一个水分子O原子形成的五配位构型。根据Addison-Reedijk几何学计算,Cu离子的配位构型为四方锥(τ=0.02)。其赤道平面由OH-PIP的两个N原子和氨基酸的N和O原子构成,水的O原子占据轴向位置,单元结构图见图2。
所述铜配合物3的结构为:基本单元由一个[Cu(OH-PIP)(Ala)(Cl)]组成。一个Cu原子与一个OH-PIP配体的2个N原子,丙氨酸配体的一个O和N原子,以及一个Cl原子形成的五配位构型。根据Addison-Reedijk几何学计算,Cu离子的配位构型为四方锥(τ=0.08)。其赤道平面由OH-PIP的两个N原子和氨基酸的N和O原子构成,Cl原子占据轴向位置,单元结构图见图3。
所述铜配合物4的结构为:基本单元由一个[Cu(OH-PIP)(Met)]+阳离子,一个六氟磷酸根阴离子和两个游离的水分子组成。一个Cu原子与一个OH-PIP配体的2个N原子,蛋氨酸配体的一个O和N原子,以及另外一个蛋氨酸的O原子形成的五配位构型。根据Addison-Reedijk几何学计算,Cu离子的配位构型为四方锥(τ=0.003)。其赤道平面由OH-PIP的两个N原子和蛋氨酸的N和O原子构成,另外一个蛋氨酸的O原子占据轴向位置,单元结构图见图4。
所述铜配合物5的结构为:基本单元由一个[Cu(OH-PIP)(Gln)(H2O)]+阳离子,一个Cl离子和三个游离的水分子组成。一个Cu原子与一个OH-PIP配体的2个N原子,谷氨酰胺配体的一个O和N原子,以及一个O原子形成的五配位构型。根据Addison-Reedijk几何学计算,Cu离子的配位构型为四方锥(τ=0.08)。其赤道平面由OH-PIP的两个N原子和氨基酸的N和O原子构成,O原子占据轴向位置,单元结构图见图5。
本发明提供的氨基酸多吡啶铜配合物用于抗肿瘤或癌症治疗领域。
本发明是以OH-PIP为主配体,含有丰富的π电子和N配位点,以不同结构的氨基酸为辅助配体,可与铜离子螯合配位,使用常规的溶剂合成法,可得到目标配合物。本发明的铜配合物对MCF-7、SMMC-7721、K562、A549和SGC-7901细胞具有良好的抗癌活性,且对蛋白酶体具有一定的抑制作用,因此是一种潜在应用价值的靶向抗癌药物,本发明制备方法简单,可靠。
附图说明
图1:铜配合物1的单元结构图。
图2:铜配合物2的单元结构图。
图3:铜配合物3的单元结构图。
图4:铜配合物4的单元结构图。
图5:铜配合物5的单元结构图。
图6:铜配合物1-5浓度为10μmol/L时的对蛋白酶体作用的荧光值。
图7:铜配合物1-5浓度为10μmol/L时对蛋白酶体作用的抑制率。
具体实施方式
实施例1
铜配合物1的合成:
将0.5mmol的氨基酸和0.5mmol碱溶于20mL水和20mL醇混合溶液中,常温搅拌下加入0.5mmol的氯化铜,回流搅拌3小时,过滤,再加0.5mmol六氟磷酸铵,继续室温反应1小时,过滤,滤液室温缓慢挥发,3周后,析出适合X-射线分析的绿色晶体,产率约为48%(以铜盐计算)。元素分析结果(%),实验值:C,54.80;H,4.62;N,11.40.理论值(C28H28N5O5ClCu):C,54.81;H,4.60;N,11.41,结果与理论值基本一致。
实施例2
铜配合物2的合成:
将0.5mmol的氨基酸和0.5mmol碱溶于20mLl水和20mL醇混合溶液中,常温搅拌下加入0.5mmol的硝酸铜,回流搅拌3小时,过滤,再加0.5mmol六氟磷酸铵,继续室温反应1小时,过滤,滤液室温缓慢挥发,3周后,析出适合X-射线分析的绿色晶体,产率约为41%(以铜盐计算),元素分析结果(%),实验值:C,44.54;H,3.95;N,14.85.理论值(C21H22N6O9Cu):C,44.56;H,3.92;N,14.85.结果与理论值基本一致。
实施例3
铜配合物3的合成:
将0.5mmol的氨基酸和0.5mmol碱溶于20mL水和20mL醇混合溶液中,常温搅拌下加入0.5mmol的氯化铜,回流搅拌3小时,过滤,再加0.5mmol六氟磷酸铵,继续室温反应1小时,过滤,滤液室温缓慢挥发,3周后,析出适合X-射线分析的绿色晶体,产率约为43%(以铜盐计算)。元素分析结果(%),实验值:C,52.90;H,3.65;N,14.01.理论值(C22H18N5O3ClCu):C,52.91;H,3.63;N,14.02,结果与理论值基本一致。
实施例4
铜配合物4的合成:
将0.5mmol的氨基酸和0.5mmol碱溶于20mL水和20mL醇混合溶液中,常温搅拌下加入0.5mmol的硝酸铜,回流搅拌3小时,过滤,再加0.5mmol六氟磷酸铵,继续室温反应1小时,过滤,滤液室温缓慢挥发,3周后,析出适合X-射线分析的绿色晶体,产率约为38%(以铜盐计算)。元素分析结果(%),实验值:C,52.90;H,3.65;N,14.01.理论值(C24H26N5O5SPF6Cu):C,40.88;H,3.71;N,9.93,结果与理论值基本一致。
实施例5
铜配合物5的合成:
将0.5mmol的氨基酸和0.5mmol碱溶于20mL水和20mL醇混合溶液中,常温搅拌下加入0.5mmol的氯化铜,回流搅拌3小时,过滤,再加0.5mmol六氟磷酸铵,继续室温反应1小时,过滤,滤液室温缓慢挥发,3周后,析出适合X-射线分析的绿色晶体,产率约为38%(以铜盐计算)。元素分析结果(%),实验值:C,52.90;H,3.65;N,14.01.理论值(C24H29N6O8ClCu):C,45.86;H,4.65;N,13.37,结果与理论值基本一致。
铜配合物1-5的结构参数见表1-6。
实施例6
铜配合物1-5对几种癌细胞的选择性实验:
MTT(噻唑兰)法是一种检测细胞存活和生的方法。该实验基本原理是:噻唑兰可透过活细胞膜进入细胞内,活细胞线粒体中的琥珀脱氢酶能使外源性MTT还原为难溶于水的蓝紫色的Formazan结晶并沉淀在细胞中,结晶物能被DMSO溶解,用酶标仪检测570nm处的吸光度值,可间接反映活细胞数量。该方法常用于大量的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等。具有灵敏度高、经济等优点。
实验过程:
我们利用MTT法测定了配合物对体外MCF-7、SMMC-7721、K562、A549和SGC-7901细胞生长的抑制能力。其基本步骤是:将细胞接种于96孔培养板,每孔2×105个细胞,6复孔。5%CO2,37℃下孵育24h后,不同浓度药物加入相应孔板中作用肿瘤细胞48h,同时设置对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜),并且每组设定3复孔。每孔加入MTT(5mg·mL-1)20μL,继续培养4h,小心吸弃上层清液,加二甲基亚砜(100μL/孔),轻微震荡,室温反应0.5h,用酶标仪检测570nm处的吸光度值,然后分析数据。
实验结果:
不同浓度的配合物1作用于上述癌细胞48小时后,发现对上述癌细胞的抑制作用有显著差别,对SGC-7901细胞作用较强,其半数抑制率IC50值为3.50μg·mL-1,对MCF-7和A549细胞作用相当,而对SMMC-7和K562细胞作用较弱,IC50值均大于100μg·mL-1,数据见表7。
不同浓度的配合物2作用于上述癌细胞48小时后,发现对上述癌细胞的抑制作用有显著差别,对MCF-7、SMMC-7721、K562、A549和SGC-7901细胞的IC50值为2.69-65.25μg·mL-1,其中对SGC-7901作用最强,对MCF-7和A549细胞作用相当,而对SMMC-7721作用相对最弱,数据见表8。
不同浓度的配合物3作用于上述癌细胞48小时后,发现对上述癌细胞的抑制作用有显著差别,对MCF-7、SMMC-7721、K562、A549和SGC-7901细胞的IC50值为2.18-22.26μg·mL-1,其中对SGC-7901细胞作用最强,而对SMMC-7721细胞作用相对最弱,数据见表9。
不同浓度的配合物4作用于上述癌细胞48小时后,发现对上述癌细胞的抑制作用有明显差别,对MCF-7、SMMC-7721、K562、A549和SGC-7901细胞的IC50值为2.49-65.97μg·mL-1,其中对SGC-7901细胞作用最强,而对SMMC-7721细胞作用相对最弱,数据见表10。
不同浓度的配合物5作用于上述癌细胞48小时后,发现对上述癌细胞的抑制作用有显著差别,对MCF-7、SMMC-7721、K562、A549和SGC-7901细胞的IC50值为0.08-19.80μg·mL-1,其中对K562细胞作用最强,其次是SGC-7901细胞,而对SMMC-7721细胞作用相对最弱,数据见表11。
从上述评价结果看出,配合物5对上述五种肿瘤细胞作用都较强,尤其是对K562细胞作用最强,其IC50值达到0.083μg·mL-1;配合物3对MCF-7细胞的活性最高,而其他四个配合物对MCF-7细胞的活性相当;配合物1对SMMC7721和K562细胞的活性最差,半数抑制率均超过100μg·mL-1;配合物2和4对MCF-7和SMMC-7721细胞的活性相当,而对K562细胞,配合物2活性要高于配合物4。配合物1-5均对SGC-7901细胞的IC50值均低于4μg·mL-1,而对SMMC-7721细胞相对最弱,说明该类化合物对肿瘤细胞具有选择性。
实施例7
铜配合物1-5抑制蛋白酶体活性的体外评价实验:
实验方法:蛋白酶体的糜蛋白酶样活性是通过测定细胞释放的AMC基团的量来计算得出的。向含有一定量的20S蛋白酶体的100μL缓冲液中(20mMTris–HCl,pH 7.5)分别加入不同浓度的配合物或不加药处理,再加10μmol·L-1糜蛋白酶样活性底物Suc-LLVY-AMC,37℃孵育2小时,用酶标仪监测荧光活性(激发波长为365nm,发射波长为460nm),硼替佐米组作为阳性对照组。
实验结果:
如图6所示,配合物1-5释放的荧光强度与阳性对照相比均明显减少,其中硼替佐米的荧光强度最低,这说明我们的化合物的蛋白酶体抑制活性是弱于阳性药,但从结果可以看出释放的荧光减少的幅度均超过50%,这说明配合物1-5的IC50值均小于10μmol·L-1,这些化合物具有一定的蛋白酶体抑制活性。
通过定量计算发现,结果如图7所示,阳性药抑制了超过90%的蛋白酶体活性,而配合物1-5在给药浓度为10μmol·L-1时,抑制率均超过60%,证明我们设计合成的化合物对该酶也具备相当的抑制活性,可以作为蛋白酶体抑制剂进行抗肿瘤药物开发。
实施例8
铜配合物1-5抑制细胞内蛋白酶体活性的评价实验:
实验方法:
用相应配合物处理MCF-7肿瘤细胞后,PBS洗涤细胞,加细胞裂解液,震荡裂解细胞,离心,收集上清。取10μg细胞提取物37℃条件下,与20μmol·L-1荧光多肽底物Suc-LLVY-AMC在100μL缓冲液中共孵育1小时,利用酶标仪测定水解的AMC基团的产物的荧光。激发波长为365nm,发射波长为460nm。其中,阴性对照组为DMSO,阳性对照组为硼替佐米。
实验结果:
如表12所示,配合物1-5在终浓度为6.67μg·mL-1时抑制率均大于50%,初步认为该化合物具有蛋白酶体活性抑制作用,对MCF-7细胞中的蛋白酶体活性抑制作用与阴性对照组相比均有显著性差异(P<0.01)。
表1铜配合物1-5的晶体结构的主要数据
表2铜配合物1晶体的主要键长和键角
表3铜配合物2晶体的主要键长和键角
表4铜配合物3晶体的主要键长和键角
表5铜配合物4晶体的主要键长和键角
表6铜配合物5晶体的主要键长和键角
表7不同浓度的铜配合物1对五种肿瘤细胞株的抑制作用及其IC50值
“-”indicates the complex has no inhibitory effect on the tumor cell proliferation.
表8不同浓度的铜配合物2对五种肿瘤细胞株的抑制作用及其IC50值
“-”indicates the complex has no inhibitory effect on the tumor cell proliferation.
表9不同浓度的铜配合物3对五种肿瘤细胞株的抑制作用及其IC50值
“-”indicates the complex has no inhibitory effect on the tumor cell proliferation.
表10不同浓度的铜配合物4对五种肿瘤细胞株的抑制作用及其IC50值
“-”indicates the complex has no inhibitory effect on the tumor cell proliferation.
表11不同浓度的铜配合物5对五种肿瘤细胞株的抑制作用及其IC50值
“-”indicates the complex has no inhibitory effect on the tumor cell proliferation.
表12铜配合物1-5对蛋白酶体活性的抑制作用
**compared to NS p<0.01。
- 还没有人留言评论。精彩留言会获得点赞!
- 1‑(2‑吡啶)‑9‑(3‑苯基丙基)‑β‑咔啉的氯化铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(4‑甲基苄基)‑β‑咔啉的硝酸铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑丁基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑己基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑辛基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑壬基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑异戊基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(萘‑2‑甲基)‑β‑咔啉的氯化铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(2‑乙氧基乙基)‑β‑咔啉的氯化铜配合物及合成方法和应用与制造工艺
- 一种含葛根的药物组合物及其制备方法与制造工艺