YAP的用途的制作方法
本发明涉及生物医疗技术领域,尤其涉及yap的用途。
背景技术:
间充质干细胞是最初从骨髓中分化而来的多向分化潜能干细胞,可分化为多种不同种类的细胞,包括成骨细胞、软骨细胞、肌细胞以及脂肪细胞等。越来越多的证据证明间充质干细胞可存在于非骨髓组织中。多数成人的间充质干细胞可用于细胞介导的组织工程。源于骨髓、骨膜、以及脂肪组织等不同组织的间充质干细胞拥有相似的表面标记特征,但是不同组织来源的间充质细胞在分化、增殖以及迁移等方面存在着显著差异。在过去的几十年里,基于其干细胞的特性,一类新的干细胞从口腔颌面组织中分离出来,包括源于牙周膜、牙髓以及根尖乳头等组织的干细胞。这些细胞具有多向分化潜能、成骨/成牙本质分化及自我更新能力。将其移植到小鼠或小型猪体内,可以生成骨样/牙本质样矿化组织并具有修复牙体组织缺损的能力。相比较源于骨髓的间充质干细胞,这类干细胞更易获得,而且与牙体组织有着更紧密的联系。因此牙源性间充质干细胞为牙齿组织的再生提供了可靠的细胞来源,但是其成牙定向分化的分子机制尚未明确,限制了其潜在的应用。
yap蛋白(yesassociatedprotein)是hippo信号通路中一个起中心作用的开关蛋白,yap作为一种基因转录共抑制因子,在维持干细胞自我更新及分化方面起着重要作用。然而,yap在牙源性间充质干细胞中的作用及作用机制尚不明确。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供提供yap的用途,本发明研究表明,yap基因能够调控通过调控与成骨、成牙相关基因的表达,实现对间充质干细胞成骨/成牙定向分化的调控。
本发明提供了yap在制备调控间充质干细胞成牙相关基因表达的制剂中的应用。本发明实施例中,成牙相关基因为dspp、dmp1和/或osx。一些实施例中,所述间充质干细胞为根尖牙乳头间充质干细胞、脐带间充质干细胞或骨髓间充质干细胞。
本发明还提供了yap在制备调控间充质干细胞内成骨相关基因的制剂中的应用。本发明实施例中,所述成骨相关基因为bsp和/或osx。一些实施例中,所述间充质干细胞为根尖牙乳头间充质干细胞、脐带间充质干细胞或骨髓间充质干细胞。
本发明所述调控具体为:过表达yap基因,抑制bsp基因、osx基因、dspp基因和/或dmp1基因的表达。敲除yap基因,促进bsp基因、osx基因、dspp基因和/或dmp1基因的表达。
本发明所述yap为yap蛋白、yap基因序列、能够过表达间充质细胞中yap基因的物质,或者能够敲除间充质细胞中yap基因的物质。
所述yap基因核苷酸序列的登录号为geneid:10413,所述yap蛋白氨基酸序列有登录号为geneid:10413的核苷酸序列翻译而来。
所述能够过表达间充质细胞中yap基因的物质为包含yap基因的表达载体;或者由包含yap基因的表达载体转染的逆转录病毒。所述逆转录病毒的表达载体为pqcxih。
所述能够敲除间充质细胞中yap基因的物质为baxr1的sirna,序列为gcttcaggtcctcttcctgat。或者为将baxr1的sirna插入慢病毒的shrna载体上构建而成baxr1的shrna质粒。
本发明实施例中,过表达根尖牙乳头间充质干细胞中的yap基因,培养后以成骨诱导培养液诱导干细胞分化,2~3周后,在mrna水平检测与成骨相关、成牙相关基因。结果表明,过表达yap抑制根尖牙乳头间充质干细胞bsp基因、dspp基因、osx基因和dmp1基因的表达。结果中,所述抑制与未经过表达的正常根尖牙乳头间充质干细胞相比,具有显著性差异(p<0.05或p<0.01)。
本发明实施例中,敲除脐带间充质干细胞中的yap基因,培养后以成骨诱导培养液诱导干细胞分化,2~3周后,在mrna水平检测与成骨相关、成牙相关基因。结果表明,敲除yap促进脐带间充质干细胞bsp基因、dspp基因、osx基因和dmp1基因的表达。结果中,所述促进与未经敲除的正常脐带充质干细胞相比,具有显著性差异(p<0.05或p<0.01)。
本发明实施例中,敲除骨髓间充质干细胞中的yap基因,培养后以成骨诱导培养液诱导干细胞分化,2~3周后,在mrna水平检测与成骨相关、成牙相关基因。结果表明,敲除yap促进骨髓间充质干细胞bsp基因、dspp基因、osx基因和dmp1基因的表达。结果中,所述促进与未经敲除的正常骨髓充质干细胞相比,具有显著性差异(p<0.05或p<0.01)。
本发明还提供了yap在制备调控间充质干细胞内barx1基因表达的制剂中的应用。
前期研究表明,ap2a可以促进间充质干细胞成骨/成牙分化。本发明通过实时定量rt-pcr检测结果表明,基因敲除yap,能够促进barx1在间充质干细胞的表达,染色质免疫共沉淀(chip)结果证实了yap和ap2a在间充质干细胞可以形成蛋白复合体,通过ap2a结合到barx1基因启动子序列,共同抑制barx1基因的表达,从而调节间充质干细胞的分化功能。具体的,所述yap通过与ap2a形成蛋白复合体,抑制barx1表达。
本发明还提供了yap基因在制备调控间充质干细胞矿化能力的制剂中的应用。
所述调控具体为敲除yap基因促进骨髓间充质干细胞或脐带间充质干细胞的体外矿化能力;所述矿化指钙化结节的形成。
本发明实施例中,过表达根尖牙乳头间充质干细胞中的yap基因,培养后以成骨诱导培养液诱导干细胞分化,定期在光镜下观察钙结节形成情况。结果表明过表达yap促进根尖牙乳头间充质干细胞体外矿化能力。
本发明实施例中,敲除脐带或骨髓间充质干细胞中的yap基因,培养后以成骨诱导培养液诱导干细胞分化,定期在光镜下观察钙结节形成情况。结果表明敲除yap促进脐带或骨髓间充质干细胞体外矿化能力。
本发明还提供了yap在制备调控间充质干细胞成牙和/或成骨分化的制剂中的应用。
本发明实施例中,间充质干细胞为根尖牙乳头间充质干细胞、脐带间充质干细胞或骨髓间充质干细胞。
如前所述,本发明实验表明,过表达yap基因能够抑制间充质干细胞内成牙相关基因的表达;且抑制成骨相关基因的表达。而敲除yap基因能够促进间充质干细胞内成牙相关基因的表达;且促进成骨相关基因的表达。最终结果表明,过表达yap基因能够抑制间充质干细胞成牙分化,抑制成骨分化。敲除yap基因能够促进间充质干细胞成牙分化,促进成骨分化。
为了验证过表达yap对根尖牙乳头干细胞牙向/骨向分化的影响,将scaps与ha/tap混合,植入裸鼠皮下,观察过表达yap后在体内环境中对scaps分化的影响。结果显示,实验组根尖牙乳头干细胞成矿化组织能力显著弱于对照组,实验组矿化组织形成面积较对照组明显减小。
本发明还提供了一种促进间充质干细胞成骨分化,或成牙分化的制剂,其包括yap表达抑制剂或能够敲除yap基因的物质。本发明实施例中,该制剂包括能够敲除yap基因的物质;具体为yap的sirna插入慢病毒的shrna载体上构建而成yap的shrna质粒。
本发明还提供了一种抑制间充质干细胞成骨分化,或成牙分化的制剂,其包括yap蛋白或能够过表达yap基因的物质。本发明实施例中,钙制剂包括能够过表达yap基因的物质,具体的为:由包含yap基因的表达载体转染的逆转录病毒。所述逆转录病毒的表达载体为pqcxih。
本发明还提供了一种促进间充质干细胞成骨分化,或成牙分化的方法,其为敲除间充质干细胞的yap基因,或以含有yap表达抑制剂的诱导液对间充质干细胞进行诱导。
本发明还提供了一种抑制间充质干细胞成骨分化,或成牙分化的方法,其为过表达间充质干细胞的yap基因,或以含有yap的诱导液对间充质干细胞进行诱导。
促进间充质干细胞成牙分化亦可称为促进牙组织再生;促进间充质干细胞成骨分化可称为促进骨组织再生。
本发明研究结果表明,yap能够通过调控成骨、成牙基因的表达,影响间充质干细胞向成骨、成牙的分化,从而影响间充质干细胞体外内矿化能力。本发明为制备含有yap基因的骨组织或牙组织再生药物提供技术支持。
附图说明
图1是过表达yap抑制根尖牙乳头间充质干细胞成骨分化、抑制成牙分化;其中图1-a示qrt-pcr结果显示osx的表达;图1-b示qrt-pcr结果显示bsp的表达;图1-c示qrt-pcr结果显示dspp的表达;图1-d示qrt-pcr结果显示dmp1的表达;
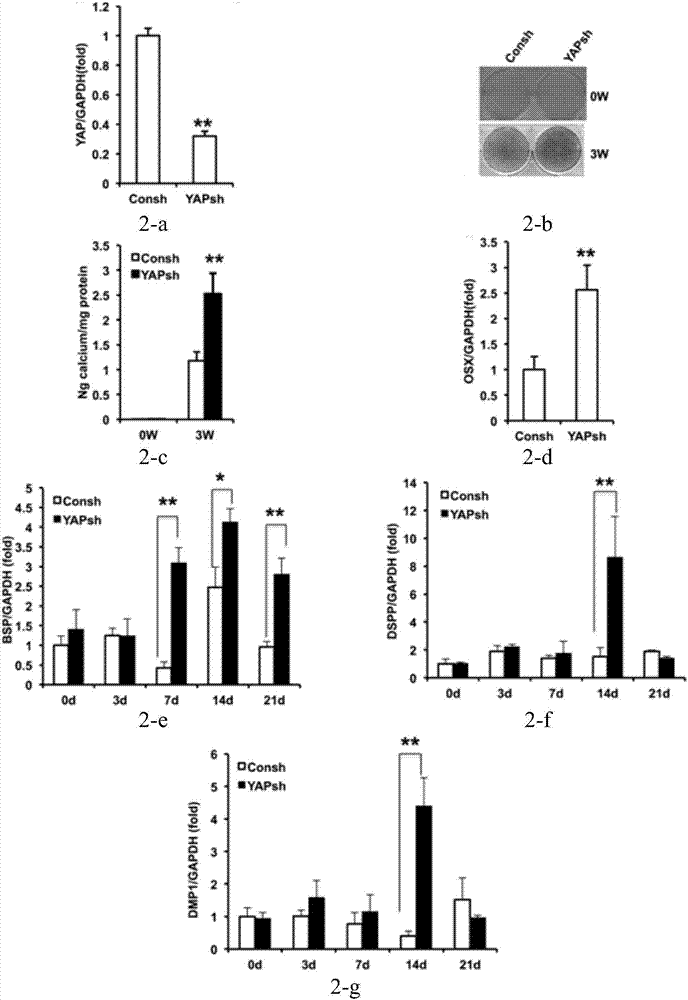
图2是基因敲除yap促进脐带间充质干细胞成骨分化、促进成牙分化;其中图2-a示基因敲除yap的qrt-pcr结果;图2-b示茜素红染色;图2-c示钙离子定量分析;图2-d示qrt-pcr结果显示osx的表达;图2-e示qrt-pcr结果显示bsp的表达;图2-f示qrt-pcr结果显示dspp的表达;图2-g示qrt-pcr结果显示dmp1的表达;
图3是基因敲除yap促进骨髓间充质干细胞成骨分化、促进成牙分化;其中图3-a示基因敲除yap的qrt-pcr结果;图3-b示茜素红染色;图3-c示qrt-pcr结果显示barx1的表达;图3-d示qrt-pcr结果显示osx的表达;图3-e示qrt-pcr结果显示bsp的表达;图3-f示qrt-pcr结果显示dspp的表达;图3-g示qrt-pcr结果显示dmp1的表达;
图4是过表达yap抑制根尖牙乳头间充质干细胞体内成骨/成牙分化,标尺100μm;4-a示he染色显示ha/tcp复合空载体根尖牙乳头干细胞(scaps-pqcxih+ha/tcp)裸鼠背部皮下回植结果,图4-b示he染色显示ha/tcp复合过表达yap根尖牙乳头干细胞(scaps-myc-yap+ha/tcp)裸鼠背部皮下回植结果;图4-c示实验组与对照组的新生矿化组织面积与回植物总面积的百分比;
图5是ap2a或yap在间充质干细胞抑制barx1的表达;其中图5-a示flag-bcor的westernblot结果;图5-b示qrt-pcr结果显示barx1的表达;图5-c示flag-ap2a的westernblot结果;图5-d示qrt-pcr结果显示barx1的表达;图5-e示myc-yap的westernblot结果;图5-f示qrt-pcr结果显示barx1的表达;图5-g示qrt-pcr结果显示yap的表达;图5-h示qrt-pcr结果显示barx1的表达;图5-i示chip结果显示barx1启动子上ap2a蛋白的结合;
图6是yap和ap2a在间充质干细胞形成蛋白复合体;其中图6-a示co-ip结果显示过表达yap后yap-ap2a蛋白复合体的形成;图6-b示co-ip结果显示基因敲除yap后yap-ap2a蛋白复合体的形成;图6-c示co-ip结果显示过表达ap2a后yap-ap2a蛋白复合体的形成;图6-d示qrt-pcr结果显示ap2a在非牙源性间充质干细胞(wjcmscs、adscs、bmscs)与牙源性间充质干细胞(scaps、dpscs、pdlscs)中的表达;图6-e示qrt-pcr结果显示yap在非牙源性间充质干细胞(wjcmscs、adscs、bmscs)与牙源性间充质干细胞(scaps、dpscs、pdlscs)中的表达;图6-f示co-ip结果显示wjcmscs与scaps中yap-ap2a蛋白复合体的形成;
图7是runx2与ap2a竞争性结合yap;其中图7-a示co-ip结果显示过表达yap后yap-runx2蛋白复合体的形成;图7-b示co-ip结果显示基因敲除yap后yap-runx2蛋白复合体的形成;图7-c示co-ip结果显示过表达ap2a后yap-runx2蛋白复合体的形成。
具体实施方式
本发明提供了yap的用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的仪器皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
1)干细胞的分离、培养与鉴定
人体组织的利用得到首都医科大学伦理委员会的批准,志愿者均知情同意术前签订知情同意书。获取了人恒牙根尖牙乳头组织,按照以往文献报道的方法分离和培养根尖牙乳头干细胞。
将拔除的牙齿立即放入无菌装有预冷pbs的离心管,移送进细胞室,在24h内分离培养根尖牙乳头干细胞。轻轻剥离牙齿周围的牙周组织,取根尖牙乳头组织,用pbs反复清洗,剪碎,置于含ⅰ型胶原酶(3g/l)和dispase(4g/l)的消化液,37℃下消化1小时,过70μm细胞筛收集细胞,1000rpm离心10min,用培养液重新悬浮成单细胞悬液。将细胞接种于25cm2细胞培养瓶中,在α-mem培养基(含15%胎牛血清、2mmol/l谷氨酰胺、100u/ml青霉素和100μg/ml链霉素)中37℃、5%co2培养,每2~3天换液1次。
每天在倒置显微镜下观察细胞生长状况。当细胞生长至80%汇合状态时,用0.25%胰蛋白酶按1:2消化传代。通过检测间充质干细胞的表面标志物cd44、cd90、cd146、stro-1和干细胞的多向分化能力、克隆形成能力等方法鉴定间充质干细胞。购买脐带间充质干细胞。购买脐带间充质干细胞。
2)构建病毒质粒
通过ncbi数据库查询yap的基因序列(geneid:10413),应用whitehead提供的程序设计yap的sirna(序列为gcttcaggtcctcttcctgat),将其插入慢病毒的shrna载体上,测序鉴定,最终构建成yap的shrna的质粒。设计yap基因全长的pcr引物,用pcr的方法得到yap的全长并加表面标记myc,将其连接到逆转录病毒的表达载体(pqcxih)上,测序鉴定,最终构建成myc-yap的质粒。然后进行病毒包装、收集,病毒滴度鉴定,分装后保存在-80度冰箱。
3)稳定转染细胞系的建立
对照scramble的shrna,yap的shrna转染根尖牙乳头干细胞、脐带干细胞,转染48小时后,用puromycin筛选7天后得到对照scramble和yap基因敲除的稳定转染干细胞,提取细胞的mrna和蛋白,在mrna水平和蛋白水平检测shrna的敲除效果。
对照质粒及myc-yap的病毒转染根尖牙乳头干细胞、脐带干细胞,转染48小时后,用药物筛选得到yap过表达的稳定转染干细胞,在mrna和蛋白水平检测myc的表达鉴定外源性yap的表达。结果表明yap基因敲除及过表达稳定转染细胞的建立。
本实施例中所采用的具体方法:
1)实时反转录聚合酶链式反应的过程为:
1.引物设计,primer3及oligo6等生物软件;
2.rna提取:
2.1培养皿细胞弃上清,pbs冲洗2遍,加700ulqiazol,吹打混匀,收于ep管,室温孵育5min,加140ul氯仿,强力震荡混匀15s,室温孵育3min,4℃12000g离心15min,收上清于新ep管;
2.2取700ul样本至rneasyminicolumn,4℃8000g离心15s,弃下层液体;
2.3加700ulbufferrwt至rneasyminicolumn,4℃8000g离心15s,弃下层液体;
2.4加500ulbufferrpe至rneasyminicolumn,4℃8000g离心15s,弃下层液体;
2.5重复步骤2.4;
2.6转移rneasyminicolumn至一新2mlcollectiontube,4℃1000g离心1min,弃下层液体;
2.7转移rneasyminicolumn至一新2mlcollectiontube,加30-50ulrnase-freewater,4℃8000g离心15s,收集下层液体于新ep管,测rna浓度,-80℃保存。
3.反转录pcr
3.1microtube管中配制下列模板rna/引物混合液:模板rna:1ng~5ug;oligo(dt)(500μg/ml):1μl;10mmdntp:1μl;加入灭菌蒸馏水至12ul。
3.265℃保温5分钟后迅速在冰上冷冻1分钟以上。
3.3离心数秒使模板rna/引物的变性溶液聚集于microtube管底部。
3.4在上述microtube管中配制加入下列反转录反应液:5×firststrandbuffer:4ul;0.1mdtt:2ul;rnaseout:1ul。
3.5混匀各组分,37℃保温2分钟后冰上冷却。
3.6加入1ulm-mlv逆转录酶,轻轻吹打混匀。
3.737℃保温2分钟,70℃保温15分钟,4℃保温,样本收于-20℃。
4.实时定量荧光pcr
配置real-timepcr反应体系如下:5×sybrmix:5μl;pcrprimer(5pmol):0.5μl;ddh2o:5μl;cdna:10.5μl;total21μl。
反应体系如表1:
表1反应体系
2)westernblot的过程为:
1.细胞总蛋白的提取
1.1弃培养基,用4℃预冷的5mlpbs漂洗细胞两次,加入5mlpbs后,用细胞刮下培养皿中的细胞,收于15ml离心管,1100rpm离心6min;弃上清,加入1mlpbs重悬细胞,收于ep管,7200rpm离心2min;
1.2弃上清,以1:5(细胞:裂解液)体积比加裂解液(100ulripa+1ulpmsf+1ulpic),冰上15min,每2-3min混悬一次;
1.34℃,14000rpm离心15min,收集上清液于新ep管中,-80℃保存。
2.bradford法测定蛋白浓度
2.1bsa蛋白标准品按说明依次用双蒸水稀释,使终浓度分别为1000μg/ml,750μg/ml,500μg/ml,250μg/ml,125μg/ml,62.5μg/ml,0μg/ml;
2.2根据样品和标准品数量,按每孔加200ul1x考马斯亮蓝液,取1ul样品和标准品加入96孔板中,室温孵育5min,设副孔和空白孔;
2.3测定595nm波长的吸光度。根据标准曲线计算蛋白浓度;
2.4根据蛋白浓度计算上样体积,每组蛋白的上样量为25μg。
3.聚丙烯酰胺凝胶电泳
3.1准备预成胶;
3.2变性:每孔25μg蛋白量上样,用蒸馏水将待测样本体积稀释至20ul,每样本加入5ulloadingbuffer(溴酚蓝),95℃加热10min;
3.3上样,以80v电压电泳至溴酚蓝电泳至分离胶,将电压调到100v,直至溴酚蓝到达分离胶底部,终止电泳。
4.转膜
4.1准备预成膜;
4.2将电泳胶转移至预成膜中,使用biorad半干转进行转膜;
4.3取出pvdf膜,tbst漂洗5min。
5.westernblot滤膜杂交
5.1将转印后的pvdf膜用5%脱脂奶粉室温摇床封闭1小时;
5.2tbst漂洗10min×3次;
5.3将滤膜取出,放入5%脱脂奶粉稀释的一抗稀释液中,4℃摇床过夜;
5.4tbst洗膜,10min×3次;
5.5将滤膜放入5%脱脂奶粉稀释的hrp标记的二抗中,室温摇床孵育1小时;
5.6tbst洗膜,10min×3次。
6.显色
将pvdf膜胶面朝上放在保鲜膜上,加入1:1混合的显影液,使其均匀覆盖膜,暗室曝光,扫描。
实施例2yap对间充质干细胞成骨/成牙分化功能影响的体外研究
1)取实施例1构建的过表达yap的根尖牙乳头间充质干细胞,以2×103/cm2的浓度接种于6孔板中,待细胞生长至80%融合后,用成骨诱导培养液将干细胞在体外向成骨/成牙本质方向分化诱导,每3天换1次液。
在mrna水平检测相关核心转录因子osx,结果表明过表达yap抑制根尖牙乳头间充质干细胞osx的表达(图1-c)。
并在诱导0,3,7,14和21天的不同时间点收获细胞,在mrna水平检测成骨分化指标-骨涎蛋白(bsp,图1-d),结果表明过表达yap抑制根尖牙乳头间充质干细胞bsp的表达。
在mrna水平检测成牙本质分化指标-牙本质涎蛋白(dspp,图1-e)、牙本质基质酸性磷酸化蛋白1(dmp1,图1-f),结果表明过表达yap抑制根尖牙乳头间充质干细胞dspp和dmp1的表达。
上述结果表明过表达yap抑制根尖牙乳头间充质干细胞成骨分化,抑制成牙分化。
2)取实施例1构建的敲除yap的脐带间充质干细胞被使用慢病毒介导shrna(yapsh)感染,2μg/ml嘌呤霉素筛选后,实时定量rt-pcr检测结果表明,yap可以被yapsh有效的敲除(图2-a);取脐带干细胞以2×103/cm2的浓度接种于6孔板中,待细胞生长至80%融合后,用成骨诱导培养液将干细胞在体外向成骨/成牙本质方向分化诱导,每3天换1次液,在光镜下观察钙结节形成情况。
3周后检测茜素红染色及测定钙离子浓度来检测晚期成骨指标-细胞矿化能力,结果表明基因敲除yap促进脐带间充质干细胞体外矿化能力(图2-b,2-c)。在mrna水平检测相关核心转录因子osx,结果表明基因敲除yap促进脐带间充质干细胞osx的表达(图2-d)。
并在诱导0,3,7,14和21天的不同时间点收获细胞,在mrna水平检测成骨分化指标-bsp(图2-e),结果表明基因敲除yap促进脐带间充质干细胞bsp的表达。
在mrna水平检测成牙本质分化指标-dspp(图2-f)、dmp1(图2-g),结果表明基因敲除yap促进脐带间充质干细胞dspp和dmp1的表达。
上述结果表明基因敲除yap促进脐带间充质干细胞成骨分化,促进成牙分化。
3)取实施例1构建的敲除yap的骨髓间充质干细胞被使用慢病毒介导shrna(yapsh)感染,2μg/ml嘌呤霉素筛选后,实时定量rt-pcr检测结果表明,yap可以被yapsh有效的敲除(图3-a);
取骨髓干细胞以2×103/cm2的浓度接种于6孔板中,待细胞生长至80%融合后,用成骨诱导培养液将干细胞在体外向成骨/成牙本质方向分化诱导,每3天换1次液,在光镜下观察钙结节形成情况。
3周后检测茜素红染色来检测晚期成骨指标-细胞矿化能力,结果表明基因敲除yap促进骨髓间充质干细胞体外矿化能力(图3-b)。
在mrna水平检测下游基因barx1,结果表明基因敲除yap促进骨髓间充质干细胞barx1的表达(图3-c)。
在mrna水平检测相关核心转录因子osx,结果表明基因敲除yap促进骨髓间充质干细胞osx的表达(图3-d)。
并在诱导0,3,7,10和14天的不同时间点收获细胞,在mrna水平检测成骨分化指标-bsp(图3-e),结果表明基因敲除yap促进骨髓间充质干细胞bsp的表达。
在mrna水平检测成牙本质分化指标-dspp(图3-f)、dmp1(图3-g),结果表明基因敲除yap促进骨髓间充质干细胞dspp和dmp1的表达。
上述结果表明基因敲除yap促进骨髓间充质干细胞成骨分化,促进成牙分化。
具体过程为:
1.茜素红染色
1.1弃掉培养基,pbs洗2次;
1.270%乙醇固定,4℃,1h;
1.3双蒸水洗2次;
1.440mm茜素红溶液(ph4.2)室温染色1-10min,肉眼观察着色情况;
1.5双蒸水洗5次,轻轻吹打;
1.6扫描仪透摄模式采集图像。
2.ca2+浓度检测
2.1茜素红染色后,加入10%w/vcpc,室温放置30min(ar-s被溶解至cpc中);
2.2以1:10稀释溶液,在酶标仪中以562nm波长测定其吸光度值(od);
2.3以ar-s标准曲线计算ca2+的相对浓度。
3.real-timert-pcr
步骤同实施例1。rt-pcr引物序列为:
osx-f:cctcctcagctcaccttctc(seqidno:1);
osx-r:gttgggagcccaaatagaaa(seqidno:2);
barx1-f:cgcttcgagaagcagaagta(seqidno:3)
barx1-r:cttcatcctccgattctggt(seqidno:4)
bsp-f:caggccacgatattatctttaca(seqidno:5);
bsp-r:ctcctcttcttcctcctcctc(seqidno:6);
dspp-f:cgacataggtcacaatgaggatgtcg(seqidno:7);
dspp-r:ttgcttccagctacttgaggtc(seqidno:8);
dmp1-f:gacagcctctcactggattcgctgtc(seqidno:9);
dmp1-r:ctcgcacacactctcccactc(seqidno:10);
gapdh-f:cggaccaatacgaccaaatccg(seqidno:11);
gapdh-r:agccacatcgctcagacacc(seqidno:12)。
实施例3过表达yap抑制根尖牙乳头干细胞体内矿化组织生成能力的研究
为了验证过表达yap对根尖牙乳头干细胞牙向/骨向分化的影响,将scaps与ha/tap混合,植入裸鼠皮下,观察过表达yap后在体内环境中对scaps分化的影响。
取5只裸鼠,分别在其后肢皮下植入scaps与ha/tcp混合物,植入8周后,取出组织标本进行切片染色分析(图4)标尺100um。,图4-a为对照组(scaps-pqcxih+ha/tcp),图4-b示实验组(scaps-myc-yap+ha/tcp)。结果显示,实验组根尖牙乳头干细胞成矿化组织能力显著弱于对照组,实验组矿化组织形成面积较对照组明显减小(图4-c)。
具体过程为:
1.细胞移植
1.1分别取生长状态良好的第4代细胞,以1×105个/皿的密度接种于10cm培养皿,待细胞长至80%汇合度时弃掉培养基,用pbs漂洗(为保证细胞状态,细胞汇合度不宜过大);
1.2每皿细胞加3ml不含edta的胰酶,于37℃孵育2min,将细胞从培养皿上洗脱,加入4ml含15%fbs、1%双抗和1%l-谷氨酰胺的α-mem培养基中和胰酶作用,之后将细胞悬液转移至50ml的离心管中;
1.3于1000rpm,离心6min。
1.4用上述含15%fbs、1%双抗和1%l-谷氨酰胺的α-mem培养基重悬细胞,计数,然后取1ml细胞悬液(约4×106个/ml)至含有40mg羟基磷灰石/磷酸三钙(ha/tcp)的2ml圆底ep管中(要保证每组细胞量一致,约4×106个细胞/样本)。
1.537℃旋转摇床孵育1.5h。
1.6短时离心,使ha沉于管底,吸弃上清,细胞与ha混合物待用。
1.8裸鼠称重,4%水合氯醛腹腔注射麻醉。75%酒精消毒背部皮肤,在背部中线处剪一2-3cm的切口。
1.9钝性分离皮下结缔组织,将细胞与ha/tcp混合物植入裸鼠皮下,每只裸鼠可植入2个部位,左侧为对照组,右侧为实验组,缝合皮肤。
2.标本固定,脱钙,脱水包埋,制作石蜡切片
在体内移植8周后处死裸鼠,取出组织标本,置于4%多聚甲醛中固定,之后转至ph值等于7(7.4-7.6)的10%edta内,完全脱钙后流水冲洗24小时,随后将组织脱水包埋。
脱水步骤:75%乙醇ⅰ:10min;75%乙醇ⅱ:10min;85%乙醇ⅰ:10min;85%乙醇ⅱ:10min;95%乙醇ⅰ:10min;95%乙醇ⅱ:10min;无水乙醇ⅰ:30min;无水乙醇ⅱ:30min;二甲苯ⅰ:30min;二甲苯ⅱ:30min;浸蜡ⅰ:30min;浸蜡ⅱ:过夜。
包埋:浸蜡结束后,将组织转到预热的包埋框中,迅速倾入熔蜡,用温热的镊子调整组织块的位置,制冷机上放置,使熔蜡凝固。
切片:修整蜡块后在轮转切片机切5μm厚连续切片,将切片裱于多聚赖氨酸处理的玻片上,37℃干燥过夜。
石蜡切片he染色步骤:二甲苯ⅰ:10min;二甲苯ⅱ:10min;无水乙醇ⅰ:3min;无水乙醇ⅱ:3min;95%乙醇ⅰ:3min;95%乙醇ⅱ:3min;85%乙醇:3min;75%乙醇:3min;流水冲洗:3min;蒸馏水洗:1min;苏木精液染色:2min;流水洗去苏木精液:30s;1%盐酸-乙醇:3s;流水冲洗返蓝:10min;蒸馏水洗:1min;0.5%伊红液染色:1min;蒸馏水稍洗:2s;80%乙醇:10s;95%乙醇ⅰ:10s;95%乙醇ⅱ:10s;无水乙醇ⅰ:10s;无水乙醇ⅱ:10s;二甲苯ⅰ:2min;二甲苯ⅱ:2min;中性树胶封固。
实施例4在间充质干细胞yap和ap2a形成蛋白复合体调节barx1基因表达
前期研究表明bcor为ap2a上游基因,负向调控ap2a的表达,而ap2a可以促进间充质干细胞成骨/成牙分化。为了揭示yap调节barx1的分子机制,间充质干细胞利用表达flag标签的野生型bcor和ap2a的逆转录病毒,在2微克/毫升嘌呤霉素筛选后,western印迹结果表明bcor、ap2a在间充质干细胞异位表达(图5-a、5-c)。实时定量rt-pcr结果显示,过表达bcor促进barx1在间充质干细胞的表达(图5-b),过表达ap2a抑制barx1在间充质干细胞的表达(图5-d)。
进一步,间充质干细胞利用表达myc标签的野生型yap的逆转录病毒,在2微克/毫升嘌呤霉素筛选后,western印迹结果表明yap在间充质干细胞异位表达(图5-e);实时定量rt-pcr结果显示,过表达yap抑制barx1在间充质干细胞的表达(图5-f)。另外,间充质干细胞被使用慢病毒介导shrna(yapsh)感染,2μg/ml嘌呤霉素筛选后,实时定量rt-pcr检测结果表明,yap可以被yapsh有效的敲除(图5-g);实时定量rt-pcr检测结果表明,基因敲除yap促进barx1在间充质干细胞的表达(图5-h)。
此外,生物信息学分析发现了barx1的转录启动子上游2kb的保守序列区域存在着转录因子ap2a的蛋白结合位点,推测barx1可能是转录因子ap2a的下游基因,其表达和功能受ap2a的调控,染色质免疫共沉淀(chip)结果证实了barx1启动子上ap2a蛋白的结合(图5-i)(横坐标为ap2abindingsite的缩写即ap2abs,共有5个,5kb-down代表基因编码区下游5kb,作为阴性对照)。
对ap2a和yap进行结构分析发现,ap2a存在py结构域,yap存在ww功能域,以往研究证实蛋白的py结构域和ww功能域可以结合,免疫共沉淀(co-ip)结果表明yap和ap2a在间充质干细胞可以形成蛋白复合体(图6-a、6-b、6-c)。
在mrna水平检测ap2a、yap在非牙源性间充质干细胞(wjcmscs、adscs、bmscs)与牙源性间充质干细胞(scaps、dpscs、pdlscs)中的表达情况,结果显示相比牙源性间充质干细胞,ap2a在非牙源性间充质干细胞中表达升高(图6-d),而yap在两种间充质干细胞中表达没有明显差异(图6-e),此外co-ip结果显示yap-ap2a蛋白复合体在非牙源性间充质干细胞wjcmscs中多于牙源性间充质干细胞scaps(图6-f)。
上述结果表明在间充质干细胞中yap和ap2a可以形成蛋白复合体,通过ap2a结合到barx1基因启动子序列,共同抑制barx1基因的表达,从而调节间充质干细胞的分化功能。
具体过程为:
1.westernblot:
步骤同实施例1。
2.real-timert-pcr
步骤同实施例1。rt-pcr引物序列为:
yap1-f:cacagcatgttcgagctcat(seqidno:13)
yap1-r:gactactccagtgggggtca(seqidno:14)
ap2a-f:actgagactcccgtcaatgg(seqidno:15)
ap2a-r:gcgtgttccttaatccgtgt(seqidno:16)
3.chip
3.1培养皿细胞中加入甲醛,终浓度为1%,37℃,15min;
3.2弃含甲醛的培养基,用4℃预冷的5mlpbs漂洗细胞两次,加入5mlpbs后,用细胞刮刮下培养皿中的细胞,收于50ml离心管,4℃2000rpm离心4min;
3.3弃上清,每样本加入含蛋白酶抑制剂的室温sds裂解液200ul(100ulsds裂解液+1ulpmsf+1ulpic),冰上10min;
3.4超声破碎,功率75%,3次,每次7-8s,间隔90s;
3.54℃,13000rpm离心10min,收集上清液于新ep管中;
3.6测dna浓度,将各样本制成同浓度、同体积样本;
3.7用chip稀释缓冲液(含蛋白酶抑制剂)将上述样本稀释10倍;取1%稀释后的样本作为input,加入20ul5mnacl,65℃,4h,-20℃保存待用;
3.8将剩余样本分组,目的蛋白组中加入免疫沉淀抗体2ug,阴性对照组中加入igg2ug,4℃旋转摇床孵育1h;
3.9加入60ul蛋白a琼脂糖珠子,4℃旋转摇床孵育过夜;
3.10轻柔离心,小心去除上清液,得到琼脂糖凝胶/抗体/组蛋白复合体,分别加入1ml下列缓冲液清洗上述复合体:
1)低盐免疫沉淀复合体清洗缓冲液,1次,1min/次,4℃5000rpm离心;
2)高盐免疫沉淀复合体清洗缓冲液,1次,3min/次,4℃5000rpm离心;
3)氯化锂免疫沉淀复合体清洗缓冲液,1次,1min/次,4℃5000rpm离心;
4)te缓冲液,2次,1min/次,4℃5000rpm离心;
3.11在清洗后的复合体中加入250ul洗脱液(1%sds,0.1mnahco3),旋转摇床室温孵育15min,4℃5000rpm离心,将上清液转入新的ep管内,再重复一遍,共得到500ul洗脱后的样本;
3.12在洗脱样本中加入20ul5mnacl65℃4h;
3.13dna纯化:
3.13.1在input和洗脱样本中加入10ul0.5medta,20ul1mtris-hcl(ph6.5)和1ul20mg/ml蛋白酶k,45℃,1h;
3.13.2加入500ul酚/氯仿,涡旋混匀,静置5min,4℃14000rpm5min离心;
3.13.3收集上清液至新ep管,加入1ml乙醇+1‰糖原,-20℃30min-1h,4℃14000rpm10min离心;
3.13.4弃上清液,室温晾干,加入100-200ul双蒸水重悬。
3.14real-timepcr:
步骤同实施例1。real-timepcr引物序列为:
barx1-1-f:ggagagacagtgggctcttg(seqidno:17)
barx1-1-r:gcctggagtgaggacaaaga(seqidno:18)
barx1-2-f:caggtgccagggactgag(seqidno:19)
barx1-2-r:aagtcctttctccagctcca(seqidno:20)
barx1-3-f:tcccaccagagtttggtctt(seqidno:21)
barx1-3-r:actgttactgggcggagttg(seqidno:22)
barx1-4-f:ctctgtgccctccgtcac(seqidno:23)
barx1-4-r:agaccaaaagaggcgtgaga(seqidno:24)
barx1-5-f:ctcctttttggcctcccttc(seqidno:25)
barx1-5-r:cccaacccctaggctgag(seqidno:26)
barx1-nc-f:gggatctgaccagcatcagt(seqidno:27)
barx1-nc-r:aagattcgcaaggcagctaa(seqidno:28)
4.co-ip
4.1弃培养基,用4℃预冷的5mlpbs漂洗细胞两次,加入5mlpbs后,用细胞刮刮下培养皿中的细胞,收于50ml离心管,1100rpm离心6min;弃上清,加入1mlpbs重悬细胞,收于ep管,7200rpm离心2min;
4.2弃上清,加入1mlip裂解液,冰上15min,每2-3min混悬一次;
4.34℃,14000rpm离心15min,收集上清液于新ep管中;
4.4bradford法测定蛋白浓度,步骤同实施例1;
4.5根据蛋白样本的浓度将样本配制成同浓度同体积样本,取25ug蛋白样本作为input,蛋白变性,步骤同实施例1;
4.6将剩余样本平均分为两组,目的蛋白组中加入免疫沉淀抗体2ug,阴性对照组中加入igg2ug,4℃旋转摇床孵育1h;
4.7加入40ul蛋白a琼脂糖珠子,4℃旋转摇床孵育过夜;
4.8轻柔离心,小心去除上清液,加入1ml20%免疫共沉淀洗脱液清洗,4℃5000rpm离心30s,去除上清液,重复3-4次;
4.9加入30ul2×loadingbuffer(溴酚蓝),95℃加热5min变性;
4.10input与免疫共沉淀样本一起进行westernblot,步骤同实施例1。
实施例5在间充质干细胞中,ap2a与runx2竞争性结合yap形成蛋白复合体,调节间充质干细胞的分化
为了阐明yap抑制间充质干细胞成骨分化的作用,通过查阅文献发现成骨相关转录因子runx2也存在py功能域,在成骨细胞中可以和yap形成蛋白复合体;过表达和基因敲除yap的co-ip结果表明yap和runx2在间充质干细胞也是可以形成蛋白复合体的(图7-a、7-b)。此外,过表达ap2a的co-ip结果显示yap-runx2蛋白复合体减少(图7-c),说明ap2a与runx2(成骨相关的转录因子)竞争性结合yap。
以上结果说明在间充质干细胞中,yap-runx2蛋白复合体调控干细胞成骨分化,而ap2a与runx2竞争性结合yap,通过调控barx1的表达,调节干细胞成牙分化。
具体过程为:
1.co-ip
步骤同实施例4。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>首都医科大学附属北京口腔医院
<120>yap的用途
<130>mp1619298
<160>28
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
cctcctcagctcaccttctc20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
gttgggagcccaaatagaaa20
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
cgcttcgagaagcagaagta20
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
cttcatcctccgattctggt20
<210>5
<211>23
<212>dna
<213>人工序列
<400>5
caggccacgatattatctttaca23
<210>6
<211>21
<212>dna
<213>人工序列
<400>6
ctcctcttcttcctcctcctc21
<210>7
<211>26
<212>dna
<213>人工序列
<400>7
cgacataggtcacaatgaggatgtcg26
<210>8
<211>22
<212>dna
<213>人工序列
<400>8
ttgcttccagctacttgaggtc22
<210>9
<211>26
<212>dna
<213>人工序列
<400>9
gacagcctctcactggattcgctgtc26
<210>10
<211>21
<212>dna
<213>人工序列
<400>10
ctcgcacacactctcccactc21
<210>11
<211>22
<212>dna
<213>人工序列
<400>11
cggaccaatacgaccaaatccg22
<210>12
<211>20
<212>dna
<213>人工序列
<400>12
agccacatcgctcagacacc20
<210>13
<211>20
<212>dna
<213>人工序列
<400>13
cacagcatgttcgagctcat20
<210>14
<211>20
<212>dna
<213>人工序列
<400>14
gactactccagtgggggtca20
<210>15
<211>20
<212>dna
<213>人工序列
<400>15
actgagactcccgtcaatgg20
<210>16
<211>20
<212>dna
<213>人工序列
<400>16
gcgtgttccttaatccgtgt20
<210>17
<211>20
<212>dna
<213>人工序列
<400>17
ggagagacagtgggctcttg20
<210>18
<211>20
<212>dna
<213>人工序列
<400>18
gcctggagtgaggacaaaga20
<210>19
<211>18
<212>dna
<213>人工序列
<400>19
caggtgccagggactgag18
<210>20
<211>20
<212>dna
<213>人工序列
<400>20
aagtcctttctccagctcca20
<210>21
<211>20
<212>dna
<213>人工序列
<400>21
tcccaccagagtttggtctt20
<210>22
<211>20
<212>dna
<213>人工序列
<400>22
actgttactgggcggagttg20
<210>23
<211>18
<212>dna
<213>人工序列
<400>23
ctctgtgccctccgtcac18
<210>24
<211>20
<212>dna
<213>人工序列
<400>24
agaccaaaagaggcgtgaga20
<210>25
<211>20
<212>dna
<213>人工序列
<400>25
ctcctttttggcctcccttc20
<210>26
<211>18
<212>dna
<213>人工序列
<400>26
cccaacccctaggctgag18
<210>27
<211>20
<212>dna
<213>人工序列
<400>27
gggatctgaccagcatcagt20
<210>28
<211>20
<212>dna
<213>人工序列
<400>28
aagattcgcaaggcagctaa20
- 还没有人留言评论。精彩留言会获得点赞!